Method Article
用于研究髓磷脂中央微管蛋白依赖性缺陷的无标记非线性光学器件
摘要
在本文中,我们提出了一种协议,通过简单,创新的二次谐波产生显微镜方法检测微管负载的少突胶质细胞在微管疾病模型中。
摘要
大脑中细胞骨架成分的令人满意的可视化具有挑战性。微管、微丝和中间丝网络在所有神经组织中的普遍分布,以及荧光蛋白融合策略结果的可变性以及它们对作为发色载体的抗体和药物的动态研究的有限适用性,使得经典的光学方法不如其他蛋白质有效。当需要研究微管蛋白时,由于分子的非中心对称组织,二次谐波的无标记产生是非常合适的选择。当与显微镜结合时,该技术可以定性地描述生物样品中平行微管束的体积分布,具有处理未固定和未透化的新鲜组织的额外优势。这项工作描述了如何使用商业的二次谐波生成显微镜设置对微管蛋白进行成像,以突出显示少突胶质细胞富含微管蛋白的结构中的微管,如髓鞘功能减退伴基底神经节萎缩和小脑(H-ABC)微管蛋白病,一种最近描述的髓鞘疾病。
引言
组织和器官制剂中细胞骨架结构的光学成像并非易事。细胞骨架丝无处不在,因此,如果对上皮样品中的α-微管蛋白或β-肌动蛋白或潜在的角蛋白进行通用染色,则信号可能会在整个样品中均匀分布。为了将染色限制在更有意义的细胞成分亚群中,可以使用靶向表达1的转基因小鼠或计划使用亚型特异性抗体。虽然后者很少在市场上(而且很少存在2,3,4),但转基因动物模型可能是可用的。但是,它需要由实验室购买并妥善安置,以及该过程所涉及的所有费用。某些抗体或化学物质,例如荧光团偶联药物,如鬼笔环肽或紫杉醇,可能部分或完全与活细胞或组织的使用不相容,因此将其适用性限制在仅研究固定样品。
在微管蛋白的情况下,必须考虑另一个方面,即聚合物对固定的敏感性。众所周知,用甲醛进行常规化学固定不足以最佳地保持微管的完整性5。此外,最近的一份报告证实,甲醛交联诱导微管超微结构的细微变化,类似于某些药物或生理分子(如GTP6)结合时发生的情况。
因此,在未染色、未固定的样品中直接观察微管通常是可取的。为了实现这一目标,一种技术解决方案是二次谐波产生(SHG)显微镜7,它基于平行微管束作为干扰团并在用强烈的脉冲红外激光正确照射时发射倍频光的能力。虽然胶原蛋白和肌球蛋白可以产生更强,更稳定的二次谐波信号,这是已知唯一能够倍频的另外两种生物材料,但迄今为止,来自微管蛋白的信号主要用于研究有丝分裂纺锤体重排8,9,10和轴突微管形态11,12,13。
在这项工作中,我们介绍了SHG显微镜作为诊断工具的新用途,以区分受微管蛋白β4A(TUBB4A)微管蛋白病影响的中枢神经系统(CNS)组织与健康对应物14。在这种主要由神经性微管蛋白亚型引起的一些突变中发生的突变,如导致基底神经节和小脑(H-ABC)髓鞘减退和萎缩的突变,诱导少突胶质细胞中的微管过度充盈15,16;反过来,细胞骨架改变与髓鞘形成等下游效应有关,运动和感觉通路严重受损16,17,18,19。这项工作中使用的taiep小鼠模型在少突胶质细胞中显示出异常的微管含量,并概括了H-ABC患者的大多数感觉运动症状17。该协议解释了如何将结构成像为胼胝体和小脑,它们通常是高度髓鞘的,并且在人类患者以及taiep rat19中受到严重影响,以突出健康和突变组织之间SH信号的差异。
研究方案
所描述的所有程序均符合墨西哥政府《关于健康研究的一般卫生法条例》(NOM-062-ZOO-1999)第七章中批准的法律和法规,并符合《美国国立卫生研究院实验动物护理和使用指南》的建议,并经瓜纳华托大学和贝内梅里塔自治大学生物伦理学研究机构委员会批准 普埃布拉。
1. 显微镜设置
- 打开显微镜系统。
- 打开脉冲激光器,以确保在样品提取和制备后,它能够以最佳和稳定的功率水平进行激光化。
- 将激光调谐到 810 nm。为了研究乳腺微管,使用10%-20%的可用激光功率,在所述系统中,这对应于在物镜后焦平面处测量的13-26mW。
- 确保显微镜是科勒对准的(补充文件1),物镜将用于SHG成像。
注意:这一点很重要,因为在这项工作中使用的商业设置中,检测是在传输模式下通过聚光镜进行的。 - 从光学检测路径中移除不需要的滤光片(图1A)。
- 确保聚光镜光圈完全打开,以确保在此水平上不会不必要地停止光线。
- 准备一个25x/0.8数值孔径(NA)油浸物镜,在镜头中加入一小滴浸油。
注意:此物镜用于最好地匹配冷凝器数值孔径,即0.55(理想情况下,数值孔径≥数值孔径obj)。
2. 显微镜初步控制
注意:除非修改了设置,否则执行一次初步显微镜控制。
- 使用SHG参数对夹在载玻片之间的干玉米淀粉进行成像,以生成揭示激光偏振方向的SHG图像。按照 补充文件 2 中报告的步骤进行操作,但激光功率除外,玉米淀粉的激光功率小于 5%。
- 拍摄一张稀疏玉米淀粉粒的图像,并在x-y平面上标记SHG小叶的方向。该方向对应于激光方向(图2A)。
- 作为对照,拍摄同一样品的另一张图像,将半波板插入光路( 如图1A所示的位置)以改变激光的振荡方向。生成的图像显示旋转的SHG信号小叶(图2B,C)。
- 如果对SHG使用不同类型的带通滤光片,请通过沿线扫描逐像素比较图像(图2D,E)和信号强度(图2F),确保其具有最佳的传输特性。
3. 组织提取
注意:始终使用干净的工具进行外科手术。
- 使用6-12个月大的 taiep 大鼠和年龄匹配的Sprague-Dawley对照(WT)。
- 用腹膜内注射在0.9%无菌NaCl溶液中稀释的氯胺酮 - 甲苯噻嗪(0.125mg / Kg和5mg / Kg)混合物麻醉动物。
- 检查疼痛反射,只有在它们不存在时才继续。
- 通过斩首 献 祭动物。
- 一旦头部被隔离,沿着中线小心地打开颅穹窿的骨骼,从顶部的最尾部开始朝向鼻子,从眶腔到中线,然后从最尾部到大脑和小脑下方。
注意:切骨器和Rongeurs可以在不损坏大脑结构的情况下正确去除头骨。 - 从骨骼中释放大脑和小脑。两个半球可以分开。如果半球被分割,则使用一半进行SHG成像,并将另一半固定在磷酸盐缓冲盐水(PBS)中的3.7%多聚甲醛中20分钟,用于随后的切片和染色。
4. 振动切片
- 准备一个装有温热(37°C)汉克平衡盐溶液(HBSS)的振动切片机缓冲托盘。
- 使用氰基丙烯酸酯胶通过一块遮蔽胶 将 大脑固定在标本板上。最尾部/区域接触胶水,以便可以切割来自相反的喙部的可用冠状部分。
- 让胶水聚合~10秒,以获得样品的有效附着。
注意:当大脑定向时,最佳结果是使刀片"从上到下"而不是"从一侧到另一侧"切割时获得的(图1B)。
- 让胶水聚合~10秒,以获得样品的有效附着。
- 将试样板转移到缓冲托盘内的磁性支架上。
- 开始切割300-500μm切片,直到产生的切片覆盖大脑的整个表面。
- 此时,将切片的厚度减小到160μm。
- 一旦在胼胝体水平处切割完整的160μm切片,就用带有大火焰孔的改良玻璃巴斯德移液管将其恢复(图1C)。
- 用新的温HBSS将其转移到干净的培养皿中,或直接转移到玻璃支架上进行显微镜检查(盖玻片或玻璃底培养皿)。
注意:对于所描述的实验条件,在样品上方添加盖玻片不利于成像。
5. 转移到显微镜
- 如果显微镜在不同的房间,请准备一个带有加热凝胶包的绝缘盒,以转移组织切片,同时保持温度。该盒子还用于保持切片温暖,直到它们被成像。
- 将样品放在显微镜下,并通过透射光目镜直接观察,确保其正确定位在物镜下方。
注意:目标是将预测的发射结构与激光的振荡方向对齐,以最大化发射(因此检测到)的SHG信号。 - 去除多余的HBSS,使薄的液膜覆盖整个样品。每隔几分钟目视检查一次液膜,以避免样品过度蒸发和干燥。
注意:在所述条件下,使用部分不超过20分钟。样品干燥会造成剧烈的人工影响(补充图1A)。如果需要更长的成像时间,建议定期将切片浸泡在温暖、新鲜的培养基中,而不是添加更多的 HBSS。在进行较长时间的实验时,还建议使用灌注室和胶水或低熔点琼脂糖来固定组织。 - 准备显微镜载物台以进行非去扫描成像,这可能包括关闭深色培养室的所有门或用黑色尼龙聚氨酯涂层织物覆盖培养室。
6. 成像
- 沿传输路径选择"非去扫描"成像模式。这样,微管蛋白微弱SH信号的捕获将得到优化。
- 选择 LCI 计划-新氟 25x/0.8 数值孔径物镜。
- 将激光功率设置在 13 mW 和 26 mW 之间,像素停留时间为 12.6 μs。拍摄不超过 512 像素 x 512 像素的图像,速度为 5,平均速度为 2,平均采集时间约为 15 秒。
注意:使用更高的激光功率和/或更长的停留时间可能会损坏样品(补充图1B)。 - 首先使用 485 nm 短通滤光片 (SP485) 拍摄图像,然后在第二步中添加清晰的 405 nm 带通滤光片 (BP405; 图3)。按照 补充文件 2 中报告的步骤进行操作。
注意:伪明场图像可以通过同一探测器使用可见线的残余激光(405 nm或488 nm激光器效果最佳)拍摄。
7. 小脑的处理
- 首先,用手术刀将小脑切成两个半球,然后通过中间部分(切割后获得的扁平部分)将它们粘在振动切片机支架上。
- 以与大脑描述相同的方式对小脑进行切片和成像(160μm切片,相同的振动切片机设置,相同的刀片,相同的显微镜设置等)。
注意:由于小脑的解剖结构,它在切片时的方向并不重要;在远离表面生成的大多数切片中,叶子会很好地切入白质中。
结果
由于生物组织中存在的异构载体数量非常有限,因此使用该方法获得的图像具有固有的低背景水平,这是该方法的显着优势之一。
当对胼胝体的纤维进行成像时,可以在太极脑中一致地找到纤维状的短结构和圆形元素(图3B),而对照脑的胼胝体在整个大脑区域显示出更加异质和各向同性的信号(图3A)。差分信号的起源具体在于二次谐波产生现象,因为添加窄带通滤波器只会降低来自控制图像的非特定信号强度(图 3C-D),同时选择性地从 taiep 图像中的体细胞样和短而细长的结构周围去除这种低漫射信号,这些结构总是产生强烈的 SH 光(图 3E-F)。
分析的另一个结构,小脑白质,给出了类似的结果。具体来说,虽然在对照组织中几乎完全没有SH信号(图4B),并且在使用短通滤波器时几乎看不到浦肯野细胞,但细长和圆形的结构在taiep组织的SH图像中持续存在(图4D)。
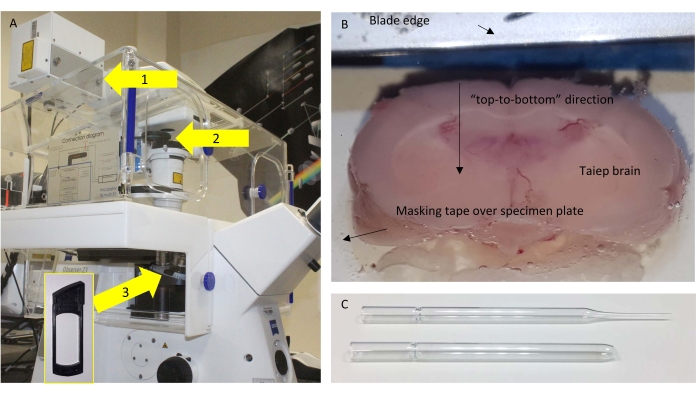
图1:显微镜和切片 。 (A)所用显微镜的示意图,突出显示相关组件。箭头:1 = NDD 端口,SP485 位于探测器附近;2 = 放置 BP405 的可拆卸框架;3 = 放置半波板(HWP)进行对照实验的物镜下的位置。插图显示了可以插入 HWP 的框架。(B) 振动切片机缓冲托盘的顶视图,胶合的大脑准备进行精细切片。(C)用于转移切片的原始(顶部)和修改(底部)巴斯德移液器。 请点击此处查看此图的大图。

图 2:初步控制。 (A)玉米淀粉粒发出的SHG信号显示出与激光振荡方向重合的主要方向(在这种情况下是水平)。(B)插入半波板后,其快速轴相对于水平方向为45°,信号旋转90°。(C)半波板插入前后信号的合并。(D)玉米淀粉粒发出的低于485nm的信号。(E)在405/10nm处检测到的来自淀粉粒的SHG信号。(F) 显示对应于 D 和 E 放大插入中显示的线扫描的两个信号的比较的图表。使用的SHG滤波器造成的信号损失可以忽略不计。 请点击此处查看此图的大图。

图3:来自 taiep 和WT语料库的SHG图像。 从胼胝体获得的(A)WT和(B) 太极 信号的代表性例子。(C) 来自WT语料库的SP485过滤图像。(D) BP405过滤图像来自与C相同的样品.(E)SP485过滤图像来自 taiep corpus callosum。(F) 与E中相同样品的BP405过滤图像, 请单击此处查看此图的大图。

图 4:来自 taiep 和 WT 小脑的 SHG 图像。从小脑对叶获得的(A-B)WT和(C-D)taiep信号的代表性例子。(A) 来自 WT 叶子的 SP485 过滤图像;只有一些浦肯野细胞可见。(B) 来自与A中相同样品的BP405过滤图像。(C) 来自 taiep 叶子的 SP485 过滤图像。(D) 与 C 中相同样品的 BP405 过滤图像。请点击此处查看此图的大图。
补充图1:伪影示例。 (A) 由于样品干燥而造成的伪影。(B) 由于过度暴露而导致的伪影。比例尺:30 μm。 请点击这里下载此文件。
补充文件1:科勒对齐。该文件提供了执行科勒对齐的步骤。请点击此处下载此文件。
补充文件2:用于SHG图像采集的ZEN软件步骤。请点击此处下载此文件。
讨论
SHG显微镜是一组非线性光学技术的一部分,其中包括双光子激发显微镜,三次谐波产生显微镜和相干反斯托克斯拉曼散射显微镜,这些技术有助于将传统光学显微镜的应用范围扩展到生命科学20。
具体来说,SHG显微镜的主要优点和缺点与相同的条件有关:信号发生器是非中心对称的21。这种特殊的建筑条件通常存在于无机和有机晶体领域,但在生物物体中很少见。与胶原蛋白和肌肉肌球蛋白一起,微管能够产生二次谐波信号22,如果在平行聚合物束中发生足够的求和,可以用显微镜检测到该信号。在细胞内,微管蛋白结合在轴突的核心(细胞类型特异性位置),有丝分裂纺锤体(时间特异性分布)中形成平行束,并且如这项工作所述,在最近描述的微管蛋白病 - 髓鞘减退与基底神经节和小脑萎缩或H-ABC(代表此类病理分布的第一个报告)的商标微管关联中,14,16,23.
这种感觉运动综合征仍然是一种孤儿病,因为许多神经科医生还不熟悉所有症状和/或无法负担对疑似患者的基因筛查以确认诊断,这很可能导致诊断不足,至少在某些人群中是这样。最重要的是,对分子和细胞水平的病理学知之甚少,因此可以帮助阐明这种退行性过程的特定机制的技术非常有价值,也是在基本水平上。
因此,提出了SHG显微镜关于这种髓磷脂疾病的两种用途。从长远来看,SHG显微镜可以整合到活检筛查或直接颅内分析的诊断方法中,但最大的影响可能与试图破译疾病的分子基础有关。
与其他显微镜技术相比,SHG显微镜具有许多优势。事实上,SHG显微镜不需要固定组织,这是微管情况下样品制备的一个特别精细的步骤,并且不需要任何类型的染色。最大的优势与所涉及的物理现象有关。一方面,由于几乎没有背景,尽管产生的信号微弱,但它仍提供高对比度,另一方面,由于倍频所需的光强度非常高,并且这些强度仅在非常有限的样品体积内得到满足,该技术提供了固有的光学切片,从而允许3D重建。
这种显微镜技术的主要局限性与设备成本有关。良好的共聚焦显微镜和脉冲红外(IR)激光器对于此应用是必要的,尽管许多神经科学实验室都提供了双光子激发系统,可以很容易地将其修改为SHG设置,但与传统的落射荧光设置相比,成本差异仍然很大。此外,作为一种衍射限制技术,其分辨率会受到使用红外光进行照明的影响。
与许多开创性应用一样,应用于生命科学的SHG显微镜早期实验所使用的设置是完全定制的光学设置,构建为开放系统11,24,25,使实验人员有可能优化每个组件。由于在生命科学实验室中,访问商业设置更为常见,因此我们想测试这些系统之一是否足够敏感,可以检测由鼬状微管束发出的微弱信号,已知这些微管束不像胶原蛋白那样强。蔡司的LSM710 NLO系统由倒置共聚焦显微镜组成,该显微镜带有用于透射和"epi"模式下非去扫描检测的模块,以及相干变色龙可调谐红外激光器。由于SHG现象的相干性,选择传输路径以最大限度地从样品中收集倍频光至关重要,因此,通过0.55 NA聚光镜通过积分进行检测。使用LCI Plan-Neofluar 25X/0.8 NA浸没物镜从底部照亮样品并接近冷凝器NA。通过本文描述的条件,我们可以可靠地检测到来自携带TUBB4A突变的组织信号,并且该信号在对照中始终不存在。
在报告的方案中,需要调整两个步骤才能获得最佳成像条件:组织切片的厚度和冷凝器隔膜的开口。切片应尽可能薄,以防止过度的吸光度,散射和SH光子的损失,特别是因为由于物理现象的相干性质,目标是在透射中成像。在我们的案例中,限制因素是 taiep 组织的一致性,这阻碍了160-180μm以下均匀厚切片的切片。使用传统的科勒对准,聚光镜光阑通常关闭在其面积的60%左右,以在透射光图像中产生对比度;相反,对于此应用,目的是收集尽可能多的光子,因此膜片完全打开。
SHG显微镜的这种应用非常重要,因为它提供了区分富含微管蛋白的组织与富含微管蛋白的正常组织的可能性,富含微管蛋白的组织发出可检测的信号。其他尚未描述的微管蛋白病突变也可能导致其他组织中的细胞骨架疾病26,这也可能涉及微管蛋白富集。
就其他可能的应用而言,SHG显微镜可以扩展到研究较弱的信号,例如存在于微管蛋白正常组织,细小,解离的轴突或具有混合极性的细胞内束中的信号。为此,设置修改,例如用具有更高数值孔径和/或浸入式或使用更灵敏的探测器替换空气冷凝器,可能会产生重要影响。
披露声明
作者没有相互竞争的经济利益。
致谢
这项工作得到了国家科学与技术委员会(CONACYT)通过以下赠款的支持:infraestructura 226450给副总裁-CIO,infraestructura 255277给副总裁,FORDECYT-PRONACES/194171/2020给V.H.。我们感谢CIO的Juvenal Hernández Guevara在视频制作方面的支持。
材料
| Name | Company | Catalog Number | Comments |
| 405/10 nm BrightLine(R) single-band bandpass filter | Semrock | FF01-405/10-25 | 32 mm diameter, with housing ring |
| Black Nylon, Polyurethane-Coated Fabric | Thorlabs | BK5 | 5' x 9' (1.5 m x 2.7 m) x 0.005" (0.12 mm) Thick |
| Blades for vibratome | any commercial; e.g. Wilkinson Sword | Classic stainless steel double edge razor blades | |
| Cell culture dishes, 35 mm | any commercial; e.g. Falcon | 351008 | |
| Confocal microscope | Zeiss | LSM710NLO AxioObserver Z1 | Inverted microscope, objective used is LCI Plan-Neofluar 25x/0.8 NA |
| Cooler | any commercial | Any insulated, polystyrene box could work, to mantain the sample at about 37 °C | |
| Corn stach | e.g. Maizena | From the supermarket | |
| Coverslips #1.5 | any commercial | Rectangular | |
| Cyanoacrylate glue | e.g. Loctite | To glue the brain to the masking tape | |
| Fine forceps | fine science tools | 11412-11 | To manipulate tissue sections by handling from the meninges |
| Fine scissors | fine science tools | 14370-22 | To cut the skin |
| Fine scissors curved tip | fine science tools | 14061-09 | To cut along the midline |
| Formaldehyde 37% | Sigma-Aldrich | 252549 | To dilute 1:10 in PBS |
| Friedman Rongeur | fine science tools | 16000-14 | To cut the bone |
| Gel packs | any commercial | Prewarmed to 37 °C, to help mantaining the temperature inside the cooler | |
| Glass Pasteur pipette, modified | any commercial | To transfer the tissue section | |
| Hanks′ Balanced Salt solution (HBSS) | Gibco | 14025-076 | Could be prepared from powders |
| Kelly hemostats | fine science tools | 13018-14 | To separate the bone |
| Masking tape | any commercial | To protect th surface of the specimen plate | |
| NDD module, type C | Zeiss | 000000-1410-101 | To detect the signal, reducing light loss. Housing the 000000-1935-163 filter set with the SP485 |
| Offset bone nippers | fine science tools | 16101-10 | To cut the bone |
| Phosphate buffered saline (PBS) | Gibco | 10010-031 | Could be prepared from powders or tabs |
| Pulsed laser | Coherent | Chameleon Vision II | 680–1080 nm tunable laser |
| Scalpel | any commercial | Straight blade with sharp point | |
| Standard pattern forceps | fine science tools | 11000-18 | |
| Vannas spring scissors | fine science tools | 15018-10 | To cut meninges that remain joined to both the slice obtained from vibratome cutting and the section glued to the specimen plate. |
| Vibratome | any commercial; e.g. Leica | VT1200 |
参考文献
- Palmiter, R. D., et al. Cell lineage ablation in transgenic mice by cell-specific expression of a toxin gene. Cell. 50 (3), 435-443 (1987).
- Banerjee, A., et al. A monoclonal antibody against the type II isotype of beta-tubulin. Preparation of isotypically altered tubulin. The Journal of Biological Chemistry. 263 (6), 3029-3034 (1988).
- Banerjee, A., Roach, M. C., Trcka, P., Luduena, R. F. Preparation of a monoclonal antibody specific for the class IV isotype of beta-tubulin. Purification and assembly of alpha beta II, alpha beta III, and alpha beta IV tubulin dimers from bovine brain. The Journal of Biological Chemistry. 267 (8), 5625-5630 (1992).
- Banerjee, A., et al. Localization of βv tubulin in the cochlea and cultured cells with a novel monoclonal antibody. Cell Motility and the Cytoskeleton. 65 (6), 505-514 (2008).
- Cross, A. R., Williams, R. C. Kinky microtubules: Bending and breaking induced by fixation in vitro with glutaraldehyde and formaldehyde. Cell Motility and the Cytoskeleton. 20 (4), 272-278 (1991).
- Van Steenbergen, V., et al. Molecular understanding of label-free second harmonic imaging of microtubules. Nature Communications. 10 (1), 3530 (2019).
- Campagnola, P. J., Clark, H. A., Mohler, W. A., Lewis, A., Loew, L. M. Second-harmonic imaging microscopy of living cells. Journal of Biomedical Optics. 6 (3), 277 (2001).
- Campagnola, P. J., et al. Three-dimensional high-resolution second-harmonic generation imaging of endogenous structural proteins in biological tissues. Biophysical Journal. 82 (1), 493-508 (2002).
- Yu, C. -. H., et al. Measuring microtubule polarity in spindles with second-harmonic generation. Biophysical Journal. 106 (8), 1578-1587 (2014).
- Bancelin, S., et al. Probing microtubules polarity in mitotic spindles in situ using Interferometric Second Harmonic Generation Microscopy. Scientific Reports. 7, 6758 (2017).
- Dombeck, D. A., et al. Uniform polarity microtubule assemblies imaged in native brain tissue by second-harmonic generation microscopy. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7081-7086 (2003).
- Psilodimitrakopoulos, S., et al. Estimation of the effective orientation of the SHG source in primary cortical neurons. Optics Express. 17 (16), 14418 (2009).
- Sharoukhov, D., Bucinca-Cupallari, F., Lim, H. Microtubule imaging reveals cytoskeletal deficit predisposing the retinal ganglion cell axons to atrophy in DBA/2J. Investigative Opthalmology & Visual Science. 59 (13), 5292 (2018).
- Alata, M., Piazza, V., Eguibar, J. R., Cortes, C., Hernandez, V. H. H-ABC tubulinopathy revealed by label-free second harmonic generation microscopy. Scientific Reports. 12, 14417 (2022).
- Duncan, I. D., Lunn, K. F., Holmgren, B., Urba-Holmgren, R., Brignolo-Holmes, L. The taiep rat: A myelin mutant with an associated oligodendrocyte microtubular defect. Journal of Neurocytology. 21 (12), 870-884 (1992).
- Duncan, I. D., et al. A mutation in the Tubb4a gene leads to microtubule accumulation with hypomyelination and demyelination: Tubb4a Mutation. Annals of Neurology. 81 (5), 690-702 (2017).
- Garduno-Robles, A., et al. MRI features in a rat model of H-ABC tubulinopathy. Frontiers in Neuroscience. 14, 555 (2020).
- Lopez-Juarez, A., et al. Auditory impairment in H-ABC tubulinopathy. Journal of Comparative Neurology. 529 (5), 957-968 (2021).
- Alata, M., et al. Longitudinal evaluation of cerebellar signs of H-ABC tubulinopathy in a patient and in the taiep model. Frontiers in Neurology. 12, 702039 (2021).
- Parodi, V., et al. Nonlinear optical microscopy: From fundamentals to applications in live bioimaging. Frontiers in Bioengineering and Biotechnology. 8, 585363 (2020).
- Lefort, C. A review of biomedical multiphoton microscopy and its laser sources. Journal of Physics D: Applied Physics. 50 (42), 423001 (2017).
- Campagnola, P. J., Loew, L. M. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms. Nature Biotechnology. 21 (11), 1356-1360 (2003).
- vander Knaap, M. S., et al. New syndrome characterized by hypomyelination with atrophy of the basal ganglia and cerebellum. American Journal of Neuroradiology. 23 (9), 1466 (2002).
- Stoller, P., Kim, B. -. M., Rubenchik, A. M., Reiser, K. M., Da Silva, L. B. Polarization-dependent optical second-harmonic imaging of a rat-tail tendon. Journal of Biomedical Optics. 7 (2), 205 (2002).
- Brown, E. B., et al. In vivo measurement of gene expression, angiogenesis and physiological function in tumors using multiphoton laser scanning microscopy. Nature Medicine. 7 (7), 864-868 (2001).
- Chakraborti, S., Natarajan, K., Curiel, J., Janke, C., Liu, J. The emerging role of the tubulin code: From the tubulin molecule to neuronal function and disease. Cytoskeleton. 73 (10), 521-550 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。