Method Article
Óptica não linear livre de rótulos para o estudo de defeitos dependentes de tubulina na mielina central
Neste Artigo
Resumo
Neste artigo, apresentamos um protocolo para detectar oligodendrócitos carregados de microtúbulos em um modelo de tubulinopatia através de uma abordagem microscópica simples e inovadora de segunda geração harmônica.
Resumo
A visualização satisfatória dos componentes citoesqueléticos no cérebro é um desafio. A distribuição ubíqua das redes de microtúbulos, microfilamentos e filamentos intermediários em todos os tecidos neurais, juntamente com a variabilidade nos resultados das estratégias de fusão de proteínas fluorescentes e sua aplicabilidade limitada a estudos dinâmicos de anticorpos e drogas como veículos cromóforos, tornam as abordagens ópticas clássicas não tão eficazes quanto para outras proteínas. Quando a tubulina precisa ser estudada, a geração livre de rótulo de segundos harmônicos é uma opção muito adequada devido à organização não centrossimétrica da molécula. Esta técnica, quando conjugada à microscopia, pode descrever qualitativamente a distribuição volumétrica de feixes paralelos de microtúbulos em amostras biológicas, com a vantagem adicional de trabalhar com tecidos frescos não fixos e não permeabilizados. Este trabalho descreve como obter imagens de tubulina com uma configuração comercial de microscopia de segunda geração harmônica para destacar microtúbulos nas estruturas enriquecidas com tubulina dos oligodendrócitos, como na hipomielinização com atrofia dos gânglios da base e tubulinopatia do cerebelo (H-ABC), um distúrbio de mielina recentemente descrito.
Introdução
A imagem óptica de estruturas citoesqueléticas em tecidos e preparações de órgãos não é uma tarefa fácil. Os filamentos citoesqueléticos são onipresentes, portanto, se a coloração genérica for realizada, por exemplo, contra alfa-tubulina ou beta-actina ou potencialmente queratina em uma amostra epitelial, o sinal provavelmente será distribuído de forma bastante homogênea por toda a amostra. Para restringir a coloração a um subconjunto mais significativo de componentes celulares, pode-se usar camundongos transgênicos com expressão direcionada1 ou planejar o uso de anticorpos específicos de isoformas. Embora muito poucos destes últimos estejam no mercado (e muito poucos existam em todos os 2,3,4), um modelo animal transgênico pode estar disponível. No entanto, ele precisa ser adquirido pelo laboratório e devidamente alojado, com todos os gastos envolvidos no processo. Certos anticorpos ou produtos químicos, por exemplo, drogas conjugadas com fluoróforos, como faloidina ou paclitaxel, podem ser parcial ou totalmente incompatíveis com o uso em células ou tecidos vivos, limitando assim sua aplicabilidade apenas a estudos de amostras fixas.
No caso da tubulina, um aspecto adicional deve ser levado em consideração, que é a sensibilidade do polímero à fixação. A fixação química convencional com formaldeído é conhecida por não ser adequada para preservar de forma ideal a integridade dos microtúbulos5. Além disso, um relatório recente confirma que a reticulação de formaldeído induz mudanças sutis na ultraestrutura do microtúbulo, semelhante ao que acontece com a ligação de algumas drogas ou moléculas fisiológicas, como o GTP6.
A visualização direta de microtúbulos em amostras não coradas e não fixas é, portanto, muitas vezes desejável. Para conseguir isso, uma solução técnica é a microscopia de segunda geração harmônica (SHG)7, que se baseia na capacidade de feixes de microtúbulos paralelos de atuar como harmonóforos e emitir luz duplicada de frequência quando adequadamente iluminados com um laser infravermelho intenso e pulsado. Embora um segundo sinal harmônico mais forte e estável possa ser gerado a partir do colágeno e da miosina, que são os únicos outros dois materiais biológicos conhecidos por serem capazes de duplicação de frequência, o sinal da tubulina tem sido usado até o momento principalmente para estudar os rearranjos do fuso mitótico 8,9,10 e a morfologia dos microtúbulos axonais11,12,13.
Neste trabalho, apresentamos um novo uso da microscopia SHG como ferramenta diagnóstica para distinguir tecidos do sistema nervoso central (SNC) afetados pela tubulinopatia da tubulina beta 4 A (TUBB4A) de suas contrapartes saudáveis14. Algumas das mutações que ocorrem nessa isoforma predominantemente neural da tubulina, como as que causam hipomielinização e atrofia dos gânglios da base e do cerebelo (H-ABC), induzem o superenchimento de microtúbulos nos oligodendrócitos15,16; as alterações citoesqueléticas, por sua vez, estão associadas a efeitos a jusante, como a dismielinização, com profundo comprometimento das vias motora e sensorial16,17,18,19. O modelo murino de taiep utilizado neste trabalho apresenta conteúdo anormal de microtúbulos nos oligodendrócitos e recapitula a maioria dos sintomas sensório-motores de pacientes com H-ABC17. O protocolo explica como visualizar estruturas como o corpo caloso e o cerebelo, que geralmente são altamente mielinizadas e que são severamente afetadas em pacientes humanos, bem como no rato taiep 19, para destacar as diferenças nos sinais de HAS entre tecidos saudáveis e mutantes.
Protocolo
Todos os procedimentos descritos foram feitos em conformidade com as leis e códigos aprovados no sétimo título do Regulamento da Lei Geral de Saúde Relativa à Pesquisa em Saúde do Governo Mexicano (NOM-062-ZOO-1999) e de acordo com as recomendações do Guia dos Institutos Nacionais de Saúde para o Cuidado e Uso de Animais Experimentais e foram aprovados pelo comitê institucional de bioética em pesquisa da Universidad de Guanajuato e Benemérita Universidad Autónoma de Puebla.
1. Configurações do microscópio
- Ligue o sistema de microscopia.
- Ligue o laser pulsado para garantir que ele estará pronto para lascar em um nível de potência ideal e constante após a extração e preparação da amostra.
- Ajuste o laser para 810 nm. Para estudar os microtúbulos tissulares, utiliza-se 10%-20% da potência laser disponível, o que, no sistema descrito, corresponde a 13-26 mW medidos no plano focal posterior da objetiva.
- Certifique-se de que o microscópio esteja alinhado a Köhler (Arquivo Suplementar 1), com o objetivo que será usado para a imagem SHG.
NOTA: Isto é importante uma vez que, na configuração comercial utilizada neste trabalho, a detecção é realizada no modo de transmissão e através do condensador. - Remova filtros indesejados do caminho de detecção óptica (Figura 1A).
- Certifique-se de que o diafragma do condensador esteja totalmente aberto para garantir que nenhuma luz seja parada desnecessariamente nesse nível.
- Prepare uma objetiva de imersão em óleo de abertura numérica (NA) de 25x/0,8 com uma pequena gota de óleo de imersão na lente.
NOTA: Este objetivo foi utilizado para melhor corresponder ao condensador NA, que foi de 0,55 (idealmente, NAcond≥ NAobj).
2. Controles preliminares do microscópio
NOTA: Execute os controles preliminares do microscópio uma vez, a menos que a configuração seja modificada.
- Imagem amido de milho seco ensanduichado entre lâminas de vidro com parâmetros SHG para gerar imagens SHG que revelam a direção da polarização do laser. Siga as etapas relatadas no Arquivo Suplementar 2, exceto para a potência do laser, que é inferior a 5% para o amido de milho.
- Pegue uma imagem de grãos esparsos de amido de milho e marque a orientação dos lóbulos SHG no plano x-y. Essa orientação corresponde à orientação do laser (Figura 2A).
- Como controle, pegue outra imagem da mesma amostra, inserindo no caminho óptico uma placa de meia onda (posição mostrada na Figura 1A) para alterar a direção de oscilação do laser. A imagem resultante exibe lóbulos de sinal SHG girados (Figura 2B, C).
- Se estiver usando um tipo diferente de filtro passa-banda para o SHG, verifique se ele tem propriedades de transmissão ideais comparando as imagens (Figura 2D, E) e as intensidades de sinal pixel por pixel ao longo de uma varredura de linha (Figura 2F).
3. Extração de tecidos
NOTA: Use sempre ferramentas limpas para realizar os procedimentos cirúrgicos.
- Use ratos taiep de 6 a 12 meses de idade e controles Sprague-Dawley (WT) com idade correspondente.
- Anestesiar os animais com uma injeção i.p. de uma mistura de cetamina-xilazina (0,125 mg/Kg e 5 mg/Kg) diluída numa solução de NaCl estéril a 0,9%.
- Verifique os reflexos de dor e prossiga apenas se eles estiverem ausentes.
- Sacrifice o animal via decapitação.
- Uma vez que a cabeça esteja isolada, abra os ossos da abóbada craniana cuidadosamente ao longo da linha média, começando do ponto mais caudal no topo em direção ao nariz, das cavidades orbitais em direção à linha média e, em seguida, do ponto mais caudal até abaixo do cérebro e do cerebelo.
NOTA: Cortadores de ossos e Rongeurs permitem a remoção adequada dos ossos da cabeça sem danificar as estruturas cerebrais. - Solte o cérebro e o cerebelo do osso. Os dois hemisférios poderiam ser separados. Se os hemisférios estiverem divididos, use uma metade para imagens SHG e fixe a outra metade em paraformaldeído a 3,7% em solução salina tamponada com fosfato (PBS) por 20 minutos dentro de um exaustor químico para posterior seccionamento e coloração.
4. Seccionamento do vibratome
- Prepare uma bandeja tampão vibratome cheia de solução salina balanceada (HBSS) quente (37 °C).
- Fixe o cérebro à placa da amostra usando cola de cianoacrilato através de um pedaço de fita adesiva. A porção/região mais caudal entra em contato com a cola para que as seções coronais utilizáveis da porção oposta e rostral possam ser cortadas.
- Permitir ~10 s para que a cola polimerize para obter a fixação efetiva da amostra.
NOTA: Os melhores resultados são obtidos quando o cérebro é orientado de modo que a lâmina corte "de cima para baixo" em vez de "de um lado para o outro" (Figura 1B).
- Permitir ~10 s para que a cola polimerize para obter a fixação efetiva da amostra.
- Transfira a placa da amostra para o seu suporte magnético dentro da bandeja tampão.
- Comece a cortar seções de 300-500 μm até que as fatias produzidas abranjam toda a superfície do cérebro.
- Neste ponto, reduza a espessura da seção para 160 μm.
- Uma vez que uma seção completa de 160 μm seja cortada ao nível do corpo caloso, recupere-a com uma pipeta Pasteur de vidro modificada com um grande orifício inflamado (Figura 1C).
- Transfira-o para uma placa de Petri limpa com novo HBSS quente ou diretamente para o suporte de vidro para microscopia (coverslip ou prato com fundo de vidro).
NOTA: Para as condições experimentais descritas, a adição de uma folha de cobertura acima da amostra é prejudicial para a imagem.
5. Transferência para o microscópio
- Se o microscópio estiver em uma sala diferente, prepare uma caixa isolada com pacotes de gel aquecidos para transferir as seções de tecido, mantendo a temperatura. A caixa também serve para manter as seções quentes até que sejam fotografadas.
- Coloque a amostra sob o microscópio e certifique-se de que ela está posicionada adequadamente sob a objetiva por observação direta através dos óculos com luz transmitida.
NOTA: O objetivo é alinhar as estruturas emissoras previstas com a direção de oscilação do laser para maximizar o sinal SHG emitido (e, portanto, detectado). - Remova o excesso de HBSS para que uma película líquida fina cubra toda a amostra. Verifique visualmente o filme líquido a cada poucos minutos para evitar a evaporação excessiva e a secagem da amostra.
NOTA: Nas condições descritas, uma seção é usada por não mais de 20 minutos. A secagem da amostra causa efeitos artifactuais drásticos (Figura 1A suplementar). Em vez de adicionar mais HBSS, recomenda-se a imersão periódica da seção em meio quente e fresco se forem necessários tempos de imagem mais longos. O uso de câmaras de perfusão e cola ou agarose de baixa fusão para imobilizar o tecido também é recomendado quando experimentos mais longos devem ser feitos. - Prepare o estágio do microscópio para imagens não desenterradas, o que pode incluir fechar todas as portas da câmara de incubação escura ou cobrir a câmara de incubação com um tecido revestido de poliuretano de nylon preto.
6. Imagens
- Selecione o modo de imagem "não descartado" ao longo do caminho de transmissão. Desta forma, a captura do sinal SH fraco da tubulina será otimizada.
- Selecione o objetivo LCI Plan-Neofluar 25x/0.8 NA.
- Defina uma potência do laser entre 13 mW e 26 mW, com um tempo de permanência de pixels de 12,6 μs. Tire imagens não maiores que 512 pixels x 512 pixels, com velocidade 5 e média 2, para um tempo médio de aquisição de cerca de 15 s.
NOTA: O uso de potências de laser mais altas e/ou tempos de permanência mais longos pode danificar a amostra (Figura 1B Suplementar). - Tire imagens primeiro usando um filtro passa-curto de 485 nm (SP485) e, em uma segunda etapa, adicione um filtro passa-banda nítido de 405 nm (BP405; Figura 3). Siga as etapas relatadas no Arquivo Suplementar 2.
NOTA: Imagens de pseudo-campo brilhante podem ser tiradas através do mesmo detector usando a luz laser residual de uma linha visível (lasers de 405 nm ou 488 nm funcionam melhor).
7. Processamento do cerebelo
- Primeiro, corte o cerebelo com um bisturi em dois hemisférios e, em seguida, cole-os ao suporte do vibratome pela porção média (a parte plana obtida após o corte).
- Seção e imagem do cerebelo da mesma forma que foi descrito para o cérebro (seções de 160 μm, mesmas configurações de vibratome, mesma lâmina, mesmas configurações de microscópio, etc.).
NOTA: Devido à anatomia do cerebelo, sua orientação no momento da seccionamento não é crítica; na maioria das fatias geradas longe da superfície, haverá folia seccionada bem na substância branca.
Resultados
As imagens obtidas com esta metodologia têm um baixo nível de fundo intrínseco devido ao número muito limitado de harmonóforos presentes nos tecidos biológicos, o que é uma das vantagens significativas do método.
Quando as fibras do corpo caloso são visualizadas, estruturas curtas semelhantes a fibras e elementos arredondados podem ser consistentemente encontrados no cérebro taiep (Figura 3B), enquanto o corpo caloso do cérebro controle mostra um sinal muito mais heterogêneo e isotrópico em toda a região do cérebro (Figura 3A). A origem do sinal diferencial reside especificamente no fenômeno da segunda geração harmônica, uma vez que a adição do filtro passa-banda estreito apenas diminui a intensidade do sinal não específico das imagens de controle (Figura 3C-D), ao mesmo tempo em que remove seletivamente esse sinal baixo e difuso ao redor do soma-like e das estruturas curtas e alongadas nas imagens de taiep, que sempre geram luz intensa SH (Figura 3E-F).
A outra estrutura analisada, a substância branca cerebelar, dá resultados comparáveis. Especificamente, enquanto no tecido controle há uma ausência quase completa de sinal de SH (Figura 4B), e as células de Purkinje são pouco visíveis quando se usa o filtro passa-curto, as estruturas alongadas e arredondadas persistem na imagem SH do tecido taiep (Figura 4D).
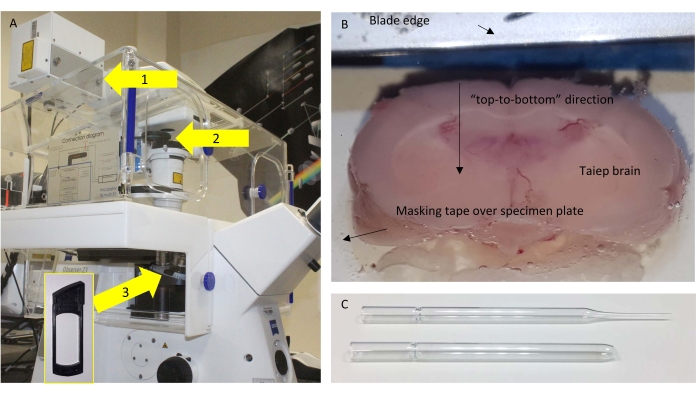
Figura 1: Microscópio e seccionamento . (A) Esquema do microscópio utilizado, com componentes relevantes destacados. Setas: 1 = porta NDD onde o SP485 está localizado perto do detector; 2 = quadros removíveis onde o BP405 é colocado; 3 = posição sob a objetiva onde a placa de meia onda (HWP) é colocada para experimentos de controle. A inserção mostra o quadro onde o HWP pode ser inserido. (B) Vista superior da bandeja tampão do vibratome com o cérebro colado pronto para ser seccionado finamente. (C) A pipeta Pasteur original (superior) e modificada (inferior) utilizada para transferir as secções. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: Controles preliminares. (A) O sinal SHG emitido pelos grãos de amido de milho mostra uma orientação predominante que coincide com a direção de oscilação do laser (horizontal neste caso). (B) Depois de inserir uma placa de meia onda com seu eixo rápido orientado a 45° em relação à horizontal, o sinal é girado em 90°. (C) Fusão do sinal antes e depois da inserção da placa de meia onda. (D) O sinal abaixo de 485 nm emitido pelos grãos de amido de milho. (E) O sinal SHG dos grãos de amido detectados a 405/10 nm. (F) Gráfico mostrando uma comparação dos dois sinais correspondentes às varreduras de linha mostradas nas inserções ampliadas de D e E. O filtro SHG usado causa perda de sinal insignificante. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Imagens SHG do taiep e do corpo caloso WT. Exemplos representativos de (A) WT e (B) sinais taiep obtidos do corpo caloso. (C) Imagem filtrada SP485 de um corpo caloso WT. (D) Imagem filtrada BP405 da mesma amostra que em C. (E) Imagem filtrada SP485 de um corpo caloso taiep . (F) Imagem filtrada BP405 da mesma amostra que em E. Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagens SHG dos cerebelos taiep e WT. Exemplos representativos de sinais de taiep (A-B) WT e (C-D) obtidos da folia cerebelar. (A) Uma imagem filtrada SP485 de um fólio WT; apenas algumas células de Purkinje são visíveis. (B) Uma imagem filtrada BP405 da mesma amostra que em A. (C) Uma imagem filtrada SP485 de um taiep folium. (D) Uma imagem filtrada BP405 da mesma amostra que em C. Por favor, clique aqui para ver uma versão maior desta figura.
Figura 1 suplementar: Exemplos de artefatos. (A) Artefato devido à secagem da amostra. (B) Artefato devido à exposição excessiva. Barras de escala: 30 μm. Clique aqui para baixar este arquivo.
Arquivo Suplementar 1: Alinhamento de Köhler. O arquivo apresenta as etapas para executar o alinhamento da Köhler. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Etapas do software ZEN para aquisição de imagens SHG. Clique aqui para baixar este arquivo.
Discussão
A microscopia SHG faz parte de um grupo de técnicas de óptica não linear, que incluem microscopia de excitação de dois fótons, microscopia de terceira geração harmônica e microscopia coerente de espalhamento Raman anti-Stokes, que contribuíram para expandir a gama de aplicações da microscopia óptica convencional para as ciências da vida20.
Especificamente, a maior força e fraqueza da microscopia SHG referem-se à mesma condição: o gerador de sinal é não-centrossimétrico21. Tal condição arquitetônica específica é frequentemente encontrada no reino dos cristais inorgânicos e orgânicos, mas é rara entre os objetos biológicos. Juntamente com o colágeno e a miosina muscular, os microtúbulos são capazes de gerar um segundo sinal harmônico22, que pode ser detectado com um microscópio se ocorrer soma suficiente nos feixes de polímeros paralelos. No interior das células, a tubulina associa-se para formar feixes paralelos nos núcleos dos axônios (localização específica do tipo celular), nos fusos mitóticos (uma distribuição temporal-específica) e, como apresentado neste trabalho, na associação de microtúbulos de uma tubulinopatia-hipomielinização recentemente descrita com atrofia dos gânglios da base e cerebelo, ou H-ABC (que representa a primeira distribuição patológica relatada desse tipo)14, 16,23.
Esta síndrome sensório-motora ainda é uma doença órfã, pois muitos neurologistas ainda não estão familiarizados com todos os sintomas e/ou não podem arcar com a triagem genética de pacientes suspeitos para confirmar o diagnóstico, o que muito provavelmente causa subdiagnóstico, pelo menos em algumas populações. Além disso, não se sabe muito sobre a patologia a nível molecular e celular, pelo que as técnicas que poderiam ajudar a lançar luz sobre os mecanismos específicos deste processo degenerativo são muito valiosas, também a nível básico.
Portanto, dois usos da microscopia SHG em relação a esse distúrbio de mielina são propostos. A longo prazo, a microscopia SHG poderia ser integrada em abordagens diagnósticas para triagem de biópsia ou análise intracraniana direta, mas o maior impacto poderia estar associado à tentativa de decifrar a base molecular da doença.
Existem muitas vantagens da microscopia SHG em relação a outras técnicas de microscopia. De fato, a microscopia SHG não requer a fixação do tecido, que é uma etapa particularmente delicada da preparação da amostra no caso dos microtúbulos e não requer coloração de qualquer tipo. A maior vantagem está relacionada ao fenômeno físico envolvido. Por um lado, devido ao fundo praticamente ausente, proporciona alto contraste apesar dos sinais fracos gerados, e por outro lado, uma vez que as intensidades de luz necessárias para a duplicação de frequência são muito altas e essas intensidades são atendidas apenas em um volume muito restrito da amostra, a técnica fornece seccionamento óptico intrínseco, permitindo assim reconstruções 3D.
As principais limitações dessa técnica de microscopia estão relacionadas ao custo do equipamento. Um bom microscópio confocal, juntamente com um laser infravermelho pulsado (IR), é necessário para esta aplicação e, embora um sistema de excitação de dois fótons esteja disponível em muitos laboratórios de neurociência, que pode ser facilmente modificado em uma configuração SHG, a diferença de custo em comparação com uma configuração de epifluorescência convencional ainda é significativa. Além disso, como uma técnica limitada por difração, sua resolução é afetada pelo uso de luz infravermelha para iluminação.
Tal como acontece com muitas aplicações pioneiras, as configurações utilizadas para os primeiros experimentos em microscopia SHG aplicada às ciências da vida foram configurações ópticas totalmente personalizadas construídas como sistemas abertos 11,24,25, dando aos experimentadores a possibilidade de otimizar cada componente. Uma vez que, em laboratórios de ciências da vida, é mais comum ter acesso a uma configuração comercial, queríamos testar se um desses sistemas é sensível o suficiente para detectar o sinal fraco emitido pelos feixes de microtúbulos tissulares, que são conhecidos por não serem harmonóforos tão fortes quanto o colágeno. O sistema LSM710 NLO da Zeiss consiste em um microscópio confocal invertido com módulos para detecção não descanizada em modo de transmissão e "epi" e com um laser IR ajustável Chameleon Coerente. Devido à natureza coerente do fenômeno SHG, é crucial selecionar o caminho de transmissão para maximizar a coleta de luz duplicada em frequência da amostra e, portanto, a detecção foi realizada através do condensador de 0,55 NA por integração. Uma objetiva de imersão de LCI Plan-Neofluar 25X/0.8 NA foi utilizada para iluminar a amostra a partir do fundo e aproximar o condensador NA. Com as condições descritas neste artigo, pudemos detectar de forma confiável um sinal do tecido portador da mutação TUBB4A, e esse sinal estava sempre ausente nos controles.
No protocolo relatado, duas etapas exigiram ajustes para alcançar as melhores condições de imagem: a espessura da seção do tecido e a abertura do diafragma do condensador. As seções devem ser tão finas quanto possível para evitar a absorção excessiva, espalhamento e perda de fótons SH, especialmente porque o objetivo é a imagem na transmissão devido à natureza coerente do fenômeno físico. Em nosso caso, o fator limitante foi a consistência do tecido taiep , o que dificultou o corte em cortes homogeneamente espessos abaixo de 160-180 μm. Com o alinhamento convencional de Köhler, o diafragma do condensador é geralmente fechado em cerca de 60% de sua área para gerar contraste na imagem de luz transmitida; por outro lado, para esta aplicação, o objetivo é coletar o maior número possível de fótons, daí a abertura total do diafragma.
Esta aplicação da microscopia SHG é importante, pois fornece a possibilidade de discernir tecido rico em tubulina versus tecido normal em tubulina, com o tecido rico em tubulina emitindo um sinal detectável. Também é possível que outras mutações de tubulinopatia ainda a serem descritas causem distúrbios citoesqueléticos em outros tecidos26, que também podem envolver o enriquecimento de tubulinas.
Em termos de outras aplicações possíveis, a microscopia SHG poderia ser expandida para o estudo de sinais mais fracos, como aqueles presentes no tecido tubulina-normal, em axônios finos e dissociados ou em feixes intracelulares com polaridade mista. Para isso, modificações de configuração, como a substituição do condensador de ar por um com maior abertura numérica e/ou com imersão ou o uso de um detector mais sensível, podem fazer uma diferença importante.
Divulgações
Os autores não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo Consejo Nacional de Ciencia y Tecnología (CONACYT) através das seguintes subvenções: infraestructura 226450 ao VP-CIO, infraestructura 255277 a V.P. e FORDECYT-PRONACES/194171/2020 a V.H. Reconhecemos o apoio de Juvenal Hernández Guevara no CIO na produção de vídeos.
Materiais
| Name | Company | Catalog Number | Comments |
| 405/10 nm BrightLine(R) single-band bandpass filter | Semrock | FF01-405/10-25 | 32 mm diameter, with housing ring |
| Black Nylon, Polyurethane-Coated Fabric | Thorlabs | BK5 | 5' x 9' (1.5 m x 2.7 m) x 0.005" (0.12 mm) Thick |
| Blades for vibratome | any commercial; e.g. Wilkinson Sword | Classic stainless steel double edge razor blades | |
| Cell culture dishes, 35 mm | any commercial; e.g. Falcon | 351008 | |
| Confocal microscope | Zeiss | LSM710NLO AxioObserver Z1 | Inverted microscope, objective used is LCI Plan-Neofluar 25x/0.8 NA |
| Cooler | any commercial | Any insulated, polystyrene box could work, to mantain the sample at about 37 °C | |
| Corn stach | e.g. Maizena | From the supermarket | |
| Coverslips #1.5 | any commercial | Rectangular | |
| Cyanoacrylate glue | e.g. Loctite | To glue the brain to the masking tape | |
| Fine forceps | fine science tools | 11412-11 | To manipulate tissue sections by handling from the meninges |
| Fine scissors | fine science tools | 14370-22 | To cut the skin |
| Fine scissors curved tip | fine science tools | 14061-09 | To cut along the midline |
| Formaldehyde 37% | Sigma-Aldrich | 252549 | To dilute 1:10 in PBS |
| Friedman Rongeur | fine science tools | 16000-14 | To cut the bone |
| Gel packs | any commercial | Prewarmed to 37 °C, to help mantaining the temperature inside the cooler | |
| Glass Pasteur pipette, modified | any commercial | To transfer the tissue section | |
| Hanks′ Balanced Salt solution (HBSS) | Gibco | 14025-076 | Could be prepared from powders |
| Kelly hemostats | fine science tools | 13018-14 | To separate the bone |
| Masking tape | any commercial | To protect th surface of the specimen plate | |
| NDD module, type C | Zeiss | 000000-1410-101 | To detect the signal, reducing light loss. Housing the 000000-1935-163 filter set with the SP485 |
| Offset bone nippers | fine science tools | 16101-10 | To cut the bone |
| Phosphate buffered saline (PBS) | Gibco | 10010-031 | Could be prepared from powders or tabs |
| Pulsed laser | Coherent | Chameleon Vision II | 680–1080 nm tunable laser |
| Scalpel | any commercial | Straight blade with sharp point | |
| Standard pattern forceps | fine science tools | 11000-18 | |
| Vannas spring scissors | fine science tools | 15018-10 | To cut meninges that remain joined to both the slice obtained from vibratome cutting and the section glued to the specimen plate. |
| Vibratome | any commercial; e.g. Leica | VT1200 |
Referências
- Palmiter, R. D., et al. Cell lineage ablation in transgenic mice by cell-specific expression of a toxin gene. Cell. 50 (3), 435-443 (1987).
- Banerjee, A., et al. A monoclonal antibody against the type II isotype of beta-tubulin. Preparation of isotypically altered tubulin. The Journal of Biological Chemistry. 263 (6), 3029-3034 (1988).
- Banerjee, A., Roach, M. C., Trcka, P., Luduena, R. F. Preparation of a monoclonal antibody specific for the class IV isotype of beta-tubulin. Purification and assembly of alpha beta II, alpha beta III, and alpha beta IV tubulin dimers from bovine brain. The Journal of Biological Chemistry. 267 (8), 5625-5630 (1992).
- Banerjee, A., et al. Localization of βv tubulin in the cochlea and cultured cells with a novel monoclonal antibody. Cell Motility and the Cytoskeleton. 65 (6), 505-514 (2008).
- Cross, A. R., Williams, R. C. Kinky microtubules: Bending and breaking induced by fixation in vitro with glutaraldehyde and formaldehyde. Cell Motility and the Cytoskeleton. 20 (4), 272-278 (1991).
- Van Steenbergen, V., et al. Molecular understanding of label-free second harmonic imaging of microtubules. Nature Communications. 10 (1), 3530 (2019).
- Campagnola, P. J., Clark, H. A., Mohler, W. A., Lewis, A., Loew, L. M. Second-harmonic imaging microscopy of living cells. Journal of Biomedical Optics. 6 (3), 277 (2001).
- Campagnola, P. J., et al. Three-dimensional high-resolution second-harmonic generation imaging of endogenous structural proteins in biological tissues. Biophysical Journal. 82 (1), 493-508 (2002).
- Yu, C. -. H., et al. Measuring microtubule polarity in spindles with second-harmonic generation. Biophysical Journal. 106 (8), 1578-1587 (2014).
- Bancelin, S., et al. Probing microtubules polarity in mitotic spindles in situ using Interferometric Second Harmonic Generation Microscopy. Scientific Reports. 7, 6758 (2017).
- Dombeck, D. A., et al. Uniform polarity microtubule assemblies imaged in native brain tissue by second-harmonic generation microscopy. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7081-7086 (2003).
- Psilodimitrakopoulos, S., et al. Estimation of the effective orientation of the SHG source in primary cortical neurons. Optics Express. 17 (16), 14418 (2009).
- Sharoukhov, D., Bucinca-Cupallari, F., Lim, H. Microtubule imaging reveals cytoskeletal deficit predisposing the retinal ganglion cell axons to atrophy in DBA/2J. Investigative Opthalmology & Visual Science. 59 (13), 5292 (2018).
- Alata, M., Piazza, V., Eguibar, J. R., Cortes, C., Hernandez, V. H. H-ABC tubulinopathy revealed by label-free second harmonic generation microscopy. Scientific Reports. 12, 14417 (2022).
- Duncan, I. D., Lunn, K. F., Holmgren, B., Urba-Holmgren, R., Brignolo-Holmes, L. The taiep rat: A myelin mutant with an associated oligodendrocyte microtubular defect. Journal of Neurocytology. 21 (12), 870-884 (1992).
- Duncan, I. D., et al. A mutation in the Tubb4a gene leads to microtubule accumulation with hypomyelination and demyelination: Tubb4a Mutation. Annals of Neurology. 81 (5), 690-702 (2017).
- Garduno-Robles, A., et al. MRI features in a rat model of H-ABC tubulinopathy. Frontiers in Neuroscience. 14, 555 (2020).
- Lopez-Juarez, A., et al. Auditory impairment in H-ABC tubulinopathy. Journal of Comparative Neurology. 529 (5), 957-968 (2021).
- Alata, M., et al. Longitudinal evaluation of cerebellar signs of H-ABC tubulinopathy in a patient and in the taiep model. Frontiers in Neurology. 12, 702039 (2021).
- Parodi, V., et al. Nonlinear optical microscopy: From fundamentals to applications in live bioimaging. Frontiers in Bioengineering and Biotechnology. 8, 585363 (2020).
- Lefort, C. A review of biomedical multiphoton microscopy and its laser sources. Journal of Physics D: Applied Physics. 50 (42), 423001 (2017).
- Campagnola, P. J., Loew, L. M. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms. Nature Biotechnology. 21 (11), 1356-1360 (2003).
- vander Knaap, M. S., et al. New syndrome characterized by hypomyelination with atrophy of the basal ganglia and cerebellum. American Journal of Neuroradiology. 23 (9), 1466 (2002).
- Stoller, P., Kim, B. -. M., Rubenchik, A. M., Reiser, K. M., Da Silva, L. B. Polarization-dependent optical second-harmonic imaging of a rat-tail tendon. Journal of Biomedical Optics. 7 (2), 205 (2002).
- Brown, E. B., et al. In vivo measurement of gene expression, angiogenesis and physiological function in tumors using multiphoton laser scanning microscopy. Nature Medicine. 7 (7), 864-868 (2001).
- Chakraborti, S., Natarajan, K., Curiel, J., Janke, C., Liu, J. The emerging role of the tubulin code: From the tubulin molecule to neuronal function and disease. Cytoskeleton. 73 (10), 521-550 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados