Method Article
Óptica no lineal sin etiquetas para el estudio de defectos dependientes de tubulina en mielina central
En este artículo
Resumen
En este artículo, presentamos un protocolo para detectar oligodendrocitos cargados de microtúbulos en un modelo de tubulinopatía a través de un enfoque simple e innovador de microscopía de segunda generación armónica.
Resumen
La visualización satisfactoria de los componentes citoesqueléticos en el cerebro es un desafío. La distribución ubicua de las redes de microtúbulos, microfilamentos y filamentos intermedios en todos los tejidos neurales, junto con la variabilidad en los resultados de las estrategias de fusión de proteínas fluorescentes y su aplicabilidad limitada a estudios dinámicos de anticuerpos y fármacos como vehículos cromóforos, hacen que los enfoques ópticos clásicos no sean tan efectivos como para otras proteínas. Cuando la tubulina necesita ser estudiada, la generación sin etiqueta de segundos armónicos es una opción muy adecuada debido a la organización no centrosimétrica de la molécula. Esta técnica, cuando se conjuga con microscopía, puede describir cualitativamente la distribución volumétrica de haces paralelos de microtúbulos en muestras biológicas, con la ventaja adicional de trabajar con tejidos frescos que no están fijados ni permeabilizados. Este trabajo describe cómo obtener imágenes de la tubulina con una configuración comercial de microscopía de segunda generación armónica para resaltar los microtúbulos en las estructuras enriquecidas con tubulina de los oligodendrocitos, como en la hipomielinización con atrofia de los ganglios basales y la tubulinopatía del cerebelo (H-ABC), un trastorno de mielina descrito recientemente.
Introducción
La obtención de imágenes ópticas de estructuras citoesqueléticas en tejidos y preparaciones de órganos no es una tarea fácil. Los filamentos citoesqueléticos son ubicuos, por lo que si se realiza una tinción genérica, por ejemplo, contra alfa-tubulina o beta-actina o potencialmente queratina en una muestra epitelial, la señal probablemente se distribuirá de manera bastante homogénea en toda la muestra. Para restringir la tinción a un subconjunto más significativo de componentes celulares, se pueden usar ratones transgénicos con expresión dirigida1 o planear usar anticuerpos específicos de isoforma. Si bien muy pocos de estos últimos están en el mercado (y muy pocos existen en absoluto 2,3,4), un modelo animal transgénico podría estar disponible. Sin embargo, debe ser adquirido por el laboratorio y alojado adecuadamente, con todos los gastos involucrados en el proceso. Ciertos anticuerpos o productos químicos, por ejemplo, fármacos conjugados con fluoróforos como la faloidina o el paclitaxel, pueden ser parcial o totalmente incompatibles con el uso en células o tejidos vivos, lo que limita su aplicabilidad solo a estudios de muestras fijas.
En el caso de la tubulina, se debe tener en cuenta un aspecto adicional, que es la sensibilidad del polímero a la fijación. La fijación química convencional con formaldehído es conocida por no ser adecuada para preservar de manera óptima la integridad de los microtúbulos5. Además, un informe reciente confirma que la reticulación de formaldehído induce cambios sutiles en la ultraestructura del microtúbulo, similar a lo que sucede con la unión de algunos fármacos o moléculas fisiológicas como GTP6.
La visualización directa de microtúbulos en muestras no teñidas y no fijadas es, por lo tanto, a menudo deseable. Para lograr esto, una solución técnica es la microscopía7 de segunda generación armónica (SHG), que se basa en la capacidad de los haces de microtúbulos paralelos para actuar como armonóforos y emitir luz duplicada en frecuencia cuando se iluminan adecuadamente con un láser infrarrojo intenso y pulsado. Aunque se puede generar una segunda señal armónica más fuerte y estable a partir del colágeno y la miosina, que son los únicos otros dos materiales biológicos conocidos por ser capaces de duplicar la frecuencia, la señal de la tubulina se ha utilizado hasta ahora principalmente para estudiar los reordenamientos del huso mitótico 8,9,10 y la morfología de los microtúbulos axonales11,12,13.
En este trabajo, presentamos un uso novedoso de la microscopía SHG como herramienta de diagnóstico para distinguir los tejidos del sistema nervioso central (SNC) afectados por la tubulinopatía por tubulina beta 4 A (TUBB4A) de sus contrapartes sanas14. Algunas de las mutaciones que ocurren en esta isoforma predominantemente neural de tubulina, como las que causan hipomielinización y atrofia de los ganglios basales y cerebelo (H-ABC), inducen el sobrellenado de microtúbulos en los oligodendrocitos15,16; Las alteraciones citoesqueléticas, a su vez, están asociadas con efectos posteriores como la desmielinización, con un profundo deterioro de las vías motoras y sensoriales16,17,18,19. El modelo murino taiep utilizado en este trabajo muestra un contenido anormal de microtúbulos en los oligodendrocitos y recapitula la mayoría de los síntomas sensorio-motores de los pacientes con H-ABC17. El protocolo explica cómo visualizar estructuras como el cuerpo calloso y el cerebelo, que generalmente están altamente mielinizadas y que se ven gravemente afectadas en pacientes humanos, así como en la rata taiep 19, para resaltar las diferencias en las señales de SH entre tejidos sanos y mutantes.
Protocolo
Todos los procedimientos descritos se realizaron en cumplimiento con las leyes y códigos aprobados en el título séptimo del Reglamento de la Ley General de Salud en Investigación en Salud del Gobierno de México (NOM-062-ZOO-1999) y de acuerdo con las recomendaciones de la Guía de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Experimentación y fueron aprobados por el comité institucional de bioética en investigación de la Universidad de Guanajuato y la Benemérita Universidad Autónoma de Puebla.
1. Ajustes del microscopio
- Encienda el sistema de microscopía.
- Encienda el láser pulsado para garantizar que estará listo para lase a un nivel de potencia óptimo y constante después de la extracción y preparación de la muestra.
- Sintoniza el láser a 810 nm. Para estudiar los microtúbulos tisulares se utiliza el 10%-20% de la potencia láser disponible, que, en el sistema descrito, corresponde a 13-26 mW medidos en el plano focal posterior del objetivo.
- Asegúrese de que el microscopio esté alineado con Köhler (Archivo suplementario 1), con el objetivo que se utilizará para la obtención de imágenes de SHG.
NOTA: Esto es importante ya que, en la configuración comercial utilizada en este trabajo, la detección se realiza en modo de transmisión y a través del condensador. - Elimine los filtros no deseados de la ruta de detección óptica (Figura 1A).
- Asegúrese de que el diafragma del condensador esté completamente abierto para garantizar que no se detenga innecesariamente la luz a este nivel.
- Prepare un objetivo de inmersión en aceite de apertura numérica (NA) de 25x/0,8 con una pequeña gota de aceite de inmersión en el objetivo.
NOTA: Este objetivo se utilizó para que coincida mejor con el condensador NA, que era 0.55 (idealmente, NAcond≥ NAobj).
2. Controles preliminares del microscopio
NOTA: Realice los controles preliminares del microscopio una vez, a menos que se modifique la configuración.
- Imagen de almidón de maíz seco intercalado entre portaobjetos de vidrio con parámetros SHG para generar imágenes de SHG que revelan la dirección de polarización del láser. Siga los pasos indicados en el Archivo complementario 2, excepto la potencia del láser, que es inferior al 5% para el almidón de maíz.
- Tome una imagen de granos de almidón de maíz dispersos y marque la orientación de los lóbulos SHG en el plano x-y. Esta orientación corresponde a la orientación del láser (Figura 2A).
- Como control, tome otra imagen de la misma muestra, insertando en la trayectoria óptica una placa de media onda (posición mostrada en la Figura 1A) para alterar la dirección de oscilación del láser. La imagen resultante muestra lóbulos de señal SHG girados (Figura 2B, C).
- Si utiliza un tipo diferente de filtro de paso de banda para el SHG, asegúrese de que tenga propiedades de transmisión óptimas comparando las imágenes (Figura 2D, E) y las intensidades de señal píxel por píxel a lo largo de un escaneo de línea (Figura 2F).
3. Extracción de tejidos
NOTA: Utilice siempre herramientas limpias para realizar los procedimientos quirúrgicos.
- Use ratas taiep de 6 a 12 meses de edad y controles Sprague-Dawley (WT) de la misma edad.
- Anestesiar a los animales con una inyección i.p. de una mezcla de ketamina-xilazina (0,125 mg/Kg y 5 mg/Kg) diluida en una solución estéril de NaCl al 0,9%.
- Verifique los reflejos del dolor y proceda solo si están ausentes.
- Sacrificar el animal a través de la decapitación.
- Una vez que la cabeza esté aislada, abra los huesos de la bóveda craneal cuidadosamente a lo largo de la línea media, comenzando desde el punto más caudal en la parte superior hacia la nariz, desde las cavidades orbitales hacia la línea media, y luego desde el punto más caudal hasta debajo del cerebro y el cerebelo.
NOTA: Los cortadores de huesos y Rongeurs permiten la eliminación adecuada de los huesos de la cabeza sin dañar las estructuras cerebrales. - Liberar el cerebro y el cerebelo del hueso. Los dos hemisferios podrían separarse. Si los hemisferios están divididos, use una mitad para las imágenes de SHG y fije la otra mitad en paraformaldehído al 3,7% en solución salina tamponada con fosfato (PBS) durante 20 minutos dentro de una campana química para su posterior seccionamiento y tinción.
4. Sección de vibratoré
- Prepare una bandeja tampón de vibratomo llena de solución salina equilibrada (HBSS) tibia (37 °C) de Hank's.
- Fije el cerebro a la placa de la muestra usando pegamento de cianoacrilato a través de un trozo de cinta adhesiva. La porción / región más caudal entra en contacto con el pegamento para que se puedan cortar las secciones coronales utilizables de la porción rostral opuesta.
- Permita ~10 s para que el pegamento polimerice para obtener una unión efectiva de la muestra.
NOTA: Los mejores resultados se obtienen cuando el cerebro está orientado de manera que la cuchilla corta "de arriba a abajo" en lugar de "de lado a lado" (Figura 1B).
- Permita ~10 s para que el pegamento polimerice para obtener una unión efectiva de la muestra.
- Transfiera la placa de la muestra a su soporte magnético dentro de la bandeja intermedia.
- Comience a cortar secciones de 300-500 μm hasta que las rebanadas producidas abarquen toda la superficie del cerebro.
- En este punto, reduzca el grosor de la sección a 160 μm.
- Una vez cortada una sección completa de 160 μm a nivel del cuerpo calloso, recuperarla con una pipeta Pasteur de vidrio modificada con un orificio grande y flameado (Figura 1C).
- Transfiéralo a una placa de Petri limpia con HBSS nuevo y caliente o directamente sobre el soporte de vidrio para microscopía (cubreobjetos o plato con fondo de vidrio).
NOTA: Para las condiciones experimentales descritas, agregar un cubreobjetos sobre la muestra es perjudicial para la imagen.
5. Transferencia al microscopio
- Si el microscopio está en una habitación diferente, prepare una caja aislada con paquetes de gel calentados para transferir las secciones de tejido mientras mantiene la temperatura. La caja también sirve para mantener las secciones calientes hasta que se visualizen.
- Coloque la muestra bajo el microscopio y asegúrese de que esté colocada correctamente debajo del objetivo mediante la observación directa a través de los oculares con luz transmitida.
NOTA: El objetivo es alinear las estructuras emisoras previstas con la dirección de oscilación del láser para maximizar la señal SHG emitida (y, por lo tanto, detectada). - Retire el exceso de HBSS para que una película líquida delgada cubra toda la muestra. Revise visualmente la película líquida cada pocos minutos para evitar la evaporación excesiva y el secado de la muestra.
NOTA: En las condiciones descritas, una sección se utiliza durante no más de 20 minutos. El secado de la muestra provoca efectos artificóficos drásticos (Figura complementaria 1A). En lugar de agregar más HBSS, se recomienda el remojo periódico de la sección en un medio cálido y fresco si se necesitan tiempos de imagen más largos. También se recomienda el uso de cámaras de perfusión y pegamento o agarosa de bajo punto de fusión para inmovilizar el tejido cuando se van a realizar experimentos más largos. - Prepare la etapa del microscopio para imágenes no escaneadas, lo que podría incluir cerrar todas las puertas de la cámara de incubación oscura o cubrir la cámara de incubación con una tela recubierta de poliuretano de nylon negro.
6. Imágenes
- Seleccione el modo de imagen "no descanado" a lo largo de la ruta de transmisión. De esta manera, se optimizará la captura de la débil señal SH de tubulina.
- Seleccione el objetivo LCI Plan-Neofluar 25x/0.8 NA.
- Establezca una potencia láser entre 13 mW y 26 mW, con un tiempo de permanencia de píxeles de 12,6 μs. Tome imágenes de no más de 512 píxeles x 512 píxeles, con una velocidad de 5 y un promedio de 2, para un tiempo de adquisición promedio de aproximadamente 15 s.
NOTA: El uso de potencias láser más altas y/o tiempos de permanencia más largos puede dañar la muestra (Figura suplementaria 1B). - Tome imágenes primero con un filtro de paso corto de 485 nm (SP485) y, en un segundo paso, agregue un filtro de paso de banda nítido de 405 nm (BP405; Figura 3). Siga los pasos indicados en el Archivo complementario 2.
NOTA: Las imágenes de campo de gran riesgo se pueden tomar a través del mismo detector utilizando la luz láser residual de una línea visible (los láseres de 405 nm o 488 nm funcionan mejor).
7. Procesamiento del cerebelo
- Primero, corte el cerebelo con un bisturí en dos hemisferios y luego péguelos al soporte del vibratomo por la porción media (la parte plana obtenida después del corte).
- Sección e imagen del cerebelo de la misma manera que se describió para el cerebro (secciones de 160 μm, mismos ajustes de vibratomo, misma cuchilla, mismos ajustes de microscopio, etc.).
NOTA: Debido a la anatomía del cerebelo, su orientación en el momento de la sección no es crítica; En la mayoría de las rodajas generadas lejos de la superficie, habrá folia seccionada bien en la sustancia blanca.
Resultados
Las imágenes obtenidas con esta metodología tienen un nivel de fondo intrínsecamente bajo debido al número muy limitado de armonóforos presentes en los tejidos biológicos, que es una de las ventajas significativas del método.
Cuando se obtienen imágenes de las fibras del cuerpo calloso, se pueden encontrar consistentemente estructuras cortas similares a fibras y elementos redondeados en el cerebro taiep (Figura 3B), mientras que el cuerpo calloso del cerebro control muestra una señal mucho más heterogénea e isotrópica en toda la región del cerebro (Figura 3A). El origen de la señal diferencial se encuentra específicamente en el fenómeno de segunda generación armónica, ya que agregar el filtro de paso de banda estrecho solo disminuye la intensidad de la señal no específica de las imágenes de control (Figura 3C-D) mientras elimina selectivamente esta señal baja y difusa de alrededor del soma y las estructuras cortas y alargadas en las imágenes taiep, que siempre generan luz SH intensa (Figura 3E-F).
La otra estructura analizada, la sustancia blanca cerebelosa, da resultados comparables. Específicamente, mientras que en el tejido control hay una ausencia casi completa de señal SH (Figura 4B), y las células de Purkinje son apenas visibles cuando se usa el filtro de paso corto, las estructuras alargadas y redondeadas persisten en la imagen SH del tejido taiep (Figura 4D).
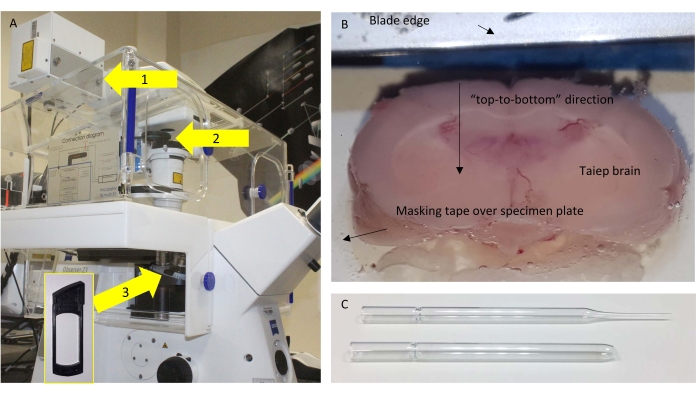
Figura 1: Microscopio y seccionamiento . (A) Esquema del microscopio utilizado, con los componentes relevantes resaltados. Flechas: 1 = puerto NDD donde se encuentra el SP485 cerca del detector; 2 = marcos extraíbles donde se coloca el BP405; 3 = posición debajo del objetivo donde se coloca la placa de media onda (HWP) para experimentos de control. El recuadro muestra el marco donde se podría insertar el HWP. (B) Vista superior de la bandeja amortiguadora de vibratomo con el cerebro pegado listo para ser seccionado con precisión. (C) La pipeta Pasteur original (superior) y modificada (abajo) utilizada para transferir las secciones. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Controles preliminares. (A) La señal SHG emitida por los granos de almidón de maíz muestra una orientación predominante que coincide con la dirección de oscilación del láser (horizontal en este caso). (B) Después de insertar una placa de media onda con su eje rápido orientado a 45° con respecto a la horizontal, la señal se gira 90°. (C) Fusión de la señal antes y después de la inserción de la placa de media onda. (D) La señal por debajo de 485 nm emitida por los granos de almidón de maíz. (E) La señal SHG de los granos de almidón detectados a 405/10 nm. (F) Gráfico que muestra una comparación de las dos señales correspondientes a los escaneos lineales mostrados en las inserciones ampliadas de D y E. El filtro SHG utilizado causa una pérdida de señal insignificante. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Imágenes SHG de taiep y WT corpus calloso. Ejemplos representativos de (A) WT y (B) señales taiep obtenidas del cuerpo calloso. (C) Imagen filtrada SP485 de un cuerpo calloso WT. (D) Imagen filtrada BP405 de la misma muestra que en C. (E) SP485 imagen filtrada de un cuerpo calloso taiep . (F) Imagen filtrada BP405 de la misma muestra que en E. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes SHG de cerebelos taiep y WT. Ejemplos representativos de señales (A-B) WT y (C-D) taiep obtenidas de folios cerebelosos. (A) Una imagen filtrada SP485 de un folio WT; sólo algunas células de Purkinje son visibles. (B) Una imagen filtrada BP405 de la misma muestra que en A. (C) Una imagen filtrada SP485 de un folio taiep. (D) Una imagen filtrada BP405 de la misma muestra que en C. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Ejemplos de artefactos. (A) Artefacto debido al secado de la muestra. (B) Artefacto debido a una exposición excesiva. Barras de escala: 30 μm. Haga clic aquí para descargar este archivo.
Archivo complementario 1: Alineación de Köhler. El archivo presenta los pasos para realizar la alineación de Köhler. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Pasos del software ZEN para la adquisición de imágenes SHG. Haga clic aquí para descargar este archivo.
Discusión
La microscopía SHG forma parte de un grupo de técnicas ópticas no lineales, que incluyen microscopía de excitación de dos fotones, microscopía de tercera generación armónica y microscopía de dispersión Raman anti-Stokes coherente, que han contribuido a ampliar la gama de aplicaciones de la microscopía óptica convencional a las ciencias de la vida20.
Específicamente, la mayor fortaleza y debilidad de la microscopía SHG se relaciona con la misma condición: el generador de señales no es centrosimétrico21. Tal condición arquitectónica específica se encuentra a menudo en el reino de los cristales inorgánicos y orgánicos, pero es rara entre los objetos biológicos. Junto con el colágeno y la miosina muscular, los microtúbulos son capaces de generar una segunda señal armónica22, que puede ser detectada con un microscopio si se produce suficiente suma en los haces de polímeros paralelos. Dentro de las células, la tubulina se asocia para formar haces paralelos en los núcleos de los axones (una ubicación específica del tipo celular), en los husos mitóticos (una distribución específica temporal) y, como se presenta en este trabajo, en la asociación de microtúbulos de marca registrada de una tubulinopatía-hipomielinización recientemente descrita con atrofia de los ganglios basales y el cerebelo, o H-ABC (que representa la primera distribución patológica reportada de este tipo)14, 16,23.
Este síndrome sensorio-motor sigue siendo una enfermedad huérfana, ya que muchos neurólogos aún no están familiarizados con todos los síntomas y / o no pueden permitirse el cribado genético de pacientes sospechosos para confirmar el diagnóstico, lo que muy probablemente causa un infradiagnóstico, al menos en algunas poblaciones. Además de eso, no se sabe mucho sobre la patología a nivel molecular y celular, por lo que las técnicas que podrían ayudar a arrojar luz sobre los mecanismos específicos de este proceso degenerativo son muy valiosas, también a nivel básico.
Por lo tanto, se proponen dos usos de la microscopía SHG con respecto a este trastorno de la mielina. A largo plazo, la microscopía SHG podría integrarse en los enfoques diagnósticos para la detección de biopsias o el análisis intracraneal directo, pero el mayor impacto podría estar asociado con tratar de descifrar las bases moleculares de la enfermedad.
Hay muchas ventajas de la microscopía SHG sobre otras técnicas de microscopía. De hecho, la microscopía SHG no requiere la fijación del tejido, que es un paso particularmente delicado de la preparación de muestras en el caso de los microtúbulos, y no requiere tinción de ningún tipo. La mayor ventaja está relacionada con el fenómeno físico involucrado. Por un lado, debido a la ausencia de fondo virtual, proporciona un alto contraste a pesar de las débiles señales generadas, y por otro lado, dado que las intensidades de luz necesarias para la duplicación de frecuencia son muy altas y estas intensidades se cumplen solo en un volumen muy restringido de la muestra, la técnica proporciona una sección óptica intrínseca, lo que permite reconstrucciones 3D.
Las principales limitaciones de esta técnica de microscopía están relacionadas con el costo del equipo. Un buen microscopio confocal, junto con un láser infrarrojo pulsado (IR), es necesario para esta aplicación, y aunque un sistema de excitación de dos fotones está disponible en muchos laboratorios de neurociencia, que se puede modificar fácilmente en una configuración de SHG, la diferencia en el costo en comparación con una configuración de epifluorescencia convencional sigue siendo significativa. Además, como técnica limitada por difracción, su resolución se ve afectada por el uso de luz IR para la iluminación.
Al igual que con muchas aplicaciones pioneras, las configuraciones utilizadas para los primeros experimentos en microscopía SHG aplicadas a las ciencias de la vida fueron configuraciones ópticas totalmente personalizadas construidas como sistemas abiertos 11,24,25, dando a los experimentadores la posibilidad de optimizar cada componente. Dado que, en los laboratorios de ciencias de la vida, es más común tener acceso a una configuración comercial, queríamos probar si uno de estos sistemas es lo suficientemente sensible como para detectar la señal débil emitida por los haces de microtúbulos tisulares, que se sabe que no son tan fuertes como el colágeno. El sistema LSM710 NLO de Zeiss consiste en un microscopio confocal invertido con módulos para detección no desescaneada en modo transmisión y "epi" y con un láser IR sintonizable Coherent Chameleon. Debido a la naturaleza coherente del fenómeno SHG, es crucial seleccionar la ruta de transmisión para maximizar la recolección de luz duplicada de frecuencia de la muestra y, por lo tanto, la detección se realizó a través del condensador de 0.55 NA por integración. Se utilizó un objetivo de inmersión LCI Plan-Neofluar 25X/0.8 NA para iluminar la muestra desde el fondo y aproximar el condensador NA. Con las condiciones descritas en este documento, pudimos detectar de manera confiable una señal del tejido portador de la mutación TUBB4A, y esta señal siempre estuvo ausente en los controles.
En el protocolo informado, dos pasos requirieron ajustes para lograr las mejores condiciones de imagen: el grosor de la sección de tejido y la apertura del diafragma del condensador. Las secciones deben ser lo más delgadas posible para evitar la absorbancia excesiva, la dispersión y la pérdida de fotones SH, especialmente porque el objetivo es obtener imágenes en transmisión debido a la naturaleza coherente del fenómeno físico. En nuestro caso, el factor limitante fue la consistencia del tejido taiep , lo que dificultó la seccionación en secciones homogéneamente gruesas por debajo de 160-180 μm. Con la alineación convencional de Köhler, el diafragma del condensador generalmente se cierra en aproximadamente el 60% de su área para generar contraste en la imagen de luz transmitida; Por el contrario, para esta aplicación, el objetivo es recoger tantos fotones como sea posible, de ahí la apertura total del diafragma.
Esta aplicación de la microscopía SHG es importante ya que proporciona la posibilidad de discernir el tejido rico en tubulina frente al tejido normal de tubulina, con el tejido rico en tubulina emitiendo una señal detectable. También es posible que otras mutaciones de tubulinopatía aún por describir causen trastornos citoesqueléticos en otros tejidos26, que también pueden implicar el enriquecimiento de tubulina.
En cuanto a otras posibles aplicaciones, la microscopía SHG podría ampliarse al estudio de señales más débiles, como las presentes en el tejido tubulina-normal, en axones finos y disociados, o en haces intracelulares con polaridad mixta. Para ello, las modificaciones de configuración, como la sustitución del condensador de aire por uno con una apertura numérica más alta y/o con inmersión o el uso de un detector más sensible, podrían marcar una diferencia importante.
Divulgaciones
Los autores no tienen intereses financieros contrapuestos.
Agradecimientos
Este trabajo fue apoyado por el Consejo Nacional de Ciencia y Tecnología (CONACYT) a través de las siguientes subvenciones: infraestructura 226450 a VP-CIO, infraestructura 255277 a V.P., y FORDECYT-PRONACES/194171/2020 a V.H. Reconocemos el apoyo de Juvenal Hernández Guevara en CIO en la realización del video.
Materiales
| Name | Company | Catalog Number | Comments |
| 405/10 nm BrightLine(R) single-band bandpass filter | Semrock | FF01-405/10-25 | 32 mm diameter, with housing ring |
| Black Nylon, Polyurethane-Coated Fabric | Thorlabs | BK5 | 5' x 9' (1.5 m x 2.7 m) x 0.005" (0.12 mm) Thick |
| Blades for vibratome | any commercial; e.g. Wilkinson Sword | Classic stainless steel double edge razor blades | |
| Cell culture dishes, 35 mm | any commercial; e.g. Falcon | 351008 | |
| Confocal microscope | Zeiss | LSM710NLO AxioObserver Z1 | Inverted microscope, objective used is LCI Plan-Neofluar 25x/0.8 NA |
| Cooler | any commercial | Any insulated, polystyrene box could work, to mantain the sample at about 37 °C | |
| Corn stach | e.g. Maizena | From the supermarket | |
| Coverslips #1.5 | any commercial | Rectangular | |
| Cyanoacrylate glue | e.g. Loctite | To glue the brain to the masking tape | |
| Fine forceps | fine science tools | 11412-11 | To manipulate tissue sections by handling from the meninges |
| Fine scissors | fine science tools | 14370-22 | To cut the skin |
| Fine scissors curved tip | fine science tools | 14061-09 | To cut along the midline |
| Formaldehyde 37% | Sigma-Aldrich | 252549 | To dilute 1:10 in PBS |
| Friedman Rongeur | fine science tools | 16000-14 | To cut the bone |
| Gel packs | any commercial | Prewarmed to 37 °C, to help mantaining the temperature inside the cooler | |
| Glass Pasteur pipette, modified | any commercial | To transfer the tissue section | |
| Hanks′ Balanced Salt solution (HBSS) | Gibco | 14025-076 | Could be prepared from powders |
| Kelly hemostats | fine science tools | 13018-14 | To separate the bone |
| Masking tape | any commercial | To protect th surface of the specimen plate | |
| NDD module, type C | Zeiss | 000000-1410-101 | To detect the signal, reducing light loss. Housing the 000000-1935-163 filter set with the SP485 |
| Offset bone nippers | fine science tools | 16101-10 | To cut the bone |
| Phosphate buffered saline (PBS) | Gibco | 10010-031 | Could be prepared from powders or tabs |
| Pulsed laser | Coherent | Chameleon Vision II | 680–1080 nm tunable laser |
| Scalpel | any commercial | Straight blade with sharp point | |
| Standard pattern forceps | fine science tools | 11000-18 | |
| Vannas spring scissors | fine science tools | 15018-10 | To cut meninges that remain joined to both the slice obtained from vibratome cutting and the section glued to the specimen plate. |
| Vibratome | any commercial; e.g. Leica | VT1200 |
Referencias
- Palmiter, R. D., et al. Cell lineage ablation in transgenic mice by cell-specific expression of a toxin gene. Cell. 50 (3), 435-443 (1987).
- Banerjee, A., et al. A monoclonal antibody against the type II isotype of beta-tubulin. Preparation of isotypically altered tubulin. The Journal of Biological Chemistry. 263 (6), 3029-3034 (1988).
- Banerjee, A., Roach, M. C., Trcka, P., Luduena, R. F. Preparation of a monoclonal antibody specific for the class IV isotype of beta-tubulin. Purification and assembly of alpha beta II, alpha beta III, and alpha beta IV tubulin dimers from bovine brain. The Journal of Biological Chemistry. 267 (8), 5625-5630 (1992).
- Banerjee, A., et al. Localization of βv tubulin in the cochlea and cultured cells with a novel monoclonal antibody. Cell Motility and the Cytoskeleton. 65 (6), 505-514 (2008).
- Cross, A. R., Williams, R. C. Kinky microtubules: Bending and breaking induced by fixation in vitro with glutaraldehyde and formaldehyde. Cell Motility and the Cytoskeleton. 20 (4), 272-278 (1991).
- Van Steenbergen, V., et al. Molecular understanding of label-free second harmonic imaging of microtubules. Nature Communications. 10 (1), 3530 (2019).
- Campagnola, P. J., Clark, H. A., Mohler, W. A., Lewis, A., Loew, L. M. Second-harmonic imaging microscopy of living cells. Journal of Biomedical Optics. 6 (3), 277 (2001).
- Campagnola, P. J., et al. Three-dimensional high-resolution second-harmonic generation imaging of endogenous structural proteins in biological tissues. Biophysical Journal. 82 (1), 493-508 (2002).
- Yu, C. -. H., et al. Measuring microtubule polarity in spindles with second-harmonic generation. Biophysical Journal. 106 (8), 1578-1587 (2014).
- Bancelin, S., et al. Probing microtubules polarity in mitotic spindles in situ using Interferometric Second Harmonic Generation Microscopy. Scientific Reports. 7, 6758 (2017).
- Dombeck, D. A., et al. Uniform polarity microtubule assemblies imaged in native brain tissue by second-harmonic generation microscopy. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7081-7086 (2003).
- Psilodimitrakopoulos, S., et al. Estimation of the effective orientation of the SHG source in primary cortical neurons. Optics Express. 17 (16), 14418 (2009).
- Sharoukhov, D., Bucinca-Cupallari, F., Lim, H. Microtubule imaging reveals cytoskeletal deficit predisposing the retinal ganglion cell axons to atrophy in DBA/2J. Investigative Opthalmology & Visual Science. 59 (13), 5292 (2018).
- Alata, M., Piazza, V., Eguibar, J. R., Cortes, C., Hernandez, V. H. H-ABC tubulinopathy revealed by label-free second harmonic generation microscopy. Scientific Reports. 12, 14417 (2022).
- Duncan, I. D., Lunn, K. F., Holmgren, B., Urba-Holmgren, R., Brignolo-Holmes, L. The taiep rat: A myelin mutant with an associated oligodendrocyte microtubular defect. Journal of Neurocytology. 21 (12), 870-884 (1992).
- Duncan, I. D., et al. A mutation in the Tubb4a gene leads to microtubule accumulation with hypomyelination and demyelination: Tubb4a Mutation. Annals of Neurology. 81 (5), 690-702 (2017).
- Garduno-Robles, A., et al. MRI features in a rat model of H-ABC tubulinopathy. Frontiers in Neuroscience. 14, 555 (2020).
- Lopez-Juarez, A., et al. Auditory impairment in H-ABC tubulinopathy. Journal of Comparative Neurology. 529 (5), 957-968 (2021).
- Alata, M., et al. Longitudinal evaluation of cerebellar signs of H-ABC tubulinopathy in a patient and in the taiep model. Frontiers in Neurology. 12, 702039 (2021).
- Parodi, V., et al. Nonlinear optical microscopy: From fundamentals to applications in live bioimaging. Frontiers in Bioengineering and Biotechnology. 8, 585363 (2020).
- Lefort, C. A review of biomedical multiphoton microscopy and its laser sources. Journal of Physics D: Applied Physics. 50 (42), 423001 (2017).
- Campagnola, P. J., Loew, L. M. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms. Nature Biotechnology. 21 (11), 1356-1360 (2003).
- vander Knaap, M. S., et al. New syndrome characterized by hypomyelination with atrophy of the basal ganglia and cerebellum. American Journal of Neuroradiology. 23 (9), 1466 (2002).
- Stoller, P., Kim, B. -. M., Rubenchik, A. M., Reiser, K. M., Da Silva, L. B. Polarization-dependent optical second-harmonic imaging of a rat-tail tendon. Journal of Biomedical Optics. 7 (2), 205 (2002).
- Brown, E. B., et al. In vivo measurement of gene expression, angiogenesis and physiological function in tumors using multiphoton laser scanning microscopy. Nature Medicine. 7 (7), 864-868 (2001).
- Chakraborti, S., Natarajan, K., Curiel, J., Janke, C., Liu, J. The emerging role of the tubulin code: From the tubulin molecule to neuronal function and disease. Cytoskeleton. 73 (10), 521-550 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados