Method Article
Нелинейная оптика без этикеток для изучения тубулин-зависимых дефектов в центральном миелине
В этой статье
Резюме
В этой статье мы представляем протокол обнаружения олигодендроцитов, нагруженных микротрубочками, в модели тубулинопатии с помощью простого, инновационного подхода к микроскопии второй гармонической генерации.
Аннотация
Удовлетворительная визуализация цитоскелетных компонентов в головном мозге является сложной задачей. Повсеместное распределение сетей микротрубочек, микрофиламентов и промежуточных нитей во всех нервных тканях вместе с изменчивостью результатов стратегий слияния флуоресцентных белков и их ограниченной применимостью к динамическим исследованиям антител и лекарств в качестве хромофорных носителей делают классические оптические подходы не такими эффективными, как для других белков. Когда тубулин необходимо изучить, генерация вторых гармоник без меток является очень подходящим вариантом из-за нецентросимметричной организации молекулы. Этот метод при сопряжении с микроскопией может качественно описать объемное распределение параллельных пучков микротрубочек в биологических образцах, с дополнительным преимуществом работы со свежими тканями, которые являются нефиксированными и неразрывноженными. В этой работе описывается, как изобразить тубулин с помощью коммерческой микроскопии второй гармонической генерации для выделения микротрубочек в обогащенных тубулином структурах олигодендроцитов, как при гипомиелинизации с атрофией базальных ганглиев и тубулинопатии мозжечка (H-ABC), недавно описанного расстройства миелина.
Введение
Оптическая визуализация цитоскелетных структур в тканях и препаратах органов – непростая задача. Цитоскелетные нити распространены повсеместно, поэтому, если общее окрашивание выполняется, например, против альфа-тубулина или бета-актина или потенциально кератина в образце эпителия, сигнал, вероятно, будет распределен довольно однородно по всему образцу. Чтобы ограничить окрашивание более значимым подмножеством клеточных компонентов, можно либо использовать трансгенных мышей с целевой экспрессией1, либо планировать использование изоформ-специфических антител. В то время как очень немногие из последних представлены на рынке (и очень немногие из них существуют вообще 2,3,4), трансгенная модель животных может быть доступна. Тем не менее, он должен быть приобретен лабораторией и должным образом размещен, со всеми расходами, связанными с процессом. Некоторые антитела или химические вещества, например, флуорофор-конъюгированные препараты, такие как фаллоидин или паклитаксел, могут быть частично или полностью несовместимы с использованием в живых клетках или тканях, что ограничивает их применимость только к исследованиям фиксированных образцов.
В случае тубулина необходимо учитывать дополнительный аспект, которым является чувствительность полимера к фиксации. Традиционная химическая фиксация формальдегидом известна тем, что не является адекватной для оптимального сохранения целостности микротрубочек5. Кроме того, недавний отчет подтверждает, что сшивание формальдегида вызывает тонкие изменения в ультраструктуре микротрубочек, аналогичные тому, что происходит при связывании некоторых лекарств или физиологических молекул, таких как GTP6.
Поэтому прямая визуализация микротрубочек в незапятнанных, неповрежденных образцах часто желательна. Для достижения этого одним из технических решений является микроскопия второй гармонической генерации (SHG)7, которая основана на способности пучков параллельных микротрубочек действовать как гармониофоры и излучать удвоенный по частоте свет при правильном освещении интенсивным импульсным инфракрасным лазером. Хотя более сильный и стабильный второй гармонический сигнал может быть получен из коллагена и миозина, которые являются единственными двумя другими биологическими материалами, которые, как известно, способны к удвоению частоты, сигнал от тубулина до сих пор использовался в основном для изучения митотических перестроек веретена 8,9,10 и морфологии аксональных микротрубочек 11,12,13.
В этой работе мы представляем новое использование микроскопии SHG в качестве диагностического инструмента для различения тканей центральной нервной системы (ЦНС), пораженных тубулинопатией бета-4 А (TUBB4A), от их здоровых аналогов14. Некоторые из мутаций, происходящих в этой преимущественно нейронной изоформе тубулина, например, вызывающие гипомиелинизацию и атрофию базальных ганглиев и мозжечка (H-ABC), вызывают переполнение микротрубочек в олигодендроцитах15,16; цитоскелетные изменения, в свою очередь, связаны с последующими эффектами, такими как дисмиелинизация, с глубоким нарушением двигательных и сенсорных путей 16,17,18,19. Модель тайеповых мышей, используемая в этой работе, отображает аномальное содержание микротрубочек в олигодендроцитах и повторяет большинство сенсорно-моторных симптомов пациентов h-ABC17. Протокол объясняет, как визуализировать такие структуры, как мозолистое тело и мозжечок, которые обычно сильно миелинизированы и которые серьезно страдают у пациентов на людях, а также у крысы тайепа 19, чтобы подчеркнуть различия в сигналах SH между здоровыми и мутантными тканями.
протокол
Все описанные процедуры были выполнены в соответствии с законами и кодексами, утвержденными в седьмом названии Положения Общего закона о здравоохранении, касающегося исследований в области здравоохранения правительства Мексики (NOM-062-ZOO-1999), и в соответствии с рекомендациями Руководства национальных институтов здравоохранения по уходу за экспериментальными животными и их использованию, и были одобрены институциональным комитетом по биоэтике в исследованиях Университета Гуанахуато и Автономного университета Бенемериты. Пуэбла.
1. Настройки микроскопа
- Включите систему микроскопии.
- Включите импульсный лазер, чтобы гарантировать, что он будет готов к работе на оптимальном и устойчивом уровне мощности после извлечения и подготовки образца.
- Настройте лазер на 810 нм. Для исследования тиссулярных микротрубочек используется 10%-20% доступной мощности лазера, что в описываемой системе соответствует 13-26 мВт, измеренным на задней фокальной плоскости объектива.
- Убедитесь, что микроскоп выровнен по Келеру (дополнительный файл 1) с целью, которая будет использоваться для визуализации SHG.
ПРИМЕЧАНИЕ: Это важно, поскольку в коммерческой установке, используемой в этой работе, обнаружение выполняется в режиме передачи и через конденсатор. - Удалите нежелательные фильтры из оптического пути обнаружения (рисунок 1A).
- Убедитесь, что диафрагма конденсатора полностью открыта, чтобы гарантировать, что свет не останавливается без необходимости на этом уровне.
- Подготовьте масляный объектив с числовой диафрагмой (NA) с небольшой каплей погружного масла в объектив.
ПРИМЕЧАНИЕ: Эта цель была использована, чтобы наилучшим образом соответствовать конденсатору NA, который составлял 0,55 (в идеале, NAcond≥ NAobj).
2. Предварительный контроль микроскопа
ПРИМЕЧАНИЕ: Выполните предварительное управление микроскопом один раз, если настройка не изменена.
- Изображение сухого кукурузного крахмала, зажатого между стеклянными слайдами с параметрами SHG для получения изображений SHG, которые показывают направление лазерной поляризации. Выполните действия, описанные в дополнительном файле 2, за исключением мощности лазера, которая составляет менее 5% для кукурузного крахмала.
- Сделайте одно изображение разреженных зерен кукурузного крахмала и отметьте ориентацию долек SHG в плоскости x-y. Эта ориентация соответствует лазерной ориентации (рисунок 2А).
- В качестве элемента управления возьмите другое изображение того же образца, вставив в оптический путь полуволновую пластину (положение, показанное на рисунке 1А) для изменения направления колебаний лазера. Полученное изображение отображает повернутые дольки сигнала SHG (рисунок 2B, C).
- Если используется другой тип полосового фильтра для SHG, убедитесь, что он обладает оптимальными свойствами передачи, сравнивая изображения (рисунок 2D, E) и интенсивность сигнала пиксель за пикселем вдоль линейного сканирования (рисунок 2F).
3. Извлечение тканей
ПРИМЕЧАНИЕ: Всегда используйте чистые инструменты для выполнения хирургических процедур.
- Используйте 6-12-месячных крыс тайепа и соответствующие возрасту контрольные группы Sprague-Dawley (WT).
- Обезболивают животных в/инъекцией смеси кетамина-ксилазина (0,125 мг/кг и 5 мг/кг), разведенной в 0,9% стерильном растворе NaCl.
- Проверьте болевые рефлексы, и приступайте только в том случае, если они отсутствуют.
- Приносить животное в жертву путем обезглавливания.
- Как только голова изолирована, осторожно откройте кости свода черепа вдоль средней линии, начиная с самой хвостовой точки наверху к носу, от орбитальных полостей к средней линии, а затем от самой хвостовой точки до нижней части мозга и мозжечка.
ПРИМЕЧАНИЕ: Костяные резаки и Rongeurs позволяют правильно удалять кости головы, не повреждая структуры мозга. - Освободите мозг и мозжечок от кости. Два полушария могут быть разделены. Если полушария разделены, используйте одну половину для визуализации SHG, а другую половину зафиксируйте в 3,7% параформальдегиде в фосфат-буферном физиологическом растворе (PBS) в течение 20 минут внутри химической вытяжки для последующего сечения и окрашивания.
4. Вибратомное секционирование
- Подготовьте буферный лоток для вибратома, наполненный теплым (37 °C) сбалансированным солевым раствором Хэнка (HBSS).
- Закрепите мозг на пластине образца с помощью цианоакрилатного клея через кусок маскировочной ленты. Наибольшая каудальная часть/ область контактирует с клеем, так что пригодные для использования корональные участки из противоположной ростральной части могут быть разрезаны.
- Дайте ~10 с для полимеризации клея для получения эффективного прикрепления образца.
ПРИМЕЧАНИЕ: Наилучшие результаты получаются, когда мозг ориентирован так, что лезвие режет «сверху вниз», а не «из стороны в сторону» (рисунок 1B).
- Дайте ~10 с для полимеризации клея для получения эффективного прикрепления образца.
- Перенесите пластину образца на магнитную опору внутри буферного лотка.
- Начните резать 300-500 мкм срезов до тех пор, пока полученные срезы не охватят всю поверхность мозга.
- В этот момент уменьшите толщину сечения до 160 мкм.
- После того, как полный срез размером 160 мкм разрезан на уровне мозолистого тела, восстановите его с помощью модифицированной стеклянной пипетки Пастера с большим пламенным отверстием (рисунок 1C).
- Переложите его в чистую чашку Петри с новым теплым HBSS или непосредственно на стеклянную опору для микроскопии (крышку или стеклянную тарелку).
ПРИМЕЧАНИЕ: Для описанных экспериментальных условий добавление крышки над образцом наносит ущерб визуализации.
5. Перенос в микроскоп
- Если микроскоп находится в другом помещении, подготовьте изолированную коробку с подогретыми гелевыми компрессами для переноса участков ткани при сохранении температуры. Коробка также служит для поддержания разделов в тепле до тех пор, пока они не будут изображены.
- Поместите образец под микроскоп и убедитесь, что он правильно расположен под объективом, путем непосредственного наблюдения через глаз с пропускаемым светом.
ПРИМЕЧАНИЕ: Цель состоит в том, чтобы выровнять прогнозируемые излучающие структуры с направлением колебаний лазера для максимизации излучаемого (и, следовательно, обнаруженного) сигнала SHG. - Удалите избыток HBSS так, чтобы тонкая жидкая пленка покрывала весь образец. Визуально проверяйте жидкую пленку каждые несколько минут, чтобы избежать чрезмерного испарения и высыхания образца.
ПРИМЕЧАНИЕ: В описанных условиях секция используется не более 20 мин. Высыхание образца вызывает резкие артефактные эффекты (дополнительный рисунок 1А). Вместо того, чтобы добавлять больше HBSS, рекомендуется периодическое замачивание участка в теплой, свежей среде, если требуется более длительное время визуализации. Использование перфузионных камер и клея или низкоплавкой агарозы для иммобилизации ткани также рекомендуется при проведении более длительных экспериментов. - Подготовьте стадию микроскопа для неосканированной визуализации, которая может включать закрытие всех дверей темной инкубационной камеры или покрытие инкубационной камеры черной нейлоновой полиуретановой тканью.
6. Визуализация
- Выберите режим «неотсканированной» визуализации вдоль пути передачи. Таким образом, захват слабого сигнала SH тубулина будет оптимизирован.
- Выберите цель LCI Plan-Neofluar 25x/0.8 NA.
- Установите мощность лазера от 13 мВт до 26 мВт со временем выдержки пикселя 12,6 мкс. Делайте снимки размером не более 512 x 512 пикселей со скоростью 5 и средним значением 2 для среднего времени съемки около 15 с.
ПРИМЕЧАНИЕ: Использование более высокой мощности лазера и/или более длительного времени выдержки может повредить образец (дополнительный рисунок 1B). - Сначала сделайте снимки с помощью фильтра коротких частот 485 нм (SP485), а на втором этапе добавьте резкий полосовой фильтр 405 нм (BP405; Рисунок 3). Выполните действия, описанные в дополнительном файле 2.
ПРИМЕЧАНИЕ: Изображения псевдоярчего поля могут быть получены через тот же детектор с использованием остаточного лазерного света видимой линии (лучше всего работают лазеры 405 нм или 488 нм).
7. Обработка мозжечка
- Сначала разрезают мозжечок скальпелем на две полусферы, а затем приклеивают их к вибратомной опоре средней частью (плоской частью, полученной после разреза).
- Сечение и изображение мозжечка таким же образом, как было описано для мозга (160 мкм срезов, те же настройки вибратома, то же лезвие, те же настройки микроскопа и т.д.).
ПРИМЕЧАНИЕ: Из-за анатомии мозжечка его ориентация в момент сечения не является критической; в большинстве срезов, образующихся вдали от поверхности, фолиевы будут хорошо разделены на белое вещество.
Результаты
Изображения, полученные с помощью данной методики, имеют внутренний низкий фоновый уровень из-за очень ограниченного количества гармоникофоров, присутствующих в биологических тканях, что является одним из существенных преимуществ метода.
Когда волокна мозолистого тела визуализируются, волокнистые короткие структуры и округлые элементы могут быть последовательно найдены в мозге тайепа (рисунок 3B), в то время как мозолистое тело контрольного мозга показывает гораздо более гетерогенный и изотропный сигнал по всей области мозга (рисунок 3A). Происхождение дифференциального сигнала лежит именно во втором явлении генерации гармоник, поскольку добавление узкополосного фильтра только уменьшает неспецифическую интенсивность сигнала от контрольных изображений (рисунок 3C-D), при этом выборочно удаляя этот низкий, диффузный сигнал вокруг сомоподобных и коротких, вытянутых структур на изображениях тайепа, которые всегда генерируют интенсивный свет SH (рисунок 3E-F).
Другая проанализированная структура, мозжечковое белое вещество, дает сопоставимые результаты. В частности, в то время как в контрольной ткани наблюдается почти полное отсутствие сигнала SH (рисунок 4B), а клетки Пуркинье едва заметны при использовании фильтра коротких частот, удлиненные и округлые структуры сохраняются на изображении SH из тайепной ткани (рисунок 4D).
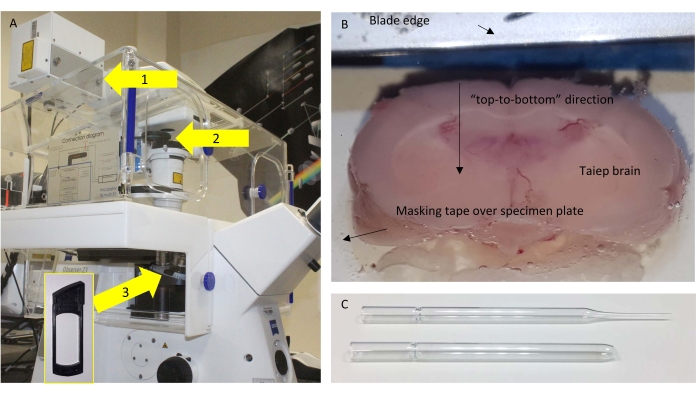
Рисунок 1: Микроскоп и секционирование. (A) Схема используемого микроскопа с выделенными соответствующими компонентами. Стрелки: 1 = порт NDD, где SP485 расположен близко к детектору; 2 = съемные рамы, в которых размещен BP405; 3 = положение под целью, где полуволновая пластина (HWP) размещается для контрольных экспериментов. Вставка показывает кадр, в который может быть вставлен HWP. (B) Вид сверху буферного лотка вибратома со склеенным мозгом, готовым к тонкому сечению. (C) Оригинальная (верхняя) и модифицированная (нижняя) пипетка Пастера, используемая для переноса секций. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Предварительный контроль. (A) Сигнал SHG, излучаемый зернами кукурузного крахмала, показывает преобладающую ориентацию, которая совпадает с направлением колебаний лазера (в данном случае горизонтально). (B) После вставки полуволновой пластины с быстрой осью, ориентированной на 45° по отношению к горизонтали, сигнал поворачивается на 90°. (C) Слияние сигнала до и после вставки полуволновой пластины. (D) Сигнал ниже 485 нм, излучаемый зернами кукурузного крахмала. (E) Сигнал SHG от крахмальных зерен, обнаруженный при 405/10 нм. F) График, показывающий сопоставление двух сигналов, соответствующих линейному сканированию, показанному в увеличенных вставках D и E. Используемый фильтр SHG приводит к незначительным потерям сигнала. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Изображения SHG из тайепа и мозолистого тела WT. Репрезентативные примеры сигналов (A) WT и (B) taiep , полученных от мозолистого тела. (C) SP485 отфильтрованное изображение мозолистого тела WT. (D) BP405 отфильтрованное изображение из того же образца, что и в C. (E) SP485 отфильтрованное изображение из мозолистого тела тайепа . (F) BP405 отфильтрованное изображение того же образца, что и в E. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Снимки SHG с мозжечков тайепа и WT. Репрезентативные примеры сигналов (A-B) WT и (C-D) taiep, полученных от мозжечковой фолии. (A) Отфильтрованное sp485 изображение из фолиевого листа WT; видны только некоторые клетки Пуркинье. (B) Отфильтрованное BP405 изображение из того же образца, что и в A. (C) Отфильтрованное sp485 изображение из фолиевого фолия. (D) Отфильтрованное BP405 изображение того же образца, что и в C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Примеры артефактов. (A) Артефакт, вызванный высыханием образца. (B) Артефакт из-за чрезмерного воздействия. Шкала: 30 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Выравнивание Кёлера. В файле представлены шаги для выполнения выравнивания Köhler. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Шаги программного обеспечения ZEN для получения изображений SHG. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Микроскопия SHG является частью группы нелинейных оптических методов, которые включают в себя двухфотонную микроскопию возбуждения, микроскопию генерации третьей гармоники и когерентную рамановскую рассеянную микроскопию против Стокса, которые способствовали расширению спектра применения обычной оптической микроскопии в науках о жизни20.
В частности, основные сильные и слабые стороны микроскопии SHG связаны с одним и тем же состоянием: генератор сигналов нецентросимметричен21. Такое специфическое архитектурное состояние часто встречается в царстве неорганических и органических кристаллов, но редко встречается среди биологических объектов. Вместе с коллагеном и мышечным миозином микротрубочки способны генерировать второй гармонический сигнал22, который может быть обнаружен с помощью микроскопа, если в пучках параллельных полимеров происходит достаточное суммирование. Внутри клеток тубулин связывается с образованием параллельных пучков в ядрах аксонов (специфическое расположение клеток), в митотических веретенах (височно-специфическое распределение) и, как представлено в этой работе, в фирменной ассоциации микротрубочек недавно описанной тубулинопатии-гипомиелинизации с атрофией базальных ганглиев и мозжечка, или H-ABC (которая представляет собой первое зарегистрированное патологическое распределение такого рода)14, 16,23.
Этот сенсомоторный синдром по-прежнему является орфанным заболеванием, так как многие неврологи еще не знакомы со всеми симптомами и / или не могут позволить себе генетический скрининг подозреваемых пациентов для подтверждения диагноза, что, скорее всего, вызывает недодиагностику, по крайней мере, в некоторых популяциях. Кроме того, мало что известно о патологии на молекулярном и клеточном уровне, поэтому методы, которые могли бы помочь пролить свет на конкретные механизмы этого дегенеративного процесса, очень ценны, в том числе и на базовом уровне.
Поэтому предлагаются два применения микроскопии SHG в отношении этого миелинного расстройства. В долгосрочной перспективе микроскопия SHG может быть интегрирована в диагностические подходы к скринингу биопсии или прямому внутричерепному анализу, но наибольшее влияние может быть связано с попыткой расшифровать молекулярную основу заболевания.
Существует много преимуществ микроскопии SHG по сравнению с другими методами микроскопии. Действительно, микроскопия SHG не требует фиксации ткани, что является особенно деликатным этапом подготовки образца в случае микротрубочек, и не требует окрашивания любого рода. Наибольшее преимущество связано с физическим явлением. С одной стороны, из-за практически отсутствующего фона он обеспечивает высокую контрастность, несмотря на слабые генерируемые сигналы, а с другой стороны, поскольку интенсивность света, необходимая для удвоения частоты, очень высока, и эти интенсивности встречаются только в очень ограниченном объеме образца, метод обеспечивает внутреннее оптическое сечение, что позволяет проводить 3D-реконструкции.
Основные ограничения этого метода микроскопии связаны со стоимостью оборудования. Хороший конфокальный микроскоп вместе с импульсным инфракрасным (ИК) лазером необходим для этого применения, и хотя во многих лабораториях нейробиологии доступна двухфотонная система возбуждения, которую можно легко модифицировать в установку SHG, разница в стоимости по сравнению с обычной установкой эпифлуоресценции по-прежнему значительна. Кроме того, как метод, ограниченный дифракцией, на его разрешение влияет использование ИК-света для освещения.
Как и во многих новаторских приложениях, установки, используемые для ранних экспериментов по микроскопии SHG, примененных к наукам о жизни, были полностью настроенными оптическими установками, построенными как открытые системы 11,24,25, что давало экспериментаторам возможность оптимизировать каждый отдельный компонент. Поскольку в лабораториях наук о жизни чаще всего доступ к коммерческой установке, мы хотели проверить, достаточно ли чувствительна одна из этих систем, чтобы обнаружить слабый сигнал, излучаемый пучками тиссулярных микротрубочек, которые, как известно, не являются такими сильными гармоникофорами, как коллаген. Система LSM710 NLO от Zeiss состоит из перевернутого конфокального микроскопа с модулями для неотсканированного обнаружения в режиме передачи и «эпи» и с когерентным перестраиваемым ИК-лазером Chameleon. В связи с когерентным характером явления SHG крайне важно выбрать путь пропускания, чтобы максимизировать сбор удвоенного по частоте света от образца, и, следовательно, обнаружение осуществлялось через конденсатор 0,55 NA путем интеграции. Для освещения образца со дна и приближения конденсатора NA использовался погружной объектив LCI Plan-Neofluar 25X/0.8 NA. С условиями, описанными в этой статье, мы могли надежно обнаружить сигнал от ткани, несущей мутацию TUBB4A, и этот сигнал всегда отсутствовал в контроле.
В отчетном протоколе два шага требовали корректировки для достижения наилучших условий визуализации: толщина участка ткани и открытие диафрагмы конденсатора. Срезы должны быть как можно более тонкими, чтобы предотвратить чрезмерное поглощение, рассеяние и потерю фотонов SH, тем более что цель состоит в том, чтобы получить изображение в передаче из-за когерентной природы физического явления. В нашем случае ограничивающим фактором была консистенция тайепной ткани, которая препятствовала сечению в однородно толстых срезах ниже 160-180 мкм. При обычном выравнивании Кёлера диафрагма конденсатора обычно закрыта примерно на 60% своей площади для создания контраста в продаваемом световом изображении; и наоборот, для этого применения цель состоит в том, чтобы собрать как можно больше фотонов, отсюда и полное открытие диафрагмы.
Это применение микроскопии SHG важно, поскольку оно обеспечивает возможность различать ткань, богатую тубулином, и ткань, богатую тубулином, причем богатая тубулином ткань излучает обнаруживаемый сигнал. Также возможно, что другие еще не описанные мутации тубулинопатии вызывают цитоскелетные расстройства в других тканях26, которые также могут включать обогащение тубулином.
С точки зрения других возможных применений, микроскопия SHG может быть расширена для изучения более слабых сигналов, таких как те, которые присутствуют в тубулин-нормальной ткани, в тонких, диссоциированных аксонах или во внутриклеточных пучках со смешанной полярностью. Для этого изменения настройки, такие как замена воздушного конденсатора конденсатором с более высокой числовой апертурой и/или с погружением или использование более чувствительного детектора, могут иметь важное значение.
Раскрытие информации
У авторов нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Национальным советом по вопросам науки и технологий (CONACYT) посредством следующих грантов: infraestructura 226450 для VP-CIO, infraestructura 255277 для V.P. и FORDECYT-PRONACES/194171/2020 для V.H. Мы признаем поддержку Хувенала Эрнандеса Гевары в CIO в создании видео.
Материалы
| Name | Company | Catalog Number | Comments |
| 405/10 nm BrightLine(R) single-band bandpass filter | Semrock | FF01-405/10-25 | 32 mm diameter, with housing ring |
| Black Nylon, Polyurethane-Coated Fabric | Thorlabs | BK5 | 5' x 9' (1.5 m x 2.7 m) x 0.005" (0.12 mm) Thick |
| Blades for vibratome | any commercial; e.g. Wilkinson Sword | Classic stainless steel double edge razor blades | |
| Cell culture dishes, 35 mm | any commercial; e.g. Falcon | 351008 | |
| Confocal microscope | Zeiss | LSM710NLO AxioObserver Z1 | Inverted microscope, objective used is LCI Plan-Neofluar 25x/0.8 NA |
| Cooler | any commercial | Any insulated, polystyrene box could work, to mantain the sample at about 37 °C | |
| Corn stach | e.g. Maizena | From the supermarket | |
| Coverslips #1.5 | any commercial | Rectangular | |
| Cyanoacrylate glue | e.g. Loctite | To glue the brain to the masking tape | |
| Fine forceps | fine science tools | 11412-11 | To manipulate tissue sections by handling from the meninges |
| Fine scissors | fine science tools | 14370-22 | To cut the skin |
| Fine scissors curved tip | fine science tools | 14061-09 | To cut along the midline |
| Formaldehyde 37% | Sigma-Aldrich | 252549 | To dilute 1:10 in PBS |
| Friedman Rongeur | fine science tools | 16000-14 | To cut the bone |
| Gel packs | any commercial | Prewarmed to 37 °C, to help mantaining the temperature inside the cooler | |
| Glass Pasteur pipette, modified | any commercial | To transfer the tissue section | |
| Hanks′ Balanced Salt solution (HBSS) | Gibco | 14025-076 | Could be prepared from powders |
| Kelly hemostats | fine science tools | 13018-14 | To separate the bone |
| Masking tape | any commercial | To protect th surface of the specimen plate | |
| NDD module, type C | Zeiss | 000000-1410-101 | To detect the signal, reducing light loss. Housing the 000000-1935-163 filter set with the SP485 |
| Offset bone nippers | fine science tools | 16101-10 | To cut the bone |
| Phosphate buffered saline (PBS) | Gibco | 10010-031 | Could be prepared from powders or tabs |
| Pulsed laser | Coherent | Chameleon Vision II | 680–1080 nm tunable laser |
| Scalpel | any commercial | Straight blade with sharp point | |
| Standard pattern forceps | fine science tools | 11000-18 | |
| Vannas spring scissors | fine science tools | 15018-10 | To cut meninges that remain joined to both the slice obtained from vibratome cutting and the section glued to the specimen plate. |
| Vibratome | any commercial; e.g. Leica | VT1200 |
Ссылки
- Palmiter, R. D., et al. Cell lineage ablation in transgenic mice by cell-specific expression of a toxin gene. Cell. 50 (3), 435-443 (1987).
- Banerjee, A., et al. A monoclonal antibody against the type II isotype of beta-tubulin. Preparation of isotypically altered tubulin. The Journal of Biological Chemistry. 263 (6), 3029-3034 (1988).
- Banerjee, A., Roach, M. C., Trcka, P., Luduena, R. F. Preparation of a monoclonal antibody specific for the class IV isotype of beta-tubulin. Purification and assembly of alpha beta II, alpha beta III, and alpha beta IV tubulin dimers from bovine brain. The Journal of Biological Chemistry. 267 (8), 5625-5630 (1992).
- Banerjee, A., et al. Localization of βv tubulin in the cochlea and cultured cells with a novel monoclonal antibody. Cell Motility and the Cytoskeleton. 65 (6), 505-514 (2008).
- Cross, A. R., Williams, R. C. Kinky microtubules: Bending and breaking induced by fixation in vitro with glutaraldehyde and formaldehyde. Cell Motility and the Cytoskeleton. 20 (4), 272-278 (1991).
- Van Steenbergen, V., et al. Molecular understanding of label-free second harmonic imaging of microtubules. Nature Communications. 10 (1), 3530(2019).
- Campagnola, P. J., Clark, H. A., Mohler, W. A., Lewis, A., Loew, L. M. Second-harmonic imaging microscopy of living cells. Journal of Biomedical Optics. 6 (3), 277(2001).
- Campagnola, P. J., et al. Three-dimensional high-resolution second-harmonic generation imaging of endogenous structural proteins in biological tissues. Biophysical Journal. 82 (1), 493-508 (2002).
- Yu, C. -H., et al. Measuring microtubule polarity in spindles with second-harmonic generation. Biophysical Journal. 106 (8), 1578-1587 (2014).
- Bancelin, S., et al. Probing microtubules polarity in mitotic spindles in situ using Interferometric Second Harmonic Generation Microscopy. Scientific Reports. 7, 6758(2017).
- Dombeck, D. A., et al. Uniform polarity microtubule assemblies imaged in native brain tissue by second-harmonic generation microscopy. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7081-7086 (2003).
- Psilodimitrakopoulos, S., et al. Estimation of the effective orientation of the SHG source in primary cortical neurons. Optics Express. 17 (16), 14418(2009).
- Sharoukhov, D., Bucinca-Cupallari, F., Lim, H. Microtubule imaging reveals cytoskeletal deficit predisposing the retinal ganglion cell axons to atrophy in DBA/2J. Investigative Opthalmology & Visual Science. 59 (13), 5292(2018).
- Alata, M., Piazza, V., Eguibar, J. R., Cortes, C., Hernandez, V. H. H-ABC tubulinopathy revealed by label-free second harmonic generation microscopy. Scientific Reports. 12, 14417(2022).
- Duncan, I. D., Lunn, K. F., Holmgren, B., Urba-Holmgren, R., Brignolo-Holmes, L. The taiep rat: A myelin mutant with an associated oligodendrocyte microtubular defect. Journal of Neurocytology. 21 (12), 870-884 (1992).
- Duncan, I. D., et al. A mutation in the Tubb4a gene leads to microtubule accumulation with hypomyelination and demyelination: Tubb4a Mutation. Annals of Neurology. 81 (5), 690-702 (2017).
- Garduno-Robles, A., et al. MRI features in a rat model of H-ABC tubulinopathy. Frontiers in Neuroscience. 14, 555(2020).
- Lopez-Juarez, A., et al. Auditory impairment in H-ABC tubulinopathy. Journal of Comparative Neurology. 529 (5), 957-968 (2021).
- Alata, M., et al. Longitudinal evaluation of cerebellar signs of H-ABC tubulinopathy in a patient and in the taiep model. Frontiers in Neurology. 12, 702039(2021).
- Parodi, V., et al. Nonlinear optical microscopy: From fundamentals to applications in live bioimaging. Frontiers in Bioengineering and Biotechnology. 8, 585363(2020).
- Lefort, C. A review of biomedical multiphoton microscopy and its laser sources. Journal of Physics D: Applied Physics. 50 (42), 423001(2017).
- Campagnola, P. J., Loew, L. M. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms. Nature Biotechnology. 21 (11), 1356-1360 (2003).
- vander Knaap, M. S., et al. New syndrome characterized by hypomyelination with atrophy of the basal ganglia and cerebellum. American Journal of Neuroradiology. 23 (9), 1466(2002).
- Stoller, P., Kim, B. -M., Rubenchik, A. M., Reiser, K. M., Da Silva, L. B. Polarization-dependent optical second-harmonic imaging of a rat-tail tendon. Journal of Biomedical Optics. 7 (2), 205(2002).
- Brown, E. B., et al. In vivo measurement of gene expression, angiogenesis and physiological function in tumors using multiphoton laser scanning microscopy. Nature Medicine. 7 (7), 864-868 (2001).
- Chakraborti, S., Natarajan, K., Curiel, J., Janke, C., Liu, J. The emerging role of the tubulin code: From the tubulin molecule to neuronal function and disease. Cytoskeleton. 73 (10), 521-550 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены