Method Article
İn vivo Kombine İki Foton Floresan ve Stimüle Raman Saçılma Mikroskobu ile Biyolojik Dokuların Görüntülenmesi
Bu Makalede
Özet
Uyarılmış Raman saçılması (SRS) mikroskopisi, biyomoleküllerin spesifik kimyasal bağların içsel titreşimine dayanarak etiketsiz görüntülenmesini sağlar. Bu protokolde, canlı farelerin omuriliğindeki hücresel yapıları görselleştirmek için entegre bir SRS ve iki fotonlu floresan mikroskobun enstrümantal kurulumu açıklanmaktadır.
Özet
Uyarılmış Raman saçılması (SRS) mikroskopisi, biyolojik dokuların doğal mikro ortamında içsel moleküler titreşime dayalı etiketsiz görüntülenmesini sağlar, böylece hücresel altı çözünürlükte biyolojik süreçlerin in vivo çalışması için mükemmel bir araç sağlar. İki foton uyarılmış floresan (TPEF) görüntülemeyi SRS mikroskobuna entegre ederek, dokuların çift modal in vivo görüntülemesi, hücresel metabolizma, bağışıklık tepkisi ve doku yeniden şekillenmesinde yer alan dinamik süreçleri anlamaya yardımcı olan çoklu perspektiflerden kritik biyokimyasal ve biyofiziksel bilgiler elde edebilir. Bu video protokolünde, bir TPEF-SRS mikroskop sisteminin kurulması ve hayvan omuriliğinin in vivo görüntüleme yöntemi tanıtılmaktadır. Omurilik, merkezi sinir sisteminin bir parçası olarak, beyin ve periferik sinir sistemi arasındaki iletişimde kritik bir rol oynar. Fosfolipitlerde bol miktarda bulunan miyelin kılıfı, aksiyon potansiyellerinin tuzlayıcı iletimine izin vermek için aksonu çevreler ve yalıtır. Omurilikteki miyelin kılıfların in vivo görüntülenmesi, nörodejeneratif hastalıkların ve omurilik hasarının ilerlemesini incelemek için önemlidir. Protokol ayrıca hayvan hazırlama ve yüksek çözünürlüklü biyolojik görüntüler elde etmek için in vivo TPEF-SRS görüntüleme yöntemlerini de tanımlamaktadır.
Giriş
Raman mikroskobu1,2, biyomoleküllerdeki çeşitli kimyasal bağların karakteristik frekanslarına dayanarak biyolojik dokuları görüntülemek için güçlü bir etiketsiz yöntem olarak ortaya çıkmaktadır. Non-invaziv ve iyi uyarlanabilir görüntüleme kabiliyeti sayesinde Raman mikroskopisi, miyelin kılıfı3,4,5, adipositler6,7 ve lipit damlacıkları gibi biyolojik dokulardaki lipitle zenginleştirilmiş bileşenleri görüntülemek için yaygın olarak kullanılmaktadır8,9,10 . Uyarılmış Raman kazancı (SRG) veya uyarılmış Raman kaybı (SRL) olarak elde edilen uyarılmış Raman saçılması (SRS) sinyali arka plansızdır ve spontan Raman saçılmasına mükemmel spektral benzerlik gösterir11,12. Ek olarak, SRL ve SRG, analit konsantrasyonuna doğrusal olarak bağımlıdır ve biyokimyasal bileşenlerin kantitatif analizine izin verir9,11,13. İki foton uyarılmış floresan mikroskobu (TPEF), doğal optik kesitleme yeteneği, derin penetrasyon derinliği ve düşük fototoksisitesi nedeniyle in vivo biyolojik görüntüleme için yaygın olarak kullanılmaktadır14,15,16. Bununla birlikte, TPEF görüntülemenin performansı floresan etiketlerin özelliklerine bağlıdır ve geniş bant floresan spektrumları nedeniyle çözülebilir renklerin sayısı sınırlıdır8,17,18,19. Etiketsiz SRS görüntüleme ve floresan bazlı TPEF görüntüleme iki tamamlayıcı görüntüleme yöntemidir ve bunların kombinasyonu dokuların bol miktarda biyofiziksel ve biyokimyasal bilgisini sağlayabilir. Bu iki görüntüleme yönteminin her ikisi de, tek bir mikroskop sistemine basit entegrasyona izin veren doğrusal olmayan optik (NLO) işlemlere dayanmaktadır. SRS ve TPEF görüntülemenin kombinasyonu, sözde çift modal görüntüleme, hücrelerin ve dokuların yüksek boyutlu görüntülenmesini ve profillenmesini sağlayarak karmaşık biyolojik sistemlerin kapsamlı bir şekilde anlaşılmasını kolaylaştırır. Spesifik olarak, pikosaniye (ps) SRS mikroskopisi, femtosaniye (fs) SRS tekniğine11 kıyasla yüksek spektral çözünürlükte kimyasal bağ görüntülemesi elde edebilir ve biyolojik dokuda, özellikle kalabalık parmak izi bölgesinde20,21 çoklu biyokimyasal bileşenleri ayırt etmeyi sağlar. Ek olarak, tutarlı anti-Stokes saçılma (CARS) mikroskobunun entegrasyonu ile yaygın olarak kullanılan bir başka çift modlu NLO mikroskop sistemi ile karşılaştırıldığında, SRS, spektral ve görüntü yorumlamanın yanı sıra algılama hassasiyeti açısından CARS'a üstün performans göstermektedir11. SRS-TPEF mikroskobu, Caenorhabditis elegans9,22, Xenopus laevis kurbağa yavrusu beyni5, fare beyni23,24, omurilik25,26, periferik sinir27 ve yağ dokusu7 gibi çeşitli biyolojik sistemleri incelemek için güçlü bir araç olarak kullanılmıştır.
Omurilik, beyin ile birlikte merkezi sinir sistemini (CNS) oluşturur. Fizyolojik ve patolojik koşullar altında CNS'deki hücresel aktiviteleri in vivo olarak görselleştirmek, CNS bozukluklarının mekanizmalarını anlamak için kritik öneme sahiptir28,29,30 ve buna karşılık gelen tedavilerin geliştirilmesi31,32,33. Yüksek hızlı aksiyon potansiyeli iletimi için aksonları saran ve yalıtan miyelin kılıf, CNS'nin gelişiminde önemli bir rol oynar. Demiyelinasyon, multipl skleroz gibi beyaz cevher bozukluklarında bir ayırt edici özellik olarak düşünülmektedir34. Ek olarak, omurilik yaralanmasından35 sonra, miyelin kalıntıları makrofaj aktivasyonunu modüle ederek kronik inflamasyona ve ikincil yaralanmaya katkıda bulunabilir36. Bu nedenle, canlı fare modellerinde nöronlar ve glial hücrelerle birlikte miyelin kılıfın in vivo görüntülenmesi, CNS bozukluklarındaki dinamik süreçleri anlamada büyük yardımcı olmaktadır.
Bu protokolde, ev yapımı bir TPEF-SRS mikroskobunun temel kurulum prosedürleri tanımlanmış ve fare omuriliği için çift modlu in vivo görüntüleme yöntemleri tanıtılmıştır.
Protokol
Bu çalışmada gerçekleştirilen tüm hayvan prosedürleri, Hong Kong Bilim ve Teknoloji Üniversitesi (HKUST) Laboratuvar Hayvanları Tesisi'nin yönergelerine göre yürütülmekte ve HKUST Hayvan Etiği Komitesi tarafından onaylanmıştır. TPEF-SRS mikroskobunun kurulması ve çalıştırılması için lazer kullanımı için güvenlik eğitimi gereklidir. Lazerle çalışırken daima uygun dalga boyu aralığına sahip lazer güvenlik gözlükleri kullanın.
1. TPEF-SRS mikroskobunun kurulumu (kurulum şeması için bkz. Şekil 1)
- SRS görüntüleme için ps lazer kaynağı olarak mod kilitli bir Iterbiyum fiber lazerle bağlı entegre bir optik parametrik osilatör (OPO) kullanın.
NOT: OPO, 2 ps darbe süresi ve 80 MHz tekrarlama hızı ile bir Stokes ışını (1031 nm) ve bir pompa ışını (780 nm ila 960 nm arasında ayarlanabilir) verir. Stokes ışını, MHz seviyesinde yüksek frekanslı faza duyarlı SRS tespiti için dahili bir elektro-optik modülatör (EOM) ile 20 MHz'de modüle edilir. - Bir fs titanyum (Ti) kullanın: TPEF görüntüleme için lazer kaynağı olarak safir lazer.
- Fs ışınının boyutunu 3 mm'ye çıkarmak ve ayarlamak için bir çift lens (L1 ve L2) kullanın.
- ps lazer ışınını harmanlamak ve çapını 3 mm'ye genişletmek için bir çift lens (L3 ve L4) kullanın.
- Yarım dalga plakası kullanarak fs lazer ışınının polarizasyonunu p polarizasyonundan s polarizasyonuna değiştirin.
- İki lazer ışınını polarize edici ışın ayırıcı (PBS) ile birleştirin.
- Işın taraması için PBS'nin arkasına bir çift 3 mm XY taramalı galvanometre aynası ekleyin.
- Tarama aynasını ve 25x objektif lensin arka göz bebeğini birleştirmek için telesentrik tarama lensi (L5) ve sonsuzluk düzeltmeli tüp lens (L6) kullanın. Objektifin arka diyaframını doldurmak için lazer ışınını tarama lensi ve tüp lens ile genişletin.
- SRS veya floresan sinyali toplama için tüp lens ile objektif lens arasına PBS veya dikroik ayna (D2) yerleştirin. PBS ve D2 arasında geçiş yapmak için motorlu bir palet kullanın.
NOT: Rastgele kaydırılan polarizasyonun bir sonucu olarak PBS'den geçerken geriye dağılmış SRS sinyalinin bir kısmı kaybolur. - Algılama ışınını daraltmak ve 25x objektif lensin arka gözbebeğini bir fotodiyot sensörüyle birleştirmek için bir çift lens (L7 ve L9) kullanın.
- Algılama ışınını daraltmak ve 25x hedefin arka gözbebeğini fotoçarpanın (PMT) algılama yüzeyiyle birleştirmek için bir çift lens (L8 ve L10) kullanın.
- Floresan ve SRS sinyallerinin algılama yolunu ayırmak için dikroik ayna (D3) kullanın.
- Stokes lazerini engellemek ve yalnızca pompa ışınını geçirmek için fotodiyot dedektörünün önüne bir filtre seti (Fs1) yerleştirin.
- Yalnızca hedef floresan sinyalini iletmek için PMT dedektörünün önüne bir filtre seti (Fs2) yerleştirin.
- Sinyal amplifikasyonu için PMT'yi bir akım amplifikatörüne bağlayın.
- Fotodiyotu kilitli bir amplifikatöre bağlayın.
- SRS sinyal demodülasyonu için dahili EOM çıkışından gelen senkronizasyon sinyalini kilitli amplifikatörün referans girişine bağlayın.
- PMT amplifikatörünü ve kilitli amplifikatör çıkışlarını veri toplama modülüne bağlayın.
2. TPEF-SRS mikroskop sistemi kalibrasyonu
- Lazerlerin başlatılması
- Ti: safir lazeri açmak için tuş düğmesini Bekleme modundan Açık konumuna getirin ve lazerin ısınması için 30 dakika bekleyin.
- OPO kontrol panelindeki Başlat düğmesine tıklayarak OPO'yu açın ve lazerin ısınması için 20 dakika bekleyin.
- ps lazer ısındıktan sonra, Stokes ışınının modülasyon derinliğini kontrol etmek için yüksek hızlı bir fotodetektör kullanın. Stokes ışını için lazer deklanşörü açın. OPO Gücünü Ayarla kutusuna tıklayın ve 20 girin. Işını algılamak için yüksek hızlı fotodetektörü, OPO çıkışına yerleştirin. Lazer darbesini izlemek için Bayonet Neill-Concelman (BNC) konektörlü koaksiyel bir kablo kullanarak fotodetektörün çıkış portunu bir osiloskopun giriş portuna bağlayın.
- OPO kontrol yazılımında EOM Control penceresini açın. 20 MHz'de maksimum modülasyon derinliği elde etmek için EOM gücünü ve fazını osiloskopta gösterilen darbe yoğunluğu diyagramına göre ayarlayın.
NOT: EOM performansı genellikle kararlıdır ve yalnızca SRS sinyali önemli ölçüde azaldığında kontrol edilmesi gerekir.
- Kombine TPEF-SRS mikroskobunun optik hizalaması
- ps ve fs ışınlarının birlikte lokalizasyonu için 2.2.2 ila 2.2.13 arasındaki adımlarda açıklandığı gibi optik hizalama gerçekleştirin.
- OPO kontrol yazılımında Stokes çıkışını durdururken pompa lazer deklanşörünü açın. OPO kontrol yazılımını kullanarak pompa ışınının dalga boyunu 796 nm olarak ayarlamak için Sinyali Ayarla kutusuna tıklayıp 796 dalga boyu değerini girin. OPO Gücünü Ayarla kutusuna tıklayın ve optik hizalama için gücünü minimum (~ 20 mW) olarak ayarlamak üzere 20 girin.
- Mikroskop bilgisayarını ve tarayıcılar, objektif aktüatörler, fotodiyotlar, PMT'ler, akım amplifikatörleri, kilitli amplifikatörler ve motorlu yüzgeçler dahil olmak üzere ilgili tüm elektronik bileşenleri açın. Mikroskop kontrol yazılımını başlatın.
NOT: Mikroskop kontrol yazılımı ev yapımı bir arayüzdür. - Optik yola iki hizalama plakası ( Şekil 1'de P1 ve P2) yerleştirin. P1'i PBS'nin arkasına yaklaşık 10 cm'lik bir mesafeye yerleştirin ve P2'yi P1'in arkasına yaklaşık 30 cm'lik bir mesafeye yerleştirin.
NOT: ps ve fs ışınları PBS kullanılarak birleştirilir (Şekil 1). İki hizalama plakası, hizalamayı ve iki lazer ışınının kolokalizasyonunu kontrol etmek için kullanılır. - ps lazer ışını için mikroskop deklanşörünü açın.
- P1'in geçiş deliğindeki ps lazer ışını merkezini bulmak için M1 aynasını ayarlayın. M1 aynasını ayarlarken P1'deki ışın noktasının konumunu gözlemlemek için kızılötesi (IR) bir kapsam kullanın.
- P2'nin geçiş deliğindeki ps lazer ışını merkezini bulmak için ayna M2'yi ayarlayın. M2 aynasını ayarlarken P2'deki ışın noktasının konumunu gözlemlemek için IR kapsamını kullanın.
- ps ışın merkezi her iki hizalama plakasının geçiş deliğinde bulunana kadar 2.2.6 ve 2.2.7 adımlarını yineleyin. Mikroskop kontrol yazılımındaki ps ışınının deklanşörünü kapatın.
- fs Ti: safir lazerin dalga boyunu 740 nm'ye ayarlayın ve lazer deklanşörünü açın. Optik hizalama için lazer gücünü 5 mW'a (mikroskop sisteminin giriş portunda ölçülür) ayarlayın.
- Fs lazer ışını için mikroskop deklanşörünü açın.
- P1'in geçiş deliğindeki fs lazer ışını nokta merkezini bulmak için ayna M3'ü ayarlayın.
- P4'ün içinden geçen delikteki lazer ışını nokta merkezini bulmak için M2 aynasını ayarlayın.
- 2.2.11 ve 2.2.12 numaralı adımları, fs lazer ışını merkezi iki hizalama plakasının geçiş deliklerinde bulunana kadar tekrarlayın. Fs ışını için mikroskop deklanşörünü kapatın.
- Pompanın ve Stokes kirişlerinin uzamsal üst üste binmesini 2.2.15 ila 2.2.18 arasındaki adımlarda açıklandığı gibi gerçekleştirin.
NOT: Pompa ve Stokes ışınları ps lazerin içinde kabaca üst üste binmiş olsa da, optimum SRS performansı elde etmek için iki lazer ışınının konumlarının ince ayarlanması gerekir. Pompa kirişi ilk önce daha önce açıklandığı gibi hizalandığından, daha sonra Stokes kirişi pompa kirişi ile birlikte lokalize olacak şekilde ayarlanır. - İki ışın noktasının konumunu görselleştirmek için kameranın bulunduğu yere yerleştirin. Pompa ışınının kamera ekranındaki konumunu referans olarak işaretleyin.
- L3'ten önce bir P0 hizalama plakası yerleştirin (Şekil 1). Optik ayna 1'i (OM1) ayarlamak için bir altıgen anahtar kullanın, böylece Stokes ışın merkezi hizalama plakasının içinden geçer ve lazer çıkış portundaki pompa ışını ile birlikte lokalize olur. Ayarlama sırasında P0'daki ışın noktasının konumunu onaylamak için IR kapsamını kullanın.
NOT: OM1 ve OM2, 1031 nm Stokes ışınının konumunu ayarlamak için OPO kafasındaki iki aynadır. - P0 hizalama plakasını çıkarın ve OM2'yi ayarlamak için altıgen tuşunu kullanın, böylece Stokes kirişinin merkezi, kamera üzerindeki pompa kirişinin referans işareti ile birlikte lokalize olur.
- Stokes ışını hem P0 hem de kamera düzlemlerindeki pompa ışını ile kesinlikle örtüşene kadar 2.2.16 ve 2.2.17 adımlarını tekrarlayın.
NOT: Fotoğraf makinesindeki ışın noktalarını görselleştirirken, tüm hizalama plakaları optik yoldan çıkarılmalıdır.
- Görüntüleme koşullarını optimize edin
- Kilitli amplifikatörün faz ayarını adım 2.3.2'de açıklandığı gibi gerçekleştirin. 2.3.7'ye kadar.
NOT: SRS algılaması, yüksek frekanslı faza duyarlı bir şemaya dayanır. SRL tespiti için, Stokes ışınının yoğunluğu 20 MHz'de modüle edilir ve sinyali demodüle etmek için bir kilitleme amplifikatörü kullanılır. Kilitlenebilir amplifikatörün fazı ve ofseti, optimum görüntü kontrastı elde etmek için ayarlanmalıdır. - Kilitli amplifikatör kontrol yazılımını açın.
- Pompa lazerinin dalga boyunu 796 nm'ye ve pompanın ve Stokes ışınının gücünü numune üzerinde sırasıyla 15 mW ve 25 mW olacak şekilde ayarlayın.
NOT: Burada SRS görüntüleme optimizasyonu ve kalibrasyonu için zeytinyağı kullanın. Karbon-hidrojen bölgesindeki zeytinyağının Raman zirvesi, 2863.5 nm'deki pompa ışını dalga boyuna karşılık gelen 796 cm-1'dir. - Zeytinyağını bir slaytta kapatın ve epi-SRS tespiti için sinyal geri saçılımını arttırmak için slaytın altına katlanmış bir kağıt mendil takın. Zeytinyağı örneğini sahneye yerleştirin ve 25x hedefinin odağını numuneye ayarlayın.
- Görüntüleme parametrelerini aşağıdaki gibi ayarlamak için mikroskop kontrol yazılımını kullanın: 500 μm x 500 μm görüş alanı (FOV) için 512 x 512 piksel, 6,4 μs piksel bekleme süresi. Zaman sabiti değerini, piksel bekleme süresine yakın olan 10 μs olarak ayarlamak için kilitli amplifikatör kontrol yazılımını kullanın.
- Lazer ışınını numunenin üzerinde tarayın. SRS sinyal yoğunluğu maksimuma ulaşana kadar fazı (0-180°) 22,5° adım boyutuyla ayarlamak için kilitli amplifikatör kontrol yazılımını kullanın.
NOT: Bu tamamen analog kilitlemeli amplifikatörde, sinyal çıkışı, referans sinyalin fazına bağlı olan faz içi bileşendir. Faz 11° çözünürlüğe sahip kilitli amplifikatör kontrol yazılımı tarafından ayarlanabilir ve algılanan sinyalin ~%212 içinde en üst düzeye çıkarılmasına olanak tanır. Kilitleme amplifikatörü, senkronizasyon sinyali bozulduğunda fazdan çıkar. Senkronizasyon sinyali her yeniden kurulduğunda fazın yeniden ayarlanması gerekir. - Lazer deklanşör kapalıyken numuneyi tarayın. Ortalama SRS sinyali sıfıra yakın olana kadar ofset değerini 1 mV'luk bir adım boyutuyla ayarlamak için kilitli amplifikatör kontrol yazılımını kullanın.
NOT: Ortalama SRS sinyali, mikroskop kontrol yazılımı tarafından otomatik olarak hesaplanan SRS görüntüsündeki tüm piksellerin ortalama yoğunluğu olarak tahmin edilir. Ofsetler, istenmeyen faz tutarlı sinyalleri iptal etmek için kullanışlıdır. - 2.3.9 - 2.3.14 arasındaki adımlarda açıklandığı gibi zamansal eşitleme en iyi duruma getirme gerçekleştirin.
- OPO kontrol yazılımında Gecikme Yöneticisi iletişim kutusunu açın (Şekil 2).
- Zeytinyağını tarayın ve zeytinyağı SRS sinyali maksimuma ulaşana kadar gecikme aşamasını ayarlayın.
NOT: SRS görüntülemenin ilk kez, kilitli amplifikatörün fazı optimize edilmediğinde, zamansal senkronizasyon, kilitleme amplifikatörünün fazını optimize etmeden önce numunenin SRS sinyalini görselleştirmek için kabaca ayarlanır. - Taramayı durdurun ve geçerli gecikme verilerini kaydetmek için gecikme yöneticisi iletişim kutusundaki Veri Ekle düğmesine tıklayın.
- 2.3 numaralı adımları yineleyin. Farklı dalga boylarında farklı kimyasal numuneler için 10 ve 2.3.11.
NOT: Polistiren boncuklar, ağır su, 5-Etinil-2′-deoksiüridin, gliserol farklı titreşim bantlarındaki gecikme verilerini ölçmek için kullanılır. - Geçerli veri noktalarını beşinci dereceden polinom işleviyle sığdırmak için gecikme yöneticisi iletişim kutusunda Veri Sığdırma ve Sipariş 5'i seçin. Özel Olarak Kullan düğmesini tıklatıp onay kutusunu işaretleyerek takılan verileri uygulayın. Gecikme aşaması, takılan gecikme eğrisine göre farklı dalga boylarında otomatik olarak ayarlanacaktır.
- Tüm gecikme verilerini, ileride kullanılmak üzere yüklenebilecek bir metin dosyasına kaydedin.
- Kilitli amplifikatörün faz ayarını adım 2.3.2'de açıklandığı gibi gerçekleştirin. 2.3.7'ye kadar.
3. İn vivo floresan ve SRS görüntüleme için farenin cerrahi olarak hazırlanması
- Neşter, yaylı makas, forseps, örtü kayışı ve gazlı bez pedleri dahil olmak üzere gerekli tüm aletleri sterilize edin.
- Ameliyat sırasında dokunulacak tüm yüzeyleri% 70 etanol ile dezenfekte edin. Tezgahın çalışma alanını steril örtülerle örtün. Örtünün altına bir ısıtma yastığı koyun.
- İn vivo omurilik görüntülemesi için dorsal kök ganglion afferent nöronlarında gelişmiş sarı floresan proteini (EYFP) eksprese eden Thy1-YFP-H (Tg(Thy1-YFP)HJrs/J)37 transgenik fareleri kullanın. Fareyi tartın ve ketamin-ksilazin karışımının (87.5 mg kg-1 ve 12.5 mg kg-1) intraperitoneal (i.p.) enjeksiyonu ile anestezi indükleyin.
- Derin anestezi sağlamak için farenin ayak parmağını sıkıştırın. Gerekirse anesteziklerin orijinal dozunun yarısı ile takviye edin. Kornea kuruluğunu önlemek için fare gözlerine merhem uygulayın.
- Torasik omurganın üstündeki sırttaki saçları tıraş edin ve ardından tüy dökücü krem kullanarak saçları tamamen çıkarın. Tıraş edilen bölgeyi iyot çözeltisi ile dezenfekte edin.
- Bir neşter ile T11-T13 omurunun üzerinde cildin küçük bir orta hat kesisini (~ 1.5 cm) yapın.
- T11-T13 omurunun hem üstündeki hem de yanlarındaki kasları ve tendonları yay makası ve forseps ile kesin. Üç bitişik omurları açığa çıkarın. Kanamayı kontrol etmek ve cerrahi bölgeyi temizlemek için steril gazlı bez pedleri ve steril salin kullanın.
- Özel olarak tasarlanmış bir stabilizasyon aşamasında iki paslanmaz çelik kenar çubuğunun yardımıyla omurgayı stabilize edin (Şekil 2B).
- T12'de laminektomi yapmak için #2 forseps kullanın. T12 omurunun tüm laminası çıkarılana kadar laminayı parça parça kırmak için forsesi dikkatlice kullanın.
- Omuriliğin üzerindeki kanı steril salinle yıkayın ve aşırı sıvıyı emmek için gazlı bez pedi kullanın. Kanamayı kontrol etmek için kanama bölgesine bir parça gazlı bezle baskı uygulayın.
- Sıkıştırma çubuğuna bir örtü kayması (22 x 22 mm) yerleştirin ve kapak kayması ile omurilik arasındaki boşluğu salinle doldurun.
4. Fare omuriliğinin in vivo TPEF-SRS görüntülemesi
- Stabilizasyon aşamasını TPEF-SRS mikroskobunun altındaki beş eksenli bir aşamaya monte edin.
NOT: Beş eksenli aşama, üç eksenli çeviriye ve ±5° eğim ve rulo eğme hareketine izin verir. - Fare kafasını iki kafa çubuğuyla sabitleyin ve nefes alma sırasında göğüs hareketi için yeterli alan sağlamak üzere tutma plakasını alçaltarak hareket artefaktlarını hafifletin.
- Görüntüleme sırasında fareyi sıcak tutmak için farenin altına bir ısıtma yastığı yerleştirin.
- Omurilik vaskülatürünün parlak alan görüntüsü 10x hedefi altında gözlemlenene kadar odağı ayarlamak için z çeviri aşamasını ayarlayın.
- Beş eksenli aşamanın iki eksenli translasyonel aşamasını ayarlayarak omurilik dorsal venini FOV'un merkezine yerleştirin.
- Omurilik dorsal yüzeyini parlak alan görüntüsüne göre objektif eksene dik olarak ayarlamak için beş eksenli aşamanın yuvarlanma ve perde açılarını ayarlayın.
- TPEF-SRS görüntüleme için 10x'i 25x suya daldırma hedefiyle değiştirin.
- fs ışınının dalga boyunu 920 nm olarak ayarlayın. Numune üzerinde fs ışın gücünü 10 mW olacak şekilde ayarlayın.
- Pompa ışınının dalga boyunu 796 nm olarak ayarlayın. Pompanın ve Stokes ışınının gücünü, numune üzerinde sırasıyla 60 mW ve 75 mW olacak şekilde ayarlayın.
NOT: Omurilik SRS görüntülemesi, ölçülen SRS spektrumuna göre karbon-hidrojen bölgesindeki miyelin kılıflarının Raman zirvesine karşılık gelen 2863,5 cm-1 dalga numarasında gerçekleştirilir7,9. Lazer gücü, omuriliğin yüksek çözünürlüklü TPEF-SRS görüntülemesini sağlamak için belirlenmiştir. Mevcut görüntüleme koşullarında doku hasarı gözlenmez. - SRS görüntüleme için, motorlu palete bağlı Switch düğmesine basarak motorlu bir palet kullanarak hedefin üzerinde PBS'yi seçin.
- Görüntüleme parametrelerini aşağıdaki gibi ayarlayın: 150 μm x 150 μm FOV için 512 x 512 piksel, 3,2 μs piksel bekleme süresi, 2 μs zaman sabiti.
- Numuneyi taramaya başlayın ve odağı omuriliğin dorsal yüzeyine ayarlayın.
- Maksimum omurilik SRS sinyali elde edilene kadar OPO kontrol yazılımı ile gecikme aşamasını hassas bir şekilde ayarlayın.
NOT: Biyolojik numuneler ekstra kromatik dispersiyona neden olabilir, zamansal senkronizasyonu optimize etmek için gecikme aşamasının ayarlanması gerekebilir. Bununla birlikte, SRS görüntüleme doku üst yüzeyinin yakınında yapıldığında, biyolojik doku ve görüntüleme penceresi tarafından tanıtılan iki lazer darbesinin zamansal farkı genellikle küçüktür (birkaç yüz fs'den az). - TPEF görüntüleme için, motorlu palete bağlı Switch düğmesine basarak motorlu bir palet kullanarak hedefin üzerindeki dikroik ayna D2'yi seçin.
- Görüntüleme parametrelerini ayarlayın ve örneği taramaya başlayın. TPEF-SRS görüntü yığınını yakalamak için, bir sonraki derinliğe geçmeden önce TPEF ve SRS görüntülerini aynı derinlikte 1 s aralıklarla sırayla alın. TPEF görüntüleme için görüntüleme parametreleri 512 x 512 piksel, 150 μm x 150 μm FOV, 3,2 μs piksel bekleme süresidir.
- Tüm görüntüler toplandıktan sonra hayvanı stabilizasyon aşamasından çıkarın.
- Maruz kalan dokuyu salini yıkayarak temizleyin ve fazla sıvıyı bir gazlı bez kullanarak emer. Maruz kalan omuriliğe silikon jel uygulayın ve iyileşene kadar ~ 5 dakika bekleyin.
- Yarayı kapatmak için cildi #6-0 cerrahi dikişle dikin. Enfeksiyonu önlemek için cerrahi bölgenin cildine yanık kremi uygulayın. Analjezik tedaviyi deri altından uygulayın (0.1 mg / kg buprenorfin).
- Hayvanı temiz bir kafese yerleştirin ve fare anesteziden tamamen iyileşene kadar kafesi bir ısıtma yastığına yerleştirin.
- Ameliyattan sonraki 3 gün boyunca her 12 saatte bir analjezik uygulamayı tekrarlayın.
- OPO ve fs lazerin deklanşörünü kapatın. Pompanın ve Stokes ışınının gücünü maksimuma ayarlayın.
NOT: Lazeri kapatmadan önce maksimum gücü ayarlamak, lazer bakımı için faydalıdır. - Pompa ışınının ve fs lazerin dalga boyunu 800 nm'ye ayarlayın.
- İki lazeri bekleme moduna getirin, tüm elektronik kontrol yazılımını kapatın ve ilgili tüm ekipmanı kapatın.
Sonuçlar
Spinal aksonların ve miyelin kılıflarının in vivo dual-modal görüntülemesi, dorsal kök gangliyon afferent nöronlarında EYFP'yi eksprese eden Thy1-YFPH transgenik fareler kullanılarak gerçekleştirilir (Şekil 3). Bu etiketli afferent nöronlar, duyusal bilgiyi periferik sinirden omuriliğe iletir, merkezi dal omurilik dorsal kolonunda bulunur. TPEF-SRS mikroskobu ile, yoğun olarak dağılmış miyelin kılıfı, etiketsiz SRS görüntüleme kullanılarak net bir şekilde görselleştirilebilir ve TPEF görüntüleme kullanılarak seyrek etiketli YFP aksonları gözlemlenebilir. Çift modelli görüntüleme ile aksonların kalın bir miyelin kılıf tabakası ile yakından sarıldığı ortaya konmuştur (Şekil 3C). Aksollemmanın miyelin kılıfının çıplak olduğu Ranvier (NR) düğümleri, aksiyon potansiyellerinin hızlı tuzlayıcı yayılımında önemli bir rol oynar. TPEF-SRS omurilik görüntüsünde (Şekil 3C) görülebileceği gibi, NR azalmış aksonal çapı ve doğrudan hücre dışı matrikse maruz kalan aksolemmayı göstermektedir. NR'nin varlığını ve yerini doğrulamak için aksonları çevreleyen miyelin kılıflarla birlikte görüntülemek önemlidir. Bu nedenle, TPEF-SRS mikroskopisi, hücresel dinamiklerin mekanizmalarını anlamak için önemli olan omurilik bozukluklarının gelişiminde aksonların ve miyelin kılıflarının dinamik değişikliklerini gözlemlememizi sağlar.

Resim 1: TPEF-SRS mikroskop sisteminin şematik diyagramı. Pompa ve Stokes ışınları, pikosaniye (ps) lazerde dikroik ayna (D1) ile birleştirilir. ps ışını ve femtosaniye (fs) ışını, 3 mm XY-tarama galvanometre aynalarına uyacak şekilde bir çift lens (sırasıyla L3, L4 ve L1, L2) tarafından harmanlanır ve genişletilir / daraltılır. Fs ışını bir yarım dalga plakası (HWP) ile yataydan dikey polarizasyona döndürülür ve daha sonra polarize edici bir ışın ayırıcı (PBS) tarafından ps ışını ile birleştirilir. Tarama aynaları ve objektif lensin arka göz bebeği, telesentrik tarama lensi L5 ve sonsuzluk düzeltmeli tüp lens L6 ile konjuge edilir. Lazer ışını, 25x hedefin arka diyaframını doldurmak için tarama ve tüp lens tarafından genişletilir. Uyarılmış Raman saçılması (SRS) görüntüleme için, hedef tarafından toplanan geri saçılan pompa ışını bir PBS tarafından yansıtılır ve geniş bir alana (10 mm x 10 mm) silikon fotodiyota (PD) yönlendirilir. İki fotonlu görüntüleme için, iki foton uyarılmış floresan (TPEF) sinyali, dikroik ışın ayırıcı D2 tarafından fotoalgılama ünitesine yansıtılır. TPEF sinyalini algılamak için bir akım fotoçarpanı (PMT) modülü kullanılır. Kısaltmalar-L1-L10: lensler; OL: objektif lens; D1-D3: dikroik aynalar; Fs1, Fs2: filtre kümeleri; M: aynalar; OM1, OM2: optik aynalar; P0-P2: hizalama plakaları. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
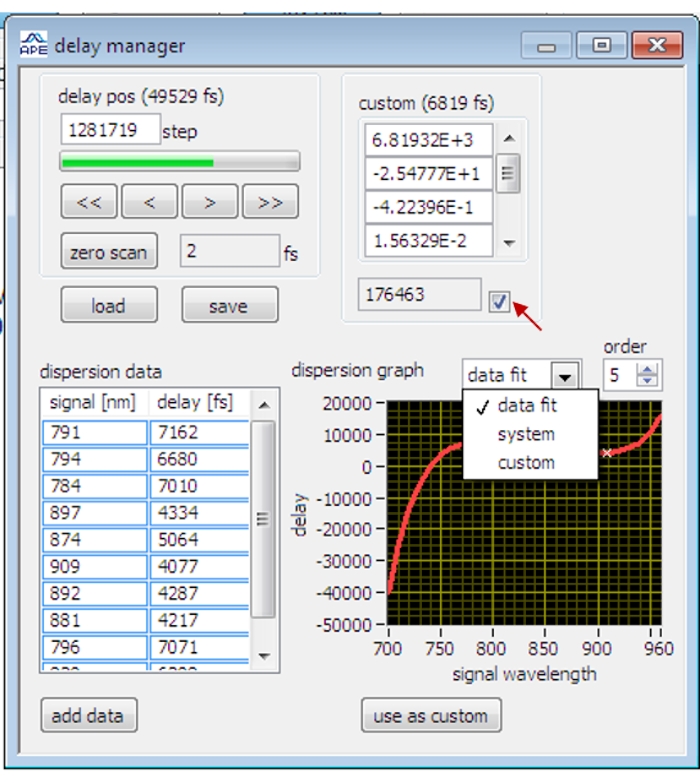
Şekil 2: OPO kontrol yazılımındaki gecikme yöneticisinin arayüzü. Kırmızı ok, kalibre edilmiş gecikme verilerinin uygulanması için onay kutusunu gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
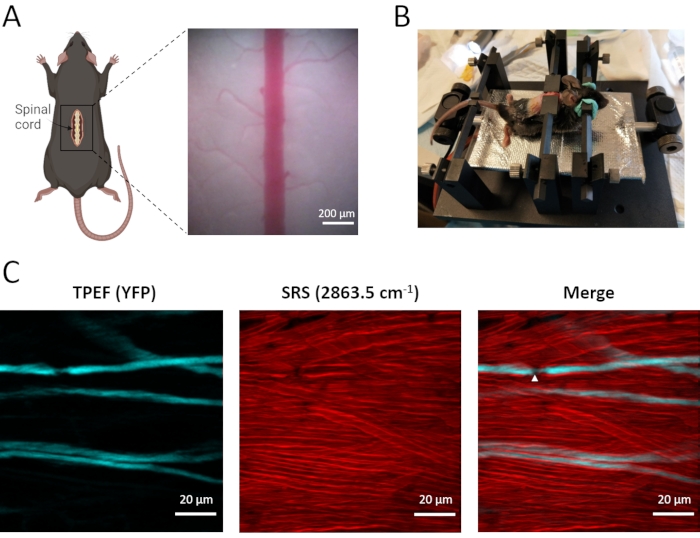
Resim 3: Fare omuriliğinin in vivo TPEF-SRS görüntülemesi. (A) Fare omuriliğinin cerrahi hazırlığının şematik diyagramı ve omuriliğin parlak alan görüntüsü. (B) Omuriliğin in vivo görüntülenmesi için fare montaj şeması. (C) Fare omuriliğindeki aksonların ve miyelin kılıflarının maksimal z projeksiyon görüntüleri. Beyaz ok uçları, Ranvier'in bir düğümünün yerini gösterir. Miyelinin SRS görüntüleri 2863.5 cm-1'lik Raman kaymasında çekilmiştir. Şekil A , BioRender (https://biorender.com/) kullanılarak oluşturulmuştur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, TPEF-SRS mikroskobunun temel kurulumu ayrıntılı olarak açıklanmaktadır. SRS görüntüleme için, pompa ve Stokes kirişleri OPO'nun içinde geçici ve uzamsal olarak üst üste biner. Bununla birlikte, bu örtüşme mikroskop sisteminden geçtikten sonra bozulabilir. Bu nedenle, pompanın ve Stokes ışınlarının kolokalizasyonunun hem mekansal hem de zamansal optimizasyonu, optimum SRS görüntülemeyi elde etmek için gerekli ve kritiktir. Pompa ve Stokes ışını arasındaki zamansal gecikme, mikroskop sistemindeki optik elemanların dağılmasıyla belirlenen iki ışının optik yol farkı ile ilgilidir38. Pompa ışınının dalga boyu farklı Raman kaymalarında SRS görüntüleme için ayarlandığında, optik lenslerin kırılma indisi dalga boyuna bağlı olduğundan, pompa ışınının optik yol uzunluğu buna göre değişir38. Bu nedenle, pompa ve Stokes lazer darbesi arasındaki zamansal gecikme, pompa ışınının dalga boyuna göre değişir ve bu nedenle kalibre edilmesi gerekir. OPO, pompanın ve Stokes ışınının zamansal senkronizasyonu için yazılım kontrollü bir gecikme hattı ile donatılmıştır. Aynı optik kurulum için, gecikme verileri sabit kalır ve yalnızca bir kez kalibre edilmesi gerekir. Sonuç olarak, pompa ışınının farklı dalga boylarındaki gecikme verileri, gelecekteki kullanım için ilk ölçümde kaydedilebilir. Kalibre edilmiş gecikme verileri, pompa ışınının dalga boyu değiştirildiğinde OPO kontrol yazılımı tarafından otomatik olarak uygulanabilir, bu da farklı Raman kaymalarında SRS görüntüleme veya hiperspektral SRS görüntüleme için uygundur. TPEF-SRS görüntüleme için, kombinasyondan sonra ps ve fs ışınlarının sıkı uzamsal örtüşmesi, iki görüntüleme modeli arasında herhangi bir FOV kaymasını önlemek için kritik bir adımdır. İlk olarak, ps pompa ışını ve fs ışını, her ikisinin de mikroskop sisteminin optik ekseninde olduğundan emin olmak için hizalanır, bu da iki görüntüleme modelini değiştirirken herhangi bir FOV kaymasını önlemek için kritik öneme sahiptir. Daha sonra, pompa kirişini referans olarak kullanarak, Stokes kiriş konumu, katı mekansal kolokalizasyon elde etmek için buna göre ayarlanır. Her hizalama prosedürü, optimuma ulaşmak için birkaç deneme gerektirir.
SRS sinyali önemli ölçüde azalırsa, önce kilitleme amplifikatörünün faz değeri ve zaman gecikmesi verileri kontrol edilmelidir. Senkronizasyon sinyali bozulduğunda kilitli amplifikatör fazdan çıktığından, faz değeri, güç kaynağı veya EOM senkronizasyon sinyali kesildikten sonra her seferinde yeniden ayarlanmayı gerektirir. Pompanın ve Stokes kirişinin zamansal senkronizasyonu, OPO içindeki gecikme hattını hafifçe ayarlayarak hızlı bir şekilde kontrol edilebilir. Kalibre edilen zaman gecikmesi verileri optimum değerden uzaksa, gecikme yöneticisi iletişim kutusundaki Sıfır Tarama düğmesine tıklayarak gecikme ofsetini yeniden kalibre etmek için sıfır tarama yapılmalıdır. Tüm sıfır tarama prosedürü yaklaşık 10 dakika sürer. SRS sinyali, faz ve zaman gecikmesi değerinin optimizasyonundan sonra toparlanamazsa, Stokes ışınının EOM modülasyonu, adım 2.1.3-2.1.4'te açıklandığı gibi kontrol edilmelidir. Stokes darbe treninin kapalı konumundaki küçük darbe zirvelerinin gözlemlenmesiyle yok olma oranı 10 dB'den çok daha düşükse, EOM yeniden başlatılmalı ve modülasyon gücü ve fazı maksimum modülasyon derinliği elde etmek için yeniden ayarlanmalıdır. Genellikle, modülasyon problemi EOM'yi sıfırlayarak çözülebilir. Değilse, üreticiden teknik destek alınmalıdır.
İn vivo kalın doku görüntülemesi için epi-SRS tespit modu kullanılmalıdır. Bu protokolde, uyarma lazerini geçirmek ve geriye saçılan SRS sinyalini dedektöre yansıtmak için bir PBS kullanılır. Algılanan SRL sinyali, ileri giden pompa ışınının dokular tarafından geri saçılmasına bağlıdır. Uyarma lazerleri doğrusal polarizasyona sahiptir ve PBS'den tamamen geçebilirken, geri saçılan ışın polarizasyonu kaydırmıştır ve bu nedenle PBS tarafından sadece kısmen yansıtılabilir. Bu nedenle, mevcut sinyal toplama şeması, dairesel bir fotodetektörün doğrudan hedefin önüne yerleştiren stratejiye kıyasla daha düşük verimlilik gösterir12. Bununla birlikte, lipit bakımından zengin dokuların güçlü saçılması nedeniyle39, omuriliğin yüksek sinyal-gürültü oranlı SRS görüntüleri (512 x 512 piksel) 1-2 s entegrasyon süresi ile elde edilebilir ve bu PBS tabanlı toplama şeması omurilik görüntüleme için uygun bir yaklaşım haline gelir. Öte yandan, güçlü doku saçılması ışık penetrasyon derinliğini sınırlar. Hem SRS hem de TPEF görüntüleme için, omurilik için görüntüleme derinliği yaklaşık 50 μm ile sınırlıdır.
SRS ve TPEF görüntüleme için sıralı görüntüleme prosedürü, mevcut çift modal görüntüleme yönteminin en büyük sınırlamasıdır. Protokolde TPEF ve SRS görüntüleme, motorlu palet otomatik olarak anahtarlanarak 1 s aralıklarla aynı yerde sırayla gerçekleştirilir. Hareket artefaktları, TPEF ve SRS görüntülerinin kusurlu bir şekilde birleşmesine neden olabilir, bu da bu yöntemin hayvanların nefes ve kalp atışlarından büyük ölçüde etkilenen son derece dinamik süreçleri veya dokuları görüntüleme yeteneğini sınırlar. Olası bir çözüm, SRS görüntüleme sırasında ps lazer ile uyarılmış iki foton floresansını aynı anda toplamaktır9. Bununla birlikte, bu yöntem sadece güçlü floresan sinyallere sahip biyolojik yapılara uygulanabilir, çünkü ps darbesi fs darbesine kıyasla çok daha düşük bir floresan uyarma verimliliğine sahiptir14. Alternatif olarak, sorun, fs lazer kaynağının, SRS görüntülemenin düşük spektral çözünürlüğü pahasına, SRS ve TPEF sinyallerinin aynı anda etkili bir şekilde uyarılmasına izin verdiği bir fs-SRS sistemi22,40 kullanılarak çözülebilir. Diğer bir çözüm, SRS görüntüleme sırasında elde edilen ps lazer uyarılmış floresansı, fs floresan görüntülerini kaydetmek için referans olarak kullanmaktır. Şekil 3'te gösterildiği gibi, SRS ve floresan görüntüleme sırasında önemli bir hareket meydana gelmezse bu kayıt stratejisi iyi çalışır.
SRS, biyolojik görüntülemede benzersiz avantajlar sergiler, çünkü spesifik etiketsiz kontrast mekanizmasına dayanarak biyomoleküllerin kimyasal bilgilerini sağlar41. Multimodal NLO görüntüleme için TPEF ile de birleştirilen CARS ile karşılaştırıldığında, SRS daha iyi spektral ve görüntü yorumlama yeteneği göstermiştir11. Bu nedenle, lipid9,11, protein42,43, DNA44 ve alkin (C ≡ C)13,45, karbon-döteryum (C-D)9,46 ve oksijen-döteryum (O-D) bağları47,48 içeren biyo-ortogonal bileşenlerin görüntülenmesinde yaygın olarak uygulanmaktadır. biyolojik dokularda. Bu protokolde, SRS görüntüleme için bir ps lazer kaynağı ve TPEF görüntüleme için bir fs lazer kaynağı kullandık, bu da verimli floresan uyarımı ve yüksek Raman spektral çözünürlüğünün avantajlarını birleştirerek çeşitli biyomoleküllerin etkili bir şekilde farklılaşmasına izin verdi42,44. Omurilikte, glial hücreleri, nöronları ve işe alınan bağışıklık hücrelerini içeren karmaşık hücre-mikro çevre etkileşimleri, yaralanmaların49 ve hastalıkların50 ilerlemesine katkıda bulunur. Çeşitli floresan ve SRS görüntüleme probları ile birleştirildiğinde, TPEF-SRS mikroskopisi, çeşitli hücresel yapıların yanı sıra farklı biyomolekül bileşenlerinin eşzamanlı görüntülenmesini sağlayabilir ve bu da omurilik bozukluklarının başlangıcını ve gelişimini anlamamızı önemli ölçüde kolaylaştırabilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur ve rekabet eden finansal çıkarları yoktur.
Teşekkürler
Bu çalışma, Hong Kong Araştırma Hibeleri Konseyi tarafından 16103215, 16148816, 16102518 16102920, T13-607/12R, T13-706/11-1, T13-605/18W, C6002-17GF, C6001-19E, N_HKUST603/19, İnovasyon ve Teknoloji Komisyonu (ITCPD/17-9), Üniversite Hibeleri Komitesi Mükemmellik Programı Alanı (AoE/M-604/16, AOE/M-09/12) ve Hong Kong Bilim ve Teknoloji Üniversitesi (HKUST) tarafından RPC10EG33 hibesi yoluyla desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #2 Forceps | Dumont | 11223-20 | For laminectomy |
| 10X objective | Nikon | CFI Plan Apo Lambda 10X | |
| 25X objective | Olympus | XLPLN25XSVMP2 | |
| Burn cream | Betadine | ||
| Camera | Sony | α6300 | |
| Current amplifier | Stanford research | SR570 | |
| Current photomultiplier modules | Hamamatsu | H11461-01 | |
| D2 665 nm long-pass dichroic mirror | Semrock | FF665-Di02-25x36 | For directing epi-fluorescence signal to the detection module |
| D3 700 nm short-pass dichroic mirror | Edmund | 69-206 | For separating SRS from TPEF detection path |
| Depilating cream | Veet | ||
| FS1 975 nm short-pass filter | Edmund | 86-108 | For blocking stokes beam |
| FS1 Bandpass filter | Semrock | FF01-850/310 | For blocking stokes beam |
| Fs2 Bandpass filter | Semrock | FF01-525/50 | For selecting YFP signal |
| Fs2 Shortpass filter | Semrock | FF01-715/SP-25 | For blocking fs excitation laser beam |
| Half-wave plate | Thorlabs | SAHWP05M-1700 | |
| High-speed photodetector | MenloSystems | FPD 310-F | For checking Stokes beam modulation |
| Iodine | Betadine | ||
| IR Scope | FJW | FIND-R-SCOPE Infrared Viewer 2X Kit Model 84499C2X | |
| Iris | Thorlabs | CPA1 | |
| L1 | Thorlabs | AC254-060-B-ML | |
| L10 | Thorlabs | LA4052-A | |
| L2 | Thorlabs | LA1422-B | |
| L3 | Thorlabs | AC254-050-B | |
| L4 | Thorlabs | AC254-060-B-ML | |
| L7 | f=100 mm, AB coating | ||
| L8 | Thorlabs | LA4874-A | |
| L9 | Thorlabs | AC254-035-B-ML | |
| Lock-in amplifier | APE | ||
| Mirror | Thorlabs | PF10-03-P01 | |
| Motorized flipper | Thorlabs | MFF101/M | |
| multifunctional acquisition card | National Instrument | PCIe-6363 | |
| Oscilloscope | Tektronix | TDS2012C | |
| Photodiode | APE | For detecting SRS signal | |
| Picosecond laser source | APE | picoEmerald | |
| Polarizing beam splitter | Thorlabs | CCM1-PBS252/M | |
| Power meter | Newport | 843-R | |
| Saline | Braun | ||
| Scan lens L5 | Thorlabs | SL50-CLS2 | |
| Scanning mirror | Cambridge Technology | 6215H | |
| Silicone gel | World Precision Inc. | KWIK-SIL | |
| Ti:sapphire fs laser | Coherent | Chameleon Ultra II | |
| Tube lens L6 | Thorlabs | TTL200-S8 |
Referanslar
- Raman, C. V., Krishnan, K. S. The optical analogue of the compton effect. Nature. 121 (3053), 711(1928).
- Turrell, G., Corset, J. Raman Microscopy: Developments and Applications. , Academic Press. (1996).
- Tian, F., et al. Monitoring peripheral nerve degeneration in ALS by label-free stimulated Raman scattering imaging. Nature Communications. 7 (1), 13283(2016).
- Shi, Y., et al. Longitudinal in vivo coherent anti-Stokes Raman scattering imaging of demyelination and remyelination in injured spinal cord. Journal of Biomedical Optics. 16 (10), 106012(2011).
- Hu, C. R., Zhang, D., Slipchenko, M. N., Cheng, J. -X., Hu, B. Label-free real-time imaging of myelination in the Xenopus laevis tadpole by in vivo Stimulated Raman Scattering Microscopy. Journal of Biomedical Optics. 19 (8), 086005(2014).
- Den Broeder, M. J., et al. Altered adipogenesis in Zebrafish larvae following high fat diet and chemical exposure is visualised by Stimulated Raman Scattering Microscopy. International Journal of Molecular Sciences. 18 (4), 894(2017).
- He, S., et al. In vivo metabolic imaging and monitoring of brown and beige fat. Journal of Biophotonics. 11 (8), (2018).
- Wang, M. C., Min, W., Freudiger, C. W., Ruvkun, G., Xie, X. S. RNAi screening for fat regulatory genes with SRS microscopy. Nature Methods. 8 (2), 135-138 (2011).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by Stimulated Raman Scattering Microscopy. Analytical Chemistry. 91 (3), 2279-2287 (2019).
- Zhang, C., Li, J., Lan, L., Cheng, J. -X. Quantification of lipid metabolism in living cells through the dynamics of lipid droplets measured by Stimulated Raman Scattering Imaging. Analytical Chemistry. 89 (8), 4502-4507 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by Stimulated Raman Scattering Microscopy. Science. 322 (5909), 1857-1861 (2008).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with Stimulated Raman Scattering. Science. 330 (6009), 1368-1370 (2010).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and Stimulated Raman Scattering Microscopy using a probe of the aggregation-induced emission characteristic. Journal of the American Chemical Society. 139 (47), 17022-17030 (2017).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Pawlicki, M., Collins, H. A., Denning, R. G., Anderson, H. L. Two-photon absorption and the design of two-photon dyes. Angewandte Chemie International Edition. 48 (18), 3244-3266 (2009).
- König, K. Multiphoton microscopy in life sciences. Journal of Microscopy. 200 (2), 83-104 (2000).
- Dean, K. M., Palmer, A. E. Advances in fluorescence labeling strategies for dynamic cellular imaging. Nature Chemical Biology. 10 (7), 512-523 (2014).
- Tsurui, H., et al. Seven-color fluorescence imaging of tissue samples based on fourier spectroscopy and singular value decomposition. Journal of Histochemistry & Cytochemistry. 48 (5), 653-662 (2000).
- Niehörster, T., et al. Multi-target spectrally resolved fluorescence lifetime imaging microscopy. Nature Methods. 13 (3), 257-262 (2016).
- Zhang, X., et al. Label-free live cell imaging of nucleic acids using Stimulated Raman Scattering (SRS) Microscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 13 (4), 1054-1059 (2012).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 7715(2018).
- Li, X., et al. Integrated femtosecond stimulated Raman scattering and two-photon fluorescence imaging of subcellular lipid and vesicular structures. Journal of Biomedical Optics. 20 (11), 110501(2015).
- Imitola, J., et al. Multimodal coherent anti-Stokes Raman scattering microscopy reveals microglia-associated myelin and axonal dysfunction in multiple sclerosis-like lesions in mice. Journal of Biomedical Optics. 16 (2), 021109(2011).
- Uckermann, O., et al. Label-free multiphoton microscopy reveals altered tissue architecture in hippocampal sclerosis. Epilepsia. 58 (1), 1-5 (2017).
- Tamosaityte, S., et al. Inflammation-related alterations of lipids after spinal cord injury revealed by Raman spectroscopy. Journal of Biomedical Optics. 21 (6), 061008(2016).
- Uckermann, O., et al. Endogenous two-photon excited fluorescence provides label-free visualization of the inflammatory response in the rodent spinal cord. BioMed Research International. 2015, 859084(2015).
- van Hameren, G., et al. In vivo real-time dynamics of ATP and ROS production in axonal mitochondria show decoupling in mouse models of peripheral neuropathies. Acta Neuropathologica Communications. 7 (1), 1-16 (2019).
- Davalos, D., et al. Fibrinogen-induced perivascular microglial clustering is required for the development of axonal damage in neuroinflammation. Nature Communications. 3 (1), 1-15 (2012).
- Ylera, B., et al. Chronically CNS-injured adult sensory neurons gain regenerative competence upon a lesion of their peripheral axon. Current Biology. 19 (11), 930-936 (2009).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Lau, S. -F., et al. IL-33-PU.1 transcriptome reprogramming drives functional state transition and clearance activity of microglia in Alzheimer's Disease. Cell Reports. 31 (3), 107530(2020).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Scientific Reports. 5, 9691(2015).
- Yang, Z., Xie, W., Ju, F., Khan, A., Zhang, S. In vivo two-photon imaging reveals a role of progesterone in reducing axonal dieback after spinal cord injury in mice. Neuropharmacology. 116, 30-37 (2017).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Totoiu, M. O., Keirstead, H. S. Spinal cord injury is accompanied by chronic progressive demyelination. Journal of Comparative Neurology. 486 (4), 373-383 (2005).
- Kopper, T. J., Gensel, J. C. Myelin as an inflammatory mediator: Myelin interactions with complement, macrophages, and microglia in spinal cord injury. Journal of Neuroscience Research. 96 (6), 969-977 (2018).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Pedrotti, F. L., Pedrotti, L. M., Pedrotti, L. S. Introduction to Optics. , Higher Education from Cambridge University Press. (2017).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), 37-61 (2013).
- Zhang, D., Slipchenko, M. N., Cheng, J. -X. Highly sensitive vibrational imaging by Femtosecond Pulse Stimulated Raman Loss. The Journal of Physical Chemistry Letters. 2 (11), 1248-1253 (2011).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, label-free detection of brain tumors with Stimulated Raman Scattering Microscopy. Science Translational Medicine. 5 (201), (2013).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging. Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Yamakoshi, H., et al. Imaging of EdU, an Alkyne-tagged cell proliferation probe, by Raman Microscopy. Journal of the American Chemical Society. 133 (16), 6102-6105 (2011).
- van Manen, H. -J., Lenferink, A., Otto, C. Noninvasive imaging of protein metabolic labeling in single human cells using stable isotopes and Raman Microscopy. Analytical Chemistry. 80 (24), 9576-9582 (2008).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nature Biomedical Engineering. 3 (5), 402-413 (2019).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995(2018).
- Ahuja, C. S., et al. Traumatic spinal cord injury. Nature Reviews Disease Primers. 3 (1), 1-21 (2017).
- Lassmann, H. Multiple sclerosis pathology. Cold Spring Harbor Perspectives in Medicine. 8 (3), 028936(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır