Method Article
インビボ で2光子蛍光と誘導ラマン散乱顕微鏡を組み合わせた生体組織のイメージング
要約
誘導ラマン散乱(SRS)顕微鏡は、特定の化学結合の固有の振動に基づいて生体分子の標識のないイメージングを可能にします。このプロトコルでは、生きたマウスの脊髄の細胞構造を視覚化するために、統合されたSRSおよび2光子蛍光顕微鏡の機器セットアップが記載されている。
要約
誘導ラマン散乱(SRS)顕微鏡は、固有の分子振動に基づいて、その天然微小環境における生体組織の標識のないイメージングを可能にし、したがって、細胞内分解能での生物学的プロセスの in vivo 研究のための完璧なツールを提供する。2光子励起蛍光(TPEF)イメージングをSRS顕微鏡に統合することにより、組織のデュアルモーダル in vivo イメージングは、細胞代謝、免疫応答、組織リモデリングなどに関与する動的プロセスを理解するのに役立つ、複数の視点から重要な生化学的および生物物理学的情報を取得できます。このビデオプロトコルでは、TPEF-SRS顕微鏡システムのセットアップと、動物の脊髄の in vivo イメージング方法が導入されています。脊髄は、中枢神経系の一部として、脳と末梢神経系との間のコミュニケーションにおいて重要な役割を果たしている。リン脂質が豊富なミエリン鞘は、軸索を囲んで絶縁し、活動電位の塩分化伝導を可能にする。脊髄内のミエリン鞘の インビボ イメージングは、神経変性疾患および脊髄損傷の進行を研究するために重要である。このプロトコルはまた、高解像度の生物学的画像を取得するための動物調製および インビボ TPEF-SRSイメージング法についても記載しています。
概要
ラマン顕微鏡1,2は、生体分子中の様々な化学結合の特徴的な周波数に基づいて生体組織を画像化する強力な標識フリー法として浮上している。ラマン顕微鏡は、その非侵襲的で適応性の高いイメージング能力により、ミエリン鞘3,4,5、脂肪細胞6,7、および脂肪滴8,9,10などの生物学的組織における脂質富化成分のイメージングに広く使用されています。.誘導ラマンゲイン(SRG)または刺激ラマン損失(SRL)として取得された誘導ラマン散乱(SRS)信号はバックグラウンドフリーであり、自発的なラマン散乱と完全にスペクトル的に類似している11、12。さらに、SRLおよびSRGは分析物濃度に直線的に依存し、生化学成分の定量分析を可能にする9、11、13。二光子励起蛍光顕微鏡(TPEF)は、その固有の光学切片化能力、深い浸透深さ、および低い光毒性のために、in vivo生物学的イメージングに広く使用されてきました14,15,16。しかし、TPEFイメージングの性能は蛍光タグの特性に依存し、広帯域蛍光スペクトル8、17、18、19のために解決可能な色の数が制限されています。ラベルフリーSRSイメージングと蛍光ベースのTPEFイメージングは、2つの相補的なイメージングモダリティであり、それらの組み合わせは、組織の豊富な生物物理学的および生化学的情報を提供することができます。これら2つのイメージングモダリティは、どちらも非線形光学(NLO)プロセスに基づいており、1つの顕微鏡システムに簡単に統合できます。SRSイメージングとTPEFイメージングの組み合わせ、いわゆるデュアルモーダルイメージングは、細胞や組織の高次元イメージングとプロファイリングを可能にし、複雑な生物学的システムの包括的な理解を容易にします。具体的には、ピコ秒(ps)SRS顕微鏡は、フェムト秒(fs)SRS技術11と比較して高いスペクトル分解能で化学結合イメージングを達成することができ、生体組織、特に混雑した指紋領域20,21における複数の生化学的成分を区別することを可能にする。さらに、コヒーレントアンチストークス散乱(CARS)顕微鏡を統合した別の一般的に使用されるデュアルモーダルNLO顕微鏡システムと比較して、SRSはスペクトルおよび画像解釈、および検出感度の点でCARSよりも優れた性能を示しています11。SRS-TPEF顕微鏡は、カエノラブディティス・エレガンス9,22、アフリカツメガエル・ラエビス・オタマジャクシ脳5、マウス脳23,24、脊髄25,26、末梢神経27、脂肪組織7など、さまざまな生物系を研究するための強力なツールとして使用されてきました。
脊髄は脳とともに中枢神経系(CNS)を構成しています。生理学的および病理学的条件下でのCNSのインビボでの細胞活動を視覚化することは、CNS障害のメカニズムを理解し28,29,30および対応する治療法を開発するために重要である31,32,33。高速活動電位伝導のために軸索を包み込み、絶縁するミエリン鞘は、CNSの発達において重要な役割を果たしている。脱髄は、多発性硬化症などの白質障害の特徴として考えられています34。さらに、脊髄損傷後35、ミエリン破片はマクロファージの活性化を調節し、慢性炎症および二次損傷に寄与する36。したがって、生きたマウスモデルにおけるニューロンおよびグリア細胞と共にミエリン鞘のインビボイメージングは、CNS障害における動的プロセスを理解するのに非常に役立つ。
このプロトコルでは、自家製のTPEF-SRS顕微鏡の基本的なセットアップ手順を説明し、マウス脊髄のデュアルモーダル in vivo イメージング方法を紹介します。
プロトコル
この作業で実施されるすべての動物処置は、香港科技大学(HKUST)の実験動物施設のガイドラインに従って行われ、HKUSTの動物倫理委員会によって承認されています。TPEF-SRS顕微鏡のセットアップと操作には、レーザーハンドリングの安全トレーニングが必要です。レーザーを扱うときは、常に適切な波長範囲のレーザー安全ゴーグルを着用してください。
1. TPEF-SRS顕微鏡のセットアップ(セットアップ回路図については図1を参照)
- SRSイメージング用のpsレーザ光源として、モードロックされたイッテルビウムファイバレーザに接続された内蔵光パラメトリック発振器(OPO)を使用します。
メモ:OPOは、2 psのパルス持続時間と80 MHzの繰り返しレートでストークスビーム(1031 nm)とポンプビーム(780 nmから960 nmまで調整可能)を出力します。ストークスビームは、内蔵の電気光学変調器(EOM)によって20MHzで変調され、MHzレベルでの高周波位相感度SRS検出を実現します。 - TPEFイメージングのレーザー光源としてfsチタン(Ti):サファイアレーザーを使用してください。
- 一対のレンズ(L1とL2)を使用してコリメートし、fsビームのサイズを3mmに調整します。
- 一対のレンズ(L3とL4)を使用してpsレーザービームを平行化し、その直径を3mmに拡大します。
- 1/2波長板を用いてfsレーザ光の偏光をp偏光からs偏光に変更する。
- 2つのレーザービームを偏光ビームスプリッター(PBS)と組み合わせます。
- ビームスキャン用のPBSの後ろに3 mm XYスキャンガルバノミラーのペアを追加します。
- テレセントリックスキャンレンズ(L5)と無限補正チューブレンズ(L6)を使用して、走査ミラーと25x対物レンズの後部瞳孔を共役させます。スキャンレンズとチューブレンズでレーザー光を展開し、対物レンズの背面開口部を埋めます。
- PBSまたはダイクロイックミラー(D2)をチューブレンズと対物レンズの間に配置して、SRSまたは蛍光シグナル収集を行う。電動フリッパーを使用して、PBSとD2を切り替えます。
メモ: 後方散乱 SRS 信号の一部は、PBS を通過するときに、ランダムにシフトされた偏波の結果として失われます。 - 一対のレンズ(L7とL9)を使用して検出ビームを狭くし、25x対物レンズの後部瞳孔をフォトダイオードセンサーで共役させます。
- 一対のレンズ(L8とL10)を使用して検出ビームを狭くし、25倍の対物レンズの後部瞳孔を光電子増倍管(PMT)の検出面と共役させます。
- ダイクロイックミラー(D3)を使用して、蛍光シグナルとSRSシグナルの検出経路を分離します。
- フォトダイオード検出器の前にフィルタセット(Fs1)を配置してストークスレーザをブロックし、ポンプビームのみを通過させます。
- PMT検出器の前にフィルターセット(Fs2)を配置して、標的蛍光シグナルのみを通過させる。
- PMTを電流増幅器に接続して信号増幅を行います。
- フォトダイオードをロックインアンプに接続します。
- 内蔵EOM出力からの同期信号をロックインアンプのリファレンス入力に接続し、SRS信号復調を行います。
- PMTアンプとロックインアンプ出力をデータ集録モジュールに接続します。
2. TPEF-SRS顕微鏡システム校正
- レーザーの起動
- キースイッチを スタンバイ から オン の位置に切り替えてTi:サファイアレーザーをオンにし、レーザーがウォームアップするまで30分間待ちます。
- OPOコントロールパネルの [スタート ]ボタンをクリックしてOPOの電源を入れ、レーザーがウォームアップするまで20分間待ちます。
- psレーザーがウォームアップしたら、高速光検出器を使用してストークスビームの変調深さを確認します。ストークスビームのレーザーシャッターを開きます。[ OPO電源の設定] ボックスをクリックし、「20」と入力します。高速光検出器をOPO出力に配置してビームを検出します。ベヨネットニールコンセルマン(BNC)コネクタ付きの同軸ケーブルを使用して、光検出器の出力ポートをオシロスコープの入力ポートに接続し、レーザーパルスを監視します。
- OPO制御ソフトウェアで EOM制御 ウィンドウを開きます。オシロスコープに示されているパルス強度図に従ってEOMの電力と位相を調整し、20MHzで最大の変調深度を達成します。
メモ: EOM のパフォーマンスは通常安定しており、SRS 信号が大幅に低下している場合にのみチェックする必要があります。
- TPEF-SRS複合顕微鏡の光アライメント
- ステップ 2.2.2 から 2.2.13 で説明されているように、ps ビームと fs ビームの共局在化のための光アライメントを実行します。
- OPO制御ソフトウェアでストークス出力を停止しながら、ポンプレーザーシャッターを開きます。OPO制御ソフトウェアを使用して、ポンプビームの波長を796nmに設定するには、[ 信号の設定] ボックスをクリックし、波長値796を入力します。 [OPO 電源の設定] ボックスをクリックし、「20」と入力して、光アライメントの電力を最小(~20 mW)に設定します。
- 顕微鏡コンピュータと、スキャナ、対物アクチュエータ、フォトダイオード、PMT、電流アンプ、ロックインアンプ、電動フリッパーなど、関連するすべての電子部品の電源を入れます。顕微鏡制御ソフトウェアを起動します。
メモ:顕微鏡制御ソフトウェアは自家製のインターフェースです。 - 2枚のアライメントプレート(図1の P1とP2)を光路上に配置します。P1 を約 10 cm の距離で PBS の後ろに置き、P2 を P1 の後ろに約 30 cm の距離で配置します。
メモ:psビームとfsビームは、PBSを使用して結合されます(図1)。2つのアライメントプレートは、2つのレーザービームのアライメントと共局在を確認するために使用されます。 - psレーザービーム用の顕微鏡シャッターを開きます。
- ミラーM1を調整して、P1の貫通孔にpsレーザービームの中心を配置します。赤外線(IR)スコープを使用して、ミラーM1を調整するときにP1のビームスポットの位置を観察します。
- ミラーM2を調整して、P2の貫通穴にpsレーザービームの中心を配置します。ミラーM2を調整する際に、IRスコープを使用してP2のビームスポットの位置を観察します。
- 手順 2.2.6 と 2.2.7 を繰り返して、ps ビームの中心が両方のアライメントプレートの貫通孔の位置に収まるようにします。顕微鏡制御ソフトでpsビームのシャッターを閉じます。
- fs Ti:サファイアレーザーの波長を740nmに設定し、レーザーシャッターを開きます。レーザー出力を5mW(顕微鏡システムの入力ポートで測定)に設定して、光学アライメントを行います。
- 顕微鏡のシャッターを開けて、fsレーザービームを照射します。
- ミラーM3を調整して、P1のスルーホールにあるfsレーザービームスポットの中心を見つけます。
- ミラーM4を調整して、P2のスルーホールのレーザービームスポット中心の位置を確認します。
- fs レーザービームの中心が 2 枚のアライメントプレートの貫通孔に位置するまで、手順 2.2.11 と 2.2.12 を繰り返します。fsビームの顕微鏡シャッターを閉じます。
- ポンプビームとストークスビームの空間オーバーラップを、ステップ 2.2.15 ~ 2.2.18 で説明されているように実行します。
注:ポンプビームとストークスビームはpsレーザ内でほぼ重なっていますが、最適なSRS性能を達成するためには、2つのレーザビームの位置を微調整する必要があります。ポンプビームは、前述のように最初に位置合わせされるので、次にストークスビームは、ポンプビームと共局在するように調整される。 - 対物レンズの位置にカメラを配置して、2 つのビーム スポットの位置を視覚化します。カメラ画面上のポンプビームの位置を基準としてマークします。
- L3の前にアライメントプレートP0を配置します(図1)。16進キーを使用して光学ミラー1(OM1)を調整し、ストークスビーム中心がアライメントプレートの貫通孔を通過し、レーザー出力ポートでポンプビームと共局在化するようにします。IRスコープを使用して、調整中にP0のビームスポットの位置を確認します。
メモ: OM1 と OM2 は、1031 nm ストークスビームの位置を調整するための OPO ヘッド内の 2 つのミラーです。 - アライメントプレートP0を取り外し、六角キーを使用してOM2を調整し、ストークスビームの中心がカメラのポンプビームの基準マークと共局在するようにします。
- 手順 2.2.16 と 2.2.17 を繰り返して、ストークスビームが P0 平面とカメラ面の両方でポンプビームと厳密に重なるまで待ちます。
メモ:カメラのビームスポットを視覚化するときは、すべてのアライメントプレートを光路から取り外す必要があります。
- イメージング条件の最適化
- 手順 2.3.2 の説明に従ってロックインアンプの位相調整を実行します。から 2.3.7 まで。
メモ: SRS 検出は、高周波位相に敏感な方式に基づいています。SRL検出では、ストークスビームの強度が20MHzで変調され、ロックインアンプを使用して信号が復調されます。ロックインアンプの位相とオフセットを調整して、最適な画像コントラストを実現する必要があります。 - ロックインアンプ制御ソフトウェアを開きます。
- ポンプレーザーの波長を796nmに設定し、ポンプとストークスビームのパワーをサンプル上でそれぞれ15mWと25mWに設定します。
注:ここでは、SRSイメージングの最適化とキャリブレーションにオリーブオイルを使用します。炭素 - 水素領域におけるオリーブオイルのラマンピークは2863.5cm-1にあり、796nmのポンプビーム波長に対応する。 - オリーブオイルをスライドに密封し、折りたたんだティッシュペーパーをスライドの底に取り付けて、エピSRS検出のための信号後方散乱を強化します。オリーブオイルのサンプルをステージに置き、サンプル上の25倍の対物レンズの焦点を調整します。
- 顕微鏡制御ソフトウェアを使用して、500 μm x 500 μm の視野 (FOV) で 512 x 512 ピクセル、6.4 μs ピクセルの滞留時間でイメージングパラメータを設定します。ロックインアンプ制御ソフトウェアを使用して、時定数値をピクセルの滞留時間に近い10μsに設定します。
- サンプル上のレーザービームをスキャンします。ロックインアンプ制御ソフトウェアを使用して、SRS信号強度が最大に達するまで、位相(0~180°)を22.5°のステップサイズで調整します。
メモ:この全アナログロックインアンプでは、信号出力は同相成分であり、リファレンス信号の位相に依存します。位相は11°分解能のロックインアンプ制御ソフトウェアによって調整することができ、検出された信号を最大化して〜2%12以内にすることができます。ロックインアンプは、同期信号が中断されると位相が切れます。同期信号が再確立されるたびに位相を再調整する必要があります。 - レーザーシャッターを閉じた状態でサンプルをスキャンします。ロックインアンプ制御ソフトウェアを使用して、平均SRS信号がゼロに近づくまで、オフセット値を1mVのステップサイズで調整します。
注:平均SRS信号は、顕微鏡制御ソフトウェアによって自動的に計算されるSRS画像内のすべてのピクセルの平均強度として推定されます。オフセットは、不要な位相コヒーレント信号をキャンセルする場合に便利です。 - ステップ 2.3.9 から 2.3.14 で説明されているように、時間同期の最適化を実行します。
- OPO制御ソフトウェアで 遅延マネージャ ダイアログ(図2)を開きます。
- オリーブオイルをスキャンし、オリーブオイルSRS信号が最大に達するまで遅延ステージを調整します。
メモ:SRSイメージングの初めて、ロックインアンプの位相が最適化されていない場合、ロックインアンプの位相を最適化する前に、まず時間同期を大まかに調整してサンプルのSRS信号を視覚化します。 - スキャンを停止し、遅延マネージャダイアログの [データの追加] ボタンをクリックして、現在の遅延データを記録します。
- 手順 2.3 を繰り返します。10および2.3.11は、異なる波長の異なる化学サンプル用である。
注:ポリスチレンビーズ、重水、5-エチニル-2'-デオキシウリジン、グリセロールを使用して、異なる振動バンドでの遅延データを測定します。 - 遅延マネージャダイアログでデータ適合と次数5を選択し、現在のデータポイントを5次ポリノミック関数に適合させます。適合データを適用するには、[カスタムとして使用]ボタンをクリックし、チェックボックスをオンにします。遅延段は、適合された遅延曲線に従って異なる波長で自動調整されます。
- すべての遅延データをテキストファイルに保存し、将来使用するためにロードすることができます。
- 手順 2.3.2 の説明に従ってロックインアンプの位相調整を実行します。から 2.3.7 まで。
3. in vivo 蛍光およびSRSイメージングのためのマウスの外科的調製
- メス、スプリングハサミ、鉗子、カバースリップ、ガーゼパッドなど、必要なすべてのツールを滅菌します。
- 手術中に70%エタノールで触れられるすべての表面を消毒します。ベンチトップの作業領域を滅菌ドレープで覆います。ドレープの下に加熱パッドを置きます。
- 後根神経節求心性ニューロンで増強黄色蛍光タンパク質(EYFP)を発現するThy1-YFP-H(Tg(Thy1-YFP)HJrs/J)37トランスジェニックマウスをin vivo脊髄イメージングに使用してください。マウスを秤量し、ケタミン - キシラジン混合物(87.5mg kg-1および12.5mg kg-1)の腹腔内(すなわち)注射によって麻酔を誘導する。
- マウスのつま先をつまんで、深い麻酔を確実にします。必要に応じて麻酔薬の元の用量の半分を補う。角膜の乾燥を防ぐためにマウスの目に軟膏を塗布します。
- 胸椎の上の背中の髪を剃り、脱毛クリームを使用して髪を完全に取り除きます。剃った部分をヨウ素溶液で消毒する。
- メスでT11-T13椎の上に皮膚の小さな正中線切開(〜1.5cm)を行います。
- T11-T13椎骨の上と側面の両方の筋肉と腱を春のはさみと鉗子で切開します。隣接する3つの椎骨を露出させる。滅菌ガーゼパッドと滅菌生理食塩水を使用して出血を制御し、手術部位を清掃します。
- カスタム設計の安定化ステージで、2つのステンレススチール製サイドバーを使用して背骨を安定させます(図2B)。
- #2 鉗子を使用して、T12 で椎間板切除術を実行します。T12椎骨の薄層全体が除去されるまで、鉗子を慎重に使用して薄層を1枚ずつ壊します。
- 滅菌生理食塩水で脊髄に覆われた血液を洗い流し、ガーゼパッドを使用して過剰な水分を吸収します。出血を制御するためにガーゼパッドで出血部位に圧力をかけます。
- クランプバーにカバースリップ(22 x 22 mm)を置き、カバースリップと脊髄の間の隙間を生理食塩水で満たします。
4. マウス脊髄の インビボ TPEF-SRSイメージング
- マウスヘッドを2つのヘッドバーで固定し、保持プレートを下げて、呼吸中の胸の動きに十分なスペースを確保し、モーションアーチファクトを軽減します。
- マウスの下に加熱パッドを挿入して、イメージング中にマウスを暖かく保ちます。
- z並進ステージを調整して、脊髄血管系の明視野画像が10倍の対物レンズの下で観察できるようになるまで、焦点を調整します。
- 5軸段階の2軸並進段階を同調させることによって、FOVの中心にある脊髄背静脈の位置を特定する。
- 5軸ステージのロール角とピッチ角を調整し、明視野画像に基づいて対物軸に垂直な脊髄背面を調整します。
- TPEF-SRSイメージング用の10倍の水浸漬対物レンズを25倍に置き換えます。
- fsビームの波長を920nmに設定します。サンプルの fs ビーム出力を 10 mW に調整します。
- ポンプビームの波長を796nmに設定します。ポンプとストークスビームのパワーを、サンプル上でそれぞれ60mWと75mWに調整します。
注:脊髄SRSイメージングは、測定されたSRSスペクトル7,9に基づく炭素水素領域におけるミエリン鞘のラマンピークに対応する2863.5cm-1の波数で行われる。レーザー出力は、脊髄の高解像度TPEF-SRSイメージングを保証するために決定されます。組織損傷は、現在の画像化条件下では観察されない。 - SRSイメージングの場合は、電動フリッパーに接続されている スイッチ ボタンを押して、電動フリッパーを使用して対物レンズの上にあるPBSを選択します。
- イメージングパラメータは、150 μm x 150 μm FOV の場合は 512 x 512 ピクセル、3.2 μs ピクセルのドウェルタイム、2 μs 時定数で設定します。
- サンプルのスキャンを開始し、脊髄の背側表面に焦点を合わせます。
- 最大の脊髄SRS信号が達成されるまで、OPO制御ソフトウェアによって遅延ステージを微調整します。
注:生物学的サンプルは、余分な色分散を誘発することができ、遅延段階は、時間的同期を最適化するために調整することが必要な場合があります。しかしながら、SRSイメージングが組織上面付近で行われる場合、生体組織とイメージングウィンドウによって導入される2つのレーザパルスの時間的差は通常小さい(数百fs未満)。 - TPEFイメージングでは、電動フリッパーに接続されている スイッチ ボタンを押して、電動フリッパーを使用して対物レンズの上にあるダイクロイックミラーD2を選択します。
- イメージングパラメータを設定し、サンプルのスキャンを開始します。TPEF-SRS イメージ スタックをキャプチャするには、TPEF イメージと SRS イメージを同じ深度で 1 秒間隔で順番に取得してから、次の深度に進みます。TPEFイメージングのイメージングパラメータは、512 x 512ピクセル、150 μm x 150 μm FOV、3.2 μsピクセルのドウェルタイムです。
- すべての画像が収集されたら、動物を安定化段階から取り外します。
- 生理食塩水を洗い流して露出した組織をきれいにし、ガーゼパッドを使用して余分な液体を吸収します。露出した脊髄にシリコーンゲルを塗布し、硬化するまで約5分間待ちます。
- #6-0外科用縫合糸で皮膚を縫合して傷口を閉じる。感染を防ぐために手術部位の皮膚に火傷クリームを塗布する。鎮痛治療を皮下投与する(ブプレノルフィン0.1mg/kg)。
- 動物を清潔なケージに入れ、マウスが麻酔から完全に回復するまでケージを加熱パッドの上に置きます。
- 術後3日間、12時間毎に鎮痛剤投与を繰り返す。
- OPOとFSレーザーのシャッターを閉じます。ポンプとストークスビームのパワーを最大に設定します。
メモ: レーザーをオフにする前に最大出力を設定すると、レーザーのメンテナンスに役立ちます。 - ポンプビームとfsレーザーの波長を800nmに設定します。
- 2つのレーザーをスタンバイ状態にし、すべての電子制御ソフトウェアを閉じて、関連するすべての機器をオフにします。
結果
脊髄軸索およびミエリン鞘のインビボデュアルモーダルイメージングは、後根神経節求心性ニューロンでEYFPを発現するThy1-YFPHトランスジェニックマウスを用いて実施される(図3)。これらの標識された求心性ニューロンは、末梢神経から脊髄に感覚情報を中継し、中央枝は脊髄背柱に位置する。TPEF-SRS顕微鏡では、ラベルフリーSRSイメージングにより密集分布ミエリン鞘を鮮明に可視化し、TPEFイメージングにより疎標識YFP軸索を観察することができます。デュアルモデルイメージングにより、軸索はミエリン鞘の厚い層によって密接に包まれていることが明らかになりました(図3C)。軸索がミエリン鞘の裸であるランヴィエ(NR)の節は、活動電位の速い塩分化伝播において不可欠な役割を果たす。TPEF−SRS脊髄画像(図3C)に見られるように、NRは、細胞外マトリックスに直接露出した軸索径および軸索の減少を示す。NRの存在と位置を確認するために、周囲のミエリン鞘とともに軸索を画像化することが不可欠である。したがって、TPEF-SRS顕微鏡は、脊髄障害の発症における軸索およびミエリン鞘の動的変化を観察することを可能にし、これは細胞動態のメカニズムを理解する上で重要である。

図1:TPEF-SRS顕微鏡システムの概略図ポンプビームとストークスビームは、ピコ秒(ps)レーザーのダイクロイックミラー(D1)と組み合わされます。psビームとフェムト秒(fs)ビームは、3mmのXYスキャンガルバノメータミラーに合わせて、一対のレンズ(それぞれL3、L4、L1、L2)によってコリメートおよび拡張/狭められます。fsビームは、1/2波長板(HWP)によって水平偏光から垂直偏光に回転し、次いで偏光ビームスプリッタ(PBS)によってpsビームと結合される。走査ミラーと対物レンズの後部瞳孔とは、テレセントリックスキャンレンズL5と無限大補正管レンズL6とで共役している。レーザービームは、スキャンレンズとチューブレンズによって拡張され、25倍の対物レンズのバックアパーチャを満たします。誘導ラマン散乱(SRS)イメージングの場合、対物レンズによって収集された後方散乱ポンプビームはPBSによって反射され、大面積(10mm x 10mm)シリコンフォトダイオード(PD)に向けられる。二光子イメージングの場合、二光子励起蛍光(TPEF)信号は、ダイクロイックビームスプリッタD2によって光検出部に反射される。現在の光電子増倍管(PMT)モジュールは、TPEF信号を検出するために使用されます。略語 - L1 - L10:レンズ;OL: 対物レンズ;D1-D3:ダイクロイックミラー;Fs1, Fs2: フィルタセット;M:ミラー;OM1, OM2: 光ミラー;P0-P2:アライメントプレート。この図の拡大版を表示するには、ここをクリックしてください。
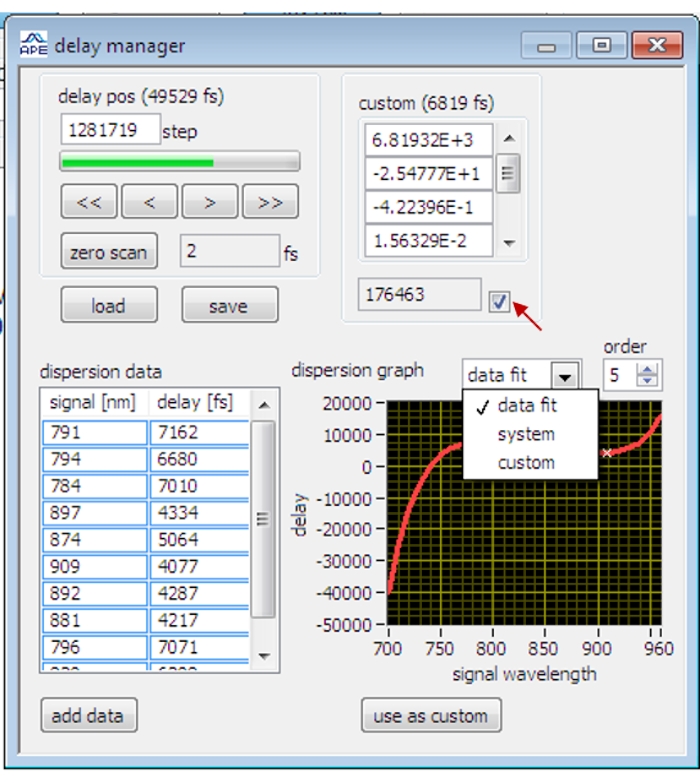
図2:OPO制御ソフトウェアの遅延マネージャのインタフェース 赤い矢印は、キャリブレーションされた遅延データを適用するためのチェックボックスを示します。 この図の拡大版を表示するには、ここをクリックしてください。
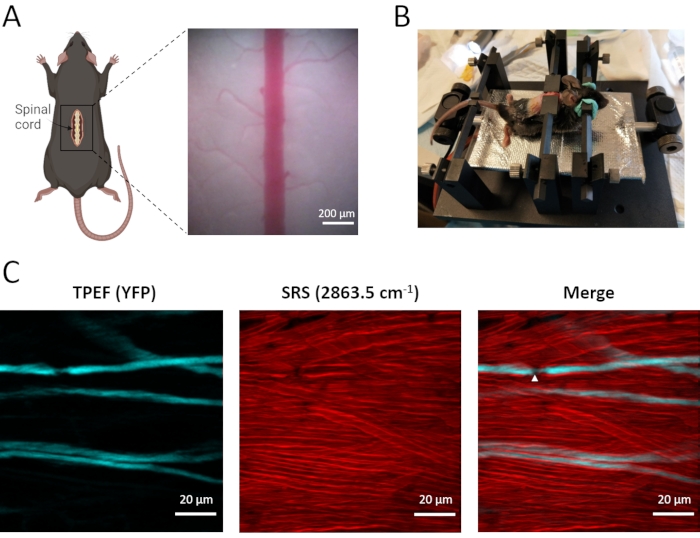
図3:マウス脊髄のインビボTPEF-SRSイメージング。 (a)マウス脊髄の手術準備の模式図及び脊髄の明視野像。(b)脊髄のインビボイメージングのためのマウス搭載スキーム。(c)マウス脊髄における軸索およびミエリン鞘の最大z投影像。白い矢印はランヴィエのノードの位置を示す。ミエリンのSRS画像は、2863.5cm-1のラマンシフトで撮影される。図Aは、BioRender(https://biorender.com/)を使用して作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルでは、TPEF-SRS顕微鏡の基本的なセットアップが詳細に説明されています。SRSイメージングの場合、ポンプビームとストークスビームはOPO内で時間的および空間的に重なり合っています。しかしながら、この重なりは、顕微鏡システムを通過した後に破壊され得る。したがって、ポンプビームとストークスビームの共局在化の空間的および時間的最適化の両方が、最適なSRSイメージングを達成するために必要かつ重要である。ポンプとストークスビームとの間の時間的遅延は、顕微鏡システム38における光学素子の分散によって決定される2つのビームの光路差に関係している。異なるラマンシフトでのSRS撮像のためにポンプビームの波長が同調されると、光学レンズの屈折率が波長に依存するため、ポンプビームの光路長はそれに応じて変化する38。したがって、ポンプとストークスレーザパルスとの間の時間的遅延は、ポンプビームの波長によって変化するため、較正する必要がある。OPOには、ポンプとストークスビームの時間同期のためのソフトウェア制御遅延ラインが装備されています。同じ光学セットアップの場合、遅延データは安定したままであり、一度だけ較正する必要があります。その結果、ポンプビームの異なる波長の遅延データを、将来の使用のために最初の測定時に保存することができます。較正された遅延データは、ポンプビームの波長が変更されるとOPO制御ソフトウェアによって自動的に適用することができ、異なるラマンシフトまたはハイパースペクトルSRSイメージングでのSRSイメージングに便利です。TPEF-SRSイメージングでは、組み合わせ後のpsビームとfsビームの厳密な空間的オーバーラップは、2つのイメージングモデル間のFOVシフトを回避するための重要なステップです。まず、psポンプビームとfsビームは、それらが両方とも顕微鏡システムの光軸上にあることを確認するために整列されており、これは2つのイメージングモデルを切り替えるときにFOVシフトを避けるために重要です。次に、ポンプビームを基準として使用して、それに応じてストークスビーム位置を調整し、厳密な空間共局在化を達成する。各アライメント手順では、最適な状態に達するまでに数回の試行が必要です。
SRS信号が大幅に減少した場合は、まずロックインアンプの位相値と時間遅延データをチェックする必要があります。同期信号が途切れるとロックインアンプは位相が切れるため、電源またはEOM同期信号が中断されるたびに位相値を再調整する必要があります。ポンプとストークスビームの時間的同期は、OPO内部の遅延線をわずかに調整することによって迅速に確認することができる。キャリブレーションされた時間遅延データが最適値から遠く離れている場合は、ゼロスキャンを実行して、遅延マネージャダイアログの ゼロスキャン ボタンをクリックして遅延オフセットを再キャリブレーションする必要があります。ゼロスキャン手順全体は約10分かかります。位相および時間遅延値の最適化後にSRS信号が回復しない場合は、ステップ2.1.3~2.1.4の説明に従ってストークスビームのEOM変調をチェックする必要があります。ストークスパルス列のオフ位置で小さなパルスピークが観測された状態で消光比が10dBよりはるかに小さい場合は、EOMを再起動し、変調電力と位相を再調整して最大の変調深度を達成する必要があります。通常、変調の問題はEOMをリセットすることで解決できます。そうでない場合は、製造元からの技術サポートが必要です。
インビボ厚組織イメージングでは、epi-SRS検出モードを使用する必要があります。このプロトコルでは、PBSを使用して励起レーザを通過させ、後方散乱SRS信号を検出器に反射させます。検出されたSRL信号は、組織による順方向ポンプビームの後方散乱に依存する。励起レーザは直線偏光を有し、PBSを完全に通過することができるが、後方散乱ビームは偏光をシフトしているため、PBSによって部分的にしか反射できない。したがって、現在の信号収集方式は、対物レンズ12の前に環状光検出器を直接配置する戦略と比較して、低い効率を示す。それにもかかわらず、脂質が豊富な組織の強い散乱39のために、脊髄の高い信号対雑音比SRS画像(512 x 512ピクセル)を1〜2秒の積分時間で取得することができ、このPBSベースの収集スキームは脊髄イメージングのための適切なアプローチとなっている。しかし、その一方で、強い組織散乱は光の浸透深さを制限する。SRSおよびTPEFイメージングの両方について、脊髄のイメージング深さは約50μmに制限される。
SRSおよびTPEFイメージングのためのシーケンシャルイメージング手順は、現在のデュアルモーダルイメージング法の主な制限です。プロトコルでは、TPEFとSRSイメージングは、電動フリッパーを自動的に切り替えることによって、同じ場所で1秒間隔で順番に行われます。モーションアーチファクトは、TPEF画像とSRS画像の不完全なマージを引き起こす可能性があり、これは動物の呼吸および心拍によって大きく影響を受ける高度に動的なプロセスまたは組織を画像化するためのこの方法の能力を制限する。1つの可能な解決策は、SRSイメージング中にpsレーザー励起2光子蛍光を同時に収集することです9。しかし、この方法は、psパルスがfsパルスと比較してはるかに低い蛍光励起効率を有するため、強い蛍光シグナルを有する生物学的構造にのみ適用可能である14。あるいは、fs-SRSシステム22,40を使用することで、fsレーザ光源がSRS信号とTPEF信号の同時励起を効果的に可能にし、SRSイメージングのスペクトル分解能を低く抑えることで、この問題を解決することができます。別の解決策は、SRSイメージング中に得られたpsレーザー励起蛍光を基準として使用して、fs蛍光画像を登録することである。図3に示すように、この登録戦略は、SRSおよび蛍光イメージング中に有意な動きが起こらない場合にうまく機能します。
SRSは、その特異的な標識のない造影機構に基づいて生体分子の化学情報を提供するため、生物学的イメージングにおいて独自の利点を示す41。マルチモーダルNLOイメージングのためにTPEFと組み合わされたCARSと比較して、SRSはスペクトルおよび画像解釈能力が優れていました11。そのため、脂質9,11、タンパク質42,43、DNA44、アルキン(C≡C)13,45、炭素-重水素(C-D)9,46、酸素-重水素(O-D)結合を含む生体直交成分47,48のイメージングに広く応用されています。 生物学的組織において。このプロトコルでは、効率的な蛍光励起と高いラマンスペクトル分解能の利点を兼ね備えたPSSレーザー光源をSRSイメージングに、fsレーザー光源をTPEFイメージングに使用し、多様な生体分子の効果的な分化を可能にしました42,44。脊髄では、グリア細胞、ニューロン、およびリクルートされた免疫細胞を含む複雑な細胞-微小環境相互作用が、傷害49および疾患の進行に寄与する50。TPEF-SRS顕微鏡は、さまざまな蛍光およびSRSイメージングプローブと組み合わせることで、さまざまな細胞構造とその別個の生体分子成分の同時イメージングを実現でき、脊髄障害の発症と発症の理解を大幅に促進できます。
開示事項
著者らは開示するものは何もなく、競合する財政的利益もありません。
謝辞
この研究は、香港研究助成金評議会の助成金16103215、16148816、16102518、16102920、T13-607/12R、T13-706/11-1、T13-605/18W、C6002-17GF、C6001-19E、N_HKUST603/19、イノベーション技術委員会(ITCPD/17-9)、大学助成金委員会のエリア・オブ・エクセレンス・スキーム(AoE/M-604/16、AOE/M-09/12)、香港科技大学(HKUST)の助成金RPC10EG33を通じて支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| #2 Forceps | Dumont | 11223-20 | For laminectomy |
| 10X objective | Nikon | CFI Plan Apo Lambda 10X | |
| 25X objective | Olympus | XLPLN25XSVMP2 | |
| Burn cream | Betadine | ||
| Camera | Sony | α6300 | |
| Current amplifier | Stanford research | SR570 | |
| Current photomultiplier modules | Hamamatsu | H11461-01 | |
| D2 665 nm long-pass dichroic mirror | Semrock | FF665-Di02-25x36 | For directing epi-fluorescence signal to the detection module |
| D3 700 nm short-pass dichroic mirror | Edmund | 69-206 | For separating SRS from TPEF detection path |
| Depilating cream | Veet | ||
| FS1 975 nm short-pass filter | Edmund | 86-108 | For blocking stokes beam |
| FS1 Bandpass filter | Semrock | FF01-850/310 | For blocking stokes beam |
| Fs2 Bandpass filter | Semrock | FF01-525/50 | For selecting YFP signal |
| Fs2 Shortpass filter | Semrock | FF01-715/SP-25 | For blocking fs excitation laser beam |
| Half-wave plate | Thorlabs | SAHWP05M-1700 | |
| High-speed photodetector | MenloSystems | FPD 310-F | For checking Stokes beam modulation |
| Iodine | Betadine | ||
| IR Scope | FJW | FIND-R-SCOPE Infrared Viewer 2X Kit Model 84499C2X | |
| Iris | Thorlabs | CPA1 | |
| L1 | Thorlabs | AC254-060-B-ML | |
| L10 | Thorlabs | LA4052-A | |
| L2 | Thorlabs | LA1422-B | |
| L3 | Thorlabs | AC254-050-B | |
| L4 | Thorlabs | AC254-060-B-ML | |
| L7 | f=100 mm, AB coating | ||
| L8 | Thorlabs | LA4874-A | |
| L9 | Thorlabs | AC254-035-B-ML | |
| Lock-in amplifier | APE | ||
| Mirror | Thorlabs | PF10-03-P01 | |
| Motorized flipper | Thorlabs | MFF101/M | |
| multifunctional acquisition card | National Instrument | PCIe-6363 | |
| Oscilloscope | Tektronix | TDS2012C | |
| Photodiode | APE | For detecting SRS signal | |
| Picosecond laser source | APE | picoEmerald | |
| Polarizing beam splitter | Thorlabs | CCM1-PBS252/M | |
| Power meter | Newport | 843-R | |
| Saline | Braun | ||
| Scan lens L5 | Thorlabs | SL50-CLS2 | |
| Scanning mirror | Cambridge Technology | 6215H | |
| Silicone gel | World Precision Inc. | KWIK-SIL | |
| Ti:sapphire fs laser | Coherent | Chameleon Ultra II | |
| Tube lens L6 | Thorlabs | TTL200-S8 |
参考文献
- Raman, C. V., Krishnan, K. S. The optical analogue of the compton effect. Nature. 121 (3053), 711 (1928).
- Turrell, G., Corset, J. . Raman Microscopy: Developments and Applications. , (1996).
- Tian, F., et al. Monitoring peripheral nerve degeneration in ALS by label-free stimulated Raman scattering imaging. Nature Communications. 7 (1), 13283 (2016).
- Shi, Y., et al. Longitudinal in vivo coherent anti-Stokes Raman scattering imaging of demyelination and remyelination in injured spinal cord. Journal of Biomedical Optics. 16 (10), 106012 (2011).
- Hu, C. R., Zhang, D., Slipchenko, M. N., Cheng, J. -. X., Hu, B. Label-free real-time imaging of myelination in the Xenopus laevis tadpole by in vivo Stimulated Raman Scattering Microscopy. Journal of Biomedical Optics. 19 (8), 086005 (2014).
- Den Broeder, M. J., et al. Altered adipogenesis in Zebrafish larvae following high fat diet and chemical exposure is visualised by Stimulated Raman Scattering Microscopy. International Journal of Molecular Sciences. 18 (4), 894 (2017).
- He, S., et al. In vivo metabolic imaging and monitoring of brown and beige fat. Journal of Biophotonics. 11 (8), (2018).
- Wang, M. C., Min, W., Freudiger, C. W., Ruvkun, G., Xie, X. S. RNAi screening for fat regulatory genes with SRS microscopy. Nature Methods. 8 (2), 135-138 (2011).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by Stimulated Raman Scattering Microscopy. Analytical Chemistry. 91 (3), 2279-2287 (2019).
- Zhang, C., Li, J., Lan, L., Cheng, J. -. X. Quantification of lipid metabolism in living cells through the dynamics of lipid droplets measured by Stimulated Raman Scattering Imaging. Analytical Chemistry. 89 (8), 4502-4507 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by Stimulated Raman Scattering Microscopy. Science. 322 (5909), 1857-1861 (2008).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with Stimulated Raman Scattering. Science. 330 (6009), 1368-1370 (2010).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and Stimulated Raman Scattering Microscopy using a probe of the aggregation-induced emission characteristic. Journal of the American Chemical Society. 139 (47), 17022-17030 (2017).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Pawlicki, M., Collins, H. A., Denning, R. G., Anderson, H. L. Two-photon absorption and the design of two-photon dyes. Angewandte Chemie International Edition. 48 (18), 3244-3266 (2009).
- König, K. Multiphoton microscopy in life sciences. Journal of Microscopy. 200 (2), 83-104 (2000).
- Dean, K. M., Palmer, A. E. Advances in fluorescence labeling strategies for dynamic cellular imaging. Nature Chemical Biology. 10 (7), 512-523 (2014).
- Tsurui, H., et al. Seven-color fluorescence imaging of tissue samples based on fourier spectroscopy and singular value decomposition. Journal of Histochemistry & Cytochemistry. 48 (5), 653-662 (2000).
- Niehörster, T., et al. Multi-target spectrally resolved fluorescence lifetime imaging microscopy. Nature Methods. 13 (3), 257-262 (2016).
- Zhang, X., et al. Label-free live cell imaging of nucleic acids using Stimulated Raman Scattering (SRS) Microscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 13 (4), 1054-1059 (2012).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 7715 (2018).
- Li, X., et al. Integrated femtosecond stimulated Raman scattering and two-photon fluorescence imaging of subcellular lipid and vesicular structures. Journal of Biomedical Optics. 20 (11), 110501 (2015).
- Imitola, J., et al. Multimodal coherent anti-Stokes Raman scattering microscopy reveals microglia-associated myelin and axonal dysfunction in multiple sclerosis-like lesions in mice. Journal of Biomedical Optics. 16 (2), 021109 (2011).
- Uckermann, O., et al. Label-free multiphoton microscopy reveals altered tissue architecture in hippocampal sclerosis. Epilepsia. 58 (1), 1-5 (2017).
- Tamosaityte, S., et al. Inflammation-related alterations of lipids after spinal cord injury revealed by Raman spectroscopy. Journal of Biomedical Optics. 21 (6), 061008 (2016).
- Uckermann, O., et al. Endogenous two-photon excited fluorescence provides label-free visualization of the inflammatory response in the rodent spinal cord. BioMed Research International. 2015, 859084 (2015).
- van Hameren, G., et al. In vivo real-time dynamics of ATP and ROS production in axonal mitochondria show decoupling in mouse models of peripheral neuropathies. Acta Neuropathologica Communications. 7 (1), 1-16 (2019).
- Davalos, D., et al. Fibrinogen-induced perivascular microglial clustering is required for the development of axonal damage in neuroinflammation. Nature Communications. 3 (1), 1-15 (2012).
- Ylera, B., et al. Chronically CNS-injured adult sensory neurons gain regenerative competence upon a lesion of their peripheral axon. Current Biology. 19 (11), 930-936 (2009).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Lau, S. -. F., et al. IL-33-PU.1 transcriptome reprogramming drives functional state transition and clearance activity of microglia in Alzheimer's Disease. Cell Reports. 31 (3), 107530 (2020).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Scientific Reports. 5, 9691 (2015).
- Yang, Z., Xie, W., Ju, F., Khan, A., Zhang, S. In vivo two-photon imaging reveals a role of progesterone in reducing axonal dieback after spinal cord injury in mice. Neuropharmacology. 116, 30-37 (2017).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Totoiu, M. O., Keirstead, H. S. Spinal cord injury is accompanied by chronic progressive demyelination. Journal of Comparative Neurology. 486 (4), 373-383 (2005).
- Kopper, T. J., Gensel, J. C. Myelin as an inflammatory mediator: Myelin interactions with complement, macrophages, and microglia in spinal cord injury. Journal of Neuroscience Research. 96 (6), 969-977 (2018).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Pedrotti, F. L., Pedrotti, L. M., Pedrotti, L. S. . Introduction to Optics. , (2017).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), 37-61 (2013).
- Zhang, D., Slipchenko, M. N., Cheng, J. -. X. Highly sensitive vibrational imaging by Femtosecond Pulse Stimulated Raman Loss. The Journal of Physical Chemistry Letters. 2 (11), 1248-1253 (2011).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, label-free detection of brain tumors with Stimulated Raman Scattering Microscopy. Science Translational Medicine. 5 (201), (2013).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging. Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Yamakoshi, H., et al. Imaging of EdU, an Alkyne-tagged cell proliferation probe, by Raman Microscopy. Journal of the American Chemical Society. 133 (16), 6102-6105 (2011).
- van Manen, H. -. J., Lenferink, A., Otto, C. Noninvasive imaging of protein metabolic labeling in single human cells using stable isotopes and Raman Microscopy. Analytical Chemistry. 80 (24), 9576-9582 (2008).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nature Biomedical Engineering. 3 (5), 402-413 (2019).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Ahuja, C. S., et al. Traumatic spinal cord injury. Nature Reviews Disease Primers. 3 (1), 1-21 (2017).
- Lassmann, H. Multiple sclerosis pathology. Cold Spring Harbor Perspectives in Medicine. 8 (3), 028936 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved