Method Article
생체 내 결합 된 이광자 형광 및 자극 된 라만 산란 현미경을 사용한 생물학적 조직 이미징
요약
자극된 라만 산란(SRS) 현미경은 특정 화학 결합의 고유 진동을 기반으로 생체 분자의 라벨 없는 이미징을 가능하게 합니다. 이 프로토콜에서, 통합 SRS 및 이광자 형광 현미경의 도구 셋업은 살아있는 마우스의 척수에서 세포 구조를 시각화하기 위해 기술된다.
초록
자극된 라만 산란(SRS) 현미경 검사는 내재적 분자 진동을 기반으로 자연 미세환경에서 생물학적 조직을 라벨 없이 이미징할 수 있게 해줌으로써 세포 내 분해능에서 생물학적 과정에 대한 생체 내 연구를 위한 완벽한 도구를 제공합니다. 이광자 여기형광(TPEF) 이미징을 SRS 현미경에 통합함으로써 조직의 이중 모달 생체 내 이미징은 세포 대사, 면역 반응 및 조직 리모델링 등과 관련된 동적 과정을 이해하는 데 도움이 되는 다양한 관점에서 중요한 생화학 및 생물 물리학 정보를 획득할 수 있습니다. 이 비디오 프로토콜에서는 TPEF-SRS 현미경 시스템의 설정뿐만 아니라 동물 척수의 생체 내 이미징 방법이 도입됩니다. 척수는 중추 신경계의 일부로서 뇌와 말초 신경계 간의 의사 소통에 중요한 역할을합니다. 인지질이 풍부한 Myelin sheath는 축삭을 둘러싸고 절연하여 작용 잠재력의 염분 전도를 허용합니다. 척수에서 미엘린 외피의 생체 내 영상은 신경 퇴행성 질환 및 척수 손상의 진행을 연구하는 데 중요합니다. 이 프로토콜은 또한 고해상도 생물학적 이미지를 획득하기 위한 동물 준비 및 생체내 TPEF-SRS 이미징 방법을 기술한다.
서문
라만 현미경1,2는 생체 분자의 다양한 화학 결합의 특징적인 주파수를 기반으로 생물학적 조직을 이미지화하는 강력한 라벨 프리 방법으로 부상하고 있습니다. 비침습적이고 잘 적응하는 이미징 기능으로 인해 라만 현미경은 미엘린 외피3,4,5, 지방세포6,7 및 지질 방울8,9,10과 같은 생물학적 조직에서 지질 풍부 성분을 이미징하는 데 널리 사용되었습니다. . 자극된 라만 이득(SRG) 또는 자극된 라만 손실(SRL)로서 획득된 자극된 라만 산란(SRS) 신호는 배경이 없으며, 자발적인 라만 산란과 완벽한 스펙트럼 유사성을 나타낸다11,12. 또한, SRL 및 SRG는 분석물 농도에 선형적으로 의존하므로 생화학 성분9,11,13의 정량적 분석이 가능합니다. 이광자 여기된 형광 현미경(TPEF)은 고유의 광학 단면화 능력, 깊은 침투 깊이 및 낮은 광독성으로 인해 생체 내 생물학적 이미징에 널리 사용되어 왔습니다14,15,16. 그러나, TPEF 이미징의 성능은 형광 태그의 특성에 의존하며, 분해 가능한 색상의 수는 광대역 형광 스펙트럼8,17,18,19로 인해 제한된다. 라벨이 없는 SRS 이미징 및 형광 기반 TPEF 이미징은 두 가지 상보적인 이미징 방식이며, 이들의 조합은 조직의 풍부한 생물물리학적 및 생화학적 정보를 제공할 수 있다. 이 두 가지 이미징 방식은 모두 비선형 광학 (NLO) 프로세스를 기반으로하므로 하나의 현미경 시스템에서 간단하게 통합 할 수 있습니다. SRS와 TPEF 이미징, 소위 이중 모달 이미징의 조합은 세포와 조직의 고차원 이미징 및 프로파일 링을 가능하게하여 복잡한 생물학적 시스템에 대한 포괄적 인 이해를 용이하게합니다. 특히, 피코초(ps) SRS 현미경 검사는 펨토초(fs) SRS 기술11에 비해 높은 스펙트럼 분해능을 갖는 화학 결합 이미징을 달성할 수 있어, 생물학적 조직, 특히 혼잡한 지문 영역20,21에서 여러 생화학적 성분을 구별할 수 있다. 또한, 코히어런트 스토크스 산란(CARS) 현미경의 통합과 함께 일반적으로 사용되는 다른 이중 모달 NLO 현미경 시스템과 비교하여, SRS는 스펙트럼 및 이미지 해석 및 검출 감도 측면에서 CARS에 우수한 성능을 보여줍니다11. SRS-TPEF 현미경은 예쁜꼬마선 충9,22, 제노푸스 래비스 올챙이 뇌5, 마우스 뇌23,24, 척수25,26, 말초 신경27 및 지방 조직7 등과 같은 다양한 생물학적 시스템을 연구하는 강력한 도구로 사용되었습니다.
척수는 뇌와 함께 중추 신경계 (CNS)를 구성합니다. 생리학적 및 병리학적 조건 하에서 생체내 CNS에서의 세포 활성을 시각화하는 것은 CNS 장애28,29,30의 메카니즘을 이해하고 상응하는 치료법을 개발하는 데 매우 중요하다31,32,33. 고속 작용 전위 전도를 위해 축삭돌기를 감싸고 절연하는 Myelin sheath는 CNS 개발에 중요한 역할을합니다. 탈수초화는 다발성 경화증과 같은 백질 장애의 특징으로 생각된다34. 또한, 척수 손상 후35, 미엘린 파편은 대식세포 활성화를 조절하여 만성 염증 및 이차 손상에 기여할 수 있습니다36. 따라서, 살아있는 마우스 모델에서 뉴런 및 신경교세포와 함께 미엘린 외피의 생체내 영상화는 CNS 장애에서 역동적인 과정을 이해하는 데 큰 도움이 된다.
이 프로토콜에서는 자체 제작된 TPEF-SRS 현미경의 기본 설정 절차가 설명되고 마우스 척수에 대한 이중 모달 생체 내 이미징 방법이 도입됩니다.
프로토콜
이 작업에서 수행 된 모든 동물 절차는 홍콩 과학 기술 대학 (HKUST)의 실험실 동물 시설의 지침에 따라 수행되며 HKUST의 동물 윤리위원회의 승인을 받았습니다. TPEF-SRS 현미경을 설정하고 작동하려면 레이저 취급을 위한 안전 교육이 필요합니다. 레이저를 다룰 때는 항상 적절한 파장 범위의 레이저 안전 고글을 착용하십시오.
1. TPEF-SRS 현미경 설치(설정 회로도는 그림 1 참조)
- 모드 잠금 Ytterbium 파이버 레이저와 연결된 통합 광학 파라메트릭 발진기(OPO)를 SRS 이미징을 위한 ps 레이저 소스로 사용하십시오.
참고: OPO는 2ps 펄스 지속 시간 및 80MHz 반복률로 스톡스 빔(1031nm) 및 펌프 빔(780nm ~ 960nm에서 조정 가능)을 출력합니다. Stokes 빔은 MHz 레벨에서 고주파 위상 감지 SRS 검출을 위해 내장된 EOM(전기 광학 변조기)에 의해 20MHz에서 변조됩니다. - fs 티타늄 (Ti) : 사파이어 레이저를 TPEF 이미징을위한 레이저 소스로 사용하십시오.
- 한 쌍의 렌즈(L1 및 L2)를 사용하여 fs 빔의 크기를 시준하고 3mm로 조정합니다.
- 한 쌍의 렌즈 (L3 및 L4)를 사용하여 ps 레이저 빔을 시준하고 직경을 3mm로 확장하십시오.
- 반파 플레이트를 사용하여 fs 레이저 빔의 편광을 p 분극에서 s 분극으로 변경하십시오.
- 두 레이저 빔을 편광 빔 스플리터(PBS)와 결합합니다.
- 빔 스캔을 위해 PBS 뒤에 3mm XY 스캔 갈바노미터 미러 한 쌍을 추가합니다.
- 텔레센트릭 스캔 렌즈(L5)와 무한대 보정 튜브 렌즈(L6)를 사용하여 스캐닝 미러와 25x 대물 렌즈의 후방 동공을 결합합니다. 스캔 렌즈와 튜브 렌즈로 레이저 빔을 확장하여 목표물의 뒤쪽 조리개를 채 웁니다.
- SRS 또는 형광 신호 수집을 위해 튜브 렌즈와 대물 렌즈 사이에 PBS 또는 이색성 미러(D2)를 배치한다. 전동 플리퍼를 사용하여 PBS와 D2 사이를 전환합니다.
참고: 후방 산란된 SRS 신호의 일부는 랜덤하게 시프트된 편광의 결과로 PBS를 통과할 때 손실됩니다. - 한 쌍의 렌즈(L7 및 L9)를 사용하여 감지 빔을 좁히고 25x 대물 렌즈의 후방 동공을 광 다이오드 센서와 결합합니다.
- 한 쌍의 렌즈(L8 및 L10)를 사용하여 감지 빔을 좁히고 25x 대물대의 후방 동공을 광승수(PMT)의 검출 표면과 결합시킵니다.
- 이색성 미러(D3)를 사용하여 형광 및 SRS 신호의 검출 경로를 분리한다.
- 필터 세트(Fs1)를 광 다이오드 검출기 앞에 배치하여 스토크스 레이저를 차단하고 펌프 빔만 통과시킵니다.
- PMT 검출기 앞에 필터 세트(Fs2)를 배치하여 표적 형광 신호만을 통과시킨다.
- 신호 증폭을 위해 PMT를 전류 증폭기에 연결합니다.
- 광 다이오드를 잠금 증폭기에 연결합니다.
- 내장 EOM 출력의 싱크 신호를 SRS 신호 복조를 위한 록인 증폭기의 기준 입력에 연결합니다.
- PMT 증폭기 및 록인 증폭기 출력을 데이터 수집 모듈에 연결합니다.
2. TPEF-SRS 현미경 시스템 교정
- 레이저의 시동
- 키 스위치를 대기 모드에서 켜 짐 위치로 전환하여 Ti: 사파이어 레이저를 켜고 레이저가 예열될 때까지 30분 동안 기다립니다.
- OPO 제어판에서 시작 버튼을 클릭하여 OPO를 켜고 레이저가 예열될 때까지 20분 동안 기다립니다.
- ps 레이저가 예열되면 고속 광검출기를 사용하여 스토크스 빔의 변조 깊이를 확인하십시오. 스토크스 빔의 레이저 셔터를 엽니다. OPO 전원 설정 상자를 클릭하고 20을 입력합니다. 고속 광검출기를 OPO 출력에 배치하여 빔을 감지합니다. Bayonet Neill-Concelman(BNC) 커넥터가 있는 동축 케이블을 사용하여 광검출기의 출력 포트를 오실로스코프의 입력 포트에 연결하여 레이저 펄스를 모니터링합니다.
- OPO 제어 소프트웨어에서 EOM 제어 창을 엽니다. 오실로스코프에 표시된 펄스 강도 다이어그램에 따라 EOM 전력 및 위상을 조정하여 20MHz에서 최대 변조 깊이를 달성하십시오.
참고: EOM 성능은 일반적으로 안정적이며 SRS 신호가 크게 감소한 경우에만 확인하면 됩니다.
- 결합된 TPEF-SRS 현미경의 광학 정렬
- 단계 2.2.2 내지 2.2.13에 설명된 바와 같이 ps 및 fs 빔의 공국소화를 위한 광학 정렬을 수행한다.
- OPO 제어 소프트웨어에서 Stokes 출력을 중지하면서 펌프 레이저 셔터를 엽니다. OPO 제어 소프트웨어를 사용하여 신호 설정 상자를 클릭하고 파장 값(796)을 입력하여 펌프 빔의 파장을 796nm로 설정합니다 . OPO 전원 설정 상자를 클릭하고 20을 입력하여 광 정렬을 위해 전력을 최소(~20mW)로 설정합니다.
- 현미경 컴퓨터와 스캐너, 대물 액추에이터, 광 다이오드, PMT, 전류 증폭기, 잠금 증폭기 및 전동 플리퍼를 포함한 모든 관련 전자 부품을 켭니다. 현미경 제어 소프트웨어를 시작합니다.
참고: 현미경 제어 소프트웨어는 수제 인터페이스입니다. - 두 개의 정렬 플레이트(그림 1의 P1 및 P2)를 광 경로에 놓습니다. P1을 PBS 뒤에 약 10cm 떨어진 곳에 놓고 P2를 P1 뒤에 약 30cm 떨어진 곳에 놓습니다.
참고: ps 및 fs 빔은 PBS를 사용하여 결합됩니다(그림 1). 두 개의 정렬 플레이트는 두 레이저 빔의 공동 위치화뿐만 아니라 정렬을 확인하는 데 사용됩니다. - ps 레이저 빔의 현미경 셔터를 엽니다.
- 미러 M1을 조정하여 P1의 관통 구멍에서 ps 레이저 빔 중심을 찾습니다. 적외선(IR) 범위를 사용하여 미러 M1을 조정할 때 P1에서 빔 스폿의 위치를 관찰합니다.
- 미러 M2를 조정하여 P2의 관통 구멍에서 ps 레이저 빔 중심을 찾습니다. 미러 M2를 조정할 때 IR 스코프를 사용하여 P2에서 빔 스폿의 위치를 관찰하십시오.
- ps 빔 중심이 두 정렬 플레이트의 관통 구멍에 위치할 때까지 2.2.6단계와 2.2.7단계를 반복합니다. 현미경 제어 소프트웨어에서 ps 빔의 셔터를 닫습니다.
- fs Ti: 사파이어 레이저의 파장을 740nm로 설정하고 레이저 셔터를 엽니다. 광학 정렬을 위해 레이저 파워를 5mW(현미경 시스템의 입력 포트에서 측정)로 설정합니다.
- fs 레이저 빔의 현미경 셔터를 엽니다.
- 미러 M3을 조정하여 P1의 스루홀에서 fs 레이저 빔 스폿 중심을 찾습니다.
- 미러 M4를 조정하여 P2의 관통 구멍에서 레이저 빔 스폿 중심을 찾습니다.
- fs 레이저 빔 중심이 두 정렬 플레이트의 스루홀에 위치할 때까지 2.2.11단계와 2.2.12단계를 반복합니다. fs 빔의 현미경 셔터를 닫습니다.
- 단계 2.2.15 내지 2.2.18에 설명된 대로 펌프와 스토크스 빔의 공간 중첩을 수행한다.
참고: 펌프와 스토크스 빔은 ps 레이저 내부에서 대략 겹쳐지지만 최적의 SRS 성능을 얻으려면 두 레이저 빔의 위치를 미세 조정해야 합니다. 펌프 빔이 앞서 설명된 바와 같이 먼저 정렬되기 때문에, 다음으로 스톡스 빔은 펌프 빔과 함께 지역화되도록 조정된다. - 목표의 위치에 카메라를 배치하여 두 개의 빔 지점의 위치를 시각화합니다. 카메라 화면에서 펌프 빔의 위치를 참조로 표시합니다.
- L3 앞에 정렬 플레이트 P0을 놓습니다(그림 1). 육각 키를 사용하여 옵티컬 미러 1(OM1)을 조정하여 스토크스 빔 센터가 정렬 플레이트의 스루홀을 통과하고 레이저 출력 포트에서 펌프 빔과 공동 로컬화되도록 합니다. IR 범위를 사용하여 조정 중에 P0에서 빔 스폿의 위치를 확인합니다.
참고: OM1 및 OM2는 OPO 헤드에 있는 두 개의 미러로, 1031nm 스토크스 빔의 위치를 조정합니다. - 정렬 플레이트 P0을 분리하고 육각 키를 사용하여 OM2를 조정하여 스토크스 빔의 중심이 카메라의 펌프 빔의 참조 마크와 함께 공국화되도록 합니다.
- Stokes 빔이 P0 및 카메라 평면 모두에서 펌프 빔과 엄격하게 겹칠 때까지 2.2.16 및 2.2.17단계를 반복합니다.
참고: 카메라의 빔 스폿을 시각화할 때는 광학 경로에서 모든 정렬 플레이트를 제거해야 합니다.
- 이미징 조건 최적화
- 2.3.2단계에서 설명한 대로 lock-in 증폭기의 위상 조정을 수행합니다. 에 2.3.7.
참고: SRS 감지는 고주파 위상 감지 방식을 기반으로 합니다. SRL 검출을 위해, 스토크스 빔의 강도는 20MHz에서 변조되고 록인 증폭기는 신호를 복조하는 데 사용된다. 잠금 증폭기의 위상과 오프셋은 최적의 이미지 대비를 달성하기 위해 조정되어야 합니다. - 잠금 증폭기 제어 소프트웨어를 엽니다.
- 펌프 레이저의 파장을 796nm로 설정하고 펌프와 스토크스 빔의 전력을 샘플에서 각각 15mW 및 25mW로 설정합니다.
참고: SRS 이미징 최적화 및 교정을 위해 올리브 오일을 사용하십시오. 탄소 수소 영역에서 올리브 오일의 라만 피크는 2863.5cm-1이며, 796nm에서의 펌프 빔 파장에 해당합니다. - 슬라이드에 올리브 오일을 밀봉하고 접힌 티슈 페이퍼를 슬라이드 바닥에 부착하여 epi-SRS 검출을 위한 신호 후방 산란을 강화합니다. 올리브 오일 샘플을 무대에 놓고 25x 목표의 초점을 샘플에 조정하십시오.
- 현미경 제어 소프트웨어를 사용하여 이미징 파라미터를 다음과 같이 설정합니다: 500 μm x 500 μm 시야각(FOV)에 대해 512 x 512 픽셀, 6.4 μs 픽셀 드웰 시간. 록인 증폭기 제어 소프트웨어를 사용하여 픽셀 유지 시간에 가까운 시간 상수 값을 10μs로 설정합니다.
- 샘플 위로 레이저 빔을 스캔합니다. 록인 증폭기 제어 소프트웨어를 사용하여 SRS 신호 강도가 최대에 도달할 때까지 스텝 크기가 22.5°인 위상(0-180°)을 튜닝할 수 있습니다.
참고: 이 모든 아날로그 잠금 증폭기에서 신호 출력은 기준 신호의 위상에 따라 달라지는 동위상 구성 요소입니다. 위상은 11° 분해능의 록인 증폭기 제어 소프트웨어로 조정할 수 있으므로 검출된 신호를 ~2%12 이내로 최대화할 수 있습니다. 록인 증폭기는 싱크 신호가 중단되면 위상을 벗어납니다. 동기화 신호가 다시 설정될 때마다 위상을 재조정해야 합니다. - 레이저 셔터를 닫은 상태로 샘플을 스캔합니다. 록인 증폭기 제어 소프트웨어를 사용하여 평균 SRS 신호가 0에 가까워질 때까지 1mV의 스텝 크기로 오프셋 값을 튜닝합니다.
참고: 평균 SRS 신호는 현미경 제어 소프트웨어에 의해 자동으로 계산되는 SRS 이미지의 모든 픽셀의 평균 강도로 추정됩니다. 오프셋은 원치 않는 위상 일관성 신호를 취소하는 데 유용합니다. - 2.3.9 ~ 2.3.14단계에 설명된 대로 시간 동기화 최적화를 수행합니다.
- OPO 제어 소프트웨어에서 지연 관리자 대화 상자(그림 2)를 엽니다.
- 올리브 오일을 스캔하고 올리브 오일 SRS 신호가 최대에 도달 할 때까지 지연 단계를 조정하십시오.
참고: SRS 이미징의 첫 번째 경우, 록인 증폭기의 위상이 최적화되지 않은 경우, 잠금 증폭기의 위상을 최적화하기 전에 먼저 샘플의 SRS 신호를 시각화하도록 시간 동기화가 대략적으로 조정됩니다. - 스캔을 중지하고 지연 관리자 대화 상자에서 데이터 추가 버튼을 클릭하여 현재 지연 데이터를 기록하십시오.
- 2.3단계를 반복합니다. 10 및 2.3.11 다른 파장에서 서로 다른 화학 샘플.
참고: 폴리스티렌 비드, 중수, 5-에티닐-2'-데옥시우리딘, 글리세롤은 다른 진동 대역에서 지연 데이터를 측정하는 데 사용됩니다. - 지연 관리자 대화상자에서 데이터 적합 및 순서 5를 선택하여 현재 데이터 요소를 다섯 번째 순서 다항식 함수에 맞춥니다. 사용자 지정으로 사용 단추를 클릭하고 확인란을 선택하여 적합한 데이터를 적용합니다. 지연 단계는 적합 지연 곡선에 따라 다른 파장에서 자동 조정됩니다.
- 모든 지연 데이터를 텍스트 파일에 저장하면 나중에 사용할 수 있도록 로드할 수 있습니다.
- 2.3.2단계에서 설명한 대로 lock-in 증폭기의 위상 조정을 수행합니다. 에 2.3.7.
3. 생체내 형광 및 SRS 영상화를 위한 마우스의 외과적 준비
- 메스, 스프링 가위, 포셉, 커버슬립 및 거즈 패드를 포함하여 필요한 모든 도구를 멸균하십시오.
- 70 % 에탄올로 수술 중에 만질 수있는 모든 표면을 소독하십시오. 벤치 탑의 작업 영역을 멸균 커튼으로 덮으십시오. 커튼 아래에 가열 패드를 넣으십시오.
- 생체 내 척수 영상화를 위해 등쪽 뿌리 신경절 구심성 뉴런에서 향상된 황색 형광 단백질 (EYFP)을 발현하는 Thy1-YFP-H (Tg(Thy1-YFP)HJrs/J)37 트랜스제닉 마우스를 사용하십시오. 마우스를 계량하고, 케타민-자일라진 혼합물 (87.5 mg kg-1 및 12.5 mg kg-1)의 복강내 (i.p.) 주사에 의해 마취를 유도하였다.
- 깊은 마취를 보장하기 위해 마우스의 발가락을 꼬집습니다. 필요한 경우 마취제의 원래 복용량의 절반으로 보충하십시오. 각막 건조를 방지하기 위해 마우스 눈에 연고를 바르십시오.
- 흉추 뒤쪽의 머리카락을 면도하고 제모 크림을 사용하여 머리카락을 완전히 제거하십시오. 면도 된 부위를 요오드 용액으로 소독하십시오.
- 메스로 T11-T13 척추 위에 피부의 작은 중간 선 절개 (~ 1.5cm)를하십시오.
- T11-T13 척추의 위쪽과 옆구리에 근육과 힘줄을 스프링 가위와 집게로 절개하십시오. 인접한 세 개의 척추를 노출시킵니다. 멸균 거즈 패드와 멸균 식염수를 사용하여 출혈을 조절하고 수술 부위를 청소하십시오.
- 맞춤 설계된 안정화 단계에서 두 개의 스테인리스강 사이드바를 사용하여 척추를 안정화시킵니다(그림 2B).
- #2 포셉을 사용하여 T12에서 laminectomy를 수행하십시오. T12 척추의 전체 라미나가 제거 될 때까지 포셉을 조심스럽게 사용하여 라미나 조각을 조각으로 부러 뜨립니다.
- 멸균 식염수로 척수 위에 놓인 혈액을 씻어 내고 거즈 패드를 사용하여 과도한 체액을 흡수하십시오. 출혈을 조절하기 위해 거즈 패드 조각으로 출혈 부위에 압력을 가하십시오.
- 클램핑 바에 커버슬립(22 x 22mm)을 놓고 커버슬립과 척수 사이의 간격을 식염수로 채 웁니다.
4. 마우스 척수의 생체 내 TPEF-SRS 영상
- 안정화 단계를 TPEF-SRS 현미경 아래의 다섯 축 스테이지에 장착합니다.
참고: 5축 스테이지는 3축 변환 및 ±5° 피치 및 롤 굴곡 동작을 허용합니다. - 두 개의 헤드 바를 사용하여 마우스 헤드를 고정하고 홀딩 플레이트를 내려 호흡 중 가슴 움직임을위한 충분한 공간을 제공하여 모션 아티팩트를 완화시킵니다.
- 마우스 아래에 가열 패드를 삽입하여 이미징 중에 마우스를 따뜻하게 유지합니다.
- 척수 혈관구조의 밝은 필드 이미지가 10x 목표 하에서 관찰될 수 있을 때까지 초점을 조정하도록 z 번역 단계를 조정한다.
- 다섯 축 단계의 두 축 번역 단계를 조정하여 FOV의 중앙에 척수 등정맥을 찾습니다.
- 다섯 축 스테이지의 롤 및 피치 각도를 조정하여 밝은 필드 이미지를 기반으로 척수 등쪽 표면을 목표 축에 수직으로 조정합니다.
- 10x를 TPEF-SRS 이미징을 위한 25x 수침 목표로 교체합니다.
- fs 빔의 파장을 920nm로 설정합니다. 샘플에서 fs 빔 전력을 10mW로 조정합니다.
- 펌프 빔의 파장을 796nm로 설정합니다. 펌프와 스토크스 빔의 전력을 샘플에서 각각 60mW 및 75mW로 조정합니다.
참고: 척수 SRS 이미징은 2863.5 cm-1의 파수에서 수행되며, 이는 측정된 SRS 스펙트럼7,9에 기초한 탄소-수소 영역에서의 미엘린 시스의 라만 피크에 해당한다. 레이저 파워는 척수의 고해상도 TPEF-SRS 이미징을 보장하기 위해 결정됩니다. 조직 손상은 현재 이미징 조건에서는 관찰되지 않습니다. - SRS 이미징의 경우 전동 플리퍼에 연결된 스위치 버튼을 눌러 전동 플리퍼를 사용하여 목표 위의 PBS를 선택합니다.
- 이미징 파라미터를 다음과 같이 설정하십시오: 150 μm x 150 μm FOV에 대해 512 x 512 픽셀, 3.2 μs 픽셀 드웰 시간, 2 μs 시간 상수.
- 샘플 스캔을 시작하고 척수의 등쪽 표면에 초점을 맞춥니다.
- 최대 척수 SRS 신호가 달성될 때까지 OPO 제어 소프트웨어에 의해 지연 단계를 미세하게 조정하십시오.
참고: 생물학적 샘플은 추가적인 색채 분산을 유도할 수 있으며, 지연 단계는 시간적 동기화를 최적화하기 위해 조정되어야 할 수도 있다. 그러나, SRS 이미징이 조직 상부 표면 근처에서 수행될 때, 생물학적 조직과 이미징 윈도우에 의해 도입된 두 레이저 펄스의 시간적 차이는 일반적으로 작다(수백 fs 미만). - TPEF 이미징의 경우, 전동 플리퍼에 연결된 스위치 버튼을 눌러 전동 플리퍼를 사용하여 목표 위의 이색성 미러 D2를 선택합니다.
- 이미징 파라미터를 설정하고 샘플 스캔을 시작합니다. TPEF-SRS 이미지 스택을 캡처하려면 다음 깊이로 이동하기 전에 동일한 깊이에서 1s 간격으로 TPEF 및 SRS 이미지를 순차적으로 획득합니다. TPEF 이미징을 위한 이미징 파라미터는 512 x 512 픽셀, 150 μm x 150 μm FOV, 3.2 μs 픽셀 드웰 시간이다.
- 모든 이미지가 수집 된 후 안정화 단계에서 동물을 제거하십시오.
- 식염수를 플러싱하여 노출 된 조직을 청소하고 거즈 패드를 사용하여 과도한 유체를 흡수하십시오. 노출 된 척수에 실리콘 젤을 바르고 완치 될 때까지 ~ 5 분 동안 기다리십시오.
- #6-0 수술 봉합사로 피부를 봉합하여 상처를 닫습니다. 감염을 예방하기 위해 수술 부위의 피부에 화상 크림을 바르십시오. 진통 치료를 피하 (0.1 mg / kg buprenorphine)로 투여하십시오.
- 동물을 깨끗한 케이지에 넣고 마우스가 마취에서 완전히 회복 될 때까지 케이지를 가열 패드에 놓습니다.
- 수술 후 3 일 동안 12 시간마다 진통 투여를 반복하십시오.
- OPO 및 fs 레이저의 셔터를 닫습니다. 펌프와 스토크스 빔의 힘을 최대로 설정하십시오.
참고: 레이저를 끄기 전에 최대 전력을 설정하는 것은 레이저 유지 보수에 유용합니다. - 펌프 빔과 fs 레이저의 파장을 800nm로 설정합니다.
- 두 레이저를 대기 상태로 설정하고 모든 전자 제어 소프트웨어를 닫은 다음 관련된 모든 장비를 끕니다.
결과
미엘린 외피뿐만 아니라 척추 축색돌기의 생체내 이중 모달 영상은 등쪽 뿌리 신경절 구심성 뉴런에서 EYFP를 발현하는 Thy1-YFPH 형질전환 마우스를 사용하여 수행된다(도 3). 이 표지 된 구심성 뉴런은 말초 신경에서 척수로 감각 정보를 전달하며, 중앙 지점은 척수 등쪽 기둥에 위치합니다. TPEF-SRS 현미경을 사용하면 조밀하게 분포된 미엘린 시스를 라벨이 없는 SRS 이미징을 사용하여 명확하게 시각화할 수 있으며, TPEF 이미징을 사용하여 드물게 표지된 YFP 축색돌기를 관찰할 수 있습니다. 이중 모델 이미징에 의해 축삭이 미엘린 칼집의 두꺼운 층으로 밀접하게 감싸여 있음이 밝혀졌습니다 (그림 3C). 액솔레마가 미엘린 외피의 맨손인 랜비어(NR)의 노드는 작용 전위의 빠른 염분 전파에 필수적인 역할을 한다. TPEF-SRS 척수 이미지에서 알 수 있는 바와 같이(도 3C), NR은 세포외 매트릭스에 직접 노출된 축삭 직경 및 액솔레마 감소를 보여준다. NR의 존재와 위치를 확인하기 위해 주변 미엘린 외피와 함께 축삭을 이미지화하는 것이 필수적입니다. 따라서 TPEF-SRS 현미경 검사는 척수 장애의 발달에서 축삭 돌기 및 미엘린 외피의 동적 변화를 관찰 할 수있게 해주 며, 이는 세포 역학의 메커니즘을 이해하는 데 중요합니다.

그림 1: TPEF-SRS 현미경 시스템의 개략도. 펌프 및 스토크스 빔은 피코초(ps) 레이저의 이색성 미러(D1)와 결합된다. ps 빔 및 펨토초(fs) 빔은 3mm XY 스캔 갈바노미터 미러와 일치하도록 한 쌍의 렌즈(각각 L3, L4 및 L1, L2)에 의해 시준되고 확장/좁아집니다. fs 빔은 반파 플레이트 (HWP)에 의해 수평에서 수직 편광으로 회전 한 다음 편광 빔 스플리터 (PBS)에 의해 ps 빔과 결합됩니다. 스캐닝 미러와 대물 렌즈의 후방 동공은 텔레센트릭 스캔 렌즈 L5와 무한대 보정 튜브 렌즈 L6에 의해 접합됩니다. 레이저 빔은 스캔 및 튜브 렌즈에 의해 확장되어 25x 목표의 후면 조리개를 채 웁니다. 자극된 라만 산란(SRS) 영상화를 위해, 목적에 의해 수집된 후방 산란 펌프 빔은 PBS에 의해 반사되고 넓은 영역(10 mm x 10 mm) 실리콘 광다이오드(PD)로 향하게 된다. 2광자 이미징의 경우, 이광자 여기형광(TPEF) 신호는 이색성 빔 스플리터 D2에 의해 광검출 유닛으로 반사된다. 전류 광승수(PMT) 모듈은 TPEF 신호를 감지하는 데 사용됩니다. 약어 - L1-L10 : 렌즈; OL: 대물렌즈; D1-D3: 이색성 거울; Fs1, Fs2: 필터 세트; M: 거울; OM1, OM2: 광학 미러; P0-P2: 정렬 플레이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
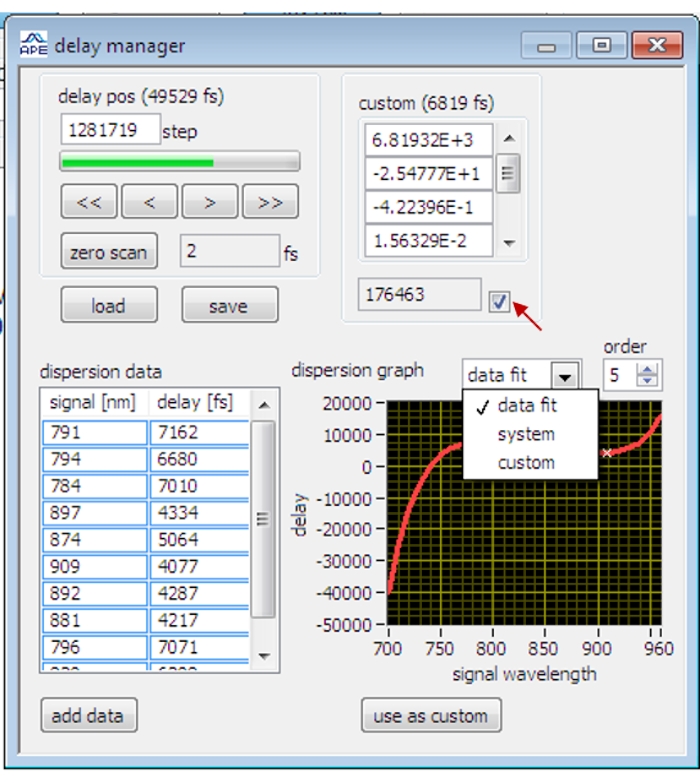
그림 2: OPO 제어 소프트웨어에 있는 지연 관리자의 인터페이스. 빨간색 화살표는 보정된 지연 데이터를 적용하기 위한 확인란을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
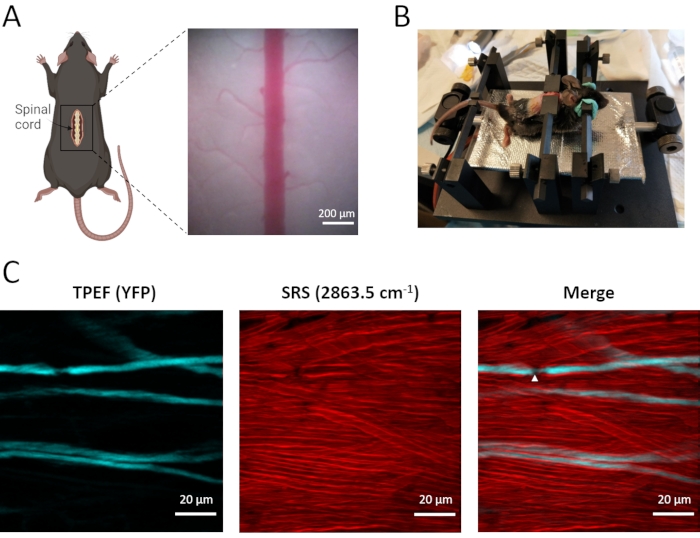
도 3: 마우스 척수의 생체내 TPEF-SRS 영상화. (a) 마우스 척수의 수술 준비 및 척수의 밝은 필드 이미지의 개략도. (b) 척수의 생체내 영상화를 위한 마우스 장착 방식. (C) 마우스 척수에서 축삭돌기와 미엘린 외피의 최대 z 투사 이미지. 흰색 화살촉은 Ranvier 노드의 위치를 나타냅니다. 미엘린의 SRS 이미지는 2863.5 cm-1의 라만 시프트에서 촬영됩니다. 도 A는 바이오렌더(https://biorender.com/)를 사용하여 생성되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜에서, TPEF-SRS 현미경의 기본 셋업이 상세히 설명된다. SRS 이미징의 경우, 펌프와 스토크스 빔은 OPO 내부에서 시간적으로나 공간적으로 겹쳐집니다. 그러나, 이러한 중첩은 현미경 시스템을 통과한 후에 중단될 수 있다. 따라서 펌프와 스토크스 빔의 공동 현지화에 대한 공간적 및 시간적 최적화가 모두 최적의 SRS 이미징을 달성하는 데 필요하고 중요합니다. 펌프와 스토크스 빔 사이의 시간적 지연은 두 빔의 광학 경로 차이와 관련이 있으며, 이는 현미경 시스템38에서 광학 요소의 분산에 의해 결정된다. 펌프 빔의 파장이 상이한 라만 시프트에서 SRS 이미징을 위해 튜닝될 때, 펌프 빔의 광 경로 길이는 광학 렌즈의 굴절률이 파장에 의존하기 때문에 그에 따라 변한다38. 따라서 펌프와 스토크스 레이저 펄스 사이의 시간적 지연은 펌프 빔의 파장에 따라 변하므로 보정이 필요합니다. OPO에는 펌프와 스토크스 빔의 시간적 동기화를 위한 소프트웨어 제어 지연 라인이 장착되어 있습니다. 동일한 광학 설정의 경우 지연 데이터는 안정적으로 유지되며 한 번만 보정하면 됩니다. 결과적으로, 펌프 빔의 상이한 파장에서의 지연 데이터는 장래의 사용을 위해 첫 번째 측정에서 저장될 수 있다. 보정된 지연 데이터는 펌프 빔의 파장이 변경될 때 OPO 제어 소프트웨어에 의해 자동으로 적용될 수 있으며, 이는 상이한 라만 시프트 또는 하이퍼스펙트럼 SRS 이미징에서의 SRS 이미징에 편리하다. TPEF-SRS 이미징의 경우, 조합 후 ps 및 fs 빔의 엄격한 공간 중첩은 두 이미징 모델 간의 FOV 이동을 피하기 위한 중요한 단계입니다. 첫째, ps 펌프 빔과 fs 빔은 둘 다 현미경 시스템의 광축에 있는지 확인하기 위해 정렬되며, 이는 두 이미징 모델을 전환 할 때 FOV 이동을 피하는 데 중요합니다. 그런 다음 펌프 빔을 참조로 사용하여 Stokes 빔 위치가 그에 따라 조정되어 엄격한 공간 공동 현지화를 달성합니다. 각 정렬 절차에는 최적에 도달하기 위해 여러 번의 시도가 필요합니다.
SRS 신호가 크게 감소하는 경우, 록인 증폭기의 위상 값 및 시간 지연 데이터를 먼저 점검해야 한다. 싱크 신호가 중단되면 록인 증폭기가 위상을 벗어나기 때문에 위상 값은 전원 공급 장치 또는 EOM 동기 신호가 중단된 후 매번 다시 조정해야 합니다. 펌프와 스토크스 빔의 시간적 동기화는 OPO 내부의 지연 라인을 약간 조정하여 신속하게 확인할 수 있습니다. 보정된 시간 지연 데이터가 최적 값에서 멀리 떨어져 있는 경우 제로 스캔을 수행하여 지연 관리자 대화상자에서 제로 스캔 버튼을 클릭하여 지연 오프셋을 재보정해야 합니다. 전체 제로 스캔 절차는 약 10 분이 걸립니다. 위상 및 시간 지연 값의 최적화 후 SRS 신호가 복구되지 않으면 단계 2.1.3-2.1.4에 설명된 대로 스토크스 빔의 EOM 변조를 검사해야 합니다. Stokes 펄스 트레인의 오프 위치에서 작은 펄스 피크를 관찰하여 소멸비가 10dB 미만인 경우, EOM을 다시 시작해야 하며, 최대 변조 깊이를 달성하기 위해 변조 전력과 위상을 재조정해야 합니다. 일반적으로 변조 문제는 EOM을 재설정하여 해결할 수 있습니다. 그렇지 않은 경우 제조업체의 기술 지원이 필요합니다.
생체내 두꺼운 조직 영상화를 위해, epi-SRS 검출 모드가 사용되어야 한다. 이 프로토콜에서, PBS는 여기 레이저를 통과시키고 후방 산란된 SRS 신호를 검출기에 반사하는데 사용된다. 검출된 SRL 신호는 조직에 의한 전방 펌프 빔의 후방 산란에 의존한다. 여기 레이저는 선형 분극을 가지며 PBS를 완전히 통과 할 수 있지만 후방 산란 빔은 편광을 이동시켜 PBS에 의해 부분적으로 만 반사 될 수 있습니다. 따라서, 현재의 신호 수집 방식은 목표12 앞에 환형 광검출기를 직접 배치하는 전략에 비해 낮은 효율을 나타낸다. 그럼에도 불구하고, 지질이 풍부한 조직39의 강한 산란으로 인해, 척수의 높은 신호-대-잡음비 SRS 이미지(512 x 512 픽셀)는 1-2 s 통합 시간으로 획득될 수 있고, 이러한 PBS 기반 수집 방식은 척수 영상화에 적합한 접근법이다. 그러나 다른 한편으로는, 강한 조직 산란은 빛의 침투 깊이를 제한한다. SRS 및 TPEF 이미징 둘 다의 경우, 척수에 대한 이미징 깊이는 약 50 μm로 제한된다.
SRS 및 TPEF 이미징을 위한 순차적 이미징 절차는 현재 듀얼 모달 이미징 방법의 주요 한계입니다. 이 프로토콜에서 TPEF 및 SRS 이미징은 전동 플리퍼를 자동으로 전환하여 1s 간격으로 동일한 위치에서 순차적으로 수행됩니다. 모션 아티팩트는 TPEF 및 SRS 이미지의 불완전한 병합을 야기할 수 있으며, 이는 동물의 호흡 및 심장 박동에 의해 크게 영향을 받는 매우 역동적인 과정 또는 조직을 영상화하기 위한 이 방법의 능력을 제한한다. 한 가지 가능한 해결책은 SRS 이미징 동안 ps 레이저 여기된 이광자 형광을 동시에 수집하는 것이다9. 그러나, 이 방법은 ps 펄스가 fs pulse14에 비해 훨씬 낮은 형광 여기 효율을 갖기 때문에 강한 형광 신호를 갖는 생물학적 구조에만 적용가능하다. 대안적으로, 문제는 fs-SRS 시스템22,40을 사용함으로써 해결될 수 있는데, 여기서 fs 레이저 소스는 SRS 이미징의 낮은 스펙트럼 분해능을 희생시키면서, SRS 및 TPEF 신호들의 동시 여기 효과를 효과적으로 허용한다. 또 다른 해결책은 SRS 이미징 동안 얻어진 ps 레이저 여기된 형광을 fs 형광 이미지를 등록하기 위한 참조로서 사용하는 것이다. 그림 3에 나타난 바와 같이, 이 등록 전략은 SRS 및 형광 이미징 동안 유의한 움직임이 발생하지 않는 경우에 잘 작동한다.
SRS는 특정 라벨이 없는 대조 메커니즘에 기초하여 생체분자의 화학적 정보를 제공하기 때문에 생물학적 이미징에서 독특한 이점을 나타낸다41. 멀티모달 NLO 이미징을 위해 TPEF와 결합된 CARS와 비교했을 때, SRS는 더 나은 스펙트럼 및 이미지 해석 능력을 보였다11. 따라서, 지질9,11, 단백질42,43, DNA44 및 알킨(C≡C)13,45, 탄소-중수소(C-D)9,46 및 산소-중수소(O-D) 결합을 포함하는 생체직교 성분을 이미징하는 데 널리 적용되어 왔다47,48 생물학적 조직에서. 이 프로토콜에서는 SRS 이미징을 위한 ps 레이저 소스와 TPEF 이미징을 위한 fs 레이저 소스를 사용했는데, 이는 효율적인 형광 여기와 높은 라만 스펙트럼 분해능의 장점을 결합하여 다양한 생체분자42,44를 효과적으로 분화시킬 수 있게 했습니다. 척수에서, 신경교세포, 뉴런 및 모집된 면역 세포를 포함하는 복잡한 세포-미세환경 상호작용은 손상의 진행에 기여한다49 및 질병50. 다양한 형광 및 SRS 이미징 프로브와 결합 된 TPEF-SRS 현미경 검사는 다양한 세포 구조뿐만 아니라 고유 한 생체 분자 구성 요소의 동시 이미징을 달성 할 수있어 척수 장애의 발병 및 발달에 대한 이해를 크게 촉진 할 수 있습니다.
공개
저자는 공개 할 것이 없으며 경쟁 할 재정적 이익이 없습니다.
감사의 말
이 작업은 보조금 16103215, 16148816, 16102518, T13-607/12R 16102920, T13-706/11-1, T13-605/18W, C6002-17GF, C6001-19E, N_HKUST603/19, 혁신 및 기술위원회 (ITCPD/17-9), 대학 보조금위원회 우수 제도 영역 (AoE / M-604 / 16, AOE / M-09 / 12) 및 보조금 RPC10EG33을 통한 홍콩 과학 기술 대학 (HKUST)을 통해 홍콩 연구 보조금위원회에서 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| #2 Forceps | Dumont | 11223-20 | For laminectomy |
| 10X objective | Nikon | CFI Plan Apo Lambda 10X | |
| 25X objective | Olympus | XLPLN25XSVMP2 | |
| Burn cream | Betadine | ||
| Camera | Sony | α6300 | |
| Current amplifier | Stanford research | SR570 | |
| Current photomultiplier modules | Hamamatsu | H11461-01 | |
| D2 665 nm long-pass dichroic mirror | Semrock | FF665-Di02-25x36 | For directing epi-fluorescence signal to the detection module |
| D3 700 nm short-pass dichroic mirror | Edmund | 69-206 | For separating SRS from TPEF detection path |
| Depilating cream | Veet | ||
| FS1 975 nm short-pass filter | Edmund | 86-108 | For blocking stokes beam |
| FS1 Bandpass filter | Semrock | FF01-850/310 | For blocking stokes beam |
| Fs2 Bandpass filter | Semrock | FF01-525/50 | For selecting YFP signal |
| Fs2 Shortpass filter | Semrock | FF01-715/SP-25 | For blocking fs excitation laser beam |
| Half-wave plate | Thorlabs | SAHWP05M-1700 | |
| High-speed photodetector | MenloSystems | FPD 310-F | For checking Stokes beam modulation |
| Iodine | Betadine | ||
| IR Scope | FJW | FIND-R-SCOPE Infrared Viewer 2X Kit Model 84499C2X | |
| Iris | Thorlabs | CPA1 | |
| L1 | Thorlabs | AC254-060-B-ML | |
| L10 | Thorlabs | LA4052-A | |
| L2 | Thorlabs | LA1422-B | |
| L3 | Thorlabs | AC254-050-B | |
| L4 | Thorlabs | AC254-060-B-ML | |
| L7 | f=100 mm, AB coating | ||
| L8 | Thorlabs | LA4874-A | |
| L9 | Thorlabs | AC254-035-B-ML | |
| Lock-in amplifier | APE | ||
| Mirror | Thorlabs | PF10-03-P01 | |
| Motorized flipper | Thorlabs | MFF101/M | |
| multifunctional acquisition card | National Instrument | PCIe-6363 | |
| Oscilloscope | Tektronix | TDS2012C | |
| Photodiode | APE | For detecting SRS signal | |
| Picosecond laser source | APE | picoEmerald | |
| Polarizing beam splitter | Thorlabs | CCM1-PBS252/M | |
| Power meter | Newport | 843-R | |
| Saline | Braun | ||
| Scan lens L5 | Thorlabs | SL50-CLS2 | |
| Scanning mirror | Cambridge Technology | 6215H | |
| Silicone gel | World Precision Inc. | KWIK-SIL | |
| Ti:sapphire fs laser | Coherent | Chameleon Ultra II | |
| Tube lens L6 | Thorlabs | TTL200-S8 |
참고문헌
- Raman, C. V., Krishnan, K. S. The optical analogue of the compton effect. Nature. 121 (3053), 711 (1928).
- Turrell, G., Corset, J. . Raman Microscopy: Developments and Applications. , (1996).
- Tian, F., et al. Monitoring peripheral nerve degeneration in ALS by label-free stimulated Raman scattering imaging. Nature Communications. 7 (1), 13283 (2016).
- Shi, Y., et al. Longitudinal in vivo coherent anti-Stokes Raman scattering imaging of demyelination and remyelination in injured spinal cord. Journal of Biomedical Optics. 16 (10), 106012 (2011).
- Hu, C. R., Zhang, D., Slipchenko, M. N., Cheng, J. -. X., Hu, B. Label-free real-time imaging of myelination in the Xenopus laevis tadpole by in vivo Stimulated Raman Scattering Microscopy. Journal of Biomedical Optics. 19 (8), 086005 (2014).
- Den Broeder, M. J., et al. Altered adipogenesis in Zebrafish larvae following high fat diet and chemical exposure is visualised by Stimulated Raman Scattering Microscopy. International Journal of Molecular Sciences. 18 (4), 894 (2017).
- He, S., et al. In vivo metabolic imaging and monitoring of brown and beige fat. Journal of Biophotonics. 11 (8), (2018).
- Wang, M. C., Min, W., Freudiger, C. W., Ruvkun, G., Xie, X. S. RNAi screening for fat regulatory genes with SRS microscopy. Nature Methods. 8 (2), 135-138 (2011).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by Stimulated Raman Scattering Microscopy. Analytical Chemistry. 91 (3), 2279-2287 (2019).
- Zhang, C., Li, J., Lan, L., Cheng, J. -. X. Quantification of lipid metabolism in living cells through the dynamics of lipid droplets measured by Stimulated Raman Scattering Imaging. Analytical Chemistry. 89 (8), 4502-4507 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by Stimulated Raman Scattering Microscopy. Science. 322 (5909), 1857-1861 (2008).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with Stimulated Raman Scattering. Science. 330 (6009), 1368-1370 (2010).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and Stimulated Raman Scattering Microscopy using a probe of the aggregation-induced emission characteristic. Journal of the American Chemical Society. 139 (47), 17022-17030 (2017).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Pawlicki, M., Collins, H. A., Denning, R. G., Anderson, H. L. Two-photon absorption and the design of two-photon dyes. Angewandte Chemie International Edition. 48 (18), 3244-3266 (2009).
- König, K. Multiphoton microscopy in life sciences. Journal of Microscopy. 200 (2), 83-104 (2000).
- Dean, K. M., Palmer, A. E. Advances in fluorescence labeling strategies for dynamic cellular imaging. Nature Chemical Biology. 10 (7), 512-523 (2014).
- Tsurui, H., et al. Seven-color fluorescence imaging of tissue samples based on fourier spectroscopy and singular value decomposition. Journal of Histochemistry & Cytochemistry. 48 (5), 653-662 (2000).
- Niehörster, T., et al. Multi-target spectrally resolved fluorescence lifetime imaging microscopy. Nature Methods. 13 (3), 257-262 (2016).
- Zhang, X., et al. Label-free live cell imaging of nucleic acids using Stimulated Raman Scattering (SRS) Microscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 13 (4), 1054-1059 (2012).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 7715 (2018).
- Li, X., et al. Integrated femtosecond stimulated Raman scattering and two-photon fluorescence imaging of subcellular lipid and vesicular structures. Journal of Biomedical Optics. 20 (11), 110501 (2015).
- Imitola, J., et al. Multimodal coherent anti-Stokes Raman scattering microscopy reveals microglia-associated myelin and axonal dysfunction in multiple sclerosis-like lesions in mice. Journal of Biomedical Optics. 16 (2), 021109 (2011).
- Uckermann, O., et al. Label-free multiphoton microscopy reveals altered tissue architecture in hippocampal sclerosis. Epilepsia. 58 (1), 1-5 (2017).
- Tamosaityte, S., et al. Inflammation-related alterations of lipids after spinal cord injury revealed by Raman spectroscopy. Journal of Biomedical Optics. 21 (6), 061008 (2016).
- Uckermann, O., et al. Endogenous two-photon excited fluorescence provides label-free visualization of the inflammatory response in the rodent spinal cord. BioMed Research International. 2015, 859084 (2015).
- van Hameren, G., et al. In vivo real-time dynamics of ATP and ROS production in axonal mitochondria show decoupling in mouse models of peripheral neuropathies. Acta Neuropathologica Communications. 7 (1), 1-16 (2019).
- Davalos, D., et al. Fibrinogen-induced perivascular microglial clustering is required for the development of axonal damage in neuroinflammation. Nature Communications. 3 (1), 1-15 (2012).
- Ylera, B., et al. Chronically CNS-injured adult sensory neurons gain regenerative competence upon a lesion of their peripheral axon. Current Biology. 19 (11), 930-936 (2009).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Lau, S. -. F., et al. IL-33-PU.1 transcriptome reprogramming drives functional state transition and clearance activity of microglia in Alzheimer's Disease. Cell Reports. 31 (3), 107530 (2020).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Scientific Reports. 5, 9691 (2015).
- Yang, Z., Xie, W., Ju, F., Khan, A., Zhang, S. In vivo two-photon imaging reveals a role of progesterone in reducing axonal dieback after spinal cord injury in mice. Neuropharmacology. 116, 30-37 (2017).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Totoiu, M. O., Keirstead, H. S. Spinal cord injury is accompanied by chronic progressive demyelination. Journal of Comparative Neurology. 486 (4), 373-383 (2005).
- Kopper, T. J., Gensel, J. C. Myelin as an inflammatory mediator: Myelin interactions with complement, macrophages, and microglia in spinal cord injury. Journal of Neuroscience Research. 96 (6), 969-977 (2018).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Pedrotti, F. L., Pedrotti, L. M., Pedrotti, L. S. . Introduction to Optics. , (2017).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), 37-61 (2013).
- Zhang, D., Slipchenko, M. N., Cheng, J. -. X. Highly sensitive vibrational imaging by Femtosecond Pulse Stimulated Raman Loss. The Journal of Physical Chemistry Letters. 2 (11), 1248-1253 (2011).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, label-free detection of brain tumors with Stimulated Raman Scattering Microscopy. Science Translational Medicine. 5 (201), (2013).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging. Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Yamakoshi, H., et al. Imaging of EdU, an Alkyne-tagged cell proliferation probe, by Raman Microscopy. Journal of the American Chemical Society. 133 (16), 6102-6105 (2011).
- van Manen, H. -. J., Lenferink, A., Otto, C. Noninvasive imaging of protein metabolic labeling in single human cells using stable isotopes and Raman Microscopy. Analytical Chemistry. 80 (24), 9576-9582 (2008).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nature Biomedical Engineering. 3 (5), 402-413 (2019).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Ahuja, C. S., et al. Traumatic spinal cord injury. Nature Reviews Disease Primers. 3 (1), 1-21 (2017).
- Lassmann, H. Multiple sclerosis pathology. Cold Spring Harbor Perspectives in Medicine. 8 (3), 028936 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유