Method Article
In vivo Визуализация биологических тканей с помощью комбинированной двухфотонной флуоресценции и стимулированной рамановской рассеянной микроскопии
В этой статье
Резюме
Микроскопия с стимулированным комбинационным рассеянием (SRS) позволяет безметочно визуализировать биомолекулы на основе их внутренней вибрации определенных химических связей. В этом протоколе описана инструментальная установка интегрированного SRS и двухфотонного флуоресцентного микроскопа для визуализации клеточных структур в спинном мозге живых мышей.
Аннотация
Микроскопия с стимулированным комбинационным рассеянием (SRS) позволяет безметочно визуализировать биологические ткани в их естественном микроокружении на основе внутренней молекулярной вибрации, обеспечивая тем самым идеальный инструмент для изучения in vivo биологических процессов с субклеточным разрешением. Интегрируя двухфотонную возбужденную флуоресцентную (TPEF) визуализацию в микроскоп SRS, двухмодальная визуализация тканей in vivo может получать критически важную биохимическую и биофизическую информацию с нескольких точек зрения, которая помогает понять динамические процессы, участвующие в клеточном метаболизме, иммунном ответе и ремоделировании тканей и т. Д. В этом видеопротоколе вводится настройка системы микроскопа TPEF-SRS, а также метод визуализации спинного мозга животных in vivo . Спинной мозг, как часть центральной нервной системы, играет решающую роль в коммуникации между головным мозгом и периферической нервной системой. Миелиновая оболочка, богатая фосфолипидами, окружает и изолирует аксон, чтобы обеспечить солевую проводимость потенциалов действия. Визуализация in vivo миелиновых оболочек в спинном мозге важна для изучения прогрессирования нейродегенеративных заболеваний и травм спинного мозга. Протокол также описывает препараты животных и методы визуализации in vivo TPEF-SRS для получения биологических изображений с высоким разрешением.
Введение
Рамановская микроскопия1,2 становится мощным методом без меток для изображения биологических тканей на основе характерных частот различных химических связей в биомолекулах. Благодаря своей неинвазивной и хорошо адаптивной способности к визуализации, рамановская микроскопия широко используется для визуализации обогащенных липидами компонентов в биологических тканях, таких как миелиновая оболочка3,4,5, адипоциты6,7 и липидные капли8,9,10 . Сигнал стимулированного комбинационного рассеяния (SRS), полученный в виде стимулированного комбинационного усиления (SRG) или стимулированного рамановского рассеяния (SRL), не имеет фона, показывая идеальное спектральное сходство со спонтанным комбинационным рассеянием11,12. Кроме того, SRL и SRG линейно зависят от концентрации анализируемого вещества, что позволяет проводить количественный анализ биохимических компонентов9,11,13. Двухфотонная возбужденная флуоресцентная микроскопия (TPEF) широко используется для биологической визуализации in vivo благодаря присущей ей способности к оптическому сечению, глубине глубокого проникновения и низкой фототоксичности14,15,16. Однако производительность визуализации TPEF зависит от характеристик флуоресцентных меток, а количество разрешимых цветов ограничено из-за широкополосных флуоресцентных спектров8,17,18,19. Визуализация SRS без меток и флуоресцентная визуализация TPEF являются двумя взаимодополняющими методами визуализации, и их комбинация может обеспечить обильную биофизическую и биохимическую информацию тканей. Эти два метода визуализации основаны на нелинейных оптических (NLO) процессах, что позволяет легко интегрировать их в одну систему микроскопа. Сочетание визуализации SRS и TPEF, так называемой двойной модальной визуализации, позволяет проводить многомерную визуализацию и профилирование клеток и тканей, способствуя всестороннему пониманию сложных биологических систем. В частности, пикосекундная (ps) SRS-микроскопия может достигать визуализации химических связей с высоким спектральным разрешением по сравнению с фемтосекундным (fs) методом SRS11, что позволяет дифференцировать несколько биохимических компонентов в биологической ткани, особенно в переполненной области отпечатков пальцев20,21. Кроме того, по сравнению с другой широко используемой двухмодальной системой микроскопа NLO с интеграцией когерентного микроскопа рассеяния против Стокса (CARS), SRS демонстрирует превосходную производительность по сравнению с CARS с точки зрения спектральной интерпретации и интерпретации изображений, а также чувствительности обнаружения11. Микроскоп SRS-TPEF использовался в качестве мощного инструмента для изучения различных биологических систем, таких как Caenorhabditis elegans9,22, Xenopus laevis головастик brain5, мозг мыши23,24, спинной мозг25,26, периферический нерв27 и жировая ткань7 и т.д.
Спинной мозг вместе с головным мозгом составляет центральную нервную систему (ЦНС). Визуализация клеточной активности в ЦНС in vivo при физиологических и патологических состояниях имеет решающее значение для понимания механизмов расстройств ЦНС28,29,30 и для разработки соответствующих методов лечения31,32,33. Миелиновая оболочка, которая оборачивает и изолирует аксоны для высокоскоростной проводимости потенциала действия, играет значительную роль в развитии ЦНС. Демиелинизация считается отличительной чертой при расстройствах белого вещества, таких как рассеянный склероз34. Кроме того, после травмы спинного мозга35 обломки миелина могут модулировать активацию макрофагов, способствуя хроническому воспалению и вторичному повреждению36. Поэтому визуализация in vivo миелиновой оболочки вместе с нейронами и глиальными клетками в живых мышиных моделях очень помогает понять динамические процессы при нарушениях ЦНС.
В этом протоколе описываются фундаментальные процедуры настройки домашнего микроскопа TPEF-SRS и представлены методы двойной модальной визуализации in vivo для спинного мозга мыши.
протокол
Все процедуры для животных, выполняемые в этой работе, проводятся в соответствии с руководящими принципами Лаборатории животных Гонконгского университета науки и технологии (HKUST) и были одобрены Комитетом по этике животных HKUST. Для настройки и эксплуатации микроскопа TPEF-SRS требуется обучение технике безопасности для лазерного обращения. Всегда надевайте лазерные защитные очки с соответствующим диапазоном длин волн при работе с лазером.
1. Настройка микроскопа TPEF-SRS (схема настройки см. рисунок 1)
- Используйте встроенный оптический параметрический генератор (OPO), подключенный к волокнистому лазеру иттербия с блокировкой режима, в качестве источника лазера ps для визуализации SRS.
ПРИМЕЧАНИЕ: OPO выводит луч Стокса (1031 нм) и пучок насоса (настраиваемый от 780 нм до 960 нм) с длительностью импульса 2 пс и частотой повторения 80 МГц. Луч Стокса модулируется на частоте 20 МГц встроенным электрооптическим модулятором (EOM) для высокочастотного фазочувствительного обнаружения SRS на уровне МГц. - Используйте fs титан (Ti): сапфировый лазер в качестве лазерного источника для визуализации TPEF.
- Используйте пару объективов (L1 и L2) для сопоставления и регулировки размера луча fs до 3 мм.
- Используйте пару линз (L3 и L4), чтобы коллимировать луч лазера ps и расширить его диаметр до 3 мм.
- Измените поляризацию лазерного луча fs с поляризации p на поляризацию s с помощью полуволновой пластины.
- Объедините два лазерных луча с поляризационным разветвителем пучка (PBS).
- Добавьте пару 3-мм зеркал гальванометра XY-сканирования позади PBS для сканирования луча.
- Используйте телецентрический сканирующий объектив (L5) и трубчатый объектив с коррекцией бесконечности (L6) для сопряжения сканирующего зеркала и заднего зрачка объектива 25x. Разверните лазерный луч с помощью сканирующей линзы и трубчатой линзы, чтобы заполнить заднюю диафрагму объектива.
- Поместите PBS или дихроичное зеркало (D2) между ламповым объективом и объективом для сбора сигналов SRS или флуоресцентного сигнала. Используйте моторизованный флиппер для переключения между PBS и D2.
ПРИМЕЧАНИЕ: Часть обратно рассеянного сигнала SRS теряется при прохождении через PBS в результате его случайно смещенной поляризации. - Используйте пару линз (L7 и L9) для сужения луча обнаружения и сопряжения заднего зрачка объектива 25x с фотодиодным датчиком.
- Используйте пару линз (L8 и L10) для сужения луча обнаружения и сопряжения заднего зрачка объектива 25x с поверхностью обнаружения фотоумножителя (PMT).
- Используйте дихроичное зеркало (D3) для разделения пути обнаружения флуоресценции и сигналов SRS.
- Поместите набор фильтров (Fs1) перед фотодиодным детектором, чтобы заблокировать лазер Стокса и пропускать только пучок накачки.
- Поместите набор фильтров (Fs2) перед детектором PMT, чтобы пропускать только целевой флуоресцентный сигнал.
- Подключите PMT к усилителю тока для усиления сигнала.
- Подключите фотодиод к блокируемому усилителю.
- Подключите сигнал синхронизации от встроенного выхода EOM к опорному входу блокирующего усилителя для демодуляции сигнала SRS.
- Подключите усилитель PMT и блокируемые выходы усилителя к модулю сбора данных.
2. Калибровка системы микроскопа TPEF-SRS
- Запуск лазеров
- Переключите переключатель клавиши из положения Standby в положение On , чтобы включить сапфировый лазер Ti: и подождите 30 минут, пока лазер прогреется.
- Включите OPO, нажав кнопку «Пуск» на панели управления OPO, и подождите 20 минут, пока лазер прогреется.
- После того, как ps-лазер разогреется, используйте высокоскоростной фотоприемник, чтобы проверить глубину модуляции луча Стокса. Откройте лазерный затвор для луча Стокса. Нажмите на поле Установить питание OPO и введите 20. Поместите высокоскоростной фотоприемник на выход OPO, чтобы обнаружить луч. Подключите выходной порт фотоприемника к входному порту осциллографа с помощью коаксиального кабеля с байонетным разъемом Neill-Concelman (BNC) для мониторинга лазерного импульса.
- Откройте окно Управление EOM в программном обеспечении управления OPO. Отрегулируйте мощность и фазу EOM в соответствии с диаграммой интенсивности импульсов, показанной на осциллографе, для достижения максимальной глубины модуляции на частоте 20 МГц.
ПРИМЕЧАНИЕ: Производительность EOM обычно стабильна и должна быть проверена только тогда, когда сигнал SRS значительно снижен.
- Оптическое выравнивание комбинированного микроскопа TPEF-SRS
- Выполните оптическое выравнивание для колокализации пучков ps и fs, как описано в шагах 2.2.2-2.2.13.
- Откройте лазерный затвор накачки, остановив выход Stokes в программном обеспечении управления OPO. Используйте управляющее программное обеспечение OPO, чтобы установить длину волны пучка насоса на 796 нм, щелкнув поле Установить сигнал и введя значение длины волны 796. Нажмите на блок Set OPO Power box и введите 20, чтобы установить его мощность до минимума (~ 20 мВт) для оптического выравнивания.
- Включите компьютер микроскопа и все связанные с ним электронные компоненты, включая сканеры, исполнительные механизмы, фотодиоды, PMT, усилители тока, запирающие усилители и моторизованные ласты. Запустите программное обеспечение для управления микроскопом.
ПРИМЕЧАНИЕ: Программное обеспечение для управления микроскопом является самодельным интерфейсом. - Поместите две выравнивающие пластины (P1 и P2 на рисунке 1) на оптический контур. Поместите P1 позади PBS на расстоянии около 10 см и поместите P2 позади P1 на расстоянии около 30 см.
ПРИМЕЧАНИЕ: Лучи ps и fs объединяются с помощью PBS (рисунок 1). Две пластины выравнивания используются для проверки выравнивания, а также колокализации двух лазерных лучей. - Откройте затвор микроскопа для лазерного луча ps.
- Отрегулируйте зеркало M1, чтобы найти центр лазерного луча ps в сквозном отверстии P1. Используйте инфракрасный (ИК) прицел для наблюдения за положением точки луча на P1 при регулировке зеркала M1.
- Отрегулируйте зеркало M2, чтобы найти центр лазерного луча ps в сквозном отверстии P2. Используйте ИК-прицел для наблюдения за положением точки луча на P2 при регулировке зеркала M2.
- Повторяйте шаги 2.2.6 и 2.2.7 до тех пор, пока центр пучка ps не расположится в сквозном отверстии обеих пластин выравнивания. Закройте затвор луча ps в управляющем программном обеспечении микроскопа.
- Установите длину волны fs Ti: сапфирового лазера на 740 нм и откройте лазерный затвор. Установите мощность лазера на 5 мВт (измеряется во входном порту системы микроскопа) для оптического выравнивания.
- Откройте затвор микроскопа для лазерного луча fs.
- Отрегулируйте зеркало M3, чтобы найти центр пятна лазерного луча fs в сквозном отверстии P1.
- Отрегулируйте зеркало M4, чтобы найти центр пятна лазерного луча в сквозном отверстии P2.
- Повторяйте шаги 2.2.11 и 2.2.12 до тех пор, пока центр лазерного луча fs не расположится в сквозных отверстиях двух пластин выравнивания. Закройте затвор микроскопа для луча fs.
- Выполните пространственное перекрытие пучков насоса и Стокса, как описано в шагах 2.2.15-2.2.18.
ПРИМЕЧАНИЕ: Хотя лучи накачки и Стокса примерно перекрываются внутри ps-лазера, для достижения оптимальной производительности SRS требуется тонкая настройка положений двух лазерных лучей. Поскольку балка насоса сначала выравнивается, как описано ранее, затем балка Стокса настраивается для колокализации с пучкой насоса. - Поместите камеру в положение объектива, чтобы визуализировать расположение двух лучевых пятен. Отметьте положение пучка насоса на экране камеры в качестве эталона.
- Поместите выравнивающую пластину P0 перед L3 (рисунок 1). Используйте шестигранную клавишу для регулировки оптического зеркала 1 (OM1) таким образом, чтобы центр луча Стокса проходил сквозное отверстие выравнивающей пластины и колокализовался с пучком накачки в выходном порту лазера. Используйте ИК-прицел для подтверждения положения пятна луча на P0 во время регулировки.
ПРИМЕЧАНИЕ: OM1 и OM2 представляют собой два зеркала в головке OPO для регулировки положения луча Stokes 1031 нм. - Снимите выравнивающую пластину P0 и используйте шестигранную клавишу для регулировки OM2 таким образом, чтобы центр луча Стокса колокализовался с опорным знаком пучка насоса на камере.
- Повторяйте шаги 2.2.16 и 2.2.17 до тех пор, пока луч Стокса не будет строго перекрываться с пучкой насоса как в плоскостях P0, так и в плоскостях камеры.
ПРИМЕЧАНИЕ: При визуализации лучевых пятен на камере все выравнивающие пластины должны быть удалены с оптического пути.
- Оптимизация условий обработки изображений
- Выполните фазовую регулировку блокирующего усилителя, как описано в шагах 2.3.2. до 2.3.7.
ПРИМЕЧАНИЕ: Обнаружение SRS основано на высокочастотной фазочувствительной схеме. Для обнаружения SRL интенсивность луча Стокса модулируется на частоте 20 МГц, а для демодуляции сигнала используется блокирующий усилитель. Фаза и смещение блокирующего усилителя необходимо отрегулировать для достижения оптимальной контрастности изображения. - Откройте программное обеспечение управления блокирующим усилителем.
- Установите длину волны накачки лазера на 796 нм, а мощность накачки и луча Стокса на образце составит 15 мВт и 25 мВт соответственно.
ПРИМЕЧАНИЕ: Здесь используют оливковое масло для оптимизации и калибровки изображений SRS. Рамановский пик оливкового масла в углерод-водородной области составляет 2863,5 см-1, что соответствует длине волны пучка насоса при 796 нм. - Запечатайте оливковое масло на слайде и прикрепите сложенную папиросную бумагу к нижней части слайда, чтобы усилить обратное рассеяние сигнала для обнаружения эпи-SRS. Поместите образец оливкового масла на сцену и отрегулируйте фокус 25-кратного объектива на образец.
- Используйте программное обеспечение для управления микроскопом для установки параметров изображения следующим образом: 512 x 512 пикселей для поля зрения 500 мкм x 500 мкм (FOV), время ожидания пикселя 6,4 мкс. Используйте программное обеспечение управления блокирующим усилителем, чтобы установить значение постоянной времени равным 10 мкс, что близко ко времени выдержки пикселя.
- Отсканируйте лазерный луч над образцом. Используйте программное обеспечение для управления блокирующим усилителем для настройки фазы (0-180°) с размером шага 22,5° до тех пор, пока интенсивность сигнала SRS не достигнет максимума.
ПРИМЕЧАНИЕ: В этом полностью аналоговом блокируемом усилителе выходной сигнал является фазовым компонентом, который зависит от фазы опорного сигнала. Фаза может быть отрегулирована программным обеспечением управления блокирующим усилителем с разрешением 11°, что позволяет максимизировать обнаруженный сигнал в пределах ~ 2% 12. Блокирующий усилитель выходит из фазы, как только сигнал синхронизации нарушается. Фазу необходимо перенастраивать каждый раз при восстановлении сигнала синхронизации. - Отсканируйте образец с закрытым лазерным затвором. Используйте программное обеспечение для управления блокирующим усилителем для настройки значения смещения с размером шага 1 мВ до тех пор, пока средний сигнал SRS не будет близок к нулю.
ПРИМЕЧАНИЕ: Средний сигнал SRS оценивается как средняя интенсивность всех пикселей в изображении SRS, которая рассчитывается автоматически программным обеспечением управления микроскопом. Смещения полезны для отмены нежелательных фазо-когерентных сигналов. - Выполните оптимизацию временной синхронизации, как описано в шагах 2.3.9-2.3.14.
- Откройте диалоговое окно Delay Manager (рисунок 2) в программном обеспечении управления OPO.
- Отсканируйте оливковое масло и настройте стадию задержки, пока сигнал SRS оливкового масла не достигнет своего максимума.
ПРИМЕЧАНИЕ: Впервые в SRS-визуализации, когда фаза блокирующего усилителя не была оптимизирована, временная синхронизация сначала грубо настраивается для визуализации сигнала SRS образца перед оптимизацией фазы блокирующего усилителя. - Остановите сканирование и нажмите кнопку «Добавить данные » в диалоговом окне диспетчера задержек, чтобы записать текущие данные о задержке.
- Повторите шаги 2.3. 10 и 2.3.11 для различных химических образцов на разных длинах волн.
ПРИМЕЧАНИЕ: Полистирольные шарики, тяжелая вода, 5-этинил-2'-дезоксиуридин, глицерин используются для измерения данных задержки в различных колебательных полосах. - Выберите Data Fit и Order 5 в диалоговом окне диспетчера задержек, чтобы соответствовать текущим точкам данных с полиномической функцией пятого порядка. Примените соответствующие данные, нажав кнопку «Использовать как пользовательский» и установив флажок. Стадия задержки будет автоматически отрегулироваться на разных длинах волн в соответствии с установленной кривой задержки.
- Сохраните все данные задержки в текстовом файле, который можно загрузить для дальнейшего использования.
- Выполните фазовую регулировку блокирующего усилителя, как описано в шагах 2.3.2. до 2.3.7.
3. Хирургическая подготовка мыши к флуоресценции in vivo и SRS-визуализации
- Стерилизуйте все необходимые инструменты, включая скальпели, пружинные ножницы, щипцы, чехлы и марлевые подушечки.
- Продезинфицируйте все поверхности, которые будут тронуты во время операции 70% этанолом. Накройте рабочую зону столешницы стерильными шторами. Положите грелку под драпировку.
- Используйте Thy1-YFP-H (Tg(Thy1-YFP)HJrs/J)37 трансгенных мышей, которые экспрессируют усиленный желтый флуоресцентный белок (EYFP) в афферентных нейронах дорсального корешка ганглия для визуализации спинного мозга in vivo . Взвешивают мышь и индуцируют анестезию путем внутрибрюшинной (в т.п.) инъекции смеси кетамина-ксилазина (87,5 мг кг-1 и 12,5 мг кг-1).
- Зажмите палец мыши, чтобы обеспечить глубокую анестезию. При необходимости дополните половиной первоначальной дозы анестетиков. Нанесите мазь на глаза мыши, чтобы предотвратить сухость роговицы.
- Сбрить волосы на спине над грудной клеткой, а затем полностью удалить волосы с помощью крема для депиляции. Продезинфицируйте выбритый участок раствором йода.
- Сделайте небольшой разрез средней линии (~1,5 см) кожи над позвонком T11-T13 скальпелем.
- Разрезайте мышцы и сухожилия как сверху, так и по бокам позвонка T11-T13 пружинными ножницами и щипцами. Обнажите три соседних позвонка. Используйте стерильные марлевые прокладки и стерильный физиологический раствор для контроля кровотечения и очистки места операции.
- Стабилизируйте позвоночник с помощью двух боковых панелей из нержавеющей стали на специально разработанной ступени стабилизации (рисунок 2B).
- Используйте щипц No2 для выполнения ламинэктомии при Т12. Осторожно используйте щипц, чтобы сломать пластинку по частям, пока вся пластина позвонка T12 не будет удалена.
- Смойте кровь, покрывающую спинной мозг, стерильным физиологическим раствором и используйте марлевую прокладку для поглощения избыточной жидкости. Надавите на место кровотечения куском марлевой прокладки, чтобы контролировать кровотечение.
- Поместите крышку (22 x 22 мм) на зажимную планку и заполните промежуточное пространство между чехлом и спинным мозгом физиологическим раствором.
4. In vivo TPEF-SRS визуализация спинного мозга мыши
- Установите стабилизационную ступень на пятиосевой ступени под микроскопом TPEF-SRS.
ПРИМЕЧАНИЕ: Пятиосевая ступень обеспечивает трехосевой перевод и ±5° тангажа и движения крена. - Закрепите голову мыши двумя стойками головы и опустите удерживающую пластину, чтобы обеспечить достаточно места для движения грудной клетки во время дыхания, облегчая артефакты движения.
- Вставьте грелку под мышь, чтобы держать мышь в тепле во время съемки.
- Отрегулируйте трансляционную стадию z, чтобы настроить фокус до тех пор, пока изображение сосудистой системы спинного мозга с ярким полем не будет наблюдаться под 10-кратным объективом.
- Найдите спинную вену спинного мозга в центре FOV, настроив двухосевую трансляционную стадию пятиосевой стадии.
- Настройте углы крена и тангажа пятиосевой ступени, чтобы отрегулировать дорсальную поверхность спинного мозга перпендикулярно оси объектива на основе изображения яркого поля.
- Замените 10-кратный объектив на 25-кратный объектив погружения в воду для визуализации TPEF-SRS.
- Установите длину волны луча fs равным 920 нм. Настройте мощность луча fs на 10 мВт на образце.
- Установите длину волны пучка насоса на 796 нм. Настройте мощность насоса и балки Стокса на 60 мВт и 75 мВт на образец соответственно.
ПРИМЕЧАНИЕ: Визуализация SRS спинного мозга выполняется при волновом числе 2863,5 см-1, что соответствует рамановскому пику миелиновых оболочек в углерод-водородной области на основе измеренных спектров SRS7,9. Мощность лазера определяется для обеспечения визуализации спинного мозга с высоким разрешением TPEF-SRS. Повреждение тканей не наблюдается в современных условиях визуализации. - Для получения изображений SRS выберите PBS над объективом с помощью моторизованного флиппера, нажав кнопку Switch , подключенную к моторизованному флипперу.
- Задайте параметры изображения следующим образом: 512 x 512 пикселей для 150 мкм x 150 мкм FOV, время ожидания пикселя 3,2 мкс, постоянная времени 2 мкс.
- Начните сканирование образца и установите фокус на дорсальную поверхность спинного мозга.
- Тонкая настройка стадии задержки с помощью программного обеспечения управления OPO до тех пор, пока не будет достигнут максимальный сигнал SRS спинного мозга.
ПРИМЕЧАНИЕ: Биологические образцы могут индуцировать дополнительную хроматическую дисперсию, может потребоваться регулировка стадии задержки для оптимизации временной синхронизации. Однако, когда SRS-визуализация выполняется вблизи верхней поверхности ткани, временная разница двух лазерных импульсов, вводимых биологической тканью и окном визуализации, обычно невелика (менее нескольких сотен fs). - Для получения изображений TPEF выберите дихроичное зеркало D2 над объективом с помощью моторизованного флиппера, нажав кнопку Switch , подключенную к моторизованному флипперу.
- Задайте параметры изображения и начните сканирование образца. Чтобы захватить стек изображений TPEF-SRS, получите изображения TPEF и SRS последовательно с интервалом 1 с на той же глубине, прежде чем перейти на следующую глубину. Параметры изображения для визуализации TPEF составляют 512 x 512 пикселей, 150 мкм x 150 мкм FOV, время ожидания пикселя 3,2 мкс.
- Удалите животное из стадии стабилизации после того, как все изображения будут собраны.
- Очистите открытую ткань путем промывки физиологическим раствором и впитайте лишнюю жидкость с помощью марлевой прокладки. Нанесите силиконовый гель на открытый спинной мозг и подождите ~ 5 минут, пока он не вылечится.
- Зашить кожу хирургическим швом No6-0, чтобы закрыть рану. Нанесите крем от ожогов на кожу хирургического участка для предотвращения инфекции. Назначают анальгетик подкожно (0,1 мг/кг бупренорфина).
- Поместите животное в чистую клетку и поместите клетку на грелку до тех пор, пока мышь полностью не оправится от анестезии.
- Повторяют введение анальгетика каждые 12 часов в течение 3 дней после операции.
- Закройте затвор OPO и fs лазера. Установите мощность насоса и балки Стокса на максимум.
ПРИМЕЧАНИЕ: Установка максимальной мощности перед выключением лазера полезна для обслуживания лазера. - Установите длину волны пучка накачки и лазера fs на 800 нм.
- Установите два лазера в режим ожидания, закройте все программное обеспечение для управления электроникой и выключите все связанное оборудование.
Результаты
In vivo двухмодальная визуализация спинномозговых аксонов, а также миелиновых оболочек проводится с использованием трансгенных мышей Thy1-YFPH, которые экспрессируют EYFP в афферентных нейронах дорсального корешка ганглия (рисунок 3). Эти меченые афферентные нейроны передают сенсорную информацию от периферического нерва к спинному мозгу, причем центральная ветвь расположена в дорсальном столбе спинного мозга. С помощью микроскопа TPEF-SRS плотно распределенная миелиновая оболочка может быть четко визуализирована с использованием визуализации SRS без меток, а редко меченые аксоны YFP можно наблюдать с помощью визуализации TPEF. С помощью двухмодельной визуализации видно, что аксоны плотно обернуты толстым слоем миелиновых оболочек (рисунок 3C). Узлы Ранвье (NR), где аксолемма обнажена из миелиновой оболочки, играют существенную роль в быстром соленом распространении потенциалов действия. Как видно на изображении спинного мозга TPEF-SRS (рисунок 3C), NR показывают уменьшение аксонального диаметра и аксолемму, непосредственно подверженную воздействию внеклеточного матрикса. Важно изобразить аксоны вместе с окружающими миелинными оболочками, чтобы подтвердить существование и местоположение NR. Поэтому микроскопия TPEF-SRS позволяет наблюдать динамические изменения аксонов и миелиновых оболочек при развитии нарушений спинного мозга, что важно для понимания механизмов клеточной динамики.

Рисунок 1: Принципиальная схема микроскопической системы TPEF-SRS. Лучи накачки и Стокса объединены с дихроичным зеркалом (D1) в пикосекундном (ps) лазере. Пучок ps и фемтосекундный (fs) луч коллимированы и расширены/сужены парой линз (L3, L4 и L1, L2 соответственно), чтобы соответствовать 3 мм зеркалам гальванометра XY-сканирования. Луч fs поворачивается от горизонтальной к вертикальной поляризации полуволновой пластиной (HWP), а затем объединяется с пучком ps с помощью поляризационного делителя пучка (PBS). Сканирующие зеркала и задний зрачок объектива сопряжены с телецентрическим сканирующим объективом L5 и трубчатым объективом L6 с коррекцией бесконечности. Лазерный луч расширяется сканирующей и трубчатой линзой для заполнения задней диафрагмы 25-кратного объектива. Для визуализации стимулированного комбинационного рассеяния (SRS) обратно рассеянный пучок насоса, собранный объективом, отражается PBS и направляется на большую площадь (10 мм x 10 мм) кремниевого фотодиода (PD). Для двухфотонной визуализации двухфотонный сигнал возбужденной флуоресценции (TPEF) отражается дихроичным делителем пучка D2 к блоку фотодетекции. Для обнаружения сигнала TPEF используется текущий модуль фотоумножителя (PMT). Аббревиатуры-L1-L10: линзы; OL: объектив; D1-D3: дихроичные зеркала; Fs1, Fs2: наборы фильтров; M: зеркала; OM1, OM2: оптические зеркала; P0-P2: выравнивание пластин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 2: Интерфейс менеджера задержек на управляющем программном обеспечении OPO. Красная стрелка указывает на флажок для применения калиброванных данных задержки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
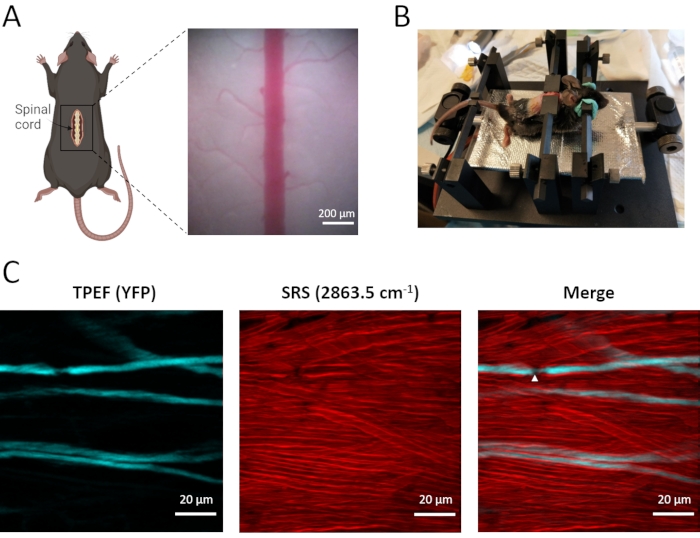
Рисунок 3: Визуализация спинного мозга мыши in vivo TPEF-SRS. (А) Принципиальная схема хирургической подготовки спинного мозга мыши и изображение яркого поля спинного мозга. (B) Схема крепления мыши для визуализации спинного мозга in vivo . (C) Максимальные проекционные изображения аксонов и миелиновых оболочек в спинном мозге мыши. Белые наконечники стрелок указывают на расположение узла Ранвье. Снимки миелина sRS сделаны при рамановском сдвиге 2863,5 см-1. Рисунок А был создан с помощью BioRender (https://biorender.com/). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этом протоколе подробно описана базовая настройка микроскопа TPEF-SRS. Для визуализации SRS пучки насоса и Стокса временно и пространственно перекрываются внутри OPO. Однако это перекрытие может быть нарушено после прохождения через систему микроскопа. Поэтому как пространственная, так и временная оптимизация колокализации пучков насоса и пучков Стокса необходима и имеет решающее значение для достижения оптимальной визуализации SRS. Временная задержка между насосом и пучком Стокса связана с разницей оптических путей двух лучей, которая определяется дисперсией оптических элементов в системе микроскопа38. Когда длина волны пучка насоса настраивается для визуализации SRS при различных рамановских сдвигах, длина оптического пути пучка насоса изменяется соответственно, поскольку показатель преломления оптических линз зависит от длины волны38. Поэтому временная задержка между накачкой и лазерным импульсом Стокса изменяется в зависимости от длины волны пучка накачки и, следовательно, должна быть откалибрована. OPO оснащен программно управляемой линией задержки для временной синхронизации насоса и балки Стокса. Для той же оптической установки данные задержки остаются стабильными и должны быть откалиброваны только один раз. В результате данные о задержке на разных длинах волн пучка насоса могут быть сохранены при первом измерении для будущего использования. Калиброванные данные о задержке могут автоматически применяться управляющим программным обеспечением OPO при изменении длины волны пучка насоса, что удобно для визуализации SRS при различных рамановских сдвигах или гиперспектральной визуализации SRS. Для визуализации TPEF-SRS строгое пространственное перекрытие пучков ps и fs после комбинации является критическим шагом, чтобы избежать любого сдвига FOV между двумя моделями визуализации. Во-первых, пучок насоса ps и пучок fs выровнены, чтобы убедиться, что они оба находятся на оптической оси системы микроскопа, что имеет решающее значение для предотвращения любого смещения FOV при переключении двух моделей визуализации. Затем, используя пучок насоса в качестве эталона, положение пучка Стокса корректируется соответствующим образом для достижения строгой пространственной колокализации. Каждая процедура выравнивания требует нескольких испытаний для достижения оптимального уровня.
Если сигнал SRS значительно уменьшается, сначала следует проверить фазовое значение блокирующего усилителя и данные о временной задержке. Поскольку блокирующий усилитель выходит из фазы после нарушения сигнала синхронизации, значение фазы требует перенастройки каждый раз после прерывания его источника питания или сигнала синхронизации EOM. Временную синхронизацию насоса и балки Стокса можно быстро проверить, слегка отрегулировав линию задержки внутри OPO. Если калиброванные данные о временной задержке далеки от оптимального значения, необходимо выполнить нулевое сканирование для повторной калибровки смещения задержки, нажав кнопку Zero Scan в диалоговом окне диспетчера задержек. Вся процедура нулевого сканирования занимает около 10 минут. Если сигнал SRS не восстанавливается после оптимизации значения фазы и временной задержки, следует проверить модуляцию EOM луча Стокса, как описано в шагах 2.1.3-2.1.4. Если коэффициент вымирания намного меньше 10 дБ при наблюдении малых импульсных пиков в выключенном положении импульсной цепи Стокса, EOM следует перезапустить, а мощность модуляции и фазу следует перенастроить для достижения максимальной глубины модуляции. Обычно проблема модуляции может быть решена путем сброса EOM. Если нет, то должна потребоваться техническая поддержка производителя.
Для визуализации толстых тканей in vivo необходимо использовать режим обнаружения эпи-SRS. В этом протоколе PBS используется для передачи лазера возбуждения и отражения обратно рассеянного сигнала SRS на детектор. Обнаруженный сигнал SRL зависит от обратного рассеяния вперед пучка насоса тканями. Лазеры возбуждения имеют линейную поляризацию и могут полностью проходить через PBS, в то время как обратно рассеянный луч имеет смещенную поляризацию и, таким образом, может быть только частично отражен PBS. Таким образом, текущая схема сбора сигнала показывает более низкую эффективность по сравнению со стратегией, которая непосредственно размещает кольцевой фотоприемник перед объективом12. Тем не менее, из-за сильного рассеяния богатых липидами тканей39, изображения SRS с высоким соотношением сигнал/шум (512 x 512 пикселей) спинного мозга могут быть получены со временем интеграции 1-2 с, что делает эту схему сбора на основе PBS подходящим подходом для визуализации спинного мозга. С другой стороны, однако, сильное рассеяние тканей ограничивает глубину проникновения света. Как для SRS, так и для TPEF глубина визуализации спинного мозга ограничена примерно 50 мкм.
Процедура последовательной визуализации для визуализации SRS и TPEF является основным ограничением современного метода двухмодальной визуализации. В протоколе визуализация TPEF и SRS выполняется в одном и том же месте последовательно с интервалом 1 с путем автоматического переключения моторизованного флиппера. Артефакты движения могут вызывать несовершенное слияние изображений TPEF и SRS, что ограничивает возможности этого метода для визуализации высокодинамичных процессов или тканей, в значительной степени затронутых дыханием и сердцебиением животных. Одним из возможных решений является одновременный сбор двухфотонной флуоресценции с лазерным возбуждением ps во время визуализации SRS9. Однако этот метод применим только к биологическим структурам с сильными флуоресцентными сигналами, поскольку импульс ps имеет гораздо более низкую эффективность возбуждения флуоресценции по сравнению с импульсом fs14. Альтернативно, задача может быть решена с помощью системы fs-SRS22,40, где лазерный источник fs позволяет одновременно возбуждать сигналы SRS и TPEF эффективно, за счет низкого спектрального разрешения SRS-визуализации. Другим решением является использование флуоресценции ps с лазерным возбуждением, полученной во время визуализации SRS, в качестве эталона для регистрации флуоресцентных изображений fs. Как показано на рисунке 3, эта стратегия регистрации хорошо работает, если во время SRS и флуоресцентной визуализации не происходит значительного движения.
SRS демонстрирует уникальные преимущества в биологической визуализации, поскольку она предоставляет химическую информацию о биомолекулах на основе своего специфического механизма контраста без меток41. По сравнению с CARS, который также был объединен с TPEF для мультимодальной визуализации NLO, SRS показал лучшую спектральную и интерпретацию изображений11. Поэтому он широко применяется для визуализации липидных 9,11, белков42,43, ДНК44 и биоортогональных компонентов, содержащих алкин (C ≡ C)13,45, углерод-дейтерий (C−D)9,46 и кислород-дейтериевые (O-D) связи47,48 в биологических тканях. В этом протоколе мы использовали лазерный источник ps для визуализации SRS и лазерный источник fs для визуализации TPEF, который сочетает в себе преимущества эффективного флуоресцентного возбуждения и высокого спектрального разрешения Комбинации, что позволяет эффективно дифференцировать различные биомолекулы42,44. В спинном мозге сложные взаимодействия между клетками и микроокружением с участием глиальных клеток, нейронов и рекрутированных иммунных клеток способствуют прогрессированию травм49 и заболеваний50. В сочетании с различными флуоресцентными и SRS-зондами визуализации микроскопия TPEF-SRS может обеспечить одновременную визуализацию различных клеточных структур, а также их отдельных компонентов биомолекул, что может значительно облегчить наше понимание возникновения и развития заболеваний спинного мозга.
Раскрытие информации
Авторам нечего раскрывать и у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Советом по исследовательским грантам Гонконга посредством грантов 16103215, 16148816, 16102518, 16102920, T13-607/12R, T13-706/11-1, T13-605/18W, C6002-17GF, C6001-19E, N_HKUST603/19, Комиссии по инновациям и технологиям (ITCPD/17-9), Схемы области передового опыта Комитета по университетским грантам (AoE/M-604/16, AOE/M-09/12) и Гонконгского университета науки и технологии (HKUST) через грант RPC10EG33.
Материалы
| Name | Company | Catalog Number | Comments |
| #2 Forceps | Dumont | 11223-20 | For laminectomy |
| 10X objective | Nikon | CFI Plan Apo Lambda 10X | |
| 25X objective | Olympus | XLPLN25XSVMP2 | |
| Burn cream | Betadine | ||
| Camera | Sony | α6300 | |
| Current amplifier | Stanford research | SR570 | |
| Current photomultiplier modules | Hamamatsu | H11461-01 | |
| D2 665 nm long-pass dichroic mirror | Semrock | FF665-Di02-25x36 | For directing epi-fluorescence signal to the detection module |
| D3 700 nm short-pass dichroic mirror | Edmund | 69-206 | For separating SRS from TPEF detection path |
| Depilating cream | Veet | ||
| FS1 975 nm short-pass filter | Edmund | 86-108 | For blocking stokes beam |
| FS1 Bandpass filter | Semrock | FF01-850/310 | For blocking stokes beam |
| Fs2 Bandpass filter | Semrock | FF01-525/50 | For selecting YFP signal |
| Fs2 Shortpass filter | Semrock | FF01-715/SP-25 | For blocking fs excitation laser beam |
| Half-wave plate | Thorlabs | SAHWP05M-1700 | |
| High-speed photodetector | MenloSystems | FPD 310-F | For checking Stokes beam modulation |
| Iodine | Betadine | ||
| IR Scope | FJW | FIND-R-SCOPE Infrared Viewer 2X Kit Model 84499C2X | |
| Iris | Thorlabs | CPA1 | |
| L1 | Thorlabs | AC254-060-B-ML | |
| L10 | Thorlabs | LA4052-A | |
| L2 | Thorlabs | LA1422-B | |
| L3 | Thorlabs | AC254-050-B | |
| L4 | Thorlabs | AC254-060-B-ML | |
| L7 | f=100 mm, AB coating | ||
| L8 | Thorlabs | LA4874-A | |
| L9 | Thorlabs | AC254-035-B-ML | |
| Lock-in amplifier | APE | ||
| Mirror | Thorlabs | PF10-03-P01 | |
| Motorized flipper | Thorlabs | MFF101/M | |
| multifunctional acquisition card | National Instrument | PCIe-6363 | |
| Oscilloscope | Tektronix | TDS2012C | |
| Photodiode | APE | For detecting SRS signal | |
| Picosecond laser source | APE | picoEmerald | |
| Polarizing beam splitter | Thorlabs | CCM1-PBS252/M | |
| Power meter | Newport | 843-R | |
| Saline | Braun | ||
| Scan lens L5 | Thorlabs | SL50-CLS2 | |
| Scanning mirror | Cambridge Technology | 6215H | |
| Silicone gel | World Precision Inc. | KWIK-SIL | |
| Ti:sapphire fs laser | Coherent | Chameleon Ultra II | |
| Tube lens L6 | Thorlabs | TTL200-S8 |
Ссылки
- Raman, C. V., Krishnan, K. S. The optical analogue of the compton effect. Nature. 121 (3053), 711 (1928).
- Turrell, G., Corset, J. . Raman Microscopy: Developments and Applications. , (1996).
- Tian, F., et al. Monitoring peripheral nerve degeneration in ALS by label-free stimulated Raman scattering imaging. Nature Communications. 7 (1), 13283 (2016).
- Shi, Y., et al. Longitudinal in vivo coherent anti-Stokes Raman scattering imaging of demyelination and remyelination in injured spinal cord. Journal of Biomedical Optics. 16 (10), 106012 (2011).
- Hu, C. R., Zhang, D., Slipchenko, M. N., Cheng, J. -. X., Hu, B. Label-free real-time imaging of myelination in the Xenopus laevis tadpole by in vivo Stimulated Raman Scattering Microscopy. Journal of Biomedical Optics. 19 (8), 086005 (2014).
- Den Broeder, M. J., et al. Altered adipogenesis in Zebrafish larvae following high fat diet and chemical exposure is visualised by Stimulated Raman Scattering Microscopy. International Journal of Molecular Sciences. 18 (4), 894 (2017).
- He, S., et al. In vivo metabolic imaging and monitoring of brown and beige fat. Journal of Biophotonics. 11 (8), (2018).
- Wang, M. C., Min, W., Freudiger, C. W., Ruvkun, G., Xie, X. S. RNAi screening for fat regulatory genes with SRS microscopy. Nature Methods. 8 (2), 135-138 (2011).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by Stimulated Raman Scattering Microscopy. Analytical Chemistry. 91 (3), 2279-2287 (2019).
- Zhang, C., Li, J., Lan, L., Cheng, J. -. X. Quantification of lipid metabolism in living cells through the dynamics of lipid droplets measured by Stimulated Raman Scattering Imaging. Analytical Chemistry. 89 (8), 4502-4507 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by Stimulated Raman Scattering Microscopy. Science. 322 (5909), 1857-1861 (2008).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with Stimulated Raman Scattering. Science. 330 (6009), 1368-1370 (2010).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and Stimulated Raman Scattering Microscopy using a probe of the aggregation-induced emission characteristic. Journal of the American Chemical Society. 139 (47), 17022-17030 (2017).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Pawlicki, M., Collins, H. A., Denning, R. G., Anderson, H. L. Two-photon absorption and the design of two-photon dyes. Angewandte Chemie International Edition. 48 (18), 3244-3266 (2009).
- König, K. Multiphoton microscopy in life sciences. Journal of Microscopy. 200 (2), 83-104 (2000).
- Dean, K. M., Palmer, A. E. Advances in fluorescence labeling strategies for dynamic cellular imaging. Nature Chemical Biology. 10 (7), 512-523 (2014).
- Tsurui, H., et al. Seven-color fluorescence imaging of tissue samples based on fourier spectroscopy and singular value decomposition. Journal of Histochemistry & Cytochemistry. 48 (5), 653-662 (2000).
- Niehörster, T., et al. Multi-target spectrally resolved fluorescence lifetime imaging microscopy. Nature Methods. 13 (3), 257-262 (2016).
- Zhang, X., et al. Label-free live cell imaging of nucleic acids using Stimulated Raman Scattering (SRS) Microscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 13 (4), 1054-1059 (2012).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 7715 (2018).
- Li, X., et al. Integrated femtosecond stimulated Raman scattering and two-photon fluorescence imaging of subcellular lipid and vesicular structures. Journal of Biomedical Optics. 20 (11), 110501 (2015).
- Imitola, J., et al. Multimodal coherent anti-Stokes Raman scattering microscopy reveals microglia-associated myelin and axonal dysfunction in multiple sclerosis-like lesions in mice. Journal of Biomedical Optics. 16 (2), 021109 (2011).
- Uckermann, O., et al. Label-free multiphoton microscopy reveals altered tissue architecture in hippocampal sclerosis. Epilepsia. 58 (1), 1-5 (2017).
- Tamosaityte, S., et al. Inflammation-related alterations of lipids after spinal cord injury revealed by Raman spectroscopy. Journal of Biomedical Optics. 21 (6), 061008 (2016).
- Uckermann, O., et al. Endogenous two-photon excited fluorescence provides label-free visualization of the inflammatory response in the rodent spinal cord. BioMed Research International. 2015, 859084 (2015).
- van Hameren, G., et al. In vivo real-time dynamics of ATP and ROS production in axonal mitochondria show decoupling in mouse models of peripheral neuropathies. Acta Neuropathologica Communications. 7 (1), 1-16 (2019).
- Davalos, D., et al. Fibrinogen-induced perivascular microglial clustering is required for the development of axonal damage in neuroinflammation. Nature Communications. 3 (1), 1-15 (2012).
- Ylera, B., et al. Chronically CNS-injured adult sensory neurons gain regenerative competence upon a lesion of their peripheral axon. Current Biology. 19 (11), 930-936 (2009).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Lau, S. -. F., et al. IL-33-PU.1 transcriptome reprogramming drives functional state transition and clearance activity of microglia in Alzheimer's Disease. Cell Reports. 31 (3), 107530 (2020).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Scientific Reports. 5, 9691 (2015).
- Yang, Z., Xie, W., Ju, F., Khan, A., Zhang, S. In vivo two-photon imaging reveals a role of progesterone in reducing axonal dieback after spinal cord injury in mice. Neuropharmacology. 116, 30-37 (2017).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Totoiu, M. O., Keirstead, H. S. Spinal cord injury is accompanied by chronic progressive demyelination. Journal of Comparative Neurology. 486 (4), 373-383 (2005).
- Kopper, T. J., Gensel, J. C. Myelin as an inflammatory mediator: Myelin interactions with complement, macrophages, and microglia in spinal cord injury. Journal of Neuroscience Research. 96 (6), 969-977 (2018).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Pedrotti, F. L., Pedrotti, L. M., Pedrotti, L. S. . Introduction to Optics. , (2017).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), 37-61 (2013).
- Zhang, D., Slipchenko, M. N., Cheng, J. -. X. Highly sensitive vibrational imaging by Femtosecond Pulse Stimulated Raman Loss. The Journal of Physical Chemistry Letters. 2 (11), 1248-1253 (2011).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, label-free detection of brain tumors with Stimulated Raman Scattering Microscopy. Science Translational Medicine. 5 (201), (2013).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging. Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Yamakoshi, H., et al. Imaging of EdU, an Alkyne-tagged cell proliferation probe, by Raman Microscopy. Journal of the American Chemical Society. 133 (16), 6102-6105 (2011).
- van Manen, H. -. J., Lenferink, A., Otto, C. Noninvasive imaging of protein metabolic labeling in single human cells using stable isotopes and Raman Microscopy. Analytical Chemistry. 80 (24), 9576-9582 (2008).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nature Biomedical Engineering. 3 (5), 402-413 (2019).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Ahuja, C. S., et al. Traumatic spinal cord injury. Nature Reviews Disease Primers. 3 (1), 1-21 (2017).
- Lassmann, H. Multiple sclerosis pathology. Cold Spring Harbor Perspectives in Medicine. 8 (3), 028936 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены