Method Article
في الجسم الحي تصوير الأنسجة البيولوجية مع التألق المشترك ثنائي الفوتون والمجهر المجهري المبعثر رامان المحفز
In This Article
Summary
يسمح الفحص المجهري لتشتت رامان المحفز (SRS) بالتصوير الخالي من الملصقات للجزيئات الحيوية بناء على اهتزازها الجوهري لروابط كيميائية محددة. في هذا البروتوكول ، يتم وصف الإعداد الفعال لمجهر SRS المتكامل والمجهر الفلوري ثنائي الفوتون لتصور الهياكل الخلوية في الحبل الشوكي للفئران الحية.
Abstract
يتيح الفحص المجهري لتشتت رامان المحفز (SRS) التصوير الخالي من الملصقات للأنسجة البيولوجية في بيئتها الدقيقة الطبيعية استنادا إلى الاهتزاز الجزيئي الجوهري ، وبالتالي توفير أداة مثالية لدراسة العمليات البيولوجية في الجسم الحي بدقة دون الخلايا. من خلال دمج التصوير الفلوري المثير ثنائي الفوتون (TPEF) في مجهر SRS ، يمكن للتصوير المزدوج الوسائط في الجسم الحي للأنسجة الحصول على معلومات كيميائية حيوية وفيزيائية حيوية مهمة من وجهات نظر متعددة مما يساعد على فهم العمليات الديناميكية التي ينطوي عليها التمثيل الغذائي الخلوي والاستجابة المناعية وإعادة تشكيل الأنسجة ، إلخ. في بروتوكول الفيديو هذا ، يتم تقديم إعداد نظام مجهر TPEF-SRS بالإضافة إلى طريقة التصوير في الجسم الحي للحبل الشوكي الحيواني. يلعب الحبل الشوكي ، كجزء من الجهاز العصبي المركزي ، دورا حاسما في التواصل بين الدماغ والجهاز العصبي المحيطي. غمد المايلين ، الوفير في الدهون الفوسفاتية ، يحيط بالمحور العصبي ويعزله للسماح بالتوصيل المالح لإمكانات العمل. في الجسم الحي التصوير من أغماد المايلين في الحبل الشوكي مهم لدراسة تطور الأمراض العصبية التنكسية وإصابة الحبل الشوكي. يصف البروتوكول أيضا إعداد الحيوانات وطرق التصوير TPEF-SRS في الجسم الحي للحصول على صور بيولوجية عالية الدقة.
Introduction
يظهر مجهر رامان 1,2 كطريقة قوية خالية من الملصقات لتصوير الأنسجة البيولوجية بناء على الترددات المميزة للروابط الكيميائية المختلفة في الجزيئات الحيوية. نظرا لقدرته على التصوير غير الغازية والتكيفية بشكل جيد ، تم استخدام مجهر رامان على نطاق واسع لتصوير المكونات الغنية بالدهون في الأنسجة البيولوجية مثل غمد المايلين 3،4،5 ، الخلايا الشحمية6،7 ، وقطرات الدهون 8،9،10 . إشارة تشتت رامان المحفزة (SRS) المكتسبة ككسب رامان محفز (SRG) أو فقدان رامان محفز (SRL) خالية من الخلفية ، وتظهر تشابها طيفيا مثاليا مع تشتت رامان التلقائي 11,12. بالإضافة إلى ذلك ، يعتمد SRL و SRG خطيا على تركيز التحليل ، مما يسمح بالتحليل الكمي للمكونات الكيميائية الحيوية 9،11،13. تم استخدام المجهر الفلوري المثير ثنائي الفوتون (TPEF) على نطاق واسع للتصوير البيولوجي في الجسم الحي بسبب قدرته المتأصلة على التقسيم البصري ، وعمق الاختراق العميق ، وانخفاض السمية الضوئية 14،15،16. ومع ذلك ، يعتمد أداء تصوير TPEF على خصائص علامات الفلورسنت ، وعدد الألوان القابلة للحل محدود بسبب أطياف التألق عريض النطاق8،17،18،19. يعد تصوير SRS الخالي من الملصقات وتصوير TPEF القائم على التألق طريقتين للتصوير التكميلي ، ويمكن أن يوفر مزيجهما معلومات فيزيائية حيوية وكيميائية حيوية وفيرة للأنسجة. تعتمد هاتان الطريقتان للتصوير على العمليات البصرية غير الخطية (NLO) ، والتي تسمح بالتكامل البسيط في نظام مجهري واحد. يتيح الجمع بين التصوير SRS و TPEF ، ما يسمى بالتصوير ثنائي الوسائط ، التصوير عالي الأبعاد وتوصيف الخلايا والأنسجة ، مما يسهل فهما شاملا للأنظمة البيولوجية المعقدة. وعلى وجه التحديد، يمكن للفحص المجهري للبيكوثانية (ps) SRS تحقيق تصوير الرابطة الكيميائية بدقة طيفية عالية مقارنة بتقنية الفيمتو ثانية (fs) SRS11، مما يسمح بالتمييز بين مكونات كيميائية حيوية متعددة في الأنسجة البيولوجية، خاصة في منطقة بصمات الأصابع المزدحمة20،21. بالإضافة إلى ذلك، بالمقارنة مع نظام مجهر NLO مزدوج الوسائط شائع الاستخدام مع دمج مجهر متماسك مضاد لتشتت ستوكس (CARS)، يظهر SRS أداء متفوقا على CARS من حيث التفسير الطيفي والصورة وكذلك حساسية الكشف11. تم استخدام مجهر SRS-TPEF كأداة قوية لدراسة الأنظمة البيولوجية المختلفة ، مثل Caenorhabditis elegans9,22 ، Xenopus laevis tadpole brain5 ، دماغ الفأر 23,24 ، الحبل الشوكي 25,26 ، العصب المحيطي 27 ، والأنسجة الدهنية7 ، إلخ.
يشكل الحبل الشوكي مع الدماغ الجهاز العصبي المركزي (CNS). يعد تصور الأنشطة الخلوية في الجهاز العصبي المركزي في الجسم الحي في ظل الظروف الفسيولوجية والمرضية أمرا بالغ الأهمية لفهم آليات اضطرابات الجهاز العصبي المركزي28،29،30 ولتطوير العلاجات المقابلة31،32،33. يلعب غمد المايلين ، الذي يلف ويعزل المحاور العصبية للتوصيل المحتمل للعمل عالي السرعة ، دورا مهما في تطوير الجهاز العصبي المركزي. يعتقد أن إزالة الميالين هي السمة المميزة في اضطرابات المادة البيضاء، مثل التصلب المتعدد34. بالإضافة إلى ذلك ، بعد إصابة الحبل الشوكي35 ، يمكن لحطام المايلين تعديل تنشيط البلاعم ، مما يساهم في الالتهاب المزمن والإصابة الثانوية36. لذلك ، فإن التصوير في الجسم الحي لغمد المايلين مع الخلايا العصبية والخلايا الدبقية في نماذج الفئران الحية يساعد بشكل كبير على فهم العمليات الديناميكية في اضطرابات الجهاز العصبي المركزي.
في هذا البروتوكول ، يتم وصف إجراءات الإعداد الأساسية لمجهر TPEF-SRS المصنوع في المنزل ويتم تقديم طرق التصوير ثنائية الوسائط في الجسم الحي للحبل الشوكي للفأر.
Protocol
يتم إجراء جميع الإجراءات الحيوانية التي يتم تنفيذها في هذا العمل وفقا للمبادئ التوجيهية لمرفق المختبر التابع لجامعة هونغ كونغ للعلوم والتكنولوجيا (HKUST) وقد تمت الموافقة عليها من قبل لجنة أخلاقيات الحيوان في HKUST. مطلوب تدريب على السلامة للتعامل مع الليزر لإعداد وتشغيل مجهر TPEF-SRS. دائما ارتداء نظارات السلامة الليزر مع نطاق الطول الموجي المناسب عند التعامل مع الليزر.
1. إعداد مجهر TPEF-SRS (للإعداد التخطيطي انظر الشكل 1)
- استخدم مذبذبا بصريا بارامتري مدمجا (OPO) متصلا بليزر ألياف Ytterbium مغلق في الوضع كمصدر ليزر ps لتصوير SRS.
ملاحظة: يخرج OPO شعاع ستوكس (1031 نانومتر) وشعاع مضخة (قابل للضبط من 780 نانومتر إلى 960 نانومتر) مع مدة نبض 2 ثانية ومعدل تكرار 80 ميجاهرتز. يتم تعديل شعاع ستوكس عند 20 ميجاهرتز بواسطة مغير كهروضوئي مدمج (EOM) للكشف عن SRS عالي التردد الحساس للطور على مستوى MHz. - استخدم التيتانيوم fs (Ti): ليزر الياقوت كمصدر ليزر لتصوير TPEF.
- استخدم زوجا من العدسات (L1 وL2) لتجميع وضبط حجم شعاع fs إلى 3 مم.
- استخدم زوجا من العدسات (L3 و L4) لتجميع شعاع الليزر ps وتوسيع قطره إلى 3 مم.
- تغيير استقطاب شعاع الليزر fs من الاستقطاب p إلى الاستقطاب s باستخدام لوحة نصف موجة.
- اجمع بين شعاعي الليزر مع مقسم شعاع الاستقطاب (PBS).
- أضف زوجا من مرايا الجلفانومتر XY-scan مقاس 3 مم خلف PBS لمسح الشعاع.
- استخدم عدسة مسح ضوئي عن بعد (L5) وعدسة أنبوبية مصححة بلا حدود (L6) لاقتران مرآة المسح الضوئي والبؤبؤ الخلفي للعدسة الموضوعية 25x. قم بتوسيع شعاع الليزر بواسطة عدسة المسح الضوئي وعدسة الأنبوب لملء الفتحة الخلفية للهدف.
- ضع PBS أو مرآة ثنائية اللون (D2) بين عدسة الأنبوب والعدسة الموضوعية ل SRS أو مجموعة إشارات التألق. استخدم زعانف آلية للتبديل بين PBS و D2.
ملاحظة: يتم فقدان جزء من إشارة SRS المبعثرة إلى الخلف عند المرور عبر PBS نتيجة لاستقطابها المتغير عشوائيا. - استخدم زوجا من العدسات (L7 و L9) لتضييق شعاع الكشف واقتران التلميذ الخلفي للعدسة الموضوعية 25x بمستشعر الصمام الثنائي الضوئي.
- استخدم زوجا من العدسات (L8 و L10) لتضييق شعاع الكشف واقتران التلميذ الخلفي لهدف 25x بسطح الكشف الخاص بالمضاعف الضوئي (PMT).
- استخدم مرآة ثنائية اللون (D3) لفصل مسار الكشف عن إشارات التألق وإشارات SRS.
- ضع مجموعة مرشحات (Fs1) أمام كاشف الصمام الثنائي الضوئي لمنع ليزر ستوكس وتمرير شعاع المضخة فقط.
- ضع مجموعة مرشح (Fs2) أمام كاشف PMT لتمرير إشارة التألق المستهدفة فقط.
- قم بتوصيل PMT بمكبر صوت تيار لتضخيم الإشارة.
- قم بتوصيل الصمام الثنائي الضوئي بمضخم صوت مقفل.
- قم بتوصيل إشارة المزامنة من مخرج EOM المدمج بالإدخال المرجعي لمضخم القفل لإزالة إشارة SRS.
- قم بتوصيل مضخم الصوت PMT ومخرجات مضخم الصوت القفل بوحدة الحصول على البيانات.
2. TPEF-SRS معايرة نظام المجهر
- بدء تشغيل الليزر
- قم بتبديل مفتاح المفتاح من وضع الاستعداد إلى وضع التشغيل لتشغيل Ti: ليزر الياقوت وانتظر لمدة 30 دقيقة حتى يسخن الليزر.
- قم بتشغيل OPO بالنقر فوق الزر "ابدأ" في لوحة تحكم OPO وانتظر لمدة 20 دقيقة حتى يسخن الليزر.
- بعد تسخين ليزر ps ، استخدم كاشفا ضوئيا عالي السرعة للتحقق من عمق التعديل لشعاع ستوكس. افتح مصراع الليزر لشعاع ستوكس. انقر فوق مربع تعيين OPO Power وأدخل 20. ضع الكاشف الضوئي عالي السرعة عند مخرج OPO للكشف عن الشعاع. قم بتوصيل منفذ الإخراج الخاص بكاشف الصور بمنفذ الإدخال الخاص بمنظار الذبذبات باستخدام كابل محوري واحد مع موصل Bayonet Neill-Concelman (BNC) لمراقبة نبضة الليزر.
- افتح نافذة التحكم في EOM في برنامج التحكم OPO. اضبط قدرة EOM وطورها وفقا لمخطط شدة النبض الموضح على منظار الذبذبات لتحقيق أقصى عمق تعديل عند 20 ميجاهرتز.
ملاحظة: عادة ما يكون أداء EOM مستقرا ويجب التحقق منه فقط عند العثور على إشارة SRS منخفضة بشكل كبير.
- المحاذاة البصرية لمجهر TPEF-SRS المشترك
- قم بإجراء محاذاة بصرية للتوطين المشترك لحزم ps و fs كما هو موضح في الخطوات من 2.2.2 إلى 2.2.13.
- افتح مصراع ليزر المضخة أثناء إيقاف إخراج Stokes في برنامج التحكم OPO. استخدم برنامج التحكم OPO لضبط الطول الموجي لشعاع المضخة على 796 نانومتر بالنقر فوق مربع تعيين الإشارة وإدخال قيمة الطول الموجي 796. انقر فوق مربع ضبط طاقة OPO وأدخل 20 لضبط طاقته على الحد الأدنى (~ 20 mW) للمحاذاة البصرية.
- قم بتشغيل الكمبيوتر المجهري وجميع المكونات الإلكترونية المرتبطة به ، بما في ذلك الماسحات الضوئية ، والمحركات الموضوعية ، والثنائيات الضوئية ، و PMTs ، ومكبرات الصوت الحالية ، ومكبرات الصوت القفلية ، والزعانف الآلية. بدء تشغيل برنامج التحكم المجهر.
ملاحظة: برنامج التحكم في المجهر هو واجهة محلية الصنع. - ضع لوحين محاذاة (P1 و P2 في الشكل 1) على المسار البصري. ضع P1 خلف PBS على مسافة حوالي 10 سم وضع P2 خلف P1 على مسافة حوالي 30 سم.
ملاحظة: يتم الجمع بين الحزم ps و fs باستخدام PBS (الشكل 1). يتم استخدام لوحين المحاذاة للتحقق من المحاذاة وكذلك التوطين المشترك لشعاعي الليزر. - افتح مصراع المجهر لشعاع الليزر PS.
- اضبط المرآة M1 لتحديد موقع مركز شعاع الليزر ps عند فتحة P1. استخدم نطاق الأشعة تحت الحمراء (IR) لمراقبة موضع بقعة الشعاع عند P1 عند ضبط المرآة M1.
- اضبط المرآة M2 لتحديد موقع مركز شعاع الليزر ps عند فتحة P2. استخدم نطاق الأشعة تحت الحمراء لمراقبة موضع بقعة الشعاع عند P2 عند ضبط المرآة M2.
- كرر الخطوتين 2.2.6 و2.2.7 حتى يقع مركز شعاع ps في الفتحة العرضية لكل من لوحات المحاذاة. أغلق مصراع شعاع ps في برنامج التحكم في المجهر.
- اضبط الطول الموجي ل fs Ti: ليزر الياقوت عند 740 نانومتر وافتح مصراع الليزر. اضبط طاقة الليزر على 5 ميجاوات (يتم قياسها في منفذ الإدخال الخاص بنظام المجهر) للمحاذاة البصرية.
- افتح مصراع المجهر لشعاع الليزر fs.
- اضبط المرآة M3 لتحديد موقع مركز بقعة شعاع الليزر fs عند فتحة P1.
- اضبط المرآة M4 لتحديد موقع مركز بقعة شعاع الليزر عند فتحة P2.
- كرر الخطوتين 2.2.11 و2.2.12 حتى يقع مركز شعاع الليزر fs عند الثقوب الموجودة في لوحين محاذاة. أغلق مصراع المجهر لشعاع fs.
- إجراء التداخل المكاني للمضخة وعوارض ستوكس كما هو موضح في الخطوات من 2.2.15 إلى 2.2.18.
ملاحظة: على الرغم من أن المضخة وحزم ستوكس متداخلة تقريبا داخل ليزر PS ، إلا أن ضبط مواضع شعاعي الليزر مطلوب لتحقيق أداء SRS الأمثل. نظرا لأن شعاع المضخة محاذاة أولا كما هو موضح سابقا ، يتم ضبط شعاع ستوكس بعد ذلك ليتناسب مع شعاع المضخة. - ضع كاميرا في موضع الهدف لتصور موقع نقطتي شعاع. ضع علامة على موضع شعاع المضخة على شاشة الكاميرا كمرجع.
- ضع لوحة محاذاة P0 قبل L3 (الشكل 1). استخدم مفتاحا سداسيا لضبط المرآة البصرية 1 (OM1) بحيث يمر مركز شعاع ستوكس عبر ثقب لوحة المحاذاة ويتزامن مع شعاع المضخة في منفذ إخراج الليزر. استخدم نطاق الأشعة تحت الحمراء لتأكيد موضع بقعة الشعاع عند P0 أثناء الضبط.
ملاحظة: OM1 و OM2 هما مرآتان في رأس OPO لضبط موضع شعاع ستوكس 1031 نانومتر. - قم بإزالة لوحة المحاذاة P0 واستخدم المفتاح السداسي لضبط OM2 بحيث يتزامن مركز شعاع ستوكس مع العلامة المرجعية لشعاع المضخة على الكاميرا.
- كرر الخطوتين 2.2.16 و2.2.17 حتى يتداخل شعاع ستوكس بشكل صارم مع شعاع المضخة في كل من طائرات P0 والكاميرا.
ملاحظة: عند تصور بقع الشعاع على الكاميرا، يجب إزالة جميع لوحات المحاذاة من المسار البصري.
- تحسين ظروف التصوير
- قم بإجراء ضبط الطور لمضخم القفل كما هو موضح في الخطوات 2.3.2. إلى 2.3.7.
ملاحظة: يعتمد اكتشاف SRS على نظام حساس للطور عالي التردد. للكشف عن SRL ، يتم تعديل شدة شعاع ستوكس عند 20 ميجاهرتز ويتم استخدام مضخم صوت قفل لخفض الإشارة. يجب ضبط مرحلة وإزاحة مضخم الصوت القفل لتحقيق تباين الصورة الأمثل. - افتح برنامج التحكم في مضخم الصوت القفل.
- اضبط الطول الموجي لليزر المضخة على 796 نانومتر وقوة المضخة وشعاع ستوكس لتكون 15 ميجاوات و25 ميجاوات على العينة ، على التوالي.
ملاحظة: هنا استخدم زيت الزيتون لتحسين ومعايرة تصوير SRS. تبلغ ذروة رامان لزيت الزيتون في منطقة الكربون والهيدروجين 2863.5 سم - 1 ، المقابلة للطول الموجي لشعاع المضخة عند 796 نانومتر. - أغلق زيت الزيتون في شريحة وقم بتوصيل ورقة مناديل مطوية بالجزء السفلي من الشريحة لتعزيز تشتت الإشارة مرة أخرى للكشف عن epi-SRS. ضع عينة زيت الزيتون على المسرح واضبط تركيز هدف 25x على العينة.
- استخدم برنامج التحكم في المجهر لتعيين معلمات التصوير على النحو التالي: 512 × 512 بكسل لمجال رؤية 500 ميكرومتر × 500 ميكرومتر (FOV) ، 6.4 ميكروثانية بكسل وقت الإقامة. استخدم برنامج التحكم في مضخم الصوت القفل لتعيين القيمة الثابتة للوقت لتكون 10 ميكروثانية ، وهي قريبة من وقت سكن البكسل.
- امسح شعاع الليزر فوق العينة. استخدم برنامج التحكم في مضخم الصوت القفل لضبط المرحلة (0-180 درجة) بحجم خطوة يبلغ 22.5 درجة حتى تصل كثافة إشارة SRS إلى الحد الأقصى.
ملاحظة: في مضخم الصوت التناظري بالكامل هذا، يكون خرج الإشارة هو المكون داخل الطور، والذي يعتمد على طور الإشارة المرجعية. يمكن ضبط المرحلة بواسطة برنامج التحكم في مضخم الصوت القفل بدقة 11 درجة ، مما يسمح بزيادة الإشارة المكتشفة إلى أقصى حد ممكن في حدود ~ 2٪ 12. يخرج مضخم القفل من الطور بمجرد تعطل إشارة المزامنة. يجب إعادة ضبط المرحلة في كل مرة يتم فيها إعادة إنشاء إشارة المزامنة. - امسح العينة ضوئيا باستخدام مصراع الليزر المغلق. استخدم برنامج التحكم في مضخم الصوت القفل لضبط قيمة الإزاحة بحجم خطوة 1 mV حتى يقترب متوسط إشارة SRS من الصفر.
ملاحظة: يقدر متوسط إشارة SRS على أنه متوسط كثافة جميع وحدات البكسل في صورة SRS ، والتي يتم حسابها تلقائيا بواسطة برنامج التحكم في المجهر. الإزاحات مفيدة لإلغاء الإشارات غير المتماسكة للطور. - قم بإجراء تحسين المزامنة الزمنية كما هو موضح في الخطوات من 2.3.9 إلى 2.3.14.
- افتح مربع الحوار " إدارة التأخير" (الشكل 2) في برنامج التحكم OPO.
- امسح زيت الزيتون واضبط مرحلة التأخير حتى تصل إشارة SRS لزيت الزيتون إلى الحد الأقصى.
ملاحظة: لأول مرة من تصوير SRS ، عندما لا يتم تحسين مرحلة مضخم الصوت القفل ، يتم أولا ضبط المزامنة الزمنية تقريبا لتصور إشارة SRS للعينة قبل تحسين مرحلة مضخم صوت القفل. - توقف عن المسح الضوئي وانقر فوق الزر " إضافة بيانات" في مربع حوار مدير التأخير لتسجيل بيانات التأخير الحالية.
- كرر الخطوات 2.3. 10 و 2.3.11 للعينات الكيميائية المختلفة بأطوال موجية مختلفة.
ملاحظة: يتم استخدام حبات البوليسترين والماء الثقيل و 5-Ethynyl-2′-deoxyuridine والجلسرين لقياس بيانات التأخير في نطاقات اهتزازية مختلفة. - حدد احتواء البيانات والترتيب 5 في مربع حوار مدير التأخير لملاءمة نقاط البيانات الحالية مع الدالة متعددة الأسماء من الدرجة الخامسة. قم بتطبيق البيانات المجهزة بالنقر فوق الزر استخدام كمخصص وتحديد خانة الاختيار. سيتم ضبط مرحلة التأخير تلقائيا بأطوال موجية مختلفة وفقا لمنحنى التأخير المجهز.
- احفظ جميع بيانات التأخير في ملف نصي ، والذي يمكن تحميله للاستخدام في المستقبل.
- قم بإجراء ضبط الطور لمضخم القفل كما هو موضح في الخطوات 2.3.2. إلى 2.3.7.
3. التحضير الجراحي للفأر للتألق في الجسم الحي والتصوير SRS
- قم بتعقيم جميع الأدوات المطلوبة ، بما في ذلك المشارط والمقص الربيعي والملقط والأغطية ووسادات الشاش.
- تطهير جميع الأسطح ، والتي سيتم لمسها أثناء الجراحة مع 70 ٪ من الإيثانول. قم بتغطية منطقة العمل على الطاولة بستائر معقمة. ضع وسادة تدفئة تحت الستائر.
- استخدم Thy1-YFP-H (Tg(Thy1-YFP)HJrs/J)37 الفئران المعدلة وراثيا التي تعبر عن بروتين التألق الأصفر المحسن (EYFP) في الخلايا العصبية المرتبطة بعقدة الجذر الظهرية لتصوير الحبل الشوكي في الجسم الحي. وزن الفأر والحث على التخدير عن طريق الحقن داخل الصفاق (i.p) من خليط الكيتامين-زيلازين (87.5 ملغ كغ-1 و 12.5 مغ كغ-1).
- قرصة إصبع القدم من الماوس لضمان التخدير العميق. تكملة مع نصف الجرعة الأصلية من التخدير إذا لزم الأمر. ضع مرهما على عيون الفأر لمنع جفاف القرنية.
- حلق الشعر على الظهر فوق العمود الفقري الصدري ، ثم قم بإزالة الشعر بالكامل باستخدام كريم إزالة الشعر. تطهير المنطقة المحلوقة بمحلول اليود.
- قم بعمل شق صغير في خط الوسط (~ 1.5 سم) من الجلد فوق فقرة T11-T13 باستخدام مشرط.
- شق العضلات والأوتار على جانبي فقرة T11-T13 باستخدام مقص زنبركي وملقط. كشف الفقرات الثلاث المجاورة. استخدم وسادات الشاش المعقمة والمياه المالحة المعقمة للسيطرة على النزيف وتنظيف موقع الجراحة.
- قم بتثبيت العمود الفقري بمساعدة الشريطين الجانبيين من الفولاذ المقاوم للصدأ على مرحلة تثبيت مصممة خصيصا (الشكل 2B).
- استخدم ملقط #2 لإجراء استئصال الصفيحة الفقرية في T12. استخدم الملقط بعناية لكسر الصفيحة قطعة قطعة حتى تتم إزالة الصفيحة الكاملة للفقرة T12.
- اغسل الدم الذي يغطي الحبل الشوكي بمحلول ملحي معقم واستخدم وسادة الشاش لامتصاص السوائل الزائدة. اضغط على موقع النزيف باستخدام قطعة من وسادة الشاش للسيطرة على النزيف.
- ضع غطاء (22 × 22 مم) على شريط التثبيت واملأ المسافة الفاصلة بين الغطاء والحبل الشوكي بمحلول ملحي.
4. في الجسم الحي TPEF-SRS التصوير من الحبل الشوكي الماوس
- قم بتركيب مرحلة التثبيت على مرحلة من خمسة محاور تحت مجهر TPEF-SRS.
ملاحظة: تسمح المرحلة المكونة من خمسة محاور بالترجمة ثلاثية المحاور وحركة انحسار الميل واللفة ±5 درجات. - قم بتأمين رأس الماوس بقضيبي رأس وخفض لوحة الإمساك لتوفير مساحة كافية لحركة الصدر أثناء التنفس ، مما يخفف من التحف المتحركة.
- أدخل وسادة تسخين أسفل الماوس للحفاظ على دفء الماوس أثناء التصوير.
- اضبط المرحلة الانتقالية z لضبط التركيز البؤري حتى يمكن ملاحظة صورة المجال الساطع للأوعية الدموية في الحبل الشوكي تحت هدف 10x.
- حدد موقع الوريد الظهري للحبل الشوكي في وسط FOV عن طريق ضبط المرحلة الانتقالية ذات المحورين للمرحلة ذات المحاور الخمسة.
- اضبط زوايا اللفة والميل لمرحلة المحاور الخمسة لضبط السطح الظهري للحبل الشوكي عموديا على المحور الموضوعي استنادا إلى صورة المجال الساطع.
- استبدل 10x بهدف غمر الماء 25x لتصوير TPEF-SRS.
- اضبط الطول الموجي لشعاع fs على 920 نانومتر. اضبط طاقة شعاع fs لتكون 10 ميجاوات على العينة.
- اضبط الطول الموجي لشعاع المضخة على 796 نانومتر. اضبط قوة المضخة وشعاع ستوكس لتكون 60 ميجاوات و75 ميجاوات على العينة على التوالي.
ملاحظة: يتم إجراء تصوير SRS للحبل الشوكي عند الرقم الموجي 2863.5 سم-1 ، والذي يتوافق مع ذروة رامان لأغماد المايلين في منطقة الكربون والهيدروجين بناء على أطياف SRS المقاسة7,9. تم تصميم قوة الليزر لضمان تصوير TPEF-SRS عالي الدقة للحبل الشوكي. لا يلاحظ تلف الأنسجة في ظل ظروف التصوير الحالية. - بالنسبة لتصوير SRS، حدد PBS فوق الهدف باستخدام زعانف مزودة بمحرك عن طريق الضغط على زر التبديل المتصل بالزعانف المزودة بمحرك.
- اضبط معلمات التصوير على النحو التالي: 512 × 512 بكسل ل 150 ميكرومتر × 150 ميكرومتر FOV ، 3.2 ميكروثانية بكسل وقت الإقامة ، 2 ميكروثانية الوقت ثابت.
- ابدأ في مسح العينة وضبط التركيز على السطح الظهري للحبل الشوكي.
- قم بضبط مرحلة التأخير بدقة بواسطة برنامج التحكم OPO حتى يتم تحقيق أقصى إشارة SRS للحبل الشوكي.
ملاحظة: يمكن أن تحفز العينات البيولوجية تشتتا لونا إضافيا ، وقد تتطلب مرحلة التأخير تعديلها لتحسين التزامن الزمني. ومع ذلك ، عندما يتم إجراء تصوير SRS بالقرب من السطح العلوي للنسيج ، فإن الفرق الزمني بين نبضتي الليزر اللتين أدخلهما النسيج البيولوجي ونافذة التصوير عادة ما يكون صغيرا (أقل من عدة مئات من fs). - لتصوير TPEF ، حدد المرآة ثنائية اللون D2 فوق الهدف باستخدام زعانف آلية عن طريق الضغط على زر التبديل المتصل بالزعانف الآلية.
- اضبط معلمات التصوير وابدأ في مسح العينة. لالتقاط مكدس صور TPEF-SRS ، احصل على صور TPEF و SRS بالتتابع مع فاصل زمني 1 ثانية بنفس العمق قبل الانتقال إلى العمق التالي. معلمات التصوير لتصوير TPEF هي 512 × 512 بكسل ، 150 ميكرومتر × 150 ميكرومتر FOV ، 3.2 ميكروثانية بكسل وقت السكن.
- قم بإزالة الحيوان من مرحلة التثبيت بعد جمع جميع الصور.
- نظف الأنسجة المكشوفة عن طريق تنظيف المياه المالحة وامتصاص السوائل الزائدة باستخدام وسادة شاش. ضع جل السيليكون على الحبل الشوكي المكشوف وانتظر لمدة 5 دقائق تقريبا حتى يتم علاجه.
- خياطة الجلد مع # 6-0 خياطة جراحية لإغلاق الجرح. ضع كريم الحروق على جلد الموقع الجراحي لمنع العدوى. إدارة العلاج المسكن تحت الجلد (0.1 مغ / كغ من البوبرينورفين).
- ضع الحيوان في قفص نظيف وضع القفص على وسادة تدفئة حتى يتعافى الفأر تماما من التخدير.
- كرر إعطاء مسكن كل 12 ساعة لمدة 3 أيام بعد الجراحة.
- أغلق غالق OPO و fs laser. اضبط قوة المضخة وشعاع ستوكس على الحد الأقصى.
ملاحظة: يعد إعداد الطاقة القصوى قبل إيقاف تشغيل الليزر مفيدا لصيانة الليزر. - اضبط الطول الموجي لشعاع المضخة وليزر fs على 800 نانومتر.
- اضبط جهازي الليزر في وضع الاستعداد ، وأغلق جميع برامج التحكم في الإلكترونيات وأوقف تشغيل جميع المعدات المرتبطة بها.
النتائج
في الجسم الحي ، يتم إجراء التصوير ثنائي الوسائط للمحاور الشوكية وكذلك أغماد المايلين باستخدام الفئران المعدلة وراثيا Thy1-YFPH ، والتي تعبر عن EYFP في الخلايا العصبية العقدية الجذرية الظهرية (الشكل 3). تنقل هذه الخلايا العصبية القريبة المعلومات الحسية من العصب المحيطي إلى الحبل الشوكي ، مع وجود الفرع المركزي في العمود الظهري للحبل الشوكي. باستخدام مجهر TPEF-SRS ، يمكن تصور غمد المايلين الموزع بكثافة بوضوح باستخدام تصوير SRS الخالي من الملصقات ، ويمكن ملاحظة محاور YFP ذات العلامات المتناثرة باستخدام تصوير TPEF. ويكشف التصوير ثنائي النموذج أن المحاور العصبية ملفوفة عن كثب بواسطة طبقة سميكة من أغماد المايلين (الشكل 3C). تلعب عقد رانفييه (NR) ، حيث يكون axolemma عاريا من غمد المايلين ، دورا أساسيا في الانتشار الملحي السريع لإمكانات العمل. كما يتضح من صورة الحبل الشوكي TPEF-SRS (الشكل 3C) ، يظهر NR انخفاض القطر المحوري والمحور المعرض مباشرة للمصفوفة خارج الخلية. من الضروري تصوير المحاور العصبية مع أغماد المايلين المحيطة بها لتأكيد وجود وموقع NR. لذلك ، يسمح لنا الفحص المجهري TPEF-SRS بمراقبة التغيرات الديناميكية للمحاور العصبية وأغماد المايلين في تطور اضطرابات الحبل الشوكي ، وهو أمر مهم لفهم آليات الديناميكيات الخلوية.

الشكل 1: الرسم التخطيطي لنظام المجهر TPEF-SRS. يتم الجمع بين المضخة وعوارض ستوكس مع مرآة ثنائية اللون (D1) في ليزر بيكو ثانية (ps). يتم تجميع شعاع ps وشعاع الفيمتو ثانية (fs) وتوسيعهما / تضييقهما بواسطة زوج من العدسات (L3 و L4 و L1 و L2 على التوالي) لمطابقة مرايا الجلفانومتر XY-scan مقاس 3 مم. يتم تدوير شعاع fs من الاستقطاب الأفقي إلى الرأسي بواسطة لوحة نصف موجة (HWP) ، ثم يتم دمجه مع شعاع ps بواسطة مقسم شعاع استقطابي (PBS). يتم اقتران مرايا المسح الضوئي والبؤبؤ الخلفي للعدسة الموضوعية بعدسة مسح ضوئي عن بعد L5 وعدسة أنبوبية L6 مصححة إلى ما لا نهاية. يتم توسيع شعاع الليزر بواسطة عدسة المسح الضوئي والأنبوب لملء الفتحة الخلفية لهدف 25x. بالنسبة لتصوير تشتت رامان المحفز (SRS) ، ينعكس شعاع المضخة المتناثر الخلفي الذي تم جمعه بواسطة الهدف بواسطة PBS ويتم توجيهه إلى مساحة كبيرة (10 مم × 10 مم) من السيليكون الثنائي (PD). بالنسبة للتصوير ثنائي الفوتون ، تنعكس إشارة التألق المثار ثنائي الفوتون (TPEF) بواسطة مقسم شعاع ثنائي اللون D2 إلى وحدة الكشف الضوئي. يتم استخدام وحدة المضاعف الضوئي الحالية (PMT) للكشف عن إشارة TPEF. الاختصارات-L1-L10: العدسات. OL: عدسة موضوعية. D1-D3: المرايا ثنائية اللون ؛ Fs1 ، Fs2: مجموعات المرشحات ؛ M: المرايا. OM1 ، OM2: المرايا البصرية ؛ P0-P2: لوحات المحاذاة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
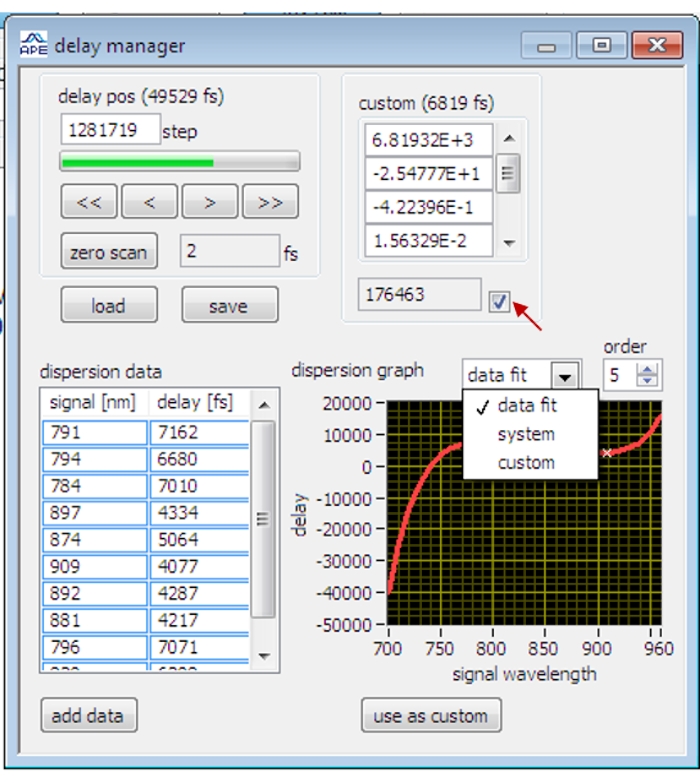
الشكل 2: واجهة مدير التأخير على برنامج التحكم OPO. يشير السهم الأحمر إلى خانة الاختيار الخاصة بتطبيق بيانات التأخير المعايرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
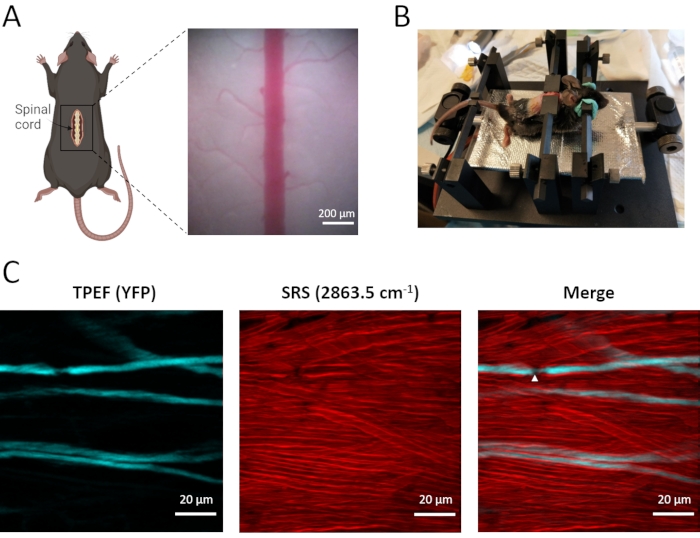
الشكل 3: تصوير TPEF-SRS في الجسم الحي للحبل الشوكي للفأر. (أ) رسم تخطيطي للتحضير الجراحي للحبل الشوكي للفأر وصورة المجال الساطع للحبل الشوكي. (ب) مخطط تركيب الماوس للتصوير في الجسم الحي للحبل الشوكي. (ج) صور الإسقاط القصوى z للمحاور العصبية وأغماد المايلين في الحبل الشوكي للفأر. تشير رؤوس الأسهم البيضاء إلى موقع عقدة رانفييه. يتم التقاط صور SRS للمايلين عند تحول رامان من 2863.5 سم إلى 1. تم إنشاء الشكل A باستخدام BioRender (https://biorender.com/). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذا البروتوكول ، يتم وصف الإعداد الأساسي لمجهر TPEF-SRS بالتفصيل. بالنسبة لتصوير SRS ، تتداخل المضخة وحزم Stokes زمنيا ومكانيا داخل OPO. ومع ذلك ، يمكن تعطيل هذا التداخل بعد المرور عبر نظام المجهر. لذلك ، فإن كل من التحسين المكاني والزماني للتوطين المشترك للمضخة وعوارض ستوكس ضروري وحاسم لتحقيق التصوير الأمثل SRS. يرتبط التأخير الزمني بين المضخة وشعاع ستوكس باختلاف المسار البصري للحزمتين، والذي يتم تحديده من خلال تشتت العناصر البصرية في نظام المجهر38. عندما يتم ضبط الطول الموجي لشعاع المضخة لتصوير SRS عند إزاحات رامان المختلفة، يتغير طول المسار البصري لشعاع المضخة وفقا لذلك لأن معامل الانكسار للعدسات البصرية يعتمد على الطول الموجي38. لذلك ، يتغير التأخير الزمني بين المضخة ونبضة ليزر ستوكس مع الطول الموجي لشعاع المضخة وبالتالي يحتاج إلى معايرة. تم تجهيز OPO بخط تأخير يتم التحكم فيه بواسطة برنامج للمزامنة الزمنية للمضخة وشعاع Stokes. بالنسبة لنفس الإعداد البصري ، تظل بيانات التأخير مستقرة وتحتاج إلى معايرة مرة واحدة فقط. ونتيجة لذلك ، يمكن حفظ بيانات التأخير عند أطوال موجية مختلفة لشعاع المضخة عند القياس الأول للاستخدام في المستقبل. يمكن تطبيق بيانات التأخير المعايرة تلقائيا بواسطة برنامج التحكم OPO عند تغيير الطول الموجي لشعاع المضخة ، وهو مناسب لتصوير SRS في نوبات رامان المختلفة أو تصوير SRS الفائق الطيف. بالنسبة لتصوير TPEF-SRS ، يعد التداخل المكاني الصارم لحزم ps و fs بعد الدمج خطوة حاسمة لتجنب أي تحول FOV بين طرازي التصوير. أولا ، يتم محاذاة شعاع مضخة ps وشعاع fs للتأكد من وجودهما على المحور البصري لنظام المجهر ، وهو أمر بالغ الأهمية لتجنب أي تحول FOV عند تبديل نموذجي التصوير. بعد ذلك ، باستخدام شعاع المضخة كمرجع ، يتم ضبط موضع شعاع ستوكس وفقا لذلك لتحقيق توطين مكاني صارم. يتطلب كل إجراء محاذاة عدة تجارب للوصول إلى المستوى الأمثل.
إذا انخفضت إشارة SRS بشكل كبير ، فيجب التحقق أولا من قيمة الطور لمضخم القفل وبيانات تأخير الوقت. نظرا لأن مضخم القفل يخرج من الطور بمجرد تعطل إشارة المزامنة، فإن قيمة الطور تتطلب إعادة ضبطها في كل مرة بعد انقطاع مزود الطاقة أو إشارة مزامنة EOM. يمكن التحقق بسرعة من التزامن الزمني للمضخة وشعاع ستوكس عن طريق ضبط خط التأخير قليلا داخل OPO. إذا كانت بيانات تأخير الوقت المعايرة بعيدة كل البعد عن القيمة المثلى، فيجب إجراء فحص صفري لإعادة معايرة إزاحة التأخير بالنقر فوق الزر "مسح ضوئي صفري " في مربع حوار مدير التأخير. يستغرق إجراء المسح الضوئي الصفري بأكمله حوالي 10 دقائق. إذا فشلت إشارة SRS في الاسترداد بعد تحسين قيمة الطور والتأخير الزمني ، فيجب التحقق من تعديل EOM لشعاع Stokes كما هو موضح في الخطوات 2.1.3-2.1.4. إذا كانت نسبة الانقراض أقل بكثير من 10 ديسيبل مع ملاحظة قمم النبض الصغيرة في الموقع الخارجي لقطار نبض ستوكس ، فيجب إعادة تشغيل EOM ، ويجب إعادة ضبط قوة التشكيل والطور لتحقيق أقصى عمق للتعديل. عادة ، يمكن حل مشكلة التشكيل عن طريق إعادة تعيين EOM. إذا لم يكن الأمر كذلك ، فيجب أن يكون الدعم الفني من الشركة المصنعة مطلوبا.
لتصوير الأنسجة السميكة في الجسم الحي ، يجب استخدام وضع الكشف epi-SRS. في هذا البروتوكول ، يتم استخدام PBS لتمرير ليزر الإثارة وعكس إشارة SRS المتناثرة إلى الكاشف. تعتمد إشارة SRL المكتشفة على التشتت الخلفي لشعاع المضخة الأمامية بواسطة الأنسجة. يحتوي ليزر الإثارة على استقطاب خطي ويمكن أن يمر بالكامل عبر PBS ، في حين أن الحزمة المتناثرة عكسيا قد حولت الاستقطاب وبالتالي لا يمكن أن تنعكس إلا جزئيا بواسطة PBS. لذلك ، يظهر مخطط جمع الإشارات الحالي كفاءة أقل مقارنة بالاستراتيجية التي تضع مباشرة كاشفا ضوئيا حلقيا أمام الهدف12. ومع ذلك، ونظرا للتشتت القوي للأنسجة الغنية بالدهون39، يمكن الحصول على صور SRS عالية النسبة من الإشارة إلى الضوضاء (512 × 512 بكسل) من الحبل الشوكي مع وقت تكامل 1-2 ثانية، مما يجعل مخطط التجميع القائم على PBS نهجا مناسبا لتصوير الحبل الشوكي. من ناحية أخرى ، ومع ذلك ، فإن تشتت الأنسجة القوية يحد من عمق اختراق الضوء. بالنسبة لكل من تصوير SRS و TPEF ، يقتصر عمق التصوير للحبل الشوكي على حوالي 50 ميكرومتر.
يعد إجراء التصوير المتسلسل لتصوير SRS و TPEF هو القيد الرئيسي لطريقة التصوير ثنائية الوسائط الحالية. في البروتوكول ، يتم إجراء تصوير TPEF و SRS في نفس الموقع بالتتابع مع فاصل زمني 1 ثانية عن طريق تبديل الزعانف الآلية تلقائيا. قد تتسبب القطع الأثرية المتحركة في دمج غير كامل لصور TPEF و SRS ، مما يحد من قدرة هذه الطريقة على تصوير العمليات أو الأنسجة الديناميكية للغاية المتأثرة إلى حد كبير بتنفس الحيوانات ونبضات قلبها. أحد الحلول الممكنة هو جمع التألق ثنائي الفوتون المثير بالليزر في وقت واحد أثناء تصوير SRS9. ومع ذلك ، فإن هذه الطريقة قابلة للتطبيق فقط على الهياكل البيولوجية ذات إشارات التألق القوية ، لأن نبضة ps لديها كفاءة إثارة تألق أقل بكثير مقارنة بنبض fs 14. بدلا من ذلك ، يمكن حل المشكلة باستخدام نظام fs-SRS22,40 ، حيث يسمح مصدر ليزر fs بالإثارة المتزامنة لإشارات SRS و TPEF بفعالية ، على حساب الدقة الطيفية المنخفضة لتصوير SRS. حل آخر هو استخدام التألق المثار بالليزر ps الذي تم الحصول عليه أثناء تصوير SRS كمرجع لتسجيل صور التألق fs. كما هو موضح في الشكل 3 ، تعمل استراتيجية التسجيل هذه بشكل جيد إذا لم تحدث حركة كبيرة أثناء التصوير الفلوري والتصوير الفلوري.
يظهر SRS مزايا فريدة في التصوير البيولوجي لأنه يوفر معلومات كيميائية عن الجزيئات الحيوية بناء على آلية التباين المحددة الخالية من الملصقات41. بالمقارنة مع CARS التي تم دمجها أيضا مع TPEF للتصوير NLO متعدد الوسائط ، أظهرت SRS قدرة أفضل على تفسير الطيف والصور11. لذلك ، تم تطبيقه على نطاق واسع لتصوير الدهون 9,11 ، البروتين 42,43 ، DNA44 ، والمكونات الحيوية المتعامدة التي تحتوي على الألكين (C ≡ C) 13,45 ، الكربون - الديوتيريوم (C−D) 9،46 وروابط الأكسجين والديوتيريوم (O-D) 47،48 في الأنسجة البيولوجية. في هذا البروتوكول ، استخدمنا مصدر ليزر PS لتصوير SRS ومصدر ليزر fs لتصوير TPEF ، والذي يجمع بين مزايا الإثارة الفلورية الفعالة ودقة رامان الطيفية العالية ، مما يسمح بالتمايز الفعال للجزيئات الحيوية المتنوعة 42,44. في الحبل الشوكي، تساهم التفاعلات المعقدة بين الخلايا والبيئة الدقيقة التي تنطوي على الخلايا الدبقية والخلايا العصبية والخلايا المناعية المعينة في تطور الإصابة49 والأمراض50. جنبا إلى جنب مع العديد من تحقيقات التصوير الفلورية و SRS ، يمكن للفحص المجهري TPEF-SRS تحقيق التصوير المتزامن لمختلف الهياكل الخلوية بالإضافة إلى مكوناتها الجزيئية الحيوية المتميزة ، والتي يمكن أن تسهل بشكل كبير فهمنا لظهور وتطور اضطرابات الحبل الشوكي.
Disclosures
وليس لدى المؤلفين ما يفصح عنه وليس لديهما مصالح مالية منافسة.
Acknowledgements
تم دعم هذا العمل من قبل مجلس هونغ كونغ للمنح البحثية من خلال المنح 16103215 16148816 16102518 16102920 و T13-607/12R و T13-706/11-1 و T13-605/18W و C6002-17GF و C6001-19E و N_HKUST603/19 ولجنة الابتكار والتكنولوجيا (ITCPD/17-9) ومخطط مجال التميز للجنة المنح الجامعية (AoE / M-604/16 و AOE / M-09/12) وجامعة هونغ كونغ للعلوم والتكنولوجيا (HKUST) من خلال المنحة RPC10EG33.
Materials
| Name | Company | Catalog Number | Comments |
| #2 Forceps | Dumont | 11223-20 | For laminectomy |
| 10X objective | Nikon | CFI Plan Apo Lambda 10X | |
| 25X objective | Olympus | XLPLN25XSVMP2 | |
| Burn cream | Betadine | ||
| Camera | Sony | α6300 | |
| Current amplifier | Stanford research | SR570 | |
| Current photomultiplier modules | Hamamatsu | H11461-01 | |
| D2 665 nm long-pass dichroic mirror | Semrock | FF665-Di02-25x36 | For directing epi-fluorescence signal to the detection module |
| D3 700 nm short-pass dichroic mirror | Edmund | 69-206 | For separating SRS from TPEF detection path |
| Depilating cream | Veet | ||
| FS1 975 nm short-pass filter | Edmund | 86-108 | For blocking stokes beam |
| FS1 Bandpass filter | Semrock | FF01-850/310 | For blocking stokes beam |
| Fs2 Bandpass filter | Semrock | FF01-525/50 | For selecting YFP signal |
| Fs2 Shortpass filter | Semrock | FF01-715/SP-25 | For blocking fs excitation laser beam |
| Half-wave plate | Thorlabs | SAHWP05M-1700 | |
| High-speed photodetector | MenloSystems | FPD 310-F | For checking Stokes beam modulation |
| Iodine | Betadine | ||
| IR Scope | FJW | FIND-R-SCOPE Infrared Viewer 2X Kit Model 84499C2X | |
| Iris | Thorlabs | CPA1 | |
| L1 | Thorlabs | AC254-060-B-ML | |
| L10 | Thorlabs | LA4052-A | |
| L2 | Thorlabs | LA1422-B | |
| L3 | Thorlabs | AC254-050-B | |
| L4 | Thorlabs | AC254-060-B-ML | |
| L7 | f=100 mm, AB coating | ||
| L8 | Thorlabs | LA4874-A | |
| L9 | Thorlabs | AC254-035-B-ML | |
| Lock-in amplifier | APE | ||
| Mirror | Thorlabs | PF10-03-P01 | |
| Motorized flipper | Thorlabs | MFF101/M | |
| multifunctional acquisition card | National Instrument | PCIe-6363 | |
| Oscilloscope | Tektronix | TDS2012C | |
| Photodiode | APE | For detecting SRS signal | |
| Picosecond laser source | APE | picoEmerald | |
| Polarizing beam splitter | Thorlabs | CCM1-PBS252/M | |
| Power meter | Newport | 843-R | |
| Saline | Braun | ||
| Scan lens L5 | Thorlabs | SL50-CLS2 | |
| Scanning mirror | Cambridge Technology | 6215H | |
| Silicone gel | World Precision Inc. | KWIK-SIL | |
| Ti:sapphire fs laser | Coherent | Chameleon Ultra II | |
| Tube lens L6 | Thorlabs | TTL200-S8 |
References
- Raman, C. V., Krishnan, K. S. The optical analogue of the compton effect. Nature. 121 (3053), 711(1928).
- Turrell, G., Corset, J. Raman Microscopy: Developments and Applications. , Academic Press. (1996).
- Tian, F., et al. Monitoring peripheral nerve degeneration in ALS by label-free stimulated Raman scattering imaging. Nature Communications. 7 (1), 13283(2016).
- Shi, Y., et al. Longitudinal in vivo coherent anti-Stokes Raman scattering imaging of demyelination and remyelination in injured spinal cord. Journal of Biomedical Optics. 16 (10), 106012(2011).
- Hu, C. R., Zhang, D., Slipchenko, M. N., Cheng, J. -X., Hu, B. Label-free real-time imaging of myelination in the Xenopus laevis tadpole by in vivo Stimulated Raman Scattering Microscopy. Journal of Biomedical Optics. 19 (8), 086005(2014).
- Den Broeder, M. J., et al. Altered adipogenesis in Zebrafish larvae following high fat diet and chemical exposure is visualised by Stimulated Raman Scattering Microscopy. International Journal of Molecular Sciences. 18 (4), 894(2017).
- He, S., et al. In vivo metabolic imaging and monitoring of brown and beige fat. Journal of Biophotonics. 11 (8), (2018).
- Wang, M. C., Min, W., Freudiger, C. W., Ruvkun, G., Xie, X. S. RNAi screening for fat regulatory genes with SRS microscopy. Nature Methods. 8 (2), 135-138 (2011).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by Stimulated Raman Scattering Microscopy. Analytical Chemistry. 91 (3), 2279-2287 (2019).
- Zhang, C., Li, J., Lan, L., Cheng, J. -X. Quantification of lipid metabolism in living cells through the dynamics of lipid droplets measured by Stimulated Raman Scattering Imaging. Analytical Chemistry. 89 (8), 4502-4507 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by Stimulated Raman Scattering Microscopy. Science. 322 (5909), 1857-1861 (2008).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with Stimulated Raman Scattering. Science. 330 (6009), 1368-1370 (2010).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and Stimulated Raman Scattering Microscopy using a probe of the aggregation-induced emission characteristic. Journal of the American Chemical Society. 139 (47), 17022-17030 (2017).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Pawlicki, M., Collins, H. A., Denning, R. G., Anderson, H. L. Two-photon absorption and the design of two-photon dyes. Angewandte Chemie International Edition. 48 (18), 3244-3266 (2009).
- König, K. Multiphoton microscopy in life sciences. Journal of Microscopy. 200 (2), 83-104 (2000).
- Dean, K. M., Palmer, A. E. Advances in fluorescence labeling strategies for dynamic cellular imaging. Nature Chemical Biology. 10 (7), 512-523 (2014).
- Tsurui, H., et al. Seven-color fluorescence imaging of tissue samples based on fourier spectroscopy and singular value decomposition. Journal of Histochemistry & Cytochemistry. 48 (5), 653-662 (2000).
- Niehörster, T., et al. Multi-target spectrally resolved fluorescence lifetime imaging microscopy. Nature Methods. 13 (3), 257-262 (2016).
- Zhang, X., et al. Label-free live cell imaging of nucleic acids using Stimulated Raman Scattering (SRS) Microscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 13 (4), 1054-1059 (2012).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 7715(2018).
- Li, X., et al. Integrated femtosecond stimulated Raman scattering and two-photon fluorescence imaging of subcellular lipid and vesicular structures. Journal of Biomedical Optics. 20 (11), 110501(2015).
- Imitola, J., et al. Multimodal coherent anti-Stokes Raman scattering microscopy reveals microglia-associated myelin and axonal dysfunction in multiple sclerosis-like lesions in mice. Journal of Biomedical Optics. 16 (2), 021109(2011).
- Uckermann, O., et al. Label-free multiphoton microscopy reveals altered tissue architecture in hippocampal sclerosis. Epilepsia. 58 (1), 1-5 (2017).
- Tamosaityte, S., et al. Inflammation-related alterations of lipids after spinal cord injury revealed by Raman spectroscopy. Journal of Biomedical Optics. 21 (6), 061008(2016).
- Uckermann, O., et al. Endogenous two-photon excited fluorescence provides label-free visualization of the inflammatory response in the rodent spinal cord. BioMed Research International. 2015, 859084(2015).
- van Hameren, G., et al. In vivo real-time dynamics of ATP and ROS production in axonal mitochondria show decoupling in mouse models of peripheral neuropathies. Acta Neuropathologica Communications. 7 (1), 1-16 (2019).
- Davalos, D., et al. Fibrinogen-induced perivascular microglial clustering is required for the development of axonal damage in neuroinflammation. Nature Communications. 3 (1), 1-15 (2012).
- Ylera, B., et al. Chronically CNS-injured adult sensory neurons gain regenerative competence upon a lesion of their peripheral axon. Current Biology. 19 (11), 930-936 (2009).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Lau, S. -F., et al. IL-33-PU.1 transcriptome reprogramming drives functional state transition and clearance activity of microglia in Alzheimer's Disease. Cell Reports. 31 (3), 107530(2020).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Scientific Reports. 5, 9691(2015).
- Yang, Z., Xie, W., Ju, F., Khan, A., Zhang, S. In vivo two-photon imaging reveals a role of progesterone in reducing axonal dieback after spinal cord injury in mice. Neuropharmacology. 116, 30-37 (2017).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Totoiu, M. O., Keirstead, H. S. Spinal cord injury is accompanied by chronic progressive demyelination. Journal of Comparative Neurology. 486 (4), 373-383 (2005).
- Kopper, T. J., Gensel, J. C. Myelin as an inflammatory mediator: Myelin interactions with complement, macrophages, and microglia in spinal cord injury. Journal of Neuroscience Research. 96 (6), 969-977 (2018).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Pedrotti, F. L., Pedrotti, L. M., Pedrotti, L. S. Introduction to Optics. , Higher Education from Cambridge University Press. (2017).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), 37-61 (2013).
- Zhang, D., Slipchenko, M. N., Cheng, J. -X. Highly sensitive vibrational imaging by Femtosecond Pulse Stimulated Raman Loss. The Journal of Physical Chemistry Letters. 2 (11), 1248-1253 (2011).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, label-free detection of brain tumors with Stimulated Raman Scattering Microscopy. Science Translational Medicine. 5 (201), (2013).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging. Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Yamakoshi, H., et al. Imaging of EdU, an Alkyne-tagged cell proliferation probe, by Raman Microscopy. Journal of the American Chemical Society. 133 (16), 6102-6105 (2011).
- van Manen, H. -J., Lenferink, A., Otto, C. Noninvasive imaging of protein metabolic labeling in single human cells using stable isotopes and Raman Microscopy. Analytical Chemistry. 80 (24), 9576-9582 (2008).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nature Biomedical Engineering. 3 (5), 402-413 (2019).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995(2018).
- Ahuja, C. S., et al. Traumatic spinal cord injury. Nature Reviews Disease Primers. 3 (1), 1-21 (2017).
- Lassmann, H. Multiple sclerosis pathology. Cold Spring Harbor Perspectives in Medicine. 8 (3), 028936(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved