Method Article
In vivo Imaging di tessuti biologici con fluorescenza combinata a due fotoni e microscopia a dispersione Raman stimolata
In questo articolo
Riepilogo
La microscopia A scattering Raman stimolato (SRS) consente l'imaging senza etichette di biomolecole in base alla loro vibrazione intrinseca di specifici legami chimici. In questo protocollo, viene descritta la configurazione strumentale di un microscopio integrato SRS e fluorescenza a due fotoni per visualizzare le strutture cellulari nel midollo spinale di topi vivi.
Abstract
La microscopia a diffusione Raman stimolata (SRS) consente l'imaging senza etichette dei tessuti biologici nel suo microambiente naturale basato sulla vibrazione molecolare intrinseca, fornendo così uno strumento perfetto per lo studio in vivo dei processi biologici a risoluzione subcellulare. Integrando l'imaging a fluorescenza eccitata a due fotoni (TPEF) nel microscopio SRS, l'imaging dual-modal in vivo dei tessuti può acquisire informazioni biochimiche e biofisiche critiche da più prospettive che aiutano a comprendere i processi dinamici coinvolti nel metabolismo cellulare, nella risposta immunitaria e nel rimodellamento dei tessuti, ecc. In questo protocollo video, viene introdotta la configurazione di un sistema di microscopio TPEF-SRS e il metodo di imaging in vivo del midollo spinale animale. Il midollo spinale, come parte del sistema nervoso centrale, svolge un ruolo fondamentale nella comunicazione tra il cervello e il sistema nervoso periferico. La guaina mielinica, abbondante nei fosfolipidi, circonda e isola l'assone per consentire la conduzione saltatoria dei potenziali d'azione. L'imaging in vivo delle guaine mieliniche nel midollo spinale è importante per studiare la progressione delle malattie neurodegenerative e delle lesioni del midollo spinale. Il protocollo descrive anche la preparazione animale e i metodi di imaging TPEF-SRS in vivo per acquisire immagini biologiche ad alta risoluzione.
Introduzione
La microscopia Raman1,2 sta emergendo come un potente metodo senza etichetta per l'immagine di tessuti biologici basati sulle frequenze caratteristiche di vari legami chimici nelle biomolecole. Grazie alla sua capacità di imaging non invasiva e ben adattativa, la microscopia Raman è stata ampiamente utilizzata per l'imaging di componenti arricchiti di lipidi nei tessuti biologici come la guaina mielinica3,4,5, gli adipociti6,7 e le goccioline lipidiche8,9,10 . Il segnale di scattering Raman stimolato (SRS) acquisito come guadagno Raman stimolato (SRG) o perdita Raman stimolata (SRL) è privo di sfondo, mostrando una perfetta somiglianza spettrale con lo scattering Raman spontaneo11,12. Inoltre, SRL e SSR dipendono linearmente dalla concentrazione di analiti, consentendo l'analisi quantitativa dei componenti biochimici9,11,13. La microscopia a fluorescenza eccitata a due fotoni (TPEF) è stata ampiamente utilizzata per l'imaging biologico in vivo grazie alla sua intrinseca capacità di sezionamento ottico, profondità di penetrazione profonda e bassa fototossicità14,15,16. Tuttavia, le prestazioni dell'imaging TPEF dipendono dalle caratteristiche dei tag fluorescenti e il numero di colori risolvibili è limitato a causa degli spettri di fluorescenza a banda larga8,17,18,19. L'imaging SRS senza etichette e l'imaging TPEF basato sulla fluorescenza sono due modalità di imaging complementari e la loro combinazione può fornire abbondanti informazioni biofisiche e biochimiche sui tessuti. Queste due modalità di imaging sono entrambe basate sui processi ottici non lineari (NLO), che consentono una semplice integrazione in un unico sistema di microscopio. La combinazione dell'imaging SRS e TPEF, il cosiddetto imaging dual-modale, consente l'imaging ad alta dimensione e la profilazione di cellule e tessuti, facilitando una comprensione completa di sistemi biologici complessi. In particolare, la microscopia SRS a picosecondi (ps) può ottenere l'imaging del legame chimico con un'elevata risoluzione spettrale rispetto alla tecnica SRS a femtosecondi (fs)11, consentendo di differenziare più componenti biochimici nel tessuto biologico, specialmente nella regione affollata delle impronte digitali20,21. Inoltre, rispetto a un altro sistema di microscopio NLO dual-modale comunemente usato con integrazione del microscopio a dispersione coerente anti-Stokes (CARS), SRS mostra prestazioni superiori a CARS in termini di interpretazione spettrale e dell'immagine, nonché sensibilità di rilevamento11. Il microscopio SRS-TPEF è stato utilizzato come potente strumento per studiare vari sistemi biologici, come Caenorhabditis elegans9,22, Xenopus laevis tadpole brain5, mouse brain23,24, midollo spinale25,26, nervo periferico27 e tessuto adiposo7, ecc.
Il midollo spinale insieme al cervello costituisce il sistema nervoso centrale (SNC). Visualizzare le attività cellulari nel SNC in vivo in condizioni fisiologiche e patologiche è fondamentale per comprendere i meccanismi dei disturbi del SNC28,29,30 e per sviluppare terapie corrispondenti31,32,33. La guaina mielinica, che avvolge e isola gli assoni per la conduzione del potenziale d'azione ad alta velocità, svolge un ruolo significativo nello sviluppo del SNC. La demielinizzazione è considerata un segno distintivo nei disturbi della sostanza bianca, come la sclerosi multipla34. Inoltre, dopo una lesione del midollo spinale35, i detriti mielinici possono modulare l'attivazione dei macrofagi, contribuendo all'infiammazione cronica e alle lesioni secondarie36. Pertanto, l'imaging in vivo della guaina mielinica insieme ai neuroni e alle cellule gliali in modelli murini viventi è di grande aiuto per comprendere i processi dinamici nei disturbi del SNC.
In questo protocollo, vengono descritte le procedure di configurazione fondamentali di un microscopio TPEF-SRS costruito in casa e vengono introdotti i metodi di imaging in vivo dual-modal per il midollo spinale del topo.
Protocollo
Tutte le procedure animali eseguite in questo lavoro sono condotte secondo le linee guida del Laboratory Animal Facility della Hong Kong University of Science and Technology (HKUST) e sono state approvate dal Comitato etico animale di HKUST. La formazione sulla sicurezza per la manipolazione laser è necessaria per configurare e utilizzare il microscopio TPEF-SRS. Indossare sempre occhiali di sicurezza laser con un intervallo di lunghezze d'onda appropriato quando si ha a che fare con il laser.
1. Configurazione del microscopio TPEF-SRS (per lo schema di configurazione vedere la Figura 1)
- Utilizzare un oscillatore ottico parametrico integrato (OPO) collegato a un laser a fibra di itterbio bloccato in modalità come sorgente laser ps per l'imaging SRS.
NOTA: OPO emette un fascio stokes (1031 nm) e un fascio pompa (sintonizzabile da 780 nm a 960 nm) con durata dell'impulso di 2 ps e frequenza di ripetizione di 80 MHz. Il fascio di Stokes è modulato a 20 MHz da un modulatore elettro-ottico (EOM) integrato per il rilevamento SRS sensibile alla fase ad alta frequenza a livello di MHz. - Utilizzare un laser fs titanium (Ti): zaffiro come sorgente laser per l'imaging TPEF.
- Utilizzare un paio di obiettivi (L1 e L2) per collimare e regolare la dimensione del fascio fs a 3 mm.
- Utilizzare una coppia di lenti (L3 e L4) per collimare il raggio laser ps ed espandere il suo diametro a 3 mm.
- Modificare la polarizzazione del raggio laser fs dalla polarizzazione p alla polarizzazione s utilizzando una piastra a mezza onda.
- Combinare i due raggi laser con uno splitter a fascio polarizzatore (PBS).
- Aggiungere una coppia di specchi galvanometrici XY-scan da 3 mm dietro il PBS per la scansione del fascio.
- Utilizzare un obiettivo a scansione telecentrica (L5) e un obiettivo valvolare a correzione infinita (L6) per coniugare lo specchio di scansione e la pupilla posteriore dell'obiettivo 25x. Espandere il raggio laser dall'obiettivo di scansione e dall'obiettivo valvolare per riempire l'apertura posteriore dell'obiettivo.
- Posizionare un PBS o uno specchio dicroico (D2) tra la lente valvolare e la lente dell'obiettivo per la raccolta del segnale SRS o di fluorescenza. Utilizzare una pinna motorizzata per passare da PBS a D2.
NOTA: parte del segnale SRS retrodisperso viene perso quando passa attraverso il PBS a causa della sua polarizzazione spostata casualmente. - Utilizzare un paio di obiettivi (L7 e L9) per restringere il fascio di rilevamento e coniugare la pupilla posteriore dell'obiettivo 25x con un sensore a fotodiodo.
- Utilizzare una coppia di lenti (L8 e L10) per restringere il fascio di rilevamento e coniugare la pupilla posteriore dell'obiettivo 25x con la superficie di rilevamento del fotomoltiplicatore (PMT).
- Utilizzare uno specchio dicroico (D3) per separare il percorso di rilevamento dei segnali di fluorescenza e SRS.
- Posizionare un set di filtri (Fs1) davanti al rilevatore di fotodiodi per bloccare il laser Stokes e far passare solo il raggio della pompa.
- Posizionare un set di filtri (Fs2) davanti al rilevatore PMT per far passare solo il segnale di fluorescenza target.
- Collegare il PMT a un amplificatore di corrente per l'amplificazione del segnale.
- Collegare il fotodiodo a un amplificatore lock-in.
- Collegare il segnale di sincronizzazione dall'uscita EOM integrata all'ingresso di riferimento dell'amplificatore lock-in per la demodulazione del segnale SRS.
- Collegare l'amplificatore PMT e le uscite dell'amplificatore lock-in al modulo di acquisizione dati.
2. Calibrazione del sistema di microscopio TPEF-SRS
- Avvio dei laser
- Cambiare l'interruttore a chiave dalla posizione Standby a On per accendere il laser Ti: zaffiro e attendere 30 minuti affinché il laser si riscaldi.
- Accendi l'OPO facendo clic sul pulsante Start sul pannello di controllo OPO e attendi 20 minuti affinché il laser si riscaldi.
- Dopo che il laser ps si è riscaldato, utilizzare un fotorivelatore ad alta velocità per controllare la profondità di modulazione del raggio di Stokes. Aprire l'otturatore laser per il raggio stokes. Fare clic sulla casella Imposta alimentazione OPO e immettere 20. Posizionare il fotorivelatore ad alta velocità sull'uscita OPO per rilevare il fascio. Collegare la porta di uscita del fotorivelatore alla porta di ingresso di un oscilloscopio utilizzando un cavo coassiale con connettore Bayonet Neill-Concelman (BNC) per monitorare l'impulso laser.
- Aprire la finestra Controllo EOM nel software di controllo OPO. Regolare la potenza e la fase EOM in base al diagramma di intensità dell'impulso mostrato sull'oscilloscopio per ottenere la massima profondità di modulazione a 20 MHz.
NOTA: le prestazioni EOM sono generalmente stabili e devono essere controllate solo quando il segnale SRS viene rilevato significativamente diminuito.
- Allineamento ottico del microscopio combinato TPEF-SRS
- Eseguire l'allineamento ottico per la colocalizzazione dei fasci ps e fs come descritto nei passaggi da 2.2.2 a 2.2.13.
- Aprire l'otturatore laser della pompa mentre si arresta l'uscita Stokes nel software di controllo OPO. Utilizzare il software di controllo OPO per impostare la lunghezza d'onda del fascio della pompa su 796 nm facendo clic sulla casella Imposta segnale e immettendo il valore della lunghezza d'onda 796. Fare clic sulla casella Imposta alimentazione OPO e immettere 20 per impostarne la potenza al minimo (~ 20 mW) per l'allineamento ottico.
- Accendere il computer del microscopio e tutti i componenti elettronici associati, inclusi scanner, attuatori oggettivi, fotodiodi, PMT, amplificatori di corrente, amplificatori lock-in e pinne motorizzate. Avviare il software di controllo del microscopio.
NOTA: Il software di controllo del microscopio è un'interfaccia fatta in casa. - Posizionare due piastre di allineamento (P1 e P2 nella Figura 1) sul percorso ottico. Posizionare P1 dietro PBS a una distanza di circa 10 cm e posizionare P2 dietro P1 a una distanza di circa 30 cm.
NOTA: i fasci ps e fs sono combinati utilizzando un PBS (Figura 1). Le due piastre di allineamento vengono utilizzate per controllare l'allineamento e la colocalizzazione dei due raggi laser. - Aprire l'otturatore del microscopio per il raggio laser ps.
- Regolare lo specchio M1 per posizionare il centro del raggio laser ps sul foro passante di P1. Utilizzare un telescopio a infrarossi (IR) per osservare la posizione del punto del fascio a P1 quando si regola lo specchio M1.
- Regolare lo specchio M2 per posizionare il centro del raggio laser ps sul foro passante di P2. Utilizzare l'oscilloscopio IR per osservare la posizione del punto del fascio a P2 quando si regola lo specchio M2.
- Ripetere i passaggi 2.2.6 e 2.2.7 fino a quando il centro del fascio ps non si trova nel foro passante di entrambe le piastre di allineamento. Chiudere l'otturatore del fascio ps nel software di controllo del microscopio.
- Impostare la lunghezza d'onda del laser fs Ti: zaffiro a 740 nm e aprire l'otturatore laser. Impostare la potenza del laser su 5 mW (misurata alla porta di ingresso del sistema del microscopio) per l'allineamento ottico.
- Aprire l'otturatore del microscopio per il raggio laser fs.
- Regolare lo specchio M3 per posizionare il centro spot del raggio laser fs sul foro passante di P1.
- Regolare lo specchio M4 per posizionare il centro spot del raggio laser nel foro passante di P2.
- Ripetere i passaggi 2.2.11 e 2.2.12 fino a quando il centro del raggio laser fs non si trova nei fori passanti di due piastre di allineamento. Chiudere l'otturatore del microscopio per il fascio fs.
- Eseguire la sovrapposizione spaziale della pompa e delle travi di Stokes come descritto nei passaggi da 2.2.15 a 2.2.18.
NOTA: Sebbene la pompa e i raggi Stokes siano approssimativamente sovrapposti all'interno del laser ps, è necessaria la messa a punto delle posizioni dei due raggi laser per ottenere prestazioni SRS ottimali. Poiché il raggio della pompa è prima allineato come descritto in precedenza, successivamente il raggio di Stokes viene regolato per colocalizzare con il raggio della pompa. - Posizionare una telecamera nella posizione dell'obiettivo per visualizzare la posizione di due punti del fascio. Contrassegnare la posizione del fascio della pompa sullo schermo della telecamera come riferimento.
- Posizionare una piastra di allineamento P0 prima di L3 (Figura 1). Utilizzare una chiave esagonale per regolare lo specchio ottico 1 (OM1) in modo che il centro del fascio stokes passi il foro passante della piastra di allineamento e si localizzi con il raggio della pompa sulla porta di uscita laser. Utilizzare l'oscilloscopio IR per confermare la posizione del punto del fascio a P0 durante la regolazione.
NOTA: OM1 e OM2 sono due specchi nella testa OPO per regolare la posizione del fascio stokes da 1031 nm. - Rimuovere la piastra di allineamento P0 e utilizzare il tasto esadecimale per regolare l'OM2 in modo che il centro del raggio stokes si localizzi con il segno di riferimento del raggio della pompa sulla telecamera.
- Ripetere i passaggi 2.2.16 e 2.2.17 fino a quando il raggio di Stokes non si sovrappone rigorosamente al fascio della pompa sia sul piano P0 che su quello della telecamera.
NOTA: quando si visualizzano i punti del fascio sulla telecamera, tutte le piastre di allineamento devono essere rimosse dal percorso ottico.
- Ottimizza le condizioni di imaging
- Eseguire la regolazione di fase dell'amplificatore lock-in come descritto nei passaggi 2.3.2. al 2.3.7.
NOTA: il rilevamento SRS si basa su uno schema sensibile alla fase ad alta frequenza. Per il rilevamento SRL, l'intensità del fascio di Stokes viene modulata a 20 MHz e viene utilizzato un amplificatore lock-in per demodulare il segnale. La fase e l'offset dell'amplificatore lock-in devono essere regolati per ottenere il contrasto ottimale dell'immagine. - Aprire il software di controllo dell'amplificatore lock-in.
- Impostare la lunghezza d'onda del laser della pompa a 796 nm e la potenza della pompa e del fascio di Stokes su 15 mW e 25 mW sul campione, rispettivamente.
NOTA: Qui utilizzare l'olio d'oliva per l'ottimizzazione e la calibrazione dell'imaging SRS. Il picco Raman dell'olio d'oliva nella regione carbonio-idrogeno è a 2863.5 cm-1, corrispondente alla lunghezza d'onda del fascio della pompa a 796 nm. - Sigillare l'olio d'oliva in un vetrino e attaccare una carta velina piegata sul fondo della diapositiva per migliorare il backscattering del segnale per il rilevamento epi-SRS. Posiziona il campione di olio d'oliva sul palco e regola la messa a fuoco dell'obiettivo 25x sul campione.
- Utilizzare il software di controllo del microscopio per impostare i parametri di imaging come segue: 512 x 512 pixel per un campo visivo di 500 μm x 500 μm (FOV), un tempo di permanenza di pixel di 6,4 μs. Utilizzare il software di controllo dell'amplificatore lock-in per impostare il valore della costante di tempo su 10 μs, che è vicino al tempo di permanenza dei pixel.
- Scansiona il raggio laser sul campione. Utilizzare il software di controllo dell'amplificatore lock-in per regolare la fase (0-180°) con una dimensione del passo di 22,5° fino a quando l'intensità del segnale SRS raggiunge il massimo.
NOTA: in questo amplificatore lock-in completamente analogico, l'uscita del segnale è la componente in fase, che dipende dalla fase del segnale di riferimento. La fase può essere regolata dal software di controllo dell'amplificatore lock-in con risoluzione di 11 °, consentendo di massimizzare il segnale rilevato entro ~ 2% 12. L'amplificatore lock-in esce di fase una volta interrotto il segnale di sincronizzazione. La fase deve essere regolata ogni volta che il segnale di sincronizzazione viene ristabilito. - Scansiona il campione con l'otturatore laser chiuso. Utilizzare il software di controllo dell'amplificatore lock-in per regolare il valore di offset con una dimensione del passo di 1 mV fino a quando il segnale SRS medio è vicino allo zero.
NOTA: il segnale SRS medio è stimato come l'intensità media di tutti i pixel nell'immagine SRS, che viene calcolata automaticamente dal software di controllo del microscopio. Gli offset sono utili per annullare segnali indesiderati coerenti di fase. - Eseguire l'ottimizzazione della sincronizzazione temporale come descritto nei passaggi da 2.3.9 a 2.3.14.
- Aprire la finestra di dialogo Delay Manager (Figura 2) nel software di controllo OPO.
- Scansiona l'olio d'oliva e sintonizza la fase di ritardo fino a quando il segnale SRS dell'olio d'oliva raggiunge il suo massimo.
NOTA: per la prima volta nell'imaging SRS, quando la fase dell'amplificatore lock-in non è stata ottimizzata, la sincronizzazione temporale viene prima regolata approssimativamente per visualizzare il segnale SRS del campione prima di ottimizzare la fase dell'amplificatore lock-in. - Interrompere la scansione e fare clic sul pulsante Aggiungi dati nella finestra di dialogo di gestione dei ritardi per registrare i dati di ritardo correnti.
- Ripetere i passaggi 2.3. 10 e 2.3.11 per diversi campioni chimici a diverse lunghezze d'onda.
NOTA: perline di polistirene, acqua pesante, 5-etinil-2′-deossiuridina, glicerolo vengono utilizzati per misurare i dati di ritardo a diverse bande vibrazionali. - Selezionare Data Fit e Order 5 nella finestra di dialogo delay manager per adattare i punti dati correnti alla funzione polinomica del quinto ordine. Applicare i dati adattati facendo clic sul pulsante Usa come personalizzato e selezionando la casella di controllo. Lo stadio di ritardo verrà regolato automaticamente a diverse lunghezze d'onda in base alla curva di ritardo montata.
- Salva tutti i dati di ritardo in un file di testo, che può essere caricato per un uso futuro.
- Eseguire la regolazione di fase dell'amplificatore lock-in come descritto nei passaggi 2.3.2. al 2.3.7.
3. Preparazione chirurgica del topo per la fluorescenza in vivo e l'imaging SRS
- Sterilizzare tutti gli strumenti necessari, inclusi bisturi, forbici a molla, pinze, coverslip e garze.
- Disinfettare tutte le superfici, che verrebbero toccate durante l'intervento chirurgico con il 70% di etanolo. Coprire l'area di lavoro del piano di lavoro con tende sterili. Metti una piastra riscaldante sotto il drappo.
- Utilizzare Thy1-YFP-H (Tg(Thy1-YFP)HJrs/J)37 topi transgenici che esprimono una proteina di fluorescenza gialla (EYFP) potenziata nei neuroni afferenti del ganglio della radice dorsale per l'imaging del midollo spinale in vivo . Pesare il topo e indurre l'anestesia mediante iniezione intraperitoneale (i.p.) della miscela ketamina-xilazina (87,5 mg kg-1 e 12,5 mg kg-1).
- Pizzica la punta del mouse per garantire un'anestesia profonda. Integrare con metà della dose originale degli anestetici, se necessario. Applicare un unguento sugli occhi del topo per prevenire la secchezza corneale.
- Radere i capelli sulla schiena sopra la colonna vertebrale toracica, quindi rimuovere completamente i capelli con la crema depilante. Disinfettare l'area rasata con soluzione di iodio.
- Fai una piccola incisione della linea mediana (~ 1,5 cm) della pelle sulla vertebra T11-T13 con un bisturi.
- Incidere muscoli e tendini sia sulla parte superiore che sui lati della vertebra T11-T13 con forbici e pinze a molla. Esporre le tre vertebre adiacenti. Utilizzare garze sterili e soluzione salina sterile per controllare il sanguinamento e pulire il sito chirurgico.
- Stabilizzare la colonna vertebrale con l'aiuto delle due barre laterali in acciaio inossidabile su uno stadio di stabilizzazione progettato su misura (Figura 2B).
- Utilizzare un forcep #2 per eseguire una laminectomia a T12. Utilizzare con attenzione il forcipite per rompere la lamina pezzo per pezzo fino a rimuovere l'intera lamina della vertebra T12.
- Lavare via il sangue sovrastante il midollo spinale con soluzione salina sterile e utilizzare la garza per assorbire il liquido in eccesso. Applicare pressione sul sito di sanguinamento con un pezzo di garza per controllare il sanguinamento.
- Posizionare un coverslip (22 x 22 mm) sulla barra di serraggio e riempire l'intercapedine tra il coverslip e il midollo spinale con soluzione salina.
4. Imaging TPEF-SRS in vivo del midollo spinale del topo
- Montare lo stadio di stabilizzazione su uno stadio a cinque assi sotto il microscopio TPEF-SRS.
NOTA: lo stadio a cinque assi consente la traslazione a tre assi e il movimento di flessione del beccheggio e del rollio di ± 5 °. - Fissare la testa del mouse con due barre della testa e abbassare la piastra di tenuta per offrire spazio sufficiente per il movimento del torace durante la respirazione, alleviando gli artefatti di movimento.
- Inserire una piastra riscaldante sotto il mouse per mantenere il mouse caldo durante l'imaging.
- Regolare lo stadio traslazionale z per regolare la messa a fuoco fino a quando l'immagine in campo luminoso della vascolarizzazione del midollo spinale può essere osservata sotto un obiettivo 10x.
- Individuare la vena dorsale del midollo spinale al centro del FOV regolando lo stadio di traslazione a due assi dello stadio a cinque assi.
- Regolare gli angoli di rollio e beccheggio dello stadio a cinque assi per regolare la superficie dorsale del midollo spinale perpendicolare all'asse obiettivo in base all'immagine in campo luminoso.
- Sostituire il 10x con un obiettivo di immersione in acqua 25x per l'imaging TPEF-SRS.
- Impostare la lunghezza d'onda del fascio fs su 920 nm. Sintonizzare la potenza del fascio fs in modo che sia di 10 mW sul campione.
- Impostare la lunghezza d'onda del fascio della pompa su 796 nm. Regolare la potenza della pompa e del fascio di Stokes in modo che sia rispettivamente di 60 mW e 75 mW sul campione.
NOTA: l'imaging SRS del midollo spinale viene eseguito al numero d'onda di 2863,5 cm-1, che corrisponde al picco Raman delle guaine mieliniche nella regione carbonio-idrogeno in base agli spettri SRS misurati7,9. La potenza del laser è determinata per garantire l'imaging TPEF-SRS ad alta risoluzione del midollo spinale. Il danno tissutale non è osservato nelle attuali condizioni di imaging. - Per l'imaging SRS, selezionare PBS sopra l'obiettivo utilizzando una pinna motorizzata premendo il pulsante Switch collegato alla pinna motorizzata.
- Impostare i parametri di imaging come segue: 512 x 512 pixel per 150 μm x 150 μm FOV, 3,2 μs pixel tempo di permanenza, 2 μs costante di tempo.
- Iniziare la scansione del campione e impostare l'attenzione sulla superficie dorsale del midollo spinale.
- Regolare finemente lo stadio di ritardo dal software di controllo OPO fino a raggiungere il massimo segnale SRS del midollo spinale.
NOTA: I campioni biologici possono indurre una dispersione cromatica extra, potrebbe essere necessario regolare lo stadio di ritardo per ottimizzare la sincronizzazione temporale. Tuttavia, quando l'imaging SRS viene eseguito vicino alla superficie superiore del tessuto, la differenza temporale dei due impulsi laser introdotti dal tessuto biologico e dalla finestra di imaging è solitamente piccola (meno di diverse centinaia di fs). - Per l'imaging TPEF, selezionare lo specchio dicroico D2 sopra l'obiettivo utilizzando una pinna motorizzata premendo il pulsante Switch collegato alla pinna motorizzata.
- Impostare i parametri di imaging e avviare la scansione del campione. Per acquisire lo stack di immagini TPEF-SRS, acquisire le immagini TPEF e SRS in sequenza con un intervallo di 1 s alla stessa profondità prima di passare alla profondità successiva. I parametri di imaging per l'imaging TPEF sono 512 x 512 pixel, 150 μm x 150 μm FOV, 3,2 μs pixel tempo di permanenza.
- Rimuovere l'animale dalla fase di stabilizzazione dopo aver raccolto tutte le immagini.
- Pulire il tessuto esposto lavando la soluzione salina e assorbire il liquido in eccesso utilizzando una garza. Applicare gel di silicone sul midollo spinale esposto e attendere ~ 5 minuti fino a quando non viene curato.
- Suturare la pelle con la sutura chirurgica #6-0 per chiudere la ferita. Applicare la crema per ustioni sulla pelle del sito chirurgico per prevenire l'infezione. Somministrare un trattamento analgesico per via sottocutanea (0,1 mg/kg di buprenorfina).
- Metti l'animale in una gabbia pulita e posiziona la gabbia su una piastra riscaldante fino a quando il topo non si riprende completamente dall'anestesia.
- Ripetere la somministrazione analgesica ogni 12 ore per 3 giorni dopo l'intervento chirurgico.
- Chiudere l'otturatore del laser OPO e fs. Impostare la potenza della pompa e del raggio di Stokes al massimo.
NOTA: l'impostazione della potenza massima prima di spegnere il laser è vantaggiosa per la manutenzione del laser. - Impostare la lunghezza d'onda del fascio della pompa e del laser fs su 800 nm.
- Impostare i due laser in standby, chiudere tutto il software di controllo dell'elettronica e spegnere tutte le apparecchiature associate.
Risultati
L'imaging dual-modale in vivo degli assoni spinali e delle guaine mieliniche viene condotto utilizzando i topi transgenici Thy1-YFPH, che esprimono EYFP nei neuroni afferenti del ganglio della radice dorsale (Figura 3). Questi neuroni afferenti etichettati trasmettono le informazioni sensoriali dal nervo periferico al midollo spinale, con il ramo centrale situato nella colonna dorsale del midollo spinale. Con il microscopio TPEF-SRS, la guaina mielinica densamente distribuita può essere chiaramente visualizzata utilizzando l'imaging SRS senza etichetta e gli assoni YFP scarsamente etichettati possono essere osservati utilizzando l'imaging TPEF. È rivelato dall'imaging a doppio modello che gli assoni sono strettamente avvolti da uno spesso strato di guaine mieliniche (Figura 3C). I nodi di Ranvier (NR), dove l'axolemma è nudo della guaina mielinica, svolgono un ruolo essenziale nella rapida propagazione saltatoria dei potenziali d'azione. Come si può vedere nell'immagine del midollo spinale TPEF-SRS (Figura 3C), NR mostra una diminuzione del diametro assonale e dell'axolemma direttamente esposto alla matrice extracellulare. È essenziale visualizzare gli assoni insieme alle guaine mieliniche circostanti per confermare l'esistenza e la posizione di NR. Pertanto, la microscopia TPEF-SRS ci consente di osservare i cambiamenti dinamici degli assoni e delle guaine mieliniche nello sviluppo di disturbi del midollo spinale, che è significativo per comprendere i meccanismi della dinamica cellulare.

Figura 1: Il diagramma schematico del sistema di microscopi TPEF-SRS. La pompa e i raggi Stokes sono combinati con uno specchio dicroico (D1) nel laser a picosecondi (ps). Il fascio ps e il fascio di femtosecondi (fs) sono collimati ed espansi/ristretti da una coppia di lenti (rispettivamente L3, L4 e L1, L2) per abbinarsi agli specchi galvanometrici XY-scan da 3 mm. Il fascio fs viene ruotato dalla polarizzazione orizzontale a quella verticale da una piastra a mezza onda (HWP) e quindi combinato con il fascio ps da uno splitter a fascio polarizzatore (PBS). Gli specchietti retrovisori e la pupilla posteriore dell'obiettivo sono coniugati da una lente a scansione telecentrica L5 e da una lente valvolare L6 con correzione all'infinito. Il raggio laser viene espanso dalla lente di scansione e tubo per riempire l'apertura posteriore dell'obiettivo 25x. Per l'imaging A dispersione Raman stimolata (SRS), il fascio della pompa retrodiffuso raccolto dall'obiettivo viene riflesso da un PBS e diretto verso un fotodiodo di silicio (PD) di ampia area (10 mm x 10 mm). Per l'imaging a due fotoni, il segnale di fluorescenza eccitata a due fotoni (TPEF) viene riflesso da uno splitter a fascio dicroico D2 all'unità di fotorilevamento. Un modulo fotomoltiplicatore di corrente (PMT) viene utilizzato per rilevare il segnale TPEF. Abbreviazioni-L1-L10: lenti; OL: obiettivo; D1-D3: specchi dicroici; Fs1, Fs2: set di filtri; M: specchi; OM1, OM2: specchi ottici; P0-P2: piastre di allineamento. Fare clic qui per visualizzare una versione più grande di questa figura.
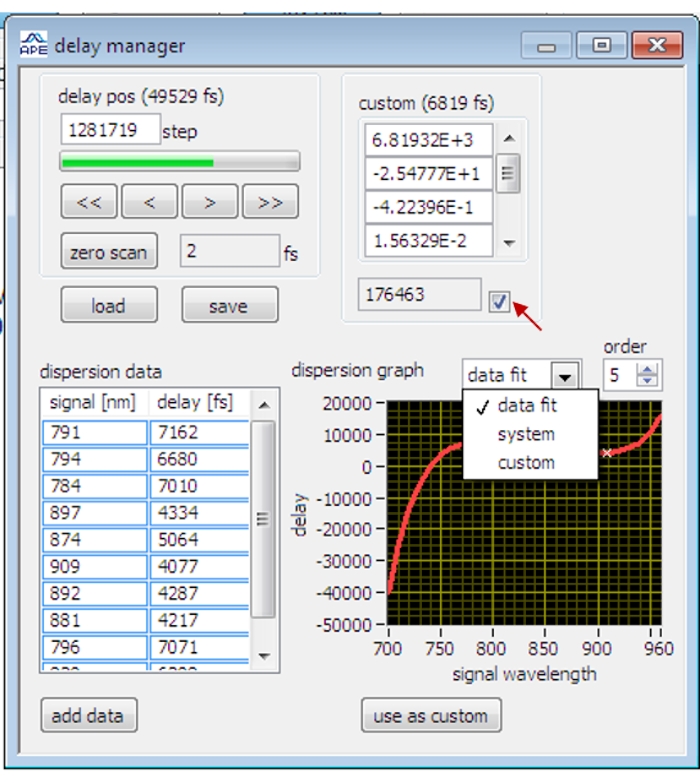
Figura 2: L'interfaccia del gestore dei ritardi sul software di controllo OPO. La freccia rossa indica la casella di controllo per l'applicazione dei dati di ritardo calibrati. Fare clic qui per visualizzare una versione più grande di questa figura.
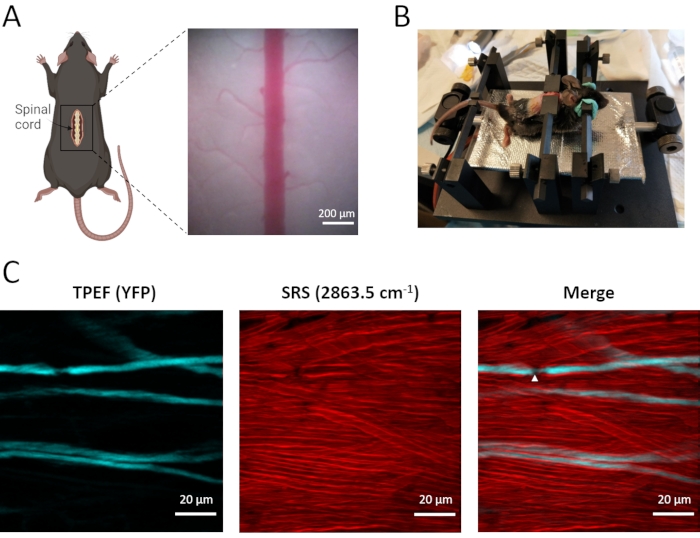
Figura 3: Imaging TPEF-SRS in vivo del midollo spinale del topo. (A) Diagramma schematico della preparazione chirurgica del midollo spinale del topo e dell'immagine in campo luminoso del midollo spinale. (B) Schema di montaggio del mouse per l'imaging in vivo del midollo spinale. (C) Immagini di proiezione Maximal z di assoni e guaine mieliniche nel midollo spinale del topo. Le punte di freccia bianche indicano la posizione di un nodo di Ranvier. Le immagini SRS della mielina sono prese allo spostamento Raman di 2863,5 cm-1. La Figura A è stata creata utilizzando BioRender (https://biorender.com/). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In questo protocollo, la configurazione di base del microscopio TPEF-SRS è descritta in dettaglio. Per l'imaging SRS, la pompa e i fasci di Stokes sono sovrapposti temporalmente e spazialmente all'interno dell'OPO. Tuttavia, questa sovrapposizione può essere interrotta dopo aver attraversato il sistema del microscopio. Pertanto, l'ottimizzazione spaziale e temporale della colocalizzazione della pompa e dei fasci di Stokes è necessaria e fondamentale per ottenere un'imaging SRS ottimale. Il ritardo temporale tra la pompa e il fascio di Stokes è correlato alla differenza di percorso ottico dei due fasci, che è determinata dalla dispersione di elementi ottici nel sistema del microscopio38. Quando la lunghezza d'onda del fascio della pompa viene regolata per l'imaging SRS a diversi spostamenti Raman, la lunghezza del percorso ottico del fascio della pompa cambia di conseguenza perché l'indice di rifrazione delle lenti ottiche dipende dalla lunghezza d'onda38. Pertanto, il ritardo temporale tra la pompa e l'impulso laser Stokes cambia con la lunghezza d'onda del fascio della pompa e quindi deve essere calibrato. L'OPO è dotato di una linea di ritardo controllata da software per la sincronizzazione temporale della pompa e del fascio di Stokes. Per la stessa configurazione ottica, i dati di ritardo rimangono stabili e devono essere calibrati una sola volta. Di conseguenza, i dati di ritardo a diverse lunghezze d'onda del fascio della pompa possono essere salvati alla prima misurazione per un uso futuro. I dati di ritardo calibrati possono essere applicati automaticamente dal software di controllo OPO quando viene modificata la lunghezza d'onda del fascio della pompa, il che è conveniente per l'imaging SRS a diversi turni Raman o imaging SRS iperspettrale. Per l'imaging TPEF-SRS, la rigorosa sovrapposizione spaziale dei fasci ps e fs dopo la combinazione è un passo fondamentale per evitare qualsiasi spostamento FOV tra i due modelli di imaging. In primo luogo, il fascio della pompa ps e il fascio fs sono allineati per assicurarsi che siano entrambi sull'asse ottico del sistema del microscopio, il che è fondamentale per evitare qualsiasi spostamento FOV quando si commutano i due modelli di imaging. Quindi, utilizzando il raggio della pompa come riferimento, la posizione del raggio di Stokes viene regolata di conseguenza per ottenere una rigorosa colocalizzazione spaziale. Ogni procedura di allineamento richiede diverse prove per raggiungere l'ottimale.
Se il segnale SRS diminuisce in modo significativo, è necessario controllare prima il valore di fase dell'amplificatore lock-in e i dati di ritardo temporale. Poiché l'amplificatore lock-in esce di fase una volta interrotto il segnale di sincronizzazione, il valore di fase richiede la riregolazione ogni volta dopo l'interruzione dell'alimentazione o del segnale di sincronizzazione EOM. La sincronizzazione temporale della pompa e del fascio di Stokes può essere rapidamente controllata regolando leggermente la linea di ritardo all'interno dell'OPO. Se i dati di ritardo calibrati sono lontani dal valore ottimale, è necessario eseguire una scansione zero per ricalibrare l'offset del ritardo facendo clic sul pulsante Scansione zero nella finestra di dialogo gestione ritardi. L'intera procedura di scansione zero richiede circa 10 minuti. Se il segnale SRS non riesce a recuperare dopo l'ottimizzazione del valore di fase e di ritardo temporale, la modulazione EOM del fascio di Stokes deve essere controllata come descritto nei passaggi 2.1.3-2.1.4. Se il rapporto di estinzione è molto inferiore a 10 dB con l'osservazione di piccoli picchi di impulso nella posizione off del treno di impulsi di Stokes, l'EOM dovrebbe essere riavviato e la potenza di modulazione e la fase dovrebbero essere riadattate per raggiungere la massima profondità di modulazione. Di solito, il problema della modulazione può essere risolto ripristinando la missione di osservazione elettorale. In caso contrario, dovrebbe essere richiesto il supporto tecnico del produttore.
Per l'imaging di tessuti spessi in vivo , è necessario utilizzare la modalità di rilevamento epi-SRS. In questo protocollo, un PBS viene utilizzato per passare il laser di eccitazione e riflettere il segnale SRS back-scattered al rilevatore. Il segnale SRL rilevato dipende dal backscattering del fascio della pompa in avanti da parte dei tessuti. I laser di eccitazione hanno polarizzazione lineare e possono passare completamente attraverso il PBS, mentre il fascio retrodiffuso ha spostato la polarizzazione e può quindi essere riflesso solo parzialmente dal PBS. Pertanto, l'attuale schema di raccolta del segnale mostra un'efficienza inferiore rispetto alla strategia che pone direttamente un fotorivelatore anulare di fronte all'obiettivo12. Tuttavia, a causa della forte dispersione dei tessuti ricchi di lipidi39, le immagini SRS ad alto rapporto segnale-rumore (512 x 512 pixel) del midollo spinale possono essere acquisite con un tempo di integrazione di 1-2 s, rendendo questo schema di raccolta basato su PBS un approccio appropriato per l'imaging del midollo spinale. D'altra parte, tuttavia, la forte dispersione dei tessuti limita la profondità di penetrazione della luce. Sia per l'imaging SRS che TPEF, la profondità di imaging per il midollo spinale è limitata a circa 50 μm.
La procedura di imaging sequenziale per l'imaging SRS e TPEF è la principale limitazione dell'attuale metodo di imaging dual-modale. Nel protocollo, l'imaging TPEF e SRS viene eseguito nella stessa posizione in sequenza con un intervallo di 1 s commutando automaticamente la pinna motorizzata. Gli artefatti di movimento possono causare una fusione imperfetta delle immagini TPEF e SRS, che limita la capacità di questo metodo di imaging di processi altamente dinamici o tessuti in gran parte influenzati dal respiro e dal battito cardiaco degli animali. Una possibile soluzione consiste nel raccogliere simultaneamente la fluorescenza a due fotoni eccitati dal laser ps durante l'imaging SRS9. Tuttavia, questo metodo è applicabile solo alle strutture biologiche con forti segnali di fluorescenza, poiché l'impulso ps ha un'efficienza di eccitazione della fluorescenza molto più bassa rispetto all'impulso fs14. In alternativa, il problema può essere risolto utilizzando un sistema fs-SRS22,40, dove la sorgente laser fs consente l'eccitazione simultanea dei segnali SRS e TPEF in modo efficace, a scapito della bassa risoluzione spettrale dell'imaging SRS. Un'altra soluzione consiste nell'utilizzare la fluorescenza eccitata dal laser ps ottenuta durante l'imaging SRS come riferimento per registrare le immagini di fluorescenza fs. Come mostrato nella Figura 3, questa strategia di registrazione funziona bene se non si verifica alcun movimento significativo durante l'SRS e l'imaging a fluorescenza.
SRS presenta vantaggi unici nell'imaging biologico poiché fornisce informazioni chimiche sulle biomolecole in base al suo specifico meccanismo di contrasto privo di etichette41. Rispetto a CARS che è stato anche combinato con TPEF per l'imaging NLO multimodale, SRS ha mostrato una migliore capacità di interpretazione spettrale e delle immagini11. Pertanto, è stato ampiamente applicato per l'imaging di lipidi9,11, proteine42,43, DNA44 e componenti bio-ortogonali contenenti legami alchinici (C ≡ C)13,45, carbonio-deuterio (C-D)9,46 e ossigeno-deuterio (O-D)47,48 nei tessuti biologici. In questo protocollo, abbiamo utilizzato una sorgente laser ps per l'imaging SRS e una sorgente laser fs per l'imaging TPEF, che combina i vantaggi di un'efficiente eccitazione a fluorescenza e un'elevata risoluzione spettrale Raman, consentendo un'efficace differenziazione di diverse biomolecole42,44. Nel midollo spinale, complesse interazioni cellula-microambiente che coinvolgono cellule gliali, neuroni e cellule immunitarie reclutate contribuiscono alla progressione delle lesioni49 e delle malattie50. In combinazione con varie sonde di imaging a fluorescenza e SRS, la microscopia TPEF-SRS può ottenere l'imaging simultaneo di varie strutture cellulari e dei loro distinti componenti biomolecolari, che possono facilitare significativamente la nostra comprensione dell'insorgenza e dello sviluppo dei disturbi del midollo spinale.
Divulgazioni
Gli autori non hanno nulla da rivelare e non hanno interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dall'Hong Kong Research Grants Council attraverso sovvenzioni 16103215, 16148816, 16102518, 16102920, T13-607/12R, T13-706/11-1, T13-605/18W, C6002-17GF, C6001-19E, N_HKUST603/19, la Commissione per l'innovazione e la tecnologia (ITCPD/17-9), l'Area of Excellence Scheme del Comitato per le sovvenzioni universitarie (AoE/M-604/16, AOE/M-09/12) e l'Università della scienza e della tecnologia di Hong Kong (HKUST) attraverso la sovvenzione RPC10EG33.
Materiali
| Name | Company | Catalog Number | Comments |
| #2 Forceps | Dumont | 11223-20 | For laminectomy |
| 10X objective | Nikon | CFI Plan Apo Lambda 10X | |
| 25X objective | Olympus | XLPLN25XSVMP2 | |
| Burn cream | Betadine | ||
| Camera | Sony | α6300 | |
| Current amplifier | Stanford research | SR570 | |
| Current photomultiplier modules | Hamamatsu | H11461-01 | |
| D2 665 nm long-pass dichroic mirror | Semrock | FF665-Di02-25x36 | For directing epi-fluorescence signal to the detection module |
| D3 700 nm short-pass dichroic mirror | Edmund | 69-206 | For separating SRS from TPEF detection path |
| Depilating cream | Veet | ||
| FS1 975 nm short-pass filter | Edmund | 86-108 | For blocking stokes beam |
| FS1 Bandpass filter | Semrock | FF01-850/310 | For blocking stokes beam |
| Fs2 Bandpass filter | Semrock | FF01-525/50 | For selecting YFP signal |
| Fs2 Shortpass filter | Semrock | FF01-715/SP-25 | For blocking fs excitation laser beam |
| Half-wave plate | Thorlabs | SAHWP05M-1700 | |
| High-speed photodetector | MenloSystems | FPD 310-F | For checking Stokes beam modulation |
| Iodine | Betadine | ||
| IR Scope | FJW | FIND-R-SCOPE Infrared Viewer 2X Kit Model 84499C2X | |
| Iris | Thorlabs | CPA1 | |
| L1 | Thorlabs | AC254-060-B-ML | |
| L10 | Thorlabs | LA4052-A | |
| L2 | Thorlabs | LA1422-B | |
| L3 | Thorlabs | AC254-050-B | |
| L4 | Thorlabs | AC254-060-B-ML | |
| L7 | f=100 mm, AB coating | ||
| L8 | Thorlabs | LA4874-A | |
| L9 | Thorlabs | AC254-035-B-ML | |
| Lock-in amplifier | APE | ||
| Mirror | Thorlabs | PF10-03-P01 | |
| Motorized flipper | Thorlabs | MFF101/M | |
| multifunctional acquisition card | National Instrument | PCIe-6363 | |
| Oscilloscope | Tektronix | TDS2012C | |
| Photodiode | APE | For detecting SRS signal | |
| Picosecond laser source | APE | picoEmerald | |
| Polarizing beam splitter | Thorlabs | CCM1-PBS252/M | |
| Power meter | Newport | 843-R | |
| Saline | Braun | ||
| Scan lens L5 | Thorlabs | SL50-CLS2 | |
| Scanning mirror | Cambridge Technology | 6215H | |
| Silicone gel | World Precision Inc. | KWIK-SIL | |
| Ti:sapphire fs laser | Coherent | Chameleon Ultra II | |
| Tube lens L6 | Thorlabs | TTL200-S8 |
Riferimenti
- Raman, C. V., Krishnan, K. S. The optical analogue of the compton effect. Nature. 121 (3053), 711 (1928).
- Turrell, G., Corset, J. . Raman Microscopy: Developments and Applications. , (1996).
- Tian, F., et al. Monitoring peripheral nerve degeneration in ALS by label-free stimulated Raman scattering imaging. Nature Communications. 7 (1), 13283 (2016).
- Shi, Y., et al. Longitudinal in vivo coherent anti-Stokes Raman scattering imaging of demyelination and remyelination in injured spinal cord. Journal of Biomedical Optics. 16 (10), 106012 (2011).
- Hu, C. R., Zhang, D., Slipchenko, M. N., Cheng, J. -. X., Hu, B. Label-free real-time imaging of myelination in the Xenopus laevis tadpole by in vivo Stimulated Raman Scattering Microscopy. Journal of Biomedical Optics. 19 (8), 086005 (2014).
- Den Broeder, M. J., et al. Altered adipogenesis in Zebrafish larvae following high fat diet and chemical exposure is visualised by Stimulated Raman Scattering Microscopy. International Journal of Molecular Sciences. 18 (4), 894 (2017).
- He, S., et al. In vivo metabolic imaging and monitoring of brown and beige fat. Journal of Biophotonics. 11 (8), (2018).
- Wang, M. C., Min, W., Freudiger, C. W., Ruvkun, G., Xie, X. S. RNAi screening for fat regulatory genes with SRS microscopy. Nature Methods. 8 (2), 135-138 (2011).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by Stimulated Raman Scattering Microscopy. Analytical Chemistry. 91 (3), 2279-2287 (2019).
- Zhang, C., Li, J., Lan, L., Cheng, J. -. X. Quantification of lipid metabolism in living cells through the dynamics of lipid droplets measured by Stimulated Raman Scattering Imaging. Analytical Chemistry. 89 (8), 4502-4507 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by Stimulated Raman Scattering Microscopy. Science. 322 (5909), 1857-1861 (2008).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with Stimulated Raman Scattering. Science. 330 (6009), 1368-1370 (2010).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and Stimulated Raman Scattering Microscopy using a probe of the aggregation-induced emission characteristic. Journal of the American Chemical Society. 139 (47), 17022-17030 (2017).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Pawlicki, M., Collins, H. A., Denning, R. G., Anderson, H. L. Two-photon absorption and the design of two-photon dyes. Angewandte Chemie International Edition. 48 (18), 3244-3266 (2009).
- König, K. Multiphoton microscopy in life sciences. Journal of Microscopy. 200 (2), 83-104 (2000).
- Dean, K. M., Palmer, A. E. Advances in fluorescence labeling strategies for dynamic cellular imaging. Nature Chemical Biology. 10 (7), 512-523 (2014).
- Tsurui, H., et al. Seven-color fluorescence imaging of tissue samples based on fourier spectroscopy and singular value decomposition. Journal of Histochemistry & Cytochemistry. 48 (5), 653-662 (2000).
- Niehörster, T., et al. Multi-target spectrally resolved fluorescence lifetime imaging microscopy. Nature Methods. 13 (3), 257-262 (2016).
- Zhang, X., et al. Label-free live cell imaging of nucleic acids using Stimulated Raman Scattering (SRS) Microscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 13 (4), 1054-1059 (2012).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 7715 (2018).
- Li, X., et al. Integrated femtosecond stimulated Raman scattering and two-photon fluorescence imaging of subcellular lipid and vesicular structures. Journal of Biomedical Optics. 20 (11), 110501 (2015).
- Imitola, J., et al. Multimodal coherent anti-Stokes Raman scattering microscopy reveals microglia-associated myelin and axonal dysfunction in multiple sclerosis-like lesions in mice. Journal of Biomedical Optics. 16 (2), 021109 (2011).
- Uckermann, O., et al. Label-free multiphoton microscopy reveals altered tissue architecture in hippocampal sclerosis. Epilepsia. 58 (1), 1-5 (2017).
- Tamosaityte, S., et al. Inflammation-related alterations of lipids after spinal cord injury revealed by Raman spectroscopy. Journal of Biomedical Optics. 21 (6), 061008 (2016).
- Uckermann, O., et al. Endogenous two-photon excited fluorescence provides label-free visualization of the inflammatory response in the rodent spinal cord. BioMed Research International. 2015, 859084 (2015).
- van Hameren, G., et al. In vivo real-time dynamics of ATP and ROS production in axonal mitochondria show decoupling in mouse models of peripheral neuropathies. Acta Neuropathologica Communications. 7 (1), 1-16 (2019).
- Davalos, D., et al. Fibrinogen-induced perivascular microglial clustering is required for the development of axonal damage in neuroinflammation. Nature Communications. 3 (1), 1-15 (2012).
- Ylera, B., et al. Chronically CNS-injured adult sensory neurons gain regenerative competence upon a lesion of their peripheral axon. Current Biology. 19 (11), 930-936 (2009).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Lau, S. -. F., et al. IL-33-PU.1 transcriptome reprogramming drives functional state transition and clearance activity of microglia in Alzheimer's Disease. Cell Reports. 31 (3), 107530 (2020).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Scientific Reports. 5, 9691 (2015).
- Yang, Z., Xie, W., Ju, F., Khan, A., Zhang, S. In vivo two-photon imaging reveals a role of progesterone in reducing axonal dieback after spinal cord injury in mice. Neuropharmacology. 116, 30-37 (2017).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. European Journal of Neurology. 26 (1), 27-40 (2019).
- Totoiu, M. O., Keirstead, H. S. Spinal cord injury is accompanied by chronic progressive demyelination. Journal of Comparative Neurology. 486 (4), 373-383 (2005).
- Kopper, T. J., Gensel, J. C. Myelin as an inflammatory mediator: Myelin interactions with complement, macrophages, and microglia in spinal cord injury. Journal of Neuroscience Research. 96 (6), 969-977 (2018).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Pedrotti, F. L., Pedrotti, L. M., Pedrotti, L. S. . Introduction to Optics. , (2017).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), 37-61 (2013).
- Zhang, D., Slipchenko, M. N., Cheng, J. -. X. Highly sensitive vibrational imaging by Femtosecond Pulse Stimulated Raman Loss. The Journal of Physical Chemistry Letters. 2 (11), 1248-1253 (2011).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, label-free detection of brain tumors with Stimulated Raman Scattering Microscopy. Science Translational Medicine. 5 (201), (2013).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging. Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Yamakoshi, H., et al. Imaging of EdU, an Alkyne-tagged cell proliferation probe, by Raman Microscopy. Journal of the American Chemical Society. 133 (16), 6102-6105 (2011).
- van Manen, H. -. J., Lenferink, A., Otto, C. Noninvasive imaging of protein metabolic labeling in single human cells using stable isotopes and Raman Microscopy. Analytical Chemistry. 80 (24), 9576-9582 (2008).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nature Biomedical Engineering. 3 (5), 402-413 (2019).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Ahuja, C. S., et al. Traumatic spinal cord injury. Nature Reviews Disease Primers. 3 (1), 1-21 (2017).
- Lassmann, H. Multiple sclerosis pathology. Cold Spring Harbor Perspectives in Medicine. 8 (3), 028936 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon