Method Article
Fare Dokularında Kararlı Mikrotübülleri, Labil Mikrotübülleri ve Serbest Tübülleri Ayırmak için Kantitatif Mikrotübül Fraksiyonlama Tekniği
Bu Makalede
Özet
Tübülin polimerleri olan mikrotübüller, ökaryotik hücrelerde bir hücre iskeleti bileşeni olarak çok önemli bir rol oynar ve dinamik kararsızlıkları ile bilinir. Bu çalışma, çeşitli fare dokularındaki mikrotübüllerin stabilitesini değerlendirmek için mikrotübülleri kararlı mikrotübüllere, kararsız mikrotübüllere ve serbest tübüllere ayırmak için fraksiyonlamak için bir yöntem geliştirdi.
Özet
α/β-tübülin dimerlerinden oluşan mikrotübüller, ökaryotik hücrelerde hücre iskeletinin çok önemli bir bileşenidir. Bu tüp benzeri polimerler, tübülin heterodimer alt birimleri tekrarlayan polimerizasyon ve depolimerizasyona uğradıkça dinamik kararsızlık sergiler. Tübülin translasyon sonrası modifikasyonlar ve mikrotübül ile ilişkili proteinler yoluyla elde edilen mikrotübül stabilitesinin ve dinamiğinin hassas kontrolü, çeşitli hücresel fonksiyonlar için gereklidir. Mikrotübüllerdeki işlev bozuklukları, nörodejeneratif bozukluklar da dahil olmak üzere patogenezde güçlü bir şekilde rol oynar. Devam eden araştırmalar, stabiliteyi modüle eden ve bu hastalıklar ve kanserler için potansiyel tedavi seçenekleri sunan mikrotübül hedefli terapötik ajanlara odaklanmaktadır. Sonuç olarak, mikrotübüllerin dinamik durumunu anlamak, hastalığın ilerlemesini ve terapötik etkilerini değerlendirmek için çok önemlidir.
Geleneksel olarak, mikrotübül dinamikleri, tübülin sonrası translasyon modifikasyonlarını hedefleyen antikorlar kullanılarak, kaba fraksiyonlama veya immünoassay yoluyla in vitro veya kültürlenmiş hücrelerde değerlendirilmiştir. Bununla birlikte, bu tür prosedürleri kullanarak dokulardaki tübülin durumunu doğru bir şekilde analiz etmek zorluklar doğurur. Bu çalışmada, fare dokularında stabil mikrotübülleri, kararsız mikrotübülleri ve serbest tübülleri ayırmak için basit ve yenilikçi bir mikrotübül fraksiyonlama yöntemi geliştirdik.
Prosedür, disseke edilmiş fare dokularının 19:1 hacim oranında bir mikrotübül stabilize edici tampon içinde homojenleştirilmesini içeriyordu. Homojenatlar daha sonra, kalıntıları gidermek için ilk yavaş santrifüjlemeyi (2.400 × g) takiben iki aşamalı bir ultrasantrifüj işlemi ile fraksiyonlandı. İlk ultrasantrifüjleme aşaması (100.000 × g) kararlı mikrotübülleri çökeltirken, elde edilen süpernatant, kararsız mikrotübülleri ve çözünür tübülin dimerlerini fraksiyonlamak için ikinci bir ultrasantrifüj adımına (500.000 × g) tabi tutuldu. Bu yöntem, fare beyninde stabil veya kararsız mikrotübüller oluşturan tübülin oranlarını belirledi. Ek olarak, kurucu hücrelerin proliferatif kapasitesi ile ilişkili olan mikrotübül stabilitesinde farklı doku varyasyonları gözlenmiştir. Bu bulgular, fizyolojik ve patolojik koşullarda mikrotübül stabilitesini analiz etmek için bu yeni yöntemin önemli potansiyelini vurgulamaktadır.
Giriş
Mikrotübüller (MT'ler), α/β-tübülin heterodimer alt birimlerinden oluşan protofilamentlerden oluşan uzun tübüler yapılardır. Hücre bölünmesi, hareketlilik, şekil bakımı ve hücre içi taşıma gibi çeşitli hücresel süreçlerde önemli roller oynarlar ve bu da onları ökaryotik hücre iskeletinin ayrılmaz bileşenleri haline getirir1. α-tubulin alt biriminin açığa çıktığı MT'lerin eksi ucu nispeten kararlıyken, β-tübülin alt biriminin açığa çıktığı artı uç, dinamik depolimerizasyon ve polimerizasyonauğrar 2. Dinamik kararsızlık olarak adlandırılan artı uçta bu sürekli tübülin dimer ilavesi ve ayrışma döngüsü, tekrarlayan bir kurtarma ve felaket süreciyle sonuçlanır3. MT'ler, kararlı ve kararsız alanlar dahil olmak üzere dinamik istikrarsızlıkta lokalize varyasyonlara sahip odak alanları sergiler4.
MT'lerin dinamik kararsızlığının hassas kontrolü, özellikle karmaşık morfolojilerle karakterize edilen nöronlarda, çok sayıda hücresel fonksiyon için çok önemlidir. MT'lerin uyarlanabilirliği ve dayanıklılığı, sinir hücrelerinin gelişiminde ve düzgün çalışmasında hayati bir rol oynar 5,6,7. MT'lerin dinamik kararsızlığının, asetilasyon, fosforilasyon, palmitoilasyon, detirozinasyon, delta 2, poliglutamin oksidasyonu ve poliglisilasyon gibi tübülinin çeşitli translasyon sonrası modifikasyonları (PTM'ler) ile ilişkili olduğu bulunmuştur. Ek olarak, mikrotübül ile ilişkili proteinlerin (MAP'ler) bağlanması, düzenleyici bir mekanizma olarak hizmet eder8. Asetilasyon hariç PTM'ler, ağırlıklı olarak MT'lerin dış yüzeyinde yer alan tübülin karboksi-terminal bölgesinde meydana gelir. Bu modifikasyonlar, MT'ler üzerinde çeşitli yüzey koşulları yaratarak MAP'lerle etkileşimlerini etkiler ve nihayetinde MT kararlılığını yönetir9. α-tübülin içinde bir karboksi-terminal tirozin kalıntısının varlığı, hızlı bir şekilde serbest tübülin havuzu ile değiştirilen dinamik MT'lerin göstergesidir. Tersine, karboksi terminalinin detirozinasyonu ve Lys40'ın asetilasyonu, azaltılmış dinamik kararsızlığa sahip kararlı MT'leri ifade eder 9,10.
Tübülin PTM'leri,MT'lerin 5,7,11,12,13,14,15'in dinamiklerini ve kararlılığını değerlendirmek için deneylerde yaygın olarak kullanılmıştır. Örneğin, hücre kültürü çalışmalarında, tübülinler iki havuza ayrılabilir: serbest tübülin havuzu ve MT havuzu. Bu, kalan MT'leri 15,16,17,18,19 sabitlemeden önce hücre geçirgenliği yoluyla serbest tübülin salınarak elde edilir. Biyokimyasal yöntemler, MT'leri felaketten koruyan, MT'lerin ve serbest tübülinin santrifüjleme yoluyla ayrılmasını sağlayan kimyasal MT stabilizatörlerinin kullanımını içerir20,21,22. Bununla birlikte, bu prosedürler stabil ve daha az stabil (kararsız) MT'ler arasında ayrım yapmaz, bu nedenle beyin gibi dokularda MT'leri veya çözünür tübülini ölçmeyi imkansız hale getirir. Sonuç olarak, fizyolojik ve patolojik koşullar altında organizmalarda MT stabilitesini değerlendirmenin zor olduğu kanıtlanmıştır. Bu deneysel sınırlamayı ele almak için, fare dokusunda MT'leri ve serbest tübülini hassas bir şekilde ayırmak için yeni bir teknik geliştirdik23.
Bu benzersiz MT fraksiyonlama yöntemi, dokularda tübülin durumunu koruyan koşullar altında doku homojenizasyonunu ve kararlı MT'leri, kararsız MT'leri ve serbest tübülini ayırmak için iki aşamalı santrifüjlemeyi içerir. Bu basit prosedür, canlı organizmalarda MT'ler ve MAP'ler üzerine temel araştırmalar, MT stabilitesi ile ilişkili sağlık ve hastalıkların fizyolojik ve patolojik analizleri ve MT'leri hedef alan ilaçlar ve diğer terapötiklerin geliştirilmesi dahil olmak üzere geniş çalışmalara uygulanabilir.
Protokol
1. MT fraksiyonlama yöntemi
NOT: Bu çalışmada yapılan tüm deneyler Doshisha Üniversitesi Hayvan Etik Kurulu tarafından onaylanmıştır. Burada her iki cinsiyetten C57BL / 6J fareleri, 3-4 aylık, kullanıldı. Bu protokolde, diseke edilen dokular, örneğin beyin, karaciğer veya timüs, sadece depolimerizasyonu değil, aynı zamanda MT'nin repolimerizasyonunu da önleyen bir konsantrasyonda Taxol (MT stabilizatörü) içeren buz gibi soğuk mikrotübül stabilize edici tampon (MSB) içinde hemen homojenize edildi. Homojenat, iki aşamalı bir ultrasantrifüj işlemi ile üç fraksiyona ayrıldı (Şekil 1). Bu protokoldeki tüm adımlar, soğuk sıcaklıktaki bir ortamda kesintisiz olarak tamamlandı ve dokular ve fraksiyonlar, sodyum dodesil sülfat (SDS) numune tamponunda çözülene kadar dondurulmadı.
- MSB ve mikrotüplerin hazırlanması
- MSB'yi hazırlamak için aşağıdaki reaktifleri karıştırın: 0.1 M 2- (N-morfolino) etansülfonik asit (MES), pH 6.8 (KOH ile nötralize edilmiş),% 10 gliserol, 0.1 mM DTT, 1 mM MgSO 4, 1 mM EGTA,% 0.5 Triton X-100, fosfataz inhibitörleri (1 mM NaF, 1 mM β-gliserofosfat, 1 mM Na3VO 4, 0.5 μM okadaik asit), 1x proteaz inhibitör kokteyli, ve proteaz inhibitörleri (0.1 mM PMSF, 0.1 mM DIFP, 1 μg/mL pepstatin, 1 μg/mL antipain, 10 μg/mL aprotinin, 10 μg/mL leupeptin, 50 μg/mL TLCK) (bkz.
- Doku diseksiyonundan hemen önce, MSB'ye (-) 10 μM Taxol ve 2 mM GTP (Malzeme Tablosuna bakınız) ekleyin. Bu arabellek MSB(+) olarak gösterilir. Tamponu kullanım günü hazırlayın ve buz üzerinde tutun.
- Mikrotüpleri örnekleme için hazırlayın. Homojenat depolama için boş 2.0 mL mikrotüp; süpernatant1 (S1) lizat, çökelti2 (P2) numunesi ve çökelti3 (P3) numune saklama için boş 1,5 mL mikrotüp; Diseke doku depolaması için 1 mL buz gibi soğuk fosfat tamponlu salin (PBS) içeren 1.5 mL mikrotüp; S1 numunesi ve süpernatant3 (S3) numune saklama için 200 μL 2x SDS numune tamponu (0.16 M Tris pH 6.8; %20 gliserol; %2 2-merkaptoetanol; %4 SDS) içeren 1,5 mL mikrotüp; ve TLA55 ve TLA120.2 santrifüj rotorları için santrifüj mikrotüpü (Malzeme Tablosuna bakınız). Tüm tüpleri etiketleyin ve buzun üzerine yerleştirin.
- Fare dokusu homojenizasyonu
- Doku diseksiyonu için soğutulmuş bir masa hazırlayın. İlk olarak, bir kutuyu kırılmış buzla doldurun ve biri iç tarafı yukarı, diğeri dış tarafı yukarı bakacak şekilde iki Petri kabını buzun üzerine yerleştirin. Kesilen dokuların geçici olarak yıkanması ve saklanması için buz gibi soğuk PBS'yi bir kaba doldurun. PBS ile nemlendirilmiş filtre kağıdını ters çevrilmiş başka bir tabağa koyun.
- Bir fareyi feda etmek için, derin anestezi altında butorphanol, midazolam ve medetomidin karışık anestezikleri ile servikal çıkık yapın. Ardından, beyin, karaciğer veya timus gibi dokuları hemen inceleyin ve bir Petri kabında buz gibi PBS ile yıkayın.
NOT: Bu yöntemle her türlü yumuşak doku analiz edilebilir. Bununla birlikte, dokunun boyutu, kullanılan homojenizatörün önerilen hacim aralığı ile sınırlıdır. Örneğin, 2 mL hacimde homojenizatör kullanılıyorsa, 50-100 mg doku önerilir. - Diseke doku depolaması için PBS ile doldurulmuş 1.5 mL mikrotüpleri tarttıktan sonra, dokuları kesin ve mikrotüplerin içinde saklayın ve her bir mikrotüpü yeniden tartın. Her dokunun yaş ağırlığı, doku eklenmeden önce ve sonra tüpün ağırlığı çıkarılarak hesaplanabilir.
- Dokuyu buz gibi soğuk MSB(+) içinde soğutulmuş bir homojenizatör ile hemen homojenize edin (bkz. Malzeme Tablosu). MSB (+) volümü doku yaş ağırlığının (mg) 19 katı (μL) idi. Doku parçaları kaybolana kadar 20 vuruşla homojenizasyon yapın.
NOT: Örneğin, 100 mg doku için 1.900 μL MSB (+) kullanılır. Analiz edilen doku parçalarının her bir yaş ağırlığı için eklenecek MSB(+) hacminin ayarlanması gerektiğinden, her doku parçasının doğru tartılması gerekir.
- Fare dokusu homojenatlarının santrifüjlenmesi
- Tüm homojenatı bir Pasteur pipeti ile 2 mL'lik bir mikrotüpe taşıyın ve kalıntıları çökeltme yoluyla temizlemek için 2,400 × g'da 2 °C'de 3 dakika santrifüjleyin.
- Tüm süpernatanı (S1 fraksiyonu) yeni bir 1.5 mL mikrotüpe aktarın ve girdap yapın. Daha sonra, 200 μL S1 fraksiyonunu bir santrifüj mikrotüpüne ayırın ve nispeten büyük moleküler ağırlıklı proteinleri bir çökelti olarak elde etmek için 2 ° C'de 20 dakika boyunca bir TLA-55 rotoru kullanarak 100.000 × g'da santrifüjleyin (P2 fraksiyonu).
NOT: Ultrasantrifüj adımlarına tabi tutulan numunenin hacmi, santrifüjleme yarıçapını ve moleküllerin çökeltme verimliliğini etkiler. Yanlış fraksiyonlamayı önlemek için bu adımdan sonra numune hacmini 200 μL veya daha düşük tutun. - Ayrıca, çökeltideki çözünmeyen protein komplekslerini (P3 fraksiyonu) süpernatanttaki (S3 fraksiyonu) çözünür proteinlerden (S3 fraksiyonu) ayırmak için 2 ° C'de 60 dakika boyunca bir TLA-120.2 rotor kullanarak 500.000 × g'da elde edilen tüm süpernatantları (S2 fraksiyonu) santrifüjleyin.
- P2 ve P3 fraksiyon tüplerine 400 μL 1x SDS-numune tamponu (0.08 M Tris pH 6.8;% 10 gliserol;% 1 2-merkaptoetanol;% 2 SDS) ekleyin ve çökeltiyi çözmek için kısaca sonikleştirin. Bu fraksiyon örneklerini boş bir 1.5 mL mikrotüpe aktarın.
- Toplam S3 fraksiyonunu 200 μL'lik 2x SDS numune tamponunda çözün.
- Kalan S1 fraksiyonlarını, Western blotlama için standart bir eğri olarak kullanmak üzere eşit hacimde 2x SDS numune tamponu ile karıştırın.
- Tüm bu numuneleri 100 °C'de 3 dakika kaynatın. Numuneler oda sıcaklığına soğuduktan sonra numuneleri -20 °C'de saklayın.
- Her fraksiyondaki proteinlerin miktar tayini
- P2, P3 ve S3 fraksiyonlarındaki proteinleri Western blotlama ile ölçün. İlk olarak, proteinleri uygun şekilde seyreltilmiş P2, P3 ve S3 fraksiyonlarından ve seri olarak seyreltilmiş S1 örneğini standart bir eğri olarak herhangi bir bireyden ayırmak için %10 SDS-poliakrilamid jel elektroforezi (SDS-PAGE) kullanın. Ardından, numuneleri poliviniliden florür membranları üzerine elektroblot yapın (bkz. Malzeme Tablosu).
NOT: Her fraksiyonun seyreltme oranı, objektif bir proteinin konsantrasyonuna ve antikorun reaktivitesine bağlıdır. (örneğin, beyin dokusunda α-tübülin, TUBB3, β-küvet ve tirozinli tübülin: S3 = 1/400, P3 = 1/2,000, P2 = 1/2,000, S1 = 1/50.000, 1/20.000, 1/10.000, 1/5.000, 1/2.000; Beyin dokusunda asetillenmiş tübülin: S3 = 1/200, P3 = 1/400, P2 = 1/8.000, S1 = 1/100.000, 1/40.000, 1/20.000, 1/10.000, 1/4.000; Karaciğerde α-tubulin: S3 = 1/20, P3 = 1/100, P2 = 1/20, S1 = 1/50.000, 1/20.000, 1/10.000, 1/5.000, 1/2.000; Timusta α-tubulin: S3 = 1/100, P3 = 1/400, P2 = 1/20, S1 = 1/50.000, 1/20.000, 1/10.000, 1/5.000, 1/2.000 doku konsantrasyonu seyreltmesi). - Membranı, 30 dakikadan fazla bir süre boyunca% 0.1 Tween 20 (TBS-T) ile Tris-tamponlu salin (50 mM Tris-HCl pH 7.6; 152 mM NaCl) içinde% 5 yağsız sütle bloke edin.
- Membranı 2 saatten fazla bir süre boyunca birincil antikor içeren TBS-T'ye daldırın (Malzeme Tablosuna bakınız). Bundan sonra, membranı TBS-T ile 3 dakika (3 kez) yıkayın.
- HRP ile konjuge sekonder antikorları kullanarak primer antikoru etiketleyin (bkz. Malzeme Tablosu) TBS-T'de 1 saatten fazla süredir. Bundan sonra, membranı TBS-T ile 3 dakika (3 kez) yıkayın.
- Membranları Gelişmiş Kemilüminesans reaktifi ile geliştirin. Ardından, ilgilenilen bantları ışıldayan bir görüntü analizörü ile analiz edin (bkz.
- Görüntü analiz yazılımını kullanarak protein bant yoğunluklarını ölçün (Malzeme Tablosuna bakın) ve X ekseni boyunca standart eğri için kullanılan seyreltilmiş S1 numunelerinin seyreltme birimlerini ve Y ekseni boyunca bant yoğunluklarını çizerek standart bir eğri oluşturun.
- Seyreltilmiş fraksiyon örneklerine karşılık gelen protein konsantrasyonunu (birim) okuyun. Her fraksiyonda bir protein birimi elde etmek için okunan konsantrasyonu numune seyreltme faktörü ile çarpın. Bir yüzde elde etmek için her fraksiyonun ölçülen birimini toplam protein birimine (P2 + P3 + S3) bölün.
- P2, P3 ve S3 fraksiyonlarındaki proteinleri Western blotlama ile ölçün. İlk olarak, proteinleri uygun şekilde seyreltilmiş P2, P3 ve S3 fraksiyonlarından ve seri olarak seyreltilmiş S1 örneğini standart bir eğri olarak herhangi bir bireyden ayırmak için %10 SDS-poliakrilamid jel elektroforezi (SDS-PAGE) kullanın. Ardından, numuneleri poliviniliden florür membranları üzerine elektroblot yapın (bkz. Malzeme Tablosu).
2. Her fraksiyondaki tübülin özelliklerinin değerlendirilmesi
NOT: Bu biyokimyasal yöntem, sedimantasyon özellikleri ile tanımlanan üç grup tübülin kompleksi sağlar. Burada, bu fraksiyonlarda elde edilen tübülin komplekslerinin durumu, kompleksin ve tübülin-PTM'lerin büyüklüğüne göre tanımlandı. Bu protokoldeki tüm adımları soğuk bir ortamda kesintisiz olarak tamamlayın, ancak fraksiyon numunelerini SDS numune tamponunda çözünene kadar dondurmayın.
- Filtre tuzağı tahlili
- S2 ve S3 fraksiyonlarını (her biri 500 μL) 300 kDa'lık bir ultrafiltrasyon spin kolonu kullanarak filtreleyin (bkz. Tüm süpernatan filtrelenene, ayrıştırılan proteinler alıcı tüplerde toplanana ve sıkışan proteinler rezervuar tüplerinin filtresinde kalana kadar 2 ° C'de 14.000 × g santrifüjleme gerçekleştirin.
- Alıcı tüplerdeki tüm filtratları (yaklaşık 500 μL) yeni 1.5 mL mikrotüplere çevirin ve bunları 500 μL 2x SDS numune tamponunda çözün.
- Rezervuar tüplerinin filtresindeki kalıntıları, numuneleri pipetleyerek ve yeni bir 1,5 mL mikrotüpe aktararak 1.000 μL 1x SDS numune tamponunda çözündürün.
- Numuneleri 100 °C'de 3 dakika kaynatın. Numuneler oda sıcaklığına soğuduktan sonra numuneleri -20 °C'de saklayın.
- DM1A (anti-α-tübülin antikoru, bkz.
- Boyut dışlama kromatografisi
- Adım 1.1.1'de açıklandığı gibi 1/10 konsantrasyonda proteaz ve fosfataz inhibitörleri ile desteklenmiş taşıyıcı tamponu (0.1 M MES, pH 6.8; %10 gliserol; 1 mM MgS04; 1 mM EGTA; 0.1 mM DTT) hazırlayın. Ardından, çözeltiyi filtreleyin ve soğuk bir ortamda saklayın.
- 4 °C'de bir kromatografi odasında (Malzeme Tablosuna bakınız) hazırlayıcı bir sıvı kromatografi sistemi ile donatılmış bir jel filtrasyon kromatografi kolonu hazırlayın.
- Numuneleri kolona enjekte etmeden önce, kolonu yıkamak için taşıyıcı tamponun 180 mL'sini akıtın. Akış hızı 3 saat boyunca 1 mL/dk'dır.
- Ticari olarak temin edilebilen saflaştırılmış domuz tübülini ( Malzeme Tablosuna bakınız) bir kontrol olarak veya fare beyinlerinden (her biri 500 μL) S3 fraksiyonunu kolona enjekte edin.
- Taşıyıcı tampon ile 1.0 mL/dk akış hızında elute. 1.5 mL'lik fraksiyonları 120 dakika boyunca toplayın. 280 nm'de absorbans ile ayrıştırılmış proteinleri izleyin. Maksimum basıncı 0,3 MPa'nın altında tutun.
- Toplanan fraksiyonları vorteksledikten sonra, 50 μL'yi 1.5 mL'lik bir mikrotüp içinde 50 μL 2x SDS numune tamponu ile karıştırın. Tüm numuneleri 100 °C'de 3 dakika kaynatın. Numuneler oda sıcaklığına soğuduktan sonra numuneleri -20 °C'de saklayın.
- DM1A, anti-α-tubulin antikoru ve KMX-1, anti-β-tubulin antikoru ile Western blotlama ile tübülin miktarlarını analiz edin (bkz.
Sonuçlar
Fare beyninden P2, P3 ve S3 fraksiyonlarındaki tübülinin MT fraksiyonlama yöntemi ile miktar tayini
Fare dokusundaki tübülin, MT fraksiyonlama yöntemi ile P2, P3 ve S3 fraksiyonlarına ayrıldı ve Western blotlama ile ölçüldü (Şekil 1A). 20 dakika boyunca 100.000 × g'da ultrasantrifüjleme ile P2 fraksiyonunda kalan MT'lerin çökeltisi, bir fare beynindeki toplam tübülinin %34.86 ± %1.68'ini oluşturuyordu. Süpernatan (S2) ayrıca 60 dakika boyunca 500.000 × g'da santrifüjlendi. Fare beyinlerinde toplam tübülinin sırasıyla %56.13 ± %2.12 veya %9.01 ± %0.68'ini oluşturan bir çökelti (P3 fraksiyonu) ve bir süpernatant (S3 fraksiyonu) elde edildi (Şekil 1B).
Bu çalışmada kullanılan serebral korteks, glia gibi nöronal ve nöronal olmayan hücreleri içerir. Fare beyinlerinin nöronlarındaki MT stabilitesini seçici olarak değerlendirmek için, Tuj1 (anti-TUBB3 antikoru) ile Western blotlama ile merkezi ve periferik sinir sistemindeki nöronlarda özel olarak eksprese edilen bir tübülin alt tipi olan TUBB3'ü ölçtük. P2, P3 veya S3 fraksiyonundaki TUBB3 yüzdesi sırasıyla %32.65 ± %2.20, %59.31 ± %2.61 veya %8.04 ± %0.74 idi. α-tübülinden önemli ölçüde farklı değillerdi (Şekil 1B). Bu sonuçlar, nöronların ve glial hücrelerin benzer MT stabilitesi sergilediğini veya nöronların in vivo glial hücrelerden çok daha yüksek miktarda tübülin içerdiğini göstermiştir.
Her fraksiyonda geri kazanılan tübülinin özellikleri
Burada, fare dokusu homojenatı, farklı yerçekimi ivmelerine sahip iki aşamalı ultrasantrifüjleme ile üç fraksiyona ayrıldı; Bu nedenle, her fraksiyondaki proteinler veya kompleksleri arasındaki sedimantasyon katsayıları farklıydı. 100.000 × g ultrasantrifüjde çökeltilen tübülin konvansiyonel MT olarak kabul edilse de, burada yeni elde edilen P3 fraksiyonunun tübülinin P2 ve S3 fraksiyonlarındaki tübülinden nasıl farklı olduğu açıklığa kavuşturulmalıdır.
S3 tubülini karakterize etmek için S2 (P3 + S3) veya S3 fraksiyonu ultrafiltrasyon ve boyut dışlama kromatografisine tabi tutuldu. S3 fraksiyonundaki tübülin kompleksleri 300 kDa'lık bir ultrafiltrasyon spin kolonundan tamamen geçebilirken, S2 fraksiyonundaki tübülin neredeyse tamamı filtre üzerinde hapsolmuştur (Şekil 2A). Ayrıca, S3 fraksiyonundaki tübülin komplekslerinin moleküler ağırlığı, boyut dışlama kromatografisi ile ölçüldü. S3 tübülin, ticari olarak temin edilebilen saflaştırılmış tübülin dimerlerininkine benzer olan 100 kDa'ya karşılık gelen bir tepe noktasında ayrıştırılır (Şekil 2B, C). Ek olarak, MT fraksiyonlama yöntemi ile her fraksiyonda geri kazanılan α- ve β-tubulin oranları eşitti (Şekil 2D). Aslında, α- ve β-tübülinin canlı hücrelerde monomer olarak hafifçe bulunabileceği gösterilmiştir24. Bununla birlikte, rapor edilen tahmini kD değerine (nM sırası) ve S3 fraksiyonunda (~ 11 μM) geri kazanılan tübülin konsantrasyonuna bakılırsa, çoğu (>% 98) tübülinin α/β-dimerler olarak var olduğu düşünülmektedir. Bu nedenle, S3 fraksiyonundaki tübülin, esas olarak çözünür bir α/β-tübülin dimeridir.
Tübülin polimerleri, translasyon sonrası modifikasyonlarına (PTM'ler) dayalı olarak P2 ve P3 olmak üzere iki fraksiyona ayrıldı. Bu fraksiyonlar arasında ayrım yapmak için, spesifik antikorlar kullanılarak Western blotlama yapıldı. Stabil MT'ler için bir belirteç görevi gören anti-asetillenmiş α-tübülin antikoru, P2 fraksiyonunun asetillenmiş α-tübülinin %97.40 ± %0.52'si ile önemli ölçüde zenginleştirildiğini gösterirken (Şekil 2E), toplam α-tübülin P3 ve S3 fraksiyonlarında geri kazanıldı (Şekil 1B). Tersine, kararsız MT'lerin göstergesi olan anti-tirozinli α-tübülin antikoru, P3 fraksiyonunda tirozinli α-tübülinin %75.43 ± %2.69'unun mevcut olduğunu ortaya koymuştur (Şekil 2F). Bu bulgular, P2 fraksiyonunun esas olarak kararlı MT'ler içinde tübülin içerdiğini, P3 fraksiyonunun ise kararsız MT'ler içinde tübülinden oluştuğunu doğrulamaktadır.
Dondurma ve nokodazol tedavisi altında MT stabilitesinin değerlendirilmesi
Dondurma ve nokodazol tedavisinin fare intraserebral MT'lerinin stabilitesi üzerindeki etkisi, MT'lerin stabilitesindeki geçici değişikliklerin MT fraksiyonasyon yöntemi ile ayırt edilip edilemeyeceğini belirlemek için analiz edildi. MT'ler genellikle düşük sıcaklıklarda sökülür, ancak bazı MT'ler soğukta stabil kalır. Beyinler tartıldıktan sonra sıvı nitrojen içinde donduruldu ve 30 dakika boyunca -80 ° C'ye yerleştirildi. Kontrol olarak geçici donmuş beyin ve ham beyin homojenize edildi ve P2, P3 ve S3 fraksiyonlarına ayrıldı. Daha sonra, üç fraksiyonda bulunan tübülin oranı, Western blotlama ile ölçüldü. Homojenizasyondan önce beyin dondurulduktan sonra, P2 fraksiyonundaki α-tubulin azaldı ve P3 fraksiyonundaki ham beyindekine kıyasla arttı (Şekil 3A). 6-11B1 (asetillenmiş α-tübülin) veya 1A2 (tirozinli α-tübülin) içeren lekeler ayrıca beyin donmasının asetilasyon seviyesini azalttığını (Şekil 3B) ve P2 fraksiyonundaki α-tübülinin tirozinasyon seviyesini (Şekil 3C) arttırdığını ortaya koydu.
Nokodazol, β-tübüline bağlanarak MT polimerizasyonunu önleyen ve MT depolimerizasyonunu destekleyen bir mikrotübül hedefleme maddesidir (MTA). Fare beyinleri, 10 μM nokodazol ile veya nokodazol olmadan Taxol içermeyen MSB (+) içinde homojenize edildi ve 20 dakika boyunca 4 ° C'ye yerleştirildi. İşlenmemiş veya nokodazol ile muamele edilmiş homojenat, 10 μM Taxol'e ilave edildi, yeniden homojenize edildi ve P2, P3 ve S3 fraksiyonlarına bölündü. Daha sonra, üç fraksiyonda bulunan tübülin oranı, Western blotlama ile ölçüldü. DM1A (α-tubulin) ile yapılan lekeler, P2 fraksiyonundaki α-tubulinin azaldığını ve P3 fraksiyonunda nokodazol tedavisi ile artma eğiliminde olduğunu gösterdi (Şekil 3D). Bu sonuçlar, P2 tubulinin düşük sıcaklığa veya nokodazole yanıt olarak destabilize olduğunu ve P2 fraksiyonunun deneysel koşullara direnen sağlam MT'ler içerdiğini göstermektedir. Donmanın aksine, nokodazol tübülin PTM'lerini etkilemedi (Şekil 3E, F). Elde edilen sonuçlara ve yukarıdaki verilere dayanarak, PTM analizi ile tespit edilemeyen MT'lerin depolimerizasyonu bu yöntemle değerlendirilebilir.
Dokulardaki stabil MT'ler, kararsız MT'ler ve serbest tübülin oranının karşılaştırılması
MT'lerin stabilitesi, bu dokulardaki hücrelerin proliferatif kapasitesine bağlı olarak farklı dokular arasında değişir. Özellikle, stabil MT'ler, esas olarak proliferatif olmayan nöronlardan oluşan sinir sisteminde, diğer dokulara kıyasla daha bol miktarda bulunur4. Geliştirilen MT fraksiyonlama yönteminin çeşitli dokulardaki MT stabilitesindeki farklılıkları ayırt etme yeteneğini değerlendirmek için, farelerin karaciğerleri ve kekikleri fraksiyonlandı ve her fraksiyondaki geri kazanılan tübülin ölçüldü. Sonuçlar, diğer dokularla karşılaştırıldığında, beynin önemli ölçüde daha yüksek bir P2 tübülin seviyesi sergilediğini, P3 tübülinlerinin ise proliferatif hücreler içeren dokularda önemli ölçüde zenginleştirildiğini ortaya koymuştur (Şekil 4). Ek olarak, 6-11B1 ve 1A2 antikorları kullanılarak yapılan Western blotlama, sinir sisteminde daha yüksek MT stabilitesinin varlığını doğruladı. Tübülin PTM'lerinin farklı dağılım paternleri, sinir sisteminde spesifik olarak bulunan P2 tübülinin stabil MT'lerden kaynaklandığını açıkça göstermiştir (Şekil 4). Bu bulgular ayrıca P2 ve P3 fraksiyonlarının sırasıyla kararlı ve kararsız MT'lere karşılık geldiği fikrini desteklemektedir.

Şekil 1: MT fraksiyonlama yöntemi kullanılarak fare dokusunda tübülin miktarının belirlenmesi. (A) Dokular için MT fraksiyonlama yönteminin özeti. Dokulardaki kararlı MT'ler (P2 fraksiyonu), kararsız MT'ler (P3 fraksiyonu) ve serbest tübülin (S3 fraksiyonu), hazırlama sırasında MT polimerizasyonunu ve depolimerizasyonunu baskılayan koşullar altında 2 aşamalı ultrasantrifüjleme ile ayrılabilir. (B) Fare korteksindeki MT'ler, geleneksel 100.000 × g ultrasantrifüjleme ve ardından 500.000 × g ultrasantrifüjleme ile çökeltildi. Daha sonra, P2, P3 ve S3 fraksiyonlarına ayrılan tübülinler, DM1A (α-tubulin) ve anti-Tuj1 (TUBB3) ile Western blotlama ile ölçüldü. Her fraksiyondaki (P2, P3 veya S3) proteinlerin toplam fraksiyona (P2 + P3 + S3) oranı, Protokol bölümünde açıklandığı gibi hesaplandı (± SD'ler anlamına gelir, n = 4). Bu rakam Hagita ve ark.23'ten değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: MT fraksiyonlama yöntemi, fare serebral korteksinde kararlı MT'lerin, kararsız MT'lerin ve serbest tübülinin ayrılmasını sağlar. (A) S2 veya S3 fraksiyonları (girdi), 300 kDa'lık bir ultrafiltrasyon spin kolonu kullanılarak filtre kapanı deneyi ile analiz edildi. Filtrasyon (alıcı) ve yakalama (rezervuar) ile elde edilen tübülinler, DM1A (α-tübülin) ile Western blotlama ile ölçüldü. (B) Saflaştırılmış domuz tübülinleri MT fraksiyonlama yöntemine tabi tutuldu ve çoğunlukla S3 fraksiyonunda toplandığı bulundu. (C) S3 fraksiyonundaki tübülinin moleküler boyutu. S3 fraksiyonu, bir jel filtrasyon kromatografisi kolonu kullanılarak boyut dışlama kromatografisi ile ayrıldı. Her fraksiyondaki proteinler, DM1A (α-tubulin) ve KMX-1 (β-tubulin) ile Western blotlama ile ölçüldü. Teorik moleküler ağırlık, panellerin üst kısmında gösterilmiştir. (D) Her fraksiyondaki α-tubulin ve β-tubulin oranları eşitti. P2, P3 ve S3 fraksiyonlarına ayrılan tübülinler, KMX-1 (β-tübülin) ile Western blotlama ile ölçüldü. Her bir fraksiyondaki α-tubulin ve β-tubulin oranının toplam fraksiyonun toplamına göre ölçülmesi (± SD'ler anlamına gelir, n = 4). İstatistiksel analizler Student t-testi ile yapıldı. (E,F) P2, P3 ve S3 fraksiyonlarındaki α-tubulin modifikasyonları, 6-11B1 (asetillenmiş α-tübülin: E) ve 1A2 (tirozinli α-tübülin: F) ile Western blotlama ile doğrulandı. Toplam fraksiyona göre her fraksiyondaki tirozinli veya asetillenmiş α-tubulin oranının miktar tayini (± SD'ler anlamına gelir, n = 4). (A-C) Hagita ve ark.23'ten değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
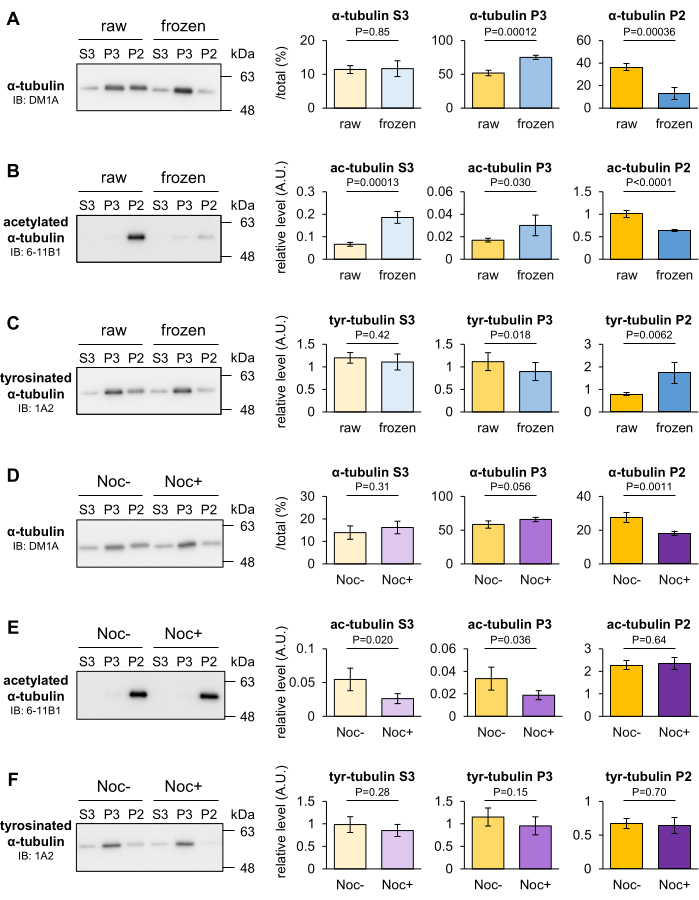
Şekil 3: Dondurma veya MTA ile indüklenen MT depolimerizasyonunun değerlendirilmesi. (A-C) -80 °C'de 30 dakika dondurulduktan sonra MT'nin stabilitesi değerlendirildi. Ham ve donmuş beynin üç fraksiyonunda bulunan tübülin oranları, DM1A (α-tübülin: A), 1A2 (tirozinli α-tübülin: B) ve 6-11B1 (asetillenmiş α-tübülin: C) ile Western blotlama ile ölçüldü. (D-F) Nokodazolün MT stabilitesi üzerindeki etkisi değerlendirildi. Tedavi edilmemiş veya tedavi edilmiş beyinlerin nokodazolün üç fraksiyonunda bulunan tübülin oranları, DM1A (α-tübülin: D), 1A2 (tirozinli α-tübülin: E) ve 6-11B1 (asetillenmiş α-tübülin: F) ile Western blotlama ile ölçüldü. Temsili nispi tirozinasyon (B,E) veya asetilasyon (C,F) seviyeleri, toplam α-tübülin (A,D) miktarına normalleştirildi ) (± SD anlamına gelir, n = 4). İstatistiksel analizler Student t-testi ile yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
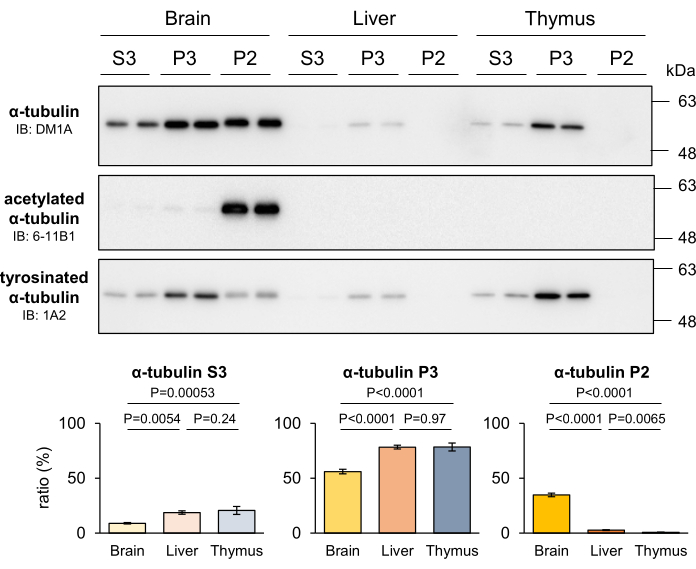
Şekil 4: Farede beyin, karaciğer ve timusta kararlı MT'lerin, kararsız MT'lerin ve serbest tübülin oranları. Farelerin beyinleri, karaciğerleri ve kekikleri diseke edildi ve MT fraksiyonlama yöntemine tabi tutuldu. Her fraksiyona ayrılan proteinler, DM1A (α-tübülin), 6-11B1 (asetillenmiş α-tübülin) ve 1A2 (tirozinli α-tübülin) ile Western blotlama ile ölçüldü. Her fraksiyondaki (P2, P3 veya S3) proteinlerin toplam fraksiyona (P2 + P3 + S3) oranı, Protokol bölümünde açıklandığı gibi hesaplandı (± SD'ler anlamına gelir, n = 4). İstatistiksel analizler tek yönlü varyans analizi ve ardından Tukey's post hoc testi ile yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Canlı organizmalardan alınan dokudaki tübülin durumunu araştırırken en önemli görev, hazırlama sırasında kazara MT polimerizasyonunu veya depolimerizasyonunu önlemektir. Numunelerdeki MT'lerin stabilitesi, MSB'deki Taxol konsantrasyonu, doku miktarının tampona oranı ve doku çıkarmadan homojenizasyon ve santrifüjlemeye kadar olan işlem sırasındaki sıcaklık gibi faktörlerden etkilenir. Bu nedenle, 20 kat homojenat hacmine sahip fare dokusunu analiz etmek için protokolün her adımında koşullar optimize edildi. Daha yüksek bir Taxol konsantrasyonu, soğutulmuş koşullar altında bile in vitro MT polimerizasyonunu indükleyebilir25. Önemli ölçüde farklı tübülin konsantrasyonlarına sahip dokuları analiz ederken veya önemli protokol değişiklikleri yaparken, her operatör deneylerinin özel hedeflerine göre adımları optimize etmelidir.
Yapılan çalışmada, 500.000 × g20'de ultrasantrifüjleme kullanılarak geleneksel "çözünür fraksiyondan" P3 olarak adlandırılan yeni bir MT popülasyonu elde edildi. Rotorun K-faktörü, merkezkaç kuvveti ve santrifüjleme süresi gibi faktörlere dayalı teorik hesaplamalar, S3 fraksiyonunda bulunan tübülinlerin büyük olasılıkla 6S tübülin dimerlerini temsil ettiğini göstermektedir. Tersine, P3 fraksiyonundaki tübülin, P2 fraksiyonunda bulunanlara kıyasla daha kısa uzunluktaki MT'lere karşılık gelebilir. Bu gözlem, MTs26'nın kısmi çökmesine yol açan homojenizasyondan önce dokuların dondurulmasının, P3 fraksiyonu içinde tübülinde önemli bir artışa ve P2 fraksiyonunda eşzamanlı bir azalmaya neden olduğunu gösteren sonuçla uyumludur (Şekil 3A). Ayrıca, tübülin PTM'lerinin analizi ve çeşitli MAP'lerin bağlanma özellikleri, P2 veya P3 fraksiyonunun sırasıyla kararlı veya kararsız MT'ler içerdiğini göstermektedir. Örneğin, esas olarak nöronlarda bulunan kararlı MT'lere özgü belirli MAP'ler, yalnızca P2 fraksiyonu23'te mevcuttu. Sonuç olarak, P3 fraksiyonunun, P2 fraksiyonundakilere kıyasla daha dinamik ve kararsız olan MT'leri içerdiğini öne sürmek akla yatkındır.
Yöntemin altında yatan teoriye göre, MT stabilizasyonu veya santrifüjlemede yer alan uygun olmayan deneysel koşullar, zayıf fraksiyonasyona neden olabilir. Örneğin, düşük bir Taxol konsantrasyonu P2 tübülinde hafif bir azalmaya yol açarken, fazla Taxol, preparat23 sırasında MT oluşumu nedeniyle P2 tübülini arttırır. Benzer şekilde, dokuların ve numunelerin uygun olmayan şekilde ısıtılması, MT'lerin hiperpolimerleşmesine ve tau'nun bozulmasına veya parçalanmasınaneden olabilir 23. Ayrıca, santrifüj koşulları P3 ve S3 fraksiyonlarını ayırmak için kritik öneme sahiptir ve yerçekimi ivmesindeki hafif bir azalma, P3 fraksiyonunun geri kazanımını önemli ölçüde azaltır. Bu nedenle, herhangi bir anormal fraksiyonasyon gözlenirse protokol adımlarını kesinlikle takip etmeniz önerilir.
Bu basit fraksiyonlama yöntemi, kararlı MT'ler, kararsız MT'ler ve dokulardaki serbest dimerler arasındaki tübülin oranlarını analiz etmek için geniş çapta uygulanabilir. Bu yöntem, tübülin PTM'lerinin miktar tayini yoluyla belirgin olmayabilecek tübülin durumundaki ince değişiklikleri tespit edebildiği için çeşitli avantajlar sunar. MT stabilitesini analiz etmek, özellikle büyük ve karmaşık nöronal hücrelerde MT'lerin fizyolojik önemini anlamak ve MT düzensizliği ile ilişkili bozuklukları araştırmak için önemlidir. Örneğin, tübülin veya MAP genlerindeki mutasyonlar veya işlev bozuklukları, nörogelişimsel bozukluklar ve nörodejeneratif hastalıklarla bağlantılıdır27,28. Alzheimer hastalığında, muhtemelen etkilenen nöronlarda tau proteininin fonksiyonel kaybı nedeniyleMT'lerin azaldığı bilinmektedir 15,29,30,31,32,33. MT stabilitesini modüle eden ve hücre bölünmesini inhibe eden MTA'lar, nörolojik bozukluklar için potansiyel tedaviler olarak önerilmiştir13,34. Hastalık modeli hayvanlarda MT'lerin ve MAP'lerin stabilitesini ve davranışını analiz etmek için bu benzersiz MT fraksiyonlama yönteminin kullanılması, tau ile ilişkili demansın patogenezinin aydınlatılmasına ve yeni terapötik hedeflerin belirlenmesine önemli ölçüde katkıda bulunabilir.
Açıklamalar
Yazarların bildirecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma kısmen JST tarafından desteklenmiştir: bilim, teknoloji, inovasyonun yaratılmasına yönelik üniversite burslarının kurulması (A.HT.; JPMJFS2145), JST SPRING (A.HT.; JPMJSP2129), JSPS Üyeleri için Yardım Hibesi (A.HT.; 23KJ2078), Bilimsel Araştırma için Yardım Hibesi (B) JSPS KAKENHI (TM için 22H02946), MEXT'ten "Beyin Proteini Yaşlanması ve Demans Kontrolü" başlıklı Yenilikçi Alanlarda Bilimsel Araştırma Hibesi (TM; 26117004) ve Uehara Memorial Foundation'dan (TM; 202020027) Uehara Araştırma Bursu. Yazarlar hiçbir rakip mali çıkar beyan etmemektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 ML TUBE CASE OF 500 | Beckman Coulter | 357448 | |
| 1A2 | Sigma-Aldrich | T9028 | 1:5,000 dilution |
| 2-(N-morpholino)ethanesulfonic acid (MES) | Nacalai Tesque | 02442-44 | |
| 300 kDa ultrafiltration spin column | Aproscience | PT-1013 | |
| 6-11B1 | Sigma-Aldrich | T7451 | 1:5,000 dilution |
| ÄKTAprime plus | Cytiva | 11001313 | |
| anti-mouse IgG | Jackson ImmunoResearch | 115-035-146 | 1:5,000 dilution |
| antipain | Peptide Institute Inc. | 4062 | |
| aprotinin | Nacalai Tesque | 03346-84 | |
| Chemi-Lumi One L | Nacalai Tesque | 07880-54 | |
| Corning bottle-top vacuum filter system | Corning | 430758 | 0.22µm 33.2cm² Nitrocellulose membrane |
| DIFP | Sigma-Aldrich | 55-91-4 | |
| DIGITAL HOMOGENIZER HK-1 | AS ONE | 1-2050-11 | |
| DM1A | Sigma-Aldrich | T9026 | 1:5,000 dilution |
| DTT | Nacalai Tesque | 14128-46 | |
| EGTA | Nacalai Tesque | 37346-05 | |
| FluoroTrans W 3.3 Meter Roll | Pall Corporation | BSP0161 | |
| glycerol | Nacalai Tesque | 17018-25 | |
| GTP | Nacalai Tesque | 17450-61 | |
| HIGH SPEED REFRIGERATIOED MICRO CENTRIFUGE Kitman | TOMY | KITMAN-24 | |
| HiLoad 16/600 Superdex 200 pg column | Cytiva | 28-9893-35 | |
| Image Gauge Software | FUJIFILUM Wako Pure Chemical Corporation | ||
| ImmunoStar LD | FUJIFILUM Wako Pure Chemical Corporation | 292-69903 | |
| KMX-1 | Millipore | MAB3408 | 1:5,000 dilution |
| LAS-4000 luminescent image analyzer | FUJIFILUM Wako Pure Chemical Corporation | ||
| leupeptin | Peptide Institute Inc. | 43449-62 | |
| MgSO4 | Nacalai Tesque | 21003-75 | |
| Na3VO4 | Nacalai Tesque | 32013-92 | |
| NaF | Nacalai Tesque | 31420-82 | |
| okadaic acid | LC Laboratories | O-2220 | |
| OPTIMA MAX-XP | Beckman Coulter | 393315 | |
| pepstatin | Nacalai Tesque | 26436-52 | |
| PMSF | Nacalai Tesque | 27327-81 | |
| Polycarbonate Centrifuge Tubes for TLA120.2 | Beckman Coulter | 343778 | |
| Protease inhibitor cocktail (cOmplete™, EDTA-free) | Roche | 11873580001 | |
| Purified tubulin | Cytoskeleton | T240 | |
| QSONICA Q55 | QSonica | Q55 | |
| Taxol | LC Laboratories | P-9600 | |
| TLA-120.2 rotor | Beckman Coulter | 357656 | |
| TLA-55 rotor | Beckman Coulter | 366725 | |
| TLCK | Nacalai Tesque | 34219-94 | |
| Triton X-100 | Nacalai Tesque | 12967-45 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
Referanslar
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Conde, C., Caceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nature Reviews Neuroscience. 10 (5), 319-332 (2009).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Challacombe, J. F., Snow, D. M., Letourneau, P. C. Dynamic microtubule ends are required for growth cone turning to avoid an inhibitory guidance cue. Journal of Neuroscience. 17 (9), 3085-3095 (1997).
- Kapitein, L. C., Hoogenraad, C. C. Building the neuronal microtubule cytoskeleton. Neuron. 87 (3), 492-506 (2015).
- Leo, L., et al. Vertebrate fidgetin restrains axonal growth by severing labile domains of microtubules. Cell Reports. 12 (11), 1723-1730 (2015).
- Janke, C. The tubulin code: molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. International Journal of Molecular Sciences. 18 (10), 2207 (2017).
- Baas, P. W., Black, M. M. Individual microtubules in the axon consist of domains that differ in both composition and stability. Journal of Cell Biology. 111 (2), 495-509 (1990).
- Cartelli, D., et al. Microtubule alterations occur early in experimental parkinsonism and the microtubule stabilizer epothilone D is neuroprotective. Scientific Reports. 3, 1837 (2013).
- Zhang, B., et al. Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proceedings of the National Academy of Sciences of the United States of America. 102 (1), 227-231 (2005).
- Zhang, F., et al. Post-translational modifications of alpha-tubulin in Alzheimer disease. Translational Neurodegeneration. 4, 9 (2015).
- Miyasaka, T., et al. Curcumin improves tau-induced neuronal dysfunction of nematodes. Neurobiology of Aging. 39, 69-81 (2016).
- Fujiwara, H., et al. Inhibition of microtubule assembly competent tubulin synthesis leads to accumulation of phosphorylated tau in neuronal cell bodies. Biochemical and Biophysical Research Communications. 521 (3), 779-785 (2020).
- Vielkind, U., Swierenga, S. H. A simple fixation procedure for immunofluorescent detection of different cytoskeletal components within the same cell. Histochemistry. 91 (1), 81-88 (1989).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. Journal of Cell Biology. 109 (3), 1173-1184 (1989).
- Brown, A., Li, Y., Slaughter, T., Black, M. M. Composite microtubules of the axon: quantitative analysis of tyrosinated and acetylated tubulin along individual axonal microtubules. Journal of Cell Science. 104 (2), 339-352 (1993).
- Black, M. M., Slaughter, T., Moshiach, S., Obrocka, M., Fischer, I. Tau is enriched on dynamic microtubules in the distal region of growing axons. Journal of Neuroscience. 16 (11), 3601-3619 (1996).
- Caron, J. M., Jones, A. L., Kirschner, M. W. Autoregulation of tubulin synthesis in hepatocytes and fibroblasts. Journal of Cell Biology. 101 (5), 1763-1772 (1985).
- Merrick, S. E., Trojanowski, J. Q., Lee, V. M. Selective destruction of stable microtubules and axons by inhibitors of protein serine/threonine phosphatases in cultured human neurons. Journal of Neuroscience. 17 (15), 5726-5737 (1997).
- Miyasaka, T., Sato, S., Tatebayashi, Y., Takashima, A. Microtubule destruction induces tau liberation and its subsequent phosphorylation. FEBS Letters. 584 (14), 3227-3232 (2010).
- Hagita, A., et al. Quantitative fractionation of tissue microtubules with distinct biochemical properties reflecting their stability and lability. Biochemical and Biophysical Research Communications. 560, 186-191 (2021).
- Montecinos-Franjola, F., Chaturvedi, S. K., Schuck, P., Sackett, D. L. All tubulins are not alike: Heterodimer dissociation differs among different biological sources. Journal of Biological Chemistry. 294 (26), 10315-10324 (2019).
- Vallee, R. B. A taxol-dependent procedure for the isolation of microtubules and microtubule-associated proteins (MAPs). Journal of Cell Biology. 92 (2), 435-442 (1982).
- Bartolo, M. E., Carter, J. V. Effect of microtubule stabilization on the freezing tolerance of mesophyll cells of spinach. Plant Physiology. 97 (1), 182-187 (1991).
- Strang, K. H., Golde, T. E., Giasson, B. I. MAPT mutations, tauopathy, and mechanisms of neurodegeneration. Laboratory Investigation. 99 (7), 912-928 (2019).
- Fourel, G., Boscheron, C. Tubulin mutations in neurodevelopmental disorders as a tool to decipher microtubule function. FEBS Letters. 594 (21), 3409-3438 (2020).
- Terry, R. D., Gonatas, N. K., Weiss, M. Ultrastructural studies in Alzheimer's presenile dementia. The American Journal of Pathology. 44 (2), 269-297 (1964).
- Yoshida, H., Ihara, Y. Tau in paired helical filaments is functionally distinct from fetal tau: assembly incompetence of paired helical filament-tau. Journal of Neurochemistry. 61 (3), 1183-1186 (1993).
- Cash, A. D., et al. Microtubule reduction in Alzheimer's disease and aging is independent of tau filament formation. The American Journal of Pathology. 162 (5), 1623-1627 (2003).
- Hempen, B., Brion, J. P. Reduction of acetylated alpha-tubulin immunoreactivity in neurofibrillary tangle-bearing neurons in Alzheimer's disease. Journal of Neuropathology and Experimental Neurology. 55 (9), 964-972 (1996).
- Miyasaka, T., et al. Imbalanced expression of tau and tubulin induces neuronal dysfunction in C. elegans models of tauopathy. Frontiers in Neuroscience. 12, 415 (2018).
- Boiarska, Z., Passarella, D. Microtubule-targeting agents and neurodegeneration. Drug Discovery Today. 26 (2), 604-615 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır