Method Article
定量微管分离技术分离小鼠组织中稳定的微管、不稳定的微管和游离微管蛋白
摘要
微管是微管蛋白聚合物,在真核细胞中作为细胞骨架成分起着至关重要的作用,并以其动态不稳定性而闻名。本研究开发了一种将微管分离为稳定微管、不稳定微管和游离微管蛋白的方法,以评估微管在各种小鼠组织中的稳定性。
摘要
微管由α/β-微管蛋白二聚体组成,是真核细胞细胞骨架的重要组成部分。这些管状聚合物表现出动态不稳定性,因为微管蛋白异二聚体亚基会经历重复聚合和解聚。通过微管蛋白翻译后修饰和微管相关蛋白实现微管稳定性和动力学的精确控制,对于各种细胞功能至关重要。微管功能障碍与发病机制密切相关,包括神经退行性疾病。正在进行的研究集中在调节稳定性的微管靶向治疗剂上,为这些疾病和癌症提供了潜在的治疗选择。因此,了解微管的动态状态对于评估疾病进展和治疗效果至关重要。
传统上,微管动力学是通过粗分离或免疫测定在 体外 或培养细胞中评估的,使用靶向微管蛋白翻译后修饰的抗体。然而,使用此类程序准确分析组织中的微管蛋白状态存在挑战。在这项研究中,我们开发了一种简单而创新的微管分离方法,用于分离小鼠组织中的稳定微管、不稳定微管和游离微管蛋白。
该过程涉及以19:1的体积比在微管稳定缓冲液中匀浆解剖的小鼠组织。然后,在初始慢速离心(2,400 × g)之后,通过两步超速离心过程对匀浆进行分馏以除去碎屑。第一个超速离心步骤(100,000 × g)沉淀出稳定的微管,而所得上清液则进行第二个超速离心步骤(500,000 × g)以分馏不稳定的微管和可溶性微管蛋白二聚体。该方法测定了微管蛋白在小鼠大脑中构成稳定或不稳定微管的比例。此外,观察到微管稳定性的明显组织变化与组成细胞的增殖能力相关。这些发现突出了这种新方法在分析生理和病理条件下微管稳定性方面的巨大潜力。
引言
微管 (MTs) 是细长的管状结构,由α/β-微管蛋白异二聚体亚基组成的原丝组成。它们在细胞分裂、运动、形状维持和细胞内运输等各种细胞过程中发挥着重要作用,使其成为真核细胞骨架1 的组成部分。暴露α-微管蛋白亚基的 MT 负端相对稳定,而暴露β-微管蛋白亚基的正端经历动态解聚和聚合2。这种微管蛋白二聚体在正端加成和解离的连续循环,称为动态不稳定性,导致重复的救援和灾难过程3.MT 表现出具有动态不稳定性局部变化的焦点域,包括稳定域和不稳定域4。
精确控制MT的动态不稳定性对于许多细胞功能至关重要,特别是在以复杂形态为特征的神经元中。MT 的适应性和耐久性在神经细胞的发育和正常功能中起着至关重要的作用 5,6,7。已发现 MT 的动态不稳定性与微管蛋白的各种翻译后修饰 (PTM) 有关,例如乙酰化、磷酸化、棕榈酰化、去酪氨酸化、δ 2、聚谷氨酰胺氧化和聚甘氨酰化。此外,微管相关蛋白 (MAP) 的结合是一种调节机制8。PTM(不包括乙酰化)主要发生在位于 MT 外表面的微管蛋白羧基末端区域。这些修饰在 MT 上创造了不同的表面条件,影响了它们与 MAP 的相互作用,并最终控制了 MT 的稳定性9。α-微管蛋白中羧基末端酪氨酸残基的存在表明存在动态 MT,其迅速被游离微管蛋白池取代。相反,羧基末端的去酪氨酸化和 Lys40 的乙酰化表明稳定的 MT 具有降低的动态不稳定性 9,10。
微管蛋白的PTM已被广泛用于评估MTs的动力学和稳定性的实验5,7,11,12,13,14,15。例如,在细胞培养研究中,微管蛋白可以分为两个池:游离微管蛋白池和MT池。这是通过在固定剩余的 MT15、16、17、18、19 之前通过细胞通透性释放游离微管蛋白来实现的。生化方法涉及使用化学 MT 稳定剂来保护 MT 免受灾难,从而通过离心分离 MT 和游离微管蛋白20,21,22。然而,这些程序无法区分稳定和不太稳定(不稳定)的 MT,因此无法量化 MT 或大脑等组织中的可溶性微管蛋白。因此,在生理和病理条件下评估生物体的MT稳定性已被证明具有挑战性。为了解决这一实验局限性,我们开发了一种新技术,用于精确分离小鼠组织中的 MT 和游离微管蛋白23。
这种独特的 MT 分离方法涉及在维持组织中微管蛋白状态的条件下进行组织匀浆,以及两步离心以分离稳定的 MT、不稳定的 MT 和游离微管蛋白。这种简单的程序可以应用于广泛的研究,包括生物体中 MT 和 MAP 的基础研究、与 MT 稳定性相关的健康和疾病的生理和病理分析,以及开发靶向 MT 的药物和其他疗法。
研究方案
1.MT分馏法
注:本研究中进行的所有实验均已获得同志社大学动物伦理委员会的批准。这里使用3-4个月大的C57BL / 6J小鼠。在该方案中,解剖的组织,例如脑,肝脏或胸腺,立即在冰冷的微管稳定缓冲液(MSB)中匀浆,其含有紫杉醇(MT稳定剂)的浓度,其浓度不仅阻止了解聚,而且阻止了MT的再聚合。通过两步超速离心过程将匀浆分离成三部分(图1)。该方案中的所有步骤均在低温环境中不间断地完成,并且组织和级分在溶解在十二烷基硫酸钠(SDS)样品缓冲液中之前不会冷冻。
- MSB和微管的制备
- 要制备MSB,请混合以下试剂:0.1M 2-(N-吗啉基)乙磺酸(MES),pH 6.8(通过KOH中和),10%甘油,0.1mM DTT,1mM MgSO 4,1mM EGTA,0.5%Triton X-100,磷酸酶抑制剂(1mM NaF,1mM β-甘油磷酸,1mM Na3VO4,0.5μM冈田酸),1x蛋白酶抑制剂混合物, 和蛋白酶抑制剂(0.1 mM PMSF、0.1 mM DIFP、1 μg/mL 胃蛋白酶抑制剂、1 μg/mL 止痛药、10 μg/mL 抑肽酶、10 μg/mL 亮肽酶、50 μg/mL TLCK)(参见材料表),表示为 MSB(-)。
- 在组织解剖之前,向MSB(-)中加入10μM紫杉醇和2mM GTP(参见 材料表)。此缓冲区表示为 MSB(+)。在使用当天准备缓冲液并将其放在冰上。
- 准备微管进行取样。空的 2.0 mL 微管用于匀浆储存;空的 1.5 mL 微管,用于储存上清液 1 (S1) 裂解物、沉淀物 2 (P2) 样品和沉淀物 3 (P3) 样品;1.5 mL 微管和 1 mL 冰冷的磷酸盐缓冲盐水 (PBS),用于解剖组织储存;1.5 mL 微管,含有 200 μL 2x SDS 样品缓冲液(0.16 M Tris pH 6.8;20% 甘油;2% 2-巯基乙醇;4% SDS),用于 S1 样品和上清液 3 (S3) 样品储存;以及用于 TLA55 和 TLA120.2 离心机转子的离心微管(参见 材料表)。标记所有试管并将它们放在冰上。
- 小鼠组织匀浆
- 准备一个冷藏的床进行组织解剖。首先,用碎冰装满一个盒子,然后将两个培养皿放在冰上,一个内侧朝上,另一个外侧朝上。将冰冷的PBS装入一个培养皿中,用于解剖组织的瞬时洗涤和储存。将用PBS润湿的滤纸放在另一个翻过来的盘子上。
- 为了牺牲小鼠,在深度麻醉下使用布托啡诺,咪达唑仑和美托咪定的混合麻醉剂进行颈椎脱位。然后,立即解剖组织,例如脑、肝脏或胸腺,并在培养皿中用冰冷的 PBS 清洗它们。
注意:任何类型的软组织都可以通过这种方法进行分析。然而,组织的大小受到所用均质器的推荐体积范围的限制。例如,如果使用 2 mL 体积的匀浆器,则建议使用 50-100 mg 的组织。 - 称量装有PBS的1.5mL微管用于解剖组织储存后,切出组织并将其储存在微管内,并重新称量每个微管。每个组织的湿重可以通过减去添加组织前后的管重量来计算。
- 立即用冷冻均质器在冰冷的MSB(+)中匀浆组织(参见 材料表)。MSB(+)的体积是组织湿重(mg)的19倍(μL)。以 20 次冲程进行均质化,直到组织碎片消失。
注:例如,1,900 μL MSB(+) 用于 100 mg 组织。由于必须根据所分析的组织块的每个湿重调整要添加的MSB(+)的体积,因此有必要准确称量每个组织块。
- 小鼠组织匀浆的离心
- 用巴斯德移液管将整个匀浆移至2mL微管中,并在2°C下以2,400× g 离心3分钟, 以通过 沉淀除去碎片。
- 将整个上清液(S1 级分)转移到新的 1.5 mL 微管中并涡旋。然后,将200μL的S1级分分装到离心微管中,并使用TLA-55转头在2°C下以100,000× g 离心20分钟,以获得相对较大的分子量蛋白质作为沉淀物(P2级分)。
注:经过超速离心步骤的样品体积会影响离心半径和分子的沉淀效率。在此步骤后,将样品体积保持在 200 μL 或更低,以防止分离不准确。 - 进一步使用TLA-120.2转子在2°C下以500,000× g 离心所有所得的上清液(S2级分)60分钟,以将沉淀物(P3级分)中的不溶性蛋白质复合物与上清液(S3级分)中的可溶性蛋白质分离。
- 向P2和P3馏分管中加入400μL的1x SDS样品缓冲液(0.08M Tris pH 6.8;10%甘油;1%2-巯基乙醇;2%SDS),并短暂超声处理以溶解沉淀物。将这些馏分样品转移到空的 1.5 mL 微管中。
- 将总 S3 级分溶解在 200 μL 的 2x SDS 样品缓冲液中。
- 将剩余的 S1 级分与等体积的 2x SDS 样品缓冲液混合,用作蛋白质印迹的标准曲线。
- 将所有这些样品在100°C下煮沸3分钟。样品冷却至室温后,将样品储存在-20°C。
- 每个组分中蛋白质的定量
- 通过蛋白质印迹法定量 P2、P3 和 S3 组分中的蛋白质。首先,使用 10% SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 将蛋白质从适当稀释的 P2、P3 和 S3 馏分中分离出来,并将连续稀释的 S1 样品作为标准曲线从任何个体中分离出来。然后,将样品电印迹到聚偏二氟乙烯膜上(参见 材料表)。
注:每个馏分的稀释率取决于客观蛋白的浓度和抗体的反应性。(例如,脑组织中的α-微管蛋白、TUBB3、β-tub 和酪氨酸化微管蛋白:S3 = 1/400,P3 = 1/2,000,P2 = 1/2,000,S1 = 1/50,000,1/20,000,1/10,000,1/5,000,1/2,000; 脑组织中乙酰化微管蛋白: S3 = 1/200, P3 = 1/400, P2 = 1/8,000, S1 = 1/100,000, 1/40,000, 1/20,000, 1/10,000, 1/4,000; 肝脏中的α-微管蛋白: S3 = 1/20, P3 = 1/100, P2 = 1/20, S1 = 1/50,000, 1/20,000, 1/10,000, 1/5,000, 1/2,000; 胸腺中的α-微管蛋白: S3 = 1/100,P3 = 1/400,P2 = 1/20,S1 = 1/50,000,1/20,000,1/10,000,1/5,000,1/2,000 稀释度)。 - 用5%脱脂牛奶在Tris缓冲盐水(50mM Tris-HCl pH 7.6;152mM NaCl)和0.1%吐温20(TBS-T)中封闭膜超过30分钟。
- 将膜浸入含有一抗的TBS-T中(参见 材料表)2小时以上。之后,用TBS-T洗涤膜3分钟(3次)。
- 在TBS-T中使用HRP偶联的二抗(参见 材料表)标记一抗超过1小时。之后,用TBS-T洗涤膜3分钟(3次)。
- 用增强型化学发光试剂显影膜。然后,使用发光图像分析仪分析感兴趣的条带(参见 材料表)。
- 使用图像分析软件(参见 材料表)量化蛋白质条带强度,并通过绘制稀释的S1样品的稀释单位来创建标准曲线,用于沿X轴的标准曲线和沿Y轴的条带强度。
- 读取与稀释馏分样品相对应的蛋白质浓度(单位)。将读数的浓度乘以样品稀释因子,以获得每个馏分中的蛋白质单位。将每个部分的测量单位除以总蛋白质单位(P2 + P3 + S3)以获得百分比。
- 通过蛋白质印迹法定量 P2、P3 和 S3 组分中的蛋白质。首先,使用 10% SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 将蛋白质从适当稀释的 P2、P3 和 S3 馏分中分离出来,并将连续稀释的 S1 样品作为标准曲线从任何个体中分离出来。然后,将样品电印迹到聚偏二氟乙烯膜上(参见 材料表)。
2. 评估微管蛋白在各馏分中的性质
注:该生化方法提供了由沉降特性定义的三组微管蛋白复合物。在这里,根据复合物和微管蛋白-PTM的大小来确定在这些馏分中获得的微管蛋白复合物的状态。在低温环境中不间断地完成本协议中的所有步骤,但在馏分样品溶解在SDS样品缓冲液中之前不要冷冻。
- 滤器捕集测定
- 使用300 kDa超滤离心柱过滤S2和S3级分(各500μL)(参见 材料表)。在2°C下进行14,000× g 离心,直到过滤整个上清液,将洗脱的蛋白质收集到接收管中,并且捕获的蛋白质保留在储液管的过滤器上。
- 将接收管中的整个滤液(约500μL)翻译成新的1.5mL微管,并将其溶解在500μL的2x SDS样品缓冲液中。
- 通过将样品移液并转移到新的1.5mL微管中,将储液管过滤器上的残留物溶解在1,000μL的1x SDS样品缓冲液中。
- 将样品在100°C下煮沸3分钟。样品冷却至室温后,将样品储存在-20°C。
- 通过用DM1A(抗α-微管蛋白抗体,参见 材料表)进行蛋白质印迹分析微管蛋白的量。
- 体积排阻色谱法
- 如步骤1.1.1所述,制备补充有1/10浓度的蛋白酶和磷酸酶抑制剂的载体缓冲液(0.1M MES,pH 6.8;10%甘油;1mM MgSO4;1mM EGTA;0.1mM DTT)。然后,过滤溶液并将其储存在寒冷的环境中。
- 在4°C的色谱室(见 材料表)中制备配备有制备液相色谱系统的凝胶过滤色谱柱。
- 在将样品注入色谱柱之前,流入 180 mL 载体缓冲液以洗涤色谱柱。流速为1mL / min,持续3小时。
- 将市售的纯化猪微管蛋白(参见 材料表)作为对照或来自小鼠脑的S3级分(每个500μL)注射到色谱柱上。
- 用载体缓冲液以 1.0 mL/min 的流速洗脱。收集 1.5 mL 馏分 120 分钟。通过在280nm处的吸光度监测洗脱的蛋白质。将最大压力保持在 0.3 MPa 以下。
- 涡旋收集的馏分后,在1.5mL微管中将其50μL与50μL的2x SDS样品缓冲液混合。将所有样品在100°C下煮沸3分钟。样品冷却至室温后,将样品储存在-20°C。
- 用DM1A,抗α-微管蛋白抗体和KMX-1,抗β-微管蛋白抗体通过蛋白质印迹分析微管蛋白的量(参见 材料表)。
结果
通过MT分馏法定量小鼠脑中P2,P3和S3组分中的微管蛋白
通过MT分馏方法将小鼠组织中的微管蛋白分离为P2,P3和S3级分,并通过蛋白质印迹进行定量(图1A)。在小鼠脑中以100,000 × g 超速离心20 min,残留在P2组分中的MTs沉淀物占总微管蛋白的34.86%±1.68%。将上清液(S2)进一步以500,000 × g 离心60分钟。获得沉淀物(P3级分)和上清液(S3级分),分别占小鼠脑中总微管蛋白的56.13%±2.12%或9.01%±0.68%(图1B)。
本研究中使用的大脑皮层包含神经元和非神经元细胞,例如神经胶质细胞。为了选择性地评估小鼠大脑神经元中 MT 的稳定性,我们通过用 Tuj1(抗 TUBB3 抗体)进行蛋白质印迹来量化 TUBB3,这是一种仅在中枢和周围神经系统神经元中表达的微管蛋白亚型。TUBB3在P2、P3和S3组分中的百分比分别为32.65%±2.20%、59.31%±2.61%或8.04%±0.74%。它们与α-微管蛋白没有显着差异(图1B)。这些结果表明,神经元和神经胶质细胞表现出相似的MT稳定性,或者神经元 在体内含有比神经胶质细胞高得多的微管蛋白。
每个馏分中回收的微管蛋白的特征
在这里,通过不同重力加速度的两步超速离心将小鼠组织匀浆分离成三部分;因此,每个组分中蛋白质或其复合物之间的沉降系数不同。虽然以 100,000 × g 超速离心沉淀的微管蛋白被认为是常规的 MT,但应澄清此处新获得的 P3 级分微管蛋白与 P2 和 S3 级分中的微管蛋白有何不同。
为了表征 S3 微管蛋白,对 S2 (P3 + S3) 或 S3 馏分进行超滤和尺寸排阻色谱。S3级分中的微管蛋白复合物可以完全通过300 kDa超滤离心柱,而S2级分中几乎所有的微管蛋白都被困在过滤器上(图2A)。此外,通过体积排阻色谱法测量S3级分中微管蛋白复合物的分子量。S3微管蛋白在对应于100 kDa的一个峰上洗脱,这与市售纯化的微管蛋白二聚体相似(图2B,C)。此外,通过MT分馏法在每个馏分中回收的α和β微管蛋白的比例相等(图2D)。实际上,已经表明α和β微管蛋白可以作为单体在活细胞中略微存在24。然而,从报告的估计 kD 值(nM 顺序)和 S3 级分中回收的微管蛋白浓度 (~11 μM) 来看,大多数 (> 98%) 微管蛋白被认为以 α/β-二聚体的形式存在。因此,S3 组分中的微管蛋白主要是一种可溶性α/β-微管蛋白二聚体。
微管蛋白聚合物根据其翻译后修饰 (PTM) 分为 P2 和 P3 两个部分。为了区分这些组分,使用特异性抗体进行蛋白质印迹。抗乙酰化α-微管蛋白抗体作为稳定MT的标志物,表明P2组分显著富集了97.40%±0.52%的乙酰化α-微管蛋白(图2E),而总α-微管蛋白在P3和S3组分中回收(图1B)。相反,抗酪氨酸化α-微管蛋白抗体(指示不稳定的 MT)显示 P3 组分中存在 75.43% ± 2.69% 的酪氨酸化α-微管蛋白(图 2F)。这些发现证实,P2 部分主要含有稳定 MT 中的微管蛋白,而 P3 部分由不稳定 MT 中的微管蛋白组成。
冷冻和诺考达唑处理下MT稳定性的评估
分析冷冻和诺考达唑处理对小鼠脑内MTs稳定性的影响,以确定MT分馏法是否能辨别出MTs稳定性的瞬时变化。MT通常在低温下拆卸,但有些MT在寒冷中保持稳定。称量大脑后,将其冷冻在液氮中,并在-80°C下放置30分钟。将瞬时冷冻脑和作为对照的原始脑均质化并分馏成 P2、P3 和 S3 组分。然后,通过Western blotting定量3组分中微管蛋白的比例。一旦大脑在匀浆前被冷冻,P2组分中的α-微管蛋白就会减少,而P3组分中的微管蛋白会与原始大脑中的微管蛋白相比增加(图3A)。用6-11B1(乙酰化α-微管蛋白)或1A2(酪氨酸化α-微管蛋白)进行印迹也显示,脑冷冻降低了P2组分中α-微管蛋白的乙酰化水平(图3B)并增加了酪氨酸化水平(图3C)。
诺考达唑是一种微管靶向剂 (MTA),通过与 β-微管蛋白结合来阻止 MT 聚合并促进 MT 解聚。将小鼠脑在含有或不含10μM诺考达唑的无紫杉醇MSB(+)中匀浆,并置于4°C下20分钟。将未经处理或诺考达唑处理的匀浆加入10μM紫杉醇中,重新匀浆,并分馏成P2、P3和S3馏分。然后,通过Western blotting定量3组分中微管蛋白的比例。DM1A(α-微管蛋白)印迹显示,随着诺考达唑处理,P2组分中的α-微管蛋白减少,P3组分中的微管蛋白趋于增加(图3D)。这些结果表明,P2微管蛋白在低温或诺考达唑的响应下不稳定,并且P2组分含有抵抗实验条件的强健MT。与冷冻相比,诺考达唑不影响微管蛋白PTM(图3E,F)。根据结果和上述数据,该方法可以评估PTM分析无法检测到的MTs的解聚。
组织中稳定 MT、不稳定 MT 和游离微管蛋白的比率比较
MTs的稳定性因不同组织而异,取决于这些组织内细胞的增殖能力。值得注意的是,与其他组织相比,稳定的 MT 在神经系统中更丰富,神经系统主要由非增殖性神经元组成4。为了评估所开发的 MT 分馏方法辨别不同组织 MT 稳定性差异的能力,对小鼠的肝脏和胸腺进行分馏,并定量每个分级中回收的微管蛋白。结果显示,与其他组织相比,大脑表现出更高水平的P2微管蛋白,而P3微管蛋白在含有增殖细胞的组织中明显富集(图4)。此外,使用 6-11B1 和 1A2 抗体的蛋白质印迹证实了神经系统中存在更高的 MT 稳定性。微管蛋白PTMs的不同分布模式清楚地表明,在神经系统中特异性发现的P2微管蛋白起源于稳定的MT(图4)。这些发现进一步支持了 P2 和 P3 分数分别对应于稳定和不稳定 MT 的概念。

图 1:使用 MT 分馏方法定量小鼠组织中的微管蛋白。 (A) 组织 MT 分馏方法的总结。组织中稳定的 MT(P2 部分)、不稳定的 MT(P3 部分)和游离微管蛋白(S3 部分)可以在制备过程中抑制 MT 聚合和解聚的条件下通过 2 步超速离心分离。(B) 通过常规的 100,000 × g 超速离心和 500,000 × g 超速离心沉淀小鼠皮层中的 MT。 然后,通过用 DM1A (α-微管蛋白) 和抗 Tuj1 (TUBB3) 进行蛋白质印迹定量分离成 P2、P3 和 S3 组分的微管蛋白。每个组分(P2、P3 或 S3)中蛋白质占总组分 (P2 + P3 + S3) 的比例按照协议部分所述计算(均值 ± SDs,n = 4)。该图由Hagita等人修改而来,23。请点击这里查看此图的较大版本.

图 2:MT 分馏方法能够分离小鼠大脑皮层中的稳定 MT、不稳定的 MT 和游离微管蛋白。 (A) 使用 300 kDa 超滤离心柱通过过滤阱测定法分析 S2 或 S3 馏分(输入)。通过过滤(接收者)和捕获(储液器)获得的微管蛋白通过DM1A(α-微管蛋白)进行蛋白质印迹定量。(B)纯化的猪微管蛋白采用MT分馏法,发现大部分收集在S3馏分中。(C) S3组分中微管蛋白的分子大小。使用凝胶过滤色谱柱通过体积排阻色谱分离S3级分。通过用 DM1A(α-微管蛋白)和 KMX-1(β-微管蛋白)进行蛋白质印迹定量每个组分中的蛋白质。理论分子量显示在面板的顶部。(D)各组分中α-微管蛋白和β-微管蛋白的比例相等。分离成 P2、P3 和 S3 组分的微管蛋白通过 KMX-1(β-微管蛋白)进行蛋白质印迹定量。量化每个馏分中α-微管蛋白和β-微管蛋白相对于总馏分总和的比例(平均值± SDs,n = 4)。采用学生t检验进行统计分析。(英,女)通过用 6-11B1(乙酰化α-微管蛋白:E)和 1A2(酪氨酸化α-微管蛋白:F)进行蛋白质印迹,验证了 P2、P3 和 S3 组分中 α-微管蛋白的修饰。 定量每个馏分中酪氨酸化或乙酰化α-微管蛋白相对于总馏分的比例(平均值 ± SD,n = 4)。(A-C)已修改自Hagita等人23。请点击这里查看此图的较大版本.
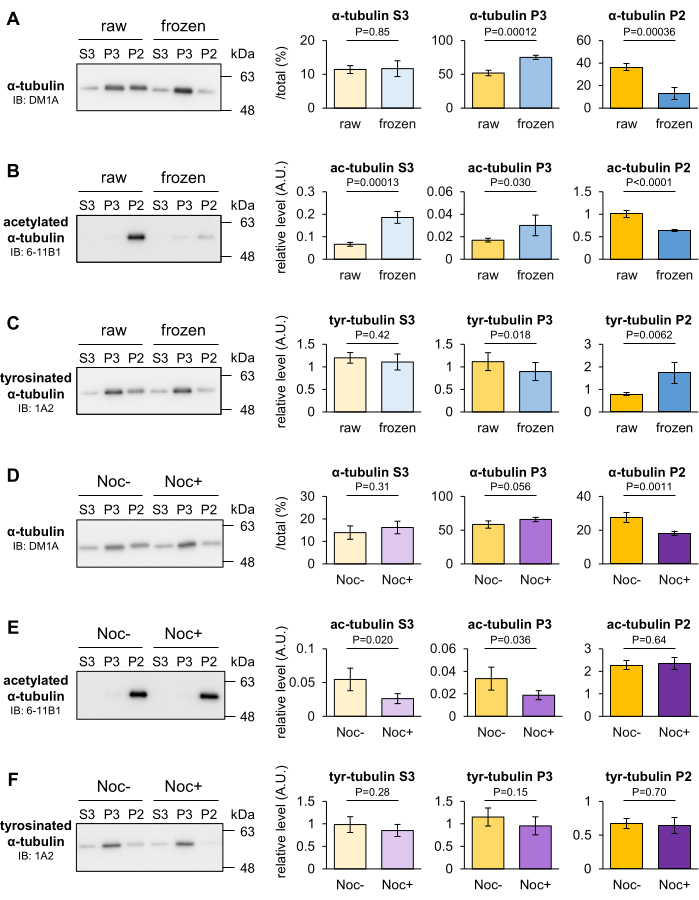
图 3:冷冻或 MTA 诱导的 MT 解聚评估。 (A-C) 评估 MT 在 -80 °C 下冷冻 30 分钟后的稳定性。通过用DM1A(α-微管蛋白:A)、1A2(酪氨酸化α-微管蛋白:B)和6-11B1(乙酰化α-微管蛋白:C)进行蛋白质印迹,定量原始和冷冻脑的三个部分所含微管蛋白的比例。 (D-F) 评价诺考达唑对MT稳定性的影响。通过用DM1A(α-微管蛋白:D)、1A2(酪氨酸化α-微管蛋白:E)和6-11B1(乙酰化α-微管蛋白:F)进行蛋白质印迹,定量未处理或处理的诺考达唑脑中三种组分中所含微管蛋白的比例。 酪氨酸化 (B,E) 或乙酰化 (C,F) 的代表性相对水平归一化为总 α-微管蛋白 (A,D) 的量) (表示 ± 个 SD,n = 4)。采用学生t检验进行统计分析。请点击这里查看此图的较大版本.
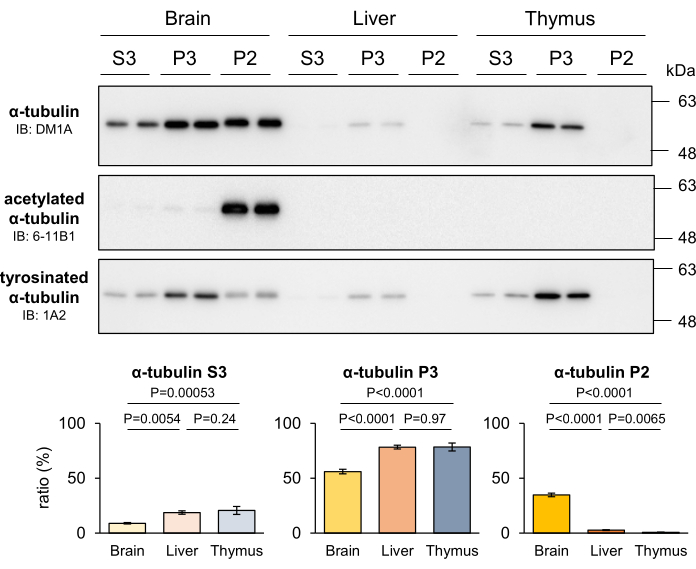
图 4:小鼠大脑、肝脏和胸腺中稳定 MT、不稳定 MT 和游离微管蛋白的比例。 对小鼠的大脑、肝脏和胸腺进行解剖,并采用MT分馏法。通过用 DM1A(α-微管蛋白)、6-11B1(乙酰化α-微管蛋白)和 1A2(酪氨酸化α-微管蛋白)进行蛋白质印迹定量分离到每个组分中的蛋白质。每个组分(P2、P3 或 S3)中蛋白质占总组分 (P2 + P3 + S3) 的比例按照协议部分所述计算(均值 ± SDs,n = 4)。统计分析采用单因素方差分析,然后进行Tukey事后检验。 请点击这里查看此图的较大版本.
讨论
在研究微管蛋白在活生物体组织中的状态时,最重要的任务是防止制备过程中意外的MT聚合或解聚。从组织去除到匀浆和离心过程中,MTS在样品中的稳定性受MSB中紫杉醇浓度、组织与缓冲液的比例、温度等因素的影响。因此,在用20倍体积的匀浆分析小鼠组织的方案的每个步骤中优化条件。较高浓度的紫杉醇可以在 体外诱导MT聚合,即使在冷却条件下也是如此25。当分析微管蛋白浓度明显不同的组织或进行实质性的方案修改时,每个操作人员都应根据其实验的特定目标优化步骤。
在进行的研究中,使用500,000 g20的超速离心从传统的"可溶性部分"中获得新的MT群体,称为P3×。基于转子的 K 因子、离心力和离心持续时间等因素的理论计算表明,S3 馏分中存在的微管蛋白最有可能代表 6S 微管蛋白二聚体。相反,P3 组分中的微管蛋白可能对应于 MT,与 P2 组分中的微管蛋白相比,其长度更短。这一观察结果与结果一致,即在匀浆前冷冻组织,导致MTs 26部分部分塌陷,导致P3部分内微管蛋白显着增加,同时P2部分减少(图3A)。此外,微管蛋白 PTM 的分析和各种 MAP 的结合特性表明,P2 或 P3 部分分别含有稳定或不稳定的 MT。例如,某些对稳定 MT 特有的 MAP,主要存在于神经元中,仅存在于 P2 分数23 中。因此,可以合理地认为,与 P2 分数相比,P3 分数包含的 MT 更具动态性和不稳定性。
根据该方法的理论基础,MT稳定或离心中涉及的不适当的实验条件会导致分馏不良。例如,低浓度的紫杉醇导致 P2 微管蛋白略有减少,而过量的紫杉醇会增加 P2 微管蛋白,这是由于制备过程中 MT 的形成23。同样,不恰当地加热组织和样品会导致 MT 过度聚合和 tau 降解或碎裂23。此外,离心条件对于分离 P3 和 S3 馏分至关重要,重力加速度的轻微降低会显着降低 P3 馏分的回收率。因此,如果观察到任何异常分馏,建议严格遵循方案步骤。
这种简单的分离方法可以广泛应用于分析组织中稳定 MT、不稳定 MT 和游离二聚体中微管蛋白的比例。这种方法有几个优点,因为它可以检测微管蛋白状态的细微变化,这些变化可能通过微管蛋白PTM的定量不明显。 分析MT的稳定性对于理解MT的生理意义非常重要,特别是在大型和复杂的神经元细胞中,以及研究与MT失调相关的疾病。例如,微管蛋白或MAP基因的突变或功能障碍与神经发育障碍和神经退行性疾病有关27,28。在阿尔茨海默病中,已知 MT 减少,可能是由于受影响神经元15、29、30、31、32、33 中 tau 蛋白的功能丧失。调节 MT 稳定性和抑制细胞分裂的 MTA 已被提议作为神经系统疾病的潜在疗法13,34。利用这种独特的MT分馏方法分析MTs和MAPs在疾病模型动物中的稳定性和行为,可以显着有助于阐明tau相关痴呆的发病机制和确定新的治疗靶点。
披露声明
作者没有利益冲突要报告。
致谢
这项工作在一定程度上得到了JST的支持,建立了大学奖学金,以创造科学技术创新(A.HT。JPMJFS2145)、JST SPRING(A.HT.;JPMJSP2129)、JSPS 研究员补助金 (A.HT.; 23KJ2078)、科学研究补助金 (B) JSPS KAKENHI (22H02946 for TM)、文部科学省 (TM; 26117004) 的名为"脑蛋白衰老和痴呆症控制"的创新领域科学研究补助金,以及上原纪念基金会 (TM; 202020027) 的上原研究奖学金。作者声明没有相互竞争的经济利益。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 ML TUBE CASE OF 500 | Beckman Coulter | 357448 | |
| 1A2 | Sigma-Aldrich | T9028 | 1:5,000 dilution |
| 2-(N-morpholino)ethanesulfonic acid (MES) | Nacalai Tesque | 02442-44 | |
| 300 kDa ultrafiltration spin column | Aproscience | PT-1013 | |
| 6-11B1 | Sigma-Aldrich | T7451 | 1:5,000 dilution |
| ÄKTAprime plus | Cytiva | 11001313 | |
| anti-mouse IgG | Jackson ImmunoResearch | 115-035-146 | 1:5,000 dilution |
| antipain | Peptide Institute Inc. | 4062 | |
| aprotinin | Nacalai Tesque | 03346-84 | |
| Chemi-Lumi One L | Nacalai Tesque | 07880-54 | |
| Corning bottle-top vacuum filter system | Corning | 430758 | 0.22µm 33.2cm² Nitrocellulose membrane |
| DIFP | Sigma-Aldrich | 55-91-4 | |
| DIGITAL HOMOGENIZER HK-1 | AS ONE | 1-2050-11 | |
| DM1A | Sigma-Aldrich | T9026 | 1:5,000 dilution |
| DTT | Nacalai Tesque | 14128-46 | |
| EGTA | Nacalai Tesque | 37346-05 | |
| FluoroTrans W 3.3 Meter Roll | Pall Corporation | BSP0161 | |
| glycerol | Nacalai Tesque | 17018-25 | |
| GTP | Nacalai Tesque | 17450-61 | |
| HIGH SPEED REFRIGERATIOED MICRO CENTRIFUGE Kitman | TOMY | KITMAN-24 | |
| HiLoad 16/600 Superdex 200 pg column | Cytiva | 28-9893-35 | |
| Image Gauge Software | FUJIFILUM Wako Pure Chemical Corporation | ||
| ImmunoStar LD | FUJIFILUM Wako Pure Chemical Corporation | 292-69903 | |
| KMX-1 | Millipore | MAB3408 | 1:5,000 dilution |
| LAS-4000 luminescent image analyzer | FUJIFILUM Wako Pure Chemical Corporation | ||
| leupeptin | Peptide Institute Inc. | 43449-62 | |
| MgSO4 | Nacalai Tesque | 21003-75 | |
| Na3VO4 | Nacalai Tesque | 32013-92 | |
| NaF | Nacalai Tesque | 31420-82 | |
| okadaic acid | LC Laboratories | O-2220 | |
| OPTIMA MAX-XP | Beckman Coulter | 393315 | |
| pepstatin | Nacalai Tesque | 26436-52 | |
| PMSF | Nacalai Tesque | 27327-81 | |
| Polycarbonate Centrifuge Tubes for TLA120.2 | Beckman Coulter | 343778 | |
| Protease inhibitor cocktail (cOmplete™, EDTA-free) | Roche | 11873580001 | |
| Purified tubulin | Cytoskeleton | T240 | |
| QSONICA Q55 | QSonica | Q55 | |
| Taxol | LC Laboratories | P-9600 | |
| TLA-120.2 rotor | Beckman Coulter | 357656 | |
| TLA-55 rotor | Beckman Coulter | 366725 | |
| TLCK | Nacalai Tesque | 34219-94 | |
| Triton X-100 | Nacalai Tesque | 12967-45 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
参考文献
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Conde, C., Caceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nature Reviews Neuroscience. 10 (5), 319-332 (2009).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Challacombe, J. F., Snow, D. M., Letourneau, P. C. Dynamic microtubule ends are required for growth cone turning to avoid an inhibitory guidance cue. Journal of Neuroscience. 17 (9), 3085-3095 (1997).
- Kapitein, L. C., Hoogenraad, C. C. Building the neuronal microtubule cytoskeleton. Neuron. 87 (3), 492-506 (2015).
- Leo, L., et al. Vertebrate fidgetin restrains axonal growth by severing labile domains of microtubules. Cell Reports. 12 (11), 1723-1730 (2015).
- Janke, C. The tubulin code: molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. International Journal of Molecular Sciences. 18 (10), 2207 (2017).
- Baas, P. W., Black, M. M. Individual microtubules in the axon consist of domains that differ in both composition and stability. Journal of Cell Biology. 111 (2), 495-509 (1990).
- Cartelli, D., et al. Microtubule alterations occur early in experimental parkinsonism and the microtubule stabilizer epothilone D is neuroprotective. Scientific Reports. 3, 1837 (2013).
- Zhang, B., et al. Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proceedings of the National Academy of Sciences of the United States of America. 102 (1), 227-231 (2005).
- Zhang, F., et al. Post-translational modifications of alpha-tubulin in Alzheimer disease. Translational Neurodegeneration. 4, 9 (2015).
- Miyasaka, T., et al. Curcumin improves tau-induced neuronal dysfunction of nematodes. Neurobiology of Aging. 39, 69-81 (2016).
- Fujiwara, H., et al. Inhibition of microtubule assembly competent tubulin synthesis leads to accumulation of phosphorylated tau in neuronal cell bodies. Biochemical and Biophysical Research Communications. 521 (3), 779-785 (2020).
- Vielkind, U., Swierenga, S. H. A simple fixation procedure for immunofluorescent detection of different cytoskeletal components within the same cell. Histochemistry. 91 (1), 81-88 (1989).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. Journal of Cell Biology. 109 (3), 1173-1184 (1989).
- Brown, A., Li, Y., Slaughter, T., Black, M. M. Composite microtubules of the axon: quantitative analysis of tyrosinated and acetylated tubulin along individual axonal microtubules. Journal of Cell Science. 104 (2), 339-352 (1993).
- Black, M. M., Slaughter, T., Moshiach, S., Obrocka, M., Fischer, I. Tau is enriched on dynamic microtubules in the distal region of growing axons. Journal of Neuroscience. 16 (11), 3601-3619 (1996).
- Caron, J. M., Jones, A. L., Kirschner, M. W. Autoregulation of tubulin synthesis in hepatocytes and fibroblasts. Journal of Cell Biology. 101 (5), 1763-1772 (1985).
- Merrick, S. E., Trojanowski, J. Q., Lee, V. M. Selective destruction of stable microtubules and axons by inhibitors of protein serine/threonine phosphatases in cultured human neurons. Journal of Neuroscience. 17 (15), 5726-5737 (1997).
- Miyasaka, T., Sato, S., Tatebayashi, Y., Takashima, A. Microtubule destruction induces tau liberation and its subsequent phosphorylation. FEBS Letters. 584 (14), 3227-3232 (2010).
- Hagita, A., et al. Quantitative fractionation of tissue microtubules with distinct biochemical properties reflecting their stability and lability. Biochemical and Biophysical Research Communications. 560, 186-191 (2021).
- Montecinos-Franjola, F., Chaturvedi, S. K., Schuck, P., Sackett, D. L. All tubulins are not alike: Heterodimer dissociation differs among different biological sources. Journal of Biological Chemistry. 294 (26), 10315-10324 (2019).
- Vallee, R. B. A taxol-dependent procedure for the isolation of microtubules and microtubule-associated proteins (MAPs). Journal of Cell Biology. 92 (2), 435-442 (1982).
- Bartolo, M. E., Carter, J. V. Effect of microtubule stabilization on the freezing tolerance of mesophyll cells of spinach. Plant Physiology. 97 (1), 182-187 (1991).
- Strang, K. H., Golde, T. E., Giasson, B. I. MAPT mutations, tauopathy, and mechanisms of neurodegeneration. Laboratory Investigation. 99 (7), 912-928 (2019).
- Fourel, G., Boscheron, C. Tubulin mutations in neurodevelopmental disorders as a tool to decipher microtubule function. FEBS Letters. 594 (21), 3409-3438 (2020).
- Terry, R. D., Gonatas, N. K., Weiss, M. Ultrastructural studies in Alzheimer's presenile dementia. The American Journal of Pathology. 44 (2), 269-297 (1964).
- Yoshida, H., Ihara, Y. Tau in paired helical filaments is functionally distinct from fetal tau: assembly incompetence of paired helical filament-tau. Journal of Neurochemistry. 61 (3), 1183-1186 (1993).
- Cash, A. D., et al. Microtubule reduction in Alzheimer's disease and aging is independent of tau filament formation. The American Journal of Pathology. 162 (5), 1623-1627 (2003).
- Hempen, B., Brion, J. P. Reduction of acetylated alpha-tubulin immunoreactivity in neurofibrillary tangle-bearing neurons in Alzheimer's disease. Journal of Neuropathology and Experimental Neurology. 55 (9), 964-972 (1996).
- Miyasaka, T., et al. Imbalanced expression of tau and tubulin induces neuronal dysfunction in C. elegans models of tauopathy. Frontiers in Neuroscience. 12, 415 (2018).
- Boiarska, Z., Passarella, D. Microtubule-targeting agents and neurodegeneration. Drug Discovery Today. 26 (2), 604-615 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。