Method Article
Tecnica di frazionamento quantitativo dei microtubuli per separare microtubuli stabili, microtubuli labili e tubulina libera nei tessuti di topo
In questo articolo
Riepilogo
I microtubuli, che sono polimeri di tubulina, svolgono un ruolo cruciale come componente del citoscheletro nelle cellule eucariotiche e sono noti per la loro instabilità dinamica. Questo studio ha sviluppato un metodo per frazionare i microtubuli per separarli in microtubuli stabili, microtubuli labili e tubulina libera per valutare la stabilità dei microtubuli in vari tessuti di topo.
Abstract
I microtubuli, composti da dimeri di α/β-tubulina, sono un componente cruciale del citoscheletro nelle cellule eucariotiche. Questi polimeri tubolari mostrano instabilità dinamica poiché le subunità eterodimeriche della tubulina subiscono polimerizzazione e depolimerizzazione ripetitive. Il controllo preciso della stabilità e della dinamica dei microtubuli, ottenuto attraverso le modificazioni post-traduzionali della tubulina e le proteine associate ai microtubuli, è essenziale per varie funzioni cellulari. Le disfunzioni nei microtubuli sono fortemente implicate nella patogenesi, comprese le malattie neurodegenerative. La ricerca in corso si concentra sugli agenti terapeutici mirati ai microtubuli che modulano la stabilità, offrendo potenziali opzioni di trattamento per queste malattie e tumori. Di conseguenza, la comprensione dello stato dinamico dei microtubuli è fondamentale per valutare la progressione della malattia e gli effetti terapeutici.
Tradizionalmente, la dinamica dei microtubuli è stata valutata in vitro o in coltura attraverso il frazionamento approssimativo o l'immunodosaggio, utilizzando anticorpi mirati alle modificazioni post-traduzionali della tubulina. Tuttavia, l'analisi accurata dello stato della tubulina nei tessuti utilizzando tali procedure pone delle sfide. In questo studio, abbiamo sviluppato un metodo di frazionamento dei microtubuli semplice e innovativo per separare i microtubuli stabili, i microtubuli labili e la tubulina libera nei tessuti di topo.
La procedura prevedeva l'omogeneizzazione di tessuti di topo sezionati in un tampone stabilizzante con microtubuli con un rapporto di volume di 19:1. Gli omogenati sono stati poi frazionati attraverso un processo di ultracentrifugazione in due fasi dopo una centrifugazione lenta iniziale (2.400 × g) per rimuovere i detriti. La prima fase di ultracentrifugazione (100.000 × g) ha precipitato microtubuli stabili, mentre il surnatante risultante è stato sottoposto a una seconda fase di ultracentrifugazione (500.000 × g) per frazionare i microtubuli labili e i dimeri solubili della tubulina. Questo metodo ha determinato le proporzioni di tubulina che costituiscono microtubuli stabili o labili nel cervello del topo. Inoltre, sono state osservate distinte variazioni tissutali nella stabilità dei microtubuli correlate con la capacità proliferativa delle cellule costituenti. Questi risultati evidenziano il potenziale significativo di questo nuovo metodo per l'analisi della stabilità dei microtubuli in condizioni fisiologiche e patologiche.
Introduzione
I microtubuli (MT) sono strutture tubolari allungate costituite da protofilamenti costituiti da subunità eterodimeriche di α/β-tubulina. Svolgono ruoli essenziali in vari processi cellulari come la divisione cellulare, la motilità, il mantenimento della forma e il trasporto intracellulare, rendendoli componenti integrali del citoscheletro eucariotico1. L'estremità negativa delle MT, in cui è esposta la subunità α-tubulina, è relativamente stabile, mentre l'estremità negativa, in cui è esposta la subunità β-tubulina, subisce depolimerizzazione dinamica e polimerizzazione2. Questo ciclo continuo di aggiunta e dissociazione del dimero di tubulina all'estremità positiva, indicato come instabilità dinamica, si traduce in un processo ripetitivo di salvataggio e catastrofe3. Le MT presentano domini focali con variazioni localizzate nell'instabilità dinamica, inclusi domini stabili e labili4.
Il controllo preciso dell'instabilità dinamica delle MT è fondamentale per numerose funzioni cellulari, in particolare nei neuroni caratterizzati da morfologie complesse. L'adattabilità e la durata delle MT svolgono un ruolo fondamentale nello sviluppo e nel corretto funzionamento delle cellule nervose 5,6,7. È stato riscontrato che l'instabilità dinamica delle MT è associata a varie modificazioni post-traduzionali (PTM) della tubulina, come l'acetilazione, la fosforilazione, la palmitoilazione, la detirosinazione, il delta 2, l'ossidazione della poliglutammina e la poliglicilazione. Inoltre, il legame delle proteine associate ai microtubuli (MAP) funge da meccanismo di regolazione8. I PTM, esclusa l'acetilazione, si trovano prevalentemente nella regione carbossi-terminale della tubulina situata sulla superficie esterna delle MT. Queste modificazioni creano diverse condizioni superficiali sulle MT, influenzando la loro interazione con le MAP e, in ultima analisi, governando la stabilità della MT9. La presenza di un residuo di tirosina carbossi-terminale nella α-tubulina è indicativa di MT dinamiche, che vengono rapidamente sostituite dal pool di tubulina libera. Al contrario, la detirosinazione dell'estremità carbossilica e l'acetilazione di Lys40 indicano MT stabili con ridotta instabilità dinamica 9,10.
I PTM della tubulina sono stati ampiamente impiegati in esperimenti per valutare la dinamica e la stabilità delle MT 5,7,11,12,13,14,15. Ad esempio, negli studi sulle colture cellulari, le tubuline possono essere segregate in due pool: il pool di tubulina libera e il pool MT. Ciò si ottiene liberando la tubulina libera attraverso la permeabilizzazione cellulare prima di fissare le MT rimanenti 15,16,17,18,19. I metodi biochimici prevedono l'uso di stabilizzatori chimici MT che salvaguardano le MT dalla catastrofe, consentendo la separazione delle MT e della tubulina libera attraverso la centrifugazione20,21,22. Tuttavia, queste procedure non distinguono tra MT stabili e meno stabili (labili), rendendo così impossibile quantificare le MT o la tubulina solubile in tessuti come il cervello. Di conseguenza, la valutazione della stabilità della MT negli organismi in condizioni fisiologiche e patologiche si è rivelata impegnativa. Per affrontare questa limitazione sperimentale, abbiamo sviluppato una nuova tecnica per separare con precisione le MT e la tubulina libera nel tessuto di topo23.
Questo metodo unico di frazionamento MT prevede l'omogeneizzazione dei tessuti in condizioni che mantengono lo stato di tubulina nei tessuti e la centrifugazione in due fasi per separare le MT stabili, le MT labili e la tubulina libera. Questa semplice procedura può essere applicata a studi ampi, tra cui la ricerca di base su MT e MAP negli organismi viventi, analisi fisiologiche e patologiche della salute e delle malattie associate alla stabilità della MT e lo sviluppo di farmaci e altre terapie mirate alle MT.
Protocollo
1. Metodo di frazionamento MT
NOTA: Tutti gli esperimenti eseguiti in questo studio sono stati approvati dal Comitato Etico Animale della Doshisha University. In questo caso sono stati utilizzati topi C57BL/6J di entrambi i sessi, di 3-4 mesi di età. In questo protocollo, i tessuti sezionati, ad esempio cervello, fegato o timo, sono stati immediatamente omogeneizzati in un tampone stabilizzante dei microtubuli ghiacciato (MSB), che conteneva Taxol (stabilizzatore MT) a una concentrazione che impediva non solo la depolimerizzazione ma anche la ripolimerizzazione della MT. L'omogenato è stato separato in tre frazioni mediante un processo di ultracentrifugazione in due fasi (Figura 1). Tutte le fasi di questo protocollo sono state completate senza interruzioni in un ambiente a temperatura fredda e i tessuti e le frazioni non sono stati congelati fino a quando non sono stati disciolti in tampone per campioni di sodio dodecilsolfato (SDS).
- Preparazione di MSB e microprovette
- Per preparare l'MSB, miscelare i seguenti reagenti: acido 0,1 M di 2-(N-morfolino)etanasolfonico (MES), pH 6,8 (neutralizzato da KOH), 10% glicerolo, 0,1 mM DTT, 1 mM MgSO 4, 1 mM EGTA, 0,5% Triton X-100, inibitori della fosfatasi (1 mM NaF, 1 mM β-glicerofosfato, 1 mM Na3VO 4, 0,5 μM acido okadaico), 1x cocktail di inibitori della proteasi, e inibitori della proteasi (0,1 mM PMSF, 0,1 mM DIFP, 1 μg/mL di pepstatina, 1 μg/mL antidolorifico, 10 μg/mL di aprotinina, 10 μg/mL di leupeptina, 50 μg/mL TLCK) (vedere Tabella dei materiali) e indicano come MSB(-).
- Appena prima della dissezione del tessuto, aggiungere 10 μM di Taxol e 2 mM di GTP (vedere la tabella dei materiali) all'MSB(-). Questo buffer è indicato come MSB(+). Preparare il tampone il giorno dell'uso e tenerlo in ghiaccio.
- Preparare le microprovette per il campionamento. Microprovetta vuota da 2,0 mL per la conservazione dell'omogeneato; microprovetta vuota da 1,5 mL per la conservazione del lisato surnatante1 (S1), del precipitato2 (P2) e del precipitato3 (P3); Microprovetta da 1,5 mL con 1 mL di soluzione salina tamponata con fosfato ghiacciato (PBS) per la conservazione dei tessuti sezionati; Microprovetta da 1,5 mL con 200 μL di tampone per campioni SDS 2x (0,16 M Tris pH 6,8; 20% glicerolo; 2% 2-mercaptoetanolo; 4% SDS) per la conservazione di campioni S1 e surnatante3 (S3); e microprovetta di centrifugazione per rotori da centrifuga TLA55 e TLA120.2 (vedi Tabella dei materiali). Etichettare tutte le provette e posizionarle sul ghiaccio.
- Omogeneizzazione dei tessuti di topo
- Preparare un tavolo refrigerato per la dissezione dei tessuti. Per prima cosa, riempi una scatola con ghiaccio tritato e posiziona due piastre di Petri sul ghiaccio, una con il lato interno rivolto verso l'alto e l'altra con il lato esterno. Riempi il PBS ghiacciato in un piatto per il lavaggio temporaneo e la conservazione dei tessuti sezionati. Stendere la carta da filtro inumidita con PBS su un altro piatto capovolto.
- Per sacrificare un topo, eseguire la lussazione cervicale in anestesia profonda con un anestetico misto di butorfanolo, midazolam e medetomidina. Quindi, sezionare immediatamente i tessuti, ad esempio cervello, fegato o timo, e lavarli con PBS ghiacciato in una capsula di Petri.
NOTA: Qualsiasi tipo di tessuto molle può essere analizzato con questo metodo. Tuttavia, la dimensione del tessuto è limitata dall'intervallo di volume raccomandato dell'omogeneizzatore utilizzato. Ad esempio, se si utilizza un volume di 2 mL di omogeneizzatore, si raccomandano 50-100 mg di tessuto. - Dopo aver pesato le microprovette da 1,5 mL riempite con PBS per la conservazione dei tessuti sezionati, ritagliare e conservare i tessuti all'interno delle microprovette e pesare nuovamente ciascuna microprovetta. Il peso umido di ogni tessuto può essere calcolato sottraendo il peso della provetta prima e dopo l'aggiunta del tessuto.
- Omogeneizzare immediatamente il tessuto in MSB ghiacciato (+) con un omogeneizzatore refrigerato (vedere la tabella dei materiali). Il volume di MSB(+) era 19 volte (μL) il peso umido del tessuto (mg). Eseguire l'omogeneizzazione con 20 colpi fino a quando i pezzi di tessuto scompaiono.
NOTA: Ad esempio, 1.900 μL di MSB(+) vengono utilizzati per 100 mg di tessuto. Poiché il volume di MSB(+) da aggiungere deve essere regolato per ogni peso umido dei pezzi di tessuto analizzati, è necessario pesare accuratamente ogni pezzo di tessuto.
- Centrifugazione degli omogeneizzati tissutali di topo
- Spostare l'intero omogenato in una microprovetta da 2 mL con una pipetta Pasteur e centrifugare a 2.400 × g per 3 minuti a 2 °C per rimuovere i detriti tramite precipitazione.
- Trasferire l'intero surnatante (frazione S1) in una nuova microprovetta da 1,5 mL e in un vortice. Quindi, aliquotare 200 μL di frazione S1 in una microprovetta di centrifugazione e centrifugare a 100.000 × g utilizzando un rotore TLA-55 per 20 minuti a 2 °C per ottenere le proteine di peso molecolare relativamente grande come precipitato (frazione P2).
NOTA: Il volume del campione sottoposto alle fasi di ultracentrifugazione influisce sul raggio di centrifugazione e sull'efficienza di precipitazione delle molecole. Mantenere il volume del campione a 200 μL o meno dopo questa fase per evitare un frazionamento impreciso. - Centrifugare ulteriormente tutto il surnatante risultante (frazione S2) a 500.000 × g utilizzando un rotore TLA-120.2 per 60 minuti a 2 °C per separare i complessi proteici insolubili nel precipitato (frazione P3) dalle proteine solubili nel surnatante (frazione S3).
- Aggiungere 400 μL di tampone per campioni SDS 1x (0,08 M Tris pH 6,8; 10% glicerolo; 1% 2-mercaptoetanolo; 2% SDS) alle provette delle frazioni P2 e P3 e brevemente sonicare per dissolvere il precipitato. Trasferire questi campioni di frazione in una microprovetta vuota da 1,5 mL.
- Sciogliere la frazione totale di S3 in 200 μL di tampone per campioni SDS 2x.
- Miscelare le restanti frazioni S1 con un volume uguale di 2 tamponi campione SDS da utilizzare come curva standard per il Western blotting.
- Far bollire tutti questi campioni a 100 °C per 3 min. Dopo che i campioni si sono raffreddati a temperatura ambiente, conservarli a -20 °C.
- Quantificazione delle proteine in ogni frazione
- Quantificare le proteine nelle frazioni P2, P3 e S3 mediante Western blotting. Innanzitutto, utilizzare l'elettroforesi su gel di poliacrilammide SDS al 10% (SDS-PAGE) per separare le proteine dalle frazioni P2, P3 e S3 adeguatamente diluite e dal campione S1 diluito in serie da qualsiasi individuo come curva standard. Quindi, elettroblot i campioni su membrane di fluoruro di polivinilidene (vedi Tabella dei materiali).
NOTA: Il rapporto di diluizione di ciascuna frazione dipende dalla concentrazione di una proteina obiettivo e dalla reattività dell'anticorpo. (ad esempio, α-tubulina, TUBB3, β-tub e tubulina tirosinata nel tessuto cerebrale: S3 = 1/400, P3 = 1/2.000, P2 = 1/2.000, S1 = 1/50, 000, 1/20.000, 1/10.000, 1/5.000, 1/2.000; tubulina acetilata nel tessuto cerebrale: S3 = 1/200, P3 = 1/400, P2 = 1/8.000, S1 = 1/100.000, 1/40.000, 1/20.000, 1/10.000, 1/4.000; α-tubulina nel fegato: S3 = 1/20, P3 = 1/100, P2 = 1/20, S1 = 1/50.000, 1/20.000, 1/10.000, 1/5.000, 1/2.000; α-tubulina nel timo: S3 = 1/100, P3 = 1/400, P2 = 1/20, S1 = 1/50.000, 1/20.000, 1/10.000, 1/5.000, 1/2.000 diluizione della concentrazione tissutale). - Bloccare la membrana con latte scremato al 5% in soluzione salina tamponata Tris (50 mM Tris-HCl pH 7,6; 152 mM NaCl) con Tween 20 allo 0,1% (TBS-T) per oltre 30 min.
- Immergere la membrana in TBS-T contenente l'anticorpo primario (vedere la tabella dei materiali) per oltre 2 ore. Successivamente, lavare la membrana con TBS-T per 3 minuti (3 volte).
- Etichettare l'anticorpo primario utilizzando anticorpi secondari coniugati con HRP (vedere Tabella dei materiali) in TBS-T per oltre 1 ora. Successivamente, lavare la membrana con TBS-T per 3 minuti (3 volte).
- Sviluppare le membrane con il reagente Chemiluminescenza potenziata. Quindi, analizzare le bande di interesse con un analizzatore di immagini luminescenti (vedi Tabella dei materiali).
- Quantificare le intensità della banda proteica utilizzando un software di analisi delle immagini (vedere la tabella dei materiali) e creare una curva standard tracciando le unità di diluizione dei campioni S1 diluiti utilizzati per la curva standard lungo l'asse X e le intensità della banda lungo l'asse Y.
- Leggere la concentrazione proteica (unità) corrispondente ai campioni di frazione diluita. Moltiplicare la concentrazione letta per il fattore di diluizione del campione per ottenere un'unità proteica in ciascuna frazione. Dividi l'unità misurata di ciascuna frazione per l'unità proteica totale (P2 + P3 + S3) per ottenere una percentuale.
- Quantificare le proteine nelle frazioni P2, P3 e S3 mediante Western blotting. Innanzitutto, utilizzare l'elettroforesi su gel di poliacrilammide SDS al 10% (SDS-PAGE) per separare le proteine dalle frazioni P2, P3 e S3 adeguatamente diluite e dal campione S1 diluito in serie da qualsiasi individuo come curva standard. Quindi, elettroblot i campioni su membrane di fluoruro di polivinilidene (vedi Tabella dei materiali).
2. Valutazione delle proprietà della tubulina in ogni frazione
NOTA: Questo metodo biochimico fornisce tre gruppi di complessi di tubulina definiti dalle proprietà di sedimentazione. Qui, lo stato dei complessi di tubulina ottenuti in queste frazioni è stato identificato in base alle dimensioni del complesso e dei PTM di tubulina. Completare tutti i passaggi di questo protocollo senza interruzioni in un ambiente a temperatura fredda, ma non congelare i campioni di frazione fino a quando non sono stati disciolti nel tampone del campione SDS.
- Saggio della trappola filtrante
- Filtrare le frazioni S2 e S3 (500 μL ciascuna) utilizzando una colonna di centrifuga di ultrafiltrazione da 300 kDa (vedere la tabella dei materiali). Eseguire una centrifugazione di 14.000 × g a 2 °C fino a quando l'intero surnatante viene filtrato, le proteine eluite vengono raccolte in provette ricevitrici e le proteine intrappolate rimangono sul filtro delle provette serbatoio.
- Tradurre i filtrati interi (circa 500 μL) nelle provette ricevitrici in nuove microprovette da 1,5 mL e scioglierle in 500 μL di tampone per campioni SDS 2x.
- Solubilizzare i residui sul filtro delle provette serbatoio in 1.000 μL di tampone per campioni SDS 1x pipettando e trasferendo i campioni in una nuova microprovetta da 1,5 mL.
- Far bollire i campioni a 100 °C per 3 min. Dopo che i campioni si sono raffreddati a temperatura ambiente, conservarli a -20 °C.
- Analizzare le quantità di tubulina mediante Western blotting con DM1A (anticorpo anti-α-tubulina, vedere Tabella dei materiali).
- Cromatografia ad esclusione dimensionale
- Preparare il tampone carrier (0,1 M MES, pH 6,8; 10% glicerolo; 1 mM MgSO4; 1 mM EGTA; 0,1 mM DTT) integrato con una concentrazione di 1/10 di inibitori della proteasi e della fosfatasi come descritto al punto 1.1.1. Quindi, filtrare la soluzione e conservarla in un ambiente freddo.
- Preparare una colonna per cromatografia a filtrazione su gel dotata di un sistema di cromatografia liquida preparativa in una camera cromatografica (vedere Tabella dei materiali) a 4 °C.
- Prima di iniettare i campioni sulla colonna, far fluire 180 mL del tampone di supporto per lavare la colonna. La portata è di 1 ml/min per 3 ore.
- Iniettare sulla colonna tubulina suina purificata disponibile in commercio (vedere Tabella dei materiali) come controllo o la frazione S3 del cervello di topo (500 μL ciascuno).
- Eluire a una portata di 1,0 mL/min con tampone carrier. Raccogliere le frazioni da 1,5 mL per 120 min. Monitorare le proteine eluite mediante assorbanza a 280 nm. Mantenere la pressione massima al di sotto di 0,3 MPa.
- Dopo aver vortex le frazioni raccolte, mescolarne 50 μL con 50 μL di tampone per campioni SDS 2x in una microprovetta da 1,5 mL. Far bollire tutti i campioni a 100 °C per 3 min. Dopo che i campioni si sono raffreddati a temperatura ambiente, conservarli a -20 °C.
- Analizzare le quantità di tubulina mediante Western blotting con DM1A, anticorpo anti-α-tubulina e KMX-1, anticorpo anti-β-tubulina (vedi Tabella dei materiali).
Risultati
Quantificazione della tubulina nelle frazioni P2, P3 e S3 del cervello di topo con il metodo del frazionamento MT
La tubulina nel tessuto di topo è stata separata nelle frazioni P2, P3 e S3 con il metodo del frazionamento MT e quantificata mediante Western blotting (Figura 1A). Il precipitato di MT che è rimasto nella frazione P2 mediante ultracentrifugazione a 100.000 × g per 20 minuti ha rappresentato il 34,86% ± l'1,68% della tubulina totale nel cervello di un topo. Il surnatante (S2) è stato ulteriormente centrifugato a 500.000 × g per 60 min. Sono stati ottenuti un precipitato (frazione P3) e un surnatante (frazione S3), che rappresentavano rispettivamente il 56,13% ± il 2,12% o il 9,01% ± lo 0,68% della tubulina totale nel cervello dei topi (Figura 1B).
La corteccia cerebrale utilizzata in questo studio contiene cellule neuronali e non neuronali, come la glia. Per valutare selettivamente la stabilità della MT nei neuroni del cervello di topo, abbiamo quantificato TUBB3, un sottotipo di tubulina espresso esclusivamente nei neuroni del sistema nervoso centrale e periferico, mediante Western blotting con Tuj1 (anticorpo anti-TUBB3). La percentuale di TUBB3 nella frazione P2, P3 o S3 era rispettivamente del 32,65% ± del 2,20%, del 59,31% ± del 2,61%, o dell'8,04% ± dello 0,74%. Non erano significativamente diversi da quelli della α-tubulina (Figura 1B). Questi risultati hanno suggerito che i neuroni e le cellule gliali mostrano una stabilità MT simile o che i neuroni contengono quantità molto più elevate di tubulina rispetto a quelle delle cellule gliali in vivo.
Caratteristiche della tubulina recuperata in ciascuna frazione
Qui, l'omogenato di tessuto di topo è stato separato in tre frazioni mediante ultracentrifugazione in due fasi con diverse accelerazioni gravitazionali; Pertanto, i coefficienti di sedimentazione tra le proteine o i loro complessi in ciascuna frazione differivano. Sebbene la tubulina precipitata a 100.000 × g di ultracentrifugazione sia stata considerata MT convenzionale, è necessario chiarire in che modo la tubulina appena ottenuta della frazione P3 differisca da quella della tubulina nelle frazioni P2 e S3.
Per caratterizzare la tubulina S3, la frazione S2 (P3 + S3) o S3 è stata sottoposta a ultrafiltrazione e cromatografia ad esclusione dimensionale. I complessi di tubulina nella frazione S3 potevano passare completamente attraverso una colonna di spin di ultrafiltrazione da 300 kDa, mentre quasi tutta la tubulina nella frazione S2 era intrappolata nel filtro (Figura 2A). Inoltre, il peso molecolare dei complessi di tubulina nella frazione S3 è stato misurato mediante cromatografia ad esclusione dimensionale. La tubulina S3 eluita ad un picco corrispondente a 100 kDa, che è simile a quella dei dimeri di tubulina purificata disponibili in commercio (Figura 2B,C). Inoltre, le proporzioni di α e β-tubulina recuperate in ciascuna frazione con il metodo di frazionamento MT erano uguali (Figura 2D). In realtà, è stato dimostrato che la α e la β-tubulina possono leggermente esistere come monomeri nelle cellule viventi24. Tuttavia, a giudicare dal valore stimato di kD (ordine nM) riportato e dalla concentrazione di tubulina recuperata nella frazione S3 (~11 μM), si ritiene che la maggior parte (> 98%) della tubulina esista come α/β-dimeri. Pertanto, la tubulina nella frazione S3 è principalmente un dimero solubile di α/β-tubulina.
I polimeri di tubulina sono stati separati in due frazioni, P2 e P3, in base alle loro modificazioni post-traduzionali (PTM). Per differenziare tra queste frazioni, il Western blotting è stato eseguito utilizzando anticorpi specifici. L'anticorpo anti-α-tubulina acetilata, che funge da marcatore per MT stabili, ha dimostrato che la frazione P2 è stata significativamente arricchita con il 97,40% ± lo 0,52% di α-tubulina acetilata (Figura 2E), mentre la α-tubulina totale è stata recuperata nelle frazioni P3 e S3 (Figura 1B). Al contrario, l'anticorpo anti-tirosina α-tubulina, indicativo di MT labili, ha rivelato che il 75,43% ± il 2,69% della α-tubulina tirosinata era presente nella frazione P3 (Figura 2F). Questi risultati confermano che la frazione P2 contiene principalmente tubulina all'interno di MT stabili, mentre la frazione P3 è costituita da tubulina all'interno di MT labili.
Valutazione della stabilità della MT in regime di congelamento e trattamento con nocodazolo
L'effetto del congelamento e del trattamento con nocodazolo sulla stabilità delle MT intracerebrali di topo è stato analizzato per determinare se i cambiamenti transitori nella stabilità delle MT potessero essere individuati con il metodo di frazionamento delle MT. Le MT generalmente si smontano a basse temperature, ma alcune MT rimangono stabili al freddo. Dopo aver pesato i cervelli, sono stati congelati in azoto liquido e posti a -80 °C per 30 minuti. Il cervello congelato transitorio e il cervello grezzo come controllo sono stati omogeneizzati e frazionati nelle frazioni P2, P3 e S3. Quindi, la proporzione di tubulina contenuta nelle tre frazioni è stata quantificata mediante Western blotting. Una volta che il cervello è stato congelato prima dell'omogeneizzazione, la α-tubulina nella frazione P2 è diminuita e quella nella frazione P3 è aumentata rispetto a quella nel cervello grezzo (Figura 3A). I blot con 6-11B1 (α-tubulina acetilata) o 1A2 (α-tubulina tirosinata) hanno anche rivelato che il congelamento cerebrale ha diminuito il livello di acetilazione (Figura 3B) e aumentato il livello di tirosinazione (Figura 3C) di α-tubulina nella frazione P2.
Il nocodazolo è un agente mirato ai microtubuli (MTA) che impedisce la polimerizzazione MT legandosi alla β-tubulina e promuove la depolimerizzazione MT. I cervelli di topo sono stati omogeneizzati in MSB senza taxolo (+) con o senza 10 μM di nocodazolo e posti a 4 °C per 20 minuti. L'omogenato non trattato o trattato con nocodazolo è stato aggiunto a 10 μM di Taxol, riomogeneizzato e frazionato nelle frazioni P2, P3 e S3. Quindi, la proporzione di tubulina contenuta nelle tre frazioni è stata quantificata mediante Western blotting. I blot con DM1A (α-tubulina) hanno mostrato che la α-tubulina nella frazione P2 diminuiva e che nella frazione P3 tendeva ad aumentare con il trattamento con nocodazolo (Figura 3D). Questi risultati indicano che la tubulina P2 è stata destabilizzata in risposta alla bassa temperatura o al nocodazolo e che la frazione P2 conteneva MT robuste che hanno resistito alle condizioni sperimentali. A differenza del congelamento, il nocodazolo non ha influenzato i PTM della tubulina (Figura 3E,F). Sulla base dei risultati e dei dati di cui sopra, la depolimerizzazione delle MT che non possono essere rilevate dall'analisi PTM può essere valutata con questo metodo.
Confronto del rapporto tra MT stabili, MT labili e tubulina libera nei tessuti
La stabilità delle MT varia tra i diversi tessuti, a seconda della capacità proliferativa delle cellule all'interno di quei tessuti. In particolare, le MT stabili sono più abbondanti nel sistema nervoso, che consiste principalmente di neuroni non proliferativi, rispetto ad altri tessuti4. Per valutare la capacità del metodo di frazionamento MT sviluppato di discernere le differenze nella stabilità MT tra i vari tessuti, i fegati e il timo dei topi sono stati frazionati ed è stata quantificata la tubulina recuperata in ciascuna frazione. I risultati hanno rivelato che, rispetto ad altri tessuti, il cervello mostrava un livello significativamente più elevato di tubuline P2, mentre le tubuline P3 erano notevolmente arricchite nei tessuti contenenti cellule proliferative (Figura 4). Inoltre, il Western blotting con anticorpi 6-11B1 e 1A2 ha confermato la presenza di una maggiore stabilità della MT nel sistema nervoso. I distinti modelli di distribuzione dei PTM della tubulina indicavano chiaramente che la tubulina P2 specificamente presente nel sistema nervoso proveniva da MT stabili (Figura 4). Questi risultati supportano ulteriormente l'idea che le frazioni P2 e P3 corrispondano rispettivamente a MT stabili e labili.

Figura 1: Quantificazione della tubulina nel tessuto di topo utilizzando il metodo di frazionamento MT. (A) Riassunto del metodo di frazionamento MT per i tessuti. Le MT stabili (frazione P2), le MT labili (frazione P3) e la tubulina libera (frazione S3) nei tessuti possono essere separate mediante ultracentrifugazione in 2 fasi in condizioni che sopprimono la polimerizzazione e la depolimerizzazione MT durante la preparazione. (B) Le MT nella corteccia del topo sono state precipitate mediante ultracentrifugazione convenzionale di 100.000 × g seguita da un'ultracentrifugazione di 500.000 × g . Quindi, le tubuline separate nelle frazioni P2, P3 e S3 sono state quantificate mediante Western blotting con DM1A (α-tubulina) e anti-Tuj1 (TUBB3). La proporzione di proteine in ciascuna frazione (P2, P3 o S3) rispetto alla frazione totale (P2 + P3 + S3) è stata calcolata come descritto nella sezione Protocollo (medie ± SD, n = 4). Questa cifra è stata modificata da Hagita et al.23. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Il metodo di frazionamento MT consente la separazione di MT stabili, MT labili e tubulina libera nella corteccia cerebrale del topo. (A) Le frazioni S2 o S3 (input) sono state analizzate mediante il saggio della trappola del filtro utilizzando una colonna di rotazione di ultrafiltrazione da 300 kDa. Le tubuline ottenute mediante filtrazione (ricevitore) e intrappolamento (serbatoio) sono state quantificate mediante Western blotting con DM1A (α-tubulina). (B) Le tubuline suine purificate sono state sottoposte al metodo di frazionamento MT e sono risultate essere raccolte principalmente nella frazione S3. (C) Dimensione molecolare della tubulina nella frazione S3. La frazione S3 è stata separata mediante cromatografia ad esclusione dimensionale utilizzando una colonna cromatografica a filtrazione su gel. Le proteine in ciascuna frazione sono state quantificate mediante Western blotting con DM1A (α-tubulina) e KMX-1 (β-tubulina). Il peso molecolare teorico è riportato nella parte superiore dei pannelli. (D) Le proporzioni di α-tubulina e β-tubulina in ciascuna frazione erano uguali. Le tubuline separate nelle frazioni P2, P3 e S3 sono state quantificate mediante Western blotting con KMX-1 (β-tubulina). Quantificazione della proporzione di α-tubulina e β-tubulina in ciascuna frazione rispetto alla somma della frazione totale (medie ± DS, n = 4). Le analisi statistiche sono state eseguite mediante il test t di Student. (E,F) Le modificazioni della α-tubulina nelle frazioni P2, P3 e S3 sono state verificate mediante Western blotting con 6-11B1 (α-tubulina acetilata: E) e 1A2 (α-tubulina tirosina: F). Quantificazione della proporzione di α-tubulina tirosinata o acetilata in ciascuna frazione rispetto alla frazione totale (medie ± DS, n = 4). (A-C) sono stati modificati da Hagita et al.23. Fare clic qui per visualizzare una versione più grande di questa figura.
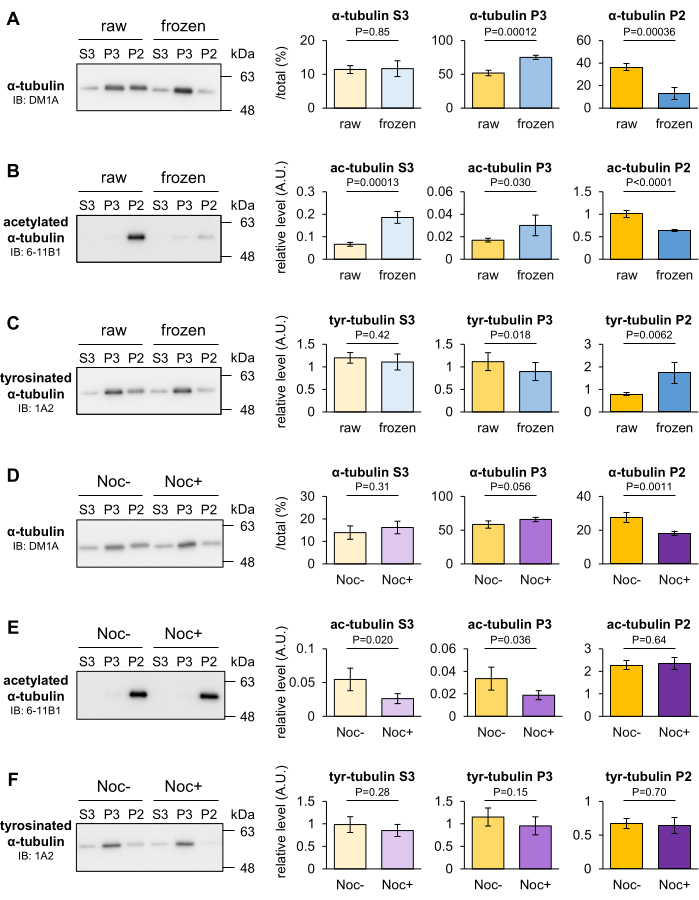
Figura 3: Valutazione della depolimerizzazione MT indotta dal congelamento o MTA. (A-C) È stata valutata la stabilità della MT dopo 30 minuti di congelamento a -80 °C. Le proporzioni di tubulina contenute nelle tre frazioni del cervello grezzo e congelato sono state quantificate mediante Western blotting con DM1A (α-tubulina: A), 1A2 (α-tubulina tirosinata: B) e 6-11B1 (α-tubulina acetilata: C). (D-F) È stato valutato l'effetto del nocodazolo sulla stabilità della MT. Le proporzioni di tubulina contenute nelle tre frazioni di cervelli non trattati o trattati con nocodazolo sono state quantificate mediante Western blotting con DM1A (α-tubulina: D), 1A2 (α-tubulina tirosinata: E) e 6-11B1 (α-tubulina acetilata: F). I livelli relativi rappresentativi di tirosinazione (B,E) o acetilazione (C,F) sono stati normalizzati alla quantità di α-tubulina totale (A,D ) (significa ± SD, n = 4). Le analisi statistiche sono state eseguite mediante il test t di Student. Fare clic qui per visualizzare una versione più grande di questa figura.
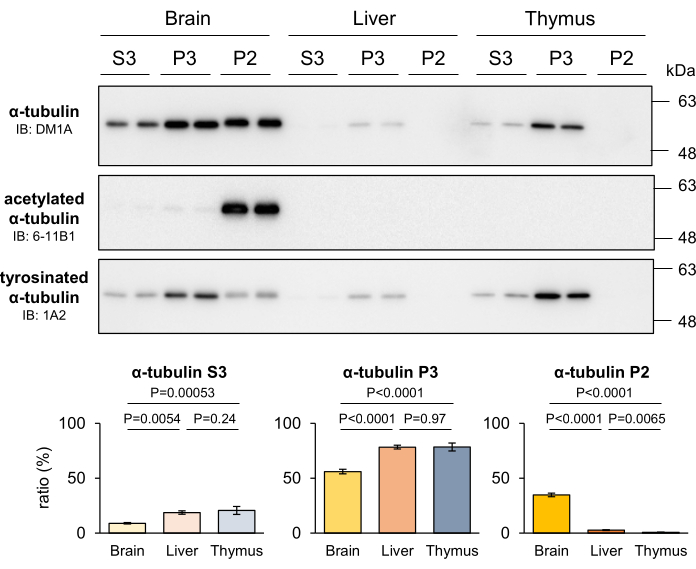
Figura 4: Proporzioni di MT stabili, MT labili e tubulina libera nel cervello, nel fegato e nel timo nel topo. Il cervello, il fegato e il timo dei topi sono stati sezionati e sottoposti al metodo del frazionamento MT. Le proteine separate in ciascuna frazione sono state quantificate mediante Western blotting con DM1A (α-tubulina), 6-11B1 (α-tubulina acetilata) e 1A2 (α-tubulina tirosinata). La proporzione di proteine in ciascuna frazione (P2, P3 o S3) rispetto alla frazione totale (P2 + P3 + S3) è stata calcolata come descritto nella sezione Protocollo (medie ± SD, n = 4). Le analisi statistiche sono state eseguite mediante ANOVA unidirezionale, seguita dal test post hoc di Tukey. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il compito più significativo quando si studia lo stato della tubulina nei tessuti di organismi viventi è prevenire la polimerizzazione o la depolimerizzazione accidentale della MT durante la preparazione. La stabilità delle MT nei campioni è influenzata da fattori quali la concentrazione di Taxol nell'MSB, la proporzione di quantità di tessuto rispetto al tampone e la temperatura durante il processo dalla rimozione del tessuto all'omogeneizzazione e centrifugazione. Pertanto, le condizioni sono state ottimizzate in ogni fase del protocollo per l'analisi del tessuto di topo con un volume di omogenato di 20 volte. Una maggiore concentrazione di Taxol può indurre la polimerizzazione MT in vitro, anche in condizioni di refrigerazione25. Quando si analizzano tessuti con concentrazioni di tubulina significativamente diverse o si apportano modifiche sostanziali al protocollo, ogni operatore dovrebbe ottimizzare i passaggi in base agli obiettivi specifici dei propri esperimenti.
Nello studio condotto, una nuova popolazione di MT, denominata P3, è stata ottenuta dalla "frazione solubile" convenzionale utilizzando l'ultracentrifugazione a 500.000 × g20. Calcoli teorici basati su fattori come il fattore K del rotore, la forza centrifuga e la durata della centrifugazione suggeriscono che le tubuline presenti nella frazione S3 rappresentano molto probabilmente dimeri di tubulina 6S. Al contrario, la tubulina nella frazione P3 può corrispondere a MT di lunghezza inferiore rispetto a quelle trovate nella frazione P2. Questa osservazione si allinea con il risultato che mostra che il congelamento dei tessuti prima dell'omogeneizzazione, che porta al collasso parziale delle MT26, ha provocato un aumento significativo della tubulina all'interno della frazione P3 e una concomitante diminuzione della frazione P2 (Figura 3A). Inoltre, l'analisi dei PTM della tubulina e le proprietà leganti di vari MAP indicano che la frazione P2 o P3 contiene rispettivamente MT stabili o labili. Ad esempio, alcune MAP specifiche per le MT stabili, che si trovano principalmente nei neuroni, erano presenti esclusivamente nella frazioneP2 23. Di conseguenza, è plausibile suggerire che la frazione P3 comprenda MT più dinamiche e labili rispetto a quelle della frazione P2.
Secondo la teoria alla base del metodo, condizioni sperimentali inappropriate coinvolte nella stabilizzazione o centrifugazione MT possono causare uno scarso frazionamento. Ad esempio, una bassa concentrazione di Taxol porta a una leggera diminuzione della tubulina P2, mentre un eccesso di Taxol aumenta la tubulina P2 a causa della formazione di MT durante la preparazione23. Allo stesso modo, il riscaldamento inappropriato di tessuti e campioni può causare l'iperpolimerizzazione delle MT e la degradazione o la frammentazione della tau23. Inoltre, le condizioni centrifughe sono critiche per separare le frazioni P3 e S3 e una leggera diminuzione dell'accelerazione gravitazionale riduce significativamente il recupero della frazione P3. Pertanto, si raccomanda di seguire rigorosamente i passaggi del protocollo se si osservano frazionamenti anomali.
Questo semplice metodo di frazionamento può essere ampiamente applicato per analizzare le proporzioni di tubuline tra MT stabili, MT labili e dimeri liberi nei tessuti. Questo metodo offre diversi vantaggi, in quanto è in grado di rilevare sottili cambiamenti nello stato della tubulina che potrebbero non essere evidenti attraverso la quantificazione dei PTM della tubulina. L'analisi della stabilità della MT è importante per comprendere il significato fisiologico delle MT, in particolare nelle cellule neuronali grandi e complesse, e per studiare i disturbi associati alla disregolazione della MT. Mutazioni o disfunzioni nei geni della tubulina o della MAP, ad esempio, sono legate a disturbi dello sviluppo neurologico e malattie neurodegenerative27,28. Nella malattia di Alzheimer, è noto che le MT sono ridotte, probabilmente a causa della perdita funzionale della proteina tau nei neuroni colpiti 15,29,30,31,32,33. Gli MTA che modulano la stabilità della MT e inibiscono la divisione cellulare sono stati proposti come potenziali terapie per i disturbi neurologici13,34. L'utilizzo di questo esclusivo metodo di frazionamento MT per analizzare la stabilità e il comportamento di MT e MAP in animali modello di malattia può contribuire in modo significativo a chiarire la patogenesi della demenza correlata alla tau e a identificare nuovi bersagli terapeutici.
Divulgazioni
Gli autori non hanno conflitti di interesse da segnalare.
Riconoscimenti
Questo lavoro è stato sostenuto in parte dal JST, dall'istituzione di borse di studio universitarie per la creazione di innovazione scientifica e tecnologica (A.HT.; JPMJFS2145), JST SPRING (A.HT.; JPMJSP2129), Grant-in-Aid for JSPS Fellows (A.HT.; 23KJ2078), Grant-in-Aid for Scientific Research (B) JSPS KAKENHI (22H02946 for TM), Grant-in-Aid for Scientific Research on Innovative Areas intitolato "Brain Protein Aging and Dementia Control" di MEXT (TM; 26117004) e Uehara Research Fellowship della Uehara Memorial Foundation (TM; 202020027). Gli autori dichiarano di non avere interessi finanziari concorrenti.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 ML TUBE CASE OF 500 | Beckman Coulter | 357448 | |
| 1A2 | Sigma-Aldrich | T9028 | 1:5,000 dilution |
| 2-(N-morpholino)ethanesulfonic acid (MES) | Nacalai Tesque | 02442-44 | |
| 300 kDa ultrafiltration spin column | Aproscience | PT-1013 | |
| 6-11B1 | Sigma-Aldrich | T7451 | 1:5,000 dilution |
| ÄKTAprime plus | Cytiva | 11001313 | |
| anti-mouse IgG | Jackson ImmunoResearch | 115-035-146 | 1:5,000 dilution |
| antipain | Peptide Institute Inc. | 4062 | |
| aprotinin | Nacalai Tesque | 03346-84 | |
| Chemi-Lumi One L | Nacalai Tesque | 07880-54 | |
| Corning bottle-top vacuum filter system | Corning | 430758 | 0.22µm 33.2cm² Nitrocellulose membrane |
| DIFP | Sigma-Aldrich | 55-91-4 | |
| DIGITAL HOMOGENIZER HK-1 | AS ONE | 1-2050-11 | |
| DM1A | Sigma-Aldrich | T9026 | 1:5,000 dilution |
| DTT | Nacalai Tesque | 14128-46 | |
| EGTA | Nacalai Tesque | 37346-05 | |
| FluoroTrans W 3.3 Meter Roll | Pall Corporation | BSP0161 | |
| glycerol | Nacalai Tesque | 17018-25 | |
| GTP | Nacalai Tesque | 17450-61 | |
| HIGH SPEED REFRIGERATIOED MICRO CENTRIFUGE Kitman | TOMY | KITMAN-24 | |
| HiLoad 16/600 Superdex 200 pg column | Cytiva | 28-9893-35 | |
| Image Gauge Software | FUJIFILUM Wako Pure Chemical Corporation | ||
| ImmunoStar LD | FUJIFILUM Wako Pure Chemical Corporation | 292-69903 | |
| KMX-1 | Millipore | MAB3408 | 1:5,000 dilution |
| LAS-4000 luminescent image analyzer | FUJIFILUM Wako Pure Chemical Corporation | ||
| leupeptin | Peptide Institute Inc. | 43449-62 | |
| MgSO4 | Nacalai Tesque | 21003-75 | |
| Na3VO4 | Nacalai Tesque | 32013-92 | |
| NaF | Nacalai Tesque | 31420-82 | |
| okadaic acid | LC Laboratories | O-2220 | |
| OPTIMA MAX-XP | Beckman Coulter | 393315 | |
| pepstatin | Nacalai Tesque | 26436-52 | |
| PMSF | Nacalai Tesque | 27327-81 | |
| Polycarbonate Centrifuge Tubes for TLA120.2 | Beckman Coulter | 343778 | |
| Protease inhibitor cocktail (cOmplete™, EDTA-free) | Roche | 11873580001 | |
| Purified tubulin | Cytoskeleton | T240 | |
| QSONICA Q55 | QSonica | Q55 | |
| Taxol | LC Laboratories | P-9600 | |
| TLA-120.2 rotor | Beckman Coulter | 357656 | |
| TLA-55 rotor | Beckman Coulter | 366725 | |
| TLCK | Nacalai Tesque | 34219-94 | |
| Triton X-100 | Nacalai Tesque | 12967-45 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
Riferimenti
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Conde, C., Caceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nature Reviews Neuroscience. 10 (5), 319-332 (2009).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Challacombe, J. F., Snow, D. M., Letourneau, P. C. Dynamic microtubule ends are required for growth cone turning to avoid an inhibitory guidance cue. Journal of Neuroscience. 17 (9), 3085-3095 (1997).
- Kapitein, L. C., Hoogenraad, C. C. Building the neuronal microtubule cytoskeleton. Neuron. 87 (3), 492-506 (2015).
- Leo, L., et al. Vertebrate fidgetin restrains axonal growth by severing labile domains of microtubules. Cell Reports. 12 (11), 1723-1730 (2015).
- Janke, C. The tubulin code: molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. International Journal of Molecular Sciences. 18 (10), 2207 (2017).
- Baas, P. W., Black, M. M. Individual microtubules in the axon consist of domains that differ in both composition and stability. Journal of Cell Biology. 111 (2), 495-509 (1990).
- Cartelli, D., et al. Microtubule alterations occur early in experimental parkinsonism and the microtubule stabilizer epothilone D is neuroprotective. Scientific Reports. 3, 1837 (2013).
- Zhang, B., et al. Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proceedings of the National Academy of Sciences of the United States of America. 102 (1), 227-231 (2005).
- Zhang, F., et al. Post-translational modifications of alpha-tubulin in Alzheimer disease. Translational Neurodegeneration. 4, 9 (2015).
- Miyasaka, T., et al. Curcumin improves tau-induced neuronal dysfunction of nematodes. Neurobiology of Aging. 39, 69-81 (2016).
- Fujiwara, H., et al. Inhibition of microtubule assembly competent tubulin synthesis leads to accumulation of phosphorylated tau in neuronal cell bodies. Biochemical and Biophysical Research Communications. 521 (3), 779-785 (2020).
- Vielkind, U., Swierenga, S. H. A simple fixation procedure for immunofluorescent detection of different cytoskeletal components within the same cell. Histochemistry. 91 (1), 81-88 (1989).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. Journal of Cell Biology. 109 (3), 1173-1184 (1989).
- Brown, A., Li, Y., Slaughter, T., Black, M. M. Composite microtubules of the axon: quantitative analysis of tyrosinated and acetylated tubulin along individual axonal microtubules. Journal of Cell Science. 104 (2), 339-352 (1993).
- Black, M. M., Slaughter, T., Moshiach, S., Obrocka, M., Fischer, I. Tau is enriched on dynamic microtubules in the distal region of growing axons. Journal of Neuroscience. 16 (11), 3601-3619 (1996).
- Caron, J. M., Jones, A. L., Kirschner, M. W. Autoregulation of tubulin synthesis in hepatocytes and fibroblasts. Journal of Cell Biology. 101 (5), 1763-1772 (1985).
- Merrick, S. E., Trojanowski, J. Q., Lee, V. M. Selective destruction of stable microtubules and axons by inhibitors of protein serine/threonine phosphatases in cultured human neurons. Journal of Neuroscience. 17 (15), 5726-5737 (1997).
- Miyasaka, T., Sato, S., Tatebayashi, Y., Takashima, A. Microtubule destruction induces tau liberation and its subsequent phosphorylation. FEBS Letters. 584 (14), 3227-3232 (2010).
- Hagita, A., et al. Quantitative fractionation of tissue microtubules with distinct biochemical properties reflecting their stability and lability. Biochemical and Biophysical Research Communications. 560, 186-191 (2021).
- Montecinos-Franjola, F., Chaturvedi, S. K., Schuck, P., Sackett, D. L. All tubulins are not alike: Heterodimer dissociation differs among different biological sources. Journal of Biological Chemistry. 294 (26), 10315-10324 (2019).
- Vallee, R. B. A taxol-dependent procedure for the isolation of microtubules and microtubule-associated proteins (MAPs). Journal of Cell Biology. 92 (2), 435-442 (1982).
- Bartolo, M. E., Carter, J. V. Effect of microtubule stabilization on the freezing tolerance of mesophyll cells of spinach. Plant Physiology. 97 (1), 182-187 (1991).
- Strang, K. H., Golde, T. E., Giasson, B. I. MAPT mutations, tauopathy, and mechanisms of neurodegeneration. Laboratory Investigation. 99 (7), 912-928 (2019).
- Fourel, G., Boscheron, C. Tubulin mutations in neurodevelopmental disorders as a tool to decipher microtubule function. FEBS Letters. 594 (21), 3409-3438 (2020).
- Terry, R. D., Gonatas, N. K., Weiss, M. Ultrastructural studies in Alzheimer's presenile dementia. The American Journal of Pathology. 44 (2), 269-297 (1964).
- Yoshida, H., Ihara, Y. Tau in paired helical filaments is functionally distinct from fetal tau: assembly incompetence of paired helical filament-tau. Journal of Neurochemistry. 61 (3), 1183-1186 (1993).
- Cash, A. D., et al. Microtubule reduction in Alzheimer's disease and aging is independent of tau filament formation. The American Journal of Pathology. 162 (5), 1623-1627 (2003).
- Hempen, B., Brion, J. P. Reduction of acetylated alpha-tubulin immunoreactivity in neurofibrillary tangle-bearing neurons in Alzheimer's disease. Journal of Neuropathology and Experimental Neurology. 55 (9), 964-972 (1996).
- Miyasaka, T., et al. Imbalanced expression of tau and tubulin induces neuronal dysfunction in C. elegans models of tauopathy. Frontiers in Neuroscience. 12, 415 (2018).
- Boiarska, Z., Passarella, D. Microtubule-targeting agents and neurodegeneration. Drug Discovery Today. 26 (2), 604-615 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon