Method Article
Quantitative Mikrotubuli-Fraktionierungstechnik zur Trennung von stabilen Mikrotubuli, labilen Mikrotubuli und freiem Tubulin in Mausgewebe
In diesem Artikel
Zusammenfassung
Mikrotubuli, bei denen es sich um Tubulin-Polymere handelt, spielen eine entscheidende Rolle als Bestandteil des Zytoskeletts in eukaryotischen Zellen und sind für ihre dynamische Instabilität bekannt. In dieser Studie wurde eine Methode zur Fraktionierung von Mikrotubuli entwickelt, um sie in stabile Mikrotubuli, labile Mikrotubuli und freies Tubulin zu trennen, um die Stabilität von Mikrotubuli in verschiedenen Mausgeweben zu bewerten.
Zusammenfassung
Mikrotubuli, die aus α/β-Tubulin-Dimeren bestehen, sind ein entscheidender Bestandteil des Zytoskeletts in eukaryotischen Zellen. Diese röhrenförmigen Polymere weisen eine dynamische Instabilität auf, da Tubulin-Heterodimer-Untereinheiten einer repetitiven Polymerisation und Depolymerisation unterzogen werden. Die präzise Kontrolle der Stabilität und Dynamik der Mikrotubuli, die durch posttranslationale Tubulinmodifikationen und Mikrotubuli-assoziierte Proteine erreicht wird, ist für verschiedene zelluläre Funktionen unerlässlich. Funktionsstörungen in Mikrotubuli sind stark an der Pathogenese beteiligt, einschließlich neurodegenerativer Erkrankungen. Die laufende Forschung konzentriert sich auf auf Mikrotubuli-gerichtete Therapeutika, die die Stabilität modulieren und potenzielle Behandlungsoptionen für diese Krankheiten und Krebsarten bieten. Daher ist das Verständnis des dynamischen Zustands von Mikrotubuli entscheidend für die Beurteilung des Krankheitsverlaufs und der therapeutischen Effekte.
Traditionell wurde die Dynamik von Mikrotubuli in vitro oder in kultivierten Zellen durch grobe Fraktionierung oder Immunoassay untersucht, wobei Antikörper verwendet wurden, die auf posttranslationale Modifikationen von Tubulin abzielen. Die genaue Analyse des Tubulinstatus in Geweben mit solchen Verfahren stellt jedoch eine Herausforderung dar. In dieser Studie haben wir eine einfache und innovative Methode zur Fraktionierung von Mikrotubuli entwickelt, um stabile Mikrotubuli, labile Mikrotubuli und freies Tubulin in Mausgeweben zu trennen.
Das Verfahren beinhaltete die Homogenisierung von präpariertem Mausgewebe in einem Mikrotubuli-stabilisierenden Puffer in einem Volumenverhältnis von 19:1. Die Homogenate wurden dann durch einen zweistufigen Ultrazentrifugationsprozess nach anfänglicher langsamer Zentrifugation (2.400 × g) fraktioniert, um Ablagerungen zu entfernen. Der erste Ultrazentrifugationsschritt (100.000 × g) fiel stabile Mikrotubuli aus, während der resultierende Überstand einem zweiten Ultrazentrifugationsschritt (500.000 × g) unterzogen wurde, um labile Mikrotubuli und lösliche Tubulindimere zu fraktionieren. Mit dieser Methode wurden die Anteile von Tubulin, die stabile oder labile Mikrotubuli im Mäusegehirn bilden, bestimmt. Darüber hinaus wurden deutliche Gewebevariationen in der Mikrotubuli-Stabilität beobachtet, die mit der proliferativen Kapazität der konstituierenden Zellen korrelierten. Diese Ergebnisse unterstreichen das signifikante Potenzial dieser neuartigen Methode zur Analyse der Mikrotubuli-Stabilität unter physiologischen und pathologischen Bedingungen.
Einleitung
Mikrotubuli (MTs) sind längliche röhrenförmige Strukturen, die aus Protofilamenten bestehen, die aus α/β-Tubulin-Heterodimer-Untereinheiten bestehen. Sie spielen eine wesentliche Rolle bei verschiedenen zellulären Prozessen wie Zellteilung, Motilität, Formerhaltung und intrazellulärem Transport und sind damit integrale Bestandteile des eukaryotischen Zytoskeletts1. Das Minus-Ende von MTs, bei dem die α-Tubulin-Untereinheit exponiert ist, ist relativ stabil, während das Plus-Ende, bei dem die β-Tubulin-Untereinheit exponiert ist, eine dynamische Depolymerisation und Polymerisation erfährt2. Dieser kontinuierliche Zyklus der Tubulin-Dimer-Addition und -Dissoziation am Plus-Ende, der als dynamische Instabilität bezeichnet wird, führt zu einem sich wiederholenden Prozess der Rettung und Katastrophe3. MTs weisen fokale Domänen mit lokalisierten Variationen der dynamischen Instabilität auf, einschließlich stabiler und labiler Domänen4.
Die präzise Kontrolle der dynamischen Instabilität von MTs ist entscheidend für zahlreiche zelluläre Funktionen, insbesondere in Neuronen, die durch komplizierte Morphologien gekennzeichnet sind. Die Anpassungsfähigkeit und Haltbarkeit von MTs spielen eine entscheidende Rolle für die Entwicklung und das reibungslose Funktionieren von Nervenzellen 5,6,7. Es wurde festgestellt, dass die dynamische Instabilität von MTs mit verschiedenen posttranslationalen Modifikationen (PTMs) von Tubulin verbunden ist, wie z. B. Acetylierung, Phosphorylierung, Palmitoylierung, Detyrosinierung, Delta 2, Polyglutaminoxidation und Polyglycylierung. Darüber hinaus dient die Bindung von Mikrotubuli-assoziierten Proteinen (MAPs) als Regulationsmechanismus8. PTMs, mit Ausnahme der Acetylierung, treten überwiegend in der Tubulin-Carboxy-terminalen Region auf, die sich auf der äußeren Oberfläche von MTs befindet. Diese Modifikationen erzeugen unterschiedliche Oberflächenbedingungen auf MTs, beeinflussen deren Wechselwirkung mit MAPs und steuern letztendlich die MT-Stabilität9. Das Vorhandensein eines carboxyterminalen Tyrosinrests in α-Tubulin ist ein Hinweis auf dynamische MTs, die schnell durch den freien Tubulinpool ersetzt werden. Umgekehrt bedeuten die Detyrosinierung des Carboxy-Terminus und die Acetylierung von Lys40 stabile MTs mit reduzierter dynamischer Instabilität 9,10.
Die PTMs von Tubulin wurden in großem Umfang in Experimenten eingesetzt, um die Dynamik und Stabilität von MTs 5,7,11,12,13,14,15 zu bewerten. Zum Beispiel können Tubuline in Zellkulturstudien in zwei Pools unterteilt werden: den freien Tubulin-Pool und den MT-Pool. Dies wird erreicht, indem freies Tubulin durch Zellpermeabilisierung freigesetzt wird, bevor die verbleibenden MTs 15,16,17,18,19 fixiert werden. Biochemische Methoden beinhalten die Verwendung chemischer MT-Stabilisatoren, die MTs vor Katastrophen schützen und die Trennung von MTs und freiem Tubulin durch Zentrifugation ermöglichen20,21,22. Diese Verfahren unterscheiden jedoch nicht zwischen stabilen und weniger stabilen (labilen) MTs, wodurch es unmöglich ist, MTs oder lösliches Tubulin in Geweben wie dem Gehirn zu quantifizieren. Folglich hat sich die Bewertung der MT-Stabilität in Organismen unter physiologischen und pathologischen Bedingungen als schwierig erwiesen. Um diese experimentelle Einschränkung zu adressieren, haben wir eine neuartige Technik zur präzisen Trennung von MTs und freiem Tubulin in Mausgewebe entwickelt23.
Diese einzigartige MT-Fraktionierungsmethode beinhaltet die Homogenisierung von Gewebe unter Bedingungen, die den Tubulinstatus im Gewebe aufrechterhalten, und die zweistufige Zentrifugation zur Trennung stabiler MTs, labiler MTs und freiem Tubulin. Dieses einfache Verfahren kann auf breit angelegte Studien angewendet werden, einschließlich Grundlagenforschung zu MTs und MAPs in lebenden Organismen, physiologische und pathologische Analysen von Gesundheit und Krankheiten, die mit der MT-Stabilität verbunden sind, sowie die Entwicklung von Medikamenten und anderen Therapeutika, die auf MTs abzielen.
Protokoll
1. Methode der MT-Fraktionierung
HINWEIS: Alle Experimente, die in dieser Studie durchgeführt wurden, wurden von der Tierethikkommission der Doshisha-Universität genehmigt. Hier wurden C57BL/6J-Mäuse beiderlei Geschlechts im Alter von 3-4 Monaten verwendet. In diesem Protokoll wurden präparierte Gewebe, z. B. Gehirn, Leber oder Thymusdrüse, sofort in eiskaltem Mikrotubuli-Stabilisierungspuffer (MSB) homogenisiert, der Taxol (MT-Stabilisator) in einer Konzentration enthielt, die nicht nur die Depolymerisation, sondern auch die Repolymerisation von MT verhinderte. Das Homogenat wurde durch einen zweistufigen Ultrazentrifugationsprozess in drei Fraktionen getrennt (Abbildung 1). Alle Schritte in diesem Protokoll wurden ohne Unterbrechung in einer Umgebung mit kühlen Temperaturen durchgeführt, und die Gewebe und Fraktionen wurden erst eingefroren, wenn sie in Natriumdodecylsulfat (SDS)-Probenpuffer gelöst waren.
- Präparation von MSB und Mikroröhrchen
- Zur Herstellung von MSB werden die folgenden Reagenzien gemischt: 0,1 M 2-(N-Morpholino)ethansulfonsäure (MES), pH 6,8 (neutralisiert durch KOH), 10 % Glycerin, 0,1 mM DTT, 1 mM MgSO4, 1 mM EGTA, 0,5 % Triton X-100, Phosphatase-Inhibitoren (1 mM NaF, 1 mM β-Glycerophosphat, 1 mMNa3VO4, 0,5 μM Okadainsäure), 1x Protease-Inhibitor-Cocktail, und Proteasehemmer (0,1 mM PMSF, 0,1 mM DIFP, 1 μg/ml Pepstatin, 1 μg/ml Schmerzmittel, 10 μg/ml Aprotinin, 10 μg/ml Leupeptin, 50 μg/ml TLCK) (siehe Materialtabelle) und als MSB(-) bezeichnet.
- Kurz vor der Gewebedissektion werden 10 μM Taxol und 2 mM GTP (siehe Materialtabelle) zu MSB(-) gegeben. Dieser Puffer wird als MSB(+) bezeichnet. Bereiten Sie den Puffer am Tag der Verwendung vor und bewahren Sie ihn auf Eis auf.
- Bereiten Sie die Mikroröhrchen für die Probenahme vor. Leeres 2,0-ml-Mikroröhrchen für die Lagerung von Homogenaten; leeres 1,5-ml-Mikroröhrchen für Lysat mit Überstand1 (S1), Probe für Niederschlag2 (P2) und Probenlagerung für Niederschlag3 (P3); 1,5-ml-Mikroröhrchen mit 1 ml eiskalter phosphatgepufferter Kochsalzlösung (PBS) zur Lagerung von präpariertem Gewebe; 1,5 ml Mikroröhrchen mit 200 μl 2x SDS-Probenpuffer (0,16 M Tris pH 6,8; 20 % Glycerin; 2 % 2-Mercaptoethanol; 4 % SDS) für die Lagerung von S1-Proben und Überständen3 (S3); und Zentrifugationsmikroröhrchen für Zentrifugenrotoren TLA55 und TLA120.2 (siehe Materialtabelle). Beschriften Sie alle Röhrchen und legen Sie sie auf Eis.
- Homogenisierung von Mausgewebe
- Bereiten Sie einen gekühlten Tisch für die Gewebedissektion vor. Füllen Sie zunächst eine Schachtel mit Crushed Ice und stellen Sie zwei Petrischalen auf Eis, eine mit der Innenseite nach oben und die andere mit der Außenseite. Füllen Sie eiskaltes PBS in eine Schale zum vorübergehenden Waschen und Aufbewahren von präpariertem Gewebe. Mit PBS angefeuchtetes Filterpapier auf eine andere umgedrehte Schale legen.
- Um eine Maus zu opfern, führen Sie eine Zervixluxation unter tiefer Betäubung mit einem gemischten Anästhetikum aus Butorphanol, Midazolam und Medetomidin durch. Sezieren Sie dann sofort das Gewebe, z. B. Gehirn, Leber oder Thymusdrüse, und waschen Sie es mit eiskaltem PBS in einer Petrischale.
HINWEIS: Jede Art von Weichgewebe kann mit dieser Methode analysiert werden. Die Größe des Gewebes ist jedoch durch den empfohlenen Volumenbereich des verwendeten Homogenisators begrenzt. Wenn beispielsweise ein Homogenisator mit einem Volumen von 2 ml verwendet wird, werden 50-100 mg Gewebe empfohlen. - Nach dem Wiegen der mit PBS gefüllten 1,5-ml-Mikroröhrchen für die Lagerung von präpariertem Gewebe schneiden Sie Gewebe aus und lagern Sie es in den Mikroröhrchen und wiegen Sie jedes Mikroröhrchen erneut. Das Nassgewicht jedes Gewebes kann berechnet werden, indem das Gewicht des Röhrchens vor und nach der Zugabe des Gewebes subtrahiert wird.
- Homogenisieren Sie das Gewebe sofort in eiskaltem MSB(+) mit einem gekühlten Homogenisator (siehe Materialtabelle). Das Volumen von MSB(+) betrug das 19-fache (μl) des Nassgewichts des Gewebes (mg). Homogenisieren Sie mit 20 Hüben, bis die Gewebestücke verschwunden sind.
HINWEIS: Für 100 mg Gewebe werden beispielsweise 1.900 μl MSB(+) verwendet. Da das Volumen des zuzugebenden MSB(+) für jedes Nassgewicht der analysierten Gewebestücke angepasst werden muss, ist es notwendig, jedes Gewebestück genau zu wiegen.
- Zentrifugation der Mausgewebe-Homogenate
- Das gesamte Homogenat mit einer Pasteurpipette in ein 2-ml-Mikroröhrchen geben und bei 2.400 × g 3 min bei 2 °C zentrifugieren, um die Ablagerungen durch Fällung zu entfernen.
- Den gesamten Überstand (S1-Fraktion) in ein neues 1,5-ml-Mikroröhrchen und einen Wirbel überführen. Dann werden 200 μl S1-Fraktion in ein Zentrifugationsmikroröhrchen aliquotiert und bei 100.000 × g mit einem TLA-55-Rotor 20 min bei 2 °C zentrifugiert, um die relativ großen Molekularproteine als Präzipitat (P2-Fraktion) zu erhalten.
HINWEIS: Das Volumen der Probe, die den Ultrazentrifugationsschritten unterzogen wird, beeinflusst den Zentrifugationsradius und die Fällungseffizienz der Moleküle. Halten Sie das Probenvolumen nach diesem Schritt bei 200 μl oder weniger, um eine ungenaue Fraktionierung zu vermeiden. - Weiter zentrifugiert der gesamte resultierende Überstand (S2-Fraktion) bei 500.000 × g unter Verwendung eines TLA-120.2-Rotors für 60 min bei 2 °C, um die unlöslichen Proteinkomplexe im Niederschlag (P3-Fraktion) von den löslichen Proteinen im Überstand (S3-Fraktion) zu trennen.
- 400 μl 1x SDS-Probenpuffer (0,08 M Tris pH 6,8; 10 % Glycerin; 1 % 2-Mercaptoethanol; 2 % SDS) in die P2- und P3-Fraktionsröhrchen geben und kurz beschallen, um den Niederschlag aufzulösen. Überführen Sie diese Fraktionsproben in ein leeres 1,5-ml-Mikroröhrchen.
- Die gesamte S3-Fraktion wird in 200 μl 2x SDS-Probenpuffer gelöst.
- Mischen Sie die verbleibenden S1-Fraktionen mit einem gleichen Volumen von 2x SDS-Probenpuffer, um sie als Standardkurve für das Western Blot zu verwenden.
- Alle diese Proben werden bei 100 °C für 3 min gekocht. Nachdem die Proben auf Raumtemperatur abgekühlt sind, lagern Sie die Proben bei -20 °C.
- Quantifizierung von Proteinen in jeder Fraktion
- Quantifizierung von Proteinen in den P2-, P3- und S3-Fraktionen durch Western Blotting. Verwenden Sie zunächst die 10%ige SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE), um Proteine aus ordnungsgemäß verdünnten P2-, P3- und S3-Fraktionen und seriell verdünnter S1-Probe von jedem Individuum als Standardkurve zu trennen. Anschließend werden die Proben auf Polyvinylidenfluorid-Membranen elektrotupft (siehe Materialtabelle).
HINWEIS: Das Verdünnungsverhältnis jeder Fraktion hängt von der Konzentration eines Zielproteins und der Reaktivität des Antikörpers ab. (z. B. α-Tubulin, TUBB3, β-Wanne und tyrosiniertes Tubulin im Hirngewebe: S3 = 1/400, P3 = 1/2.000, P2 = 1/2.000, S1 = 1/50,000, 1/20.000, 1/10.000, 1/5.000, 1/2.000; acetyliertes Tubulin im Hirngewebe: S3 = 1/200, P3 = 1/400, P2 = 1/8.000, S1 = 1/100.000, 1/40.000, 1/20.000, 1/10.000, 1/4.000; α-Tubulin in der Leber: S3 = 1/20, P3 = 1/100, P2 = 1/20, S1 = 1/50.000, 1/20.000, 1/10.000, 1/5.000, 1/2.000; α-Tubulin im Thymus: S3 = 1/100, P3 = 1/400, P2 = 1/20, S1 = 1/50.000, 1/20.000, 1/10.000, 1/5.000, 1/2.000 Verdünnung der Gewebekonzentration). - Blockieren Sie die Membran mit 5 % Magermilch in Tris-gepufferter Kochsalzlösung (50 mM Tris-HCl pH 7,6; 152 mM NaCl) mit 0,1 % Tween 20 (TBS-T) für mehr als 30 Minuten.
- Tauchen Sie die Membran länger als 2 h in TBS-T-haltige Primärantikörper (siehe Materialtabelle). Danach waschen Sie die Membran 3 Minuten lang (3 Mal) mit TBS-T.
- Markierung des Primärantikörpers mit HRP-konjugierten Sekundärantikörpern (siehe Materialtabelle) in TBS-T für mehr als 1 Stunde. Danach waschen Sie die Membran 3 Minuten lang (3 Mal) mit TBS-T.
- Entwickeln Sie die Membranen mit dem Reagenz Enhanced Chemilumineszenz. Analysieren Sie dann die interessierenden Bänder mit einem Lumineszenzbildanalysator (siehe Materialtabelle).
- Quantifizieren Sie die Proteinbandenintensitäten mit einer Bildanalysesoftware (siehe Materialtabelle) und erstellen Sie eine Standardkurve, indem Sie die Verdünnungseinheiten der verdünnten S1-Proben auftragen, die für die Standardkurve entlang der X-Achse und die Bandintensitäten entlang der Y-Achse verwendet werden.
- Lesen Sie die Proteinkonzentration (Einheit) ab, die den Proben der verdünnten Fraktion entspricht. Multiplizieren Sie die abgelesene Konzentration mit dem Verdünnungsfaktor der Probe, um eine Proteineinheit in jeder Fraktion zu erhalten. Teilen Sie die gemessene Einheit jeder Fraktion durch die gesamte Proteineinheit (P2 + P3 + S3), um einen Prozentsatz zu erhalten.
- Quantifizierung von Proteinen in den P2-, P3- und S3-Fraktionen durch Western Blotting. Verwenden Sie zunächst die 10%ige SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE), um Proteine aus ordnungsgemäß verdünnten P2-, P3- und S3-Fraktionen und seriell verdünnter S1-Probe von jedem Individuum als Standardkurve zu trennen. Anschließend werden die Proben auf Polyvinylidenfluorid-Membranen elektrotupft (siehe Materialtabelle).
2. Bewertung der Eigenschaften von Tubulin in jeder Fraktion
HINWEIS: Diese biochemische Methode liefert drei Gruppen von Tubulinkomplexen, die durch Sedimentationseigenschaften definiert sind. Hier wurde der Status der in diesen Fraktionen erhaltenen Tubulin-Komplexe anhand der Größe des Komplexes und der Tubulin-PTMs bestimmt. Führen Sie alle Schritte dieses Protokolls ohne Unterbrechung in einer Umgebung mit kühler Temperatur durch, aber frieren Sie die Fraktionsproben nicht ein, bis sie im SDB-Probenpuffer aufgelöst sind.
- Filterfallen-Assay
- Filtern Sie die S2- und S3-Fraktionen (je 500 μl) mit einer 300-kDa-Ultrafiltrations-Spin-Säule (siehe Materialtabelle). Führen Sie eine Zentrifugation von 14.000 × g bei 2 °C durch, bis der gesamte Überstand gefiltert ist, eluierte Proteine in Empfängerröhrchen gesammelt werden und eingeschlossene Proteine auf dem Filter der Reservoirröhrchen verbleiben.
- Übersetzen Sie die ganzen Filtrate (ca. 500 μl) in Empfängerröhrchen in neue 1,5-ml-Mikroröhrchen und lösen Sie sie in 500 μl 2x SDS-Probenpuffer auf.
- Solubilisieren Sie die Rückstände auf dem Filter der Reservoirröhrchen in 1.000 μl 1x SDS-Probenpuffer, indem Sie die Proben pipettieren und in ein neues 1,5-ml-Mikroröhrchen überführen.
- Die Proben werden bei 100 °C für 3 min gekocht. Nachdem die Proben auf Raumtemperatur abgekühlt sind, lagern Sie die Proben bei -20 °C.
- Analysieren Sie die Tubulinmengen durch Western Blot mit DM1A (Anti-α-Tubulin-Antikörper, siehe Materialtabelle).
- Größenausschluss-Chromatographie
- Der Trägerpuffer (0,1 M MES, pH 6,8; 10 % Glycerin; 1 mM MgSO4; 1 mM EGTA; 0,1 mM DTT) wird mit einer Konzentration von 1/10 Protease- und Phosphataseinhibitoren wie in Schritt 1.1.1 beschrieben hergestellt. Filtern Sie dann die Lösung und lagern Sie sie in einer kalten Umgebung.
- Bereiten Sie eine Gelfiltrationschromatographiesäule mit einem präparativen Flüssigkeitschromatographiesystem in einer Chromatographiekammer (siehe Materialtabelle) bei 4 °C vor.
- Bevor Sie Proben auf die Säule injizieren, lassen Sie 180 ml des Trägerpuffers zufließen, um die Säule zu waschen. Die Durchflussrate beträgt 1 ml/min für 3 h.
- Injizieren Sie handelsübliches gereinigtes Schweinetubulin (siehe Materialtabelle) als Kontrolle oder die S3-Fraktion aus Mäusegehirnen (je 500 μl) auf die Säule.
- Eluieren Sie mit einer Flussrate von 1,0 ml/min mit Trägerpuffer. Sammeln Sie die 1,5-ml-Fraktionen 120 Minuten lang. Überwachung eluierter Proteine durch Absorption bei 280 nm. Halten Sie den maximalen Druck unter 0,3 MPa.
- Nach dem Vortexen der gesammelten Fraktionen mischen Sie 50 μl davon mit 50 μl 2x SDS-Probenpuffer in einem 1,5 mL Mikroröhrchen. Alle Proben werden bei 100 °C für 3 min gekocht. Nachdem die Proben auf Raumtemperatur abgekühlt sind, lagern Sie die Proben bei -20 °C.
- Analysieren Sie die Tubulinmengen durch Western Blot mit DM1A, Anti-α-Tubulin-Antikörper und KMX-1, Anti-β-Tubulin-Antikörper (siehe Materialtabelle).
Ergebnisse
Quantifizierung von Tubulin in den P2-, P3- und S3-Fraktionen des Mäusegehirns mit der MT-Fraktionierungsmethode
Tubulin im Mausgewebe wurde mit der MT-Fraktionierungsmethode in die P2-, P3- und S3-Fraktionen aufgeteilt und durch Western Blot quantifiziert (Abbildung 1A). Die Ausfällung von MTs, die durch Ultrazentrifugation bei 100.000 × g für 20 min in der P2-Fraktion verblieben waren, machte 34,86 % ± 1,68 % des gesamten Tubulins in einem Mausgehirn aus. Der Überstand (S2) wurde weiter bei 500.000 × g für 60 min zentrifugiert. Es wurden ein Niederschlag (P3-Fraktion) und ein Überstand (S3-Fraktion) erhalten, die 56,13 % ± 2,12 % bzw. 9,01 % ± 0,68 % des gesamten Tubulins in den Mäusegehirnen ausmachten (Abbildung 1B).
Die in dieser Studie verwendete Großhirnrinde enthält neuronale und nicht-neuronale Zellen, wie z. B. Gliazellen. Um die MT-Stabilität in den Neuronen von Mäusegehirnen selektiv zu beurteilen, quantifizierten wir TUBB3, einen Tubulin-Subtyp, der ausschließlich in Neuronen des zentralen und peripheren Nervensystems exprimiert wird, durch Western Blot mit Tuj1 (Anti-TUBB3-Antikörper). Der Anteil von TUBB3 in der P2-, P3- oder S3-Fraktion betrug 32,65 % ± 2,20 %, 59,31 % ± 2,61 % bzw. 8,04 % ± 0,74 %. Sie unterschieden sich nicht signifikant von denen von α-Tubulin (Abbildung 1B). Diese Ergebnisse deuten darauf hin, dass Neuronen und Gliazellen eine ähnliche MT-Stabilität aufweisen oder dass Neuronen viel höhere Mengen an Tubulin enthalten als die von Gliazellen in vivo.
Eigenschaften von Tubulin, das in jeder Fraktion zurückgewonnen wird
Hier wurde das Gewebehomogenat der Maus durch zweistufige Ultrazentrifugation mit unterschiedlichen Gravitationsbeschleunigungen in drei Fraktionen getrennt; Daher unterschieden sich die Sedimentationskoeffizienten zwischen den Proteinen oder ihren Komplexen in jeder Fraktion. Obwohl Tubulin, das bei 100.000 × g ausgefällt wurde, als konventionelle MT angesehen wurde, sollte geklärt werden, wie sich das neu gewonnene Tubulin der P3-Fraktion hier von dem von Tubulin in den P2- und S3-Fraktionen unterscheidet.
Zur Charakterisierung von S3-Tubulin wurde die S2 (P3 + S3) oder S3-Fraktion einer Ultrafiltration und Größenausschlusschromatographie unterzogen. Die Tubulinkomplexe in der S3-Fraktion konnten eine 300-kDa-Ultrafiltrations-Spin-Säule vollständig passieren, während fast das gesamte Tubulin in der S2-Fraktion auf dem Filter gefangen wurde (Abbildung 2A). Des Weiteren wurde das Molekulargewicht der Tubulinkomplexe in der S3-Fraktion mittels Größenausschlusschromatographie gemessen. S3-Tubulin eluierte bei einem Peak, der 100 kDa entspricht, was dem von kommerziell erhältlichen gereinigten Tubulin-Dimeren ähnelt (Abbildung 2B,C). Darüber hinaus waren die Anteile an α- und β-Tubulin, die in jeder Fraktion durch die MT-Fraktionierungsmethode gewonnen wurden, gleich (Abbildung 2D). Tatsächlich hat sich gezeigt, dass α- und β-Tubulin in lebenden Zellen leicht als Monomere existieren können24. Nach dem geschätzten kD-Wert (nM-Ordnung) und der Konzentration von Tubulin, die in der S3-Fraktion (~11 μM) gewonnen wurde, zu urteilen, wird jedoch angenommen, dass das meiste (> 98 %) Tubulin als α/β-Dimere existiert. Daher ist Tubulin in der S3-Fraktion in erster Linie ein lösliches α/β-Tubulin-Dimer.
Die Tubulin-Polymere wurden anhand ihrer posttranslationalen Modifikationen (PTMs) in zwei Fraktionen, P2 und P3, getrennt. Um zwischen diesen Fraktionen zu unterscheiden, wurde ein Western Blot mit spezifischen Antikörpern durchgeführt. Der antiacetylierte α-Tubulin-Antikörper, der als Marker für stabile MTs dient, zeigte, dass die P2-Fraktion mit 97,40 % ± 0,52 % acetyliertem α-Tubulin signifikant angereichert war (Abbildung 2E), während das gesamte α-Tubulin in den P3- und S3-Fraktionen gewonnen wurde (Abbildung 1B). Umgekehrt zeigte der anti-tyrosinierte α-Tubulin-Antikörper, der auf labile MTs hinweist, dass 75,43 % ± 2,69 % des tyrosinierten α-Tubulins in der P3-Fraktion vorhanden waren (Abbildung 2F). Diese Ergebnisse bestätigen, dass die P2-Fraktion hauptsächlich Tubulin in stabilen MTs enthält, während die P3-Fraktion aus Tubulin in labilen MTs besteht.
Beurteilung der MT-Stabilität unter Gefrier- und Nocodazol-Behandlung
Die Wirkung des Einfrierens und der Behandlung mit Nocodazol auf die Stabilität von intrazerebralen MTs der Maus wurde analysiert, um festzustellen, ob vorübergehende Änderungen in der Stabilität von MTs mit der MT-Fraktionierungsmethode erkannt werden können. MTs zerlegen sich in der Regel bei niedrigen Temperaturen, aber einige MTs bleiben in der Kälte stabil. Nach dem Wiegen der Gehirne wurden sie in flüssigem Stickstoff eingefroren und 30 Minuten lang bei -80 °C gelagert. Das transiente gefrorene Gehirn und das rohe Gehirn als Kontrolle wurden homogenisiert und in die P2-, P3- und S3-Fraktionen fraktioniert. Anschließend wurde der Anteil an Tubulin, der in den drei Fraktionen enthalten war, durch Western Blot quantifiziert. Sobald das Gehirn vor der Homogenisierung eingefroren wurde, nahm α-Tubulin in der P2-Fraktion ab und das in der P3-Fraktion stieg im Vergleich zu dem im Rohhirn an (Abbildung 3A). Blots mit 6-11B1 (acetyliertes α-Tubulin) oder 1A2 (tyrosiniertes α-Tubulin) zeigten auch, dass das Einfrieren des Gehirns das Acetylierungsniveau senkte (Abbildung 3B) und das Tyrosinierungsniveau (Abbildung 3C) von α-Tubulin in der P2-Fraktion erhöhte.
Nocodazol ist ein Mikrotubuli-Targeting-Wirkstoff (MTA), der die MT-Polymerisation durch Bindung an β-Tubulin verhindert und die MT-Depolymerisation fördert. Die Mäusegehirne wurden in Taxol-freiem MSB(+) mit oder ohne 10 μM Nocodazol homogenisiert und für 20 min bei 4 °C platziert. Das unbehandelte oder mit Nocodazol behandelte Homogenat wurde zu 10 μM Taxol gegeben, rehomogenisiert und in die P2-, P3- und S3-Fraktionen fraktioniert. Anschließend wurde der Anteil an Tubulin, der in den drei Fraktionen enthalten war, durch Western Blot quantifiziert. Blots mit DM1A (α-Tubulin) zeigten, dass α-Tubulin in der P2-Fraktion abnahm und in der P3-Fraktion mit Nocodazol tendenziell zunahm (Abbildung 3D). Diese Ergebnisse deuten darauf hin, dass P2-Tubulin als Reaktion auf niedrige Temperaturen oder Nocodazol destabilisiert wurde und dass die P2-Fraktion robuste MTs enthielt, die den experimentellen Bedingungen standhielten. Im Gegensatz zum Einfrieren hatte Nocodazol keinen Einfluss auf die Tubulin-PTMs (Abbildung 3E,F). Basierend auf den Ergebnissen und den oben genannten Daten kann die Depolymerisation von MTs, die durch die PTM-Analyse nicht nachgewiesen werden können, mit dieser Methode bewertet werden.
Vergleich des Verhältnisses von stabilen MTs, labilen MTs und freiem Tubulin in Geweben
Die Stabilität von MTs variiert zwischen verschiedenen Geweben, abhängig von der Proliferationskapazität der Zellen in diesen Geweben. Bemerkenswert ist, dass stabile MTs im Nervensystem, das hauptsächlich aus nicht-proliferativen Neuronen besteht, im Vergleich zu anderen Geweben häufiger vorkommen4. Um die Fähigkeit der entwickelten MT-Fraktionierungsmethode zu bewerten, Unterschiede in der MT-Stabilität in verschiedenen Geweben zu erkennen, wurden die Lebern und der Thymi von Mäusen fraktioniert und das gewonnene Tubulin in jeder Fraktion quantifiziert. Die Ergebnisse zeigten, dass das Gehirn im Vergleich zu anderen Geweben einen signifikant höheren Gehalt an P2-Tubulinen aufwies, während P3-Tubuline in Geweben mit proliferativen Zellen deutlich angereichert waren (Abbildung 4). Darüber hinaus bestätigte das Western Blot mit 6-11B1- und 1A2-Antikörpern das Vorhandensein einer höheren MT-Stabilität im Nervensystem. Die unterschiedlichen Verteilungsmuster der Tubulin-PTMs zeigten deutlich, dass das spezifisch im Nervensystem vorkommende P2-Tubulin von stabilen MTs stammt (Abbildung 4). Diese Ergebnisse stützen die Annahme, dass die P2- und P3-Fraktionen stabilen bzw. labilen MTs entsprechen.

Abbildung 1: Quantifizierung von Tubulin in Mausgewebe mit der MT-Fraktionierungsmethode . (A) Zusammenfassung der MT-Fraktionierungsmethode für Gewebe. Stabile MTs (P2-Fraktion), labile MTs (P3-Fraktion) und freies Tubulin (S3-Fraktion) in Geweben können durch 2-stufige Ultrazentrifugation unter Bedingungen getrennt werden, die die MT-Polymerisation und -Depolymerisation während der Herstellung unterdrücken. (B) MTs im Mauskortex wurden durch konventionelle 100.000 × g Ultrazentrifugation gefolgt von 500.000 × g Ultrazentrifugation ausgefällt. Anschließend wurden die in die P2-, P3- und S3-Fraktionen aufgeteilten Tubuline mittels Western Blot mit DM1A (α-Tubulin) und Anti-Tuj1 (TUBB3) quantifiziert. Der Anteil der Proteine in jeder Fraktion (P2, P3 oder S3) an der Gesamtfraktion (P2 + P3 + S3) wurde wie im Abschnitt Protokoll beschrieben berechnet (Mittelwerte ± SDs, n = 4). Diese Abbildung wurde von Hagita et al.23 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Die MT-Fraktionierungsmethode ermöglicht die Trennung von stabilen MTs, labilen MTs und freiem Tubulin in der Großhirnrinde der Maus. (A) Die S2- oder S3-Fraktionen (Input) wurden mit dem Filterfallen-Assay unter Verwendung einer 300-kDa-Ultrafiltrations-Spin-Säule analysiert. Tubuline, die durch Filtration (Receiver) und Trapping (Reservoir) gewonnen wurden, wurden durch Western Blot mit DM1A (α-Tubulin) quantifiziert. (B) Gereinigte Schweinetubuline wurden der MT-Fraktionierungsmethode unterzogen und es wurde festgestellt, dass sie hauptsächlich in der S3-Fraktion gesammelt wurden. (C) Molekülgröße von Tubulin in der S3-Fraktion. Die S3-Fraktion wurde durch Größenausschlusschromatographie unter Verwendung einer Gelfiltrationschromatographiesäule getrennt. Die Proteine in jeder Fraktion wurden durch Western Blot mit DM1A (α-Tubulin) und KMX-1 (β-Tubulin) quantifiziert. Das theoretische Molekulargewicht ist oben auf den Tafeln angegeben. (D) Die Anteile von α-Tubulin und β-Tubulin in jeder Fraktion waren gleich. Die in die P2-, P3- und S3-Fraktionen aufgeteilten Tubuline wurden durch Western Blot mit KMX-1 (β-Tubulin) quantifiziert. Quantifizierung des Anteils von α-Tubulin und β-Tubulin in jeder Fraktion relativ zur Summe der Gesamtfraktion (Mittelwerte ± SDs, n = 4). Die statistischen Auswertungen wurden mit dem Student's t-Test durchgeführt. (E,F) Die Modifikationen von α-Tubulin in den P2-, P3- und S3-Fraktionen wurden durch Western Blot mit 6-11B1 (acetyliertes α-Tubulin: E) und 1A2 (tyrosiniertes α-Tubulin: F) verifiziert. Quantifizierung des Anteils an tyrosiniertem oder acetyliertem α-Tubulin in jeder Fraktion relativ zur Gesamtfraktion (Mittelwerte ± SDs, n = 4). (A-C) wurden von Hagita et al.23 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
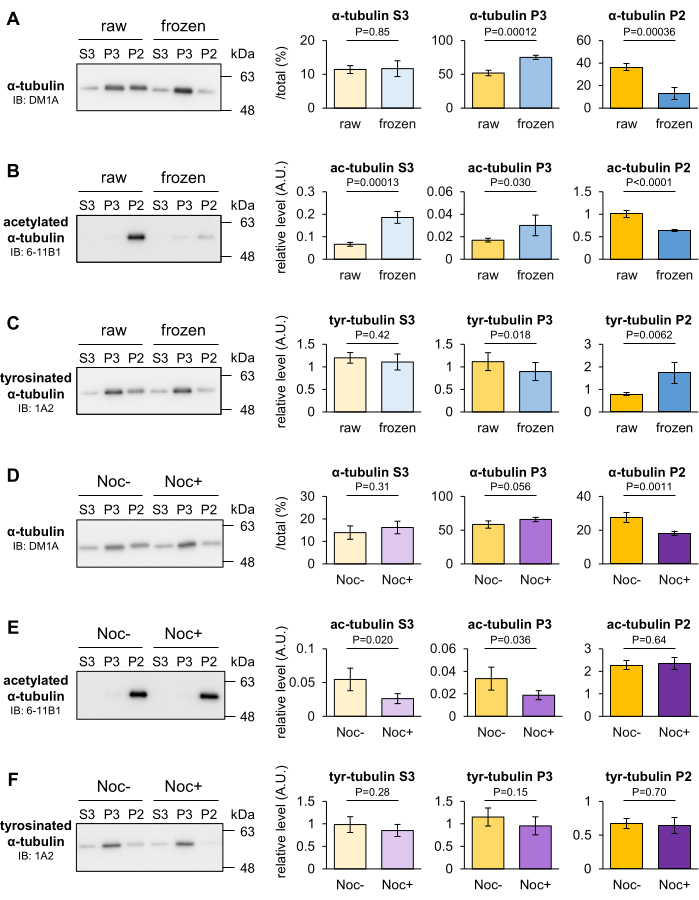
Abbildung 3: Bewertung der MT-Depolymerisation, die durch Einfrieren oder MTA induziert wird. (A-C) Die Stabilität von MT nach 30 min Gefrieren bei -80 °C wurde bewertet. Die Tubulinanteile in den drei Fraktionen des rohen und gefrorenen Gehirns wurden durch Western Blot mit DM1A (α-Tubulin: A), 1A2 (tyrosiniertes α-Tubulin: B) und 6-11B1 (acetyliertes α-Tubulin: C) quantifiziert. (D-F) Die Wirkung von Nocodazol auf die MT-Stabilität wurde untersucht. Die Anteile an Tubulin, die in den drei Fraktionen von unbehandelten oder behandelten Gehirnen von Nocodazol enthalten waren, wurden durch Western Blot mit DM1A (α-Tubulin: D), 1A2 (tyrosiniertes α-Tubulin: E) und 6-11B1 (acetyliertes α-Tubulin: F) quantifiziert. Repräsentative relative Niveaus der Tyrosinierung (B,E) oder Acetylierung (C,F) wurden auf die Menge des gesamten α-Tubulins (A,D) normalisiert ) (bedeutet ± SDs, n = 4). Die statistischen Auswertungen wurden mit dem Student's t-Test durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
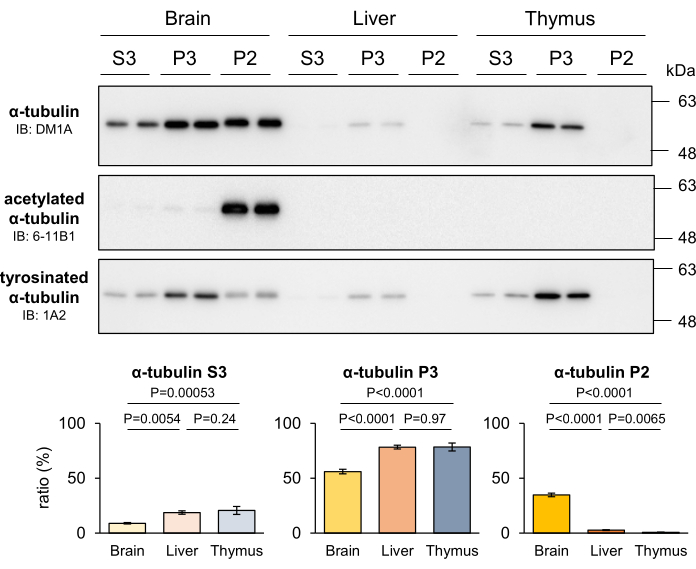
Abbildung 4: Anteile von stabilen MTs, labilen MTs und freiem Tubulin im Gehirn, in der Leber und im Thymus bei Mäusen. Das Gehirn, die Leber und der Thymi von Mäusen wurden seziert und der MT-Fraktionierungsmethode unterzogen. Die in jede Fraktion aufgeteilten Proteine wurden durch Western Blot mit DM1A (α-Tubulin), 6-11B1 (acetyliertes α-Tubulin) und 1A2 (tyrosiniertes α-Tubulin) quantifiziert. Der Anteil der Proteine in jeder Fraktion (P2, P3 oder S3) an der Gesamtfraktion (P2 + P3 + S3) wurde wie im Abschnitt Protokoll beschrieben berechnet (Mittelwerte ± SDs, n = 4). Die statistischen Analysen wurden mittels Einweg-ANOVA durchgeführt, gefolgt von Tukeys Post-hoc-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die wichtigste Aufgabe bei der Untersuchung des Status von Tubulin in Gewebe lebender Organismen besteht darin, eine versehentliche MT-Polymerisation oder -Depolymerisation während der Präparation zu verhindern. Die Stabilität von MTs in Proben wird durch Faktoren wie die Konzentration von Taxol in MSB, das Verhältnis der Gewebemenge zum Puffer und die Temperatur während des Prozesses von der Gewebeentnahme bis zur Homogenisierung und Zentrifugation beeinflusst. Daher wurden die Bedingungen in jedem Schritt des Protokolls für die Analyse von Mausgewebe mit einem 20-fachen Volumen des Homogenats optimiert. Eine höhere Konzentration von Taxol kann die MT-Polymerisation in vitro induzieren, selbst unter gekühlten Bedingungen25. Bei der Analyse von Geweben mit signifikant unterschiedlichen Tubulinkonzentrationen oder bei wesentlichen Protokolländerungen sollte jeder Anwender die Schritte entsprechend den spezifischen Zielen seiner Experimente optimieren.
In der durchgeführten Studie wurde eine neue Population von MTs, die als P3 bezeichnet wird, aus der herkömmlichen "löslichen Fraktion" mittels Ultrazentrifugation bei 500.000 × g20 gewonnen. Theoretische Berechnungen, die auf Faktoren wie dem K-Faktor des Rotors, der Zentrifugalkraft und der Zentrifugationsdauer basieren, deuten darauf hin, dass es sich bei den in der S3-Fraktion vorhandenen Tubulinen höchstwahrscheinlich um 6S-Tubulin-Dimere handelt. Umgekehrt kann Tubulin in der P3-Fraktion MTs entsprechen, die im Vergleich zu denen in der P2-Fraktion kürzer sind. Diese Beobachtung stimmt mit dem Ergebnis überein, das zeigt, dass das Einfrieren von Geweben vor der Homogenisierung, die zum teilweisen Kollaps von MTs26 führt, zu einem signifikanten Anstieg des Tubulins innerhalb der P3-Fraktion und einer gleichzeitigen Abnahme der P2-Fraktion führte (Abbildung 3A). Darüber hinaus deuten die Analyse von Tubulin-PTMs und die Bindungseigenschaften verschiedener MAPs darauf hin, dass die P2- bzw. P3-Fraktion stabile bzw. labile MTs enthält. Zum Beispiel waren bestimmte MAPs, die für stabile MTs spezifisch sind und hauptsächlich in Neuronen vorkommen, ausschließlich in der P2-Fraktion23 vorhanden. Folglich ist es plausibel anzunehmen, dass die P3-Fraktion MTs umfasst, die im Vergleich zu denen der P2-Fraktion dynamischer und labiler sind.
Nach der der Methode zugrunde liegenden Theorie können ungeeignete Versuchsbedingungen bei der MT-Stabilisierung oder Zentrifugation zu einer schlechten Fraktionierung führen. Zum Beispiel führt eine niedrige Konzentration von Taxol zu einer leichten Abnahme des P2-Tubulins, während ein Überschuss an Taxol den P2-Tubulin aufgrund der MT-Bildung während der Präparationerhöht 23. In ähnlicher Weise kann eine unangemessene Erwärmung von Geweben und Proben dazu führen, dass MTs hyperpolymerisieren und Tau abgebaut oder fragmentiertwird 23. Darüber hinaus sind die Zentrifugalbedingungen für die Trennung der P3- und S3-Fraktionen entscheidend, und eine leichte Abnahme der Erdbeschleunigung reduziert die Rückgewinnung der P3-Fraktion erheblich. Daher wird empfohlen, die Protokollschritte strikt zu befolgen, wenn abnormale Fraktionierungen beobachtet werden.
Diese einfache Fraktionierungsmethode kann breit angewendet werden, um die Anteile von Tubulinen zwischen stabilen MTs, labilen MTs und freien Dimeren in Geweben zu analysieren. Diese Methode bietet mehrere Vorteile, da sie subtile Veränderungen des Tubulinstatus erkennen kann, die durch die Quantifizierung von Tubulin-PTMs möglicherweise nicht offensichtlich sind. Die Analyse der MT-Stabilität ist wichtig, um die physiologische Bedeutung von MTs, insbesondere in großen und komplexen neuronalen Zellen, zu verstehen und Störungen zu untersuchen, die mit einer MT-Dysregulation verbunden sind. Mutationen oder Funktionsstörungen in Tubulin- oder MAP-Genen werden beispielsweise mit neurologischen Entwicklungsstörungen und neurodegenerativen Erkrankungen in Verbindung gebracht27,28. Bei der Alzheimer-Krankheit ist bekannt, dass MTs reduziert sind, möglicherweise aufgrund des funktionellen Verlusts des Tau-Proteins in den betroffenen Neuronen 15,29,30,31,32,33. MTAs, die die MT-Stabilität modulieren und die Zellteilung hemmen, wurden als potenzielle Therapien für neurologische Erkrankungen vorgeschlagen13,34. Die Verwendung dieser einzigartigen MT-Fraktionierungsmethode zur Analyse der Stabilität und des Verhaltens von MTs und MAPs in Krankheitsmodelltieren kann wesentlich zur Aufklärung der Pathogenese der Tau-bedingten Demenz und zur Identifizierung neuer therapeutischer Ziele beitragen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu melden.
Danksagungen
Diese Arbeit wurde zum Teil von JST unterstützt, der Einrichtung von Universitätsstipendien zur Schaffung von wissenschaftlich-technologischen Innovationen (A.HT.; JPMJFS2145), JST FRÜHLING (A.HT.; JPMJSP2129), Grant-in-Aid for JSPS Fellows (A.HT.; 23KJ2078), ein Grant-in-Aid for Scientific Research(B) JSPS KAKENHI (22H02946 for TM), ein Grant-in-Aid for Scientific Research on Innovative Areas mit dem Titel "Brain Protein Aging and Dementia Control" von MEXT (TM; 26117004) und von Uehara Research Fellowship von der Uehara Memorial Foundation (TM; 202020027). Die Autoren erklären, dass es keine konkurrierenden finanziellen Interessen gibt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 ML TUBE CASE OF 500 | Beckman Coulter | 357448 | |
| 1A2 | Sigma-Aldrich | T9028 | 1:5,000 dilution |
| 2-(N-morpholino)ethanesulfonic acid (MES) | Nacalai Tesque | 02442-44 | |
| 300 kDa ultrafiltration spin column | Aproscience | PT-1013 | |
| 6-11B1 | Sigma-Aldrich | T7451 | 1:5,000 dilution |
| ÄKTAprime plus | Cytiva | 11001313 | |
| anti-mouse IgG | Jackson ImmunoResearch | 115-035-146 | 1:5,000 dilution |
| antipain | Peptide Institute Inc. | 4062 | |
| aprotinin | Nacalai Tesque | 03346-84 | |
| Chemi-Lumi One L | Nacalai Tesque | 07880-54 | |
| Corning bottle-top vacuum filter system | Corning | 430758 | 0.22µm 33.2cm² Nitrocellulose membrane |
| DIFP | Sigma-Aldrich | 55-91-4 | |
| DIGITAL HOMOGENIZER HK-1 | AS ONE | 1-2050-11 | |
| DM1A | Sigma-Aldrich | T9026 | 1:5,000 dilution |
| DTT | Nacalai Tesque | 14128-46 | |
| EGTA | Nacalai Tesque | 37346-05 | |
| FluoroTrans W 3.3 Meter Roll | Pall Corporation | BSP0161 | |
| glycerol | Nacalai Tesque | 17018-25 | |
| GTP | Nacalai Tesque | 17450-61 | |
| HIGH SPEED REFRIGERATIOED MICRO CENTRIFUGE Kitman | TOMY | KITMAN-24 | |
| HiLoad 16/600 Superdex 200 pg column | Cytiva | 28-9893-35 | |
| Image Gauge Software | FUJIFILUM Wako Pure Chemical Corporation | ||
| ImmunoStar LD | FUJIFILUM Wako Pure Chemical Corporation | 292-69903 | |
| KMX-1 | Millipore | MAB3408 | 1:5,000 dilution |
| LAS-4000 luminescent image analyzer | FUJIFILUM Wako Pure Chemical Corporation | ||
| leupeptin | Peptide Institute Inc. | 43449-62 | |
| MgSO4 | Nacalai Tesque | 21003-75 | |
| Na3VO4 | Nacalai Tesque | 32013-92 | |
| NaF | Nacalai Tesque | 31420-82 | |
| okadaic acid | LC Laboratories | O-2220 | |
| OPTIMA MAX-XP | Beckman Coulter | 393315 | |
| pepstatin | Nacalai Tesque | 26436-52 | |
| PMSF | Nacalai Tesque | 27327-81 | |
| Polycarbonate Centrifuge Tubes for TLA120.2 | Beckman Coulter | 343778 | |
| Protease inhibitor cocktail (cOmplete™, EDTA-free) | Roche | 11873580001 | |
| Purified tubulin | Cytoskeleton | T240 | |
| QSONICA Q55 | QSonica | Q55 | |
| Taxol | LC Laboratories | P-9600 | |
| TLA-120.2 rotor | Beckman Coulter | 357656 | |
| TLA-55 rotor | Beckman Coulter | 366725 | |
| TLCK | Nacalai Tesque | 34219-94 | |
| Triton X-100 | Nacalai Tesque | 12967-45 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
Referenzen
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Conde, C., Caceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nature Reviews Neuroscience. 10 (5), 319-332 (2009).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Challacombe, J. F., Snow, D. M., Letourneau, P. C. Dynamic microtubule ends are required for growth cone turning to avoid an inhibitory guidance cue. Journal of Neuroscience. 17 (9), 3085-3095 (1997).
- Kapitein, L. C., Hoogenraad, C. C. Building the neuronal microtubule cytoskeleton. Neuron. 87 (3), 492-506 (2015).
- Leo, L., et al. Vertebrate fidgetin restrains axonal growth by severing labile domains of microtubules. Cell Reports. 12 (11), 1723-1730 (2015).
- Janke, C. The tubulin code: molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. International Journal of Molecular Sciences. 18 (10), 2207 (2017).
- Baas, P. W., Black, M. M. Individual microtubules in the axon consist of domains that differ in both composition and stability. Journal of Cell Biology. 111 (2), 495-509 (1990).
- Cartelli, D., et al. Microtubule alterations occur early in experimental parkinsonism and the microtubule stabilizer epothilone D is neuroprotective. Scientific Reports. 3, 1837 (2013).
- Zhang, B., et al. Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proceedings of the National Academy of Sciences of the United States of America. 102 (1), 227-231 (2005).
- Zhang, F., et al. Post-translational modifications of alpha-tubulin in Alzheimer disease. Translational Neurodegeneration. 4, 9 (2015).
- Miyasaka, T., et al. Curcumin improves tau-induced neuronal dysfunction of nematodes. Neurobiology of Aging. 39, 69-81 (2016).
- Fujiwara, H., et al. Inhibition of microtubule assembly competent tubulin synthesis leads to accumulation of phosphorylated tau in neuronal cell bodies. Biochemical and Biophysical Research Communications. 521 (3), 779-785 (2020).
- Vielkind, U., Swierenga, S. H. A simple fixation procedure for immunofluorescent detection of different cytoskeletal components within the same cell. Histochemistry. 91 (1), 81-88 (1989).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. Journal of Cell Biology. 109 (3), 1173-1184 (1989).
- Brown, A., Li, Y., Slaughter, T., Black, M. M. Composite microtubules of the axon: quantitative analysis of tyrosinated and acetylated tubulin along individual axonal microtubules. Journal of Cell Science. 104 (2), 339-352 (1993).
- Black, M. M., Slaughter, T., Moshiach, S., Obrocka, M., Fischer, I. Tau is enriched on dynamic microtubules in the distal region of growing axons. Journal of Neuroscience. 16 (11), 3601-3619 (1996).
- Caron, J. M., Jones, A. L., Kirschner, M. W. Autoregulation of tubulin synthesis in hepatocytes and fibroblasts. Journal of Cell Biology. 101 (5), 1763-1772 (1985).
- Merrick, S. E., Trojanowski, J. Q., Lee, V. M. Selective destruction of stable microtubules and axons by inhibitors of protein serine/threonine phosphatases in cultured human neurons. Journal of Neuroscience. 17 (15), 5726-5737 (1997).
- Miyasaka, T., Sato, S., Tatebayashi, Y., Takashima, A. Microtubule destruction induces tau liberation and its subsequent phosphorylation. FEBS Letters. 584 (14), 3227-3232 (2010).
- Hagita, A., et al. Quantitative fractionation of tissue microtubules with distinct biochemical properties reflecting their stability and lability. Biochemical and Biophysical Research Communications. 560, 186-191 (2021).
- Montecinos-Franjola, F., Chaturvedi, S. K., Schuck, P., Sackett, D. L. All tubulins are not alike: Heterodimer dissociation differs among different biological sources. Journal of Biological Chemistry. 294 (26), 10315-10324 (2019).
- Vallee, R. B. A taxol-dependent procedure for the isolation of microtubules and microtubule-associated proteins (MAPs). Journal of Cell Biology. 92 (2), 435-442 (1982).
- Bartolo, M. E., Carter, J. V. Effect of microtubule stabilization on the freezing tolerance of mesophyll cells of spinach. Plant Physiology. 97 (1), 182-187 (1991).
- Strang, K. H., Golde, T. E., Giasson, B. I. MAPT mutations, tauopathy, and mechanisms of neurodegeneration. Laboratory Investigation. 99 (7), 912-928 (2019).
- Fourel, G., Boscheron, C. Tubulin mutations in neurodevelopmental disorders as a tool to decipher microtubule function. FEBS Letters. 594 (21), 3409-3438 (2020).
- Terry, R. D., Gonatas, N. K., Weiss, M. Ultrastructural studies in Alzheimer's presenile dementia. The American Journal of Pathology. 44 (2), 269-297 (1964).
- Yoshida, H., Ihara, Y. Tau in paired helical filaments is functionally distinct from fetal tau: assembly incompetence of paired helical filament-tau. Journal of Neurochemistry. 61 (3), 1183-1186 (1993).
- Cash, A. D., et al. Microtubule reduction in Alzheimer's disease and aging is independent of tau filament formation. The American Journal of Pathology. 162 (5), 1623-1627 (2003).
- Hempen, B., Brion, J. P. Reduction of acetylated alpha-tubulin immunoreactivity in neurofibrillary tangle-bearing neurons in Alzheimer's disease. Journal of Neuropathology and Experimental Neurology. 55 (9), 964-972 (1996).
- Miyasaka, T., et al. Imbalanced expression of tau and tubulin induces neuronal dysfunction in C. elegans models of tauopathy. Frontiers in Neuroscience. 12, 415 (2018).
- Boiarska, Z., Passarella, D. Microtubule-targeting agents and neurodegeneration. Drug Discovery Today. 26 (2), 604-615 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten