Method Article
マウス組織における安定微小管、不安定な微小管、遊離チューブリンを分離するための定量的微小管分画技術
要約
チューブリンポリマーである微小管は、真核細胞の細胞骨格成分として重要な役割を果たしており、動的に不安定であることで知られています。本研究では、微小管を分画して安定微小管、不安定な微小管、遊離管に分離し、マウスの各種組織における微小管の安定性を評価する方法を開発しました。
要約
α/β-チューブリン二量体で構成される微小管は、真核細胞の細胞骨格の重要な構成要素です。これらのチューブ状ポリマーは、チューブリンヘテロ二量体サブユニットが重合と解重合を繰り返すため、動的不安定性を示します。チューブリンの翻訳後修飾や微小管関連タンパク質によって達成される微小管の安定性と動態の精密な制御は、さまざまな細胞機能に不可欠です。微小管の機能不全は、神経変性疾患などの病因に強く関与しています。現在進行中の研究は、安定性を調節する微小管を標的とする治療薬に焦点を当てており、これらの疾患やがんに対する潜在的な治療選択肢を提供しています。したがって、微小管の動態を理解することは、疾患の進行と治療効果を評価するために重要です。
従来、微小管の動態は、チューブリンの翻訳後修飾を標的とする抗体を用いて、粗分画またはイムノアッセイによってin vitro または培養細胞で評価されてきました。しかし、このような手順を用いて組織中のチューブリンの状態を正確に分析することは困難です。本研究では、マウス組織において安定な微小管、不安定な微小管、遊離チューブリンを分離する簡便で革新的な微小管分画法を開発しました。
この手順では、解剖したマウス組織を微小管安定化バッファー中で19:1の体積比でホモジナイズしました。次に、ホモジネートを、最初の低速遠心分離(2,400 × g)に続いて 2 段階の超遠心分離プロセスで分画し、破片を除去しました。第1の超遠心分離工程(100,000 × g)で安定な微小管を沈殿させ、得られた上清を第2の超遠心分離工程(500,000 × g)にかけ、不安定な微小管および可溶性チューブリン二量体を分画した。この方法では、マウスの脳内で安定または不安定な微小管を構成するチューブリンの割合が決定されました。さらに、微小管の安定性における明確な組織変動が観察され、構成細胞の増殖能力と相関しました。これらの知見は、生理学的および病理学的状態における微小管の安定性を分析するためのこの新しい方法の大きな可能性を浮き彫りにしています。
概要
微小管(MT)は、α/β-チューブリンヘテロ二量体サブユニットからなるプロトフィラメントからなる細長い管状構造です。それらは、細胞分裂、運動性、形状維持、細胞内輸送などのさまざまな細胞プロセスにおいて重要な役割を果たしており、真核生物の細胞骨格の不可欠な構成要素となっています1。α-チューブリンサブユニットが露出するMTのマイナス末端は比較的安定であるのに対し、β-チューブリンサブユニットが露出するプラス末端は動的解重合と重合2を受ける。プラス末端でのチューブリン二量体の付加と解離の連続的なサイクルは、動的不安定性と呼ばれ、レスキューと大惨事の繰り返しのプロセスをもたらします3。MTは、安定ドメインと不安定ドメインを含む、動的不安定性に局所的な変動を伴う焦点ドメインを示します4。
MTの動的不安定性の正確な制御は、多くの細胞機能、特に複雑な形態を特徴とするニューロンにとって非常に重要です。MTの適応性と耐久性は、神経細胞の発達と適切な機能に重要な役割を果たします5,6,7。MTの動的不安定性は、アセチル化、リン酸化、パルミトイル化、脱チロシン化、デルタ2、ポリグルタミン酸化、ポリグリシル化など、チューブリンのさまざまな翻訳後修飾(PTM)に関連していることがわかっています。さらに、微小管関連タンパク質(MAP)の結合は、調節機構として機能します8。アセチル化を除くPTMは、主にMTの外表面に位置するチューブリンカルボキシ末端領域に発生します。これらの変更により、MTに多様な表面条件が生じ、MAPとの相互作用に影響を与え、最終的にはMTの安定性を支配します9。α-チューブリン中のカルボキシ末端チロシン残基の存在は、遊離チューブリンプールに急速に置き換わる動的MTを示しています。逆に、カルボキシ末端の脱チロシン化とLys40のアセチル化は、動的不安定性が低減された安定したMTを意味する9,10。
チューブリンのPTMは、MT 5,7,11,12,13,14,15のダイナミクスと安定性を評価するための実験に広く用いられています。例えば、細胞培養研究では、チューブリンは遊離チューブリンプールとMTプールの2つのプールに分離できます。これは、残りのMT15、16、17、18、19を固定する前に、細胞透過処理によって遊離チューブリンを放出することによって達成されます。生化学的方法では、MTを大惨事から保護する化学的MT安定剤を使用し、遠心分離によってMTと遊離チューブリンを分離することができます20,21,22。しかし、これらの手順では、安定なMTと安定性の低い(不安定な)MTを区別しないため、脳などの組織におけるMTや可溶性チューブリンを定量することは不可能です。その結果、生理学的および病理学的条件下での生物のMT安定性を評価することは困難であることが証明されています。この実験的限界に対処するために、我々はマウス組織中のMTと遊離チューブリンを正確に分離するための新しい技術を開発した23。
このユニークなMT分画法では、組織内のチューブリンの状態を維持する条件下での組織ホモジナイズと、安定なMT、不安定なMT、遊離チューブリンを分離するための2段階の遠心分離を行います。この簡便な手法は、生体内のMTやMAPに関する基礎研究、MTの安定性に関わる健康や疾患の生理・病理学的解析、MTを標的とした医薬品などの治療法の開発など、幅広い研究に応用できます。
プロトコル
1. MT分別法
注:本研究で実施したすべての実験は、同志社大学動物倫理委員会の承認を受けたものです。ここでは、雌雄ともに3〜4ヶ月齢のC57BL/6Jマウスを用いた。このプロトコルでは、解剖されたティッシュ、例えば、頭脳、レバー、または胸腺は、MTの解重合だけでなく、再重合を防ぐ濃度でタキソール(MTの安定装置)を含んでいた氷冷した微小管の安定の緩衝(MSB)で、すぐに均質化されました。ホモジネートは、2段階の超遠心分離プロセスにより3つのフラクションに分離しました(図1)。このプロトコルのすべてのステップは涼しい温度の環境で中断なしで完了し、ティッシュおよび画分はナトリウムのdodecyl硫酸塩(SDS)サンプル緩衝液で分解されるまで凍結しなかった。
- MSBおよびマイクロチューブの調製
- MSBを調製するには、以下の試薬を混合します:0.1 M 2-(N-モルホリノ)エタンスルホン酸(MES)、pH 6.8(KOHで中和)、10%グリセロール、0.1 mM DTT、1 mM MgSO 4、1 mM EGTA、0.5% Triton X-100、ホスファターゼ阻害剤(1 mM NaF、1 mM β-グリセロリン酸、1 mM Na3VO4、0.5 μMオカダ酸)、1xプロテアーゼ阻害剤カクテル、 およびプロテアーゼ阻害剤(0.1 mM PMSF、0.1 mM DIFP、1 μg/mLペプスタチン、1 μg/mLの抗疼痛剤、10 μg/mLのアプロチニン、10 μg/mLのロイペプチン、50 μg/mL TLCK)(資料表を参照)およびMSB(-)と表記します。
- 組織解剖の直前に、10 μM タキソールと 2 mM GTP( 材料表を参照)を MSB(-) に添加します。このバッファーは MSB(+) と表記されます。使用当日に緩衝液を準備し、氷上に保管してください。
- サンプリング用のマイクロチューブを準備します。ホモジネート保存用の空の2.0 mLマイクロチューブ。上清1(S1)ライセート、沈殿物2(P2)サンプル、および沈殿物3(P3)サンプル保存用の空の1.5 mLマイクロチューブ。解剖組織保存用の氷冷リン酸緩衝生理食塩水(PBS)1 mLを含む1.5 mLマイクロチューブ。1.5 mL マイクロチューブと 200 μL の 2x SDS サンプルバッファー(0.16 M トリス pH 6.8、20% グリセロール、2% 2-メルカプトエタノール、4% SDS)を添加した S1 サンプルおよび上清 3(S3)サンプル保存用。TLA55およびTLA120.2遠心分離機ローター用の遠心分離マイクロチューブ( 材料表を参照)。すべてのチューブにラベルを付け、氷の上に置きます。
- マウス組織のホモジナイズ
- 組織解剖用のチルドテーブルを準備します。まず、箱に砕いた氷を入れ、内側を上にして、外側を上にして、2つのシャーレを氷の上に置きます。氷冷したPBSを1つの皿に充填し、一過性の洗浄と解剖組織の保存を行います。PBSで湿らせた濾紙を裏返した別の皿に置きます。
- マウスを犠牲にするには、ブトルファノール、ミダゾラム、メデトミジンの混合麻酔薬を使用して、深い麻酔下で子宮頸部脱臼を行います。次に、脳、肝臓、胸腺などの組織を直ちに解剖し、ペトリ皿で氷冷したPBSで洗浄します。
注:この方法では、あらゆるタイプの軟部組織を分析できます。ただし、組織のサイズは、使用するホモジナイザーの推奨容量範囲によって制限されます。例えば、2 mL の量のホモジナイザーを使用する場合は、50 〜 100 mg の組織が推奨されます。 - PBSを充填した1.5mLのマイクロチューブを秤量して解剖組織保存した後、マイクロチューブ内の組織を切り取って保存し、各マイクロチューブを再計量します。各組織の湿重量は、組織を追加する前後のチューブの重量を差し引くことによって計算できます。
- 冷やしたホモジナイザーを使用して、氷冷MSB(+)で組織を直ちに均質化します( 材料表を参照)。MSB(+)の体積は、組織湿重量(mg)の19倍(μL)であった。組織片が消えるまで20ストロークで均質化を行います。
注:例えば、100 mgの組織に対して1,900 μLのMSB(+)が使用されます。添加するMSB(+)の量は、分析する組織片の湿重量ごとに調整する必要があるため、各組織片を正確に計量する必要があります。
- マウス組織ホモジネートの遠心分離
- ホモジネート全体をパスツールピペットで2 mLのマイクロチューブに移し、2,400 × g で2°Cで3分間遠心分離し、沈殿 によって 破片を除去します。
- 上清全体(S1フラクション)を新しい1.5 mLマイクロチューブに移し、ボルテックスします。次に、200μLのS1フラクションを遠心分離用マイクロチューブに分注し、TLA-55ローターを使用して2°Cで20分間、100,000× g で遠心分離し、比較的大きな分子量のタンパク質を沈殿物(P2フラクション)として得る。
注:超遠心分離ステップに供するサンプルの量は、遠心分離の半径と分子の沈殿効率に影響を与えます。このステップの後は、不正確な分画を防ぐために、サンプル量を200 μL以下に保ちます。 - さらに、得られたすべての上清(S2フラクション)を500,000 × g でTLA-120.2ローターを使用して2°Cで60分間遠心分離し、沈殿物中の不溶性タンパク質複合体(P3フラクション)を上清中の可溶性タンパク質(S3フラクション)から分離します。
- 400 μL の 1x SDS サンプルバッファー (0.08 M トリス pH 6.8; 10% グリセロール; 1% 2-メルカプトエタノール; 2% SDS) を P2 および P3 フラクションチューブに加え、短時間超音波処理して沈殿物を溶解します。これらのフラクションサンプルを空の1.5 mLマイクロチューブに移します。
- 総S3画分を200 μLの2x SDSサンプルバッファーに溶解します。
- 残りの S1 フラクションを等量の 2x SDS サンプルバッファーと混合し、ウェスタンブロッティングの検量線として使用します。
- これらすべてのサンプルを100°Cで3分間煮沸します。サンプルが室温まで冷却されたら、サンプルを-20°Cで保管します。
- 各画分におけるタンパク質の定量
- P2、P3、S3画分のタンパク質をウェスタンブロッティングで定量します。まず、10% SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)を使用して、適切に希釈したP2、P3、S3画分、および段階希釈したS1サンプルを検量線として任意の個体からタンパク質を分離します。次に、サンプルをポリフッ化ビニリデンメンブレンにエレクトロブロットします( 材料表を参照)。
注:各フラクションの希釈比は、目的タンパク質の濃度と抗体の反応性によって異なります。(例:脳組織におけるα-チューブリン、TUBB3、β-tub、およびチロシン化チューブリン:S3 = 1/400、P3 = 1/2,000、P2 = 1/2、 000、S1 = 1/50,000、1/20,000、1/10,000、1/5,000、1/2,000; 脳組織におけるアセチル化チューブリン:S3 = 1/200、P3 = 1/400、P2 = 1/8,000、S1 = 1/100,000、1/40,000、1/20,000、1/10,000、1/4,000; 肝臓のα-チューブリン:S3 = 1/20、P3 = 1/100、P2 = 1/20、S1 = 1/50,000、1/20,000、1/20,000、1/5,000、1/2,000; 胸腺のα-チューブリン:。 S3 = 1/100、P3 = 1/400、P2 = 1/20、S1 = 1/50,000、1/20,000、1/10,000、1/5,000、1/2,000の組織濃度の希釈)。 - 5%脱脂乳をトリス緩衝生理食塩水(50 mM Tris-HCl pH 7.6;152 mM NaCl)と0.1% Tween 20(TBS-T)で30分以上ブロッキングします。
- メンブレンを一次抗体を含むTBS-T( 材料表を参照)に2時間以上浸漬します。その後、TBS-Tで3分間(3回)メンブレンを洗浄します。
- HRP標識二次抗体( 材料表参照)をTBS-Tで1時間以上標識します。その後、TBS-Tで3分間(3回)メンブレンを洗浄します。
- 強化化学発光試薬でメンブレンを開発します。次に、発光イメージアナライザーで目的のバンドを分析します( 材料表を参照)。
- 画像解析ソフトウェア( 材料表を参照)を使用してタンパク質のバンド強度を定量し、標準曲線に使用した希釈S1サンプルの希釈単位をX軸にプロットし、バンド強度をY軸にプロットして標準曲線を作成します。
- 希釈したフラクションサンプルに対応するタンパク質濃度(単位)を読み取ります。読み取った濃度にサンプル希釈係数を掛けて、各フラクションのタンパク質単位を取得します。各画分の測定単位を総タンパク質単位(P2 + P3 + S3)で割って、パーセンテージを求めます。
- P2、P3、S3画分のタンパク質をウェスタンブロッティングで定量します。まず、10% SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)を使用して、適切に希釈したP2、P3、S3画分、および段階希釈したS1サンプルを検量線として任意の個体からタンパク質を分離します。次に、サンプルをポリフッ化ビニリデンメンブレンにエレクトロブロットします( 材料表を参照)。
2. 各画分におけるチューブリンの特性評価
注:この生化学的方法は、沈降特性によって定義されるチューブリン複合体の3つのグループを提供します。ここでは、これらのフラクションで得られたチューブリン複合体の状態を、複合体およびチューブリン-PTMのサイズに基づいて同定した。このプロトコルのすべてのステップは、低温環境で中断することなく完了しますが、フラクションサンプルがSDSサンプルバッファーに溶解するまで凍結しないでください。
- フィルタートラップアッセイ
- S2 および S3 フラクション(各 500 μL)を 300 kDa 限外ろ過スピンカラムでろ過します( 材料表を参照)。上清全体がろ過され、溶出されたタンパク質がレシーバーチューブに集められ、捕捉されたタンパク質がリザーバーチューブのフィルターに残るまで、2°Cで14,000 × g の遠心分離を行います。
- レシーバーチューブ内の濾液全体(約 500 μL)を新しい 1.5 mL マイクロチューブに変換し、500 μL の 2x SDS サンプルバッファーに溶解します。
- リザーバーチューブのフィルター上の残留物を、ピペッティングして新しい1.5 mLマイクロチューブに移し替え、1,000 μLの1x SDSサンプルバッファーに可溶化します。
- サンプルを100°Cで3分間煮沸します。サンプルが室温まで冷却されたら、サンプルを-20°Cで保管します。
- DM1A(抗α-チューブリン抗体、 材料表参照)によるウェスタンブロッティングにより、チューブリンの量を分析します。
- サイズ排除クロマトグラフィー
- ステップ 1.1.1 で説明したように、1/10 濃度のプロテアーゼおよびホスファターゼ阻害剤を添加したキャリアバッファー(0.1 M MES、pH 6.8、10% グリセロール、1 mM MgSO4、1 mM EGTA、0.1 mM DTT)を調製します。次に、溶液をろ過し、低温環境で保管します。
- 分取液体クロマトグラフィーシステムを備えたゲルろ過クロマトグラフィーカラムを、4°Cのクロマトグラフィーチャンバー( 材料表参照)に調製します。
- カラムにサンプルを注入する前に、180 mL のキャリアバッファーを流してカラムを洗浄します。流速は1mL/minで3時間です。
- 市販の精製ブタチューブリン( 材料表を参照)をコントロールとして、またはマウス脳由来のS3画分(各500 μL)をカラムに注入します。
- 流速1.0 mL/minでキャリアバッファーで溶出します。1.5 mLフラクションを120分間回収します。溶出タンパク質を280 nmの吸光度でモニタリングします。最大圧力は0.3MPa以下にしてください。
- 回収したフラクションをボルテックスした後、1.5 mLのマイクロチューブで50 μLのフラクションを50 μLの2x SDSサンプルバッファーと混合します。すべてのサンプルを100°Cで3分間煮沸します。サンプルが室温まで冷却されたら、サンプルを-20°Cで保管します。
- 抗α-チューブリン抗体であるDM1Aおよび抗β-チューブリン抗体であるKMX-1を用いてウェスタンブロッティングすることにより、チューブリンの量を分析します( 材料表を参照)。
結果
MT分画法によるマウス脳のP2、P3、S3画分中のチューブリンの定量
マウス組織中のチューブリンをMT分画法によりP2、P3、S3画分に分離し、ウェスタンブロッティングにより定量しました(図1A)。100,000 × g で20分間の超遠心分離によってP2画分に残ったMTの沈殿物は、マウス脳の総チューブリンの34.86%±1.68%を占めました。上清(S2)をさらに500,000 × g で60分間遠心分離した。沈殿物(P3画分)と上清(S3画分)が得られ、マウス脳の総チューブリンのそれぞれ56.13%±2.12%または9.01%±0.68%を占めました(図1B)。
この研究で使用した大脳皮質には、神経細胞とグリアなどの非神経細胞が含まれています。マウス脳のニューロンにおけるMTの安定性を選択的に評価するために、中枢神経系および末梢神経系のニューロンにのみ発現するチューブリンサブタイプであるTUBB3を、抗TUBB3抗体であるTuj1によるウェスタンブロッティングにより定量しました。P2、P3、またはS3画分におけるTUBB3の割合は、それぞれ32.65%±2.20%、59.31%±2.61%、または8.04%±0.74%であった。α-チューブリンと有意差はありませんでした(図1B)。これらの結果から、ニューロンとグリア細胞は同様のMT安定性を示すこと、またはニューロンは in vivoでグリア細胞よりもはるかに多くのチューブリンを含んでいることが示唆されました。
各フラクションで回収されたチューブリンの特性
ここで、マウス組織ホモジネートを、異なる重力加速度を有する2段階の超遠心分離により3つのフラクションに分離した。そのため、各画分におけるタンパク質またはそれらの複合体間の沈降係数は異なっていました。100,000 × g 超遠心分離で沈殿させたチューブリンは従来のMTと考えられていましたが、ここで新たに得られたP3フラクションのチューブリンが、P2およびS3フラクションのチューブリンとどのように異なるかを明らかにする必要があります。
S3チューブリンを特徴付けるために、S2(P3 + S3)またはS3画分を限外濾過およびサイズ排除クロマトグラフィーに供した。S3フラクションのチューブリン複合体は、300 kDaの限外ろ過スピンカラムを完全に通過でき、S2フラクションのほぼすべてのチューブリンはフィルターにトラップされました(図2A)。さらに、S3画分中のチューブリン複合体の分子量をサイズ排除クロマトグラフィーにより測定した。S3 チューブリンは 100 kDaに相当する 1 つのピークで溶出し、これは市販の精製チューブリン二量体と同様です(図 2B、C)。さらに、MT分画法によって各フラクションで回収されたα-チューブリンとβチューブリンの割合は等しくなりました(図2D)。実際、αチューブリンとβチューブリンは、生細胞中にモノマーとしてわずかに存在できることが示されている24。しかし、報告された推定kD値(nMオーダー)と、S3フラクション(~11 μM)で回収されたチューブリンの濃度から判断すると、ほとんどのチューブリン(>98%)はα/β-二量体として存在すると考えられています。したがって、S3画分中のチューブリンは、主に可溶性のα/β-チューブリン二量体である。
チューブリンポリマーは、翻訳後修飾(PTM)に基づいて、P2とP3の2つのフラクションに分離されました。これらの画分を区別するために、特異的抗体を用いてウェスタンブロッティングを実施しました。安定なMTのマーカーとなる抗アセチル化α-チューブリン抗体は、P2画分が97.40%±0.52%のアセチル化αチューブリンで有意に濃縮され(図2E)、P3およびS3画分では総α-チューブリンが回収されたことを示しました(図1B)。逆に、不安定なMTを示す抗チロシン化α-チューブリン抗体では、75.43%±2.69%のチロシン化α-チューブリンがP3画分に存在することが明らかになりました(図2F)。これらの知見から、P2 フラクションは安定な MT 内に主にチューブリンを含み、P3 フラクションは不安定な MT 内にチューブリンが含まれていることが確認されました。
凍結およびノコダゾール処理下でのMT安定性の評価
マウスの脳内MTの安定性に対する凍結およびノコダゾール処理の影響を分析し、MTの安定性の一時的な変化がMT分画法によって識別できるかどうかを判断しました。MTは一般的に低温で分解されますが、一部のMTは低温でも安定しています。脳の重量を量った後、液体窒素で凍結し、-80°Cで30分間置いた。一過性の凍結脳とコントロールとしての生の脳をホモジナイズし、P2、P3、およびS3画分に分画しました。次に、3つの画分に含まれるチューブリンの割合をウェスタンブロッティングにより定量した。ホモジナイズ前に脳を凍結すると、P2画分のα-チューブリンは減少し、P3画分の-チューブリンは生の脳のそれと比較して増加しました(図3A)。6-11B1(アセチル化α-チューブリン)または1A2(チロシン化α-チューブリン)を用いたブロットでも、脳凍結によりP2画分におけるα-チューブリンのアセチル化レベルが低下し(図3B)、チロシン化レベルが上昇する(図3C)ことが明らかになった。
ノコダゾールは、β-チューブリンに結合してMT重合を防ぎ、MTの解重合を促進する微小管標的剤(MTA)です。マウスの脳をタキソールフリーMSB(+)でホモジナイズし、10 μMのノコダゾールの有無にかかわらず、4°Cで20分間放置しました。未処理またはノコダゾール処理したホモジネートを 10 μM タキソールに添加し、再ホモジナイズし、P2、P3、および S3 フラクションに分画しました。次に、3つの画分に含まれるチューブリンの割合をウェスタンブロッティングにより定量した。DM1A(α-チューブリン)を用いたブロットでは、P2画分のα-チューブリンが減少し、P3画分のチューブリンがノコダゾール処理で増加する傾向があることが示されました(図3D)。これらの結果は、P2チューブリンが低温またはノコダゾールに応答して不安定化され、P2画分に実験条件に耐性のある頑健なMTが含まれていることを示しています。凍結とは対照的に、ノコダゾールはチューブリンPTMに影響を与えませんでした(図3E、F)。この結果と上記のデータから、PTM分析では検出できないMTの解重合を本手法で評価することができます。
組織中の安定MT、不安定なMT、遊離チューブリンの比率の比較
MTの安定性は、組織内の細胞の増殖能力に応じて、組織によって異なります。特に、安定なMTは、他の組織と比較して、主に非増殖性ニューロンで構成される神経系に多く存在します4。開発したMT分画法が様々な組織間でMT安定性の違いを識別する能力を評価するために、マウスの肝臓と胸腺を分画し、各分画で回収されたチューブリンを定量しました。その結果、脳は他の組織と比較してP2チューブリンの濃度が有意に高く、P3チューブリンは増殖細胞を含む組織に顕著に富んでいることが明らかになりました(図4)。さらに、6-11B1および1A2抗体を用いたウェスタンブロッティングにより、神経系におけるMT安定性が高いことが確認されました。チューブリンPTMの明確な分布パターンは、神経系に特異的に見られるP2チューブリンが安定なMTに由来することを明確に示しています(図4)。これらの知見は、P2フラクションとP3フラクションがそれぞれ安定MTと不安定なMTに対応するという考えをさらに裏付けています。

図1:MT分画法を用いたマウス組織中のチューブリンの定量。 (A)組織のMT分画法の概要。組織中の安定なMT(P2分画)、不安定なMT(P3分画)、遊離チューブリン(S3画分)は、調製中のMT重合および解重合を抑制する条件下で、2ステップの超遠心分離により分離できます。(B)マウス皮質のMTは、従来の100,000 × g の超遠 心分離とそれに続く500,000 × g の超遠心分離によって沈殿させた。次に、P2、P3、およびS3画分に分離されたチューブリンを、DM1A(α-チューブリン)および抗Tuj1(TUBB3)によるウェスタンブロッティングにより定量しました。総画分(P2 + P3 + S3)に対する各画分(P2、P3、または S3)中のタンパク質の割合は、「プロトコル」セクションに記載されているように計算しました(平均 ± SD、n = 4)。この図は、Hagita et al.23 から修正したものである。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:MT分画法により、マウス大脳皮質における安定なMT、不安定なMT、および遊離チューブリンの分離が可能になります。 (A)S2またはS3フラクション(インプット)は、300 kDaの限外ろ過スピンカラムを用いたフィルタートラップアッセイで分析しました。濾過(レシーバー)およびトラップ(リザーバー)によって得られたチューブリンを、DM1A(α-チューブリン)によるウェスタンブロッティングにより定量しました。(B)精製ブタチューブリンをMT分画法にかけたところ、ほとんどがS3分画に回収されることがわかった。(C)S3画分中のチューブリンの分子サイズ。S3画分は、ゲル濾過クロマトグラフィーカラムを用いたサイズ排除クロマトグラフィーにより分離した。各フラクションのタンパク質は、DM1A(α-チューブリン)およびKMX-1(β-チューブリン)によるウェスタンブロッティングによって定量しました。理論上の分子量はパネルの上部に示されています。(D)各画分におけるα-チューブリンとβ-チューブリンの割合は等しい。P2、P3、およびS3画分に分離されたチューブリンは、KMX-1(β-チューブリン)によるウェスタンブロッティングによって定量されました。全画分の合計に対する各画分におけるα-チューブリンおよびβ-チューブリンの割合の定量化(平均±SD、n = 4)。統計解析はスチューデントのt検定によって行われた。(E、F)P2、P3、およびS3フラクションにおけるα-チューブリンの修飾は、6-11B1(アセチル化α-チューブリン:E)および1A2(チロシン化α-チューブリン:F)によるウェスタンブロッティングによって検証されました。 全画分に対する各画分中のチロシン化またはアセチル化α-チューブリンの割合の定量化(平均 ± SD、n = 4)。(A-C)はHagitaら23から改変された。この図の拡大版をご覧になるには、ここをクリックしてください。
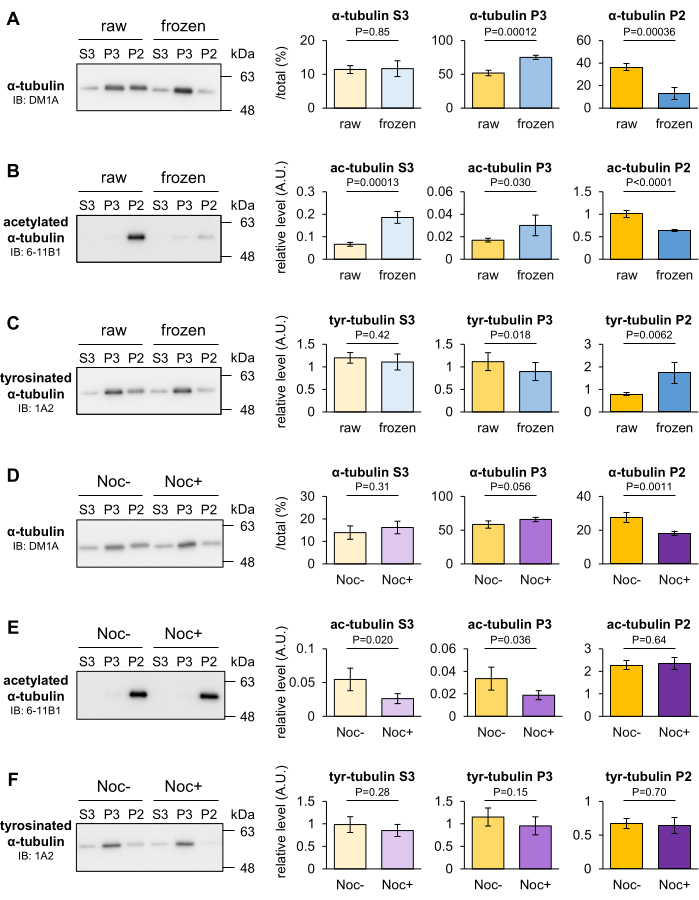
図3:凍結またはMTAによって誘発されるMT解重合の評価。 (A-C)-80°Cで30分間凍結した後のMTの安定性を評価しました。生脳および凍結脳の3つの画分に含まれるチューブリンの割合を、DM1A(α-チューブリン:A)、1A2(チロシン化α-チューブリン:B)、および6-11B1(アセチル化α-チューブリン:C)によるウェスタンブロッティングによって定量しました。 (D-F) MT安定性に対するノコダゾールの効果を評価した。未処理または処理された脳のノコダゾールの3つの画分に含まれるチューブリンの割合を、DM1A(α-チューブリン:D)、1A2(チロシン化α-チューブリン:E)、および6-11B1(アセチル化α-チューブリン:F)によるウェスタンブロッティングによって定量化しました。 チロシン化(B、E)またはアセチル化(C、F)の代表的な相対レベルは、総α-チューブリンの量(A、D)(± SD、n = 4 を意味します)。統計解析はスチューデントのt検定によって行われた。この図の拡大版をご覧になるには、ここをクリックしてください。
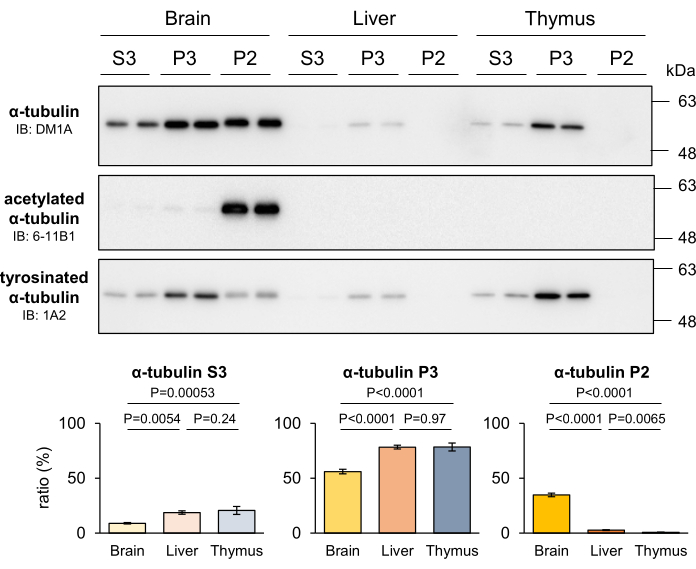
図4:マウスの脳、肝臓、胸腺における安定MT、不安定なMT、遊離チューブリンの割合。 マウスの脳、肝臓、胸腺を解剖し、MT分画法にかけた。各フラクションに分離されたタンパク質は、DM1A(α-チューブリン)、6-11B1(アセチル化α-チューブリン)、および1A2(チロシン化α-チューブリン)によるウェスタンブロッティングによって定量されました。総画分(P2 + P3 + S3)に対する各画分(P2、P3、または S3)中のタンパク質の割合は、「プロトコル」セクションに記載されているように計算しました(平均 ± SD、n = 4)。統計分析は、一元配置分散分析とそれに続くテューキーの事後検定によって実行されました。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
生体由来の組織中のチューブリンの状態を調べる際の最も重要なタスクは、調製中の偶発的なMT重合または解重合を防ぐことです。サンプル中のMTの安定性は、MSB中のタキソールの濃度、緩衝液に対する組織量の割合、組織除去からホモジナイズおよび遠心分離までのプロセス中の温度などの要因の影響を受けます。したがって、20倍の量のホモジネートでマウス組織を分析するためのプロトコルの各ステップで条件を最適化しました。高濃度のタキソールは、冷蔵条件下でも in vitroでMT重合を誘発することができる25。チューブリン濃度が大きく異なる組織を分析したり、プロトコルを大幅に変更したりする場合は、各オペレーターが実験の特定の目的に従ってステップを最適化する必要があります。
実施された研究では、500,000 × g20 での超遠心分離を使用して、従来の「可溶性画分」から P3 と呼ばれる新しい MT の集団が得られました。ローターのKファクター、遠心力、遠心分離の持続時間などの要因に基づく理論計算は、S3画分に存在するチューブリンが6Sチューブリン二量体を表す可能性が最も高いことを示唆しています。逆に、P3画分のチューブリンは、P2画分に見られるものと比較して長さが短いMTに対応する可能性があります。この観察結果は、MT26の部分的な崩壊につながるホモジナイズ前の組織凍結により、P3画分内のチューブリンが有意に増加し、同時にP2画分が減少することを示す結果と一致しています(図3A)。さらに、チューブリンPTMの分析とさまざまなMAPの結合特性は、P2またはP3画分にそれぞれ安定または不安定なMTが含まれていることを示しています。例えば、主にニューロンに見られる安定なMTに特異的な特定のMAPは、P2フラクション23にのみ存在していた。したがって、P3フラクションは、P2フラクションのMTと比較して、より動的で不安定なMTで構成されていることを示唆することが妥当です。
この分析法の根底にある理論によると、MTの安定化または遠心分離に関与する不適切な実験条件は、分画不良をもたらす可能性があります。例えば、タキソールの濃度が低いとP2チューブリンがわずかに減少し、過剰なタキソールは調製中のMT形成によりP2チューブリンを増加させる23。同様に、組織やサンプルを不適切に加熱すると、MTが過重合し、タウが分解または断片化する可能性があります23。さらに、P3フラクションとS3フラクションを分離するには遠心条件が重要であり、重力加速度がわずかに低下すると、P3フラクションの回収率が大幅に低下します。したがって、異常な分画が観察された場合は、プロトコルの手順に厳密に従うことをお勧めします。
この簡便な分画法は、組織中の安定MT、不安定なMT、遊離二量体におけるチューブリンの割合の分析に広く適用できます。この方法には、チューブリンPTMの定量では明らかにならないチューブリンの状態の微妙な変化を検出できるため、いくつかの利点があります。 MTの安定性を分析することは、特に大規模で複雑な神経細胞におけるMTの生理学的重要性を理解し、MT調節不全に関連する障害を調査するために重要です。例えば、チューブリンやMAP遺伝子の変異や機能不全は、神経発達障害や神経変性疾患に関連している27,28。アルツハイマー病では、おそらく罹患したニューロンのタウタンパク質の機能喪失により、MTが減少することが知られています15,29,30,31,32,33。MTの安定性を調節し、細胞分裂を阻害するMTAは、神経疾患の潜在的な治療法として提案されています13,34。このユニークなMT分画法を用いて、疾患モデル動物におけるMTとMAPの安定性と挙動を解析することは、タウ関連認知症の病態解明や新たな治療標的の特定に大きく貢献します。
開示事項
著者には、報告すべき利益相反はありません。
謝辞
この活動の一部は、JSTの科学技術イノベーション創出に向けた大学フェローシップの設立(A.HT;JPMJFS2145), JST SPRING (A.HT.;JPMJSP2129)、科学研究費補助金特別研究員奨励費(A.HT;23KJ2078)、科学研究費助成事業基盤研究(B)日本学術振興会科学研究費補助金(22H02946)、文部科学省新学術領域研究「脳蛋白の老化と認知症制御」(26117004)、上原記念財団上原特別研究員(202020027)が奨励された。著者らは、競合する金銭的利益がないことを宣言します。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 ML TUBE CASE OF 500 | Beckman Coulter | 357448 | |
| 1A2 | Sigma-Aldrich | T9028 | 1:5,000 dilution |
| 2-(N-morpholino)ethanesulfonic acid (MES) | Nacalai Tesque | 02442-44 | |
| 300 kDa ultrafiltration spin column | Aproscience | PT-1013 | |
| 6-11B1 | Sigma-Aldrich | T7451 | 1:5,000 dilution |
| ÄKTAprime plus | Cytiva | 11001313 | |
| anti-mouse IgG | Jackson ImmunoResearch | 115-035-146 | 1:5,000 dilution |
| antipain | Peptide Institute Inc. | 4062 | |
| aprotinin | Nacalai Tesque | 03346-84 | |
| Chemi-Lumi One L | Nacalai Tesque | 07880-54 | |
| Corning bottle-top vacuum filter system | Corning | 430758 | 0.22µm 33.2cm² Nitrocellulose membrane |
| DIFP | Sigma-Aldrich | 55-91-4 | |
| DIGITAL HOMOGENIZER HK-1 | AS ONE | 1-2050-11 | |
| DM1A | Sigma-Aldrich | T9026 | 1:5,000 dilution |
| DTT | Nacalai Tesque | 14128-46 | |
| EGTA | Nacalai Tesque | 37346-05 | |
| FluoroTrans W 3.3 Meter Roll | Pall Corporation | BSP0161 | |
| glycerol | Nacalai Tesque | 17018-25 | |
| GTP | Nacalai Tesque | 17450-61 | |
| HIGH SPEED REFRIGERATIOED MICRO CENTRIFUGE Kitman | TOMY | KITMAN-24 | |
| HiLoad 16/600 Superdex 200 pg column | Cytiva | 28-9893-35 | |
| Image Gauge Software | FUJIFILUM Wako Pure Chemical Corporation | ||
| ImmunoStar LD | FUJIFILUM Wako Pure Chemical Corporation | 292-69903 | |
| KMX-1 | Millipore | MAB3408 | 1:5,000 dilution |
| LAS-4000 luminescent image analyzer | FUJIFILUM Wako Pure Chemical Corporation | ||
| leupeptin | Peptide Institute Inc. | 43449-62 | |
| MgSO4 | Nacalai Tesque | 21003-75 | |
| Na3VO4 | Nacalai Tesque | 32013-92 | |
| NaF | Nacalai Tesque | 31420-82 | |
| okadaic acid | LC Laboratories | O-2220 | |
| OPTIMA MAX-XP | Beckman Coulter | 393315 | |
| pepstatin | Nacalai Tesque | 26436-52 | |
| PMSF | Nacalai Tesque | 27327-81 | |
| Polycarbonate Centrifuge Tubes for TLA120.2 | Beckman Coulter | 343778 | |
| Protease inhibitor cocktail (cOmplete™, EDTA-free) | Roche | 11873580001 | |
| Purified tubulin | Cytoskeleton | T240 | |
| QSONICA Q55 | QSonica | Q55 | |
| Taxol | LC Laboratories | P-9600 | |
| TLA-120.2 rotor | Beckman Coulter | 357656 | |
| TLA-55 rotor | Beckman Coulter | 366725 | |
| TLCK | Nacalai Tesque | 34219-94 | |
| Triton X-100 | Nacalai Tesque | 12967-45 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
参考文献
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Conde, C., Caceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nature Reviews Neuroscience. 10 (5), 319-332 (2009).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Challacombe, J. F., Snow, D. M., Letourneau, P. C. Dynamic microtubule ends are required for growth cone turning to avoid an inhibitory guidance cue. Journal of Neuroscience. 17 (9), 3085-3095 (1997).
- Kapitein, L. C., Hoogenraad, C. C. Building the neuronal microtubule cytoskeleton. Neuron. 87 (3), 492-506 (2015).
- Leo, L., et al. Vertebrate fidgetin restrains axonal growth by severing labile domains of microtubules. Cell Reports. 12 (11), 1723-1730 (2015).
- Janke, C. The tubulin code: molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. International Journal of Molecular Sciences. 18 (10), 2207 (2017).
- Baas, P. W., Black, M. M. Individual microtubules in the axon consist of domains that differ in both composition and stability. Journal of Cell Biology. 111 (2), 495-509 (1990).
- Cartelli, D., et al. Microtubule alterations occur early in experimental parkinsonism and the microtubule stabilizer epothilone D is neuroprotective. Scientific Reports. 3, 1837 (2013).
- Zhang, B., et al. Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proceedings of the National Academy of Sciences of the United States of America. 102 (1), 227-231 (2005).
- Zhang, F., et al. Post-translational modifications of alpha-tubulin in Alzheimer disease. Translational Neurodegeneration. 4, 9 (2015).
- Miyasaka, T., et al. Curcumin improves tau-induced neuronal dysfunction of nematodes. Neurobiology of Aging. 39, 69-81 (2016).
- Fujiwara, H., et al. Inhibition of microtubule assembly competent tubulin synthesis leads to accumulation of phosphorylated tau in neuronal cell bodies. Biochemical and Biophysical Research Communications. 521 (3), 779-785 (2020).
- Vielkind, U., Swierenga, S. H. A simple fixation procedure for immunofluorescent detection of different cytoskeletal components within the same cell. Histochemistry. 91 (1), 81-88 (1989).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. Journal of Cell Biology. 109 (3), 1173-1184 (1989).
- Brown, A., Li, Y., Slaughter, T., Black, M. M. Composite microtubules of the axon: quantitative analysis of tyrosinated and acetylated tubulin along individual axonal microtubules. Journal of Cell Science. 104 (2), 339-352 (1993).
- Black, M. M., Slaughter, T., Moshiach, S., Obrocka, M., Fischer, I. Tau is enriched on dynamic microtubules in the distal region of growing axons. Journal of Neuroscience. 16 (11), 3601-3619 (1996).
- Caron, J. M., Jones, A. L., Kirschner, M. W. Autoregulation of tubulin synthesis in hepatocytes and fibroblasts. Journal of Cell Biology. 101 (5), 1763-1772 (1985).
- Merrick, S. E., Trojanowski, J. Q., Lee, V. M. Selective destruction of stable microtubules and axons by inhibitors of protein serine/threonine phosphatases in cultured human neurons. Journal of Neuroscience. 17 (15), 5726-5737 (1997).
- Miyasaka, T., Sato, S., Tatebayashi, Y., Takashima, A. Microtubule destruction induces tau liberation and its subsequent phosphorylation. FEBS Letters. 584 (14), 3227-3232 (2010).
- Hagita, A., et al. Quantitative fractionation of tissue microtubules with distinct biochemical properties reflecting their stability and lability. Biochemical and Biophysical Research Communications. 560, 186-191 (2021).
- Montecinos-Franjola, F., Chaturvedi, S. K., Schuck, P., Sackett, D. L. All tubulins are not alike: Heterodimer dissociation differs among different biological sources. Journal of Biological Chemistry. 294 (26), 10315-10324 (2019).
- Vallee, R. B. A taxol-dependent procedure for the isolation of microtubules and microtubule-associated proteins (MAPs). Journal of Cell Biology. 92 (2), 435-442 (1982).
- Bartolo, M. E., Carter, J. V. Effect of microtubule stabilization on the freezing tolerance of mesophyll cells of spinach. Plant Physiology. 97 (1), 182-187 (1991).
- Strang, K. H., Golde, T. E., Giasson, B. I. MAPT mutations, tauopathy, and mechanisms of neurodegeneration. Laboratory Investigation. 99 (7), 912-928 (2019).
- Fourel, G., Boscheron, C. Tubulin mutations in neurodevelopmental disorders as a tool to decipher microtubule function. FEBS Letters. 594 (21), 3409-3438 (2020).
- Terry, R. D., Gonatas, N. K., Weiss, M. Ultrastructural studies in Alzheimer's presenile dementia. The American Journal of Pathology. 44 (2), 269-297 (1964).
- Yoshida, H., Ihara, Y. Tau in paired helical filaments is functionally distinct from fetal tau: assembly incompetence of paired helical filament-tau. Journal of Neurochemistry. 61 (3), 1183-1186 (1993).
- Cash, A. D., et al. Microtubule reduction in Alzheimer's disease and aging is independent of tau filament formation. The American Journal of Pathology. 162 (5), 1623-1627 (2003).
- Hempen, B., Brion, J. P. Reduction of acetylated alpha-tubulin immunoreactivity in neurofibrillary tangle-bearing neurons in Alzheimer's disease. Journal of Neuropathology and Experimental Neurology. 55 (9), 964-972 (1996).
- Miyasaka, T., et al. Imbalanced expression of tau and tubulin induces neuronal dysfunction in C. elegans models of tauopathy. Frontiers in Neuroscience. 12, 415 (2018).
- Boiarska, Z., Passarella, D. Microtubule-targeting agents and neurodegeneration. Drug Discovery Today. 26 (2), 604-615 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved