Method Article
마우스 조직에서 안정적인 미세소관, 불안정한 미세소관 및 유리 튜불린을 분리하기 위한 정량적 미세소관 분획 기술
요약
튜불린 중합체인 미세소관은 진핵 세포에서 세포골격 구성 요소로서 중요한 역할을 하며 동적 불안정성으로 알려져 있습니다. 본 연구는 다양한 마우스 조직에서 미세소관의 안정성을 평가하기 위해 미세소관을 분류하여 안정 미세소관, 불안정한 미세소관, 유리 튜불린으로 분리하는 방법을 개발하였다.
초록
α/β-튜불린 이량체로 구성된 미세소관은 진핵 세포에서 세포골격의 중요한 구성 요소입니다. 이러한 튜브형 중합체는 튜불린 헤테로다이머 소단위체가 반복적인 중합 및 해중합을 겪을 때 동적 불안정성을 나타냅니다. 튜불린 번역 후 변형(post-translational modification) 및 미세소관 관련 단백질을 통해 달성되는 미세소관 안정성 및 역학의 정밀한 제어는 다양한 세포 기능에 필수적입니다. 미세소관의 기능 장애는 신경 퇴행성 질환을 포함한 발병기전과 밀접한 관련이 있습니다. 진행 중인 연구는 안정성을 조절하는 미세소관 표적 치료제에 중점을 두고 있으며, 이러한 질병 및 암에 대한 잠재적인 치료 옵션을 제공합니다. 따라서 미세소관의 동적 상태를 이해하는 것은 질병 진행 및 치료 효과를 평가하는 데 매우 중요합니다.
전통적으로 미세소관 역학은 튜불린의 번역 후 변형을 표적으로 하는 항체를 사용하여 거친 분획 또는 면역분석을 통해 시험관 내 또는 배양된 세포에서 평가되었습니다. 그러나 이러한 절차를 사용하여 조직의 튜불린 상태를 정확하게 분석하는 것은 어려운 일입니다. 이 연구에서는 마우스 조직에서 안정적인 미세소관, 불안정한 미세소관 및 유리 튜불린을 분리하는 간단하고 혁신적인 미세소관 분획 방법을 개발했습니다.
이 절차에는 19:1 부피 비율로 미세소관 안정화 완충액에서 절개된 마우스 조직을 균질화하는 작업이 포함되었습니다. 그런 다음 균질액을 초기 느린 원심분리(2,400× g)에 이어 2단계 초원심분리 공정을 통해 분획하여 파편을 제거했습니다. 제1 초원심분리 단계(100,000 × g)는 안정한 미세소관을 침전시킨 반면, 생성된 상층액은 불안정한 미세소관 및 용해성 튜불린 이량체를 분획하기 위해 제2 초원심분리 단계(500,000 × g)를 거쳤다. 이 방법은 쥐의 뇌에서 안정적이거나 불안정한 미세소관을 구성하는 튜불린의 비율을 측정했습니다. 또한, 구성 세포의 증식 능력과 상관 관계가 있는 미세소관 안정성의 뚜렷한 조직 변이가 관찰되었습니다. 이러한 발견은 생리학적 및 병리학적 조건에서 미세소관 안정성을 분석하기 위한 이 새로운 방법의 상당한 잠재력을 강조합니다.
서문
미세소관(MT)은 α/β-튜불린 헤테로다이머 소단위로 구성된 프로토필라멘트로 구성된 길쭉한 관형 구조입니다. 이들은 세포 분열, 운동성, 형태 유지, 세포 내 수송과 같은 다양한 세포 과정에서 필수적인 역할을 하며, 진핵생물 세포골격의 필수 구성 요소가 된다1. α-튜불린 소단위체가 노출되는 MT의 마이너스 엔드는 비교적 안정적인 반면, β-튜불린 서브유닛이 노출되는 플러스 엔드는 동적 해중합 및 중합을 거친다2. 동적 불안정성(dynamic instability)이라고 하는 플러스 말단(plus-end)에서의 튜불린 이량체 첨가 및 해리의 연속적인 순환은 구조와 재앙의 반복적인 과정을 초래한다3. MT는 안정적 영역과 불안정한 영역을 포함하여 동적 불안정성의 국소적 변형이 있는 초점 영역을 나타낸다4.
MT의 동적 불안정성을 정밀하게 제어하는 것은 특히 복잡한 형태를 특징으로 하는 뉴런에서 수많은 세포 기능에 매우 중요합니다. MT의 적응성과 내구성은 신경 세포의 발달과 적절한 기능에 중요한 역할을 합니다 5,6,7. MT의 동적 불안정성은 아세틸화, 인산화, 팔미토일화, 탈티로시닝, 델타 2, 폴리글루타민 산화 및 폴리글리실화와 같은 튜불린의 다양한 번역 후 변형(PTM)과 관련이 있는 것으로 밝혀졌습니다. 또한, 미세소관 관련 단백질(microtubule-associated protein, MAP)의 결합은 조절 메커니즘역할을 한다 8. 아세틸화를 제외한 PTM은 주로 MT의 외부 표면에 위치한 튜불린 카르복시 말단 영역에서 발생합니다. 이러한 수정은 MT에 다양한 표면 조건을 만들어 MAP과의 상호 작용에 영향을 미치고 궁극적으로 MT 안정성을 좌우합니다9. α-튜불린에 카르복시 말단 티로신 잔류물이 존재한다는 것은 동적 MT를 나타내며, 이는 유리 튜불린 풀로 빠르게 대체됩니다. 반대로, 카르복시 말단의 탈티로신화와 Lys40의 아세틸화는 동적 불안정성이 감소된 안정적인 MT를 의미합니다 9,10.
튜불린의 PTM은 MT 5,7,11,12,13,14,15의 역학 및 안정성을 평가하기 위한 실험에 광범위하게 사용되었습니다. 예를 들어, 세포 배양 연구에서 튜불린은 유리 튜불린 풀과 MT 풀의 두 가지 풀로 분리할 수 있습니다. 이는 나머지 MTs 15,16,17,18,19를 고정하기 전에 세포 투과화를 통해 유리 튜불린을 방출함으로써 달성됩니다. 생화학적 방법은 MT를 재앙으로부터 보호하는 화학적 MT 안정제의 사용을 포함하며, 원심분리를 통해 MT와 유리 튜불린의 분리를 가능하게 한다20,21,22. 그러나 이러한 절차는 안정적인 MT와 덜 안정적인(불안정한) MT를 구별하지 못하므로 뇌와 같은 조직에서 MT 또는 용해성 튜불린을 정량화하는 것이 불가능합니다. 결과적으로, 생리학적 및 병리학적 조건에서 유기체의 MT 안정성을 평가하는 것은 어려운 것으로 입증되었습니다. 이러한 실험적 한계를 해결하기 위해 마우스 조직23에서 MT와 유리 튜불린을 정밀하게 분리하는 새로운 기술을 개발했습니다.
이 독특한 MT 분획 방법은 조직에서 튜불린 상태를 유지하는 조건에서의 조직 균질화와 안정적인 MT, 불안정한 MT 및 유리 튜불린을 분리하기 위한 2단계 원심분리를 포함합니다. 이 간단한 절차는 살아있는 유기체의 MT 및 MAP에 대한 기초 연구, MT 안정성과 관련된 건강 및 질병의 생리학적 및 병리학적 분석, MT를 표적으로 하는 약물 및 기타 치료제 개발을 포함한 광범위한 연구에 적용할 수 있습니다.
프로토콜
1. MT 분획법
참고: 본 연구에서 수행된 모든 실험은 도시샤 대학 동물 윤리 위원회의 승인을 받았습니다. C57BL/6J 생후 3-4개월 된 남녀 마우스를 여기에 사용하였다. 이 프로토콜에서 절개된 조직(예: 뇌, 간 또는 흉선)은 해중합뿐만 아니라 MT의 재중합을 방지하는 농도로 탁솔(MT 안정제)을 함유한 얼음처럼 차가운 미세소관 안정화 완충액(MSB)에서 즉시 균질화되었습니다. 균질액은 2단계 초원심분리 공정에 의해 3개의 분획으로 분리되었습니다(그림 1). 이 프로토콜의 모든 단계는 저온 환경에서 중단 없이 완료되었으며, 조직 및 분획은 소듐 도데실 설페이트(SDS)-샘플 완충액에 용해될 때까지 동결되지 않았습니다.
- MSB 및 마이크로튜브의 준비
- MSB를 제조하려면 다음 시약을 혼합하십시오. 0.1 M 2-(N-morpholino)ethanesulfonic acid (MES), pH 6.8 (KOH에 의해 중화됨), 10 % 글리세롤, 0.1 mM DTT, 1 mM MgSO 4, 1 mM EGTA, 0.5 % Triton X-100, 인산 분해 효소 억제제 (1 mM NaF, 1 mM β 글리세로 인산염, 1 mM Na3VO 4, 0.5 μM 오카다산), 1x 프로테아제 억제제 칵테일, 및 프로테아제 억제제(0.1mM PMSF, 0.1mM DIFP, 1μg/mL 펩스타틴, 1μg/mL 항통증제, 10μg/mL 아프로티닌, 10μg/mL 류펩틴, 50μg/mL TLCK)(재료 표 참조)로 표시되며 MSB(-)로 표시됩니다.
- 조직 해부 직전에 10μM 탁솔과 2mM GTP( 재료 표 참조)를 MSB(-)에 첨가합니다. 이 버퍼는 MSB(+)로 표시됩니다. 사용 당일에 완충제를 준비하여 얼음 위에 보관하십시오.
- 샘플링을 위해 마이크로튜브를 준비합니다. 균질한 보관을 위한 빈 2.0 mL 마이크로튜브; 상층액1(S1) 용해물, 침전물2(P2) 시료 및 침전물3(P3) 시료 보관을 위한 빈 1.5mL 마이크로튜브; 절개된 조직 보관을 위해 1mL의 얼음처럼 차가운 인산염 완충 식염수(PBS)가 포함된 1.5mL 마이크로튜브; S1.5 샘플 및 S1 (S3) 샘플 보관을 위해 200 μL의 2x SDS- 샘플 버퍼 (0.16 M Tris pH 6.8, 20 % 글리세롤, 2 % 2- 메르 캅토 에탄올, 4 % SDS)가 포함 된 1 mL 마이크로 튜브 3 mL 마이크로 튜브; TLA55 및 TLA120.2 원심분리기 로터용 원심분리 마이크로튜브( 재료 표 참조). 모든 튜브에 라벨을 붙이고 얼음 위에 놓습니다.
- 마우스 조직 균질화
- 조직 해부를 위해 냉장 테이블을 준비합니다. 먼저 상자에 으깬 얼음을 채우고 두 개의 페트리 접시를 얼음 위에 놓고 하나는 안쪽이 위로, 다른 하나는 바깥쪽이 위로 향하게 합니다. 얼음처럼 차가운 PBS를 한 접시에 채워 일시적인 세척 및 절개된 조직의 보관을 위해 합니다. PBS를 적신 여과지를 뒤집어 다른 접시에 놓습니다.
- 쥐를 희생하려면 부토르파놀, 미다졸람, 메데토미딘의 혼합 마취제로 심부 마취 하에 자궁경부 탈구를 수행합니다. 그런 다음 즉시 뇌, 간 또는 흉선과 같은 조직을 해부하고 페트리 접시에 얼음처럼 차가운 PBS로 씻습니다.
참고: 이 방법으로 모든 유형의 연조직을 분석할 수 있습니다. 그러나, 조직의 크기는 이용된 균질화기의 추천한 양 범위에 의해 제한됩니다. 예를 들어, 2mL 용량의 균질기를 사용하는 경우 50-100mg의 조직을 권장합니다. - 절개된 조직 보관을 위해 PBS로 채워진 1.5mL 마이크로튜브의 무게를 측정한 후 마이크로튜브 내부에 조직을 잘라내어 보관하고 각 마이크로튜브의 무게를 다시 잰다. 각 조직의 습윤 중량은 조직을 추가하기 전과 후의 튜브 무게를 빼서 계산할 수 있습니다.
- 냉각된 균질화기로 얼음처럼 차가운 MSB(+)에서 조직을 즉시 균질화합니다( 재료 표 참조). MSB(+)의 부피는 조직 습윤중량(mg)의 19배(μL)였다. 조직 조각이 사라질 때까지 20번의 스트로크로 균질화를 수행합니다.
참고: 예를 들어, 1,900μL의 MSB(+)는 100mg의 조직에 사용됩니다. 첨가할 MSB(+)의 부피는 분석된 티슈 조각의 각 습식 중량에 대해 조정되어야 하므로 각 티슈 조각의 무게를 정확하게 계량해야 합니다.
- 마우스 조직 균질물의 원심분리
- 파스퇴르 피펫이 있는 균질액 전체를 2mL 마이크로튜브로 옮기고 2°C에서 3분 동안 2,400× g 의 원심분리기로 이동하여 침전을 통해 파편을 제거합니다.
- 전체 상층액(S1 분획)을 새로운 1.5mL 마이크로튜브와 와류로 옮깁니다. 그런 다음, 200μL의 S1 분획을 원심분리 마이크로튜브에 분취하고, 2°C에서 20분 동안 TLA-55 로터를 사용하여 100,000× g 에서 원심분리하여 침전물로서 상대적으로 큰 분자량 단백질을 얻었다(P2 fraction).
참고: 초원심분리 단계를 거친 샘플의 부피는 원심분리 반경과 분자의 침전 효율에 영향을 미칩니다. 이 단계 후에는 부정확한 분획을 방지하기 위해 시료 부피를 200μL 이하로 유지하십시오. - 2°C에서 60분 동안 TLA-120.2 로터를 사용하여 500,000× g 에서 생성된 모든 상층액(S2 분획)을 추가로 원심분리하여 침전물(P3 분획)의 불용성 단백질 복합체를 상층액(S3 분획)의 가용성 단백질로부터 분리합니다.
- 400 μL의 1x SDS 샘플 완충액 (0.08 M Tris pH 6.8, 10 % 글리세롤, 1 % 2- 메르 캅토 에탄올, 2 % SDS)을 P2 및 P3 분획 튜브에 첨가하고 침전물을 용해시키기 위해 짧게 초음파 처리한다. 이 분획 샘플을 빈 1.5mL 마이크로튜브로 옮깁니다.
- 총 S3 분획을 2x SDS 샘플 완충액의 200μL에 용해시킵니다.
- 나머지 S1 분획을 동일한 부피의 2x SDS 샘플 완충액과 혼합하여 웨스턴 블로팅의 표준 곡선으로 사용합니다.
- 이 모든 샘플을 100°C에서 3분 동안 끓입니다. 샘플을 실온으로 냉각한 후 샘플을 -20°C에서 보관합니다.
- 각 분획의 단백질 정량화
- Western blotting을 통해 P2, P3 및 S3 분획의 단백질을 정량화합니다. 첫째로, 10% SDS polyacrylamide 젤 전기 이동법 (SDS-PAGE)를 제대로 묽게 한 P2, P3 및 S3 분획에서 단백질을 분리하고, 표준 곡선으로 어떤 개인든지에서 연속적으로 묽게 한 S1 표본을 이용하십시오. 그런 다음 샘플을 폴리비닐리덴 플루오라이드 멤브레인에 전기로 블롯합니다( 재료 표 참조).
참고: 각 분획의 희석 비율은 객관적인 단백질의 농도와 항체의 반응성에 따라 달라집니다. (예: 뇌 조직의 α-튜불린, TUBB3, β-튜브 및 티로신화 튜불린: S3 = 1/400, P3 = 1/2,000, P2 = 1/2,000, P2 = 1/2,, 000, S1 = 1/50,000, 1/20,000, 1/10,000, 1/5,000, 1/2,000; 뇌 조직의 아세틸화 튜불린: S3 = 1/200, P3 = 1/400, P2 = 1/8,000, S1 = 1/100,000, 1/40,000, 1/20,000, 1/10,000, 1/4,000; 간의 α-튜불린: S3 = 1/20, P3 = 1/100, P2 = 1/20, S1 = 1/50,000, 1/20,000, 1/10,000, 1/5,000, 1/2,000; 흉선의 α-튜불린: S3 = 1/100, P3 = 1/400, P2 = 1/20, S1 = 1/50,000, 1/20,000, 1/10,000, 1/5,000, 1/2,000 조직 농도 희석). - Tris-buffered 식염수 (50mM Tris-HCl pH 7.6, 152 mM NaCl)에 0.1 % Tween 20 (TBS-T)로 30 분 이상 30 % 탈지유로 멤브레인을 차단합니다.
- 멤브레인을 1차 항체가 포함된 TBS-T( 재료 표 참조)에 2시간 이상 담그십시오. 그 후 TBS-T로 멤브레인을 3분(3회) 세척합니다.
- HRP 접합 2차 항체( 재료 표 참조)를 사용하여 TBS-T에서 1시간 이상 1차 항체를 라벨링합니다. 그 후 TBS-T로 멤브레인을 3분(3회) 세척합니다.
- Enhanced Chemiluminescence 시약으로 멤브레인을 개발합니다. 그런 다음 발광 이미지 분석기로 관심 대역을 분석합니다( 재료 표 참조).
- 이미지 분석 소프트웨어( 재료 표 참조)를 사용하여 단백질 띠 강도를 정량화하고 표준 곡선에 사용된 희석된 S1 샘플의 희석 단위를 X축을 따라 플로팅하고 대역 강도를 Y축을 따라 플로팅하여 표준 곡선을 생성합니다.
- 희석된 분획 샘플에 해당하는 단백질 농도(단위)를 판독합니다. 판독한 농도에 샘플 희석 인자를 곱하여 각 분획의 단백질 단위를 얻습니다. 각 분획의 측정된 단위를 총 단백질 단위(P2 + P3 + S3)로 나누어 백분율을 구합니다.
- Western blotting을 통해 P2, P3 및 S3 분획의 단백질을 정량화합니다. 첫째로, 10% SDS polyacrylamide 젤 전기 이동법 (SDS-PAGE)를 제대로 묽게 한 P2, P3 및 S3 분획에서 단백질을 분리하고, 표준 곡선으로 어떤 개인든지에서 연속적으로 묽게 한 S1 표본을 이용하십시오. 그런 다음 샘플을 폴리비닐리덴 플루오라이드 멤브레인에 전기로 블롯합니다( 재료 표 참조).
2. 각 분획에서 튜불린의 특성 평가
참고: 이 생화학적 방법은 침강 특성에 의해 정의되는 세 그룹의 튜불린 복합체를 제공합니다. 여기서, 이들 분획물에서 얻어진 튜불린 복합체의 상태는 복합체의 크기 및 튜불린-PTM에 기초하여 확인하였다. 저온 환경에서 중단 없이 이 프로토콜의 모든 단계를 완료하되 분획 샘플이 SDS 샘플 버퍼에 용해될 때까지 동결하지 마십시오.
- 필터 트랩 분석
- 300kDa 한외여과 스핀 컬럼을 사용하여 S2 및 S3 분획(각각 500μL)을 여과합니다( 재료 표 참조). 전체 상층액이 여과되고, 용리된 단백질이 수용 튜브로 수집되고, 갇힌 단백질이 저장소 튜브의 필터에 남을 때까지 2°C에서 14,000 ×g 의 원심분리를 수행합니다.
- 수용 튜브의 전체 여과액(약 500μL)을 새로운 1.5mL 마이크로튜브로 변환하고 500μL의 2x SDS 시료 완충액에 용해시킵니다.
- 피펫팅하고 샘플을 새로운 1.5mL 마이크로튜브로 옮겨 1,000μL의 1x SDS 샘플 버퍼에 저장소 튜브 필터의 잔류물을 용해시킵니다.
- 샘플을 100°C에서 3분 동안 끓입니다. 샘플을 실온으로 냉각한 후 샘플을 -20°C에서 보관합니다.
- DM1A(항-α-튜불린 항체, 재료 표 참조)로 웨스턴 블로팅(Western blotting)하여 튜불린의 양을 분석합니다.
- 크기 배제 크로마토그래피
- 단계 1.1.1에 기술된 바와 같이 1/10 농도의 프로테아제 및 인산가수분해효소 억제제로 보충된 담체 완충액(0.1M MES, pH 6.8; 10% 글리세롤; 1mM MgSO4; 1mM EGTA; 0.1mM DTT)을 준비한다. 그런 다음 용액을 여과하여 추운 환경에 보관하십시오.
- 4°C의 크로마토그래피 챔버( 재료 표 참조)에서 분취용 액체 크로마토그래피 시스템이 장착된 겔 여과 크로마토그래피 컬럼을 준비합니다.
- 컬럼에 샘플을 주입하기 전에 캐리어 완충액 180mL를 흘려 컬럼을 세척합니다. 유속은 3시간 동안 1mL/분입니다.
- 시판되는 정제된 돼지 튜불린( 재료 표 참조)을 대조군으로 주입하거나 마우스 뇌의 S3 분획(각각 500μL)을 컬럼에 주입합니다.
- 캐리어 완충액을 사용하여 1.0mL/분의 유속으로 용리합니다. 1.5mL 분획을 120분 동안 수집합니다. 280nm에서 흡광도로 용리된 단백질을 모니터링합니다. 최대 압력을 0.3MPa 미만으로 유지하십시오.
- 수집된 분획을 볼텍싱한 후 1.5mL 마이크로튜브에서 50μL의 2x SDS 샘플 완충액과 50μL를 혼합합니다. 모든 샘플을 100°C에서 3분 동안 끓입니다. 샘플을 실온으로 냉각한 후 샘플을 -20°C에서 보관합니다.
- 항α-튜불린 항체인 DM1A와 β항-튜불린 항체인 KMX-1을 이용한 웨스턴 블로팅에 의한 튜불린의 양을 분석한다( 자료표 참조).
결과
MT 분획 방법에 의한 마우스 뇌의 P2, P3 및 S3 분획에서 튜불린의 정량화
마우스 조직의 튜불린을 MT 분획법에 의해 P2, P3 및 S3 분획으로 분리하고 웨스턴 블로팅(Western blotting)으로 정량화했습니다(그림 1A). 20분 동안 100,000× g 에서 초원심분리에 의해 P2 분획에 남아 있는 MT의 침전물은 마우스 뇌에서 총 튜불린의 34.86% ± 1.68%를 차지했습니다. 상층액(S2)을 60분 동안 500,000× g 에서 추가로 원심분리하였다. 침전물(P3 분획)과 상층액(S3 분획)을 얻었는데, 이는 각각 마우스 뇌에서 총 튜불린의 56.13% ± 2.12% 또는 9.01% ± 0.68%를 차지했습니다(그림 1B).
이 연구에 사용된 대뇌 피질에는 신경교세포와 같은 신경세포와 비신경세포가 포함되어 있습니다. 쥐 뇌의 뉴런에서 MT 안정성을 선택적으로 평가하기 위해 중추 및 말초 신경계의 뉴런에서만 독점적으로 발현되는 튜불린 아형인 TUBB3를 Tuj1(항 TUBB3 항체)으로 웨스턴 블로팅하여 정량화했습니다. P2, P3 또는 S3 분획에서 TUBB3의 비율은 각각 32.65% ± 2.20%, 59.31% ± 2.61% 또는 8.04% ± 0.74%였다. 이들은 α-튜불린과 크게 다르지 않았다(그림 1B). 이러한 결과는 뉴런과 신경교세포가 유사한 MT 안정성을 나타내거나 신경교세포가 생체 내 신경교세포보다 훨씬 더 많은 양의 튜불린을 함유하고 있음을 시사합니다.
각 분획에서 회수된 튜불린의 특성
여기서, 마우스 조직 균질액은 서로 다른 중력 가속도를 갖는 2단계 초원심분리에 의해 3개의 분획으로 분리되었습니다. 따라서 각 분획에서 단백질 또는 복합체 간의 침강 계수가 달랐습니다. 100,000 × g 의 초원심분리에서 침전된 튜불린은 종래의 MT로 간주되었지만, 여기서 새로 얻어진 P3 분획의 튜불린이 P2 및 S3 분획의 튜불린의 튜불린과 어떻게 다른지 명확히 해야 합니다.
S3 튜불린을 특성화하기 위해, S2 (P3 + S3) 또는 S3 분획을 한외여과 및 크기 배제 크로마토그래피를 실시하였다. S3 분획의 튜불린 복합체는 300kDa 한외여과 스핀 컬럼을 완전히 통과할 수 있는 반면, S2 분획의 거의 모든 튜불린은 필터에 포획되었습니다(그림 2A). 또한, S3 분획에서 튜불린 복합체의 분자량은 크기 배제 크로마토그래피에 의해 측정되었다. S3 튜불린은 100kDa에 해당하는 하나의 피크에서 용리되며, 이는 상업적으로 이용 가능한 정제된 튜불린 이량체와 유사합니다(그림 2B,C). 또한 MT 분획법에 의해 각 분획에서 회수된 α- 및 β-튜불린의 비율은 동일했습니다(그림 2D). 실제로, α- 및 β-튜불린은 살아있는 세포에서 단량체로서 약간 존재할 수 있음이 밝혀졌다24. 그러나, 보고된 추정 kD 값(nM 순서)과 S3 분획(~11μM)에서 회수된 튜불린의 농도로 판단할 때, 대부분의(> 98%) 튜불린은 α/β-dimers로 존재하는 것으로 생각됩니다. 따라서 S3 분획물의 튜불린은 주로 용해성 α/β-튜불린 이량체입니다.
튜불린 중합체는 번역 후 변형(PTM)에 따라 P2 및 P3의 두 가지 분획으로 분리되었습니다. 이러한 분획을 구별하기 위해, 웨스턴 블로팅(Western blotting)은 특이적 항체를 사용하여 수행되었습니다. 안정적인 MT의 표지자 역할을 하는 항-아세틸화 α-튜불린 항체는 P2 분획이 97.40% ± 0.52%의 아세틸화된 α-튜불린으로 유의하게 농축된 반면(그림 2E), 총 α-튜불린은 P3 및 S3 분획에서 회수되었음을 보여주었습니다(그림 1B). 반대로, 불안정한 MT를 나타내는 항-티로시네이트 α-튜불린 항체는 티로신화된 α-튜불린의 75.43% ± 2.69%가 P3 분획에 존재한다는 것을 보여주었습니다(그림 2F). 이러한 발견은 P2 분획이 주로 안정적인 MT 내에 튜불린을 포함하는 반면, P3 분획은 불안정한 MT 내에서 튜불린으로 구성된다는 것을 확인시켜 줍니다.
동결 및 노코다졸 처리 하에서의 MT 안정성 평가
동결 및 노코다졸 처리가 마우스 뇌내 MT의 안정성에 미치는 영향을 분석하여 MT 분획법으로 MT의 안정성의 일시적인 변화를 식별할 수 있는지 여부를 확인했습니다. MT는 일반적으로 저온에서 분해되지만 일부 MT는 추위에서도 안정적으로 유지됩니다. 뇌의 무게를 측정한 후 액체 질소에 얼린 후 -80°C에서 30분 동안 두었습니다. 일시적 동결 뇌와 대조군으로서의 원시 뇌를 균질화하여 P2, P3 및 S3 분획으로 분별했습니다. 그런 다음, 세 가지 분획물에 포함된 튜불린의 비율을 웨스턴 블로팅(Western blotting)에 의해 정량화하였다. 균질화 전에 뇌를 동결시키면 P2 분획의 α-튜불린은 감소하고 P3 분획의 투불린은 원시 뇌에 비해 증가했습니다(그림 3A). 6-11B1(아세틸화 α-튜불린) 또는 1A2(티로시화 α-튜불린)를 사용한 블롯은 또한 뇌 동결이 P2 분획에서 α-튜불린의 아세틸화 수준(그림 3B)을 감소시키고 티로시화 수준(그림 3C)을 증가시킨다는 것을 보여주었습니다.
노코다졸은 β-튜불린에 결합하여 MT 중합을 방지하고 MT 해중합을 촉진하는 미세소관 표적화제(MTA)입니다. 마우스 뇌를 10μM 노코다졸의 유무에 관계없이 탁솔이 없는 MSB(+)에서 균질화하고 4°C에서 20분 동안 두었습니다. 처리되지 않은 또는 노코다졸 처리된 균질액을 10μM 탁솔에 첨가하고, 재균질화하고, P2, P3 및 S3 분획으로 분획하였다. 그런 다음, 세 가지 분획물에 포함된 튜불린의 비율을 웨스턴 블로팅(Western blotting)에 의해 정량화하였다. DM1A(α-튜불린)를 사용한 블롯은 P2 분획의 α-튜불린이 감소하고 P3 분획의 노코다졸 처리로 증가하는 경향이 있음을 보여주었습니다(그림 3D). 이러한 결과는 P2 튜불린이 저온 또는 노코다졸에 반응하여 불안정해졌으며 P2 분획이 실험 조건에 저항하는 강력한 MT를 포함하고 있음을 나타냅니다. 동결과는 대조적으로, 노코다졸은 튜불린 PTM에 영향을 미치지 않았다(그림 3E,F). 결과와 위의 데이터를 기반으로 PTM 분석으로 검출할 수 없는 MT의 해중합을 이 방법으로 평가할 수 있습니다.
조직 내 안정된 MT, 불안정한 MT 및 유리 튜불린의 비율 비교
MT의 안정성은 조직 내 세포의 증식 능력에 따라 조직마다 다릅니다. 특히, 안정된 MT는 다른 조직에 비해 주로 비증식성 뉴런으로 구성된 신경계에 더 풍부하다4. 다양한 조직에서 MT 안정성의 차이를 식별하는 개발된 MT 분획법의 능력을 평가하기 위해 마우스의 간과 흉선을 분획하고 각 분획에서 회수된 튜불린을 정량화했습니다. 그 결과, 다른 조직과 비교했을 때 뇌는 P2 튜불린의 수치가 상당히 높았으며, P3 튜불린은 증식 세포를 포함하는 조직에서 현저하게 풍부했습니다(그림 4). 또한 6-11B1 및 1A2 항체를 사용한 웨스턴 블로팅은 신경계에서 더 높은 MT 안정성의 존재를 확인했습니다. 튜불린 PTM의 뚜렷한 분포 패턴은 신경계에서 특이적으로 발견되는 P2 튜불린이 안정적인 MT에서 유래했음을 명확하게 나타냅니다(그림 4). 이러한 발견은 P2 및 P3 분획이 각각 안정 및 불안정한 MT에 해당한다는 개념을 뒷받침합니다.

그림 1: MT 분획법을 사용한 마우스 조직의 튜불린 정량화. (A) 조직에 대한 MT 분획 방법 요약. 조직 내 안정한 MT(P2 분획), 불안정한 MT(P3 분획) 및 유리 튜불린(S3 분획)은 준비 중 MT 중합 및 해중합을 억제하는 조건에서 2단계 초원심분리로 분리할 수 있습니다. (B) 마우스 피질 내의 MT는 종래의 100,000 × g의 초원심분리에 이어 500,000 × g의 초원심분리에 의해 침전되었다. 그런 다음 P2, P3 및 S3 분획으로 분리된 튜불린을 DM1A(α-튜불린) 및 항-Tuj1(TUBB3)로 웨스턴 블로팅하여 정량화했습니다. 총 분획물(P2 + P3 + S3)에 대한 각 분획(P2, P3 또는 S3) 내의 단백질의 비율은 프로토콜 섹션(SD± 의미, n=4)에 기술된 바와 같이 계산하였다. 이 그림은 Hagita et al.23에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: MT 분획 방법을 사용하면 쥐 대뇌 피질에서 안정적인 MT, 불안정한 MT 및 유리 튜불린을 분리할 수 있습니다. (A) S2 또는 S3 분획(입력)은 300kDa 한외여과 스핀 컬럼을 사용하여 필터 트랩 분석으로 분석되었습니다. 여과(receiver) 및 트래핑(reservoir)에 의해 얻어진 튜불린은 DM1A(α-튜불린)를 사용한 웨스턴 블로팅(western blotting)에 의해 정량화되었다. (B) 정제된 돼지 튜불린을 MT 분획법으로 실시하였고, 대부분 S3 분획물에서 수집되는 것을 발견하였다. (C) S3 분획에서 튜불린의 분자 크기. S3 분획은 겔 여과 크로마토그래피 컬럼을 사용하여 크기 배제 크로마토그래피로 분리하였다. 각 분획의 단백질은 DM1A(α-튜불린) 및 KMX-1(β-튜불린)을 사용한 웨스턴 블로팅으로 정량화했습니다. 이론적 분자량은 패널 상단에 표시됩니다. (D) 각 분획에서 α-튜불린과 β-튜불린의 비율은 동일하였다. P2, P3 및 S3 분획으로 분리된 튜불린은 KMX-1(β-튜불린)을 사용한 웨스턴 블로팅으로 정량화했습니다. 전체 분획의 합에 대한 각 분획의 α-튜불린 및 β-튜불린의 비율 정량화(± SD를 의미, n = 4). 통계 분석은 스튜던트 t-검정에 의해 수행되었습니다. (E,F) P2, P3 및 S3 분획에서 α-튜불린의 변형은 6-11B1(아세틸화 α-튜불린: E) 및 1A2(티로시화 α-튜불린: F)를 사용한 웨스턴 블로팅에 의해 검증되었습니다. 전체 분획에 대한 각 분획에서 티로시화 또는 아세틸화 α-튜불린의 비율을 정량화합니다(SD± 의미, n = 4). (A-C)는 Hagita et al.23에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
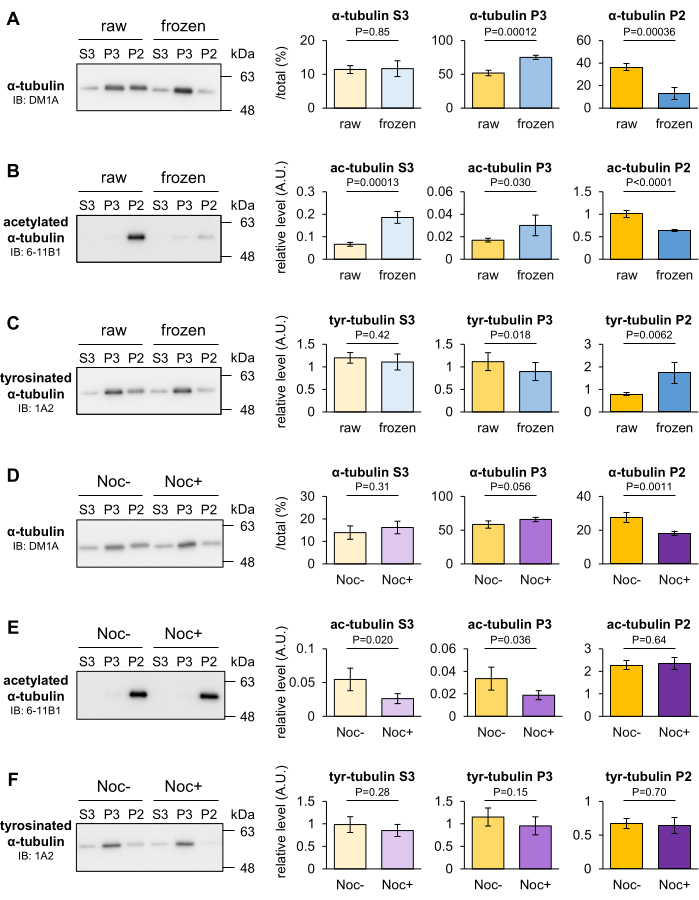
그림 3: 동결 또는 MTA에 의해 유도된 MT 해중합 평가. (A-C) -80°C에서 30분 동안 동결한 후 MT의 안정성을 평가했습니다. 원시 뇌와 냉동 뇌의 세 가지 분획에 포함된 튜불린의 비율은 DM1A(α-튜불린: A), 1A2(티로시네이티드 α-튜불린: B) 및 6-11B1(아세틸화된 α-튜불린: C)으로 웨스턴 블로팅하여 정량화했습니다. (D-F) MT 안정성에 대한 노코다졸의 효과를 평가하였다. 노코다졸의 미처리 또는 처리된 뇌의 3개 분획에 함유된 튜불린의 비율은 DM1A(α-튜불린: D), 1A2(티로시네이티드 α-튜불린: E) 및 6-11B1(아세틸화된 α-튜불린: F)으로 웨스턴 블로팅하여 정량화하였다. 티로시닝(B,E) 또는 아세틸화(C,F)의 대표적인 상대적 수준은 총 α-튜불린(A,D)의 양으로 정규화되었다 )(± SD를 의미, n = 4). 통계 분석은 스튜던트 t-검정에 의해 수행되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
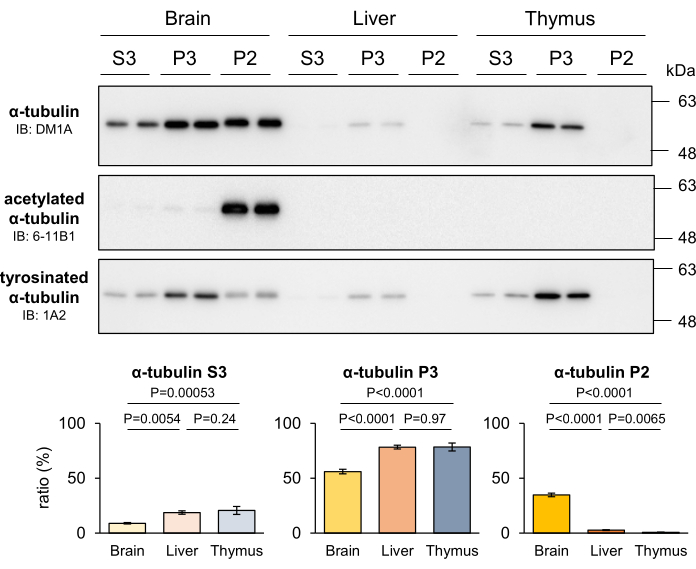
그림 4: 마우스의 뇌, 간, 흉선에서 안정적인 MT, 불안정한 MT 및 유리 튜불린의 비율. 생쥐의 뇌, 간, 흉선을 해부하여 MT 분획 방법을 적용했습니다. 각 분획으로 분리된 단백질은 DM1A(α-튜불린), 6-11B1(아세틸화된 α-튜불린) 및 1A2(티로시네이티드α-튜불린)로 웨스턴 블로팅하여 정량화했습니다. 총 분획물(P2 + P3 + S3)에 대한 각 분획(P2, P3 또는 S3) 내의 단백질의 비율은 프로토콜 섹션(SD± 의미, n=4)에 기술된 바와 같이 계산하였다. 통계 분석은 일원 분산 분석(one-way ANOVA)에 이어 Tukey의 사후 검정(post-hoc test)으로 수행되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
살아있는 유기체의 조직 내 튜불린 상태를 조사할 때 가장 중요한 작업은 준비 중 우발적인 MT 중합 또는 해중합을 방지하는 것입니다. 샘플에서 MT의 안정성은 MSB의 탁솔 농도, 완충액에 대한 조직 양의 비율, 조직 제거에서 균질화 및 원심분리에 이르는 과정 중 온도와 같은 요인의 영향을 받습니다. 따라서, 조건은 20배 부피의 균질액으로 마우스 조직을 분석하기 위한 프로토콜의 각 단계에서 최적화되었습니다. 탁솔의 농도가 높을수록 생체외에서 MT 중합을 유도할 수 있습니다25. 튜불린 농도가 현저히 다른 조직을 분석하거나 프로토콜을 크게 수정할 때 각 작업자는 실험의 특정 목표에 따라 단계를 최적화해야 합니다.
수행된 연구에서, P3라고 하는 새로운 MT 집단은 500,000 ×g20에서 초원심분리를 사용하여 종래의 "용해성 분획"으로부터 얻어졌다. 로터의 K 계수, 원심력 및 원심분리 기간과 같은 요인을 기반으로 한 이론적 계산은 S3 분획에 존재하는 튜불린이 6S 튜불린 이량체를 나타낼 가능성이 가장 높다는 것을 시사합니다. 반대로, P3 분획의 튜불린은 P2 분획에서 발견되는 것에 비해 길이가 더 짧은 MT에 해당할 수 있습니다. 이 관찰은 균질화 전에 조직을 동결시켜 MTs26의 부분적 붕괴를 초래하면 P3 분획 내에서 튜불린이 크게 증가하고 P2 분획이 동시에 감소한다는 결과와 일치합니다(그림 3A). 또한, 튜불린 PTM의 분석과 다양한 MAP의 결합 특성은 P2 또는 P3 분획이 각각 안정하거나 불안정한 MT를 포함한다는 것을 나타냅니다. 예를 들어, 주로 뉴런에서 발견되는 안정한 MT에 특이적인 특정 MAP은 P2 분획23에 독점적으로 존재했다. 결과적으로, P3 분획은 P2 분획에 비해 더 역동적이고 불안정한 MT로 구성된다고 제안하는 것이 타당합니다.
이 방법의 기초가 되는 이론에 따르면, MT 안정화 또는 원심분리와 관련된 부적절한 실험 조건은 분획 불량을 초래할 수 있습니다. 예를 들어, 탁솔의 낮은 농도는 P2 튜불린의 경미한 감소로 이어지고, 과잉 탁솔은 준비 중 MT 형성으로 인해 P2 튜불린을 증가시킨다23. 유사하게, 조직과 샘플을 부적절하게 가열하면 MT가 과중합되고 타우가 분해되거나 단편화될 수 있습니다23. 또한 원심 조건은 P3 및 S3 분획을 분리하는 데 중요하며 중력 가속도가 약간 감소하면 P3 분획의 회수율이 크게 감소합니다. 따라서 비정상적인 분별이 관찰되는 경우 프로토콜 단계를 엄격히 따르는 것이 좋습니다.
이 간단한 분획법은 조직의 안정한 MT, 불안정한 MT 및 유리 이량체 중 튜불린의 비율을 분석하는 데 광범위하게 적용될 수 있습니다. 이 방법은 튜불린 PTM의 정량화를 통해 분명하지 않을 수 있는 튜불린 상태의 미묘한 변화를 감지할 수 있기 때문에 몇 가지 이점을 제공합니다. MT 안정성 분석은 특히 크고 복잡한 신경 세포에서 MT의 생리학적 중요성을 이해하고 MT 조절 장애와 관련된 장애를 조사하는 데 중요합니다. 예를 들어, 튜불린(tubulin) 또는 MAP 유전자의 돌연변이 또는 기능 장애는 신경 발달 장애 및 신경 퇴행성 질환과 관련이 있다27,28. 알츠하이머병에서 MT는 영향을 받는 뉴런 15,29,30,31,32,33에서 타우 단백질의 기능적 손실로 인해 감소하는 것으로 알려져 있습니다. MT 안정성을 조절하고 세포 분열을 억제하는 MTA는 신경 장애에 대한 잠재적 치료법으로 제안되었습니다13,34. 이 고유한 MT 분획 방법을 활용하여 질병 모델 동물에서 MT 및 MAP의 안정성과 거동을 분석하면 타우 관련 치매의 발병 기전을 밝히고 새로운 치료 표적을 식별하는 데 크게 기여할 수 있습니다.
공개
저자는 보고할 이해 상충이 없습니다.
감사의 말
이 작업은 JST의 과학기술 혁신 창출을 위한 대학 펠로우십 설립(A.HT; JPMJFS2145), JST 스프링(A.HT.; JPMJSP2129), JSPS 펠로우를 위한 보조금(A.HT.; 23KJ2078), 과학 연구 보조금(B) JSPS KAKENHI(TM의 경우 22H02946), 문부과학성(TM; 26117004)의 "뇌 단백질 노화 및 치매 제어"라는 제목의 혁신적인 분야에 대한 과학 연구 보조금 및 우에하라 기념 재단(TM; 202020027)의 우에하라 연구 펠로우십. 저자는 재정적 이익이 상충되지 않는다고 선언합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 ML TUBE CASE OF 500 | Beckman Coulter | 357448 | |
| 1A2 | Sigma-Aldrich | T9028 | 1:5,000 dilution |
| 2-(N-morpholino)ethanesulfonic acid (MES) | Nacalai Tesque | 02442-44 | |
| 300 kDa ultrafiltration spin column | Aproscience | PT-1013 | |
| 6-11B1 | Sigma-Aldrich | T7451 | 1:5,000 dilution |
| ÄKTAprime plus | Cytiva | 11001313 | |
| anti-mouse IgG | Jackson ImmunoResearch | 115-035-146 | 1:5,000 dilution |
| antipain | Peptide Institute Inc. | 4062 | |
| aprotinin | Nacalai Tesque | 03346-84 | |
| Chemi-Lumi One L | Nacalai Tesque | 07880-54 | |
| Corning bottle-top vacuum filter system | Corning | 430758 | 0.22µm 33.2cm² Nitrocellulose membrane |
| DIFP | Sigma-Aldrich | 55-91-4 | |
| DIGITAL HOMOGENIZER HK-1 | AS ONE | 1-2050-11 | |
| DM1A | Sigma-Aldrich | T9026 | 1:5,000 dilution |
| DTT | Nacalai Tesque | 14128-46 | |
| EGTA | Nacalai Tesque | 37346-05 | |
| FluoroTrans W 3.3 Meter Roll | Pall Corporation | BSP0161 | |
| glycerol | Nacalai Tesque | 17018-25 | |
| GTP | Nacalai Tesque | 17450-61 | |
| HIGH SPEED REFRIGERATIOED MICRO CENTRIFUGE Kitman | TOMY | KITMAN-24 | |
| HiLoad 16/600 Superdex 200 pg column | Cytiva | 28-9893-35 | |
| Image Gauge Software | FUJIFILUM Wako Pure Chemical Corporation | ||
| ImmunoStar LD | FUJIFILUM Wako Pure Chemical Corporation | 292-69903 | |
| KMX-1 | Millipore | MAB3408 | 1:5,000 dilution |
| LAS-4000 luminescent image analyzer | FUJIFILUM Wako Pure Chemical Corporation | ||
| leupeptin | Peptide Institute Inc. | 43449-62 | |
| MgSO4 | Nacalai Tesque | 21003-75 | |
| Na3VO4 | Nacalai Tesque | 32013-92 | |
| NaF | Nacalai Tesque | 31420-82 | |
| okadaic acid | LC Laboratories | O-2220 | |
| OPTIMA MAX-XP | Beckman Coulter | 393315 | |
| pepstatin | Nacalai Tesque | 26436-52 | |
| PMSF | Nacalai Tesque | 27327-81 | |
| Polycarbonate Centrifuge Tubes for TLA120.2 | Beckman Coulter | 343778 | |
| Protease inhibitor cocktail (cOmplete™, EDTA-free) | Roche | 11873580001 | |
| Purified tubulin | Cytoskeleton | T240 | |
| QSONICA Q55 | QSonica | Q55 | |
| Taxol | LC Laboratories | P-9600 | |
| TLA-120.2 rotor | Beckman Coulter | 357656 | |
| TLA-55 rotor | Beckman Coulter | 366725 | |
| TLCK | Nacalai Tesque | 34219-94 | |
| Triton X-100 | Nacalai Tesque | 12967-45 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
참고문헌
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Conde, C., Caceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nature Reviews Neuroscience. 10 (5), 319-332 (2009).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Challacombe, J. F., Snow, D. M., Letourneau, P. C. Dynamic microtubule ends are required for growth cone turning to avoid an inhibitory guidance cue. Journal of Neuroscience. 17 (9), 3085-3095 (1997).
- Kapitein, L. C., Hoogenraad, C. C. Building the neuronal microtubule cytoskeleton. Neuron. 87 (3), 492-506 (2015).
- Leo, L., et al. Vertebrate fidgetin restrains axonal growth by severing labile domains of microtubules. Cell Reports. 12 (11), 1723-1730 (2015).
- Janke, C. The tubulin code: molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. International Journal of Molecular Sciences. 18 (10), 2207 (2017).
- Baas, P. W., Black, M. M. Individual microtubules in the axon consist of domains that differ in both composition and stability. Journal of Cell Biology. 111 (2), 495-509 (1990).
- Cartelli, D., et al. Microtubule alterations occur early in experimental parkinsonism and the microtubule stabilizer epothilone D is neuroprotective. Scientific Reports. 3, 1837 (2013).
- Zhang, B., et al. Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proceedings of the National Academy of Sciences of the United States of America. 102 (1), 227-231 (2005).
- Zhang, F., et al. Post-translational modifications of alpha-tubulin in Alzheimer disease. Translational Neurodegeneration. 4, 9 (2015).
- Miyasaka, T., et al. Curcumin improves tau-induced neuronal dysfunction of nematodes. Neurobiology of Aging. 39, 69-81 (2016).
- Fujiwara, H., et al. Inhibition of microtubule assembly competent tubulin synthesis leads to accumulation of phosphorylated tau in neuronal cell bodies. Biochemical and Biophysical Research Communications. 521 (3), 779-785 (2020).
- Vielkind, U., Swierenga, S. H. A simple fixation procedure for immunofluorescent detection of different cytoskeletal components within the same cell. Histochemistry. 91 (1), 81-88 (1989).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. Journal of Cell Biology. 109 (3), 1173-1184 (1989).
- Brown, A., Li, Y., Slaughter, T., Black, M. M. Composite microtubules of the axon: quantitative analysis of tyrosinated and acetylated tubulin along individual axonal microtubules. Journal of Cell Science. 104 (2), 339-352 (1993).
- Black, M. M., Slaughter, T., Moshiach, S., Obrocka, M., Fischer, I. Tau is enriched on dynamic microtubules in the distal region of growing axons. Journal of Neuroscience. 16 (11), 3601-3619 (1996).
- Caron, J. M., Jones, A. L., Kirschner, M. W. Autoregulation of tubulin synthesis in hepatocytes and fibroblasts. Journal of Cell Biology. 101 (5), 1763-1772 (1985).
- Merrick, S. E., Trojanowski, J. Q., Lee, V. M. Selective destruction of stable microtubules and axons by inhibitors of protein serine/threonine phosphatases in cultured human neurons. Journal of Neuroscience. 17 (15), 5726-5737 (1997).
- Miyasaka, T., Sato, S., Tatebayashi, Y., Takashima, A. Microtubule destruction induces tau liberation and its subsequent phosphorylation. FEBS Letters. 584 (14), 3227-3232 (2010).
- Hagita, A., et al. Quantitative fractionation of tissue microtubules with distinct biochemical properties reflecting their stability and lability. Biochemical and Biophysical Research Communications. 560, 186-191 (2021).
- Montecinos-Franjola, F., Chaturvedi, S. K., Schuck, P., Sackett, D. L. All tubulins are not alike: Heterodimer dissociation differs among different biological sources. Journal of Biological Chemistry. 294 (26), 10315-10324 (2019).
- Vallee, R. B. A taxol-dependent procedure for the isolation of microtubules and microtubule-associated proteins (MAPs). Journal of Cell Biology. 92 (2), 435-442 (1982).
- Bartolo, M. E., Carter, J. V. Effect of microtubule stabilization on the freezing tolerance of mesophyll cells of spinach. Plant Physiology. 97 (1), 182-187 (1991).
- Strang, K. H., Golde, T. E., Giasson, B. I. MAPT mutations, tauopathy, and mechanisms of neurodegeneration. Laboratory Investigation. 99 (7), 912-928 (2019).
- Fourel, G., Boscheron, C. Tubulin mutations in neurodevelopmental disorders as a tool to decipher microtubule function. FEBS Letters. 594 (21), 3409-3438 (2020).
- Terry, R. D., Gonatas, N. K., Weiss, M. Ultrastructural studies in Alzheimer's presenile dementia. The American Journal of Pathology. 44 (2), 269-297 (1964).
- Yoshida, H., Ihara, Y. Tau in paired helical filaments is functionally distinct from fetal tau: assembly incompetence of paired helical filament-tau. Journal of Neurochemistry. 61 (3), 1183-1186 (1993).
- Cash, A. D., et al. Microtubule reduction in Alzheimer's disease and aging is independent of tau filament formation. The American Journal of Pathology. 162 (5), 1623-1627 (2003).
- Hempen, B., Brion, J. P. Reduction of acetylated alpha-tubulin immunoreactivity in neurofibrillary tangle-bearing neurons in Alzheimer's disease. Journal of Neuropathology and Experimental Neurology. 55 (9), 964-972 (1996).
- Miyasaka, T., et al. Imbalanced expression of tau and tubulin induces neuronal dysfunction in C. elegans models of tauopathy. Frontiers in Neuroscience. 12, 415 (2018).
- Boiarska, Z., Passarella, D. Microtubule-targeting agents and neurodegeneration. Drug Discovery Today. 26 (2), 604-615 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유