Method Article
Sentetik Biyoloji ve Doğal Ürün Uygulamaları için Yüksek Verimli Streptomices Transkripsiyon-Çeviri Araç Seti
Bu Makalede
Özet
Bu protokol, Streptomyces venezuelae hücresiz transkripsiyon-çeviri (TX-TL) sisteminden yüksek rekombinant protein verimini sentezlemek için geliştirilmiş bir yöntemi detaylandırmamaktadır.
Özet
Streptomices spp. klinik antibiyotiklerin ve endüstriyel kimyasalların önemli bir kaynağıdır. Streptomices venezuelae ATCC 10712, hızlı büyüyen bir suş ve doğal bir kloramfenikol, jadomycin ve pikromisin üreticisidir, bu da onu yeni nesil sentetik biyoloji şasisi olarak çekici bir aday haline getirir. Bu nedenle, S. venezuelae ATCC 10712'nin ve diğer Streptomyces spp. modellerinin gelişimini hızlandıran genetik araçlar, doğal ürün mühendisliği ve keşfi için son derece arzu edilir. Bu amaçla, yüksek G+C (%) genlerinin yüksek verimli heterolog ekspresyonlarını sağlamak için bu protokolde özel bir S. venezuelae ATCC 10712 hücresiz sistem sağlanmıştır. Bu protokol, 96 kuyu veya 384 kuyu plaka biçimindeki küçük ölçekli (10-100 μL) parti reaksiyonları için uygundur, reaksiyonlar ise potansiyel olarak ölçeklenebilir. Hücresiz sistem sağlamdır ve minimum kurulumda bir dizi rekombinant protein için yüksek verim (~5-10 μ M) elde edebilir. Bu çalışma ayrıca mRNA ve protein sentezinin gerçek zamanlı ölçümü ve etiketli proteinlerin jel içi floresan boyanma için geniş bir plazmid araç seti içerir. Bu protokol ayrıca yüksek verimli gen ekspresyon karakterizasyon iş akışları veya Actinomycetes genomlarında bulunan yüksek G+C (%) genlerinden enzim yollarının incelenmesi ile entegre edilebilir.
Giriş
Hücresiz transkripsiyon-çeviri (TX-TL) sistemleri, sentetik biyoloji için kavramsal mühendislik çerçevesi olan hızlı tasarım-yap-test-öğrenme döngülerini uygulamak için sentetik biyoloji için ideal bir prototipleme platformu sağlar1. Buna ek olarak, açık reaksiyon ortamında yüksek değerli rekombinant protein üretimi için TX-TL sistemlerine olan ilgi artmaktadır2, örneğin, antikor-ilaç konjugelerine standart dışı amino asitleri dahil etmek3. Özellikle, TX-TL bir hücre özü, plazmid veya doğrusal DNA ve protein sentezini toplu veya yarı iletken reaksiyonlarda katalize etmek için bir enerji çözeltisi gerektirir. Escherichia coli TX-TL baskın hücresiz sistem olmakla birlikte, farklı uygulamalar için bir dizi gelişmekte olan modelsiz TX-TL sistemi dikkat çekmiştir4,5,6,7,8. TX-TL'nin temel avantajları arasında esnek ölçeklenebilirlik (nanoliterden litreye kadar ölçek)9,10, güçlü tekrarlanabilirlik ve otomatik iş akışları8,11,12 sayılabilir. Özellikle, TX-TL'nin otomasyonu genetik parçaların ve düzenleyici unsurların hızlandırılmış karakterizasyonuna izin vermektedir8,12,13.
Reaksiyon kurulumu açısından, TX-TL hem birincil hem de ikincil enerji kaynaklarının yanı sıra amino asitler, kofaktörler, katkı maddeleri ve şablon DNA dizisi gerektirir. Nükleotid trifosfatlar (NTP'ler), ilk mRNA (ATP, GTP, CTP ve UTP) ve protein sentezini (yalnızca ATP ve GTP) yönlendirmek için birincil enerji kaynağını sağlar. TX-TL verimini artırmak için NTP'ler maltose14, maltodekstrin15, glikoz14, 3 fosfolycerat (3-PGA)16, fosforilolpyruvate17 ve L-glutamat18 gibi ikincil bir enerji kaynağının katabolizması yoluyla yenilenir. Bu doğal metabolik aktivite şaşırtıcı derecede çok yönlüdür, ancak özellikle gelişmekte olan TX-TL sistemlerinde kötü çalışılmıştır. Her enerji kaynağının ATP verimi, kimyasal stabilite ve maliyet açısından farklı özellikleri ve avantajları vardır, bu da ölçeklenmiş TX-TL reaksiyonları için önemli bir husustur. Şimdiye kadar, E. coli TX-TL için mevcut protokoller, ikincil enerji kaynağı olarak 3-PGA (30 mM), maltodekstrin (60 mM) ve D-riboz (30 mM) karışımı kullanılarak, model yeşil floresan protein (GFP) için 4,0 mg/mL'ye (~157 μM) kadar ulaşmıştır19.
Son zamanlarda TX-TL sistemlerinde sekonder metabolit biyosintetik yolların incelenmesine olan ilgi artmaktadır20,21,22. Özellikle, Actinobacteria antibiyotikler ve tarımsal kimyasallar da dahil olmak üzere ikincil metabolitlerin önemli bir kaynağıdır23,24. Genomları, ikincil metabolit biyosentezi için enzimatik yolları kodlayan biyosentetik gen kümeleri (BGC' ler) ile zenginleştirilmiştir. Actinobacteria genetik parçaları ve biyosintetik yolların incelenmesi için yakın zamanda streptomices bazlı bir dizi TX-TL sistemi geliştirilmiştir5,6,25,26. Bu özel Streptomyces TX-TL sistemleri aşağıdaki nedenlerden dolayı potansiyel olarak faydalıdır: [1] Streptomyces spp.26 enzimleri için yerel bir protein katlama ortamının sağlanması; [2] yüksek G+C (%) gen ekspresyörü için en uygun tRNA havuzuna erişim; [3] biyosintetik öncüllerin temini için potansiyel olarak kaçırılabilen aktif birincil metabolizma; ve [4] yerel hücre özünde bulunan ikincil metabolizmadan enzimlerin, öncüllerin veya kofaktörlerin sağlanması. Bu nedenle, bu benzersiz yetenekleri kullanmak için son zamanlarda yüksek verimli bir S.venezuelae TX-TL araç seti kuruldu5.
Streptomyces venezuelae, endüstriyel biyoteknolojide zengin bir geçmişe sahip sentetik biyoloji için 5,27,28,29 ve Actinobacteria30,31,32'de hücre bölünmesi ve genetik düzenlemeyi incelemek için bir model sistemi olarak ortaya çıkan bir konaktır. Ana tip suş olan S. venezuelae ATCC 10712, 7377 kodlama dizisi, 21 rRNA, 67 tRNA ve 30 biyosinatik gen kümesini kodlayan % 72,5 G+C içeriği (%) (Katılım numarası: CP029197) ile 8,22 Mb'lık nispeten büyük bir genoma sahiptir. Sentetik biyolojide, S. venezuelae ATCC 10712 biyosentetik yolların heterolog ifadesi için çekici bir şasidir. Diğer Streptomices lekelerinin aksine, hızlı bir iki katına (~40 dk), geniş bir genetik ve deneysel araç yelpazesi5,28, misel topaklanma eksikliği ve sıvı ortamda sporülasyon dahil olmak üzere çeşitli önemli avantajlar sağlar28,33. Çeşitli çalışmalar ayrıca poliketitler, ribozomal ve nonribosomal peptitler34,35,36,37,38 dahil olmak üzere çeşitli ikincil metabolitlerin heterolog üretimi için S. venezuelae'nin kullanıldığını göstermiştir. Bu kombine özellikler, bu suşunu sentetik biyoloji ve metabolik mühendislik uygulamaları için çekici bir mikrobiyal konak haline getirir. S. venezuelae heterolog gen ekspresyolu için baskın Streptomices modeli olmasa da, daha fazla gelişme ile, doğal ürün keşfi içinde daha geniş kullanım için hazırlanır.
Bu makale, daha önce yayınlanan ilk protokol26'dan güncellenen yüksek verimli bir S. venezuelae TX-TL sistemi için ayrıntılı bir protokol (Şekil 1) s sunulmuştur. Bu çalışmada, enerji çözeltisi ve reaksiyon koşulları, standart bir plazmid, pTU1-A-SP44-mScarlet-I kullanılarak, 4 saat, 10 μL parti reaksiyonunda mScarlet-I muhabir proteini için protein verimini 260 μg / mL'ye kadar artıracak şekilde optimize edilmiştir. Bu plazmid, protein ekspresyonunun çeşitli yöntemlerini tespit etmek için özel olarak tasarlanmıştır. Protokol ayrıca düzene sokılırken, enerji sistemi verimden ödün vermeden hücresiz reaksiyonların kurulmasının karmaşıklığını ve maliyetini azaltmak için optimize edilmiştir. Optimize edilmiş TX-TL sistemi ile birlikte, gen ekspresyonunun ince ayar için ve TX-TL'yi gerçek zamanlı olarak izlemek için floresan araçlar olarak bir genetik parça kütüphanesi geliştirilmiştir, böylece Streptomyces spp. ve ilgili Actinobacteria'dan gen ekspresyonunu ve doğal ürün biyosentetik yollarını prototiplendirmek için çok yönlü bir platform oluşturulmuştur.
Bu çalışmada, önerilen standart plazmid (pTU1-A-SP44-mScarlet-I), yeni bir laboratuvarda S. venezuelae TX-TL iş akışını kurmak için kullanılabilir ve AddGene'de mevcuttur (bkz. Ek Tablo S1). pTU1-A-SP44-mScarlet-I, kullanıcıya diğer açık okuma çerçevelerini (ORF' ler) inceleme esnekliği sağlar. mScarlet-I ORF, S. venezuelae gen ekspresyon için kodon için optimize edilmiştir. SP44 promotörü, hem E. coli hem de Streptomyces spp.39'da oldukça aktif olan güçlü bir kurucu organizatördür. Plazmid, yeni ORF'lerin ortak bir C terminali FLAG-tag ve floresan arsenik saç tokası (FlAsH) bağlayıcı etiket sistemi ile çerçevede alt klonlamasına izin vermek için iki benzersiz kısıtlama enzim bölgesine (NdeI, BamHI) sahiptir. Alternatif olarak, her iki etiket de yeni bir geni alt klonladıktan sonra bir stop codon dahil edilerek kaldırılabilir. Bu baz vektör ile, bir dizi proteinin yüksek verimli ekspresyumu gösterilmiştir, yani oksitetrasiklin biyosentez yolundan proteinler ve Streptomyces rimosus'tan karakteristik olmayan bir nonribosomal peptit sentezi (NRPS). mRNA algılama açısından, pTU1-A-SP44-mScarlet-I standart plazmid, 3,5-difluoro-4-hydroxybenzylidene imidazolinone (DFHBI) probu ile tespit için bir dBroccoli aptamer (3'-çevrilmemiş bölgede) içerir. Daha fazla esneklik için, EcoFlex40 uyumlu MoClo parçalarından oluşan bir araç seti de AddGene'de kullanıma sunulmuştur, EcoFlex uyumlu Streptomyces mekik vektörü (pSF1C-A-RFP/pSF2C-A-RFP) ve süper klasör yeşil floresan proteinini (sfGFP), mScarlet-I, mVenus-I ve β-glucuronidaz (GUS). Özellikle, pSF1C-A plazmid pAV-gapdh28'den türetilmiştir ve MoClo montajı için BsaI / BsmBI sitelerinden iyileştirilmiştir. pSF1C-A-RFP/pSF2C-A-RFP, EcoFlex40'tan pTU1-A-RFP/pTU2-A-RFP'ye eşdeğerdir, ancak Streptomyces spp'de konjugasyon ve kromozomal entegrasyon için ek işlevsellik içerir. phiC31 integrase sistemini kullanarak28.
Protokolün ilk aşaması , S. venezuelae ATCC 10712'nin büyümesini veya yakından ilişkili bir suş, orta üstel fazda hücre hasadı, hücre yıkama adımları ve S30A ve S30B tamponlarında dengeyi içerir. Bu aşama üç gün gerektirir ve hücre büyümesi için zaman, aşağıda açıklandığı gibi kalan bileşenleri hazırlamak için kullanılabilir. Hasat edilen hücreler daha sonra sonication tarafından lislenir, netleştirilir ve bir çalıştırma reaksiyonuna tabi edilir. Hazırlığın bu son aşamasında, hücre özleri aktivite kaybını en aza indirmek için -80 ° C'de uzun süreli depolama için hazırlanabilir. Bu protokolü kullanarak TX-TL reaksiyonlarının montajı için, karşılaştırılabilir verim veren Minimal Enerji Çözümü formatı (MES) seçeneğine sahip bir Streptomices Master Mix (SMM) sunulmaktadır. Ayrıca, bir -80 °C gliserol stoğundan bir GYM agar plakasına S. venezuelae ATCC 10712'nin taze bir kültürünün çizİlmesi ve tek koloniler görünene kadar en az 48-72 saat boyunca 28 °C'de kuluçkaya yatmanız önerilir. Aşağıdaki adımlar için yalnızca taze kültürler kullanılmalıdır.
Protokol
NOT: GYM orta ve agar tabağı ile S30A ve S30B yıkama tamponları tarifleri için Tablo 1 ve Tablo 2'ye bakın.
1. Çözümlerin hazırlanması ve genel rehberlik
- Bir istisna belirtilmedikçe, hazırlık sonrası tüm çözeltileri, hücreleri (büyüme sonrası) ve hücre özlerini buz üzerinde tutun.
- Oda sıcaklığında 1 M Mg-glutamat, 4 M K-glutamat, %40 (w/v) PEG 6000, 1 g/mL polivinilsülfiyonik asit ve diğer tüm stokları -80 °C'de saklayın. Kimyasal bozulmayı önlemek için donma-çözülme döngülerinin sayısını en aza indirin.
- 3-PGA (pH ayarı gerektirir) gibi enerji çözeltisi stoklarının hazırlanması için ( bkz. Tablo 3), E. coli TX-TL protokolünde verilen yönergeleri izleyin41.
NOT: Tüm bileşenler ddH2O'da tamamen çözünür ve -80 °C dondurucuda aliquots olarak saklanır. - Bireysel stokları veya enerji çözümlerini (daha sonra açıklanmıştır) buz üzerinde çözün. Amino asitleri, tüm amino asitleri çözünürlükte hale getirmek için ~15-30 dakika boyunca girdap ile 42 °C'de ısıtın.
- Bazı amino asitler (L-Cys, L-Tyr, L-Leu) buz üzerinde çökelirken, dinlenme süresini en aza indirirken, bu çözeltiyi oda sıcaklığında bırakın ve çözmek için bir girdap kullanın.
- Stok çözeltilerinin ve suyun hesaplanan hacimlerini (Tablo 3) ekleyin ve bir girdap kullanarak iyice karıştırın.
- Enerji çözeltisini tüp başına 20-100 μL aliquots olarak veya istenildiği gibi buz üzerinde aliquotlayın ve bir sonraki kullanıma kadar -80 °C'de saklayın.
2. S. venezuelae ATCC 10712 hücrelerinin hazırlanması
- 1. Gün-Medya/tampon hazırlama ve gecelik kültür öncesi
- Tablo 1'de açıklandığı gibi, 2 L şaşkın bir şişede 1 L steril GYM sıvı ortamı hazırlayın. Ekipman/kimyasal/reaktif kaynakları için Malzeme Tablosuna bakın.
- Tablo 1'de açıklandığı gibi 250 mL Erlenmeyer şişesinde 1 x 50 mL steril GYM sıvı ortamı hazırlayın.
- 100 mL 1 M HEPES-KOH pH 7,5, 100 mL 1 M MgCl2 ve 500 mL 4 M NH4Cl çözümleri hazırlaarak 1 L S30A ve 1 L S30B yıkama tamponları yapın. Tarifler için Tablo 2'ye bakın.
- Gecelik kültür öncesi hazırlayın. Steril 50 mL GYM sıvı ortamını 250 mL Erlenmeyer şişesinde 30 dakika boyunca 28 °C'ye önceden ısıtın.
- Tek bir S. venezuelae ATCC 10712 kolonisini (veya ilgili suşu) bir GYM agar plakasından önceden ısıtılmış 50 mL GYM sıvı ortamına aşılayın ve 28 °C'de kuluçkaya yatın, 16 saat boyunca 200 rpm (bir gecelik kültür öncesi).
- 2. Gün-Gündüz kültür öncesi ve ana büyüme kültürünü hazırlayın.
- 28 °C'de 250 mL Erlenmeyer şişesinde 30 dakika boyunca önceden ısıtın 50 mL steril GYM sıvı ortamı.
- 1 mL gecelik ön kültürü önceden ısıtılmış 50 mL GYM sıvı ortamına aktarın ve 28 °C'de kuluçkaya yatırın, 8 saat boyunca 200 rpm (gündüz kültür öncesi).
- Bu büyüme döneminden sonra, OD600'ü 1 mL (1 cm yol uzunluğu) plastik bir cuvette steril GYM ortamı ile 1:10 seyreltme kullanarak bir spektrofotometrede kontrol edin.
NOT: OD600 en az 3-4'e ulaşmış olmalıdır. Zayıf büyüme varsa, 2.2.1-2.2.2 adımlarının tekrarlanması önerilir. - Alt kültür 0.25 mL gündüz kültür 2 L şaşkın şişeler halinde 1 L sıvı GYM ortamı içine.
- 28 °C'de bir gecede çalkalayın, 14 saat boyunca 200 rpm.
- 3. Gün-Hasat hücreleri
- Önceki kuluçka döneminden (14 saat) sonra, ana kültürün OD600'lerini kaydedin. OD600 ölçümü için geceleme kültürünü 1:10 taze GYM ortamı ile seyreltin.
NOT: OD600 bu aşamada 3.0-4.0'a ulaşmış olmalıdır. - OD600<3.0 ise, sarsıntı hızını 250-300 rpm'ye çıkarın ve 3.0'ın OD600'üne ulaşılana kadar büyüyün. Ek 2 saatten (toplamda 16 saat) daha uzun süre büyümeyin.
- OD600>3.0 ise, kültürleri santrifüj kaplarına aktarın ve ıslak buzda 30 dakika boyunca hızla soğutun.
- Hücre kültürünün buz üzerinde soğumasını beklerken, Tablo 1'de açıklandığı gibi 4 mL taze 1 M dithiothreitol (DTT), S30A ve S30B tamponları hazırlayın ve buzda tutun. Kimyasal/reaktif kaynağı için Malzeme Tablosuna bakın.
- Boş bir 50 mL santrifüj tüpünü önceden tartın ve -20 °C'de önceden soğutun.
- Buz üzerine 1 L S30A tampona 2 mL 1 M DTT ekleyin ve iyice karıştırın.
NOT: S30A ve S30B yıkama tamponlarına yalnızca kullanmadan önce DTT ekleyin. - 6.000 × g, 4 °C, 10 dk'lık hücreleri santrifüj edin ve süpernatantı hızlı ve tek bir hareketle dikkatlice atın.
NOT: Pelet bozulursa, artık GYM ortamı ile hücre tutulmasını en üst düzeye çıkarın ve protokole devam edin. - 500 mL S30A tampon ekleyin ve hücre kümeleri homojen bir şekilde dağılana kadar santrifüj şişelerini kuvvetlice sallayarak hücreleri yeniden biriktirin.
- Hücreleri 6.000 × g, 4 °C, 6 dk'da santrifüj edin ve süpernatantı dikkatlice atın.
NOT: Hücre peleli bu noktada daha sıkı olsa da, bazı hücreler süspansiyonda kalacaktır (bkz. Şekil 1). 2.3.7'de açıklandığı gibi davranin ve mümkün olduğunca çok hücre tutun. - 2.3.8-2.3.9 adımlarını yineleyin.
- Buz üzerine 1 L S30B tampona 2 mL 1 M DTT ekleyin ve iyice karıştırın. Hücrelere 500 mL S30B arabellek ekleyin. 2.3.9.
- Hücre peletini 10 mL S30B tamponda yeniden çıkarın ve önceden tartılmış, önceden soğutulmuş 50 mL santrifüj tüpüne aktarın. Gerekirse, artık hücreleri ek 5-10 mL S30B tampon ile aktarın. S30B ile 50 mL'ye doldurun.
- Hücreleri 6.000 × g, 4 °C, 10 dk'da santrifüj edin ve süpernatantı dikkatlice atın.
- 2.3.13.
- Kalan S30B süpernatantı 100-200 μL pipetle dikkatlice aspire edin.
- Islak hücre peletini tartın.
NOT: Gece spor salonu kültürünün 1 L'si için tipik ıslak hücre pelet ağırlığı (OD600 = 3.0) ~4,5 g'dır. - Her 1 g ıslak hücre için 0,9 mL S30B tampon ekleyin. Pasteur pipet veya girdap kullanarak hücreleri yeniden depolar.
- Hücreleri yatıştırmak için 500 × g'a kadar kısaca (~10 s) santrifüj.
NOT: Protokol bu noktada duraklatılabilir ve hücreler sıvı azot veya kuru buz üzerinde dondurulabilir ve -80 °C'de saklanabilir.
- Önceki kuluçka döneminden (14 saat) sonra, ana kültürün OD600'lerini kaydedin. OD600 ölçümü için geceleme kültürünü 1:10 taze GYM ortamı ile seyreltin.
3. Ham hücre özü elde etmek için sonication tarafından hücre liziz
NOT: Bu aşamada, kullanıcı hücreleri 1 mL fraksiyonlarda (seçenek 1) veya 50 mL tüpte (seçenek 2) daha büyük bir hücre süspansiyonu (5 mL) olarak sonication ile bozmayı seçebilir. Hücre süspansiyonunun son hacmi önceki hasat ve yıkama adımları sırasında hücre kaybı nedeniyle değişebileceğinden, tekrarlanabilirliği sağlamak için her iki seçenek de aşağıda ayrıntılı olarak verilmiştir. Yeni bir kullanıcı, protokolü oluşturmak için önce 2.1 seçeneğini denemelidir.
- 1 mL kesirlerde sonicating ile Hücre Lizisi
- 1 mL pipet ucu kullanarak (delik boyutunu artırmak için ucun ucunu kesin), hücre süspansiyonunun 1 mL'lik kısmını 2 mL mikrosantrifüj tüplerine aktarın.
NOT: Hücreler donmuşsa, peletin içeren 50 mL'lik tüpü hücre lizizden önce ılık suda hızla çözün. Pelet çözülmeye başlar başlamaz tüpü ıslak buza aktarın ve 10 dakika soğutun. - Her mikrosantrifüj tüpünü, sonication için tüpü tutmak için plastik bir tüp rafı kullanarak bir buzlu su kabına yerleştirin.
NOT: Hücre ekstresinin aşırı ısınmaya duyarlılığı nedeniyle, protein çökelmesini ve enzymatik aktivitenin azalmasını önlemek için tüplerin ısınmamasını sağlamak önemlidir. - 3 mm çapında uçlu bir sonicator probu kullanın ve % 70 (v/v) etanol ve çift damıtılmış su (ddH2O) ile temizleyin. Sonicator ucunu sıvı yüzeyin ~1 cm altına inene kadar hücre süspansiyonuna üfleyin.
- Sonicator içine aşağıdaki ayarları girin: 20 kHz frekans, 65% genlik, 10 s nabız ZAMANıNDA, 10 s darbeLER KAPSADI süre, 1 dakika toplam sonikasyon süresi.
- Sonication protokolünü çalıştır. Hücrelerin eşit şekilde sonik olduğundan emin olmak için ilk iki dinlenme döngüsü sırasında tüpü yukarı / aşağı ve yana doğru hareket ettirin. Enerji girişini kaydet.
NOT: Güvenlik için sonikasyon sırasında uygun işitme koruması takın. Hücreler bozuldukça viskozite azalacak ve soluk krem ıslak hücre pelezi homojen kahverengi bir sıvıya dönüşmelidir. Önerilen enerji girişi ıslak hücrelerin mL başına 240 J'dir. Hücreler sadece kısmen lizlenmişse, süspansiyon, özellikle tüpün yanlarında viskoz hücre kümeleriyle krem renginde görünecektir. - Tüpü 2-3 kez ters çevirin ve sonication'ı bir veya iki 10 s döngü için tekrarlayın, hücreler tamamen bozulana kadar sık sık karıştırın.
- 1 mL pipet ucu kullanarak (delik boyutunu artırmak için ucun ucunu kesin), hücre süspansiyonunun 1 mL'lik kısmını 2 mL mikrosantrifüj tüplerine aktarın.
- 5 mL hücre süspansiyonu sonicating tarafından Hücre Liziz
- Hücreler donmuşsa, peletı içeren 50 mL'lik tüpü hücre lizizden önce sallanarak ılık suda hızla çözün. Pelet çözülmeye başlar başlamaz tüpü ıslak buza aktarın ve 10 dakika soğutun.
- Hücreleri tortulamak için tüpü kısaca 500 x g'da döndürün.
- Sonication için 50 mL tüp buzlu su bir beher yerleştirin.
NOT: Hücre ekstresinin aşırı ısınmaya duyarlılığı nedeniyle, protein çökelmesini ve enzymatik aktivitenin azalmasını önlemek için tüplerin ısınmamasını sağlamak önemlidir. - 6 mm çapında uçlu bir sonicator probu kullanın ve % 70 (v/v) etanol ve ddH2O ile temizleyin ( Şekil 1'deki 6 mm probun görsel şemasına bakın). Sonicator ucunu sıvı yüzeyin ~1 cm altına inene kadar hücre süspansiyonuna (~5 mL) üfleyin.
- Sonicator içine aşağıdaki ayarları girin: 20 kHz frekans, 65% genlik, 10 s nabız ZAMANıNDA, 10 s darbeler KAPSAdan zaman, ıslak hücrelerin mL başına 1 dakika toplam sonikasyon süresi (toplamda 5 dk).
- Sonication protokolünü çalıştır. Hücrelerin eşit şekilde sonik olduğundan emin olmak için ilk iki dinlenme döngüsü sırasında tüpü yukarı / aşağı ve yana doğru hareket ettirin.
NOT: Güvenlik için sonikasyon sırasında uygun işitme koruması takın. Hücreler bozuldukça viskozite azalacak ve soluk krem ıslak hücre pelezi homojen kahverengi bir sıvıya dönüşmelidir. Enerji girişini kaydet. Islak hücrelerin mL başına 240 J'lik optimum enerji girişi (~5 dk sonikasyondan toplam 1200 J) önerilir. - Bazı hücreler bozulmadan kalırsa, 3.1.5 adımındaki yönergeleri izleyin.
- Hücre özlerini 2 mL mikrosantrifüj tüplerine aktarın.
4. Hücre özü açıklaması ve çalıştırma reaksiyonu
- Hücre kalıntılarını gidermek için 4 °C'de 10 dakika boyunca 16.000 × g'da lisli hücreleri santrifüj edin. Süpernatantı 1,5 mL mikrosantrifüj tüplerine 1 mL aliquots olarak aktarın.
- Hücre özleri için çalıştırma reaksiyonunu gerçekleştirin. Hücre özlerini içeren 1,5 mL'lik tüpleri 30 °C'de bir ısı bloğunda veya inkübatörde 60 dakika boyunca titremeden kuluçkaya yatırın.
- Hücre özlerini 4 °C'de 10 dakika boyunca 16.000 × g'da santrifüj edin. Süpernatantları 15 mL santrifüj tüpüne bire bir edin. Tüpü homojen olana kadar beş kez ters çevirerek süpernatant karıştırın, sonra buzda tutun. Hava kabarcıklarının oluşumunu önlemek için yavaşça ters çevirin.
- Hücre ekstresinin 10 μL'sini S30B tamponu ile 100 kat seyreltin ve üç teknik tekrarla bir Bradford tahlilini kullanarak toplam protein konsantrasyonunu ölçün (Bradford tahlil kılavuzu için Ek Malzeme S2'ye bakın).
- Protein konsantrasyonu 20-25 mg/mL ise, hücre özlerini 100 μL aliquots olarak yeni 1,5 mL tüplere aktarın, sıvı nitrojende flaş dondurun ve -80 °C'de saklayın.
NOT: Güvenlik için, yüz siperleri ve eldivenler de dahil olmak üzere sıvı nitrojen kullanırken uygun KKD giyin. - Protein konsantrasyonu <20 mg/mL ise, yüksek kaliteli hücre özü ve TX-TL verimlerinin daha önce yayınlanan çalışmayla karşılaştırılabilir olmasını sağlamak için ham ekstrakt hazırlama adımlarını tekrarlayın5.
5. Plazmid DNA şablonunun hazırlanması
- pTU1-A-SP44-mScarlet-I plazmidini (pUC19 kökenli) üreticinin talimatlarına uygun bir plazmid DNA arıtma kiti kullanarak 50 mL LB kültüründe (100 mg/mL karbenisilin ile) yetişen yeni dönüştürülmüş bir E. coli plazmid suşundan (DH10β, JM109) arındırın.
- Plazmidi 2 x 300 μL çekirdeksiz suda boşaltın ve fraksiyonları birleştirin.
- 3 M sodyum asetat (pH 5.2) 0,1 birim (66 μL) ekleyin.
- 0,7 hacim (462 μL) izopropanol ekleyin.
- DNA'yı 30 dakika boyunca -20 °C'de kuluçkaya yatırın.
- 4 °C'de 30 dakika boyunca 16.000 × g'da santrifüj ve süpernatantı atın.
- DNA peletine %70 (v/v) etanolden oluşan 2 mL ekleyin.
- Plazmid DNA peletini yeniden çıkarmak için tüpü 3-4 kez ters çevirin.
- 4 °C'de 5 dakika boyunca 16.000 × g'da santrifüj ve süpernatantı atın.
- 5.7-5.9 adımlarını tekrarlayın ve görünür tüm sıvıyı çıkarın.
- DNA peletini 10-30 dakika havayla kurulayın veya vakumlu santrifüjle 5 dakika kurutun.
- Kurutulmuş peletin 600 μL çekirdeksiz ddH2O ile yeniden ıslatır.
- Spektrofotometre kullanarak DNA konsantrasyonunu ve saflığını ölçün.
- 50-100 μL aliquots hazırlayın ve -20 °C'de saklayın.
NOT: Hücresiz reaksiyonların dar hacim kısıtlamaları nedeniyle 500-1000 ng/μL aralığında yüksek DNA konsantrasyonu önerilir. Plazmid DNA stoğunu 80 nM'ye seyreltin; 168 ng/μL pTU1-A-SP44-mScarlet-I plazmid 80 nM'ye eşdeğerdir.
6. Streptomices Master Mix (SMM) çözeltisinin hazırlanması
- Amino asit çözeltisi
- Üreticinin çevrimiçi olarak verdiği talimatları izleyerek manuel hataları önlemek ve hazırlık süresini azaltmak için amino asit örnekleyici kitini kullanın.
- DdH2O kullanarak 20x amino asit stok çözeltisini 6 mM (5 mM L-Leu) nihai konsantrasyona seyreltin.
- 2,4x SMM çözeltisi içinde 2,4 mM 'ye (2 mM L-Leu) kadar daha fazla seyreltin (bkz. Tablo 3).
NOT: TX-TL reaksiyonunda son konsantrasyon 1 mM 19x amino asitler ve 0.83 mM L-Leu'dur.
- Enerji çözeltisi ve katkı maddeleri
- Tablo 3'te açıklanan tarifi izleyerek 2,4x SMM çözeltislerindeki diğer bileşenleri hazırlayın.
- Alternatif olarak, Tablo 3'te açıklanan tarifi izleyerek 2,4x Minimal Enerji Çözeltisi (MES) hazırlayın.
7. Standart bir S. venezuela tx-TL reaksiyon ayarlama
- Hücre ekstresini, SMM (veya MES) çözeltisini ve plazmid DNA'sını buz üzerinde çözün. -20 °C'de 384 kuyulu bir plakayı önceden soğutun.
- Hacmin %25'inin plazmid DNA, %33,33'ünün hücre özü ve %41,67'sinin SMM çözümü olduğu yerlerde TX-TL reaksiyonları ayarlayın; başlangıç zamanı önyargısını önlemek için onları buzda tutun.
NOT: Reaksiyon sayısına göre ihtiyaç duyulan reaktiflerin hacmini hesaplamak için standart bir TX-TL şablonu sağlanmıştır (Tablo 4). 33 μL reaksiyon için standart hacim aşağıdaki gibidir: 11 μL hücre özü, 13,75 μL SMM ve 8,25 μL plazmid DNA. - Çözeltinin homojen olduğundan emin olmak için karışımı düşük hızlı bir ayarda ~5 sn için hafifçe girdaplayın. Köpürme/kabarcık oluşumundan kaçının.
- 10 μL aliquots'u hava kabarcıkları tanıtmadan teknik bir triplicate olarak 384 kuyu plakasının üç kuyusuna aktarın. Plakayı şeffaf bir kapakla kapatın ve 5 sn için 400 × g'da döndürün.
- Reaksiyonun 28 °C'de bir inkübatörde (bitiş noktası okumaları için) veya bir plaka okuyucuda titremeden kuluçkaya ya da inkübatörde kuluçkaya ya da bir plaka okuyucuda kuluçkaya yatırın.
NOT: Reaksiyonların tamamlanması için genellikle 3-4 saat gerekir. Plaka okuyucu ve mScarlet-I standart ölçümleri hakkında rehberlik için Ek Malzeme S2'ye bakın.
Sonuçlar
Bu ayrıntılı protokol, kullanıcının S. venezuelae ATCC 10712 model suşuna dayalı bir Streptomyces TX-TL sistemi kurmasına yardımcı olmak için bir örnek olarak sağlanmıştır (Şekil 1). Kullanıcı diğer Streptomices suşlarını incelemeye çalışabilir; bununla birlikte, daha uzun iki katına çıkış süreleri veya farklı büyüme tercihleri ile diğer suşların büyüme/hasat aşamalarının en yüksek sonuçları elde etmek için özel olarak optimize edilmesi gerekecektir. Temsili sonuç için, pTU1-A-SP44-mScarlet-I standart plazmidinden mScarlet-I floresan proteini (Şekil 2 ve Şekil 3), S. venezuelae TX-TL'de bir dizi algılama yöntemi (SDS-PAGE, floresan) ile yüksek verimli ifade sağlayacak şekilde optimize edilmiştir. Ek olarak, bu standart plazmid, S. rimosus'tan bir dizi ikincil metabolit enziminin sentezini göstermek için değiştirilmiştir (Şekil 2)5. Son olarak, ölçeklenmiş doğal ürün biyosentezi için potansiyel bir iş akışı, heme biyosentezinin erken aşamalarından itibaren bir model yolu kullanmak için bir şema olarak gösterilmiştir. İş akışı potansiyel olarak diğer ikincil metabolit biyosintetik yollarına uyarlanabilir. Kılavuz olarak, bu protokol AddGene'de sağlanan ifade plazmidlerinden sfGFP için minimum 2,8 μM ve mScarlet-I/mVenus için 3,5 μM verim sağlamalıdır. Bu rakamlar, önceki verilerde gözlenen tipik parti varyasyonlarına (%28'e kadar) izin verir5, ancak en uygun partiler (yayınlanmamış veriler) ile 10 μM mScarlet-I'den daha büyük verim elde edilmiştir.
Beş farklı yöntem kullanarak mScarlet-I geninin S. venezuelae TX-TL ölçümü
pTU1-A-SP44-mScarlet-I standart plazmidinin ifadesi, beş farklı yöntem kullanılarak mScarlet-I ifadesinin ölçümü ile gösterilmiştir: 1. dBroccoli aptamer kullanılarak mRNA'nın gerçek zamanlı floresan ölçümü, 2. FlAsH etiket sistemi kullanılarak olgunlaşmamış mScarlet-I proteininin gerçek zamanlı floresan ölçümü, 3. olgun mScarlet-I proteininin gerçek zamanlı floresan ölçümü, 4. FlAsH etiketi kullanılarak mScarlet-I'nin jel floresan boyanması, ve 5. Toplam hücresiz proteinlerin coomassie mavisi lekesi. Bu veriler için reaksiyonlar 2 mL mikrosantrifüj tüplerde 33 μL reaksiyon (uç nokta örnekleri için) veya plaka okuyucuda 384 kuyu plakalarında 10 μL teknik triplikat olarak ayarlanmıştır. Üçlü etiketli (N-terminal His6, C-terminal Flag ve C-terminal FlAsH) mScarlet-I proteini, Ek Malzeme S2'de daha ayrıntılı olarak açıklanan pET15b-mScarlet-I plazmid kullanılarak ölçümler için bir kalibrasyon standardı oluşturmak üzere ayrı ayrı saflaştırılmıştır. Bu denemelerin verileri Şekil 3'te gösterilmiştir. Jel içi floresan boyama yönteminin diğer ayrıntıları Ek Malzeme S3'te mevcuttur.
S. venezuelae Erken evre heme biosentezinin TX-TL'si
Bir model doğal ürün biyosentetik yolu olarak hizmet etmek için, uroporphyrinogen III'ün (uro'gen III) 'tek pota' biyosentezi pTU1-A-SP44-hemC-hemD/cysGA-hemB ekspresyon plazmid5 kullanılarak gerçekleştirildi. Bu model biyosantetik yol, uro'gen III'ün oksijene son derece duyarlı olması ve güçlü kırmızı floresan gösteren uroporphyrin III'e hızla oksitlenmeleri (altı elektron kaybı) olarak seçilmiştir. Bu, daha önce açıklandığı gibi floresan ölçümleri ve/veya HPLC-MS (Şekil 4) kullanılarak reaksiyonun gerçek zamanlı olarak kolayca algılanmasını sağlar5. Ek olarak, bu reaksiyonlar bir toplu veya yarı saydam yöntem kullanılarak çalışılmıştır. Yarı ikiyüzlü reaksiyon, reaksiyon süresini uzatmak ve protein sentezi verimini artırmak için ek enerji (NTP'ler, ikincil enerji kaynağı) ve amino asitler sağlayan bir mikro diyaliz cihazı42,43 kullanan bir stratejidir. Burada, hplc-ms tarafından saflaştırma ve analiz kolaylaştırmak için heme modeli reaksiyonu ölçeklemek ve TX-TL proteinleri reaksiyon ürününden ayırmak için yarı iletken yöntem kullanılır. Yöntemlerin daha fazla ayrıntısı Ek Malzeme S4'te mevcuttur veya veriler için önceki çalışmaya bakın5. Yarı saydam hücre içermeyen reaksiyonlar da önceki çalışmalarda açıklanmıştır42,43. Burada gösterilen örnek şematik iş akışı (Şekil 4) diğer doğal ürün biyosyntetik yollarına potansiyel olarak uyarlanabilir.
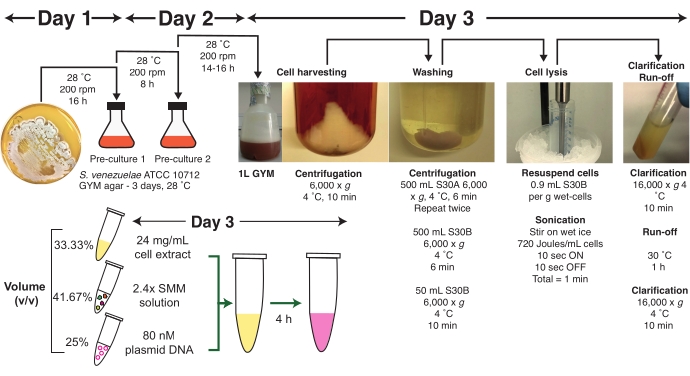
Şekil 1: Streptomyces venezuelae TX-TL protokolüne genel bakış. Üç günlük önerilen bir zaman dilimi de dahil olmak üzere bir protokol özeti gösterilmiştir. Protokol, hücre büyümesi, hücre hasadı, hücre yıkama, sonication ile hücre lizisi, açıklama, çalıştırma reaksiyonu, master mix (SMM) hazırlama, plazmid DNA hazırlama ve TX-TL reaksiyon tertibatının farklı aşamalarına ayrılır. Tam protokol, rehberlik ve pratik ipuçları ile birlikte metin içinde ayrıntılı olarak açıklanmıştır. Kısaltmalar: SMM = Streptomices Master Mix; TX-TL = transkripsiyon-çeviri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Yüksek G+C (%) genlerinden yüksek verimli protein sentezi. (A) SfGFP, mVenus-I ve mScarlet-I floresan proteinlerinin sentezi. (B) Streptomices rimosus'tan biyosentetik enzimlerin sentezi. Kısaltma: EV = Boş Vektör; NRPS = nonribosomal peptit sintetaz. Şekil 5'ten değiştirilir. Reaksiyon kurulumu ve metodolojisi için lütfen protokole ve ek dosyalara bakın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: PTU1-A-SP44-mScarlet-I plazmid ile TX-TL'nin beş yönlü ölçümü. (A) Aşağıdaki özellikleri içeren plazmid tasarımı: SP44, Streptomyces spp. ve E. coli'de aktif olan güçlü bir kurucu organizatördür; pET-RBS, pET ekspresyon plazmidlerinden türetilmiştir ve hem Streptomyces spp. hem de E. coli5,40'ta oldukça aktiftir; Streptomices, kırmızı floresan protein türevini kodlayan kodlanmış mScarlet-I geni44; Benzeşim kromatografisi saflaştırma veya batı şişkinlik tespiti için C-terminal FLAG etiketi; Jel içi boyama veya nascent protein sentezinin gerçek zamanlı ölçümü için floresan etiketleme için C-terminal FlAsH etiketi; DFHBI probu kullanılarak gerçek zamanlı mRNA ölçümü için dBroccoli aptamer; S. venezuelae ATCC 107125'te yüksek verimli olan Bba_B0015 transkripsiyon sonlandırıcısı; ampisilin direnç belirteci; ve pUC19 çoğaltma kaynağı. (B) dBroccoli aptamer ve DFHBI probu ile tespit edilen gerçek zamanlı mRNA ifadesi (heyecan 483-14 nm, emisyon 530-30 nm). (C) FlAsH-EDT2 floresan probu ile gerçek zamanlı nascent protein sentezi tespiti (ekscitasyon 500-10 nm, emisyon 535-10 nm). (D) mScarlet-I sentezinin gerçek zamanlı floresan ölçümü (ekscitasyon 565-10 nm, emisyon 600-10 nm). (E) FlAsH-EDT2 floresan probu ile jel içi boyama. (F) Karşılaştırma için saflaştırılmış His6-mScarlet-I standardı ile toplam TX-TL proteinlerinin coomassie mavi lekesi. Reaksiyonlar, protokolde açıklanan koşullar altında 40 nM plazmid DNA şablonu ile çalıştırıldı. Tüm floresan verileri RFU olarak temsil edilir ve hata çubukları (üç teknik yinelemenin standart sapması) gri gölgeli bir alanda temsil edilir. Kısaltmalar: TX-TL = transkripsiyon-çeviri; FlAsH = fluorescein arsenik hairpin; DFHBI = 3,5-difluoro-4-hidroksibenzylidene imidazolinone; RFU = göreli floresan üniteleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: S. venezuelae TX-TL yarı saydam reaksiyon için şematik iş akışı. HPLC-MS tarafından erken aşama heme biyosintetik operon ve aşağı akış analizi kullanılarak doğal ürün TX-TL için örnek bir iş akışı. Reaksiyonlar ve analizler ek malzemede ayrıntılı olarak açıklanmıştır. Şekil 5'ten değiştirilir. Kısaltmalar: SMM = Streptomices Master Mix; TX-TL = transkripsiyon-çeviri; ALA = 5-aminolevulik asit; SPE = katı faz ekstraksiyonu; ESI-MS = elektron sprey iyonlaşması-kütle spektrometresi; HPLC-MS = yüksek performanslı sıvı kromatografisi-kütle spektrometresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: GYM bakteri üreme ortamı ve GYM agar tabağı tarifi. Bu Tabloyu indirmek için lütfen tıklayınız.
Tablo 2: S30A ve S30B yıkama tamponlarını hazırlamak için reaktifler. Bu bilgi Kieser ve ark.'dan uyarlanmıştır. 45 Kısaltma: DTT = dithiothreitol. Bu Tabloyu indirmek için lütfen tıklayınız.
Tablo 3: S. venezuelae MES ve SMM çözümleri yapma tarifi. Kısaltmalar: MES = Minimal Enerji Çözümü; SMM = Streptomices Master Mix; NTP = nükleozid trifosfat; PEG 6000 = polietilen glikol 6000; 3-PGA = 3-fosfolycerat; G6P = glikoz-6-fosfat; PVSA = polivinilsülonik asit. Bu Tabloyu indirmek için lütfen tıklayınız.
Tablo 4: S. venezuelae TX-TL reaksiyon tarifi. Kısaltmalar: MES = Minimal Enerji Çözümü; SMM = Streptomices Master Mix; TX-TL = transkripsiyon-çeviri. Bu Tabloyu indirmek için lütfen tıklayınız.
Ek Tablo S1: S. venezuelae TX-TL iş akışı için plazmidler. Kısaltma: TX-TL = transkripsiyon-çeviri. Bu Tabloyu indirmek için lütfen tıklayınız.
Ek Malzeme S2: mScarlet-I kalibrasyon standart hazırlama ve plaka okuyucu ölçümleri. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Malzeme S3: FlAsH-tag yöntemleri. Kısaltma: FlAsH = fluorescein arsenical hairpin. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Malzeme S4: Yarı saydam reaksiyon, saflaştırma ve HPLC-MS. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Bu yazıda, TX-TL sistemlerinin hem deneyimli hem de yeni kullanıcıları için yürütülmesi kolay ayrıntılı adımlarla yüksek verimli bir S. venezuelae TX-TL protokolü açıklanmıştır. Mevcut Streptomyces45 ve E. coli TX-TL41 protokollerinden çeşitli özellikler, S. venezuelae TX-TL5,26 için minimal, ancak yüksek verimli bir protokol oluşturmak için kaldırılmıştır. Burada önerilen iş akışı, S. venezuelae'nin seçilen zengin ortamda hızla büyümesini sağlamak, akşamları nihai kültürü aşılayabilmektir. Bu, ertesi sabah en yüksek büyümede hücre hasadına izin verir ve kullanıcının aktif hücre ekstresini aynı gün toplamasına ve hazırlamasına izin verir. Bu kolaylaştırılmış protokolü izleyerek, tek bir araştırmacının protokolü üç günlük bir çerçevede rahatça tamamlayabilmesi beklenir. S. venezuelae TX-TL sistemi için, mRNA/protein analizi için geniş işlevsellik sağlayan güçlü bir ifade plazmid sistemi (pTU1-A-SP44-mScarlet-I) dahil olmak üzere tamamlayıcı bir plazmid araç seti de sağlanmıştır. Bu standart plazmid, çeşitli Streptomyces spp'de oldukça aktif olan constitutive SP44 promotörü tarafından desteklenmektedir. ve E. coli39'da. S. venezuelae TX-TL araç setinin başlangıç potansiyelini göstermek için, temsili sonuçlar bir dizi floresan proteinin, ikincil metabolit enzimlerinin ve bir model doğal ürün yolunun biyosentezinin (heme biosentezinden) yüksek verimli sentezini göstermektedir.
Genel olarak, protokol S. venezuelae TX-TL sisteminin ayrıntılı bir açıklamasının yanı sıra TX-TL reaksiyonunun üç temel bileşenini hazırlamak için pratik ipuçları içerir: (1) hücre özü, (2) Streptomices Master Mix (SMM) çözeltisi ve (3) plazmid DNA. Bu protokol özel ekipman gerektirmez ve sadece rutin mikrobiyoloji ve biyokimya becerileri gerektirir; bu nedenle, çoğu laboratuvar tarafından erişilebilir. Protokol küçük ölçekli (10-100 μL) ve daha büyük ölçekli reaksiyonlar (~2,5 mL) için uygundur, ancak reaksiyon boyutunun / havalandırmasının bazı optimizasyonu protein verimini etkileyebilir. Önerilen reaksiyon hacmi 2 mL'lik bir tüpte 33 μL veya 384 kuyulu bir plakada 10 μL'dir. Ham özün gliserol stoğundan başlayarak tek bir kişi tarafından hazırlanması beş gün sürer. Kültürün her litresi (L) en az 5 mL hücre ekstresi verir (~1500 x 10 μL TX-TL reaksiyonlara eşdeğerdir)- bu muhafazakar bir tahmindir ve yıkama adımları ve hücre özü açıklaması sırasında örnek kaybını hesaba katmaktadır. Protokolün her aşaması bağımsızdır ve kullanıcı tarafından ihtiyaçlarını karşılayacak şekilde optimize edilebilir. Tüm hücresiz sistemler için önemli bir sınırlama toplu değişim46,47'dir. Genel faktörler arasında pipetleme hatası, kullanıcı deneyimi, ortam toplu iş varyasyonu ve ekipman farklılıkları bulunur. Pipetleme hatasını en aza indirmek ve medya ve ekipman kullanımını kapsayan ayrıntılı talimatlar sağlamak için özellikle bir ana karışım sunuyoruz. Bugüne kadar, protokol en az beş birleşik krallık araştırma grubundaki bir dizi kullanıcı tarafından tekrarlanabilir. Bununla birlikte, biyolojik varyasyonun hücresiz parti değişkenliğine nasıl bir rol katkıda bulunduğu bilinmemektedir. Küresel gen ekspresyon düzenleme farklılıklarının yanı sıra, Streptomyces spp.'deki genom plastisitesi yaygın olarak bildirilmektedir ve potansiyel bir katkıda bulunmaktadır48. Toplu varyasyonu araştırmak için, bir gecede yetiştirilen dört tek koloniden elde edilen dört ayrı 1 L kültürüne kadar büyümeniz önerilir. Daha önce, dört biyolojik parti arasında %28'e varan değişim (standart sapma açısından) gözlenmiştir (parti başına 4 L, ~20 mL hücre özü sağlanmıştır)5. Bu verilere dayanarak, yeni bir kullanıcı için makul bir minimum hedef sfGFP için 2,8 μM ve AddGene-bu hedeflerde bulunan plazmidleri kullanan 3,5 μM mScarlet-I/mVenus-I önceki verilerde gözlenen ortalamadan% 30 daha düşüktür. Aşağı akış HPLC-MS analizi istenirse, PEG 6000 ana karışımlardan çıkarılabilir, ancak genel TX-TL veriminde% 50'ye kadar bir düşüş beklenebilir.
Özel Streptomices hücresiz sistemlerin potansiyeli açısından5,6, doğal ürünler gibi biyoprospektif uygulamalar için yeni ıslak laboratuvar araçları geliştirme arzusu artmaktadır. Streptomices cinsi antibiyotikler, herbisitler ve farmasötik ilaçlar da dahil olmak üzere doğal ürün keşfi tarihine gömülmüştür49. Tüm genom dizileme projelerinden ve en son biyoinformatik araçlardan elde edilen artan bilgi50,51,52, mikrobiyal genomlar içindeki BGC'ler tarafından kodlanan benzeri görülmemiş bir doğal ürün seviyesini ortaya çıkarmıştır53. Biyoteknolojiye yararlı yeni ilaçlar / kimyasallar ve enzimler tutması beklenen bu genetik bilginin kilidini açmak, yeni ifade sistemleri ve bir dizi metabolik mühendislik aracı da dahil olmak üzere yeni sentetik biyoloji stratejilerinin geliştirilmesini gerektirecektir54. Özel Streptomices tabanlı TX-TL sistemleri, actinobacteria ve ilgili genomlardan genleri ve düzenleyici unsurları aşağıdaki nedenlerden dolayı incelemek için avantajlıdır: [1] yerel protein katlama ortamının mevcudiyeti26, [2] yüksek G+C (%) gen ekspresyumu için en uygun tRNA havuzuna erişim ve [3] biyosinetik öncüllerin potansiyel tedariki için aktif bir birincil metabolizma. Buna ek olarak, hücresiz sistemlerin önemli bir avantajı, yeni nesil sıralama13 ve akustik sıvı taşıma robotik8,11,12 kullanılarak genetik parçaların ve gen ekspresyonunun yüksek verimli karakterizasyonudur. Özetle, S. venezuelae TX-TL araç seti5, doğal ürünler için sentetik biyoloji alanında tamamlayıcı bir araç sağlar. S. venezuelae TX-TL araç seti, S. venezuelae'nin bir model sistemi olarak daha da geliştirilmesini destekleyecek ve yeni sentetik biyoloji parçaları / araçları tasarlamak ve ikincil metabolit biyo sentetik yollarını ve enzimlerini keşfetmek için bir yöntem sağlayacaktır.
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Yazarlar aşağıdaki araştırma desteğini kabul etmek isterler: PSF'li bir PDRA olarak SJM için EPSRC [EP/K038648/1] ; Wellcome Trust, Imperial College London'da PSF ile SJM için ISSF bursu sponsoru oldu; Royal Society araştırma hibesi [RGS\R1\191186]; Kent Üniversitesi'nde SJM için Wellcome Trust SEED ödülü [217528/Z/19/Z]; ve Kent Üniversitesi'nde KC için Global Challenges Araştırma Fonu (GCRF) doktora bursu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2.5 L UltraYield Flask | Thomson | 931136-B | |
| 3-PGA (>93%) | Sigma | P8877 | |
| 384 Well Black/Clear Bottom Plate | ThermoFisher | 10692202 | |
| Ammonium chloride (98%) | Fluorochem | 44722 | |
| ATP, CTP, UTP, GTP (100 mM solution, >99%) | ThermoFisher | R0481 | |
| Carbenicillin (contact supplier for purity) | Melford | C46000-25.0 | |
| D-(+)-glucose (contact supplier for purity) | Melford | G32040 | |
| DFHBI (≥98% - HPLC) | Sigma | SML1627 | |
| DTT (contact supplier for purity) | Melford | MB1015 | |
| FlAsH-EDT2 (contact supplier for purity) | Santa Cruz Biotech | sc-363644 | |
| Glucose-6-phosphate (>98%) | Sigma | G7879 | |
| HEPES Free Acid (contact supplier for purity) | Melford | B2001 | |
| L-glutamic acid hemimagnesium salt tetrahydrate (>98%) | Sigma | 49605 | |
| Magnesium chloride (98%) | Fluorochem | 494356 | |
| Malt extract | Sigma | 70167-500G | |
| PEG-6000 | Sigma | 807491 | |
| Pierce 96-well Microdialysis Plate, 10K MWCO | ThermoFisher | 88260 | |
| Poly(vinyl sulfate) potassium salt | Sigma | 271969 | |
| Potassium glutamate (>99%) | Sigma | G1149 | |
| RTS amino acid sampler | 5 Prime | 2401530 | |
| Sodium chloride (99%) | Fluorochem | 94554 | |
| Supelclean LC-18 SPE C-18 SPE column (1 g) | Sigma | 505471 | |
| Yeast Extract | Melford | Y1333 | |
| Equipment | |||
| Platereader | BMG | Omega |
Referanslar
- Carbonell, P., et al. An automated Design-Build-Test-Learn pipeline for enhanced microbial production of fine chemicals. Communications Biology. 1, 66 (2018).
- Gregorio, N. E., Levine, M. Z., Oza, J. P. A user's guide to cell-free protein synthesis. Methods Protocols. 2 (1), 24 (2019).
- Zimmerman, E. S., et al. Production of site-specific antibody-drug conjugates using optimized non-natural amino acids in a cell-free expression system. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- Wiegand, D. J., Lee, H. H., Ostrov, N., Church, G. M. Cell-free protein expression using the rapidly growing bacterium Vibrio natriegens. Journal of Visualized Experiments: JoVE. (145), e59495 (2019).
- Moore, S. J., et al. A Streptomyces venezuelae cell-free toolkit for synthetic biology. ACS Synthetic Biology. 10 (2), 402-411 (2021).
- Xu, H., Liu, W. -. Q., Li, J. Translation related factors improve the productivity of a Streptomyces-based cell-free protein synthesis system. ACS Synthetic Biology. 9 (5), 1221-1224 (2020).
- Yim, S. S., et al. Multiplex transcriptional characterizations across diverse bacterial species using cell-free systems. Molecular Systems Biology. 15 (8), 8875 (2019).
- Moore, S. J., et al. Rapid acquisition and model-based analysis of cell-free transcription-translation reactions from nonmodel bacteria. Proceedings of the National Academy of Sciences of the United States of America. 115 (19), 4340-4349 (2018).
- Zawada, J. F., et al. Microscale to manufacturing scale-up of cell-free cytokine production--a new approach for shortening protein production development timelines. Biotechnology and Bioengineering. 108 (7), 1570-1578 (2011).
- Geertz, M., Shore, D., Maerkl, S. J. Massively parallel measurements of molecular interaction kinetics on a microfluidic platform. Proceedings of the National Academy of Sciences of the United States of America. 109 (41), 16540-16545 (2012).
- McManus, J. B., Emanuel, P. A., Murray, R. M., Lux, M. W. A method for cost-effective and rapid characterization of engineered T7-based transcription factors by cell-free protein synthesis reveals insights into the regulation of T7 RNA polymerase-driven expression. Archives of Biochemistry and Biophysics. 674, 108045 (2019).
- McManus, J. B., et al. A method for cost-effective and rapid characterization of genetic parts. bioRxiv. , (2021).
- Park, J., Yim, S. S., Wang, H. H. High-throughput transcriptional characterization of regulatory sequences from bacterial Biosynthetic Gene Clusters. ACS Synthetic Biology. , (2021).
- Caschera, F., Noireaux, V. Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie. 99, 162-168 (2014).
- Caschera, F., Noireaux, V. A cost-effective polyphosphate-based metabolism fuels an all E. coli cell-free expression system. Metabolic Engineering. 27, 29-37 (2015).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. coli RNA polymerase and sigma factor 70. Journal of Biological Engineering. 4, 8 (2010).
- Karim, A. S., Heggestad, J. T., Crowe, S. A., Jewett, M. C. Controlling cell-free metabolism through physiochemical perturbations. Metabolic Engineering. 45, 86-94 (2018).
- Cai, Q., et al. A simplified and robust protocol for immunoglobulin expression in Escherichia coli cell-free protein synthesis systems. Biotechnology Progress. 31 (3), 823-831 (2015).
- Garenne, D., Thompson, S., Brisson, A., Khakimzhan, A., Noireaux, V. The all-E. coli TXTL toolbox 3.0: New capabilities of a cell-free synthetic biology platform. Synthetic Biology. , (2021).
- Goering, A. W., et al. In vitro reconstruction of nonribosomal peptide biosynthesis directly from DNA using cell-free protein synthesis. ACS Synthetic Biology. 6 (1), 39-44 (2017).
- Khatri, Y., et al. Multicomponent microscale biosynthesis of unnatural cyanobacterial indole alkaloids. ACS Synthetic Biology. 9 (6), 1349-1360 (2020).
- Zhuang, L., et al. Total in vitro biosynthesis of the nonribosomal macrolactone peptide valinomycin. Metabolic Engineering. 60, 37-44 (2020).
- Hoskisson, P. A., Seipke, R. F. Cryptic or silent? The known unknowns, unknown knowns, and unknown unknowns of secondary metabolism. mBio. 11 (5), 02642 (2020).
- Bentley, S. D., et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 417 (6885), 141-147 (2002).
- Li, J., Wang, H., Kwon, Y. -. C., Jewett, M. C. Establishing a high yielding Streptomyces-based cell-free protein synthesis system. Biotechnology and Bioengineering. 114 (6), 1343-1353 (2017).
- Moore, S. J., Lai, H. -. E., Needham, H., Polizzi, K. M., Freemont, P. S. Streptomyces venezuelae TX-TL - a next generation cell-free synthetic biology tool. Biotechnology Journal. 12 (4), (2017).
- Kim, W., et al. Comparative genomics determines strain-dependent secondary metabolite production in Streptomyces venezuelae strains. Biomolecules. 10 (6), 864 (2020).
- Phelan, R. M., et al. Development of next generation synthetic biology tools for use in Streptomyces venezuelae. ACS Synthetic Biology. 6 (1), 159-166 (2017).
- Song, J. Y., et al. Complete genome sequence of Streptomyces venezuelae ATCC 15439, a promising cell factory for production of secondary metabolites. Journal of Biotechnology. 219, 57-58 (2016).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. mBio. 4 (5), 00684 (2013).
- Schumacher, M. A., et al. The crystal structure of the RsbN-σBldN complex from Streptomyces venezuelae defines a new structural class of anti-σ factor. Nucleic Acids Research. 46 (14), 7405-7417 (2018).
- Ramos-León, F., et al. A conserved cell division protein directly regulates FtsZ dynamics in filamentous and unicellular actinobacteria. Elife. 10, 63387 (2021).
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in Streptomycetes. Nature Reviews. Microbiology. 13 (12), 749-760 (2015).
- Ehrlich, J., Gottlieb, D., Burkholder, P. R., Anderson, L. E., Pridham, T. G. Streptomyces venezuelae, n. sp., the source of chloromycetin. Journal of Bacteriology. 56 (4), 467-477 (1948).
- Inahashi, Y., et al. Watasemycin biosynthesis in Streptomyces venezuelae: thiazoline C-methylation by a type B radical-SAM methylase homologue. Chemical Science. 8 (4), 2823-2831 (2017).
- Jakeman, D. L., et al. Antimicrobial activities of jadomycin B and structurally related analogues. Antimicrobial Agents and Chemotherapy. 53 (3), 1245-1247 (2009).
- Kodani, S., Sato, K., Hemmi, H., Ohnish-Kameyama, M. Isolation and structural determination of a new hydrophobic peptide venepeptide from Streptomyces venezuelae. Journal of Antibiotics. 67 (12), 839-842 (2014).
- Akey, D. L., et al. Structural basis for macrolactonization by the pikromycin thioesterase. Nature Chemical Biology. 2 (10), 537-542 (2006).
- Bai, C., et al. Exploiting a precise design of universal synthetic modular regulatory elements to unlock the microbial natural products in Streptomyces. Proceedings of the National Academy of Sciences of the United States of America. 112 (39), 12181-12186 (2015).
- Moore, S. J., et al. EcoFlex: A multifunctional MoClo kit for E. coli synthetic biology. ACS Synthetic Biology. 5 (10), 1059-1069 (2016).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. Journal of Visualized Experiments: JoVE. (79), e50762 (2013).
- Kim, D. M., Choi, C. Y. A semicontinuous prokaryotic coupled transcription/translation system using a dialysis membrane. Biotechnology Progress. 12 (5), 645-649 (1996).
- Liu, Y., Fritz, B. R., Anderson, M. J., Schoborg, J. A., Jewett, M. C. Characterizing and alleviating substrate limitations for improved in vitro ribosome construction. ACS Synthetic Biology. 4 (4), 454-462 (2015).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14, 53-56 (2017).
- Hopword, D. A., Kieser, T., Bibb, M. J., Buttner, M. J., Chater, K. Practical Streptomyces genetics. John Innes Foundation. , (2000).
- Hunter, D. J. B., Bhumkar, A., Giles, N., Sierecki, E., Gambin, Y. Unexpected instabilities explain batch-to-batch variability in cell-free protein expression systems. Biotechnology and Bioengineering. 115 (8), 1904-1914 (2018).
- Dopp, J. L., Jo, Y. R., Reuel, N. F. Methods to reduce variability in E. coli-based cell-free protein expression experiments. Synthetic and Systems Biotechnology. 4 (4), 204-211 (2019).
- Hoff, G., Bertrand, C., Piotrowski, E., Thibessard, A., Leblond, P. Genome plasticity is governed by double strand break DNA repair in Streptomyces. Scientific Reports. 8, 5272 (2018).
- Bibb, M. J. Regulation of secondary metabolism in streptomycetes. Current Opinion in Microbiology. 8 (2), 208-215 (2005).
- Weber, T., et al. antiSMASH 3.0-a comprehensive resource for the genome mining of biosynthetic gene clusters. Nucleic Acids Research. 43 (1), 237-243 (2015).
- Navarro-Muñoz, J. C., et al. A computational framework to explore large-scale biosynthetic diversity. Nature Chemical Biology. 16, 60-68 (2020).
- Alanjary, M., et al. The Antibiotic Resistant Target Seeker (ARTS), an exploration engine for antibiotic cluster prioritization and novel drug target discovery. Nucleic Acids Research. 45 (1), 42-48 (2017).
- Medema, M. H., Fischbach, M. A. Computational approaches to natural product discovery. Nature Chemical Biology. 11 (9), 639-648 (2015).
- Whitford, C. M., Cruz-Morales, P., Keasling, J. D., Weber, T. The Design-Build-Test-Learn cycle for metabolic engineering of Streptomycetes. Essays in Biochemistry. , (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır