Method Article
合成生物学と天然物アプリケーションのための高収量スト レプトマイス 転写翻訳ツールキット
要約
このプロトコルは、 ストレプトマイセスベネズエラ 細胞非転写変換(TX-TL)システムから組み換えタンパク質の高収率を合成するための強化された方法を詳述する。
要約
ストレプトマイセス spp.は、臨床抗生物質および工業薬品の主要な供給源である。 ベネズエラのレンサトミース ATCC 10712は、成長が急速に進む菌株であり、クロラムフェニコール、ヒドマイシン、ピクロマイシンの天然生産者であり、次世代の合成生物学シャーシとして魅力的な候補です。したがって、 S.ベネズエラ ATCC 10712の開発を加速する遺伝的ツールは、他の ストレプトマイセス spp.モデルと同様に、天然物工学および発見のために非常に望ましい。この上、専用 のS.ベネズエラ ATCC 10712無細胞システムは、高G+C(%)遺伝子の高収率異種発現を可能にするために、このプロトコルに提供されています。このプロトコルは、96ウェルまたは384ウェルプレート形式の小規模(10-100 μL)バッチ反応に適していますが、反応はスケーラブルである可能性があります。無細胞システムは堅牢で、最小限のセットアップで組み換えタンパク質の範囲のための高収率(〜5-10 μ M)を達成することができます。また、mRNAやタンパク質合成のリアルタイム測定、タグ付きタンパク質のインゲル蛍光染色用の広範なプラスミドツールセットも組み込まれています。このプロトコルは、高スループットの遺伝子発現特性解析ワークフローや、アクチノマイセテスゲノムに存在する高G+C(%)遺伝子からの酵素経路の研究と統合することもできる。
概要
無細胞転写翻訳(TX-TL)システムは、合成生物学の概念的なエンジニアリングフレームワークである迅速な設計構築テスト学習サイクルを実装するための、合成生物学のための理想的なプロトタイピングプラットフォームを提供します。また、開放反応環境における高価値組換えタンパク質生産に対するTX-TLシステムへの関心が高まっている2は、例えば、抗体薬物コンジュゲート3に非標準アミノ酸を組み込む。具体的には、TX-TLは、細胞抽出物、プラスミドまたは線形DNA、およびバッチまたは半連続反応でタンパク質合成を触媒するエネルギー溶液を必要とする。エシェリヒア・コリTX-TLは、支配的な無細胞システムである一方で、多くの非モデルTX-TLシステムは、さまざまなアプリケーションのために注目を集めています 4,5,6,7,8.TX-TLの主な利点は、柔軟な拡張性(ナノリットルからリットルスケール)9,10、強力な再現性、自動化されたワークフロー8、11、12です。特に、TX-TLの自動化により、遺伝的部分および調節要素の加速的な特性評価が可能となる8,12,13.
反応のセットアップの面では、TX-TLは、一次および二次的なエネルギー源、ならびにアミノ酸、補因子、添加剤、およびテンプレートDNA配列の両方を必要とする。ヌクレオチド三リン酸(NTP)は、初期mRNA(ATP、GTP、CTP、およびUTP)およびタンパク質合成(ATPおよびGTPのみ)を駆動する一次エネルギー源を提供します。TX-TL収率を高めるために、NTPはマルトーゼ14、マルトデキストリン15、グルコース14、3-ホスホグリセリン酸(3-PGA)16、ホスホエノールピルビン酸17、L-グルタミン酸18などの二次エネルギー源の同化を通じて再生される。この固有の代謝活性は驚くほど多目的であり、特に新興のTX-TLシステムでは、まだ十分に研究されていません。各エネルギー源は、スケールアップTX-TL反応に重要な考慮すべきATP収量、化学的安定性、コストの点で、それぞれ異なる特性と利点を有します。これまでのところ、 大腸菌 TX-TLの電流プロトコルは、3-PGA(30 mM)、マルトデキストリン(60mM)、D-リボース(30mM)を二次エネルギー源として使用して、モデルグリーン蛍光タンパク質(GFP)で最大4.0mg/mL(約157μM)に達しています。
最近、TX-TLシステム20,21,22の二次代謝産物生合成経路の研究に対する関心が高まっています。具体的には、アクチノバクテリアは、抗生物質および農薬23,24を含む二次代謝産物の主要な供給源である。彼らのゲノムは、二次代謝産物生合成のための酵素経路をコードする、いわゆる生合成遺伝子クラスター(BGC)で濃縮されています。アクチノバクテリアの遺伝子部分と生合成経路の研究のために、ストレプトマイセスベースのTX-TLシステムの範囲が最近開発された5,6,25,26。これらの特殊なストレプトマイセスTX-TLシステムは、以下の理由で潜在的に有益である:[1]ストレプトマイセスspp.26からの酵素のための天然タンパク質折りたたみ環境の提供;[2] 高G+C(%)遺伝子発現に最適なtRNAプールへのアクセス;[3] 生合成前駆体の供給のためにハイジャックされる可能性のある活発な一次代謝;[4] 天然細胞抽出物に存在する二次代謝からの酵素、前駆体、または補因子の提供。したがって、これらのユニークな機能を活用するために、高収率S.ベネズエラTX-TLツールキットが最近設立されました5。
ストレプトミセスベネズエラは、工業バイオテクノロジーの豊富な歴史を持つ合成生物学の新たな宿主であり、アクチノバクテリア30,31,32の細胞分裂と遺伝子調節を研究するためのモデルシステムとして使用されています。主型のS.ベネズエラATCC 10712は、7377のコード配列、21rRNA、67 tRNA、および30個の生合成遺伝子クラスター27をコードする72.5%G+C含有量(加盟番号:CP029197)を有する8.22 Mbの比較的大きなゲノムを有する。合成生物学では、S. ベネズエラ ATCC 10712 は生合成経路の異種発現のための魅力的なシャーシです。他のほとんどのストレプトマイセス染色とは異なり、急速な倍倍時間(〜40分)、遺伝的および実験ツールの広範な範囲5,28、骨髄凝集の欠如、および液体培地における胞子形成を含むいくつかの重要な利点を提供する28,33。いくつかの研究はまた、ポリケチド、リボソームおよび非リボソームペプチド34、35、36、37、38を含む二次代謝産物の多様な配列の異種産生のためのS.ベネズエラの使用を実証している。これらの組み合わせの特徴は、この株は、合成生物学や代謝工学のアプリケーションのための魅力的な微生物宿主になります。S.ベネズエラは異種遺伝子発現の支配的なストレプトマイセスモデルではありませんが、さらなる発展に伴い、天然物発見におけるより広範な使用のために準備されています。
この原稿は、以前に公開された元のプロトコル26から更新された高収率S.ベネズエラTX-TLシステムの詳細なプロトコル(図1)を提示する。この研究では、エネルギー溶液と反応条件が最適化され、標準プラスミドpTU1-A-SP44-mScarlet-Iを用いた4時間、10μLバッチ反応でmScarlet-Iレポータータンパク質のタンパク質収量を最大260μg/mLに増加させます。このプラスミドは、タンパク質発現を検出する様々な方法を有効にするように特別に設計されています。このプロトコルも合理化され、エネルギーシステムは、収量を損なうことなく無細胞反応を設定する複雑さとコストを削減するために最適化されています。最適化されたTX-TLシステムに加えて、遺伝子発現を微調整し、TX-TLをリアルタイムでモニタリングするための蛍光ツールとして開発された遺伝部分のライブラリを開発し、ストレプトマイセスspp.および関連するアクチノバクテリアからの遺伝子発現および天然物生合成経路を試作するための汎用性の高いプラットフォームを作成しました。
この研究では、推奨標準プラスミド(pTU1-A-SP44-mScarlet-I)を使用して、新しい実験室でS.ベネズエラTX-TLワークフローを確立し、AddGeneで利用可能です(補足表S1を参照)。pTU1-A-SP44-mScarlet-I は、他のオープンリーディングフレーム (ORF) を柔軟に学習できます。mScarlet-I ORFは、S.ベネズエラ遺伝子発現に対してコドン最適化されています。SP44プロモーターは、大腸菌およびストレプトマイセスspp.39の両方で高活性である強力な構成プロモーターです。プラスミドは、2つのユニークな制限酵素部位(NdeI、BamHI)を有し、C末端FLAGタグとフルオレセインアーセニカルヘアピン(FlAsH)バインダータグシステムを有する新しいORFをフレーム内でサブクローニングすることを可能にする。あるいは、両方のタグを、新しい遺伝子をサブクローニングした後に停止コドンを含めて除去することができる。この塩基ベクターにより、様々なタンパク質の高収率発現、すなわち、オキシテトラサイクリン生合成経路からのタンパク質と、ストレプトマイセスリモサスからの非リボソームペプチド合成酵素(NRPS)の発現が実証されている(図2)。mRNA検出の観点から、pTU1-A-SP44-mScarlet-I標準プラスミドは、3,5-ジフルオロ-4-ヒドロキシベンジリデンイミダゾリニヨン(DFHBI)プローブで検出するためのdBroccoliアプタマー(3'未翻訳領域)を含んでいます。柔軟性を高めるために、EcoFlex40互換のMoClo部品のツールセットもAddGeneで利用可能になりました。 EcoFlex互換ストレプトマイセスシャトルベクター(pSF1C-A-RFP/pSF2C-A-RFP)およびスーパーフォルダグリーン蛍光タンパク質(sfGFP)を発現するpTU1-A-SP44変異プラスミドの範囲、mScarlet-I、mVenus-I、β-グルクリダーゼ(GUS)を含む。特に、pSF1C-AプラスミドはpAV-gapdh28に由来し、MoCloアセンブリのBsaI/BsmBI部位を硬化する。pSF1C-A-RFP/pSF2C-A-RFPはEcoFlex40のpTU1-A-RFP/pTU2-A-RFPに相当しますが、ストレプトマイセスsppの共役および染色体統合のための追加機能が含まれています。phiC31インテグラーゼシステム28を使用して。
プロトコルの第1段階は 、S.ベネズエラATCC 10712または密接に関連株の成長、中指数相での細胞収穫、細胞洗浄ステップ、およびS30AおよびS30Bバッファーの平衡化を含む。この段階は3日を要し、細胞増殖の時間は、以下に説明するように残りの成分を調製するために使用することができる。採取した細胞は、超音波処理によって分解され、明確化され、流出反応を受ける。この調製の最終段階では、細胞抽出物を-80°Cで長期保存して活性の損失を最小限に抑えることができます。このプロトコルを使用したTX-TL反応の組み立てでは、スト レプトマイセス マスターミックス(SMM)が提示され、同等の収率を与える最小エネルギー溶液フォーマット(MES)のオプションが表示されます。さらに、S .ベネズエラ ATCC 10712の新鮮な培養物を-80°CグリセロールストックからGYM寒天プレートにストリークし、28°Cで少なくとも48〜72時間インキュベートして、単一のコロニーが見えるまで推奨されます。次の手順では、新鮮なカルチャのみを使用する必要があります。
プロトコル
注:GYM培地と寒天プレート、S30AおよびS30B洗浄バッファのレシピについては、 表1 と 表2 を参照してください。
1. ソリューションの作成と一般的なガイダンス
- 例外が記載されていない限り、すべての溶液、細胞(成長後)、および細胞抽出物を調製後に氷上に保管してください。
- 1 M Mg-グルタミン酸、4 M K-グルタミン酸、40%(w/v)PEG 6000、室温で1 g/mLポリビニルスルホン酸、および-80°Cで他のすべての株式を保管します。 化学分解を避けるために、フリーズ融解サイクルの数を最小限に抑えます。
- 3-PGA(pH調整が必要)などのエネルギー溶液ストック( 表3参照)の調製については、 大腸菌 TX-TLプロトコル41に記載のガイダンスに従ってください。
注:すべての成分はddH2Oに完全に溶解し、-80°Cの冷凍庫にアリコートとして保存されます。 - 氷上の個々の在庫またはエネルギーソリューション(後述)を解凍します。42°Cでアミノ酸ストックを熱し、渦を〜15〜30分間加熱し、すべてのアミノ酸を可溶化します。
- 一部のアミノ酸(L-Cys、L-Tyr、L-Leu)が氷上で沈殿するので、安静時間を最小限に抑えながら、この溶液を室温に残し、渦を使用して溶解します。
- ストックソリューションと水の計算されたボリューム(表3)を追加し、渦を使用してよく混ぜます。
- Aliquotは、エネルギー溶液をチューブあたり20〜100 μLアリコートとして、または望ましいように氷上に、さらに使用するまで-80°Cで保存する。
2. ベネズエラATCC 10712細胞の調製
- 1日目-メディア/バッファ調製および夜間プレカルチャー
- 表1に記載されているように、2 Lバッフルフラスコに1Lの無菌GYM液体培地を調製する。機器/化学/試薬のソースについては、材料表を参照してください。
- 表1に記載されているように、250 mLのエルレンマイヤーフラスコに1 x 50 mLの無菌GYM液体培地を調製する。
- 1 M HEPES-KOH pH 7.5、1M MgCl2の100 mL、および4 M NH4Cl溶液の500 mLの100 mLを準備して、S30Aの1 Lおよび1 LのS30B洗浄バッファーを作ります。レシピについては 、表 2 を参照してください。
- 一晩のプレカルチャーを準備します。250 mL のエルレンマイヤーフラスコで、20 mL の無菌体 50 mL を 28 °C に 30 分間事前に温めます。
- S. ベネズエラ ATCC 10712 の単一コロニーを GYM 寒天プレートから GYM 液体培地の 50 mL を温め、28 °Cでインキュベートし、200 rpmで 16 時間 (一晩前培養) します。
- 2日目 -昼間のプレカルチャーと主な成長文化を準備します。
- 28°Cで250 mLのエルレンマイヤーフラスコで無菌ジム液体培地の50 mLを30分間温める前に。
- 一晩前培養の1 mLを、GYM液培地の50mLをあらかじめ温め、28°Cでインキュベートし、200rpmで8時間(昼間のプレカルチャー)に移す。
- この成長期間の後、1 mL(1 cmパス長)のプラスチックキュベットで無菌のGYM培地と1:10希釈を使用して分光光度計のOD600 を点検してください。
注: OD600 は少なくとも 3-4 に達しているはずです。低成長がある場合は、手順 2.2.1 - 2.2.2 を繰り返すことをお勧めします。 - 2 Lバッフルフラスコ中の液体GYM培地の1Lに昼間前培養の0.25mLのサブカルチャー。
- 28°Cで一晩振り、200rpmで14時間振る。
- 3日目-収穫細胞
- 前のインキュベーション期間(14時間)の後に、本培養物のOD600 を記録する。OD600測定用の新鮮なGYM培地で一晩培養1:10 を希釈します。
注: OD600 は、この段階で 3.0 から 4.0 に達しているはずです。 - OD600<3.0の場合、揺れ速度を250〜300rpmに上げ、OD600の3.0に達するまで成長します。追加の2時間(合計で16 h)を超えて成長します。
- OD600>3.0の場合は、培養物を遠心分離容器に移し、湿った氷の上で30分間急速に冷却します。
- 細胞培養が氷の上で冷めるのを待っている間に、 表1に記載されているように、新鮮な1 Mジチオトレイトール(DTT)、S30AおよびS30Bバッファーの4 mLを調製し、氷の上に保管します。化学/試薬のソースについては 、材料表 を参照してください。
- 空の50 mL遠心分離管を予量秤し、-20°Cで予冷します。
- 氷上のS30Aバッファーの1 Lに1 M DTTの2 mLを加え、よく混ぜます。
メモ:DTTをS30AおよびS30B洗浄バッファに追加してから使用してください。 - 6,000× g、4°C、10分で遠心分離機細胞を、迅速かつ単一の動きで慎重に上清を捨てます。
注:ペレットが乱れている場合は、残留GYM培地で細胞保持を最大化し、プロトコルを継続します。 - S30Aバッファーの500 mLを加え、細胞塊が均一に分散するまで遠心分離ボトルを激しく振って細胞を再懸濁する。
- 6,000× g、4°C、6分で細胞を遠心分離し、上清を丁寧に捨てます。
注: この時点では細胞ペレットは固まるでしょうが、一部のセルはサスペンションに残ります( 図 1 を参照)。2.3.7 で説明されているように扱い、できるだけ多くのセルを保持します。 - ステップ 2.3.8~ 2.3.9 を繰り返します。
- 氷上のS30Bバッファーの1 Lに1 M DTTの2 mLを加え、よく混ぜます。セルに500mLのS30Bバッファを加えます。ステップ 2.3.9 を繰り返します。
- セルペレットをS30Bバッファーの10 mLに再懸濁し、あらかじめ計量した50 mL遠心分離管に移します。必要に応じて、S30Bバッファの追加5〜10 mLで残留セルを転送します。S30Bで50mLに充填してください。
- 遠心分離細胞は6,000× g、4°C、10分、上清を丁寧に捨てます。
- ステップ 2.3.13 を繰り返します。
- 残りのS30B上清を100-200 μLピペットで慎重に吸引します。
- 湿った細胞ペレットの重量を量る。
注:一晩のGYM培養物の1L(OD600 = 3.0)の典型的な湿潤細胞ペレット重量は〜4.5gである。 - 1 g の湿潤細胞ごとに、0.9 mL の S30B バッファーを加えます。パスツールピペットまたは渦を使用して細胞を再中断します。
- 遠心分離機は、細胞を沈下するために500× g まで短時間(〜10s)まで。
注:この時点でプロトコルを一時停止することができ、セルは液体窒素またはドライアイスのいずれかで凍結し、 安全のために、顔の盾や手袋を含む液体窒素を扱うときに適切な個人用保護具(PPE)を着用してください。
- 前のインキュベーション期間(14時間)の後に、本培養物のOD600 を記録する。OD600測定用の新鮮なGYM培地で一晩培養1:10 を希釈します。
3. 超音波処理による細胞のリシスは、粗細胞抽出物を得る
注:この段階では、ユーザーは、1 mL分数(オプション1)または50 mLチューブ(オプション2)の大きなセルサスペンション(5 mL)のいずれかで超音波処理によって細胞を破壊することを選択することができます。両方のオプションは、前の収穫および洗浄工程中の細胞の損失により細胞懸濁液の最終容積が変化する可能性があるため、再現性を確保するために以下に詳述されている。新しいユーザーは、最初にオプション 2.1 を試してプロトコルを確立する必要があります。
- 1 mL 分数で超音波処理を行うセルのリシス
- 1 mL ピペットチップ(先端の端を切り落として穴の大きさを大きくする)を使用して、細胞懸濁液の 1 mL を 2 mL マイクロ遠心チューブに移します。
注:細胞が凍結している場合は、細胞のリシス前に、ペレットを含む50mLチューブをぬるま湯にすばやく解凍します。ペレットが解凍し始めるとすぐにチューブを湿った氷に移し、10分間冷やします。 - 各マイクロ遠心チューブを氷水のビーカーに入れ、プラスチック製のチューブラックを使用して超音波処理用のチューブを保持します。
注:細胞抽出物の過熱に対する感度が高いため、タンパク質の沈殿や酵素活性の低下を防ぐためにチューブがウォームアップしないようにすることが重要です。 - 直径3mmの先端を備えた超音波式プローブを使用し、70%(v/v)エタノールと二重蒸留水(ddH2O)で洗浄してください。ソニエーターチップを液体表面から約1cm下にするまでセル懸濁液に下げます。
- 超音波処理器に次の設定を入力します:20 kHz周波数、65%の振幅、10 sパルスオンタイム、10 sパルスオフ時間、1分の総超音波処理時間。
- 超音波処理プロトコルを実行します。細胞が均等に超音波処理されていることを確認するために、最初の2つの休息サイクル中にチューブを上下に動かします。エネルギー入力を記録します。
注: 安全のために、超音波処理中に適切な聴覚保護を着用してください。細胞が破壊されるにつれて粘度が低下し、淡いクリーム湿った細胞ペレットは均質な褐色の液体に変わるはずです。推奨エネルギー入力は、湿潤細胞のmLあたり240Jです。細胞が部分的にしか取り除かれなければ、懸濁液は、特にチューブの側面に、細胞の粘性塊でクリーム色で表示されます。 - チューブを2〜3回反転し、細胞が完全に破壊されるまで頻繁に混合し、追加の1つまたは2つの10のサイクルのための超音波処理を繰り返します。
- 1 mL ピペットチップ(先端の端を切り落として穴の大きさを大きくする)を使用して、細胞懸濁液の 1 mL を 2 mL マイクロ遠心チューブに移します。
- 5 mL 細胞懸濁液を超音波処理して細胞リシス
- 細胞が凍結された場合、細胞のリシス前に振盪して、ペレットを含む50mLチューブをぬるま湯に速やかに解凍する。ペレットが解凍し始めるとすぐにチューブを湿った氷に移し、10分間冷やします。
- 細胞を沈下するために500 x g でチューブを簡単に回転させます。
- 超音波処理のための氷水のビーカーに50 mLチューブを置きます。
注:細胞抽出物の過熱に対する感度が高いため、タンパク質の沈殿や酵素活性の低下を防ぐためにチューブがウォームアップしないようにすることが重要です。 - 直径6mmの先端を備えた超音波式プローブを使用し、70%(v/v)エタノールとddH2Oで洗浄します( 図1の6mmプローブの視覚的な概略図を参照)。ソニエーターチップをセル懸濁液(〜5 mL)に下げ、液体表面から約1cm下に下げます。
- 超音波処理器に次の設定を入力します:20 kHz周波数、65%振幅、10秒パルスオンタイム、10秒パルスオフ時間、1分の合計超音波処理時間/mmmLウェットセル(合計5分)。
- 超音波処理プロトコルを実行します。細胞が均等に超音波処理されていることを確認するために、最初の2つの休息サイクル中にチューブを上下に動かします。
注: 安全のために、超音波処理中に適切な聴覚保護を着用してください。細胞が破壊されると粘度が低下し、淡いクリーム湿った細胞ペレットは均質な褐色の液体に変わるはずです。エネルギー入力を記録します。湿細胞のmLあたり240Jの最適エネルギー入力(5分超音波処理から合計で約1200J)が推奨されます。 - 一部のセルがそのまま残っている場合は、手順 3.1.5 からのガイダンスに従います。
- 細胞抽出物を2 mLマイクロ遠心チューブに移します。
4. 細胞抽出物の明確化と流出反応
- 4°Cで10分間16,000× g で細胞を遠心分離し、細胞の破片を除去する。上清を1 mLアリコートとして1.5 mLマイクロ遠心分離管に移します。
- 細胞抽出物に対してランオフ反応を行います。細胞抽出物を含む1.5 mLチューブを、30°Cで60分間、ヒートブロックまたはインキュベーターで振盪することなくインキュベートします。
- 細胞抽出物を16,000× g で4°Cで10分間遠心する。 上清を15mL遠心管に入れます。上清を均質になるまでチューブを5回反転させて混ぜ、氷の上に置きます。気泡の形成を避けるために穏やかに反転します。
- 細胞抽出物の10μLをS30Bバッファーで100倍希釈し、3回の技術的反復でブラッドフォードアッセイを使用して全タンパク質濃度を測定します(ブラッドフォードアッセイガイダンスについては 補足材料S2 を参照)。
- タンパク質濃度が20〜25mg/mLの場合、細胞抽出物を100μLのアリコートとして新しい1.5mLチューブに移し、液体窒素中でフラッシュフリーズし、-80°Cで保存します。
注: 安全のために、顔の盾や手袋を含む液体窒素を扱うときは、適切なPPEを着用してください。 - タンパク質濃度が20mg/mL<場合は、粗抽出調製手順を繰り返して、高品質の細胞抽出物とTX-TL収率が以前に発表されたwork5と同等であることを保証します。
プラスミドDNAテンプレートの調製
- メーカーの指示に従って適切なプラスミドDNA精製キットを使用して、新たに形質転換した大腸菌プラスミド株(DH10β、JM109)からpTU1-A-SP44-mScarlet-Iプラスミド(pUC19起源)を50mLのLB培養物(100mg/mLカルベニシリン付き)で栽培して精製します。
- 2 x 300 μL のヌクレアーゼを含まない水にプラスミドを溶出し、分画を組み合わせます。
- 3 M酢酸ナトリウム(pH 5.2)の0.1ボリューム(66 μL)を加えます。
- 0.7ボリューム(462 μL)のイソプロパノールを追加します。
- DNAを-20°Cで30分間インキュベートします。
- 遠心分離機16,000× g で4°Cで30分間、上清を捨てます。
- 2 mLの70%(v/v)エタノールをDNAペレットに加えます。
- チューブを3〜4回反転し、プラスミドDNAペレットを再懸濁させた。
- 遠心分離機は4°Cで5分間16,000× g で5°Cで、上清を捨てます。
- ステップ 5.7 ~ 5.9 を繰り返し、目に見える液体をすべて取り除きます。
- DNAペレットを10〜30分間空気乾燥するか、真空遠心分離機で5分間乾燥します。
- 600 μL のヌクレアーゼを含まない ddH2O で乾燥ペレットを再懸濁します。
- 分光光度計を用いてDNA濃度と純度を測定します。
- 50~100 μLのアリコートを用意し、-20°Cで保存します。
注:無細胞反応のボリューム制約が厳しいため、500~1000 ng/μLの範囲で高いDNA濃度を推奨します。プラスミドDNAストックを80 nMに希釈します。168 ng/μL pTU1-A-SP44-mScarlet-I プラスミドは80 nMに相当する。
6. ストレプトマイセス マスターミックス(SMM)ソリューションの調製
- アミノ酸溶液
- 手動エラーを回避し、オンラインで提供されているメーカーの指示に従って、準備時間を短縮するためにアミノ酸サンプラーキットを使用してください。
- ddH2Oを用いた20xアミノ酸ストック溶液を6mM(5mM L-Leu)の最終濃度に希釈します。
- さらに2.4x SMM溶液内で 2.4mM (2mM L-Leu)に希釈する( 表3参照)。
注:TX-TL反応の最終濃度は1mM 19xアミノ酸と0.83 mM L-Leuです。
- エネルギー溶液および添加剤
- 表 3 に記載されているレシピに従って、2.4x SMM ソリューションの他のコンポーネントを準備します。
- または、表 3 に記載されているレシピに従って、2.4x 最小エネルギーソリューション (MES) を準備します。
7. 標準 のベネズエラ TX-TL反応を設定する
- 細胞抽出物、 SMM (または MES)溶液、およびプラスミドDNAを氷上で解凍する。-20°Cで384ウェルプレートを予冷してください。
- TX-TL反応は、体積の25%がプラスミドDNA、33.33%が細胞抽出物、41.67%が SMM 溶液である場合に設定します。開始時刻のバイアスを避けるために氷の上にそれらを保ちます。
注:反応数に基づいて必要な試薬の量を計算するための標準TX-TLテンプレート(表4)が提供されています。33 μL反応の標準体積は、11 μLの細胞抽出物、13.75 μL SMM、プラスミドDNA 8.25 μLです。 - 溶液が均質であることを確認するために、〜5sの混合物を低速設定で穏やかに渦を出す。発泡/泡形成を避けてください。
- 気泡を導入することなく、技術的な三重として384ウェルプレートの3つのウェルに10 μLアリコートを移します。透明なカバーでプレートを密封し、400× g で5s回転させます。
- 28°Cで反応をインキュベーター(終点の読み取り値)またはプレートリーダーで振らずにインキュベートします。
注: 反応は、通常、完了するまでに 3 - 4 時間を必要とします。プレートリーダーおよび mScarlet-I 標準測定のガイダンスについては 、補足材料 S2 を参照してください。
結果
この詳細なプロトコルは、S. ベネズエラ ATCC 10712 モデル株に基づいてストレプトマイセス TX-TL システムを確立するユーザーを支援する例として提供されています(図 1)。ユーザーは、他のストレプトマイス株を研究しようとするかもしれません;ただし、より長い倍率の時間または明確な成長の好みを持つ他の株の成長/収穫段階は、ピーク結果を達成するためにカスタム最適化する必要があります。代表的な結果については、pTU1-A-SP44-mScarlet-I標準プラスミド(図2および図3)からのmScarlet-I蛍光タンパク質を、S.ベネズエラTX-TLにおいて高収率発現を検出方法の範囲(SDS-PAGE、蛍光)で提供するように最適化した。また、この標準的なプラスミドを、S.リモサス由来の一部の二次代謝産物酵素の合成を実証するために改変した(図2)5。最後に、スケールアップされた天然物生合成の潜在的なワークフローは、ヘム生合成の初期段階からのモデル経路を使用するための概略として示される。ワークフローは、他の二次代謝産物生合成経路に適応可能である可能性がある。ガイドラインとして、このプロトコルは、addGeneで提供される発現プラスミドからのsfGFPの最小収率2.8μMおよびmScarlet-I/mVenusの3.5 μMの最小収率を提供するべきである。これらの数値は、従来のデータ5で観測された一般的なバッチ変動(最大28%)を可能にしますが、10 μM mScarlet-Iを超える収率は最適なバッチ(未公開データ)で達成されています。
5つの異なる方法を用いたmScarlet-I遺伝子の S.ベネズエラ TX-TLの測定
pTU1-A-SP44-mScarlet-I標準プラスミドの発現が示され、 5つの異なる方法を用いたmScarlet-I発現の測定:1.dBroccoliアプタマーを用いたmRNAのリアルタイム蛍光測定、2.FlAsHタグシステムを用いた未熟mScarlet-Iタンパク質のリアルタイム蛍光測定、3.成熟mScarlet-I、タンパク質4のリアルタイム蛍光測定 と5.全無細胞タンパク質のクマシーブルー染色。このデータでは、反応は2mLマイクロ遠心分離管に33 μL反応(終点サンプル用)、またはプレートリーダーの384ウェルプレートの10 μL技術的三重として設定されました。トリプルタグ付き(N末端His6、C末端フラグおよびC末端FlAsH)mScarlet-Iタンパク質を別々に精製し、pET15b-mScarlet-Iプラスミドを使用して測定用の較正標準を作成した。これらの実験のデータを図3に示します。インゲル蛍光染色法の詳細は、補足材料S3で入手できます。
ベネズエラ 初期のヘム生合成のTX-TL
天然物生合成経路のモデルとして、ウロポルフィリノゲンIII(uro'gen III)の「ワンポット」生合成をpTU1-A-SP44-hemC-hemD/cysGA-hemB発現プラスミド5を用いて実施した。このモデル生合成経路は、ウロンゲンIIIが高酸素に敏感で、強い赤色蛍光を示すウロポルフィリンIIIに急速に酸化(6個の電子の損失)として選択されました。これにより、前述の蛍光測定および/またはHPLC-MS(図4)を用いて、反応をリアルタイムで容易に検出できます5。また、これらの反応は、バッチ法または半連続法のいずれかを用いて検討した。半連続反応は、マイクロ透析装置42,43を使用して、反応時間を延長し、タンパク質合成の収量を増加させる追加のエネルギー(NTP、二次エネルギー源)とアミノ酸を提供する戦略です。ここでは、半連続的な方法を用いてヘムモデル反応をスケールアップし、TX-TLタンパク質を反応生成物から分離し、HPLC-MSによる精製および分析を容易にする。方法の詳細は、補足材料 S4 またはデータについては、前の作業 5 を参照してください。半連続無細胞反応も、以前の研究42,43に記載されている。ここで示す例の概略ワークフロー(図4)は、他の天然物生合成経路に適応可能である可能性がある。
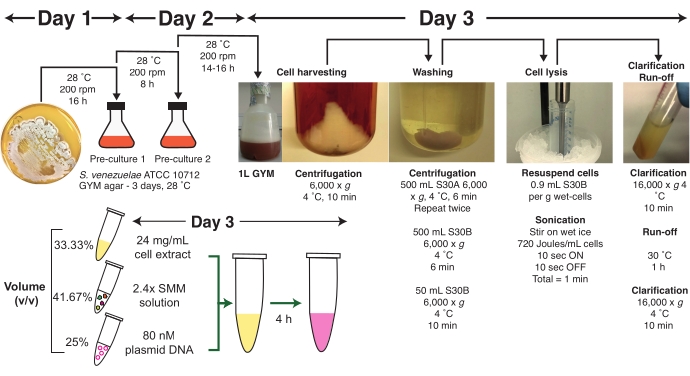
図1: ストレプトマイセスベネズエラ TX-TLプロトコルの概要 プロトコルの概要を示します(推奨期間は 3 日間です)。このプロトコルは、細胞増殖、細胞収穫、細胞洗浄、超音波処理による細胞ライシス、明確化、流出反応、マスターミックス(SMM)調製物、プラスミドDNA調製、およびTX-TL反応アセンブリの明確な段階に分解される。完全なプロトコルは、テキスト内で詳細に説明され、ガイダンスや実用的なヒントも記載されています。略語: SMM = ストレプトマイセス マスター ミックス;TX-TL = 転写翻訳。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:高G+C(%)遺伝子からの高収率タンパク質合成(A)sfGFP、mVenus-I、およびmScarlet-I蛍光タンパク質の合成。(B)リモサスからの生合成酵素の合成。省略形: EV = 空のベクトル;NRPS =非リボソームペプチド合成酵素。図は5から修正される。反応のセットアップと方法については、プロトコルと補足ファイルを参照してください。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:pTU1-A-SP44-mScarlet-Iプラスミドを用いたTX-TL5方向の測定 (A) プラスミド設計には以下の特徴が含まれています: SP44は、ストレプトマイセス属および大腸菌で活性の強い構成プロモーターです。pET-RBSはpET発現プラスミドに由来し、ストレプトマイセスspp.および大腸菌5,40の両方で非常に活性である。赤蛍光タンパク質誘導体をコードするmScarlet-I遺伝子を最適化したストレプトマイセス親和性クロマトグラフィー精製またはウェスタンブロッティング検出のためのC末端FLAGタグ;C末端FlAsHタグは、ゲル内染色または新生タンパク質合成のリアルタイム測定のための蛍光標識用タグ;DFHBIプローブを用いたリアルタイムmRNA測定用dBroccoliアプタマー;S. ベネズエラ ATCC 107125 で非常に効率的である転写ターミネーター Bba_B0015;アンピシリン耐性マーカー;および pUC19 レプリケーションの発生元。(B)リアルタイムmRNA発現は、dBroccoliアプタマーおよびDFHBIプローブ(励起483-14nm、放出530〜30nm)で検出される。(C)リアルタイムの新生タンパク質合成検出を蛍光プローブ(励起500-10 nm、発光535-10 nm)で検出した。(D)mScarlet-I合成のリアルタイム蛍光測定(励起565-10 nm、発光600-10nm)。(E) FlAsH-EDT2蛍光プローブによるインゲル染色。(F)比較のために精製His6-mScarlet-I標準を用いた全TX-TLタンパク質のクマシーブルー染色。反応は、40 nMのプラスミドDNAテンプレートを用いてプロトコルに記載された条件で実行された。蛍光データはすべてRFUとして表され、誤差範囲(3回の技術的反復の標準偏差)は灰色の陰の領域内で表されます。略語: TX-TL = 転写翻訳;FlAsH = フルオレセイン・アーセニカル・ハーピン;DFHBI = 3,5-ジフルオロ-4-ヒドロキシベンジリデンイミダゾリニオン;RFU = 相対蛍光単位。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4: S.ベネズエラ TX-TL半連続反応の概略ワークフロー。 HPLC-MSによる初期段階のヘム生合成オペロンおよび下流分析を用いた天然物TX-TLのワークフロー例。反応および分析は補足材料で詳述される。図は 5から修正される。略語: SMM = ストレプトマイセス マスター ミックス;TX-TL = 転写翻訳;ALA = 5-アミノレブリン酸;SPE = 固相抽出;ESI-MS =電子スプレーイオン化質量分析;HPLC-MS= 高速液体クロマトグラフィー質量分析法 この図の大きなバージョンを表示するには、ここをクリックしてください。
表1:GYM細菌増殖培地とGYM寒天プレートのレシピ。このテーブルをダウンロードするには、ここをクリックしてください。
表2:S30A及びS30B洗浄緩衝液を調製するための試薬。 この情報はKieserらから適応された。45 略語: DTT = ジチオスレイトール. このテーブルをダウンロードするには、ここをクリックしてください。
表3:S.ベネズエラMESとSMMソリューション を作るためのレシピ。略語: MES = 最小エネルギーソリューション;SMM = ストレプトマイセス マスター ミックス;NTP = ヌクレオシド三リン酸;PEG 6000 = ポリエチレングリコール 6000;3-PGA = 3-ホスホグリセリン酸;G6P = グルコース-6-リン酸;PVSA = ポリビニルスルホン酸。このテーブルをダウンロードするには、ここをクリックしてください。
表4: S. ベネズエラ TX-TL 反応 のレシピ.略語: MES = 最小エネルギーソリューション;SMM = ストレプトマイセス マスター ミックス;TX-TL = 転写翻訳。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表S1: S.ベネズエラ TX-TLワークフロー 用プラスミド。略語: TX-TL = 転写翻訳. このテーブルをダウンロードするには、ここをクリックしてください。
補足材料S2:mScarlet-Iキャリブレーション標準製剤およびプレートリーダー測定。このファイルをダウンロードするには、ここをクリックしてください。
補足材料S3:FlAsHタグ法。 略語: FlAsH = フルオレ セイン・アーセニカル ・ハーピン このファイルをダウンロードするには、ここをクリックしてください。
補足材料S4:半連続反応、精製、およびHPLC-MS。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この原稿では、高収率のS.ベネズエラTX-TLプロトコルは、TX-TLシステムの経験豊富なユーザーと新しいユーザーの両方のために行う簡単な詳細な手順で説明されています。既存のストレプトマイセス45および大腸菌TX-TL41プロトコルからいくつかの機能が削除され、S.ベネズエラTX-TL5,26の最小かつ高収率プロトコルが確立されました。ここで推奨されるワークフローは、S.ベネズエラが選択された豊かな媒体で急速に成長していることを確認し、夕方に最終的な文化を接種できるようにすることです。これは、翌朝のピーク成長時に細胞の収穫を可能にし、ユーザーは、同じ日に活性細胞抽出物を収穫し、準備することができます。この合理化されたプロトコルに従うことで、1人の研究者が3日間の枠組みでプロトコルを便利に完成させることが期待されます。mRNA/タンパク質分析に幅広い機能を提供する強力な発現プラスミド系(pTU1-A-SP44-mScarlet-I)を含むS.ベネズエラTX-TLシステムにも相補的なプラスミドツールキットが提供されています。この標準的なプラスミドは、ストレプトマイセスsppの範囲で高活性である構成SP44プロモーターによって動力を与えられる。そして大腸菌39で。S. ベネズエラ TX-TL ツールキットの初期の可能性を示す, 代表的な結果は、蛍光タンパク質の範囲の高収率合成を示しています, 二次代謝酵素, モデルの自然な製品経路の生合成 (ヘム生合成から).
全体として、このプロトコルには、S.ベネズエラTX-TLシステムの詳細な説明と、TX-TL反応の3つの必須成分を調製するための実用的なヒントが含まれています:(1)細胞抽出物、(2)ストレプトマイスマスターミックス(SMM)溶液、および(3)プラスミドDNA。このプロトコルは、特殊な機器を必要とせず、ルーチン微生物学と生化学のスキルを必要とします。したがって、ほとんどの研究所にアクセスできます。このプロトコルは、小スケール(10-100 μL)および大規模反応(〜2.5 mL)に適していますが、反応サイズ/エアレーションのいくつかの最適化はタンパク質の収量に影響を与える可能性があります。推奨される反応量は、2 mLチューブで33 μL、384ウェルプレートで10 μLです。粗抽出物は、グリセロールストックから始まる一人の人によって準備するのに5日かかります。培養物の各リットル(L)は、少なくとも5mLの細胞抽出物(〜1500 x 10 μL TX-TL反応に相当)を生み出す-これは、洗浄工程および細胞抽出物の明確化中のサンプル損失を示す控えめな推定値である。プロトコルの各段階は独立しており、ユーザーのニーズを満たすように最適化できます。全ての無細胞システムの主な制限は、バッチバリエーション46,47です。一般的な要因には、ピペットのエラー、ユーザー エクスペリエンス、メディア バッチのバリエーション、および機器の違いがあります。特に、ピペットの誤差を最小限に抑えるため、メディアや機器の使用をカバーする詳細な手順を提供するマスターミックスを導入します。現在までに、このプロトコルは、少なくとも5つの英国の研究グループのユーザーの範囲によって再現可能です。しかし、生物学的変動が無細胞バッチ変動に寄与する役割は不明である。世界的な遺伝子発現調節の違いに加えて、ストレプトマイセスspp.のゲノム可塑性は広く報告されており、潜在的な貢献者である48です。バッチ変動を調査するために、一晩に成長した4つの単一コロニーから派生した4つの別々の1L培養物まで成長することが推奨される。以前は、4つの生物学的バッチ(細胞抽出物〜20mL〜20 mLを提供する)の間で最大28%の変動(標準偏差の点で)が観察された。これらのデータに基づいて、新規ユーザーの合理的な最小目標は、sfGFPの場合は2.8μM、AddGene-これらのターゲットで入手可能なプラスミドを使用した3.5 μMのmScarlet-I/mVenus-Iは、以前のデータで観測された平均より30%低い。下流のHPLC-MS分析が望まれる場合、PEG 6000は、全体のTX-TL収率の低下が最大50%まで期待できるが、マスターミックスから除去することができる。
特殊なストレプトマイセス無細胞システムの可能性に関しては、天然物などのバイオプロスペクティングアプリケーション用の新しいウェットラボツールを開発したいという要望が高まっています。ストレプトマイセス属は、抗生物質、除草剤、医薬品49を含む天然物発見の歴史に染み込んでいます。全ゲノムシーケンシングプロジェクトと最新のバイオインフォマティクスツール50,51,52から得られた知識の増加は、微生物ゲノム53内のBgCsによってコード化された前例のないレベルの天然物を明らかにしました。バイオテクノロジーに役立つ新薬/化学物質や酵素を保持することが期待されるこの遺伝情報のロックを解除するには、新しい発現システムや代謝工学ツールの範囲を含む新しい合成生物学戦略の開発が必要になります54。特殊なストレプトマイセスベースのTX-TLシステムは、天然タンパク質折りたたみ環境26の利用可能性[1]、高G+C(%)遺伝子発現のための最適なtRNAプールへのアクセス、および[3]生合成presの潜在的な供給のための活性一次代謝の、アクチノバクテリアおよび関連ゲノムからの遺伝子および調節要素を研究するのに有利である。また、無細胞システムの主な利点は、次世代シーケンシング13と音響液体ハンドリングロボティクス8,11,12を使用した遺伝子部分のハイスループット特性と遺伝子発現です。要約すると、S. ベネズエラ TX-TL ツールキット 5 は、天然物の合成生物学の分野で補完的なツールを提供します。S. ベネズエラTX-TLツールキットは、モデルシステムとしてのS.ベネズエラのさらなる発展を支援し、新しい合成生物学の部品/ツールを設計し、二次代謝産物生合成経路および酵素を探求する方法を提供する。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
著者らは、PSFを持つPDRAとしてのSJMのためのEPSRC[EP/K038648/1]の研究支援を認めたいと思います。ウェルカムトラストは、インペリアル・カレッジ・ロンドンのPSFとSJMのためのISSFフェローシップを後援しました。王立協会研究助成金[RGS\R1\191186];ケント大学のSJMに対するウェルカムトラストSEEDアワード[217528/Z/19/Z]。そして、グローバルチャレンジ研究基金 (GCRF) ケント大学のKCのための博士号の奨学金.
資料
| Name | Company | Catalog Number | Comments |
| 2.5 L UltraYield Flask | Thomson | 931136-B | |
| 3-PGA (>93%) | Sigma | P8877 | |
| 384 Well Black/Clear Bottom Plate | ThermoFisher | 10692202 | |
| Ammonium chloride (98%) | Fluorochem | 44722 | |
| ATP, CTP, UTP, GTP (100 mM solution, >99%) | ThermoFisher | R0481 | |
| Carbenicillin (contact supplier for purity) | Melford | C46000-25.0 | |
| D-(+)-glucose (contact supplier for purity) | Melford | G32040 | |
| DFHBI (≥98% - HPLC) | Sigma | SML1627 | |
| DTT (contact supplier for purity) | Melford | MB1015 | |
| FlAsH-EDT2 (contact supplier for purity) | Santa Cruz Biotech | sc-363644 | |
| Glucose-6-phosphate (>98%) | Sigma | G7879 | |
| HEPES Free Acid (contact supplier for purity) | Melford | B2001 | |
| L-glutamic acid hemimagnesium salt tetrahydrate (>98%) | Sigma | 49605 | |
| Magnesium chloride (98%) | Fluorochem | 494356 | |
| Malt extract | Sigma | 70167-500G | |
| PEG-6000 | Sigma | 807491 | |
| Pierce 96-well Microdialysis Plate, 10K MWCO | ThermoFisher | 88260 | |
| Poly(vinyl sulfate) potassium salt | Sigma | 271969 | |
| Potassium glutamate (>99%) | Sigma | G1149 | |
| RTS amino acid sampler | 5 Prime | 2401530 | |
| Sodium chloride (99%) | Fluorochem | 94554 | |
| Supelclean LC-18 SPE C-18 SPE column (1 g) | Sigma | 505471 | |
| Yeast Extract | Melford | Y1333 | |
| Equipment | |||
| Platereader | BMG | Omega |
参考文献
- Carbonell, P., et al. An automated Design-Build-Test-Learn pipeline for enhanced microbial production of fine chemicals. Communications Biology. 1, 66 (2018).
- Gregorio, N. E., Levine, M. Z., Oza, J. P. A user's guide to cell-free protein synthesis. Methods Protocols. 2 (1), 24 (2019).
- Zimmerman, E. S., et al. Production of site-specific antibody-drug conjugates using optimized non-natural amino acids in a cell-free expression system. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- Wiegand, D. J., Lee, H. H., Ostrov, N., Church, G. M. Cell-free protein expression using the rapidly growing bacterium Vibrio natriegens. Journal of Visualized Experiments: JoVE. (145), e59495 (2019).
- Moore, S. J., et al. A Streptomyces venezuelae cell-free toolkit for synthetic biology. ACS Synthetic Biology. 10 (2), 402-411 (2021).
- Xu, H., Liu, W. -. Q., Li, J. Translation related factors improve the productivity of a Streptomyces-based cell-free protein synthesis system. ACS Synthetic Biology. 9 (5), 1221-1224 (2020).
- Yim, S. S., et al. Multiplex transcriptional characterizations across diverse bacterial species using cell-free systems. Molecular Systems Biology. 15 (8), 8875 (2019).
- Moore, S. J., et al. Rapid acquisition and model-based analysis of cell-free transcription-translation reactions from nonmodel bacteria. Proceedings of the National Academy of Sciences of the United States of America. 115 (19), 4340-4349 (2018).
- Zawada, J. F., et al. Microscale to manufacturing scale-up of cell-free cytokine production--a new approach for shortening protein production development timelines. Biotechnology and Bioengineering. 108 (7), 1570-1578 (2011).
- Geertz, M., Shore, D., Maerkl, S. J. Massively parallel measurements of molecular interaction kinetics on a microfluidic platform. Proceedings of the National Academy of Sciences of the United States of America. 109 (41), 16540-16545 (2012).
- McManus, J. B., Emanuel, P. A., Murray, R. M., Lux, M. W. A method for cost-effective and rapid characterization of engineered T7-based transcription factors by cell-free protein synthesis reveals insights into the regulation of T7 RNA polymerase-driven expression. Archives of Biochemistry and Biophysics. 674, 108045 (2019).
- McManus, J. B., et al. A method for cost-effective and rapid characterization of genetic parts. bioRxiv. , (2021).
- Park, J., Yim, S. S., Wang, H. H. High-throughput transcriptional characterization of regulatory sequences from bacterial Biosynthetic Gene Clusters. ACS Synthetic Biology. , (2021).
- Caschera, F., Noireaux, V. Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie. 99, 162-168 (2014).
- Caschera, F., Noireaux, V. A cost-effective polyphosphate-based metabolism fuels an all E. coli cell-free expression system. Metabolic Engineering. 27, 29-37 (2015).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. coli RNA polymerase and sigma factor 70. Journal of Biological Engineering. 4, 8 (2010).
- Karim, A. S., Heggestad, J. T., Crowe, S. A., Jewett, M. C. Controlling cell-free metabolism through physiochemical perturbations. Metabolic Engineering. 45, 86-94 (2018).
- Cai, Q., et al. A simplified and robust protocol for immunoglobulin expression in Escherichia coli cell-free protein synthesis systems. Biotechnology Progress. 31 (3), 823-831 (2015).
- Garenne, D., Thompson, S., Brisson, A., Khakimzhan, A., Noireaux, V. The all-E. coli TXTL toolbox 3.0: New capabilities of a cell-free synthetic biology platform. Synthetic Biology. , (2021).
- Goering, A. W., et al. In vitro reconstruction of nonribosomal peptide biosynthesis directly from DNA using cell-free protein synthesis. ACS Synthetic Biology. 6 (1), 39-44 (2017).
- Khatri, Y., et al. Multicomponent microscale biosynthesis of unnatural cyanobacterial indole alkaloids. ACS Synthetic Biology. 9 (6), 1349-1360 (2020).
- Zhuang, L., et al. Total in vitro biosynthesis of the nonribosomal macrolactone peptide valinomycin. Metabolic Engineering. 60, 37-44 (2020).
- Hoskisson, P. A., Seipke, R. F. Cryptic or silent? The known unknowns, unknown knowns, and unknown unknowns of secondary metabolism. mBio. 11 (5), 02642 (2020).
- Bentley, S. D., et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 417 (6885), 141-147 (2002).
- Li, J., Wang, H., Kwon, Y. -. C., Jewett, M. C. Establishing a high yielding Streptomyces-based cell-free protein synthesis system. Biotechnology and Bioengineering. 114 (6), 1343-1353 (2017).
- Moore, S. J., Lai, H. -. E., Needham, H., Polizzi, K. M., Freemont, P. S. Streptomyces venezuelae TX-TL - a next generation cell-free synthetic biology tool. Biotechnology Journal. 12 (4), (2017).
- Kim, W., et al. Comparative genomics determines strain-dependent secondary metabolite production in Streptomyces venezuelae strains. Biomolecules. 10 (6), 864 (2020).
- Phelan, R. M., et al. Development of next generation synthetic biology tools for use in Streptomyces venezuelae. ACS Synthetic Biology. 6 (1), 159-166 (2017).
- Song, J. Y., et al. Complete genome sequence of Streptomyces venezuelae ATCC 15439, a promising cell factory for production of secondary metabolites. Journal of Biotechnology. 219, 57-58 (2016).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. mBio. 4 (5), 00684 (2013).
- Schumacher, M. A., et al. The crystal structure of the RsbN-σBldN complex from Streptomyces venezuelae defines a new structural class of anti-σ factor. Nucleic Acids Research. 46 (14), 7405-7417 (2018).
- Ramos-León, F., et al. A conserved cell division protein directly regulates FtsZ dynamics in filamentous and unicellular actinobacteria. Elife. 10, 63387 (2021).
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in Streptomycetes. Nature Reviews. Microbiology. 13 (12), 749-760 (2015).
- Ehrlich, J., Gottlieb, D., Burkholder, P. R., Anderson, L. E., Pridham, T. G. Streptomyces venezuelae, n. sp., the source of chloromycetin. Journal of Bacteriology. 56 (4), 467-477 (1948).
- Inahashi, Y., et al. Watasemycin biosynthesis in Streptomyces venezuelae: thiazoline C-methylation by a type B radical-SAM methylase homologue. Chemical Science. 8 (4), 2823-2831 (2017).
- Jakeman, D. L., et al. Antimicrobial activities of jadomycin B and structurally related analogues. Antimicrobial Agents and Chemotherapy. 53 (3), 1245-1247 (2009).
- Kodani, S., Sato, K., Hemmi, H., Ohnish-Kameyama, M. Isolation and structural determination of a new hydrophobic peptide venepeptide from Streptomyces venezuelae. Journal of Antibiotics. 67 (12), 839-842 (2014).
- Akey, D. L., et al. Structural basis for macrolactonization by the pikromycin thioesterase. Nature Chemical Biology. 2 (10), 537-542 (2006).
- Bai, C., et al. Exploiting a precise design of universal synthetic modular regulatory elements to unlock the microbial natural products in Streptomyces. Proceedings of the National Academy of Sciences of the United States of America. 112 (39), 12181-12186 (2015).
- Moore, S. J., et al. EcoFlex: A multifunctional MoClo kit for E. coli synthetic biology. ACS Synthetic Biology. 5 (10), 1059-1069 (2016).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. Journal of Visualized Experiments: JoVE. (79), e50762 (2013).
- Kim, D. M., Choi, C. Y. A semicontinuous prokaryotic coupled transcription/translation system using a dialysis membrane. Biotechnology Progress. 12 (5), 645-649 (1996).
- Liu, Y., Fritz, B. R., Anderson, M. J., Schoborg, J. A., Jewett, M. C. Characterizing and alleviating substrate limitations for improved in vitro ribosome construction. ACS Synthetic Biology. 4 (4), 454-462 (2015).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14, 53-56 (2017).
- Hopword, D. A., Kieser, T., Bibb, M. J., Buttner, M. J., Chater, K. Practical Streptomyces genetics. John Innes Foundation. , (2000).
- Hunter, D. J. B., Bhumkar, A., Giles, N., Sierecki, E., Gambin, Y. Unexpected instabilities explain batch-to-batch variability in cell-free protein expression systems. Biotechnology and Bioengineering. 115 (8), 1904-1914 (2018).
- Dopp, J. L., Jo, Y. R., Reuel, N. F. Methods to reduce variability in E. coli-based cell-free protein expression experiments. Synthetic and Systems Biotechnology. 4 (4), 204-211 (2019).
- Hoff, G., Bertrand, C., Piotrowski, E., Thibessard, A., Leblond, P. Genome plasticity is governed by double strand break DNA repair in Streptomyces. Scientific Reports. 8, 5272 (2018).
- Bibb, M. J. Regulation of secondary metabolism in streptomycetes. Current Opinion in Microbiology. 8 (2), 208-215 (2005).
- Weber, T., et al. antiSMASH 3.0-a comprehensive resource for the genome mining of biosynthetic gene clusters. Nucleic Acids Research. 43 (1), 237-243 (2015).
- Navarro-Muñoz, J. C., et al. A computational framework to explore large-scale biosynthetic diversity. Nature Chemical Biology. 16, 60-68 (2020).
- Alanjary, M., et al. The Antibiotic Resistant Target Seeker (ARTS), an exploration engine for antibiotic cluster prioritization and novel drug target discovery. Nucleic Acids Research. 45 (1), 42-48 (2017).
- Medema, M. H., Fischbach, M. A. Computational approaches to natural product discovery. Nature Chemical Biology. 11 (9), 639-648 (2015).
- Whitford, C. M., Cruz-Morales, P., Keasling, J. D., Weber, T. The Design-Build-Test-Learn cycle for metabolic engineering of Streptomycetes. Essays in Biochemistry. , (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved