Method Article
Ein ertragreiches Streptomyces-Transkriptions-Translation-Toolkit für synthetische Biologie und Naturstoffanwendungen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine verbesserte Methode zur Synthese hoher Ausbeuten rekombinanter Proteine aus einem zellfreien Transkriptionstranslationssystem (TX-TL) von Streptomyces venezuelae .
Zusammenfassung
Streptomyces spp. sind eine Hauptquelle für klinische Antibiotika und Industriechemikalien. Streptomyces venezuelae ATCC 10712 ist eine schnell wachsende Sorte und ein natürlicher Produzent von Chloramphenicol, Jadomycin und Pikromycin, was es zu einem attraktiven Kandidaten als Chassis der synthetischen Biologie der nächsten Generation macht. Daher sind genetische Werkzeuge, die die Entwicklung von S. venezuelae ATCC 10712 sowie anderen Streptomyces spp.-Modellen beschleunigen, für die Naturproduktentwicklung und -entdeckung sehr wünschenswert. Zu diesem Zweck wird in diesem Protokoll ein dediziertes S. venezuelae ATCC 10712 zellfreies System bereitgestellt, um eine hochertragreiche heterologe Expression von Genen mit hohem G+C (%) zu ermöglichen. Dieses Protokoll eignet sich für kleinskalige (10-100 μL) Chargenreaktionen im 96-Well- oder 384-Well-Plattenformat, während die Reaktionen potenziell skalierbar sind. Das zellfreie System ist robust und kann hohe Ausbeuten (~ 5-10 μ M) für eine Reihe von rekombinanten Proteinen in einem minimalen Setup erzielen. Diese Arbeit beinhaltet auch ein breites Plasmid-Toolset für die Echtzeitmessung von mRNA und Proteinsynthese sowie die In-Gel-Fluoreszenzfärbung von markierten Proteinen. Dieses Protokoll kann auch in Hochdurchsatz-Genexpressionscharakterisierungs-Workflows oder die Untersuchung von Enzymwegen aus Genen mit hohem G + C (%) in Actinomycetes-Genomen integriert werden.
Einleitung
Zellfreie Transkriptions-Translation-Systeme (TX-TL) bieten eine ideale Prototyping-Plattform für die synthetische Biologie, um schnelle Design-Build-Test-Learn-Zyklen zu implementieren, den konzeptionellen technischen Rahmen für die synthetische Biologie1. Darüber hinaus besteht ein wachsendes Interesse an TX-TL-Systemen für die hochwertige rekombinante Proteinproduktion in einer offenen Reaktionsumgebung2, um beispielsweise nicht-standardisierte Aminosäuren in Antikörper-Wirkstoff-Konjugate aufzunehmen3. Insbesondere benötigt TX-TL einen Zellextrakt, ein Plasmid oder lineare DNA und eine Energielösung, um die Proteinsynthese in Batch- oder semikontinuierlichen Reaktionen zu katalysieren. Während Escherichia coli TX-TL das dominierende zellfreie System ist, haben eine Reihe von aufkommenden Nicht-Modell-TX-TL-Systemen Aufmerksamkeit für verschiedene Anwendungen erregt4,5,6,7,8. Zu den Hauptvorteilen von TX-TL gehören die flexible Skalierbarkeit (Nanoliter-Liter-Skala)9,10, eine starke Reproduzierbarkeit und automatisierte Workflows8,11,12. Insbesondere die Automatisierung von TX-TL ermöglicht die beschleunigte Charakterisierung genetischer Teile und regulatorischer Elemente8,12,13.
In Bezug auf den Reaktionsaufbau benötigt TX-TL sowohl primäre als auch sekundäre Energiequellen sowie Aminosäuren, Cofaktoren, Additive und eine Template-DNA-Sequenz. Nukleotidtriphosphate (NTPs) stellen die primäre Energiequelle dar, um die anfängliche mRNA (ATP, GTP, CTP und UTP) und die Proteinsynthese (nur ATP und GTP) voranzutreiben. Um die TX-TL-Ausbeute zu erhöhen, werden NTPs durch den Katabolismus einer sekundären Energiequelle wie Maltose14, Maltodextrin15, Glucose14, 3-Phosphoglycerat (3-PGA)16, Phosphoenolpyruvat17 und L-Glutamat18 regeneriert. Diese inhärente Stoffwechselaktivität ist überraschend vielseitig, aber schlecht untersucht, insbesondere in aufkommenden TX-TL-Systemen. Jede Energiequelle hat unterschiedliche Eigenschaften und Vorteile in Bezug auf ATP-Ausbeute, chemische Stabilität und Kosten, was eine wichtige Überlegung für skalierte TX-TL-Reaktionen ist. Bisher haben die aktuellen Protokolle für E. coli TX-TL bis zu 4,0 mg/ml (~157 μM) für das grün fluoreszierende Modellprotein (GFP) erreicht, wobei eine Mischung aus 3-PGA (30 mM), Maltodextrin (60 mM) und D-Ribose (30 mM) als sekundäre Energiequelle verwendet wird19.
In jüngster Zeit ist das Interesse an der Untersuchung sekundärer Metaboliten-Biosynthesewege in TX-TL-Systemen gestiegen20,21,22. Insbesondere sind Actinobakterien eine Hauptquelle für Sekundärmetaboliten, einschließlich Antibiotika und Agrarchemikalien23,24. Ihre Genome sind mit sogenannten biosynthetischen Genclustern (BGCs) angereichert, die enzymatische Wege für die Sekundärmetabolit-Biosynthese kodieren. Für die Untersuchung der genetischen Teile von Actinobakterien und der Biosynthesewege wurde kürzlich eine Reihe von Streptomyces-basierten TX-TL-Systemen entwickelt5,6,25,26. Diese spezialisierten Streptomyces TX-TL-Systeme sind aus folgenden Gründen potenziell vorteilhaft: [1] Bereitstellung einer nativen Proteinfaltumgebung für Enzyme aus Streptomyces spp.26; [2] Zugang zu einem optimalen tRNA-Pool für eine hohe G+C (%) Genexpression; [3] aktiver Primärstoffwechsel, der möglicherweise für die Versorgung mit biosynthetischen Vorläufern missbraucht werden kann; und [4] Bereitstellung von Enzymen, Vorläufern oder Cofaktoren aus dem Sekundärstoffwechsel, die im nativen Zellextrakt vorhanden sind. Daher wurde kürzlich ein ertragreiches S.venezuelae TX-TL-Toolkit eingerichtet, um diese einzigartigen Fähigkeiten zu nutzen5.
Streptomyces venezuelae ist ein aufstrebender Wirt für synthetische Biologie mit einer reichen Geschichte in der industriellen Biotechnologie5,27,28,29 und als Modellsystem zur Untersuchung der Zellteilung und genetischen Regulation in Actinobakterien30,31,32. Der Haupttypstamm, S. venezuelae ATCC 10712, hat ein relativ großes Genom von 8,22 Mb mit 72,5% G+C-Gehalt (%) (Beitrittsnummer: CP029197), das für 7377 kodierende Sequenzen, 21 rRNAs, 67 tRNAs und 30 biosynthetische Gencluster kodiert27. In der synthetischen Biologie ist S. venezuelae ATCC 10712 ein attraktives Chassis für die heterologe Expression von Biosynthesewegen. Im Gegensatz zu den meisten anderen Streptomyces-Flecken bietet es mehrere wichtige Vorteile, darunter eine schnelle Verdopplungszeit (~ 40 min), eine umfangreiche Palette genetischer und experimenteller Werkzeuge5,28, eine fehlende Myzelverklumpung und Sporulation in flüssigen Medien28,33. Mehrere Studien haben auch die Verwendung von S. venezuelae für die heterologe Produktion einer Vielzahl von Sekundärmetaboliten gezeigt, darunter Polyketide, ribosomale und nichtribosomale Peptide34,35,36,37,38. Diese kombinierten Eigenschaften machen diesen Stamm zu einem attraktiven mikrobiellen Wirt für Anwendungen der synthetischen Biologie und des Metabolic Engineering. Während S. venezuelae nicht das dominierende Streptomyces-Modell für die heterologe Genexpression ist, ist es mit weiteren Entwicklungen für eine breitere Verwendung in der Naturproduktentdeckung vorbereitet.
Dieses Manuskript präsentiert ein detailliertes Protokoll (Abbildung 1) für ein S. venezuelae TX-TL-System mit hoher Ausbeute, das gegenüber dem ursprünglichen zuvor veröffentlichten Protokoll aktualisiert wurde26. In dieser Arbeit wurden die Energielösung und die Reaktionsbedingungen optimiert, um die Proteinausbeute für das mScarlet-I-Reporterprotein in einer 4 h, 10 μL Batch-Reaktion unter Verwendung eines Standardplasmids pTU1-A-SP44-mScarlet-I um bis zu 260 μg/ml zu erhöhen. Dieses Plasmid wurde speziell entwickelt, um verschiedene Methoden zum Nachweis der Proteinexpression zu ermöglichen. Das Protokoll ist ebenfalls optimiert, während das Energiesystem optimiert wurde, um die Komplexität und die Kosten für die Einrichtung zellfreier Reaktionen zu reduzieren, ohne die Ausbeute zu beeinträchtigen. Zusammen mit dem optimierten TX-TL-System wurde eine Bibliothek genetischer Teile zur Feinabstimmung der Genexpression und als fluoreszierende Werkzeuge zur Überwachung von TX-TL in Echtzeit entwickelt, wodurch eine vielseitige Plattform für das Prototyping von Genexpressions- und Naturstoff-Biosynthesewegen aus Streptomyces spp. und verwandten Actinobakterien geschaffen wurde.
In dieser Arbeit kann das empfohlene Standardplasmid (pTU1-A-SP44-mScarlet-I) verwendet werden, um den S. venezuelae TX-TL-Workflow in einem neuen Labor zu etablieren und ist auf AddGene verfügbar (siehe Ergänzende Tabelle S1). pTU1-A-SP44-mScarlet-I bietet dem Benutzer die Flexibilität, andere Open-Reading-Frames (ORFs) zu untersuchen. Der mScarlet-I ORF ist codon-optimiert für die S. venezuelae Genexpression. Der SP44-Promotor ist ein starker konstitutiver Promotor, der sowohl in E. coli als auch in Streptomyces spp.39 hochaktiv ist. Das Plasmid verfügt über zwei einzigartige Restriktionsenzymstellen (NdeI, BamHI), um das Subklonen neuer ORFs im Rahmen mit einem gemeinsamen C-terminalen FLAG-Tag und einem Fluorescein arsenischen Haarnadelsystem (FlAsH) zu ermöglichen. Alternativ können beide Tags mit der Aufnahme eines Stop-Codons nach dem Sub-Klonen eines neuen Gens entfernt werden. Mit diesem Basenvektor wurde die ertragreiche Expression einer Reihe von Proteinen nachgewiesen, nämlich Proteine aus dem Oxytetracyclin-Biosyntheseweg und eine uncharakterisierte nichtribosomale Peptidsynthetase (NRPS) aus Streptomyces rimosus (Abbildung 2). In Bezug auf den mRNA-Nachweis enthält das Standardplasmid pTU1-A-SP44-mScarlet-I ein dBroccoli-Aptamer (in der 3'-untranslatierten Region) zum Nachweis mit der 3,5-Difluor-4-hydroxybenzyliden-Imidazolinon (DFHBI) -Sonde. Für mehr Flexibilität wurde auch ein Toolset von EcoFlex40-kompatiblen MoClo-Teilen auf AddGene zur Verfügung gestellt, darunter ein EcoFlex-kompatibler Streptomyces-Shuttle-Vektor (pSF1C-A-RFP/pSF2C-A-RFP) und eine Reihe von pTU1-A-SP44-Variantenplasmiden, die Superfolder Green Fluorescence Protein (sfGFP), mScarlet-I, mVenus-I und β-Glucuronidase (GUS) exprimieren. Insbesondere wird das pSF1C-A-Plasmid von pAV-gapdh28 abgeleitet und von BsaI/BsmBI-Stellen für die MoClo-Assemblierung ausgehärtet. pSF1C-A-RFP/pSF2C-A-RFP entspricht pTU1-A-RFP/pTU2-A-RFP von EcoFlex40, enthält jedoch zusätzliche Funktionen für die Konjugation und chromosomale Integration in Streptomyces spp. mit dem phiC31-Integrasesystem28.
Die erste Stufe des Protokolls umfasst das Wachstum des S. venezuelae ATCC 10712 oder eines eng verwandten Stammes, die Zellernte in der mittleren exponentiellen Phase, Zellwaschschritte und die Äquilibrierung in S30A- und S30B-Puffern. Diese Phase dauert drei Tage, und die Zeit für das Zellwachstum kann verwendet werden, um die verbleibenden Komponenten wie unten beschrieben vorzubereiten. Die geernteten Zellen werden dann durch Beschallung lysiert, geklärt und durchlaufen eine Abflussreaktion. In dieser letzten Phase der Vorbereitung können die Zellextrakte für die Langzeitlagerung bei -80 °C vorbereitet werden, um den Aktivitätsverlust zu minimieren. Für die Montage von TX-TL-Reaktionen mit diesem Protokoll wird ein Streptomyces Master Mix (SMM) vorgestellt, mit der Option eines Minimal Energy Solution-Formats (MES), das vergleichbare Ausbeuten liefert. Ferner wird empfohlen, eine frische Kultur von S. venezuelae ATCC 10712 aus einem -80 °C Glycerinvorrat auf eine GYM-Agarplatte zu streifen und bei 28 °C für mindestens 48-72 h zu inkubieren, bis einzelne Kolonien sichtbar sind. Für die folgenden Schritte sollten nur frische Kulturen verwendet werden.
Protokoll
HINWEIS: Siehe Tabelle 1 und Tabelle 2 für Rezepte für GYM Medium und Agar Plate und S30A und S30B Waschpuffer.
1. Vorbereitung von Lösungen und allgemeinen Leitlinien
- Bewahren Sie alle Lösungen, Zellen (nach dem Wachstum) und Zellextrakte nach der Zubereitung auf Eis auf, es sei denn, es wird eine Ausnahme angegeben.
- Lagervorräte für 1 M Mg-Glutamat, 4 M K-Glutamat, 40% (w/v) PEG 6000, 1 g/ml Polyvinylsulfonsäure bei Raumtemperatur und alle anderen Bestände bei -80 °C. Minimieren Sie die Anzahl der Gefrier-Tau-Zyklen, um einen chemischen Abbau zu vermeiden.
- Für die Erstellung von Energielösungsbeständen (siehe Tabelle 3) wie 3-PGA (erfordert pH-Einstellung) befolgen Sie die Anleitung im E. coli TX-TL-Protokoll41.
HINWEIS: Alle Komponenten sind in ddH2O vollständig löslich und werden als Aliquots im -80 °C Gefrierschrank gelagert. - Einzelne Bestände oder Energielösungen (später beschrieben) auf Eis abtauen. Den Aminosäurevorrat bei 42 °C mit Wirbeln für ~15-30 min erhitzen, um alle Aminosäuren zu lösen.
- Da einige Aminosäuren (L-Cys, L-Tyr, L-Leu) auf Eis ausfallen, während die Ruhezeit minimiert wird, lassen Sie diese Lösung bei Raumtemperatur und verwenden Sie einen Wirbel, um sich aufzulösen.
- Addieren Sie die berechneten Volumina (Tabelle 3) von Stammlösungen und Wasser und mischen Sie gut mit einem Wirbel.
- Aliquotieren Sie die Energielösung als 20-100 μL Aliquot pro Röhrchen, oder nach Wunsch auf Eis und lagern Sie sie bei -80 °C bis zur weiteren Verwendung.
2. Vorbereitung von S. venezuelae ATCC 10712 Zellen
- Tag 1 -Medien-/Puffervorbereitung und Vorkultur über Nacht
- 1 l steriles GYM-Flüssigmedium wird in einem 2-Liter-Prallenkolben gemäß Tabelle 1 hergestellt. Siehe die Tabelle der Materialien für Geräte/Chemikalien/Reagenzienquellen.
- 1 x 50 ml steriles GYM-Flüssigmedium werden in einem 250-ml-Erlenmeyerkolben gemäß Tabelle 1 hergestellt.
- Bereiten Sie 100 ml 1 M HEPES-KOH pH 7,5, 100 ml 1 M MgCl2 und 500 ml 4 M NH4Cl Lösungen vor, um 1 l S30A und 1 l S30B-Waschpuffer herzustellen. Siehe Tabelle 2 für die Rezepte.
- Bereiten Sie die Vorkultur über Nacht vor. Das sterile 50 mL GYM Flüssigmedium in einem 250 mL Erlenmeyerkolben 30 min auf 28 °C vorwärmen.
- Impfen Sie eine einzelne Kolonie von S. venezuelae ATCC 10712 (oder verwandten Stamm) aus einer GYM-Agarplatte in vorgewärmte 50 ml GYM-Flüssigmedium und inkubieren Sie bei 28 ° C, 200 U / min für 16 h (Vorkultur über Nacht).
- Tag 2 - Bereiten Sie die Tagesvorkultur und die Hauptwachstumskultur vor.
- 50 ml steriles GYM-Flüssigmedium in einem 250 mL Erlenmeyerkolben bei 28 °C für 30 min vorerwärmen.
- 1 ml Vorkultur über Nacht in vorgewärmte 50 ml flüssiges GYM-Medium geben und bei 28 °C, 200 U/ min für 8 h inkubieren (Tagesvorkultur).
- Nach dieser Wachstumsperiode überprüfen Sie das OD600 in einem Spektralphotometer mit einer 1:10-Verdünnung mit sterilem GYM-Medium in einer 1 ml (1 cm Pfadlänge) Kunststoffküvette.
HINWEIS: Der OD600 sollte mindestens 3-4 erreicht haben. Bei schlechtem Wachstum ist es ratsam, die Schritte 2.2.1-2.2.2 zu wiederholen. - Subkultur 0,25 ml Tagesvorkultur in 1 l flüssiges GYM-Medium in 2 L prall gefüllten Kolben.
- Über Nacht bei 28 °C, 200 U/min für 14 h schütteln.
- Tag 3-Erntezellen
- Nach der vorherigen Inkubationszeit (14 h) ist die OD600 der Hauptkultur aufzuzeichnen. Verdünnen Sie die Übernachtungskultur 1:10 mit frischem GYM-Medium für die OD600-Messung .
HINWEIS: Der OD600 sollte zu diesem Zeitpunkt 3,0-4,0 erreicht haben. - Wenn OD600<3.0, erhöhen Sie die Schüttelgeschwindigkeit auf 250-300 U / min und wachsen Sie, bis ein OD600 von 3.0 erreicht ist. Wachsen Sie nicht länger als weitere 2 h (insgesamt 16 h).
- Wenn OD600>3.0, die Kulturen in Zentrifugationsbehälter geben und schnell auf Nassemis für 30 min abkühlen.
- Während Sie darauf warten, dass die Zellkultur auf Eis abkühlt, bereiten Sie 4 ml frische 1 M Dithiothreitol (DTT), S30A und S30B Puffer vor, wie in Tabelle 1 beschrieben, und bewahren Sie sie auf Eis auf. Siehe die Tabelle der Materialien für chemikalien/reagenzienquelle.
- Ein leeres 50-ml-Zentrifugenröhrchen vorwiegen und bei -20 °C vorkühlen.
- Fügen Sie 2 ml 1 M DTT zu 1 l S30A-Puffer auf Eis hinzu und mischen Sie gut.
HINWEIS: Fügen Sie DTT nur vor der Verwendung zu den Waschpuffern S30A und S30B hinzu. - Zentrifugieren Sie die Zellen bei 6.000 × g, 4 °C, 10 min und verwerfen Sie den Überstand vorsichtig in einer schnellen und einzigen Bewegung.
HINWEIS: Wenn das Pellet gestört ist, maximieren Sie die Zellretention mit dem verbleibenden GYM-Medium und setzen Sie das Protokoll fort. - Fügen Sie 500 ml S30A-Puffer hinzu und resuspendieren Sie die Zellen, indem Sie die Zentrifugationsflaschen kräftig schütteln, bis die Zellklumpen homogen verteilt sind.
- Zentrifugieren Sie die Zellen bei 6.000 × g, 4 °C, 6 min und verwerfen Sie den Überstand vorsichtig.
HINWEIS: Obwohl das Zellpellet zu diesem Zeitpunkt fester ist, verbleiben einige Zellen in Suspension (siehe Abbildung 1). Behandeln Sie wie in 2.3.7 beschrieben und behalten Sie so viele Zellen wie möglich. - Wiederholen Sie die Schritte 2.3.8-2.3.9.
- Fügen Sie 2 ml 1 M DTT zu 1 l S30B-Puffer auf Eis hinzu und mischen Sie gut. Fügen Sie den Zellen 500 ml S30B-Puffer hinzu. Wiederholen Sie Schritt 2.3.9.
- Resuspendieren Sie das Zellpellet in 10 mL S30B-Puffer und geben Sie es in das vorgewogene, vorgekühlte 50 mL Zentrifugenröhrchen um. Übertragen Sie bei Bedarf die Restzellen mit einem zusätzlichen 5-10 mL S30B-Puffer. Füllen Sie bis zu 50 ml mit S30B.
- Zentrifugieren Sie die Zellen bei 6.000 × g, 4 °C, 10 min und verwerfen Sie den Überstand vorsichtig.
- Wiederholen Sie Schritt 2.3.13.
- Den restlichen S30B-Überstand vorsichtig mit einer 100-200 μL Pipette absaugen.
- Wiegen Sie das Nasszellpellet.
HINWEIS: Typisches Nasszellpelletgewicht für 1 L GYM-Kultur über Nacht (OD600 = 3,0) beträgt ~ 4,5 g. - Für jeweils 1 g Nasszellen 0,9 ml S30B-Puffer hinzufügen. Resuspendieren Sie die Zellen entweder mit einer Pasteurpipette oder einem Wirbel.
- Zentrifugiere kurz (~10 s) bis zu 500 × g , um die Zellen zu sedimentieren.
HINWEIS: Das Protokoll kann an dieser Stelle pausiert werden, und die Zellen können entweder auf flüssigem Stickstoff oder Trockeneis eingefroren und bei -80 ° C gelagert werden.
- Nach der vorherigen Inkubationszeit (14 h) ist die OD600 der Hauptkultur aufzuzeichnen. Verdünnen Sie die Übernachtungskultur 1:10 mit frischem GYM-Medium für die OD600-Messung .
3. Zelllyse durch Beschallung, um den Rohzellextrakt zu erhalten
HINWEIS: In diesem Stadium kann der Benutzer wählen, ob er die Zellen durch Beschallung entweder in 1 ml Fraktionen (Option 1) oder als größere Zellsuspension (5 ml) in einem 50 ml Röhrchen (Option 2) stören möchte. Beide Optionen wurden im Folgenden beschrieben, um die Reproduzierbarkeit zu gewährleisten, da sich das endgültige Volumen der Zellsuspension aufgrund des Zellverlusts während früherer Ernte- und Waschschritte ändern kann. Ein neuer Benutzer sollte zuerst Option 2.1 versuchen, das Protokoll einzurichten.
- Zelllyse durch Beschallung in 1 mL Fraktionen
- Mit einer 1 mL Pipettenspitze (das Ende der Spitze abschneiden, um die Bohrungsgröße zu erhöhen) wird 1 mL der Zellsuspension in 2 mL Mikrozentrifugenröhrchen übertragen.
HINWEIS: Wenn die Zellen eingefroren sind, tauen Sie das 50-ml-Röhrchen, das das Pellet enthält, vor der Zelllyse schnell in lauwarmem Wasser auf. Übertragen Sie das Rohr auf Nasseis, sobald das Pellet zu tauen begonnen hat, und kühlen Sie es für 10 min. - Legen Sie jedes Mikrozentrifugenrohr in ein Becherglas mit Eiswasser, wobei Sie ein Kunststoffrohrgestell verwenden, um das Rohr zur Beschallung zu halten.
HINWEIS: Aufgrund der Empfindlichkeit des Zellextrakts gegenüber Überhitzung ist es wichtig sicherzustellen, dass sich die Röhrchen nicht erwärmen, um eine Proteinfällung und eine verminderte enzymatische Aktivität zu verhindern. - Verwenden Sie eine Ultraschallsonde mit einer Spitze von 3 mm Durchmesser und reinigen Sie sie mit 70% (v/v) Ethanol und doppelt destilliertem Wasser (ddH2O). Senken Sie die Ultraschallspitze in die Zellsuspension, bis sie sich ~1 cm unter der Flüssigkeitsoberfläche befindet.
- Geben Sie die folgenden Einstellungen in den Ultraschallgerät ein: 20 kHz Frequenz, 65% Amplitude, 10 s Impuls EIN-Zeit, 10 s Impulse AUS-Zeit, 1 min Gesamtschallationszeit.
- Führen Sie das Beschallungsprotokoll aus. Bewegen Sie die Röhre während der ersten beiden Ruhezyklen nach oben / unten und zur Seite, um sicherzustellen, dass die Zellen gleichmäßig beschallt sind. Zeichnen Sie den Energieeintrag auf.
HINWEIS: Tragen Sie aus Sicherheitsgründen während der Beschallung einen geeigneten Gehörschutz. Die Viskosität nimmt ab, wenn Zellen gestört werden, und das blasse Creme-Nasszellpellet sollte sich in eine homogene braune Flüssigkeit verwandeln. Der empfohlene Energieeintrag beträgt 240 J pro ml Nasszellen. Wenn die Zellen nur teilweise lysiert sind, erscheint die Suspension immer noch cremefarben mit viskosen Zellklumpen, insbesondere an den Seiten der Tube. - Drehen Sie die Röhre 2-3 Mal um und wiederholen Sie die Beschallung für weitere ein oder zwei 10-s-Zyklen, mischen Sie häufig, bis die Zellen vollständig gestört sind.
- Mit einer 1 mL Pipettenspitze (das Ende der Spitze abschneiden, um die Bohrungsgröße zu erhöhen) wird 1 mL der Zellsuspension in 2 mL Mikrozentrifugenröhrchen übertragen.
- Zelllyse durch Beschallung einer 5 ml Zellsuspension
- Wenn die Zellen eingefroren sind, das 50-ml-Röhrchen, das das Pellet enthält, vor der Zelllyse in lauwarmem Wasser unter Schütteln schnell auftauen. Übertragen Sie das Rohr auf Nasseis, sobald das Pellet zu tauen begonnen hat, und kühlen Sie es für 10 min.
- Drehen Sie die Röhre kurz bei 500 x g , um die Zellen zu sedimentieren.
- Legen Sie das 50-ml-Rohr zur Beschallung in ein Becherglas mit Eiswasser.
HINWEIS: Aufgrund der Empfindlichkeit des Zellextrakts gegenüber Überhitzung ist es wichtig sicherzustellen, dass sich die Röhrchen nicht erwärmen, um eine Proteinfällung und eine verminderte enzymatische Aktivität zu verhindern. - Verwenden Sie eine Ultraschallsonde mit einer Spitze von 6 mm Durchmesser und reinigen Sie sie mit 70% (v/v) Ethanol und ddH2O (siehe visuelles Schema der 6 mm Sonde in Abbildung 1). Senken Sie die Ultraschallspitze in die Zellsuspension (~5 ml) ab, bis sie sich ~1 cm unter der Flüssigkeitsoberfläche befindet.
- Geben Sie die folgenden Einstellungen in den Ultraschallgerät ein: 20 kHz Frequenz, 65% Amplitude, 10 s Impuls EIN-Zeit, 10 s Impulse AUS-Zeit, 1 min Gesamtschallationszeit pro ml Nasszellen (insgesamt 5 min).
- Führen Sie das Beschallungsprotokoll aus. Bewegen Sie die Röhre während der ersten beiden Ruhezyklen nach oben / unten und zur Seite, um sicherzustellen, dass die Zellen gleichmäßig beschallt sind.
HINWEIS: Tragen Sie aus Sicherheitsgründen während der Beschallung einen geeigneten Gehörschutz. Die Viskosität nimmt ab, wenn die Zellen gestört werden, und das blasse Creme-Nasszellpellet sollte sich in eine homogene braune Flüssigkeit verwandeln. Zeichnen Sie den Energieeintrag auf. Ein optimaler Energieeintrag von 240 J pro ml Nasszellen (~1200 J insgesamt ab 5 min Beschallung) wird empfohlen. - Wenn einige Zellen intakt bleiben, befolgen Sie die Anweisungen in Schritt 3.1.5.
- Übertragen Sie die Zellextrakte in 2 ml Mikrozentrifugenröhrchen.
4. Zellextraktklärung und Abflussreaktion
- Zentrifugieren Sie die lysierten Zellen bei 16.000 × g für 10 min bei 4 °C, um die Zelltrümmer zu entfernen. Den Überstand in 1,5 ml Mikrozentrifugenröhrchen als 1 mL Aliquots überführen.
- Führen Sie die Ablaufreaktion für die Zellextrakte durch. Die 1,5 ml Röhrchen, die die Zellextrakte enthalten, bei 30 °C für 60 min auf einem Wärmeblock oder Inkubator ohne zu schütteln inkubieren.
- Zentrifugieren Sie die Zellextrakte bei 16.000 × g für 10 min bei 4 °C. Die Überstände in einem 15 ml Zentrifugenröhrchen bündeln. Mischen Sie den Überstand, indem Sie das Rohr fünfmal umkehren, bis es homogen ist, und halten Sie es dann auf Eis. Kehren Sie vorsichtig um, um die Bildung von Luftblasen zu vermeiden.
- Verdünnen Sie 10 μL des Zellextrakts 100-fach mit S30B-Puffer und messen Sie die Gesamtproteinkonzentration mit einem Bradford-Assay mit drei technischen Wiederholungen (siehe Supplemental Material S2 für Bradford Assay Guidance).
- Wenn die Proteinkonzentration 20-25 mg/ml beträgt, die Zellextrakte als 100 μL Aliquots in neue 1,5 ml Röhrchen überführen, in flüssigem Stickstoff schockgefrieren und bei -80 °C lagern.
HINWEIS: Tragen Sie aus Sicherheitsgründen geeignete PSA, wenn Sie mit flüssigem Stickstoff umgehen, einschließlich Gesichtsschilden und Handschuhen. - Wenn die Proteinkonzentration <20 mg/ml beträgt, wiederholen Sie die Schritte zur Herstellung des Rohextrakts, um sicherzustellen, dass die hochwertigen Zellextrakt- und TX-TL-Ausbeuten mit den zuvor veröffentlichten Arbeiten vergleichbar sind5.
5. Vorbereitung der Plasmid-DNA-Vorlage
- Reinigen Sie das pTU1-A-SP44-mScarlet-I-Plasmid (pUC19-Ursprung) aus einem frisch transformierten E. coli-Plasmidstamm (DH10β, JM109), der in 50 ml LB-Kultur (mit 100 mg / ml Carbenicillin) gezüchtet wurde, mit einem geeigneten Plasmid-DNA-Reinigungskit gemäß den Anweisungen des Herstellers.
- Eluieren Sie das Plasmid in 2 x 300 μL nukleasefreiem Wasser und kombinieren Sie die Fraktionen.
- 0,1 Volumen (66 μL) 3 M Natriumacetat (pH 5,2) zugeben.
- Fügen Sie 0,7 Volumen (462 μL) Isopropanol hinzu.
- Inkubieren Sie die DNA bei -20 °C für 30 min.
- Zentrifugiere bei 16.000 × g für 30 min bei 4 °C und verwerfe den Überstand.
- 2 ml 70% (v/v) Ethanol in das DNA-Pellet geben.
- Invertieren Sie die Röhre 3-4 Mal, um das Plasmid-DNA-Pellet zu resuspendieren.
- Zentrifugiere bei 16.000 × g für 5 min bei 4 °C und entsorge den Überstand.
- Wiederholen Sie die Schritte 5.7-5.9 und entfernen Sie alle sichtbaren Flüssigkeiten.
- Trocknen Sie das DNA-Pellet für 10-30 min an der Luft oder trocknen Sie es für 5 min mit einer Vakuumzentrifuge.
- Resuspendieren Sie das getrocknete Pellet mit 600 μL nukleasefreiem ddH2O.
- Messen Sie die DNA-Konzentration und -Reinheit mit einem Spektralphotometer.
- 50-100 μL Aliquots zubereiten und bei -20 °C lagern.
HINWEIS: Eine hohe DNA-Konzentration im Bereich von 500-1000 ng/μL wird aufgrund der engen Volumenbeschränkungen zellfreier Reaktionen empfohlen. Verdünnen Sie den Plasmid-DNA-Stamm auf 80 nM; 168 ng/μL pTU1-A-SP44-mScarlet-I Plasmid entspricht 80 nM.
6. Herstellung der Streptomyces Master Mix (SMM) Lösung
- Aminosäurelösung
- Verwenden Sie das Aminosäure-Sampler-Kit, um manuelle Fehler zu vermeiden und die Vorbereitungszeit zu verkürzen, indem Sie die Anweisungen des Herstellers online befolgen.
- Verdünnen Sie die 20-fache Aminosäurenstammlösung mit ddH2O auf eine Endkonzentration von 6 mM (5 mM L-Leu).
- Weitere Verdünnung auf 2,4 mM (2 mM L-Leu) innerhalb der 2,4-fachen SMM-Lösung (siehe Tabelle 3).
HINWEIS: Die Endkonzentration in der TX-TL-Reaktion beträgt 1 mM 19x Aminosäuren und 0,83 mM L-Leu.
- Energielösung und Additive
- Bereiten Sie die anderen Komponenten in der 2,4-fachen SMM-Lösung nach dem in Tabelle 3 beschriebenen Rezept vor.
- Alternativ können Sie eine 2,4-fache Minimalenergielösung (MES) nach dem in Tabelle 3 beschriebenen Rezept zubereiten.
7. Einrichten einer Standard-S. venezuelae TX-TL-Reaktion
- Tauen Sie den Zellextrakt, die SMM - (oder MES-) Lösung und die Plasmid-DNA auf Eis auf. Eine 384-Well-Platte bei -20 °C vorkühlen.
- Richten Sie TX-TL-Reaktionen ein, bei denen 25% des Volumens Plasmid-DNA, 33,33% Zellextrakt und 41,67% SMM-Lösung sind; Halten Sie sie auf Eis, um Startzeitverzerrungen zu vermeiden.
HINWEIS: Es wurde eine Standard-TX-TL-Vorlage bereitgestellt (Tabelle 4), um das Volumen der benötigten Reagenzien basierend auf der Anzahl der Reaktionen zu berechnen. Das Standardvolumen für eine 33-μL-Reaktion ist wie folgt: 11 μL Zellextrakt, 13,75 μL SMM und 8,25 μL Plasmid-DNA. - Wirbeln Sie die Mischung vorsichtig für ~ 5 s bei niedriger Geschwindigkeit, um sicherzustellen, dass die Lösung homogen ist. Schaumbildung/Blasenbildung vermeiden.
- 10 μL Aliquots in drei Vertiefungen einer 384-Well-Platte als technisches Dreifaches überführen, ohne Luftblasen einzuführen. Verschließen Sie die Platte mit einer transparenten Abdeckung und drehen Sie sie bei 400 × g für 5 s.
- Inkubieren Sie die Reaktion bei 28 °C entweder in einem Inkubator (für Endpunktmessungen) oder einem Plattenleser ohne Schütteln.
HINWEIS: Reaktionen benötigen typischerweise 3-4 h, um den Abschluss zu erreichen. Siehe Ergänzungsmaterial S2 für Anleitungen zu einem Plattenleser und mScarlet-I-Standardmessungen.
Ergebnisse
Dieses detaillierte Protokoll dient als Beispiel, um dem Benutzer zu helfen, ein Streptomyces TX-TL-System basierend auf dem Modellstamm S. venezuelae ATCC 10712 einzurichten (Abbildung 1). Der Benutzer kann versuchen, andere Streptomyces-Stämme zu untersuchen; Die Wachstums-/Erntephasen anderer Sorten mit längeren Verdopplungszeiten oder ausgeprägten Wachstumspräferenzen müssen jedoch individuell optimiert werden, um Spitzenergebnisse zu erzielen. Für das repräsentative Ergebnis wurde das fluoreszierende Protein mScarlet-I aus dem Standardplasmid pTU1-A-SP44-mScarlet-I (Abbildung 2 und Abbildung 3) optimiert, um eine hochenträchtige Expression in S. venezuelae TX-TL mit einer Reihe von Nachweismethoden (SDS-PAGE, Fluoreszenz) zu ermöglichen. Darüber hinaus wurde dieses Standardplasmid modifiziert, um die Synthese einer Reihe von Sekundärmetabolitenzymen aus S. rimosus zu demonstrieren (Abbildung 2)5. Schließlich wird ein potenzieller Workflow für die skalierte Naturstoffbiosynthese als Schema für die Verwendung eines Modellweges aus den frühen Stadien der Hämbiosynthese gezeigt. Der Workflow ist potenziell an andere sekundärmetabolische Biosynthesewege anpassbar. Als Richtlinie sollte dieses Protokoll eine Mindestausbeute von 2,8 μM für sfGFP und 3,5 μM für mScarlet-I/mVenus aus den auf AddGene bereitgestellten Expressionsplasmiden liefern. Diese Zahlen berücksichtigen typische Chargenvariationen (bis zu 28%), die in früheren Daten5 beobachtet wurden, obwohl Ausbeuten von mehr als 10 μM mScarlet-I mit optimalen Chargen (unveröffentlichte Daten) erzielt wurden.
Messung von S. venezuelae TX-TL des mScarlet-I-Gens mit fünf verschiedenen Methoden
Die Expression des pTU1-A-SP44-mScarlet-I-Standardplasmids wird mit der Messung der mScarlet-I-Expression mit fünf verschiedenen Methoden gezeigt: 1. Echtzeit-Fluoreszenzmessung von mRNA mit dem dBroccoli-Aptamer, 2. Echtzeit-Fluoreszenzmessung von unreifem mScarlet-I-Protein mit dem FlAsH-Tag-System, 3. Echtzeit-Fluoreszenzmessung von reifem mScarlet-I-Protein, 4. In-Gel-Fluoreszenzfärbung von mScarlet-I unter Verwendung von FlAsH-Tag, und 5. Coomassie-Blaufärbung von zellfreien Gesamtproteinen. Für diese Daten wurden die Reaktionen in 2 mL Mikrozentrifugenröhrchen als 33 μL-Reaktionen (für Endpunktproben) oder als 10 μL technisches Dreifach in 384-Well-Platten in einem Plattenleser aufgebaut. Ein dreifach markiertes (N-terminales His6, C-terminales Flag und C-terminales FlAsH) mScarlet-I-Protein wurde separat gereinigt, um einen Kalibrierstandard für Messungen zu erstellen, wobei das pET15b-mScarlet-I-Plasmid verwendet wurde, das in Supplemental Material S2 näher beschrieben ist. Die Daten für diese Experimente sind in Abbildung 3 dargestellt. Weitere Details zur In-Gel-Fluoreszenzfärbungsmethode finden Sie unter Ergänzungsmaterial S3.
S. venezuelae TX-TL der frühen Hämbiosynthese
Um als Modell des Biosyntheseweges für Naturprodukte zu dienen, wurde die "One-Pot"-Biosynthese von Uroporphyrinogen III (uro'gen III) unter Verwendung des pTU1-A-SP44-hemC-hemD/cysGA-hemB-Expressionsplasmids5 durchgeführt. Dieser Modellbiosyntheseweg wurde gewählt, da uro'gen III sehr sauerstoffempfindlich ist und schnell zu Uroporphyrin III oxidiert (Verlust von sechs Elektronen), das eine starke rote Fluoreszenz aufweist. Dies ermöglicht eine einfache Detektion der Reaktion in Echtzeit mittels Fluoreszenzmessungen und/oder HPLC-MS (Abbildung 4), wie bereits beschrieben5. Darüber hinaus wurden diese Reaktionen entweder mit einer Batch- oder einer semikontinuierlichen Methode untersucht. Eine halbkontinuierliche Reaktion ist eine Strategie, bei der ein Mikrodialysegerät42,43 verwendet wird, das zusätzliche Energie (NTPs, sekundäre Energiequelle) und Aminosäuren liefert, um die Reaktionszeit zu verlängern und die Proteinsyntheseausbeute zu erhöhen. Hier wird die semikontinuierliche Methode verwendet, um die Häm-Modellreaktion zu skalieren und die TX-TL-Proteine vom Reaktionsprodukt zu trennen, um die Aufreinigung und Analyse mittels HPLC-MS zu erleichtern. Weitere Einzelheiten zu den Methoden finden Sie im Ergänzungsmaterial S4 oder für Daten siehe vorherige Arbeit5. Semikontinuierliche zellfreie Reaktionen werden auch in früheren Arbeiten beschrieben42,43. Der hier gezeigte schematische Beispiel-Workflow (Abbildung 4) ist potenziell an andere Biosynthesewege von Naturprodukten anpassbar.
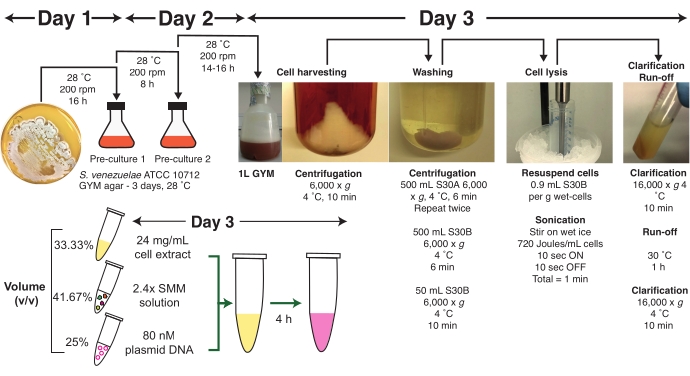
Abbildung 1: Überblick über das Streptomyces venezuelae TX-TL-Protokoll. Eine Protokollzusammenfassung wird illustriert, einschließlich eines empfohlenen Zeitrahmens von drei Tagen. Das Protokoll ist in verschiedene Stadien des Zellwachstums, der Zellernte, der Zellwäsche, der Zelllyse durch Beschallung, der Klärung, der Abflussreaktion, der Master-Mix-Vorbereitung (SMM), der Plasmid-DNA-Präparation und der TX-TL-Reaktionsanordnung unterteilt. Das vollständige Protokoll wird im Text ausführlich beschrieben, zusammen mit Anleitungen und praktischen Tipps. Abkürzungen: SMM = Streptomyces Master Mix; TX-TL = Transkriptions-Übersetzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Proteinsynthese mit hoher Ausbeute aus Genen mit hohem G+C (%). (A) Synthese von sfGFP-, mVenus-I- und mScarlet-I-fluoreszierenden Proteinen. (B) Synthese biosynthetischer Enzyme aus Streptomyces rimosus. Abkürzung: EV = Leerer Vektor; NRPS = nichtribosomale Peptidsynthetase. Die Zahl ist von 5 modifiziert. Bitte beachten Sie das Protokoll und die ergänzenden Dateien für den Reaktionsaufbau und die Methodik. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Messung von TX-TL in fünf Richtungen mit dem pTU1-A-SP44-mScarlet-I-Plasmid. (A) Plasmiddesign mit folgenden Merkmalen: SP44 ist ein starker konstitutiver Promotor, der in Streptomyces spp. und E. coli aktiv ist; pET-RBS wird von den pET-Expressionsplasmiden abgeleitet und ist sowohl in Streptomyces spp. als auch in E. coli5,40 hochaktiv; Streptomyces-Codon-optimiertes mScarlet-I-Gen, das für ein rot fluoreszierendes Proteinderivat kodiert44; C-Terminal FLAG-Tag zur Affinitätschromatographie-Aufreinigung oder Western-Blotting-Detektion; C-terminales FlAsH-Tag für fluoreszierende Markierung zur In-Gel-Färbung oder Echtzeitmessung der entstehenden Proteinsynthese; dBroccoli-Aptamer zur Echtzeit-mRNA-Messung mit der DFHBI-Sonde; Bba_B0015 Transkriptionsterminator, die in S. venezuelae ATCC 107125 sehr effizient sind; Ampicillin-Resistenz-Marker; und pUC19 Ursprung der Replikation. (B) Echtzeit-mRNA-Expression, nachgewiesen mit dem dBroccoli-Aptamer und der DFHBI-Sonde (Anregung 483-14 nm, Emission 530-30 nm). (C) Echtzeit-Nachweis der entstehenden Proteinsynthese mit FlAsH-EDT2-Fluoreszenzsonde (Anregung 500-10 nm, Emission 535-10 nm). (D) Echtzeit-Fluoreszenzmessung der mScarlet-I-Synthese (Anregung 565-10 nm, Emission 600-10 nm). (E) In-Gel-Färbung mit der FlAsH-EDT2-Fluoreszenzsonde. (F) Coomassie-Blaufärbung von Tx-TL-Gesamtproteinen mit gereinigtem His6-mScarlet-I-Standard zum Vergleich. Die Reaktionen wurden unter den im Protokoll beschriebenen Bedingungen mit 40 nM Plasmid-DNA-Template durchgeführt. Alle Fluoreszenzdaten werden als RFU dargestellt, und Fehlerbalken (Standardabweichung von drei technischen Wiederholungen) werden in einem grau schattierten Bereich dargestellt. Abkürzungen: TX-TL = Transkriptionsübersetzung; FlAsH = fluorescein arsenical hairpin; DFHBI = 3,5-Difluor-4-hydroxybenzyliden imidazolinon; RFU = relative Fluoreszenzeinheiten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Schematischer Arbeitsablauf für die semikontinuierliche S. venezuelae TX-TL-Reaktion. Ein Beispiel-Workflow für das Naturprodukt TX-TL unter Verwendung des frühen Häm-Biosynthese-Operons und der nachgeschalteten Analyse mittels HPLC-MS. Reaktionen und Analysen sind im ergänzenden Material detailliert beschrieben. Die Zahl ist von 5 modifiziert. Abkürzungen: SMM = Streptomyces Master Mix; TX-TL = Transkriptions-Übersetzung; ALA = 5-Aminolävulinsäure; SPE = Festphasenextraktion; ESI-MS = Elektronensprühionisations-Massenspektrometrie; HPLC-MS = Hochleistungsflüssigkeitschromatographie-Massenspektrometrie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Rezept für GYM Bakterienwachstumsmedium und GYM Agarplatte. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Reagenzien zur Herstellung von S30A- und S30B-Waschpuffern. Diese Informationen wurden von Kieser et al. übernommen. 45 Abkürzung: DTT = dithiothreitol. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Rezept für die Herstellung der S. venezuelae MES- und SMM-Lösungen. Abkürzungen: MES = Minimal Energy Solution; SMM = Streptomyces Master Mix; NTP = Nukleosidtriphosphat; PEG 6000 = Polyethylenglykol 6000; 3-PGA = 3-Phosphoglycerat; G6P = Glucose-6-Phosphat; PVSA = Polyvinylsulfonsäure. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4: Rezept für S. venezuelae TX-TL Reaktion. Abkürzungen: MES = Minimal Energy Solution; SMM = Streptomyces Master Mix; TX-TL = Transkriptions-Übersetzung. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle S1: Plasmide für S. venezuelae TX-TL Workflow. Abkürzung: TX-TL = Transkriptionsübersetzung. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzungsmaterial S2: mScarlet-I Kalibrierstandardvorbereitung und Plattenlesermessungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Material S3: FlAsH-Tag-Methoden. Abkürzung: FlAsH = fluorescein arsenical hairpin. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Material S4: Semikontinuierliche Reaktion, Reinigung und HPLC-MS. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In diesem Manuskript wurde ein ertragreiches S. venezuelae TX-TL-Protokoll mit detaillierten Schritten beschrieben, die sowohl für erfahrene als auch für neue Benutzer von TX-TL-Systemen einfach durchzuführen sind. Mehrere Funktionen aus den bestehenden Streptomyces45- und E. coli TX-TL41-Protokollen wurden entfernt, um ein minimales, aber ertragreiches Protokoll für S. venezuelae TX-TL5,26 zu etablieren. Der hier empfohlene Workflow besteht darin, sicherzustellen, dass S. venezuelae im gewählten reichhaltigen Medium schnell wächst, um die endgültige Kultur am Abend impfen zu können. Dies ermöglicht die Zellernte bei Spitzenwachstum am nächsten Morgen und ermöglicht es dem Benutzer, den aktiven Zellextrakt am selben Tag zu ernten und vorzubereiten. Durch die Befolgung dieses optimierten Protokolls wird erwartet, dass ein einzelner Forscher das Protokoll bequem in einem dreitägigen Rahmen vervollständigen kann. Ein komplementäres Plasmid-Toolkit wurde auch für das S. venezuelae TX-TL-System bereitgestellt, einschließlich eines starken Expressionsplasmidsystems (pTU1-A-SP44-mScarlet-I), das eine breite Funktionalität für die mRNA / Protein-Analyse bietet. Dieses Standardplasmid wird von dem konstitutiven SP44-Promotor angetrieben, der in einer Reihe von Streptomyces spp. und in E. coli39. Um das anfängliche Potenzial des S. venezuelae TX-TL-Toolkits zu demonstrieren, zeigen die repräsentativen Ergebnisse die Ausbeute einer Reihe von fluoreszierenden Proteinen, sekundären Metabolitenenzymen und die Biosynthese eines Modell-Naturstoffweges (aus der Hämbiosynthese).
Insgesamt enthält das Protokoll eine detaillierte Beschreibung des S. venezuelae TX-TL-Systems sowie praktische Tipps zur Vorbereitung der drei wesentlichen Komponenten der TX-TL-Reaktion: (1) Zellextrakt, (2) Streptomyces Master Mix (SMM) -Lösung und (3) Plasmid-DNA. Dieses Protokoll erfordert keine spezielle Ausrüstung und erfordert nur routinemäßige mikrobiologische und biochemische Fähigkeiten. Daher ist es für die meisten Labore zugänglich. Das Protokoll eignet sich für reaktionsschnelle (10-100 μL) und größere Reaktionen (~ 2,5 ml), obwohl eine gewisse Optimierung der Reaktionsgröße / Belüftung die Proteinausbeute beeinflussen kann. Das empfohlene Reaktionsvolumen beträgt 33 μL in einem 2-ml-Röhrchen oder 10 μL in einer 384-Well-Platte. Die Herstellung des Rohextrakts durch eine einzelne Person ausgehend von einem Glycerinvorrat dauert fünf Tage. Jeder Liter (L) Kultur ergibt mindestens 5 ml Zellextrakt (entspricht ~1500 x 10 μL TX-TL-Reaktionen) - dies ist eine konservative Schätzung und berücksichtigt den Probenverlust während der Waschschritte und der Zellextraktklärung. Jede Phase des Protokolls ist unabhängig und kann vom Benutzer optimiert werden, um seine Bedürfnisse zu erfüllen. Eine wesentliche Einschränkung für alle zellfreien Systeme ist die Chargenvariation46,47. Zu den allgemeinen Faktoren gehören Pipettierfehler, Benutzererfahrung, Medienchargenvariation und Geräteunterschiede. Wir führen speziell eine Mastermischung ein, um Pipettierfehler zu minimieren, und geben detaillierte Anweisungen, die die Verwendung von Medien und Geräten abdecken. Bis heute ist das Protokoll für eine Reihe von Anwendern in mindestens fünf britischen Forschungsgruppen reproduzierbar. Es ist jedoch nicht bekannt, welche Rolle die biologische Variation zur zellfreien Chargenvariabilität beiträgt. Neben globalen Unterschieden in der Genexpressionsregulation wird die Genomplastizität in Streptomyces spp. ausführlich berichtet und trägt dazu potenziell bei48 bei. Um die Chargenvariation zu untersuchen, wird empfohlen, bis zu vier separate 1-Liter-Kulturen zu züchten, die aus vier einzelnen Kolonien stammen, die über Nacht angebaut werden. Zuvor wurde eine Variation von bis zu 28% (in Bezug auf die Standardabweichung) zwischen vier biologischen Chargen beobachtet (4 L pro Charge lieferten ~20 ml Zellextrakt)5. Basierend auf diesen Daten ist ein vernünftiges Minimalziel für einen neuen Benutzer 2,8 μM für sfGFP und 3,5 μM mScarlet-I/mVenus-I unter Verwendung der Plasmide, die auf AddGene verfügbar sind - diese Ziele sind 30% niedriger als der in früheren Daten beobachtete Durchschnitt. Wenn eine nachgeschaltete HPLC-MS-Analyse gewünscht wird, kann das PEG 6000 aus den Master-Mischungen entfernt werden, obwohl eine Abnahme der gesamten TX-TL-Ausbeute um bis zu 50% zu erwarten ist.
In Bezug auf das Potenzial spezialisierter zellfreier Streptomyces-Systeme5,6 besteht ein wachsender Wunsch, neue Nasslaborwerkzeuge für Bioprospektionsanwendungen wie Naturstoffe zu entwickeln. Die Gattung Streptomyces ist tief verwurzelt in der Geschichte der Entdeckung von Naturprodukten, einschließlich Antibiotika, Herbiziden und pharmazeutischen Medikamenten49. Die zunehmenden Erkenntnisse aus Projekten zur Sequenzierung des gesamten Genoms und den neuesten bioinformatischen Werkzeugen50,51,52 haben ein beispielloses Maß an Naturstoffen aufgedeckt, die von BGCs in mikrobiellen Genomen kodiert werden53. Die Erschließung dieser genetischen Information, von der erwartet wird, dass sie neue Medikamente/Chemikalien und Enzyme enthält, die für die Biotechnologie nützlich sind, erfordert die Entwicklung neuer Strategien der synthetischen Biologie, einschließlich neuartiger Expressionssysteme und einer Reihe von Instrumenten des Metabolic Engineering54. Spezialisierte Streptomyces-basierte TX-TL-Systeme sind aus folgenden Gründen vorteilhaft, um Gene und regulatorische Elemente aus Actinobakterien und verwandten Genomen zu untersuchen: [1] Verfügbarkeit einer nativen Proteinfaltungsumgebung26, [2] Zugang zu einem optimalen tRNA-Pool für eine hohe G+ C (%) Genexpression und [3] ein aktiver Primärstoffwechsel für die potenzielle Versorgung mit biosynthetischen Vorläufern. Darüber hinaus ist ein wesentlicher Vorteil zellfreier Systeme die Hochdurchsatzcharakterisierung genetischer Teile und Genexpression unter Verwendung von Next-Generation-Sequencing13 und akustischer Flüssighandhabungsrobotik8,11,12. Zusammenfassend bietet das S. venezuelae TX-TL Toolkit5 ein ergänzendes Werkzeug auf dem Gebiet der synthetischen Biologie für Naturstoffe. Das TX-TL-Toolkit von S. venezuelae wird die Weiterentwicklung von S. venezuelae als Modellsystem unterstützen und eine Methode zur Entwicklung neuartiger Teile / Werkzeuge der synthetischen Biologie und zur Erforschung sekundärer Metaboliten-Biosynthesewege und Enzyme bereitstellen.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Autoren danken für folgende Forschungsunterstützung: EPSRC [EP/K038648/1] für SJM als PDRA mit PSF; Wellcome Trust sponserte ISSF-Stipendium für SJM mit PSF am Imperial College London; Forschungsstipendium der Royal Society [RGS\R1\191186]; Wellcome Trust SEED Award [217528/Z/19/Z] für SJM an der University of Kent; und Global Challenges Research Fund (GCRF) Ph.D. Stipendium für KC an der University of Kent.
Materialien
| Name | Company | Catalog Number | Comments |
| 2.5 L UltraYield Flask | Thomson | 931136-B | |
| 3-PGA (>93%) | Sigma | P8877 | |
| 384 Well Black/Clear Bottom Plate | ThermoFisher | 10692202 | |
| Ammonium chloride (98%) | Fluorochem | 44722 | |
| ATP, CTP, UTP, GTP (100 mM solution, >99%) | ThermoFisher | R0481 | |
| Carbenicillin (contact supplier for purity) | Melford | C46000-25.0 | |
| D-(+)-glucose (contact supplier for purity) | Melford | G32040 | |
| DFHBI (≥98% - HPLC) | Sigma | SML1627 | |
| DTT (contact supplier for purity) | Melford | MB1015 | |
| FlAsH-EDT2 (contact supplier for purity) | Santa Cruz Biotech | sc-363644 | |
| Glucose-6-phosphate (>98%) | Sigma | G7879 | |
| HEPES Free Acid (contact supplier for purity) | Melford | B2001 | |
| L-glutamic acid hemimagnesium salt tetrahydrate (>98%) | Sigma | 49605 | |
| Magnesium chloride (98%) | Fluorochem | 494356 | |
| Malt extract | Sigma | 70167-500G | |
| PEG-6000 | Sigma | 807491 | |
| Pierce 96-well Microdialysis Plate, 10K MWCO | ThermoFisher | 88260 | |
| Poly(vinyl sulfate) potassium salt | Sigma | 271969 | |
| Potassium glutamate (>99%) | Sigma | G1149 | |
| RTS amino acid sampler | 5 Prime | 2401530 | |
| Sodium chloride (99%) | Fluorochem | 94554 | |
| Supelclean LC-18 SPE C-18 SPE column (1 g) | Sigma | 505471 | |
| Yeast Extract | Melford | Y1333 | |
| Equipment | |||
| Platereader | BMG | Omega |
Referenzen
- Carbonell, P., et al. An automated Design-Build-Test-Learn pipeline for enhanced microbial production of fine chemicals. Communications Biology. 1, 66 (2018).
- Gregorio, N. E., Levine, M. Z., Oza, J. P. A user's guide to cell-free protein synthesis. Methods Protocols. 2 (1), 24 (2019).
- Zimmerman, E. S., et al. Production of site-specific antibody-drug conjugates using optimized non-natural amino acids in a cell-free expression system. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- Wiegand, D. J., Lee, H. H., Ostrov, N., Church, G. M. Cell-free protein expression using the rapidly growing bacterium Vibrio natriegens. Journal of Visualized Experiments: JoVE. (145), e59495 (2019).
- Moore, S. J., et al. A Streptomyces venezuelae cell-free toolkit for synthetic biology. ACS Synthetic Biology. 10 (2), 402-411 (2021).
- Xu, H., Liu, W. -. Q., Li, J. Translation related factors improve the productivity of a Streptomyces-based cell-free protein synthesis system. ACS Synthetic Biology. 9 (5), 1221-1224 (2020).
- Yim, S. S., et al. Multiplex transcriptional characterizations across diverse bacterial species using cell-free systems. Molecular Systems Biology. 15 (8), 8875 (2019).
- Moore, S. J., et al. Rapid acquisition and model-based analysis of cell-free transcription-translation reactions from nonmodel bacteria. Proceedings of the National Academy of Sciences of the United States of America. 115 (19), 4340-4349 (2018).
- Zawada, J. F., et al. Microscale to manufacturing scale-up of cell-free cytokine production--a new approach for shortening protein production development timelines. Biotechnology and Bioengineering. 108 (7), 1570-1578 (2011).
- Geertz, M., Shore, D., Maerkl, S. J. Massively parallel measurements of molecular interaction kinetics on a microfluidic platform. Proceedings of the National Academy of Sciences of the United States of America. 109 (41), 16540-16545 (2012).
- McManus, J. B., Emanuel, P. A., Murray, R. M., Lux, M. W. A method for cost-effective and rapid characterization of engineered T7-based transcription factors by cell-free protein synthesis reveals insights into the regulation of T7 RNA polymerase-driven expression. Archives of Biochemistry and Biophysics. 674, 108045 (2019).
- McManus, J. B., et al. A method for cost-effective and rapid characterization of genetic parts. bioRxiv. , (2021).
- Park, J., Yim, S. S., Wang, H. H. High-throughput transcriptional characterization of regulatory sequences from bacterial Biosynthetic Gene Clusters. ACS Synthetic Biology. , (2021).
- Caschera, F., Noireaux, V. Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie. 99, 162-168 (2014).
- Caschera, F., Noireaux, V. A cost-effective polyphosphate-based metabolism fuels an all E. coli cell-free expression system. Metabolic Engineering. 27, 29-37 (2015).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. coli RNA polymerase and sigma factor 70. Journal of Biological Engineering. 4, 8 (2010).
- Karim, A. S., Heggestad, J. T., Crowe, S. A., Jewett, M. C. Controlling cell-free metabolism through physiochemical perturbations. Metabolic Engineering. 45, 86-94 (2018).
- Cai, Q., et al. A simplified and robust protocol for immunoglobulin expression in Escherichia coli cell-free protein synthesis systems. Biotechnology Progress. 31 (3), 823-831 (2015).
- Garenne, D., Thompson, S., Brisson, A., Khakimzhan, A., Noireaux, V. The all-E. coli TXTL toolbox 3.0: New capabilities of a cell-free synthetic biology platform. Synthetic Biology. , (2021).
- Goering, A. W., et al. In vitro reconstruction of nonribosomal peptide biosynthesis directly from DNA using cell-free protein synthesis. ACS Synthetic Biology. 6 (1), 39-44 (2017).
- Khatri, Y., et al. Multicomponent microscale biosynthesis of unnatural cyanobacterial indole alkaloids. ACS Synthetic Biology. 9 (6), 1349-1360 (2020).
- Zhuang, L., et al. Total in vitro biosynthesis of the nonribosomal macrolactone peptide valinomycin. Metabolic Engineering. 60, 37-44 (2020).
- Hoskisson, P. A., Seipke, R. F. Cryptic or silent? The known unknowns, unknown knowns, and unknown unknowns of secondary metabolism. mBio. 11 (5), 02642 (2020).
- Bentley, S. D., et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 417 (6885), 141-147 (2002).
- Li, J., Wang, H., Kwon, Y. -. C., Jewett, M. C. Establishing a high yielding Streptomyces-based cell-free protein synthesis system. Biotechnology and Bioengineering. 114 (6), 1343-1353 (2017).
- Moore, S. J., Lai, H. -. E., Needham, H., Polizzi, K. M., Freemont, P. S. Streptomyces venezuelae TX-TL - a next generation cell-free synthetic biology tool. Biotechnology Journal. 12 (4), (2017).
- Kim, W., et al. Comparative genomics determines strain-dependent secondary metabolite production in Streptomyces venezuelae strains. Biomolecules. 10 (6), 864 (2020).
- Phelan, R. M., et al. Development of next generation synthetic biology tools for use in Streptomyces venezuelae. ACS Synthetic Biology. 6 (1), 159-166 (2017).
- Song, J. Y., et al. Complete genome sequence of Streptomyces venezuelae ATCC 15439, a promising cell factory for production of secondary metabolites. Journal of Biotechnology. 219, 57-58 (2016).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. mBio. 4 (5), 00684 (2013).
- Schumacher, M. A., et al. The crystal structure of the RsbN-σBldN complex from Streptomyces venezuelae defines a new structural class of anti-σ factor. Nucleic Acids Research. 46 (14), 7405-7417 (2018).
- Ramos-León, F., et al. A conserved cell division protein directly regulates FtsZ dynamics in filamentous and unicellular actinobacteria. Elife. 10, 63387 (2021).
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in Streptomycetes. Nature Reviews. Microbiology. 13 (12), 749-760 (2015).
- Ehrlich, J., Gottlieb, D., Burkholder, P. R., Anderson, L. E., Pridham, T. G. Streptomyces venezuelae, n. sp., the source of chloromycetin. Journal of Bacteriology. 56 (4), 467-477 (1948).
- Inahashi, Y., et al. Watasemycin biosynthesis in Streptomyces venezuelae: thiazoline C-methylation by a type B radical-SAM methylase homologue. Chemical Science. 8 (4), 2823-2831 (2017).
- Jakeman, D. L., et al. Antimicrobial activities of jadomycin B and structurally related analogues. Antimicrobial Agents and Chemotherapy. 53 (3), 1245-1247 (2009).
- Kodani, S., Sato, K., Hemmi, H., Ohnish-Kameyama, M. Isolation and structural determination of a new hydrophobic peptide venepeptide from Streptomyces venezuelae. Journal of Antibiotics. 67 (12), 839-842 (2014).
- Akey, D. L., et al. Structural basis for macrolactonization by the pikromycin thioesterase. Nature Chemical Biology. 2 (10), 537-542 (2006).
- Bai, C., et al. Exploiting a precise design of universal synthetic modular regulatory elements to unlock the microbial natural products in Streptomyces. Proceedings of the National Academy of Sciences of the United States of America. 112 (39), 12181-12186 (2015).
- Moore, S. J., et al. EcoFlex: A multifunctional MoClo kit for E. coli synthetic biology. ACS Synthetic Biology. 5 (10), 1059-1069 (2016).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. Journal of Visualized Experiments: JoVE. (79), e50762 (2013).
- Kim, D. M., Choi, C. Y. A semicontinuous prokaryotic coupled transcription/translation system using a dialysis membrane. Biotechnology Progress. 12 (5), 645-649 (1996).
- Liu, Y., Fritz, B. R., Anderson, M. J., Schoborg, J. A., Jewett, M. C. Characterizing and alleviating substrate limitations for improved in vitro ribosome construction. ACS Synthetic Biology. 4 (4), 454-462 (2015).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14, 53-56 (2017).
- Hopword, D. A., Kieser, T., Bibb, M. J., Buttner, M. J., Chater, K. Practical Streptomyces genetics. John Innes Foundation. , (2000).
- Hunter, D. J. B., Bhumkar, A., Giles, N., Sierecki, E., Gambin, Y. Unexpected instabilities explain batch-to-batch variability in cell-free protein expression systems. Biotechnology and Bioengineering. 115 (8), 1904-1914 (2018).
- Dopp, J. L., Jo, Y. R., Reuel, N. F. Methods to reduce variability in E. coli-based cell-free protein expression experiments. Synthetic and Systems Biotechnology. 4 (4), 204-211 (2019).
- Hoff, G., Bertrand, C., Piotrowski, E., Thibessard, A., Leblond, P. Genome plasticity is governed by double strand break DNA repair in Streptomyces. Scientific Reports. 8, 5272 (2018).
- Bibb, M. J. Regulation of secondary metabolism in streptomycetes. Current Opinion in Microbiology. 8 (2), 208-215 (2005).
- Weber, T., et al. antiSMASH 3.0-a comprehensive resource for the genome mining of biosynthetic gene clusters. Nucleic Acids Research. 43 (1), 237-243 (2015).
- Navarro-Muñoz, J. C., et al. A computational framework to explore large-scale biosynthetic diversity. Nature Chemical Biology. 16, 60-68 (2020).
- Alanjary, M., et al. The Antibiotic Resistant Target Seeker (ARTS), an exploration engine for antibiotic cluster prioritization and novel drug target discovery. Nucleic Acids Research. 45 (1), 42-48 (2017).
- Medema, M. H., Fischbach, M. A. Computational approaches to natural product discovery. Nature Chemical Biology. 11 (9), 639-648 (2015).
- Whitford, C. M., Cruz-Morales, P., Keasling, J. D., Weber, T. The Design-Build-Test-Learn cycle for metabolic engineering of Streptomycetes. Essays in Biochemistry. , (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten