Method Article
Mühendislik Nöral Benzeri Dokular için Murine Kortikal Astrositlerin 3D Biyobaskı
Bu Makalede
Özet
Burada, merkezi sinir sistemindeki astrositlerin işlevselliğini ve nörolojik hastalık ve tedavilerde glial hücreleri içeren mekanizmaları incelemek için nöral benzeri dokuların biyofabrik olarak tanımlanması için 3D biyobaskı murine kortikal astrositlerin bir yöntemini rapor ediyoruz.
Özet
Astrositler, nöronal destek ve işlevsellik de dahil olmak üzere merkezi sinir sisteminde (CNS) önemli bir role sahip glial hücrelerdir. Bu hücreler ayrıca sinirsel yaralanmalara yanıt verir ve dokuyu dejeneratif olaylardan korumak için hareket eder. Astrositlerin işlevselliğinin in vitro çalışmaları, bu tür olaylarda yer alan mekanizmaları aydınlatmak ve nörolojik bozuklukları tedavi etmek için tedaviler geliştirmeye katkıda bulunmak için önemlidir. Bu protokol, astrositler bakımından zengin sinir benzeri bir doku yapısını 3D biyobaskı astrosit yüklü biyoink ile biyofabrik hale getirmek için bir yöntem açıklanmaktadır. Bu çalışmada ekstrüzyon bazlı bir 3D biyobaskı kullanıldı ve C57Bl/6 fare yavrularının beyin kortikallerinden astrositler çıkarıldı. Biyoink, kortikal astrositlerin 3. 3D biyobaskı koşulları hücre stresini en aza indirerek, hücrelerin% 74.08'inin ±% 1.33'ünün biyobaskıdan hemen sonra uygulanabilir olduğu işlem sırasında astrositlerin yüksek canlılığına katkıda bulundu. 1 haftalık inkübasyondan sonra, astrositlerin canlılığı önemli ölçüde% 83.54'e ±% 3.00'e yükseldi ve bu da 3D yapının hücre büyümesi için uygun bir mikroçevrasyonu temsil ettiğini gösteriyor. Biyomalzeme bileşimi hücre bağlanmasına izin verdi ve astrositik davranışı uyardı, hücreler spesifik astrosit belirteci glial fibril asidik proteini (GFAP) ifade etti ve tipik astrositik morfolojiye sahip oldu. Bu tekrarlanabilir protokol, hücrelerin yerel mikroçevresine benzeyen astrositler bakımından zengin 3D sinir benzeri dokuyu biyofabrilleştirmek için değerli bir yöntem sağlar, astrositlerin işlevselliğini ve nörolojik hastalıklarda yer alan mekanizmalarla ilişkilerini anlamayı amaçlayan araştırmacılar için yararlıdır.
Giriş
Astrositler Merkezi Sinir Sistemi'ndeki (CNS) en bol hücre tipidir ve beyin homeostazında önemli bir rol oynar. Kalıcı nöronal desteğe ek olarak, astrositler nörotransmitter alımını modüle etmekten, kan-beyin bariyer bütünlüğünü korumaktan ve nöronal sinaptogenez1,2'yi düzenlemekten sorumludur. Astrositler ayrıca CNS iltihabında önemli bir role sahiptir, astrosit reaktivitesine veya reaktif astrogliosis3,4, dejeneratif ajanlara sağlıklı doku ekspozisyonlarını önleyen bir glial skar oluşturan bir süreçte beyindeki yaralanmalara yanıt verir5. Bu olay astrositlerin gen ekspresyonunda, morfolojisinde ve fonksiyon 6 ,7 'dedeğişikliklerlesonuçlanır. Bu nedenle, astrositlerin işlevselliğini içeren çalışmalar, nörolojik bozuklukları tedavi etmek için tedavilerin geliştirilmesine yardımcı olur.
İn vitro modeller nörolojik yaralanmalarla ilgili mekanizmaları incelemek için çok önemlidir ve başarılı izolasyon ve kortikal astrositlerin iki boyutlu (2D) kültürü oluşturulmuş olmasına rağmen8, bu model yerel hücre davranışını taklit eden gerçekçi bir ortam sağlayamaz ve beynin karmaşıklığını yeniden üretememektedir9 . 2D durumda, zayıf mekanik ve biyokimyasal destek, düşük hücre-hücre ve hücre-matris etkileşimleri ve bazal-apikal polaritenin yokluğuna yol açan hücre düzleştirme, hücre sinyal dinamiklerini ve tedavilere yanıtı tehlikeye atan değiştirilmiş hücre morfolojisi ve gen ekspresyona yol açan deneysel sonuçları etkiler10. Bu nedenle, sonuçları kliniğe çevirmeyi amaçlayan daha gerçekçi bir sinir ortamı sağlayan alternatifler geliştirmek çok önemlidir.
Üç boyutlu (3D) hücre kültürü, CNS11de dahil olmak üzere organların ve dokuların artan sadakat özellikleriyle yeniden özetleyen daha gelişmiş bir modeli temsil eder. Glial kültür ile ilgili olarak, 3D modeller astrosit morfolojisinin, hücre bazal-apikal polaritesinin ve hücre sinyalinin korunmasına katkıda bulunur12,13. 3D biyobaskı teknolojisi, yerel dokuların yapısını ve özelliklerini yeniden oluşturmak için hücreler ve biyomalzemeler kullanarak 3D canlı dokuları kontrollü bir şekilde biyofabrik hale getirmek için güçlü bir araç olarak ortaya çıkmıştır. Bu teknolojinin kullanımı sonuç tahmininin önemli ölçüde iyileşmesine yol açmış ve CNS14 , 15,16'ya uygulanan rejeneratif tıbba katkıdabulunmuştur.
Burada açıklanan protokol kortikal astrositlerin izolasyonu ve kültürünü detaylandırıyor. Protokol ayrıca, laminin ile desteklenmiş jelatin / jelatin methacryloyl (GelMA) / fibrinojene gömülü biyobaskı astrositleri için tekrarlanabilir bir yöntemi detaylandırıyor. Bu çalışmada kortikal astrositler içeren biyomalzeme bileşimi 1 x 106 hücre/mL yoğunlukta yazdırmak için ekstrüzyon bazlı bir biyobaskı kullanılmıştır. Baskı hızı kontrol altına alarak biyobaskı kesme stresi en aza indirilmiş ve astrositler işlemden sonra yüksek canlılık göstermiştir. Biyobaskılı yapılar 1 hafta boyunca kültürlendi ve astrositler hidrojel içinde yayılabildi, bağlanabildi ve hayatta kalabildi, astrositik morfolojiyi korudu ve belirli bir belirteç glial fibrili asidik proteini (GFAP)ifade etti 4.
Bu prosedür piston tahrikli ekstrüzyon bazlı biyobaskılarla uyumludur ve farklı kaynaklardan elde edilen biyobaskı astrositleri için kullanılabilir. Burada önerilen 3D biyobaskı modeli, sağlıklı dokularda astrosit işlevselliğinde yer alan mekanizmaların çalışmaları ve nörolojik patolojilerin ilerlemesini ve tedavi gelişimini anlamak gibi çok çeşitli sinir mühendisliği uygulamaları için uygundur.
Protokol
Hayvanları içeren tüm prosedürler araştırmalarda hayvan kullanımı için uluslararası yönergelere uydu (http://www.iclas.org) ve Universidade Federal de São Paulo Araştırma Etik Komitesi (CEUA 2019/ 9292090519) tarafından onaylandı.
1. Farelerin beyin diseksiyonu
- 10 mL soğuk Hanks Tamponlu Tuz Çözeltisini (HBSS) 100 mm kültür yemeğine ve 1 mL'yi 1,5 mL mikrotüpe aktarın. Hayvan başına bir mikrotüp hazırlayın.
NOT: Hem kültür yemeğinin hem de mikrotüplerin buzda tutulması gerekir. - DMEM F12 + %10 Fetal Sığır Serumu (FBS), %2 glutamin ve %1 Penisilin-Streptomisidin (P/S) kullanarak astrosit kültür ortamını hazırlayın. 0,2 μm filtre kullanarak ortamı sterilize edin.
- Keskin bir çalışma makası kullanarak kafa keserek C57Bl /6 fare yavrularını (doğum sonrası 1 gün) ötenazi edin. Yaban tokası kullanarak, deriyi çekin ve kafatasını ortaya çıkarın. Hem makas hem de asaların %70 etanol ile sterilize olduğundan emin olun.
- Keskin kavisli bir uç makası kullanarak kafatasını foramen magnum'dan sagittal düzlem boyunca başın tepesine kesin.
NOT: Ensefalik dokunun zarar görmemesine dikkat edin. - Daha önce % 70 etanol ile sterilize edilmiş bir spatula kullanarak, beyni kraniyal boşluktan kaldırın ve 10 mL soğuk HBSS içeren kültür kabına yerleştirin.
- Beyni içeren kültür çanasını stereomikroskopun altına yerleştirin ve iki künt uçlu etops kullanarak menenjitleri beyinden çıkarın (Şekil 1).
- Kortikalleri bir spatula kullanarak beynin ortanca çizgisinden yavaşça uzaklaştırarak beynin geri kalanından ayırın.
- Her iki kortiği de toplayın ve hemen 1 mL soğuk HBSS içeren aynı mikrotüpe aktarın.
2. Astrosit izolasyonu ve kültürü
- Laminer akışın altında, kavisli bir mikro makas kullanarak kortikal dokuyu küçük parçalara ayırın ve 3x yukarı ve aşağı pipetleme yaparak 1 mL HBSS ile yıkayın. Dokunun oturmasını bekle. HBSS'yi çıkarın ve işlemi iki kez daha tekrarlayarak taze HBSS ekleyin.
- HBSS'yi çıkarın ve dokuyu 5 dakika boyunca 37 °C'de% 0.05 trypsin 1 mL ile kuluçkaya yatırın.
NOT: Bu noktada sadece tripsin sindirimi yeterlidir. - 15x yukarı ve aşağı hafifçe pipetleme ile dokuyu mekanik olarak ayrıştırın.
NOT: Dokunun tamamen ayrışması, süspansiyon bulanıklığındaki artış ve süspansiyonda büyük doku parçalarının bulunmaması ile gözlenir. - Çözeltiyi 15 mL konik bir tüpe aktarın, eşit miktarda FBS ekleyerek tripsin aktivitesini nötralize edin ve ayrışmayan parçaları çıkarmak için çözeltiyi 0,4 μm hücre süzgeç filtresinde filtreleyin.
- Filtreyi 1 mL astrosit ortamıyla yıkayın, süzgeçten geçen hücre süspansiyonunu toplayın ve 200 x g ve 25 °C'de 5 dakika santrifüjleyin. Santrifüjlemeden sonra, süpernatantı atın ve peletin 1 mL astrosit kültür ortamında askıya alın.
- Hücre süspansiyonu bir T25 kültür şişesine aktarın, ortamın hacmini 3,5 mL'ye kadar yapın ve hücreleri 37 °C ve% 5 CO2'dekuluçkaya haline getirin.
- 24 saat sonra hücrelerin yapışmasını sağlayın. Ardından, ortamı değiştirin ve her 3 günde bir değiştirin.
- 7 gün sonra, hücreleri 2 mL 1x PBS ile yıkayarak mikroglia ve oligodendrositleri kültürden çıkarın.
- PBS çözümünü astrosit kültür ortamıyla değiştirin ve kültür şişesini bir gecede 180 rpm'de bir yörünge çalkalayıcıda bırakın.
NOT: Astrositler yaklaşık 10-12 günlük kültürde bir konfluent monolayer oluşturur.
3. Jelatin methacryloyl sentezi (GelMA)
- Porcine derisinden elde edilen 10 g jelatin tartın ve çözeltinin tamamen çözünene kadar 240 rpm ve 50 ° C'de bir ısıtma plakasında karıştırmasına izin vererek 100 mL PBS'de çözün.
- Bir kaputun altına, düşük bir fonksiyonelleştirme derecesi için 2 mL methakrilik anhidrit (MA) ekleyin ve jelatin emülsiyonunun 240 rpm ve 50 ° C'de 2 saat karıştırmasına izin verin.
DİkKAT: MA tehlike beyanı: H302 + H332 (yutulursa veya solunursa zararlı), H311 (ciltle temas halinde toksik), 314 (ciddi cilt yanıkları ve göz hasarına neden olur), 315 (cilt tahrişi neden olur), H317 (alerjik cilt reaksiyonuna neden olabilir), H318 (ciddi göz hasarına neden olabilir), 331 (solunursa toksik), H332 (solunursa zararlı), H335 (solunum tahrişi neden olabilir). Kullanım kuralları: P261 (toz/duman/gaz/sis/buhar/sprey solumaktan kaçının), P305 + P351 + P338 + P310 (GÖZLERDEYSE: Birkaç dakika boyunca suyla dikkatlice durulayın. Varsa ve yapılması kolaysa kontakt lensleri çıkarın. Hemen bir ZEhİr MERKEZİ / doktor arayın), P301 + P312 + P330 (YUTULURSA: Kendinizi iyi hissetmiyorsanız ZEhİr MERKEZİ / doktor çağırin. Ağzı durulayın).
NOT: MA'yı çok yavaş ekleyin, damla damla. - Jelatin-MA çözeltisini 200 mL son hacim elde etmek için önceden ısıtılmış PBS 'nin (50 °C) 100 mL'sinde seyreltin ve çözeltinin 240 rpm ve 50 °C'de 10 dakika karıştırmasını sağla.
- ~20 cm diyaliz zarını kesin (moleküler kesme 12-14 kDa) ve yumuşayana kadar deiyonize suya batırın.
NOT: Delik veya kusur olmadığından emin olmak için zarları deiyonize suyla doldurun. - Bir huni kullanarak jelatin-MA çözeltisini membranlara aktarın.
NOT: Karışıma izin vermek için içeride fazladan alan bırakarak her iki tarafı da kapatın. - Jelatin-MA çözeltisini içeren zarları diyaliz için 2 L damıtılmış su içeren bir kaba yerleştirin ve 5 gün boyunca 40 °C'de (500 rpm) karıştırmalarını sağlayın.
NOT: Suyun buharlaşmasını önlemek için kabı örtün. - Damıtılmış suyu günde iki kez değiştirin. Her seferinde, homojenizasyon için zarları ters çevirin.
- Beşinci gün, 200 mL önceden ısıtılmış ultra saf suyu (40 °C) diyalizlenmiş jelatin-MA'ya karıştırın ve 40 °C'de 15 dakika karıştırın.
- Jelatin-MA çözeltisini 25 mL'ye kadar 50 mL konik tüplere aktarın ve tüplerin 2 gün boyunca -80 ° C'de kalmasını bırakın.
NOT: Liyofilizasyonu kolaylaştırmak için tüpleri yatay olarak saklayın. - Donmuş çözeltileri 3-5 gün boyunca liyofilize edin ve nemden korunan liyofilize JelMA'yı saklayın.
4. Bioink hazırlığı
NOT: 1 mL biyoink elde etmek için filtrasyon sırasında kayıplar olabileceğinden en az 3 mL biyomalzeme çözeltisi imal edilmesi önerilir.
- Fibrinojen çözeltisinin hazırlanması
- Deiyonize suda salin çözeltisi (%0,9) hazırlayın ve 10 mg/mL konsantrasyon elde etmek için salin çözeltisinin 1 mL'sinde sığır plazmasından 10 mg fibrinojen çözün.
NOT: Fibrinojen adsorblar olarak, fibrinojen çözeltisini hazırlamak için cam şişeler kullanmayın. - Fibrinojenin tamamen çözünmesine kadar çözeltiyi 37 °C'de ajitasyon altında bırakın.
NOT: Fibrinojen çözünmesi için, 37 °C'de bir fırının içine yerleştirilmiş bir döner sistem kullanın. 37 °C'de sıcak bir plaka üzerinde manyetik ajitasyon (180 rpm) fibrinojen de uygundur. Bu durumda, 10 mg/ mL fibrinojenin çözülmesi yaklaşık 40 dakika sürer.
- Deiyonize suda salin çözeltisi (%0,9) hazırlayın ve 10 mg/mL konsantrasyon elde etmek için salin çözeltisinin 1 mL'sinde sığır plazmasından 10 mg fibrinojen çözün.
- Jelatin/GelMA çözeltisinin hazırlanması
- 0,12 g jelatin tartın ve % 4 (w/v) jelatin nihai konsantrasyon elde etmek için önceden ısıtılmış PBS (40 °C) 1,9 mL'ye ekleyin. Çözülmeyi kolaylaştırmak için girdap.
- Emülsiyonun tamamen çözünene kadar 40 °C'de tutun.
- 0.06 g lyophilized GelMA tartın ve % 2 (w/ v) JelMA son konsantrasyon elde etmek için jelatin çözeltisine aktarın. Çözülmeyi kolaylaştırmak için girdap.
- Çözeltiyi tamamen çözünene kadar 40 °C'de tutun.
- Astrosit yüklü jelatin/GelMA/fibrinojen biyoink hazırlanması
- Pipet 0.9 mL 10 mg/mL fibrinojen çözeltisi ve jelatin/ GelMA çözeltisine transfer 3 mg / mL fibrinojen nihai konsantrasyon elde etmek için.
- 0.015 g fotoinitiatör (PI) tartın ve son konsantrasyonu elde etmek için jelatin / GelMA / fibrinojen çözeltisine aktarın% 0.5 (w / v) PI. Tüpü yukarı ve aşağı çevirerek çözeltiyi karıştırın ve PI bozulmasını önlemek için ışıktan korunarak 40 °C'de tutun.
NOT: Biyoink'i maksimum 24 saat boyunca 4 °C'de stokla. - Laminar akış altında, 0,2 μm filtre kullanarak çözeltiyi steril 15 mL konik tüpe filtreleyin.
NOT: Filtrasyona izin vermek için biyomalzeme çözeltisi 37-40 °C'de olmalıdır. - Biyomalzeme çözeltisinin 980 μL'lik kısmını 15 mL konik tüpe aktarın.
- 100 μg/ mL stok çözeltisi elde etmek için laminin'i tuzlu çözeltide seyreltin.
- Pipet 20 μL laminin ve 2 μg / mL laminin nihai konsantrasyonu elde etmek için biyoink içeren tüpe aktarın.
- Kabarcıklardan kaçınarak yukarı ve aşağı pipetleyerek hafifçe karıştırın. Herhangi bir kabarcık devam ederse, konik tüpü 2 dakika boyunca 200 x g'da santrifüj edin. Biyoink'i hücrelerle karışana kadar 37 °C'de tutun.
- Trypsinize birincil astrositler ile 0.05% trypsin 5 dk.
NOT: 1 ile 3. - Trypsin aktivitesini FBS ile 1:1 oranında nötralize edin ve hücreleri 15 mL konik bir tüpe aktarın. 5 dakika boyunca 200 x g'da santrifüj edin.
- Hücreleri sayın ve 1 x 106 hücreyi farklı bir konik tüpe aktarın. 5 dakika boyunca 200 x g'da santrifüj edin.
- Konik tüpün altına hafifçe dokunarak hücre peletini askıya almak için küçük bir hacim (~200 μL) bırakarak üstnatant çıkarın.
- 1 mL jelatin/GelMA/fibrinojen çözeltisini hücreleri içeren tüpe aktarın ve homojenize etmek için hafifçe yukarı ve aşağı pipet, 1 x 106 hücre / mL'lik son bir konsantrasyon elde edin.
5. Çapraz bağlantı çözümünün hazırlanması
- Trombin rekonsesi
- Steril deiyonize suda 15 mL konik tüpte %0,1 (w/v) sığır serum albümini (BSA) ile trombin 100 U/mL stok çözeltisi hazırlayın. -20 °C'de mikrotüplerde stokla.
NOT: Trombin adsorbları cama olarak, stok çözeltisini hazırlamak veya aliquotları saklamak için cam şişeler kullanmayın.
- Steril deiyonize suda 15 mL konik tüpte %0,1 (w/v) sığır serum albümini (BSA) ile trombin 100 U/mL stok çözeltisi hazırlayın. -20 °C'de mikrotüplerde stokla.
- Trombin-CaCl2 çözeltisinin hazırlanması
- Pipet 100 μL trombin stok çözeltisi ve 1 U/mL trombin nihai konsantrasyon elde etmek için 8.9 mL steril deiyonize su içeren 50 mL konik tüpe aktarın.
- Deiyonize suda %10 (w/v) CaCl2 çözeltisi hazırlayın ve 0,2 μm filtre kullanarak sterilize edin.
- 1:9 (CaCl2 ila trombin) nihai bir oran elde etmek için% 10 CaCl2 çözeltisinin 1.1 mL'sini trombin içeren konik tüpe aktarın.
NOT: Çapraz bağlantı çözümünü denemede kullanılacak birimde hazırlayın ve depolamayı önleyin.
6. Ekstrüzyon bazlı bir biyobaskı kullanarak biyobaskı astrosit yüklü biyoink
- Sinir dokusunun tasarımı
- G kodunu kullanarak: X ve Y eksenindeki her biyobaskı çizgisi arasında 1 mm mesafe ve Z ekseninde 6 katman (her çizgi arasında 0,2 mm) 6 x 6 mm (kare şekil) ızgara oluşturun; ekstrüzyonu (E) 0,01 mm'ye ayarlayın ve Z ekseninin her yeni katmanında 0,001 mm artırın; ve yazdırma hızını (F) 400 mm/dk olarakayarlayın( Ek Bilgi ).
- Biyobaskı kurulumu
- Makineyi 15 dakika boyunca UV ışığına maruz bırak ve sonra% 70 etanol ile silin.
- Güç anahtarını kullanarak biyobaskıyı açın. Makineyi bir USB kablosuyla bilgisayara bağlayın. Biyobaskıya bağlamak ve dosya tasarımını yüklemek için kontrol yazılımını açın.
- Biyobaskı şırındının hazırlanması
- Astrosit yüklü jelatin/GelMA/fibrinojen biyoink'i 1.000 μL pipet kullanarak 5 mL plastik şırınna aktarın.
NOT: Kabarcık oluşumunu önlemek için yavaşça aktarın. - Steril 22 G künt iğneyi şırıngaya bağlayın.
NOT: Şırınnayı 4 °C'de 2 dakika bekletin. - Şırınnayı biyobaskı baskı kafasına bağlayın ve kalan kabarcıkları çıkarmak için biyoink'i manuel olarak yıkayın.
- Astrosit yüklü jelatin/GelMA/fibrinojen biyoink'i 1.000 μL pipet kullanarak 5 mL plastik şırınna aktarın.
- Biyobaskı
NOT: Biyobaskı laminar davlumbazın dışında gerçekleştirildi.- Biyobaskı masasına 35 mm'lik bir kültür çanağı yerleştirin ve iğnenin hareket etmesini sağlamak için iğneyi kültür çanağı yüzeyinden 0,1 mm uzağa yerleştirin.
NOT: Her biyobaskı için bir adet 35 mm kültür çanağı kullanın. - Yazdır düğmesine basın.
- Biyobaskı bittikten sonra şırınnanın çanaktan uzaklaştığından emin olun. Ardından, kültür yemeğini kapatın ve çapraz bağlama işlemine hazırlanın.
NOT: Bir yapının biyobaskı yaklaşık 1 dakika 10 s sürer.
- Biyobaskı masasına 35 mm'lik bir kültür çanağı yerleştirin ve iğnenin hareket etmesini sağlamak için iğneyi kültür çanağı yüzeyinden 0,1 mm uzağa yerleştirin.
- Biyobaskı yapı ve kültürün çapraz bağlantısı
- Kültür çanağı UV ışığı altında GelMA çapraz bağlama için2 x 60 s (yukarı ve aşağı) için 2 mW/cm 2'ye yerleştirin.
- Laminar akışı altında, biyobaskılı yapıyı steril bir spatula kullanarak 24 kuyulu bir tabağa aktarın.
- 500 μL trombin/CaCl2 çözeltisi ekleyin ve fibrin çapraz bağlantısına izin vermek için 30 dakika bekletin.
- Çapraz bağlama solüsyonunun çıkarın ve yapıyı 2 mL PBS 1x ile yıkayın. Ardından, PBS'yi 1 mL astrosit kültürü ortamı ile değiştirin ve 37 °C ve% 5 CO2'dekuluçkaya yatırın. Ortamı her 3 günde bir değiştirin.
7. Astrositlerin uygulanabilirliğinin değerlendirilmesi
- Biyobaskı astrositlerin uygulanabilirliği
- Biyobaskı yapıyı spatula kullanarak 35 mm'lik bir kültür çanağı içine aktarın.
- Yapıyı 1 mL 1x PBS ile yıkayın.
- Canlı/Ölü reaktifin 100 μL'lik kısmını yapının üzerine yatırın ve 37 °C'de 30 dakika boyunca tutun ve ışıktan koruyun.
- Canlı/Ölü reaktifini çıkarın ve yapıyı 1 mL 1x PBS ile yıkayın.
- Örneği bir spatula kullanarak konfokal bir çanağa aktarın ve görüntülerin elde edilmesi için 488 ve 570 nm uyarım kullanarak konfokal mikroskop altında yapı içindeki hücreleri gözlemleyin.
NOT: Yapı içindeki hücrelerin genel bir görselleştirmesi için 10x büyütme kullanın. - Numunenin düz oturduğundan emin olun. Gerekirse, düzlüğü artırmak için numunenin üzerine bir kapak yerleştirin.
NOT: Görüntüleme sırasında, numunenin kurumasını önlemek için konfokal kabın iyice kapatıldığından emin olun. - Hesaplamalı bir yazılım kullanarak uygulanabilir (yeşil) ve ölü (kırmızı) sayısını hesaplayın.
- 2D astrosit kültürünün uygulanabilirliği
- Tohum 0,5 x10 6 astrosit (geçiş 1-3) 35 mm konfokal bir tabakta, astrositler orta ekleyin ve 37 ° C ve% 5 CO2'dekuluçkaya yatır .
- Hücreler birleştiğinde, kültür ortamını çıkarın ve 1 mL 1x PBS ile yıkayın.
- Live/Dead reaktifinin 200 μL'sini biriktirin ve çanağı ışıktan korunarak 37 °C'de 30 dakika tutun.
- Canlı/Ölü reaktifini çıkarın ve hücreleri 1 mL 1x PBS ile yıkayın.
- Yemeği dijital kamerayla birleştiğinde konfokal mikroskopa alın ve görüntü elde etmek için 488 ve 570 nm heyecan verici kullanın.
- Hesaplamalı bir yazılım kullanarak uygulanabilir (yeşil) ve ölü (kırmızı) sayısını hesaplayın.
8. Astrositlerin immünositleri
- 3D biyobaskılı astrositlerin glial fibril asidik protein (GFAP) boyanma
NOT: Diğer hücre belirteçlerinin varlığını araştırmak için birincil antikoru buna göre değiştirin.- Ortamı kuyudan çıkarın ve yapıyı 1 mL 3x PBS ile yıkayın.
- Yapı tamamen kaplanana kadar kuyuya PBS'de % 4 paraformaldehit (PFA) ekleyin ve 4 °C'de 2 saat bekletin.
- PFA'yı çıkarın ve yapıyı 1 mL 3x PBS ile yıkayın.
NOT: PBS'de 4 °C'de saklanırsa bu prosedür birkaç ay duraklatılabilir. PBS buharlaşmasını önlemek için kuyu plakasının kapalı olduğundan emin olun. - Numuneyi 5 dakika boyunca glisinin 0.1 mol / L ile tedavi edin.
- 5 dakika boyunca 1 mL 1x PBS ile yıkayın.
- Orbital ajitasyon altında 25 °C'de 1 saat boyunca %0,1 Triton X-100 ve %10 FBS içeren PBS ile numuneyi permeabilize edin.
- Yapıyı bir gecede 4 °C'de tavuk anti-GFAP (birincil antikor seyreltme 1:500) ile kuluçkaya yatırın.
- Birincil antikoru epire edin ve numuneyi 1 mL PBS ile 5 dakika, 3 kez yıkayın.
NOT: Primer antikor 4 °C'de depolandığında birkaç kez tekrar kullanılabilir. - Örneği Alexa flor 488 konjuge anti-tavuk (ikincil antikor seyreltme 1:500) ve 1 μg/mL DAPI ile yörüngesel ajitasyon altında 25 °C'de 1 saat kuluçkaya yatırın.
NOT: Numuneyi ışıktan koruyun. - Numuneyi 1 mL PBS ile 5 dakika, 3 kez yıkayın.
- Yapıyı 35 mm konfokal bir tabağa aktarın.
NOT: Numunenin kurumasını önlemek için kabın iyi kapalı olduğundan emin olun.
- 2B astrosit kültürünün glial fibril asidik protein (GFAP) boyanma
- Tohum 0,5 x10 6 astrosit (geçiş 1-3) 35 mm konfokal bir tabakta, astrositler orta ekleyin ve 37 ° C ve% 5 CO2'dekuluçkaya yatır .
- Hücreler birleştiğinde, kültür ortamını çıkarın ve 1 mL 1x PBS ile yıkayın.
- 8.1.2-8.1.10 adımlarını yineleyin.
- Astrositler sitoskeleton boyama
- 8.1.1-8.1.6 adımlarını yineleyin.
- PBS'ye 200 μL 50 μg/mL floresan konjuge phalloidin çözeltisi ve yapının üzerine 1 μg/mL DAPI ekleyin.
- Yörüngesel ajitasyon altında 25 °C'de 1 saat kuluçkaya yatarak numuneyi ışıktan korur.
- Numuneyi 1 mL PBS ile 5 dakika 3 kez yıkayın ve yapıyı bir spatula kullanarak konfokal bir tabağa aktarın.
NOT: Numunenin kurumasını önlemek için kabın iyi kapalı olduğundan emin olun.
9. Konfokal görüntüleme
- Bulaşıkları görüntüleme için dijital kamera (359, 488 ve 570 nm eksilme) ile birleştirilmiş bir konfokal mikroskopa alın.
- Genel bir görselleştirme için 10x ve hücrelerin yakınlaştırılmış görüntüleri için 40 veya 63x büyütme kullanın.
NOT: Numunenin düz oturduğundan emin olun. Gerekirse, düzlüğü artırmak için numunenin üzerine bir kapak yerleştirin.
Sonuçlar
Bu çalışma, katman katman primer astrositler yüklü jelatin /GelMA/fibrinojen biyoink biriktirmek için 3D biyobaskı teknolojisini kullanarak sinir benzeri bir doku geliştirmeyi amaçlamaktadır. Astrositler, canlı bir 3D yapının biyofabrikasyonuna izin vererek biyomalzeme bileşimine eklenen fare yavrularının serebral korteksinden çıkarıldı ve izole edildi .
Bilgisayar destekli tasarım (CAD), besin maddelerinin ve oksijenin difüzyonunu kolaylaştırmayı amaçlayan, 1 mm'lik gözeneklerle kare şeklin (0,6 x 0,6 mm) birbirine bağlı bir çerçevesi olarak G kodu (Ek dosya) kullanılarak geliştirilmiştir. Çerçeve, her katmanda 90° açıyla değişen, üst üste yerleştirilmiş 6 katmandan oluşuyordu (Şekil 2A i). Tasarlanan yapı yaklaşık 5 mm yükseklik (Şekil 2A ii), doku manipülasyonu sağlar. Biyoink bileşimi ayrıca farklı şekillerdeki yapıların imalat edilmesine izin sağladı (Şekil 2B).
Jelatin, GelMA ve fibrinojenden oluşan biyoink'in hazırlanması iki çapraz bağlama adımından oluşuyordu. İlk olarak, GelMA, inter ve intramoleküler kovalans bağların oluştuğu UV ışığı altında çapraz bağlanır ve ardından fibrin çapraz bağlama yapıldı. Bu adımda, trombin enzimatik olarak fibrinojen zincirlerini ayırır, fibrin liflerinin oluşumuna neden olur17, Ca2 + iyonları18ile stabilize edilmiş bir reaksiyon . Daha sonra, GelMA ve fibrin lifleri laminin ile desteklenmiş, hücre bağlanması için uygun destek ve19,20(Şekil 2C)yayılmış kararlı bir interpenetrated polimer ağı (IPN) oluşturur.
Biyobaskıdan önce, 12 günlük izolasyondan sonra, astrositler astrosit ara filamentlerinin protein bileşeni olan GFAP varlığı ile karakterize edilmiştir4 (Şekil 3A). Daha sonra, trypsinized astrositler jelatin/ GelMA / fibrinojen çözeltisi ile 1 x 106 hücre / mL yoğunlukta karıştırılarak astrosit yüklü bir biyoink oluşturuldu. Biyoink, biyobaskı baskı kafasını oluşturan 22 G künt iğneye bağlı 5 mL şırıngaya aktarıldı (Şekil 3B i). İğne, tıkanmadan ve hücrelere yüksek kesme stresini önlemeden biyoink ekstrüzyona izin veriyordu.
Daha yüksek sıcaklıklarda bir sıvı ve daha düşük sıcaklıklarda bir jel olarak davranan jelatin viskoelastik özellikleri nedeniyle21, biyobaskı yapı şekil doğruluğunu korumuştur (Şekil 3B ii). Ardışık iki biyoink tabakasının biyobaskıdan sonra, biyomalzeme içinde kapsüllenmiş hücrelerle iyi tanımlanmış bir yapının oluşumu gözlenmiştir (Şekil 3C).
Biyobaskı ve çapraz bağlama işlemlerinden sonra, yapı astrosit ortamı ile inkübe edildi ve 1 günlük biyobaskı işleminden sonra, hücrelerin çoğu hala yuvarlak bir morfoloji sundu (Şekil 3D). Biyobaskılı iskeleler 7 günlük inkübasyondan sonra bütünlüğünü korumuştur ve bazı yuvarlak hücreler gözlenmesine rağmen, astrostik morfoloji ve ara bağlantı sunan çok sayıda astrosit yapıya yayılmıştır (Şekil 3E).
Çünkü biyobaskı parametreleri, hız gibi, hücre canlılığını doğrudan etkileyebilir, farklı biyobaskı hızları (400, 600 ve 800 mm / dk) test edildi ve astrositlerin hayatta kalması calcein-AM (canlı hücreler, yeşil floresan) ve ethidyum homodimer-III (EthD-II) (ölü hücreler, kırmızı floresan) ile Canlı / Ölü testi kullanılarak değerlendirildi. Canlı hücrelerin yüzdesi, canlı ve ölü hücrelerin sayısı hesaplanarak hesaplamalı bir yazılım kullanılarak ölçüldü. Hücre canlılığı 0 zamanında değerlendirildi (biyobaskıdan hemen sonra) ve sonuçlar daha düşük hızda, 400 mm/dk, uygulanabilir hücreler toplam hücrelerin %74,08'ini ± %1,33'ünü temsil ederek 600 ve 800 mm/dk'da biyobaskı yapılan hücrelerden önemli ölçüde daha yüksekti (%60,25 ± %1,93 ve %62,94 ± %6,18) (Şekil 4A). Bu nedenle bu çalışmada 400 mm/dk hız kullanılmıştır.
Biyobaskıdan önce, 2D kültürlü astrositler canlı hücrelerin yüzdesi olarak karakterize edildi ve biyobaskıda astrositlerin uygulanabilirliği bu duruma normalleştirildi. Sonuçlar, 2D kültürün canlı hücrelerin% 90.98±% 0.94'ünü sunduğunu göstermiştir. Biyobaskıda astrositlerin yaşayabilirliği (gün 7) %83,54 ± %3,00 dır ve 0,92 ± 0,03 değerini temsil eder ve bu değer 0'ın 0'ından (0,81 ± 0,01) önemli ölçüde yüksektir (Şekil 4B). Canlı/ ölü reaktif ile lekelenmiş astrositlerin görüntüleri Şekil 4C'desunulmuştur ve biyobaskıdan sonra hücrelerin yuvarlak bir morfolojiye sahip olduğunu göstermektedir (Şekil 4C i). 1 haftalık inkübasyondan sonra, astrositler yapıya yayıldı (Şekil 4C ii), 2B kültüründen hücrelerin farklı bir morfolojisini gösterir ( Şekil4C iii).
Biyobaskıda astrositler, yapı içindeki hücre yoğunluğunu ve hücre morfolojisini göstermek için boyandı. Şekil 5A, 7 günlük kuluçkadan sonra, F-actin sitoskeleton boyası olan phalloidin ile lekelenmiş yüksek yoğunluklu astrositlerle biyobaskılı bir yapı göstermektedir. Az sayıda yuvarlak hücre gözlenmesine rağmen, astrositler esas olarak yıldız benzeri bir morfoloji sundu. Biyobaskılı astrositler, 7 günlük biyobaskıdan sonra lekelendiğinde GFAP pozitif olduğunu göstermiş, bu da hücrelerin astrositik fenotiplerini koruduğunu gösterir (Şekil 5B i). Şekil 5B II ve 5B iii, yapı içindeki biyobaskılı GFAP+ astrositlerin Z yığılmış görüntülerini göstermektedir. Bu sonuçlar, biyoink bileşiminin astrositlerin yapışıklığını, yayılmasını ve büyümesini teşvik etmek için biyouyumlu bir mikroçevrim sağladığını göstermektedir.

Şekil 1: Primer astrosit kültürü için beyin ve korteks ayrımının çıkarılması. Primer astrositler C57Bl/6 fare yavrularının (doğum sonrası 1) beyninin korteksinden izole edildi. Beyni hayvandan çıkardıktan sonra, meneneksler mikroskop altında çıkarıldı ve korteks ayrıldı ve ardından doku sindirimi ve astrosit kültürü geldi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: 3D biyobaskı işleminin şematik illüstrasyonu. (A) 2 katman, üst görünüm ve(ii) yapının yan görünümü olmak üzere 6 katman gösteren sinir dokusunun 3D biyobaskı için tasarlanmış CAD dosyası. (B) Biyoink'in farklı şekillerdeki yapıları yazdırma kapasitesini gösteren görüntüler (i) kare, (ii) kılcal damar ve (iii) yıldız. (C) 3D biyobaskı gösterisinden sonra çapraz bağlantının şeması, GelMA'nın UV ışığı altında çapraz bağlandığı ve ardından bir trombin:Ca2+ banyosunda fibrin çapraz bağlama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Astrosit yüklü jelatin/GelMA/fibrinojen biyoink.'nin 3D boprinting. (A) 12 günlük izolasyon ve kültürden sonra astrositlerin karakterizasyonu, GFAP, yeşil ve DAPI, mavi için lekelenmiştir. (B) (i) Baskı kafası kurulumu ve (ii) biyobaskıdan hemen sonra 3D biyobaskı yapısı. (B) Biyobaskı çerçeveyi gösteren iki katmanlı yapı. 4x büyütme(C) Biyobaskıdan 1 gün sonra biyobaskıda astrositlerin görüntüsü, yuvarlak bir morfolojideki hücreleri gösterir. (D) Biyobaskı işleminden 7 gün sonra biyobaskıda astrositlerin görüntüsü, birkaç yuvarlak hücreli astrositik morfolojiye sahip hücreleri göstererek mimetik dokuya olan yakınlıklarını gösterir. 10x büyütme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
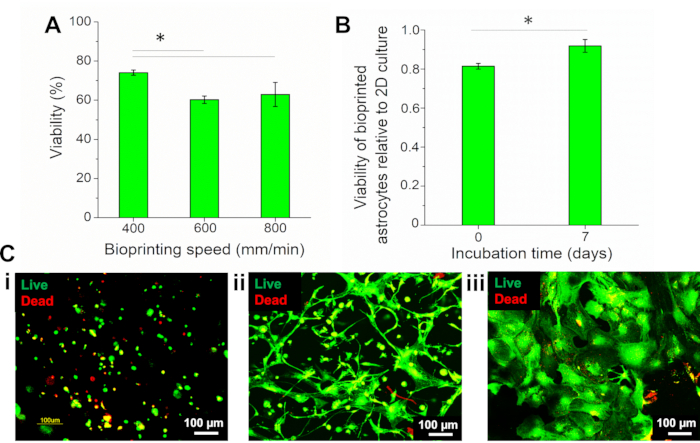
Şekil 4: Biyobaskı astrositlerin uygulanabilirliğinin değerlendirilmesi. (A) Farklı hızlarda biyobaskıda astrositlerin uygulanabilirliği. (B) Biyobaskıda astrositlerin uygulanabilirliği (i) 0. Tukey testi ile Tek Yönlü Anova ile istatistiksel analiz, n = 3, *p < 0.05. (C) Canlı / Ölü reaktif ile boyanmış astrositlerin floresan görüntüleri. Biyobaskılı astrositler (i) 0. 10x büyütme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: 3D biyobaskı astrositlerinin karakterizasyonu. 7 günlük inkübasyondan sonra 3D biyobaskılı astrositlerin immünofakoresansı(A)F-actin (phalloidin, kırmızı) ve çekirdek (DAPI, mavi) 10x ve 40x büyütmeli ve (B) GFAP için, yeşil (i) 10x büyütme ile, (ii) biyobaskı yapının X-Y-Z eksenini gösteren Z istiflenmiş ve (iii) GFAP + astrositlerin X-Z eksenini gösteren görüntü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
3D biyobaskı teknolojisi, yapısal ve fizyolojik olarak doğal dokulara benzeyen rafine yapıların mühendisliğine izin veren bir biyofabrikasyon alternatifi olarak ortaya çıkmıştır22, beyindahil 23. Nöral benzeri dokuların biyofabrikasyonu, CNS11'ietkileyen birçok hastalığın gelişimi ve tedavisi ile ilişkili hücresel ve moleküler mekanizmaları anlamak için önemli bir araç olan in vitro yerel mikroçevre modellemesine izin verir. Glial hücrelerin sinirsel işlevsellikteki önemli rolü nedeniyle, kortikal astrositler beyin gelişimi24, biyomoleküller transport25, neurite outgrowth26ve beyin benzeri doku biyofabrikasyonu14gibi birçok çalışmada kullanılmıştır.
Astrositlerin 3D kültürünün mühendisliği için yöntemler daha önce farklı biyomalzemeler ve iskele teknikleri kullanılarakbildirilmiştir 27,28,29. Benzer şekilde, insan kaynaklı pluripotent kök hücreleri (hiPSC) türetilmiş nöral agregaların 3D biyobaskı için bir yöntem de rapor edildi ve bu biyobaskı hücrelerinin in vitro30'uayırt etme ve olgunlaştırma kapasitesini gösterdi. Bununla birlikte, literatürde 3D brioprinted astrosit yapılarının biyofabrikasyonu için yöntemlere dair herhangi bir rapor bulunmamaktadır. Daha sonra, bu protokol kortikal astrositlerin 3D biyobaskı için tekrarlanabilir bir yöntemi tanımlamayı amaçladu.
Bu protokolde astrositler, araştırma31 , 32'de yaygın olarak kullanılan bir hayvan modeli olan C57Bl/6 fare yavrularının serebral kortikallerinden izole edildi ve bu modelin yerini hiPSC ve omurilik gibi diğer kaynaklardan elde edilen astrositler aldı. İzolasyon, kültür ve alt kültürden sonra, astrositler, çoğalma içsel sınırlamaları nedeniyle önerilen maksimum bölünme sayısı olan3. Astrositlerin 4.
Açıklanan yöntemde, hücrelerin biyobaskı işleminden sağ çıkma kapasitesini değerlendirmek ve hidrojel içindeki kültür sırasında canlılıklarını ve içsel özelliklerini korumak için bir kavram kanıtı olarak 1.0 x 106 hücre / mL biyomalzeme çözeltisi konsantrasyonu kullanılmıştır. Önceki çalışmada, 3D biyobaskılı nöral benzeri bir doku, astrositler ve nöronların birlikte kült haline getirilmesiyle biyofabrik hale getirilmiştir ve hücresel etkileşimi artırmak için astrosit konsantrasyonu 8.0 x 106 hücre / mL14idi. Daha sonra, hücrelerin konsantrasyonu belirli çalışmalar için optimize edilebilir.
3D biyobaskı için bir biyoink hücrelerden ve biyomalzeme veya biyomalzemelerin bir kombinasyonundan oluşur33. Bu protokolde, kültürde astrositlerin hem biyobaskı hem de sürdürülmesi için elverişli olduğunu gösteren jelatin / GelMA / fibrinojen kombinasyonu kullanılmıştır. Ekstrüzyon bazlı biyobaskı tekniği kullanılarak biyobaskı yapılabilir bir biyoink üretimi zordur. Biyomalzeme bileşimi, aynı zamanda, baskı işleminden sonra 3D şeklini korurken biyoink'in ekstrüzyonuna izin veren viskoelastik özelliklere sahip olmalıdır34. Ek olarak, biyobaskı koşullarına bağlı olarak, ölüme yol açan hücrelere kesme stresine neden olabilecek işlem sırasında hücre canlılığını koruyabilmelidir35.
Biyobaskılanabilirlik, sol-jel geçiş kapasitesi 36 nedeniyle optimum viskoelastik özelliklere sahip bir biyomalzeme olan jelatin ile güvence altınaalınmıştır. Bu, jelatin makromoleküllerinin ekstrüzyon sırasında bir sıvı olarak ve biyobaskıdan sonra 3D yapıyı koruyarak bir jel olarak yeniden düzenlenmesini ve davranmasını sağlar. Ek olarak, bir kollajen türevi olarak, jelatin hücre özgüllüğünü sağlayan glisin-amino asit peptit üçüz tekrarlarından oluşur21. Bununla birlikte, jelatin intra ve intermoleküler bağları zayıftır ve termoreversibility nedeniyle, jelatin hücre kültürü sırasında yapıdan salınan 37 ° C'de stabiliteye sahip değildir. Bu nedenle, GelMA, UV ışık fuarından sonra oluşan ve hücre özgüllüğünü koruyan19olan kursel bağlar nedeniyle istikrarlı bir hidrojel olarak bir alternatif haline geldi. GelMA'nın gözeneklilik, bozulma ve elastik modül gibi fiziksel özellikleri farklı doku mühendisliği uygulamalarına uyacak şekilde ayarlanabilir19. GelMA iskelelerinin sertliği, methacryloylikamesi 37değiştirilerek kontrol edilebilir , modellenecek dokununkine benzer bir sertlik elde edilmesine izin verir. Yani, işlevselleştirme derecesini azaltarak, daha düşük bir sertlik elde edilebilir37. Bu nedenle, fare beyninin yumuşaklığı nedeniyle38,39 ve hücre dışı matris (ECM) sertliğinin hücre davranışı üzerindeki doğrudan etkisi40, bu protokolde düşük derecede jelatin fonksiyonelleştirme önerildi. Önceki çalışmalarda, GelMA hidrojellerinin CNS fiziksel özelliklerini taklit etme yeteneği, astrositler, nöronlar ve sinir kök hücrelerinin kültleme için yüksek uygunluk gösterdiğibildirilmiştir 14,41,42.
GelMA'nın yanı sıra, enzimatik reaksiyon yoluyla fibrin lifleri oluşturan yerli bir biyopolimer olan fibrinojen, sinir benzeri dokuyu biyofabrikleştirmek, yüksek özgüllük göstermek ve nöral hücrelerin30 , 43,44'ü takması ve büyümesi için uygun bir mikroçevre sunmak için de yaygın olarak kullanılmıştır. Aljinat ve chitosan gibi diğer biyomalzemeler, 3D iskelelerin yazdırilebilirliğini ve fiziksel özelliklerini iyileştirmeyi amaçlayan jelatin, GelMA ve / veya fibrinojene karıştırılmış sinir benzeri dokuları biyobaskılamak için kullanılmıştır14,30. Mevcut yöntemde, biyoink bileşeni olarak jelatin, GelMA ve fibrinojen kullanılarak optimal bir biyobaskı, fiziksel stabilite ve hücre özgüllüğü elde edildi. Astrositlerin mikroçevriciye tanınmasını arttırmak için biyoink'i desteklemek için beyin ECM'nin laminin-a bileşeni kullanıldı.
Bu protokolde jelatin% 4 (w/ v) konsantrasyonda kullanıldı ve bu da biyoink'in yaklaşık 10 dakika içinde 25 ° C'de sol jel geçişine izin sağladı. Jelatin konsantrasyonunu artırarak daha hızlı bir jelleşme elde edilebilir. Bununla birlikte, 0,2 μm filtre kullanılarak filtrasyon ile sterilizasyon tehlikeye atılabilir. Biyoink filtrasyonu, daha yüksek jelatin konsantrasyonlarının (%>5 w/v) filtrasyonu önleyebileceğini doğrulayan kritik bir adımdır. Biyobaskı sırasında daha hızlı bir jelleşme noktası elde etmek için bir alternatif, biyoink içeren şırınnayı biyobaskı baskı kafasına bağlamadan önce 2 dakika boyunca 4 °C'de bırakmaktır. Biyobaskı işleminden sonra, 3D yapının dengesini bozmamak ve UV ekspozisyondan önce jelleştirilmiş bir durumu korumak için yapının 25 °C'de tutulması çok önemlidir. Özellikle, fibrinojen çapraz bağlantı çözeltisi plakaya eklendiğinde yapı sağlam olmalıdır. GelMA çapraz bağlama için, yapı boyunca UV fuarını sağlamak için numuneyi (her iki tarafta 2 x 60 sn) çevirmek önemlidir. Fibrinojen çapraz bağlama için, çapraz bağlantı çözeltisi yapıyı tamamen kapsamalıdır. Bu nedenle, daha büyük bir tabak veya tabak kullanıyorsanız, ses seviyesi ayarlanmalıdır. Çapraz bağlamadan sonra, hidrojel faz kontrastı mikroskopisi altında homojen görünmeli ve hücreler yuvarlak bir morfolojiye sahip olarak yapı boyunca homojen bir şekilde dağıtılmalıdır.
Bu protokol, jelatin/GelMA/fibrinojen biyoink'in farklı şekillerdeki yapıları yazdırmasına izin vererek yapıların bütünlüğünü ve 3D şeklini korumuştu. Sıcaklığın laminer akış içinde 25 °C'ye ulaşmasına yönelik sınırlamalar nedeniyle, biyobaskı laminer akışın dışındaki kültür odasında gerçekleştirildi. Biyobaskı süresi her örnek için yaklaşık 1 dakikaydı ve hücre kültürü sırasında herhangi bir kirlenme gözlenmedi.
Hücre bütünlüğü, işlemde neden olduğu kesme stresi nedeniyle biyobaskıdan etkilenebilir35. Bu, yazdırma hızı gibi yazdırma parametrelerini optimize ederek kontrol edilebilir. Bu çalışmada, 400, 600 ve 800 mm/dk olmak üzere farklı biyobaskı hızları test edilmiş ve hız 400 mm/dk'dan 600 mm/dk'ya yükseltildiğinde hücre canlılığında önemli bir azalma gözlenmiştir. 400 mm/dk'da, hücrelerin yaklaşık% 74'ü biyobaskıdan sonra canlı kaldı ve bu değer 7 günlük inkübasyondan sonra önemli ölçüde arttı (%>80). Bu nedenle, hücrelerin çevreye aşırı sergilendirilmemesi için daha düşük hızlar kullanılmamıştır. Astrositlerin 2D kültürü, biyobaskı hücrelerine kıyasla daha yüksek canlılık (~% 90) gösterdi. Bununla birlikte, floresan görüntülerde gösterildiği gibi, morfoloji kültür türünden etkilenir. 2B hücreler düzken, 3D ortamdaki astrositler, hücresel süreçlerle birbirleriyle birbirine bağlanan yıldız benzeri bir şekle sahipti.
Özellikle, mimetik mikroçevrim kortikal astrosit kültürü için elverişliydi, çünkü hücre canlılığı 1 hafta sonra önemli ölçüde arttı ve yapıdaki hücre çoğalmasını düşündürdü. Beyin ECM'sinde bulunan bir glikoprotein olan laminin, astrositlerin hidrojel14'edaha yüksek bir yapışmasını sağlamayı amaçlayan biyoink'e eklendi. Sitoskeleton F-actin lekeleme, biyobaskıda astrositlerin yapı içinde yüksek yoğunlukta olduğunu gösterdi ve bu protokolde kullanılan hücre konsantrasyonu astrositler arası bağlantıya izin verdiğini gösterdi. GFAP lokalizasyonu için immünhistokimya, astrositlerin kapsamlı arborizasyonu ve hücre hipertrofisi45ile ilişkili bir belirteç F-aktisin lekelenmesi ile doğrulanmış, hücrelerin tipik astrositik morfoloji sunduğunu göstererek, mimetik 3D sistemin hücrelerin kendi ortamlarında olduğu gibi bağlanması ve davranması için elverişli olduğunu göstermiştir.
Burada sunulan protokol, kortikal astrositlerin 3D biyobaskı için verimli ve tekrarlanabilir bir prosedürü açıklamaktadır. Nöroinflamatuvarın yaralanmaya yanıt ve nöronal işlevselliği düzenlemedeki önemi nedeniyle, bu glial hücreyi içeren çalışmalar CNS'yi etkileyen hastalıkların anlaşılmasında birçok açıdan katkıda bulunabilir. Bu nedenle, burada sunulan 3D in vitro modeli, astrosit-nöron etkileşimlerini, beyin patolojilerindeki astrositlerin işlevselliğini ve astrositlerin terapötik hedef olarak potansiyelini incelemeyi amaçlayan gelecekteki uygulamalarda yararlıdır.
Açıklamalar
Yazarların açıklayacak bir ihtilafı yoktur.
Teşekkürler
Bu çalışma São Paulo Araştırma Vakfı (FAPESP), 2018/23039-3 ve 2018/12605-8 hibe numaraları tarafından desteklendi; Ulusal Bilimsel ve Teknolojik Gelişim Konseyi (CNPq), 465656/2014-5 ve 309679/2018-4 hibe numaraları; ve Yükseköğretim Personelinin İyileştirilmesi Koordinasyonu (CAPES), mali kod 001.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3D Bioprinter | 3D Biotechnology Solutions | Extrusion-based bioprinter | |
| Blunt-tip forceps | Integra Miltex | 6--30 | Forceps for brain dissection previously sterilized |
| Bovine serum albumin | Sigma-Aldrich | 9048-46-8 | Protease free, fatty acid free, essentially globulin free |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | |
| Cell culture flask | Fisher Scientific | 156340 | Culture flask T25 |
| Cell strainer | Corning Incorporated | 352340 | Cell strainer 40 µm |
| Confocal microscope | Leica | Confocal TCS SP8 microscopy coupled with an Olympus FluoView 300 confocal system | |
| Conical tubes | Thermo Scientific | 339651, 339652 | Sterile tubes of 15 mL and 50 mL |
| DAPI | Abcam | ab224589 | DAPI staining solution |
| DMEM/F12 | Gibco; Life Technologies Corporation | 12500062 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Dyalisis tubing | Sigma-Aldrich | D9527 | Molecular weight cut-off = 14 kDa |
| Ethanol | Fisher Scientific | 64-15-5 | Reagent grade |
| Fetal Bovine Serum | Gibco; Life Technologies Corporation | 12657011 | Research Grade |
| Fibrinogen | Sigma-Aldrich | 9001-32-5 | Fibrinogen cristalline powder from bovine plasma |
| Gelatin | Sigma-Aldrich | 9000-70-8 | Gelatin powder from porcine skin |
| Glycine | Sigma-Aldrich | 56-40-6 | Glycine powder |
| Hanks Buffered Salt Solution (HBSS) | Gibco; Life Technologies Corporation | 14175095 | No calcium, no magnesium, no phenol red |
| L-Glutamine | Sigma-Aldrich | 56-85-9 | L-Glutamine crystalline powder |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin 1-2 mg/mL L in 50 mM Tris-HCl |
| Live dead kit cell imaging kit | Thermo Scientific | R37601 | Green fluorescence in live cells (ex/em 488 nm/515 nm). Red fluorescence in dead cells (ex/em 570 nm/602 nm) |
| Methacrylic anhydride | Sigma-Aldrich | 760-93-0 | For GelMA preparation |
| Microtubes | Corning Incorporated | MCT-150-C | Microtubes of 1,5 mL |
| NaCl | Sigma-Aldrich | 7647-14-5 | |
| Needle 22G | Fisher Scientific | NC1362045 | Sterile blunt needle |
| Operating scissor | Integra Miltex | 05--02 | Sharp scissor for brain dissection previously sterilized |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | Paraformaldehyde powder |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | 15070063 | Pen Strep (5,000 Units/ mL Penicillin; 5,000 ug/mL Streptomycin) |
| Petri dish | Corning Incorporated | 430591, 430588 | Sterile petri dishes of 35 and 100 mm |
| Phalloidin | Abcam | ab176753 | iFluor 488 reagent |
| Photoinitiator | Sigma-Aldrich | 106797-53-9 | 2-Hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone |
| Phosphate buffer saline (PBS) | Gibco; Life Technologies Corporation | 10010023 | PBS 1 x, culture grade, no calcium, no magnesium |
| Poly-L-lysine | Sigma-Aldrich | 25988-63-0 | Poly-L-lysine hydrobromide mol wt 30,000-70,000 |
| Primary antobody | Abcam | ab4674 | Chicken polyclonal to GFAP |
| Secondary antibody | Abcam | ab150176 | Alexa fluor 594 anti-chicken |
| Spatula | Miltex | V973-70 | Number 24 cement spatula previously sterilized |
| Stereomicroscope | Fisherbrand | 3000038 | Microscope for brain dissection |
| Syringe 5 mL | BD | 1222C84 | Sterile syringe |
| Syringe filter 2 µm | Fisher Scientific | 09-740-105 | Polypropylene filter for sterilization |
| Thrombin | Sigma-Aldrich | 9002--04-4 | Thrombin cristalline powder from bovine plasma |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Laboratory grade |
| Trypsin-EDTA | Gibco; Life Technologies Corporation | 15400054 | Trypsin no phenol red 1 x diluted in PBS |
| Versene solution | Gibco; Life Technologies Corporation | 15040066 | Versene Solution (0.48 mM) formulated as 0.2 g EDTA(Na4) per liter of PBS |
| Well plate | Thermo Scientific | 144530 | Sterile 24-well plate |
Referanslar
- Di, L., Mannelli, C., Cuzzocrea, S. Astrocytes: Role and functions in brain pathologies. Frontiers in Pharmacology. 10, 1114(2019).
- Kimelberg, H. K., Nedergaard, M. Functions of astrocytes and their potential as therapeutic targets. Neurotherapeutics. 7 (4), 338-353 (2010).
- Giovannoni, F., Quintana, F. J. The role of astrocytes in CNS inflammation. Trends in Immunology. 41 (9), 805-819 (2020).
- Escartin, C., et al. Reactive astrocyte nomenclature, definitions, and future directions. Nature Neuroscience. 24 (3), 312-325 (2021).
- Carson, M. J., Thrash, J. C., Walter, B. The cellular response in neuroinflammation: The role of leukocytes, microglia and astrocytes in neuronal death and survival. Clinical Neuroscience Research. 6 (5), 237-245 (2006).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Clarke, L. E., et al. Normal aging induces A1-like astrocyte reactivity. Proceedings of the National Academy of Sciences of the Unied States of America. 115 (8), 1896-1905 (2018).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes isolation and culture of mouse cortical astrocytes. Journal of Visualized Experiments: JoVE. (71), e50079(2013).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Knight, E., Przyborski, S. Advances in 3D cell culture technologies enabling tissue-like structures to be created in vitro. Journal of Anatomy. 227 (6), 746-756 (2015).
- Zhuang, P., Sun, A. X., An, J., Chua, C. K., Chew, S. Y. 3D neural tissue models: From spheroids to bioprinting. Biomaterials. 154, 113-133 (2018).
- Balasubramanian, S., Packard, J. A., Leach, J. B., Powell, E. M. Three-dimensional environment sustains morphological heterogeneity and promotes phenotypic progression. Tissue Engineering. Part A. 22 (11-12), 885-898 (2016).
- Watson, P. M. D., Kavanagh, E., Allenby, G., Vassey, M. Bioengineered 3D glial cell culture systems and applications for neurodegeneration and neuroinflammation. SLAS Discovery. 22 (5), 583-601 (2017).
- Li, Y. E., Jodat, Y. A., Samanipour, R., Zorzi, G., Zhu, K. Toward a neurospheroid niche model: optimizing embedded 3D bioprinting for fabrication of neurospheroid brain-like co-culture constructs. Biofabrication. , (2020).
- Zhou, X., et al. Three-dimensional-bioprinted dopamine-based matrix for promoting neural regeneration. ACS Applied Materials & Interfaces. 10 (10), 8993-9001 (2018).
- de la Vega, L., et al. 3D bioprinting human induced pluripotent stem cell-derived neural tissues using a novel lab-on-a-printer technology. Applied Sciences. 8 (12), 2414(2018).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Ariens, R. A. S., Lai, T., Weisel, J. W., Greenberg, C. S., Grant, P. J. Role of factor XIII in fibrin clot formation and effects of genetic polymorphisms. Blood. 100 (3), 743-754 (2002).
- Yue, K., et al. Synthesis, properties, and biomedical applications of Gelatin Methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- de Melo, B. A. G., et al. Strategies to use fibrinogen as bioink for 3D bioprinting fibrin-based soft and hard tissues. Acta Biomaterialia. 117, 60-76 (2020).
- Wang, X., et al. Gelatin-based hydrogels for organ 3D bioprinting. Polymers (Basel). 9 (9), 401(2017).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Naure. Biotechnology. 32 (8), 773-785 (2014).
- de la Vega, L., Lee, C., Sharma, R., Amereh, M., Willerth, S. M. 3D bioprinting models of neural tissues: The current state of the field and future directions. Brain Research Bulletin. 150, 240-249 (2019).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Hanu, R., et al. Monocarboxylic acid transporters, MCT1 and MCT2, in cortical astrocytes in vitro and in vivo. American Journal of Physiology. Cell Physiology. 278 (5), 921-930 (2000).
- Liu, R., Wang, Z. h, Gou, L., Xu, H. A cortical astrocyte subpopulation inhibits axon growth in vitro and in vivo. Molecular Medicine Reports. 12 (2), 2598-2606 (2015).
- Winter, C. C., Cullen, D. K., Donnell, J. C. O., Song, Y. J., Hernandez, N. S. Three-dimensional tissue engineered aligned astrocyte networks to recapitulate developmental mechanisms and facilitate nervous system regeneration. Journal of Visualized Experiments: JoVE. (131), e55848(2018).
- East, E., Golding, J. P., Phillips, J. B. A versatile 3D culture model facilitates monitoring of astrocytes undergoing reactive gliosis. Journal of Tissue Engineering and Regenerative Medicine. 3 (8), 634-646 (2009).
- Hawkinsn, B. T., Grego, S., Sellgren, K. L. Three-dimensional culture conditions differentially affect astrocyte modulation of brain endothelial barrier function in response to transforming growth factor B1. Brain Research. 1608, 167-176 (2015).
- Abelseth, E., et al. 3D printing of neural tissues derived from human induced pluripotent stem cells using a fibrin-based bioink. ACS Biomaterials Science and Engineering. 5 (1), 234-243 (2019).
- Filippo, T. R. M., et al. CXCL12 N-terminal end is sufficient to induce chemotaxis and proliferation of neural stem/progenitor cells. Stem Cell Research. 11 (2), 913-925 (2013).
- Galindo, L. T., et al. Chondroitin sulfate impairs neural stem cell migration through ROCK activation. Molecular Neurobiology. 55 (4), 3185-3195 (2018).
- Groll, J., et al. A definition of bioinks and their distinction from biomaterial inks. Biofabrication. 11 (1), 03001(2018).
- Kyle, S., Jessop, Z. M., Al-sabah, A., Whitaker, I. S. Printability of candidate biomaterials for extrusion-based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), (2017).
- Blaeser, A., et al. Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity. Advanced Healthcare Materials. 5 (3), 326-333 (2016).
- Miyawaki, O., Omote, C., Matsuhira, K. Thermodynamic analysis of sol-gel transition of gelatin in terms of water activity in various solutions. Biopolymers. 103 (12), 685-691 (2015).
- Shirahama, H., Lee, B. H., Tan, L. P., Cho, N. Precise tuning of facile one-pot Gelatin Methacryloyl (GelMA) synthesis. Science Reports. 6, 31036(2016).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Science Reports. 8 (1), 12517(2018).
- Iwashita, M., et al. Comparative analysis of brain stiffness among amniotes using glyoxal fixation and atomic force microscopy. Frontiers in Cell and Developmental Biology. 8, 574619(2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews. 5, 351-370 (2010).
- Ye, W., et al. 3D printing of gelatin methacrylate-based nerve guidance conduits with multiple channels. Materials and Design. 192, 108757(2020).
- Wu, Y., et al. The influence of the stiffness of GelMA substrate on the outgrowth of PC12 cells. Bioscience Reports. 39 (1), 1-9 (2019).
- Edgar, J. M., Robinson, M., Willerth, S. M. Fibrin hydrogels induce mixed dorsal/ventral spinal neuron identities during differentiation of human induced pluripotent stem cells. Acta Biomaterialia. 51, 237-245 (2017).
- Arulmoli, J., et al. Combination scaffolds of salmon fibrin, hyaluronic acid, and laminin for human neural stem cell and vascular tissue engineering. Acta Biomaterialia. 43, 122-138 (2016).
- Brenner, M. Role of GFAP in CNS Injuries. Neuroscience. Letters. 565, 7-13 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır