Method Article
3D-Bioprinting von murinen kortikalen Astrozyten für die Entwicklung von neuralähnlichem Gewebe
In diesem Artikel
Zusammenfassung
Hier berichten wir über eine Methode des 3D-Bioprintings muriner kortikaler Astrozyten zur Bioschmierung neuraler Gewebe, um die Funktionalität von Astrozyten im zentralen Nervensystem und die Mechanismen von Gliazellen bei neurologischen Erkrankungen und Behandlungen zu untersuchen.
Zusammenfassung
Astrozyten sind Gliazellen mit einer wesentlichen Rolle im zentralen Nervensystem (ZNS), einschließlich neuronaler Unterstützung und Funktionalität. Diese Zellen reagieren auch auf neuronale Verletzungen und schützen das Gewebe vor degenerativen Ereignissen. In-vitro-Studien zur Funktionalität von Astrozyten sind wichtig, um die Mechanismen solcher Ereignisse aufzuklären und zur Entwicklung von Therapien zur Behandlung neurologischer Erkrankungen beizutragen. Dieses Protokoll beschreibt eine Methode zur Biofabrikation einer neuralen Gewebestruktur, die reich an Astrozyten ist, durch 3D-Bioprinting von Astrozyten-beladener Bioink. Ein extrusionsbasierter 3D-Bioprinter wurde in dieser Arbeit verwendet, und Astrozyten wurden aus den Gehirnkortexen von C57Bl/6 Mäusenwelpen extrahiert. Die Bioink wurde hergestellt, indem kortikale Astrozyten von bis Zurgang 3 zu einer Biomateriallösung aus Gelatine, Gelatine-Methacryloyl (GelMA) und Fibrinogen gemischt wurden, ergänzt mit Laminin, das optimale Bioprinting-Bedingungen aufwies. Die 3D-Bioprinting-Bedingungen minimierten den Zellstress und trugen zur hohen Lebensfähigkeit der Astrozyten während des Prozesses bei, bei dem 74,08% ± 1,33% der Zellen direkt nach dem Bioprinting lebensfähig waren. Nach 1 Woche Inkubation stieg die Lebensfähigkeit der Astrozyten signifikant auf 83,54% ± 3,00%, was darauf hindeutet, dass das 3D-Konstrukt eine geeignete Mikroumgebung für das Zellwachstum darstellt. Die Zusammensetzung des Biomaterials ermöglichte die Zellanheftung und stimulierte das astrozytäre Verhalten, wobei zellen den spezifischen Astrozytenmarker glial fibrillary acidic protein (GFAP) exprimierten und eine typische astrozytäre Morphologie besaßen. Dieses reproduzierbare Protokoll bietet eine wertvolle Methode zur Bioschmierung von 3D-neuralem Gewebe, das reich an Astrozyten ist und der nativen Mikroumgebung der Zellen ähnelt, nützlich für Forscher, die die Funktionalität von Astrozyten und ihre Beziehung zu den Mechanismen neurologischer Erkrankungen verstehen wollen.
Einleitung
Astrozyten sind der am häufigsten vorkommende Zelltyp im Zentralnervensystem (ZNS) und spielen eine Schlüsselrolle bei der Homöostase des Gehirns. Neben der dauerhaften neuronalen Unterstützung sind Astrozyten für die Modulation der Aufnahme von Neurotransmittern, die Aufrechterhaltung der Integrität der Blut-Hirn-Schranke und die Regulierung der neuronalen Synaptogenese verantwortlich1,2. Astrozyten spielen auch eine wesentliche Rolle bei ZNS-Entzündungen und reagieren auf Verletzungen des Gehirns in einem Prozess, der zu einer Astrocitary-Reaktivität oder reaktiven Astrogliose führt3,4 und bildet eine Glianarbe, die eine gesunde Gewebeexposition gegenüber degenerativen Agenzien verhindert5. Dieses Ereignis führt zu Veränderungen in der Genexpression, Morphologie und Funktion von Astrozyten6,7. Daher sind Studien zur Funktionalität von Astrozyten hilfreich für die Entwicklung von Therapien zur Behandlung neurologischer Erkrankungen.
In-vitro-Modelle sind entscheidend für die Untersuchung von Mechanismen im Zusammenhang mit neurologischen Verletzungen, und obwohl eine erfolgreiche Isolierung und zweidimensionale (2D) Kultur von kortikalen Astrozyten etabliert wurde8, bietet dieses Modell keine realistische Umgebung, die das native Zellverhalten nachahmt und die Komplexität des Gehirns reproduziert9 . Im 2D-Zustand beeinflussen die schlechte mechanische und biochemische Unterstützung, die geringen Zell-Zell- und Zell-Matrix-Interaktionen und die Zellabflachung, die zum Fehlen einer basal-apikalen Polarität führt, die Zellsignaldynamik und die experimentellen Ergebnisse, was zu einer veränderten Zellmorphologie und Genexpression führt, was die Reaktion auf Behandlungen beeinträchtigt10. Daher ist es von entscheidender Bedeutung, Alternativen zu entwickeln, die eine realistischere neuronale Umgebung bieten, um die Ergebnisse in die Klinik zu übertragen.
Die dreidimensionale (3D) Zellkultur stellt ein fortschrittlicheres Modell dar, das mit erhöhter Genauigkeit merkmale von Organen und Geweben, einschließlich des ZNS11,rekapituliert. In Bezug auf die Gliakultur tragen 3D-Modelle zur Aufrechterhaltung der Morphologie der Astrozyten, der basal-apikalen Polarität der Zellen und der Zellsignalisierung bei12,13. Die 3D-Bioprinting-Technologie entwickelte sich zu einem leistungsstarken Werkzeug, um lebendes 3D-Gewebe kontrolliert zu biofabrizieren, indem Zellen und Biomaterialien verwendet werden, um die Struktur und Eigenschaften von nativem Gewebe nachzubilden. Der Einsatz dieser Technologie hat zu einer erheblichen Verbesserung der Ergebnisvorhersage geführt und zur regenerativen Medizin beigetragen, die auf die ZNS14,15,16angewendet wird .
Das hier beschriebene Protokoll beschreibt die Isolierung und Kultur kortikaler Astrozyten. Das Protokoll beschreibt auch eine reproduzierbare Methode zum Bioprint von Astrozyten, die in Gelatine / Gelatine Methacryloyl (GelMA) / Fibrinogen eingebettet sind, ergänzt mit Laminin. In dieser Arbeit wurde ein extrusionsbasierter Bioprinter verwendet, um die Biomaterialzusammensetzung zu drucken, die kortikale Astrozyten mit einer Dichte von 1 x 106 Zellen / ml enthält. Die Bioprinting-Scherspannung wurde durch die Kontrolle der Druckgeschwindigkeit minimiert, und Astrozyten zeigten nach dem Prozess eine hohe Lebensfähigkeit. Biogedruckte Konstrukte wurden 1 Woche lang kultiviert, und Astrozyten konnten sich innerhalb des Hydrogels ausbreiten, anheften und überleben, wobei die astrozytäre Morphologie beibehalten und ein spezifisches Marker-Glialfibrillär-saures Protein (GFAP) exprimiert wurde4.
Dieses Verfahren ist kompatibel mit kolbengetriebenen extrusionsbasierten Bioprintern und kann zum Biodrucken von Astrozyten aus verschiedenen Quellen verwendet werden. Das hier vorgeschlagene 3D-Bioprinted-Modell eignet sich für eine Vielzahl von Anwendungen im Bereich der Neurotechnik, wie z.B. Studien der Mechanismen, die an der Funktionalität von Astrozyten in gesundem Gewebe beteiligt sind, und das Verständnis des Fortschreitens neurologischer Pathologien und der Behandlungsentwicklung.
Protokoll
Alle Verfahren mit Tieren folgten den internationalen Richtlinien für die Verwendung von Tieren in der Forschung (http://www.iclas.org) und wurden vom Komitee für Ethik in der Forschung der Universidade Federal de São Paulo (CEUA 2019 / 9292090519) genehmigt.
1. Gehirndissektion von Mäusen
- 10 ml kalte Hanks Buffered Salt Solution (HBSS) in eine 100 mm Kulturschale und 1 ml in eine 1,5 ml Mikroröhre geben. Bereiten Sie eine Mikroröhrchen pro Tier vor.
HINWEIS: Sowohl die Kulturschale als auch die Mikroröhre müssen auf Eis aufbewahrt werden. - Bereiten Sie Astrozytenkulturmedium mit DMEM F12 + 10% fetalem Rinderserum (FBS), 2% Glutamin und 1% Penicillin-Streptomycin (P / S) vor. Sterilisieren Sie das Medium durch Filtern mit einem 0,2 μm-Filter.
- C57Bl/6 Mäusewelpen (postnataler Tag 1) durch Enthauptung mit einer scharfen Operationsschere einschläfern. Ziehen Sie mit einer Pinzette die Haut und legen Sie den Schädel frei. Stellen Sie sicher, dass sowohl die Schere als auch die Pinzette mit 70% Ethanol sterilisiert sind.
- Schneiden Sie den Schädel vom Foramen magnum bis zur Oberseite des Kopfes entlang der Sagittalebene mit einer scharf gekrümmten Spitzenschere ab.
HINWEIS: Stellen Sie sicher, dass das enzephale Gewebe nicht beschädigt ist. - Mit einem Spatel, der zuvor mit Ethanol 70% sterilisiert wurde, heben Sie das Gehirn aus der Schädelhöhle und legen Sie es in die Kulturschale mit 10 ml kaltem HBSS.
- Legen Sie die Kulturschale, die das Gehirn enthält, unter das Stereomikroskop und entfernen Sie mit zwei stumpfen Pinzetten die Hirnhäute aus dem Gehirn (Abbildung 1).
- Trennen Sie die Cortices vom Rest des Gehirns, indem Sie sie mit einem Spatel sanft von der Mittellinie des Gehirns wegrollen.
- Sammeln Sie beide Cortices und übertragen Sie sie sofort in dasselbe Mikroröhrchen, das 1 ml kaltes HBSS enthält.
2. Isolierung und Kultur von Astrozyten
- Schneiden Sie unter der laminaren Strömung das kortikale Gewebe mit einer gekrümmten Mikroschere in kleine Stücke und waschen Sie sie mit 1 ml HBSS, indem Sie 3x nach oben und unten pipettieren. Warten Sie, bis sich das Gewebe beruhigt hat. Entfernen Sie HBSS, fügen Sie ein neues HBSS hinzu, und wiederholen Sie den Vorgang zwei weitere Male.
- Entfernen Sie HBSS und inkubieren Sie das Gewebe mit 1 ml 0,05% Trypsin bei 37 °C für 5 min.
HINWEIS: Nur die Trypsin-Verdauung ist an dieser Stelle ausreichend. - Dissoziieren Sie das Gewebe mechanisch, indem Sie 15x vorsichtig auf und ab pipettieren.
ANMERKUNG: Die vollständige Dissoziation des Gewebes wird durch die Zunahme der Suspensionstrübung und durch das Fehlen großer Gewebefragmente in der Suspension beobachtet. - Übertragen Sie die Lösung auf ein konisches 15-ml-Röhrchen, neutralisieren Sie die Trypsinaktivität durch Zugabe eines gleichen Volumens VON FBS und filtern Sie die Lösung in einem Zellsiebfilter von 0,4 μm, um nicht dissoziierte Fragmente zu entfernen.
- Waschen Sie den Filter mit 1 ml Astrozytenmedium, sammeln Sie die Zellsuspension, die durch das Sieb gegangen ist, und zentrifugieren Sie sie für 5 min bei 200 x g und 25 ° C. Nach der Zentrifugation den Überstand verwerfen und das Pellet in 1 ml Astrozytenkulturmedium suspendieren.
- Die Zellsuspension in einen T25-Kulturkolben überführen, das Volumen des Mediums auf 3,5 ml auffüllen und die Zellen bei 37 °C und 5 %CO2inkubieren.
- Stellen Sie sicher, dass die Zellen nach 24 h adhärent sind. Ersetzen Sie dann das Medium und wechseln Sie es alle 3 Tage.
- Entfernen Sie nach 7 Tagen Mikroglia und Oligodendrozyten aus der Kultur, indem Sie die Zellen mit 2 ml 1x PBS waschen.
- Ersetzen Sie die PBS-Lösung durch das Astrozytenkulturmedium und lassen Sie den Kulturkolben über Nacht in einem Orbitalschüttler mit 180 U / min.
HINWEIS: Astrozyten bilden in etwa 10-12 Tagen Kultur eine konfluente Monoschicht.
3. Synthese von Gelatine Methacryloyl (GelMA)
- 10 g Gelatine aus Schweinehaut werden gewogen und in 100 ml PBS gelöst, indem die Lösung auf einer Heizplatte bei 240 U/min und 50 °C bis zur vollständigen Auflösung gerührt wird.
- Unter einer Haube 2 ml Methacrylsäureanhydrid (MA) für einen geringen Funktionalisierungsgrad hinzufügen und die Gelatineemulsion 2 h lang bei 240 U / min und 50 ° C rühren lassen.
VORSICHT: MA-Gefahrenhinweis: H302 + H332 (schädlich beim Verschlucken oder Einatmen), H311 (giftig bei Hautkontakt), 314 (verursacht schwere Hautverbrennungen und Augenschäden), 315 (verursacht Hautreizungen), H317 (kann eine allergische Hautreaktion verursachen), H318 (verursacht schwere Augenschäden), 331 (toxisch beim Einatmen), H332 (schädlich beim Einatmen), H335 (kann Atemwegsreizungen verursachen). Handhabungsrichtlinien: P261 (Staub/Rauch/Gas/Nebel/Dämpfe/Spray vermeiden), P305 + P351 + P338 + P310 (WENN IN AUGEN: Einige Minuten vorsichtig mit Wasser abspülen. Entfernen Sie die Kontaktlinsen, falls vorhanden und einfach. Spülen Sie weiter. Rufen Sie sofort ein GIFTZENTRUM / einen Arzt an), P301 + P312 + P330 (WENN VERSCHLUCKT: Rufen Sie ein GIFTZENTRUM / einen Arzt an, wenn Sie sich unwohl fühlen. Mund spülen).
HINWEIS: Fügen Sie MA sehr langsam hinzu, Tropfen für Tropfen. - Verdünnen Sie die Gelatine-MA-Lösung in 100 mL vorgewärmtem PBS (50 °C), um 200 mL Endvolumen zu erhalten, und lassen Sie die Lösung bei 240 U / min und 50 ° C für 10 min rühren.
- Schneiden Sie ~20 cm Dialysemembran (molekularer Cutoff 12-14 kDa) und weichen Sie sie in deionisiertem Wasser ein, bis sie weich ist.
HINWEIS: Füllen Sie die Membranen mit entionisiertem Wasser, um sicherzustellen, dass keine Löcher oder Defekte vorhanden sind. - Mit einem Trichter die Gelatine-MA-Lösung auf die Membranen übertragen.
HINWEIS: Schließen Sie beide Seiten und lassen Sie zusätzlichen Platz im Inneren, um die Mischung zu ermöglichen. - Die Membranen, die die Gelatine-MA-Lösung enthalten, zur Dialyse in einen Behälter mit 2 l destilliertem Wasser geben und bei 40 °C 5 Tage (500 U/min) rühren lassen.
HINWEIS: Decken Sie den Behälter ab, um Eine Wasserverdunstung zu vermeiden. - Wechseln Sie das destillierte Wasser zweimal am Tag. Drehen Sie die Membranen jedes Mal zur Homogenisierung auf den Kopf.
- Am fünften Tag 200 ml vorgewärmtes Reinstwasser (40 °C) mit der dialysierten Gelatine-MA vermischen und 15 min bei 40 °C rühren lassen.
- Die Gelatine-MA-Lösung auf 50 mL konische Röhrchen bis 25 mL geben und die Röhrchen 2 Tage bei -80 °C belassen.
HINWEIS: Lagern Sie die Röhrchen horizontal, um die Lyophilisation zu erleichtern. - Lyophilisieren Sie die gefrorenen Lösungen für 3-5 Tage und lagern Sie das lyophilisierte GelMA vor Feuchtigkeit geschützt.
4. Bioink-Zubereitung
HINWEIS: Um 1 ml Biotinte zu erhalten, wird empfohlen, mindestens 3 ml Biomateriallösung herzustellen, da es während der Filtration zu Verlusten kommen kann.
- Herstellung von Fibrinogenlösung
- Salzlösung (NaCl 0,9%) in entionisiertem Wasser zubereiten und 10 mg Fibrinogen aus Rinderplasma in 1 ml der Kochsalzlösung lösen, um eine Konzentration von 10 mg/ml zu erhalten.
HINWEIS: Da Fibrinogen an Glas adsorbiert, verwenden Sie keine Glaskolben, um die Fibrinogenlösung herzustellen. - Lassen Sie die Lösung unter Rühren bei 37 °C bis zur vollständigen Auflösung des Fibrinogens.
HINWEIS: Verwenden Sie für die Fibrinogenauflösung ein Rotationssystem, das bei 37 °C in einen Ofen gestellt wird. Eine magnetische Bewegung (180 U/min) von Fibrinogen auf einer Heizplatte bei 37 °C ist ebenfalls geeignet. Unter dieser Bedingung benötigt 10 mg / ml Fibrinogen ungefähr 40 Minuten, um sich aufzulösen.
- Salzlösung (NaCl 0,9%) in entionisiertem Wasser zubereiten und 10 mg Fibrinogen aus Rinderplasma in 1 ml der Kochsalzlösung lösen, um eine Konzentration von 10 mg/ml zu erhalten.
- Herstellung von Gelatine/GelMA-Lösung
- 0,12 g Gelatine werden eingewogen und zu 1,9 ml vorgewärmtem PBS (40 °C) gegeben, um eine Endkonzentration von 4 % (w/v) Gelatine zu erhalten. Wirbel, um die Auflösung zu erleichtern.
- Die Emulsion bis zur vollständigen Auflösung bei 40 °C halten.
- 0,06 g lyophilisiertes GelMA werden eingewogen und in die Gelatinelösung überführt, um eine Endkonzentration von 2% (w/v) GelMA zu erhalten. Wirbel, um die Auflösung zu erleichtern.
- Die Lösung bis zur vollständigen Auflösung bei 40 °C aufbewahren.
- Herstellung von Astrozyten-beladener Gelatine/GelMA/Fibrinogen-Biotinte
- 0,9 ml der 10 mg/ml Fibrinogenlösung pipettieren und in die Gelatine/GelMA-Lösung überführen, um eine Endkonzentration von 3 mg/ml Fibrinogen zu erhalten.
- 0,015 g Photoinitiator (PI) eingewogen und in die Gelatine/GelMA/Fibrinogen-Lösung überführt, um eine Endkonzentration von 0,5 % (w/v) PI zu erhalten. Mischen Sie die Lösung, indem Sie das Röhrchen auf und ab drehen und halten Sie es bei 40 ° C vor Licht geschützt, um pi-Degradation zu vermeiden.
HINWEIS: Lagern Sie die Biotinte bei 4 °C für maximal 24 h. - Unter der laminaren Strömung wird die Lösung mit einem 0,2 μm-Filter in ein steriles konisches 15-ml-Röhrchen filtriert.
HINWEIS: Die Biomateriallösung sollte bei 37-40 °C liegen, um eine Filtration zu ermöglichen. - 980 μL der Biomateriallösung in ein 15 mL konisches Röhrchen überführen.
- Laminin in Kochsalzlösung verdünnen, um eine Stammlösung von 100 μg/ml zu erhalten.
- 20 μL Laminin pipettieren und in das Röhrchen geben, das die Biotinte enthält, um eine Endkonzentration von 2 μg/ml Laminin zu erhalten.
- Mischen Sie vorsichtig, indem Sie auf und ab pipettieren, um Blasen zu vermeiden. Wenn Blasen bestehen bleiben, zentrifugieren Sie das konische Rohr bei 200 x g für 2 min. Halten Sie die Biotinte bei 37 °C, bis sie mit den Zellen vermischt ist.
- Trypsinisieren Sie primäre Astrozyten mit 0,05% Trypsin für 5 min.
HINWEIS: Verwenden Sie Astrozyten aus den Passagen 1 bis 3. - Neutralisieren Sie die Trypsinaktivität mit FBS im Verhältnis 1:1 und übertragen Sie die Zellen auf ein 15 ml konisches Rohr. Zentrifugieren Sie es bei 200 x g für 5 min.
- Zählen Sie die Zellen und übertragen Sie 1 x 106 Zellen in ein anderes konisches Rohr. Zentrifugieren Sie es bei 200 x g für 5 min.
- Entfernen Sie den Überstand und lassen Sie ein kleines Volumen (~ 200 μL) zurück, um das Zellpellet zu suspendieren, indem Sie vorsichtig auf den Boden des konischen Rohrs klopfen.
- 1 ml Gelatine/GelMA/Fibrinogenlösung in das Röhrchen geben, das die Zellen enthält, und vorsichtig nach oben und unten pipettieren, um zu homogenisieren, um eine Endkonzentration von 1 x 106 Zellen/ml zu erhalten.
5. Herstellung der Vernetzerlösung
- Thrombin-Rekonstitution
- Herstellen einer Stammlösung von Thrombin 100 U/ml in sterilem entionisiertem Wasser mit 0,1% (w/v) Rinderserumalbumin (BSA) in einem 15 ml konischen Röhrchen. Vorrat in Mikroröhrchen bei -20 °C.
HINWEIS: Da Thrombin an Glas adsorbiert, verwenden Sie keine Glaskolben, um die Stammlösung vorzubereiten oder die Aliquots zu lagern.
- Herstellen einer Stammlösung von Thrombin 100 U/ml in sterilem entionisiertem Wasser mit 0,1% (w/v) Rinderserumalbumin (BSA) in einem 15 ml konischen Röhrchen. Vorrat in Mikroröhrchen bei -20 °C.
- Herstellung von Thrombin-CaCl2-Lösung
- 100 μL Thrombin-Stammlösung pipettieren und in ein 50 ml konisches Röhrchen mit 8,9 ml sterilem deionisiertem Wasser überführen, um eine Endkonzentration von 1 U/ml Thrombin zu erhalten.
- Eine 10%ige (w/v) CaCl2-Lösung in entionisiertem Wasser herstellen und mit einem 0,2 μm-Filter sterilisieren.
- 1,1 mL der 10%igenCaCl2-Lösung in das thrombinhaltige konische Röhrchen überführen, um ein Endverhältnis von 1:9 (CaCl2 zu Thrombin) zu erhalten.
HINWEIS: Bereiten Sie die Vernetzerlösung in dem Volumen vor, das im Versuch verwendet werden soll, und vermeiden Sie so die Speicherung.
6. Bioprinting Astrozyten-beladene Bioink mit einem extrusionsbasierten Bioprinter
- Design des Nervengewebes
- Verwendung des G-Codes: Konstruieren Sie ein Raster von 6 x 6 mm (quadratische Form) mit 1 mm Abstand zwischen jeder biogedruckten Linie auf der X- und Y-Achse und 6 Schichten auf der Z-Achse (0,2 mm zwischen jeder Linie); Die Extrusion (E) wird auf 0,01 mm eingestellt und bei jeder neuen Schicht der Z-Achse um 0,001 mm erhöht. und stellen Sie die Druckgeschwindigkeit (F) auf 400 mm/min ein (Ergänzende Informationen).
- Bioprinter eingerichtet
- Setzen Sie die Maschine 15 Minuten lang UV-Licht aus und wischen Sie sie dann mit Ethanol 70% ab.
- Schalten Sie den Bioprinter mit dem Netzschalter ein. Verbinden Sie das Gerät über ein USB-Kabel mit dem Computer. Öffnen Sie die Steuerungssoftware, um sie mit dem Bioprinter zu verbinden und das Dateidesign zu laden.
- Vorbereitung der Bioprinting-Spritze
- Die mit Astrozyten beladene Gelatine/GelMA/Fibrinogen-Biotinte mit einer 1.000 μL Pipette in eine 5 ml Kunststoffspritze geben.
HINWEIS: Langsam übertragen, um Blasenbildung zu vermeiden. - Schließen Sie eine sterile stumpfe 22 G Nadel an die Spritze an.
HINWEIS: Lassen Sie die Spritze 2 Min. bei 4 °C stehen. - Schließen Sie die Spritze an den Bioprinter-Druckkopf an und spülen Sie die Biotinte manuell, um die verbleibenden Blasen zu entfernen.
- Die mit Astrozyten beladene Gelatine/GelMA/Fibrinogen-Biotinte mit einer 1.000 μL Pipette in eine 5 ml Kunststoffspritze geben.
- Bioprinting
HINWEIS: Das Bioprinting wurde außerhalb der laminaren Haube durchgeführt.- Legen Sie eine 35-mm-Kulturschale auf den Bioprinter-Tisch und positionieren Sie die Nadel 0,1 mm von der Oberfläche der Kulturschale entfernt, um eine Bewegung der Nadel zu ermöglichen.
HINWEIS: Verwenden Sie für jeden Bioprint eine 35-mm-Kulturschale. - Drücken Sie die Taste Drucken.
- Sobald der Bioprinting vorbei ist, stellen Sie sicher, dass sich die Spritze von der Schüssel entfernt. Schließen Sie dann das Kulturgericht und bereiten Sie sich auf den Vernetzungsprozess vor.
HINWEIS: Der Bioprinting eines Konstrukts dauert ca. 1 min und 10 s.
- Legen Sie eine 35-mm-Kulturschale auf den Bioprinter-Tisch und positionieren Sie die Nadel 0,1 mm von der Oberfläche der Kulturschale entfernt, um eine Bewegung der Nadel zu ermöglichen.
- Vernetzung des biogedruckten Konstrukts und der Kultur
- Stellen Sie die Kulturschale unter UV-Licht bei 2 mW/cm2 für 2 x 60 s (oben und unten) für die GelMA-Vernetzung.
- Übertragen Sie unter der laminaren Strömung das biogedruckte Konstrukt mit einem sterilen Spatel auf eine 24-Well-Platte.
- 500 μL Thrombin/CaCl2-Lösung zugeben und 30 min einwirken lassen, um eine Fibrinvernetzung zu ermöglichen.
- Entfernen Sie die Vernetzungslösung und waschen Sie das Konstrukt mit 2 ml PBS 1x. Ersetzen Sie dann das PBS durch 1 ml Astrozytenkulturmedium und inkubieren Sie bei 37 ° C und 5%CO2. Wechseln Sie das Medium alle 3 Tage.
7. Beurteilung der Lebensfähigkeit von Astrozyten
- Lebensfähigkeit von biogedruckten Astrozyten
- Übertragen Sie das biogedruckte Konstrukt mit einem Spatel auf eine 35-mm-Kulturschale.
- Waschen Sie das Konstrukt mit 1 ml 1x PBS.
- Geben Sie 100 μL des Live/Dead-Reagenzes über das Konstrukt und halten Sie es 30 min lang bei 37 °C, um es vor Licht zu schützen.
- Entfernen Sie das Live/Dead-Reagenz und waschen Sie das Konstrukt mit 1 ml 1x PBS.
- Übertragen Sie die Probe mit einem Spatel in eine konfokale Schale und beobachten Sie die Zellen innerhalb des Konstrukts unter einem konfokalen Mikroskop mit 488 und 570 nm Anregung für die Bildaufnahme.
HINWEIS: Verwenden Sie eine 10-fache Vergrößerung für eine Gesamtvisualisierung der Zellen innerhalb des Konstrukts. - Stellen Sie sicher, dass die Probe flach sitzt. Legen Sie bei Bedarf einen Deckglas über die Probe, um die Ebenheit zu erhöhen.
HINWEIS: Stellen Sie während der Bildgebung sicher, dass die konfokale Schale gut verschlossen ist, um ein Austrocknen der Probe zu verhindern. - Berechnen Sie die Anzahl der lebensfähigen (grün) und toten (rot) mit einer Berechnungssoftware.
- Lebensfähigkeit der 2D-Astrozytenkultur
- Säen Sie 0,5 x 106 Astrozyten (Passage 1-3) in eine 35 mm konfokale Schale, fügen Sie Astrozytenmedium hinzu und inkubieren Sie sie bei 37 ° C und 5%CO2.
- Wenn die Zellen konfluent sind, entfernen Sie das Kulturmedium und waschen Sie es mit 1 ml 1x PBS.
- Geben Sie 200 μL des Live/Dead-Reagenzes ab und bewahren Sie die Schale 30 min lang bei 37 °C auf, geschützt vor Licht.
- Entfernen Sie das Live/Dead-Reagenz und waschen Sie die Zellen mit 1 ml 1x PBS.
- Bringen Sie die Schüssel zu einem konfokalen Mikroskop in Verbindung mit einer Digitalkamera und verwenden Sie 488 und 570 nm Anregung für die Bildaufnahme.
- Berechnen Sie die Anzahl der lebensfähigen (grün) und toten (rot) mit einer Berechnungssoftware.
8. Immunfärbung von Astrozyten
- GfAP-Färbung (Glial fibrillary acidic protein) von 3D-biogedruckten Astrozyten
HINWEIS: Um das Vorhandensein anderer Zellmarker zu untersuchen, ändern Sie den primären Antikörper entsprechend.- Entfernen Sie das Medium aus dem Brunnen und waschen Sie das Konstrukt mit 1 ml 3x PBS.
- 4% Paraformaldehyd (PFA) in PBS in die Vertiefung geben, bis das Konstrukt vollständig bedeckt ist, und lassen Sie es für 2 h bei 4 °C stehen.
- Entfernen Sie die PFA und waschen Sie das Konstrukt mit 1 ml 3x PBS.
HINWEIS: Dieser Vorgang kann für mehrere Monate pausiert werden, wenn er bei 4 °C in PBS gelagert wird. Stellen Sie sicher, dass die Brunnenplatte versiegelt ist, um PBS-Verdampfung zu vermeiden. - Behandeln Sie die Probe mit Glycin 0,1 mol/L für 5 min.
- Waschen Sie mit 1 ml 1x PBS für 5 min.
- Permeabilisieren Sie die Probe mit PBS, das 0,1% Triton X-100 und 10% FBS für 1 h bei 25 °C unter Orbitalbewegung enthält.
- Inkubieren Sie das Konstrukt mit Hühner-Anti-GFAP (primäre Antikörperverdünnung 1:500) bei 4 °C über Nacht.
- Aspirieren Sie den primären Antikörper und waschen Sie die Probe mit 1 ml PBS für 5 min, 3 mal.
HINWEIS: Der primäre Antikörper kann bei Lagerung bei 4 °C mehrmals wiederverwendet werden. - Inkubieren Sie die Probe mit Alexa Fluor 488-konjugiertem Anti-Huhn (sekundäre Antikörperverdünnung 1:500) und 1 μg/ml DAPI für 1 h bei 25 °C unter orbitaler Bewegung.
HINWEIS: Bewahren Sie die Probe vor Licht geschützt auf. - Waschen Sie die Probe mit 1 ml PBS für 5 min, 3 mal.
- Übertragen Sie das Konstrukt auf eine 35 mm konfokale Schale.
HINWEIS: Stellen Sie sicher, dass die Schale gut verschlossen ist, um ein Austrocknen der Probe zu verhindern.
- GfAP-Färbung (Glialfibrillary Acidic Protein) der 2D-Astrozytenkultur
- Säen Sie 0,5 x 106 Astrozyten (Passage 1-3) in eine 35 mm konfokale Schale, fügen Sie Astrozytenmedium hinzu und inkubieren Sie sie bei 37 ° C und 5%CO2.
- Wenn die Zellen konfluent sind, entfernen Sie das Kulturmedium und waschen Sie sie mit 1 ml 1x PBS.
- Wiederholen Sie die Schritte 8.1.2-8.1.10.
- Astrozyten-Zytoskelett-Färbung
- Wiederholen Sie die Schritte 8.1.1-8.1.6.
- 200 μL 50 μg/ml fluoreszenzkonjugierte Phalloidinlösung in PBS und 1 μg/ml DAPI über das Konstrukt geben.
- 1 h bei 25 °C unter Orbitalbewegung inkubieren und die Probe vor Licht geschützt halten.
- Waschen Sie die Probe mit 1 ml PBS für 5 min 3 mal und übertragen Sie das Konstrukt mit einem Spatel in eine konfokale Schale.
HINWEIS: Stellen Sie sicher, dass die Schale gut verschlossen ist, um ein Austrocknen der Probe zu verhindern.
9. Konfokale Bildgebung
- Bringen Sie das Geschirr zu einem konfokalen Mikroskop in Verbindung mit einer Digitalkamera zur Bildgebung (359, 488 und 570 nm Anregung).
- Verwenden Sie eine Vergrößerung von 10x für eine Gesamtvisualisierung und 40 oder 63x für gezoomte Bilder von Zellen.
HINWEIS: Stellen Sie sicher, dass die Probe flach sitzt. Legen Sie bei Bedarf einen Deckglas über die Probe, um die Ebenheit zu erhöhen.
Ergebnisse
Diese Arbeit zielte darauf ab, ein neuralähnliches Gewebe zu entwickeln, das die 3D-Bioprinting-Technologie nutzt, um Schicht für Schicht primäre Astrozyten-beladene Gelatine / GelMA / Fibrinogen-Biotinte abzuscheiden. Astrozyten wurden extrahiert und aus der Großhirnrinde von Mäusewelpen isoliert (Abbildung 1), zu einer Biomaterialzusammensetzung hinzugefügt, die die Biofabrikation eines lebenden 3D-Konstrukts ermöglicht.
Das Computer-Aided-Design (CAD) wurde unter Verwendung des G-Codes (Supplemental file) als miteinander verbundener Rahmen von quadratischer Form (0,6 x 0,6 mm) mit Poren von 1 mm entwickelt, um die Diffusion von Nährstoffen und Sauerstoff zu erleichtern. Der Rahmen bestand aus 6 übereinander angeordneten Schichten, die sich in jeder Schicht in einem Winkel von 90° änderten (Abbildung 2A i). Die entworfene Struktur besaß eine Höhe von etwa 5 mm(Abbildung 2A ii),was eine Gewebemanipulation ermöglichte. Die Zusammensetzung der Biotinte ermöglichte auch die Herstellung von Konstrukten unterschiedlicher Form (Abbildung 2B).
Die Herstellung der Biotinte aus Gelatine, GelMA und Fibrinogen umfasste zwei Vernetzungsschritte. Zunächst wurde GelMA unter UV-Licht vernetzt, bei dem inter- und intramolekulare kovalente Bindungen gebildet werden, gefolgt von einer Fibrinvernetzung. In diesem Schritt spaltet Thrombin enzymatisch Fibrinogenketten, was zur Bildung von Fibrinfasernführt 17, einer Reaktion, die durchCa2+ Ionen stabilisiert wird18. Dann bilden GelMA- und Fibrinfasern ein stabiles interpenetriertes Polymernetzwerk (IPN), ergänzt mit Laminin, geeignete Unterstützung für Zellansatz und Verbreitung19,20 (Abbildung 2C).
Vor dem Bioprinting waren Astrozyten nach 12 Tagen Der Isolierung durch das Vorhandensein von GFAP gekennzeichnet, einem Proteinbestandteil von Astrozyten-Zwischenfilamenten4 (Abbildung 3A). Dann wurden trypsinisierte Astrozyten mit der Gelatine / GelMA / Fibrinogen-Lösung in einer Dichte von 1 x 106 Zellen / ml gemischt, wodurch eine mit Astrozyten beladene Bioink erzeugt wurde. Die Biotinte wurde in eine 5-ml-Spritze überführt, die mit einer stumpfen 22-G-Nadel verbunden war und den Bioprinter-Druckkopf bildete (Abbildung 3B i). Die Nadel ermöglichte die Biotintenextrusion ohne Verstopfung und verhinderte eine hohe Scherbelastung der Zellen.
Aufgrund der viskoelastischen Eigenschaften von Gelatine, die sich bei höheren Temperaturen als Flüssigkeit und bei niedrigeren Temperaturen21als Gel verhält, behielt das biogedruckte Konstrukt die Formtreue bei (Abbildung 3B ii). Nach dem Bioprinting von zwei aufeinanderfolgenden Schichten der Bioink wurde die Bildung einer wohldefinierten Struktur beobachtet (Abbildung 3C), wobei Zellen im Biomaterial eingeschlossen waren.
Nach Bioprinting- und Vernetzungsprozessen wurde das Konstrukt mit Astrozytenmedium inkubiert, und nach 1 Tag Bioprinting wiesen die meisten Zellen noch eine runde Morphologie auf (Abbildung 3D). Biogedruckte Gerüste behielten nach 7 Tagen Inkubation ihre Integrität bei, und obwohl einige runde Zellen beobachtet wurden, breitete sich eine große Anzahl von Astrozyten im gesamten Konstrukt aus und präsentierte astrozytäre Morphologie und Verbindung (Abbildung 3E).
Da die Parameter des Bioprintings, wie die Geschwindigkeit, die Zelllebensfähigkeit direkt beeinflussen konnten, wurden unterschiedliche Bioprinting-Geschwindigkeiten (400, 600 und 800 mm/min) getestet und das Überleben von Astrozyten mit dem Live/Dead-Assay mit Calcein-AM (lebende Zellen, grüne Fluoreszenz) und Ethidium-Homodimer-III (EthD-II) (tote Zellen, rote Fluoreszenz) bewertet. Der Prozentsatz der lebensfähigen Zellen wurde mit einer Computersoftware quantifiziert, indem die Anzahl der lebenden und toten Zellen berechnet wurde. Die Zelllebensfähigkeit wurde zum Zeitpunkt 0 (direkt nach dem Bioprinting) bewertet, und die Ergebnisse zeigten, dass bei der niedrigeren Geschwindigkeit, 400 mm/min, lebensfähige Zellen 74,08% ± 1,33% der Gesamtzellen ausmachten, was signifikant höher ist als Zellen, die bei 600 und 800 mm/min biogedruckt wurden (60,25% ± 1,93% bzw. 62,94 ± 6,18%)(Abbildung 4A). Daher wurde bei dieser Arbeit die Geschwindigkeit von 400 mm/min verwendet.
Vor dem Bioprinting wurden 2D-kultivierte Astrozyten als Prozentsatz lebensfähiger Zellen charakterisiert, und die Lebensfähigkeit von biogedruckten Astrozyten wurde auf diesen Zustand normalisiert. Die Ergebnisse zeigten, dass die 2D-Kultur 90,98% ± 0,94% lebensfähige Zellen präsentierte. Die Lebensfähigkeit von biogedruckten Astrozyten (Tag 7) betrug 83,54% ± 3,00%, was 0,92 ± 0,03 des 2D-Wertes entspricht, was signifikant höher war als der von Tag 0 (0,81 ± 0,01) (Abbildung 4B). Bilder von Astrozyten, die mit dem lebenden/toten Reagenz gefärbt wurden, sind in Abbildung 4Cdargestellt und zeigen, dass Zellen nach dem Bioprinting eine runde Morphologie besaßen (Abbildung 4C i). Nach 1 Woche Inkubation breiteten sich Astrozyten im gesamten Konstrukt aus (Abbildung 4C ii), was eine ausgeprägte Morphologie von Zellen aus der 2D-Kultur zeigt ( Abbildung4C iii).
Biogedruckte Astrozyten wurden gefärbt, um die Zelldichte und Zellmorphologie innerhalb des Konstrukts zu zeigen. Abbildung 5A zeigt ein biogedrucktes Konstrukt nach 7 Tagen Inkubation mit hoher Dichte an Astrozyten, die mit Phalloidin, einem F-Aktin-Zytoskelettfarbstoff, gefärbt sind. Obwohl nur wenige runde Zellen beobachtet wurden, wiesen Astrozyten hauptsächlich eine sternähnliche Morphologie auf. Biogedruckte Astrozyten zeigten sich GFAP-positiv, wenn sie nach 7 Tagen Bioprinting gefärbt wurden, was darauf hindeutet, dass die Zellen ihren astrozytären Phänotyp beibehielten (Abbildung 5B i). Abbildung 5B ii und 5B iii zeigen die Z-gestapelten Bilder der biogedruckten GFAP+-Astrozyten innerhalb des Konstrukts. Diese Ergebnisse deuten darauf hin, dass die Biotintenzusammensetzung eine biokompatible Mikroumgebung bot, um die Adhäsion, Ausbreitung und das Wachstum von Astrozyten zu fördern.

Abbildung 1:Extraktion der Trennung von Gehirn und Kortex für die primäre Astrozytenkultur. Primäre Astrozyten wurden aus dem Kortex des Gehirns von C57Bl/6 Mäusenwelpen (postnataler Tag 1) isoliert. Nach der Extraktion des Gehirns aus dem Tier wurden die Hirnhäute unter einem Mikroskop entfernt und der Kortex getrennt, gefolgt von Gewebeverdauung und Astrozytenkultur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schematische Darstellung des 3D-Bioprinting-Prozesses. (A) CAD-Datei für den 3D-Biodruck von neuronalem Gewebe mit (i) 2 Schichten, Draufsicht, und (ii) 6 Schichten, Seitenansicht, des Konstrukts. (B) Bilder, die die Fähigkeit der Bioink zeigen, Strukturen unterschiedlicher Formen(i)quadratisch,(ii)Kapillar und(iii)Stern zu drucken. (C) Schema der Vernetzung von Biomaterialien nach 3D-Bioprinting zeigt, wo GelMA unter UV-Licht vernetzt wird, gefolgt von Fibrinvernetzung in einem Thrombin:Ca2+ Bad. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: 3D-Boprinting von mit Astrozyten beladener Gelatine/GelMA/Fibrinogen-Biotinte. (A) Charakterisierung von Astrozyten nach 12 Tagen Isolation und Kultur, gefärbt für GFAP, grün und DAPI, blau. (B) (i) Druckkopfaufbau und (ii) 3D-Bioprint-Konstrukt direkt nach dem Bioprinting. (B) Zweischichtiges Konstrukt, das den biogedruckten Rahmen zeigt. Vergrößerung von 4x. (C) Bild von biogedruckten Astrozyten 1 Tag nach dem Bioprinting, das Zellen in einer runden Morphologie zeigt. (D) Bild von biogedruckten Astrozyten 7 Tage nach dem Bioprinting-Prozess, das Zellen mit astrozytischer Morphologie mit wenigen runden Zellen zeigt, was auf ihre Affinität zum mimetischen Gewebe hinweist. 10-fache Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
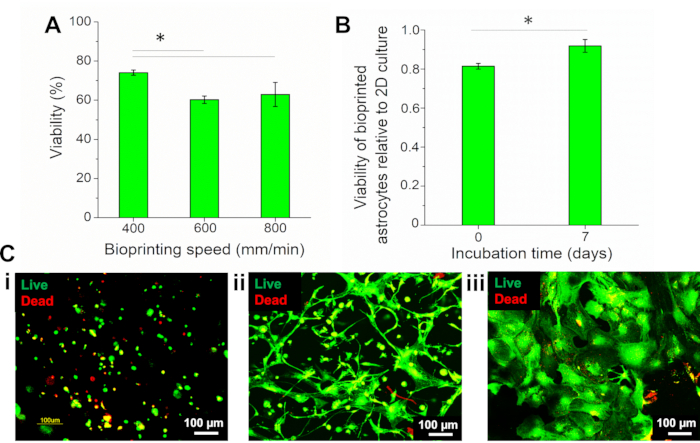
Abbildung 4: Beurteilung der Lebensfähigkeit von biogedruckten Astrozyten. (A) Lebensfähigkeit von Astrozyten, die mit unterschiedlichen Geschwindigkeiten biogedruckt wurden. (B) Lebensfähigkeit von biogedruckten Astrozyten am(i)Tag 0 (direkt nach dem Bioprinting) und (ii) nach 7 Tagen Bioprinting, normalisiert auf die Lebensfähigkeit von Astrozyten in 2D-Kultur. Statistische Analyse mittels One-Way Anova mit Tukey-Test, n = 3, *p < 0,05. (C) Fluoreszierende Bilder von Astrozyten, die mit lebendem/totem Reagenz gefärbt sind. Biogedruckte Astrozyten am(i)Tag 0 (direkt nach dem Bioprinting),(ii)Tag 7 und(iii)2D-Kultur von Astrozyten. 10-fache Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Charakterisierung von 3D-biogedruckten Astrozyten. Immunfluoreszenz von 3D-biogedruckten Astrozyten nach 7 Tagen Inkubation, gefärbt für (A) F-Aktin (Phalloidin, rot) und Kerne (DAPI, blau) mit einer Vergrößerung von 10x und 40x und für (B) GFAP, grün (i) mit einer Vergrößerung von 10x, (ii) Z-gestapelt, die die X-Y-Z-Achse des biogedruckten Konstrukts zeigt, und (iii) Bild, das die X-Z-Achse von GFAP + -Astrozyten zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die 3D-Bioprinting-Technologie hat sich als Biofabrikationsalternative herausgestellt, die die Entwicklung verfeinerter Konstrukte ermöglicht, die strukturell und physiologisch nativen Geweben ähneln22, einschließlich des Gehirns23. Die Biofabrikation von neuralähnlichen Geweben ermöglicht eine in vitro native Mikroumgebungsmodellierung und ist ein wichtiges Werkzeug zum Verständnis der zellulären und molekularen Mechanismen, die mit der Entwicklung und Behandlung vieler Krankheiten verbunden sind, die das ZNS betreffen11. Aufgrund der wichtigen Rolle von Gliazellen in der neuronalen Funktionalität wurden kortikale Astrozyten in vielen Studien verwendet, wie z.B. Gehirnentwicklung24, Biomolekültransport25, Neuritenauswuchs26und in der hirnähnlichen Gewebebiofabrikation14.
Methoden zur Entwicklung der 3D-Kultur von Astrozyten wurden zuvor unter Verwendung verschiedener Biomaterialien und Gerüsttechniken berichtet27,28,29. In ähnlicher Weise wurde auch eine Methode für den 3D-Bioprinting von humanen induzierten pluripotenten Stammzellen (hiPS-Zellen) aus neuronalen Aggregaten berichtet, die die Fähigkeit dieser biogedruckten Zellen zur Differenzierung und Reifung in vitrozeigten 30. Es gibt jedoch keine Berichte über Methoden zur Biofabrikation von 3D-Brioprint-Astrozytenkonstrukten in der Literatur. Dann zielte dieses Protokoll darauf ab, eine reproduzierbare Methode für den 3D-Biodruck kortikaler Astrozyten zu beschreiben.
In diesem Protokoll wurden Astrozyten aus den zerebralen Kortexen von C57Bl/6 Mäusewelpen isoliert, einem Tiermodell, das in der Forschung31,32weit verbreitet ist und durch Astrozyten aus anderen Quellen wie HiPS-Zellen und Rückenmark ersetzt werden kann. Nach Isolation, Kultur und Subkultur bleiben Astrozyten bis zu Passage 3 in einem proliferativen Zustand, was die maximale Anzahl von Spaltungen ist, die aufgrund ihrer intrinsischen Begrenzung der Proliferation empfohlen werden8. Es wurde nachgewiesen, dass die Proliferation von Astrozyten ab Passage 4 begrenzt war, da es schwierig war, die gewünschte Menge an Zellen für den 3D-Biodruck zu erreichen.
In der beschriebenen Methode wurde eine Konzentration von 1,0 x 106 Zellen/ml Biomateriallösung verwendet, um die Fähigkeit der Zellen zu bewerten, den Bioprinting-Prozess zu überleben und ihre Lebensfähigkeit und intrinsischen Eigenschaften während der Kultur innerhalb des Hydrogels aufrechtzuerhalten. In der vorherigen Arbeit wurde ein 3D-biogedrucktes neuralähnliches Gewebe durch co-kultivierende Astrozyten und Neuronen biogeflochten, und um die zelluläre Interaktion zu erhöhen, betrug die Astrozytenkonzentration 8,0 x 106 Zellen / ml14. Dann kann die Konzentration der Zellen für spezifische Studien optimiert werden.
Eine Biotinte für den 3D-Bioprinting besteht aus Zellen und einem Biomaterial oder einer Kombination von Biomaterialien33. In diesem Protokoll wurde eine Kombination aus Gelatine / GelMA / Fibrinogen verwendet, die sich sowohl für das Bioprinting als auch für die Aufrechterhaltung von Astrozyten in Kultur als günstig erwies. Die Herstellung einer biodruckbaren Biotinte ist eine Herausforderung, wenn extrusionsbasierte Bioprinting-Technik verwendet wird. Die Biomaterialzusammensetzung muss viskoelastische Eigenschaften besitzen, die gleichzeitig die Extrusion der Biotinte ermöglichen, während die 3D-Form nach dem Druckprozess erhalten bleibt34. Darüber hinaus sollte es in der Lage sein, die Lebensfähigkeit der Zellen während des Prozesses aufrechtzuerhalten, was je nach den Bioprinting-Bedingungen zu Scherstress für die Zellen führen kann, was zum Tod führt35.
Die Biodruckbarkeit wurde durch Gelatine sichergestellt, ein Biomaterial, das aufgrund seiner Sol-Gel-Übergangskapazität optimale viskoelastische Eigenschaften besitzt36. Dies ermöglicht es Gelatine-Makromolekülen, sich während der Extrusion neu anzuordnen und sich als Flüssigkeit und nach dem Bioprinting als Gel zu verhalten, wobei die 3D-Struktur erhalten bleibt. Darüber hinaus setzt sich Gelatine als Kollagenderivat aus Glycin-Aminosäure-Peptid-Triplett-Wiederholungen zusammen, die die Zellspezifitätgewährleisten 21. Intra- und intermolekulare Bindungen von Gelatine sind jedoch schwach, und aufgrund ihrer Thermoreversibilität hat Gelatine keine Stabilität bei 37 ° C und wird während der Zellkultur aus dem Konstrukt freigesetzt. Daher wurde GelMA aufgrund der kovalenten Bindungen, die nach der UV-Lichtexposition gebildet wurden, zu einer Alternative als stabiles Hydrogel und behielt die Zellspezifitätseigenschaftenbei 19. Die physikalischen Eigenschaften von GelMA, wie Porosität, Abbau und Elastizitätsmodul, können auf verschiedene Tissue-Engineering-Anwendungen abgestimmt werden19. Die Steifigkeit von GelMA-Gerüsten kann durch Variation der Methacryloylsubstitution37gesteuert werden, wodurch eine Steifigkeit erreicht werden kann, die der des zu modellierenden Gewebes ähnelt. Das heißt, durch Verringerung des Funktionalisierungsgrades kann eine geringere Steifigkeit erreicht werden37. Daher wurde aufgrund der Weichheit des Mausgehirns38,39 und der direkten Wirkung der Steifigkeit der extrazellulären Matrix (ECM) auf das Zellverhalten40in diesem Protokoll ein geringer Grad an Gelatinefunktionalisierung vorgeschlagen. In den vorherigen Arbeiten wurde über die Fähigkeit von GelMA-Hydrogelen berichtet, ZNS-physikalische Merkmale nachzuahmen, was eine hohe Eignung für die Kultivierung von Astrozyten, Neuronen und neuralen Stammzellen zeigt14,41,42.
Neben GelMA wurde fibrinogen, ein natives Biopolymer, das fibrinfasern durch enzymatische Reaktion bildet, auch weit verbreitet verwendet, um neuralähnliches Gewebe zu biofabrizieren, eine hohe Spezifität zu zeigen und eine geeignete Mikroumgebung für neuronale Zellen zubieten,um sich anzuheften und zu wachsen30,43,44. Andere Biomaterialien wie Alginat und Chitosan wurden verwendet, um neuralähnliche Gewebe zu biodrucken, die zu Gelatine, GelMA und / oder Fibrinogen gemischt wurden, um die Druckbarkeit und die physikalischen Eigenschaften der 3D-Gerüste14,30zu verbessern. Bei der vorliegenden Methode wurde eine optimale Bioprintierbarkeit, physikalische Stabilität und Zellspezifität unter Verwendung von Gelatine, GelMA und Fibrinogen als Bestandteile der Biotinte erreicht. Um die Erkennung der Mikroumgebung durch Astrozyten zu erhöhen, wurde Laminin - eine Komponente des Gehirn-ECM - zur Ergänzung der Biotinte verwendet.
In diesem Protokoll wurde Gelatine in einer Konzentration von 4% (w/v) verwendet, die den Sol-Gel-Übergang der Biotinte bei 25 °C innerhalb von etwa 10 min ermöglichte. Eine schnellere Gelierung kann durch Erhöhung der Gelatinekonzentration erreicht werden. Die Sterilisation durch Filtration mit einem 0,2-μm-Filter kann jedoch beeinträchtigt werden. Die Biotintenfiltration ist ein kritischer Schritt, der überprüft, ob höhere Konzentrationen von Gelatine (>5% w/v) die Filtration verhindern können. Eine Alternative, um einen schnelleren Gelierungspunkt während des Bioprintings zu erreichen, besteht darin, die Spritze, die die Biotinte enthält, 2 minuten lang bei 4 °C zu belassen, bevor sie am Bioprinter-Druckkopf angeschlossen wird. Nach dem Bioprinting ist es wichtig, das Konstrukt bei 25 ° C zu halten, um eine Destabilisierung der 3D-Struktur zu vermeiden und einen gelierten Zustand vor der UV-Exposition aufrechtzuerhalten. Insbesondere sollte das Konstrukt fest sein, wenn die Fibrinogenvernetzerlösung zur Platte gegeben wird. Für die GelMA-Vernetzung ist es wichtig, die Probe (2 x 60 s pro Seite) umzudrehen, um die UV-Exposition während des gesamten Konstrukts sicherzustellen. Für die Fibrinogenvernetzung sollte die Vernetzerlösung das Konstrukt vollständig abdecken. Wenn Sie also ein größeres Gericht oder einen größeren Teller verwenden, sollte das Volumen eingestellt werden. Nach der Vernetzung sollte das Hydrogel unter Phasenkontrastmikroskopie homogen aussehen und die Zellen sollten homogen im gesamten Konstrukt verteilt sein und eine runde Morphologie besitzen.
Dieses Protokoll ermöglichte es der Gelatine/ GelMA/Fibrinogen-Biotinte, Strukturen verschiedener Formen zu drucken, wobei die Integrität und die 3D-Form der Konstrukte erhalten blieben. Aufgrund der Einschränkungen der Temperatur auf 25 °C innerhalb der laminaren Strömung wurde das Bioprinting im Kulturraum außerhalb der laminaren Strömung durchgeführt. Die Bioprinting-Zeit betrug ungefähr 1 min für jede Probe, und während der Zellkultur wurde keine Kontamination beobachtet.
Die Zellintegrität kann durch Bioprinting aufgrund der bei diesem Prozess verursachten Scherspannung beeinflusst werden35. Dies kann durch die Optimierung von Druckparametern wie der Druckgeschwindigkeit gesteuert werden. In dieser Arbeit wurden verschiedene Bioprinting-Geschwindigkeiten getestet, 400, 600 und 800 mm / min, wobei eine signifikante Abnahme der Zelllebensfähigkeit beobachtet wurde, wenn die Geschwindigkeit von 400 auf 600 mm / min erhöht wurde. Bei 400 mm/min blieben etwa 74% der Zellen nach dem Bioprinting lebensfähig, und dieser Wert stieg nach 7 Tagen Inkubation signifikant an (>80%). Daher wurden keine niedrigeren Geschwindigkeiten verwendet, um die übermäßige Exposition der Zellen gegenüber der Umgebung zu vermeiden. Die 2D-Kultur von Astrozyten zeigte eine höhere Lebensfähigkeit (~ 90%) im Vergleich zu den biogedruckten Zellen. Wie fluoreszierende Bilder zeigen, wird die Morphologie jedoch durch die Art der Kultur beeinflusst. Während 2D-Zellen flach waren, besaßen Astrozyten in 3D-Umgebung eine sternähnliche Form, die sich durch zelluläre Prozesse miteinander verband.
Bemerkenswerterweise war die mimetische Mikroumgebung günstig für die kortikale Astrozytenkultur, da die Zelllebensfähigkeit nach 1 Woche signifikant zunahm, was auf eine Zellproliferation innerhalb des Konstrukts hindeutet. Laminin, ein im Gehirn-ECM vorhandenes Glykoprotein, wurde der Biotinte zugesetzt, um eine höhere Haftung der Astrozyten an das Hydrogel14zu erreichen. Die F-Aktin-Färbung des Zytoskeletts zeigte, dass biogedruckte Astrozyten in hoher Dichte innerhalb des Konstrukts waren, was darauf hindeutet, dass die in diesem Protokoll verwendete Zellkonzentration die Verbindung von Astrozyten ermöglichte. Die Immunhistochemie für die GFAP-Lokalisation, ein Marker, der mit der ausgedehnten Arborisierung und Zellhypertrophie von Astrozyten korreliert45,bestätigt durch F-Aktin-Färbung, zeigte, dass Zellen eine typische astrozytäre Morphologie aufwiesen, was darauf hindeutet, dass das mimetische 3D-System für Zellen günstig war, um sich anzuheften und sich wie in ihrer natürlichen Umgebung zu verhalten.
Das hier vorgestellte Protokoll beschreibt ein effizientes und reproduzierbares Verfahren zur 3D-Bioprinting kortikaler Astrozyten. Aufgrund der Bedeutung von Astrozyten bei der Reaktion der Neuroinflammation auf Verletzungen sowie bei der Regulierung der neuronalen Funktionalität könnten Studien mit dieser Gliazelle zu vielen Aspekten beim Verständnis von Krankheiten beitragen, die das ZNS betreffen. Daher ist das hier vorgestellte 3D-In-vitro-Modell nützlich für zukünftige Anwendungen, die darauf abzielen, Astrozyten-Neuronen-Interaktionen, die Funktionalität von Astrozyten in Hirnpathologien und das Potenzial von Astrozyten als therapeutische Ziele zu untersuchen.
Offenlegungen
Die Autoren haben keine Konflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von der São Paulo Research Foundation (FAPESP), Fördernummern 2018/23039-3 und 2018/12605-8, unterstützt; Nationaler Rat für wissenschaftliche und technologische Entwicklung (CNPq), Fördernummern 465656/2014-5 und 309679/2018-4; und Koordinierung zur Verbesserung des Hochschulpersonals (CAPES), Finanzcode 001.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D Bioprinter | 3D Biotechnology Solutions | Extrusion-based bioprinter | |
| Blunt-tip forceps | Integra Miltex | 6--30 | Forceps for brain dissection previously sterilized |
| Bovine serum albumin | Sigma-Aldrich | 9048-46-8 | Protease free, fatty acid free, essentially globulin free |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | |
| Cell culture flask | Fisher Scientific | 156340 | Culture flask T25 |
| Cell strainer | Corning Incorporated | 352340 | Cell strainer 40 µm |
| Confocal microscope | Leica | Confocal TCS SP8 microscopy coupled with an Olympus FluoView 300 confocal system | |
| Conical tubes | Thermo Scientific | 339651, 339652 | Sterile tubes of 15 mL and 50 mL |
| DAPI | Abcam | ab224589 | DAPI staining solution |
| DMEM/F12 | Gibco; Life Technologies Corporation | 12500062 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Dyalisis tubing | Sigma-Aldrich | D9527 | Molecular weight cut-off = 14 kDa |
| Ethanol | Fisher Scientific | 64-15-5 | Reagent grade |
| Fetal Bovine Serum | Gibco; Life Technologies Corporation | 12657011 | Research Grade |
| Fibrinogen | Sigma-Aldrich | 9001-32-5 | Fibrinogen cristalline powder from bovine plasma |
| Gelatin | Sigma-Aldrich | 9000-70-8 | Gelatin powder from porcine skin |
| Glycine | Sigma-Aldrich | 56-40-6 | Glycine powder |
| Hanks Buffered Salt Solution (HBSS) | Gibco; Life Technologies Corporation | 14175095 | No calcium, no magnesium, no phenol red |
| L-Glutamine | Sigma-Aldrich | 56-85-9 | L-Glutamine crystalline powder |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin 1-2 mg/mL L in 50 mM Tris-HCl |
| Live dead kit cell imaging kit | Thermo Scientific | R37601 | Green fluorescence in live cells (ex/em 488 nm/515 nm). Red fluorescence in dead cells (ex/em 570 nm/602 nm) |
| Methacrylic anhydride | Sigma-Aldrich | 760-93-0 | For GelMA preparation |
| Microtubes | Corning Incorporated | MCT-150-C | Microtubes of 1,5 mL |
| NaCl | Sigma-Aldrich | 7647-14-5 | |
| Needle 22G | Fisher Scientific | NC1362045 | Sterile blunt needle |
| Operating scissor | Integra Miltex | 05--02 | Sharp scissor for brain dissection previously sterilized |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | Paraformaldehyde powder |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | 15070063 | Pen Strep (5,000 Units/ mL Penicillin; 5,000 ug/mL Streptomycin) |
| Petri dish | Corning Incorporated | 430591, 430588 | Sterile petri dishes of 35 and 100 mm |
| Phalloidin | Abcam | ab176753 | iFluor 488 reagent |
| Photoinitiator | Sigma-Aldrich | 106797-53-9 | 2-Hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone |
| Phosphate buffer saline (PBS) | Gibco; Life Technologies Corporation | 10010023 | PBS 1 x, culture grade, no calcium, no magnesium |
| Poly-L-lysine | Sigma-Aldrich | 25988-63-0 | Poly-L-lysine hydrobromide mol wt 30,000-70,000 |
| Primary antobody | Abcam | ab4674 | Chicken polyclonal to GFAP |
| Secondary antibody | Abcam | ab150176 | Alexa fluor 594 anti-chicken |
| Spatula | Miltex | V973-70 | Number 24 cement spatula previously sterilized |
| Stereomicroscope | Fisherbrand | 3000038 | Microscope for brain dissection |
| Syringe 5 mL | BD | 1222C84 | Sterile syringe |
| Syringe filter 2 µm | Fisher Scientific | 09-740-105 | Polypropylene filter for sterilization |
| Thrombin | Sigma-Aldrich | 9002--04-4 | Thrombin cristalline powder from bovine plasma |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Laboratory grade |
| Trypsin-EDTA | Gibco; Life Technologies Corporation | 15400054 | Trypsin no phenol red 1 x diluted in PBS |
| Versene solution | Gibco; Life Technologies Corporation | 15040066 | Versene Solution (0.48 mM) formulated as 0.2 g EDTA(Na4) per liter of PBS |
| Well plate | Thermo Scientific | 144530 | Sterile 24-well plate |
Referenzen
- Di, L., Mannelli, C., Cuzzocrea, S. Astrocytes: Role and functions in brain pathologies. Frontiers in Pharmacology. 10, 1114(2019).
- Kimelberg, H. K., Nedergaard, M. Functions of astrocytes and their potential as therapeutic targets. Neurotherapeutics. 7 (4), 338-353 (2010).
- Giovannoni, F., Quintana, F. J. The role of astrocytes in CNS inflammation. Trends in Immunology. 41 (9), 805-819 (2020).
- Escartin, C., et al. Reactive astrocyte nomenclature, definitions, and future directions. Nature Neuroscience. 24 (3), 312-325 (2021).
- Carson, M. J., Thrash, J. C., Walter, B. The cellular response in neuroinflammation: The role of leukocytes, microglia and astrocytes in neuronal death and survival. Clinical Neuroscience Research. 6 (5), 237-245 (2006).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Clarke, L. E., et al. Normal aging induces A1-like astrocyte reactivity. Proceedings of the National Academy of Sciences of the Unied States of America. 115 (8), 1896-1905 (2018).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes isolation and culture of mouse cortical astrocytes. Journal of Visualized Experiments: JoVE. (71), e50079(2013).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Knight, E., Przyborski, S. Advances in 3D cell culture technologies enabling tissue-like structures to be created in vitro. Journal of Anatomy. 227 (6), 746-756 (2015).
- Zhuang, P., Sun, A. X., An, J., Chua, C. K., Chew, S. Y. 3D neural tissue models: From spheroids to bioprinting. Biomaterials. 154, 113-133 (2018).
- Balasubramanian, S., Packard, J. A., Leach, J. B., Powell, E. M. Three-dimensional environment sustains morphological heterogeneity and promotes phenotypic progression. Tissue Engineering. Part A. 22 (11-12), 885-898 (2016).
- Watson, P. M. D., Kavanagh, E., Allenby, G., Vassey, M. Bioengineered 3D glial cell culture systems and applications for neurodegeneration and neuroinflammation. SLAS Discovery. 22 (5), 583-601 (2017).
- Li, Y. E., Jodat, Y. A., Samanipour, R., Zorzi, G., Zhu, K. Toward a neurospheroid niche model: optimizing embedded 3D bioprinting for fabrication of neurospheroid brain-like co-culture constructs. Biofabrication. , (2020).
- Zhou, X., et al. Three-dimensional-bioprinted dopamine-based matrix for promoting neural regeneration. ACS Applied Materials & Interfaces. 10 (10), 8993-9001 (2018).
- de la Vega, L., et al. 3D bioprinting human induced pluripotent stem cell-derived neural tissues using a novel lab-on-a-printer technology. Applied Sciences. 8 (12), 2414(2018).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Ariens, R. A. S., Lai, T., Weisel, J. W., Greenberg, C. S., Grant, P. J. Role of factor XIII in fibrin clot formation and effects of genetic polymorphisms. Blood. 100 (3), 743-754 (2002).
- Yue, K., et al. Synthesis, properties, and biomedical applications of Gelatin Methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- de Melo, B. A. G., et al. Strategies to use fibrinogen as bioink for 3D bioprinting fibrin-based soft and hard tissues. Acta Biomaterialia. 117, 60-76 (2020).
- Wang, X., et al. Gelatin-based hydrogels for organ 3D bioprinting. Polymers (Basel). 9 (9), 401(2017).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Naure. Biotechnology. 32 (8), 773-785 (2014).
- de la Vega, L., Lee, C., Sharma, R., Amereh, M., Willerth, S. M. 3D bioprinting models of neural tissues: The current state of the field and future directions. Brain Research Bulletin. 150, 240-249 (2019).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Hanu, R., et al. Monocarboxylic acid transporters, MCT1 and MCT2, in cortical astrocytes in vitro and in vivo. American Journal of Physiology. Cell Physiology. 278 (5), 921-930 (2000).
- Liu, R., Wang, Z. h, Gou, L., Xu, H. A cortical astrocyte subpopulation inhibits axon growth in vitro and in vivo. Molecular Medicine Reports. 12 (2), 2598-2606 (2015).
- Winter, C. C., Cullen, D. K., Donnell, J. C. O., Song, Y. J., Hernandez, N. S. Three-dimensional tissue engineered aligned astrocyte networks to recapitulate developmental mechanisms and facilitate nervous system regeneration. Journal of Visualized Experiments: JoVE. (131), e55848(2018).
- East, E., Golding, J. P., Phillips, J. B. A versatile 3D culture model facilitates monitoring of astrocytes undergoing reactive gliosis. Journal of Tissue Engineering and Regenerative Medicine. 3 (8), 634-646 (2009).
- Hawkinsn, B. T., Grego, S., Sellgren, K. L. Three-dimensional culture conditions differentially affect astrocyte modulation of brain endothelial barrier function in response to transforming growth factor B1. Brain Research. 1608, 167-176 (2015).
- Abelseth, E., et al. 3D printing of neural tissues derived from human induced pluripotent stem cells using a fibrin-based bioink. ACS Biomaterials Science and Engineering. 5 (1), 234-243 (2019).
- Filippo, T. R. M., et al. CXCL12 N-terminal end is sufficient to induce chemotaxis and proliferation of neural stem/progenitor cells. Stem Cell Research. 11 (2), 913-925 (2013).
- Galindo, L. T., et al. Chondroitin sulfate impairs neural stem cell migration through ROCK activation. Molecular Neurobiology. 55 (4), 3185-3195 (2018).
- Groll, J., et al. A definition of bioinks and their distinction from biomaterial inks. Biofabrication. 11 (1), 03001(2018).
- Kyle, S., Jessop, Z. M., Al-sabah, A., Whitaker, I. S. Printability of candidate biomaterials for extrusion-based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), (2017).
- Blaeser, A., et al. Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity. Advanced Healthcare Materials. 5 (3), 326-333 (2016).
- Miyawaki, O., Omote, C., Matsuhira, K. Thermodynamic analysis of sol-gel transition of gelatin in terms of water activity in various solutions. Biopolymers. 103 (12), 685-691 (2015).
- Shirahama, H., Lee, B. H., Tan, L. P., Cho, N. Precise tuning of facile one-pot Gelatin Methacryloyl (GelMA) synthesis. Science Reports. 6, 31036(2016).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Science Reports. 8 (1), 12517(2018).
- Iwashita, M., et al. Comparative analysis of brain stiffness among amniotes using glyoxal fixation and atomic force microscopy. Frontiers in Cell and Developmental Biology. 8, 574619(2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews. 5, 351-370 (2010).
- Ye, W., et al. 3D printing of gelatin methacrylate-based nerve guidance conduits with multiple channels. Materials and Design. 192, 108757(2020).
- Wu, Y., et al. The influence of the stiffness of GelMA substrate on the outgrowth of PC12 cells. Bioscience Reports. 39 (1), 1-9 (2019).
- Edgar, J. M., Robinson, M., Willerth, S. M. Fibrin hydrogels induce mixed dorsal/ventral spinal neuron identities during differentiation of human induced pluripotent stem cells. Acta Biomaterialia. 51, 237-245 (2017).
- Arulmoli, J., et al. Combination scaffolds of salmon fibrin, hyaluronic acid, and laminin for human neural stem cell and vascular tissue engineering. Acta Biomaterialia. 43, 122-138 (2016).
- Brenner, M. Role of GFAP in CNS Injuries. Neuroscience. Letters. 565, 7-13 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.