Method Article
3D-биопечать мышиных кортикальные астроциты для инженерии невроходобной ткани
В этой статье
Резюме
Здесь мы сообщаем о методе 3D-биопечати мышиных кортикальных астроцитов для биофабрикации нервно-подобных тканей для изучения функциональности астроцитов в центральной нервной системе и механизмов с участием глиальных клеток при неврологических заболеваниях и методах лечения.
Аннотация
Астроциты представляют собой глиальные клетки с существенной ролью в центральной нервной системе (ЦНС), включая поддержку и функциональность нейронов. Эти клетки также реагируют на нервные травмы и защищают ткани от дегенеративных событий. Исследования функциональности астроцитов in vitro важны для выяснения механизмов, участвующих в таких событиях, и способствуют разработке методов лечения неврологических расстройств. Этот протокол описывает метод биофабрикатного моделирования невроходной структуры ткани, богатой астроцитами, с помощью 3D-биопечати биоинков, нагруженных астроцитами. В этой работе был использован 3D-биопринтер на основе экструзии, а астроциты были извлечены из коры головного мозга детенышей мышей C57Bl/6. Биомочинку готовили путем смешивания кортикальных астроцитов от пассажа до пассажа 3 с раствором биоматериала, состоящим из желатина, желатино-метанрилоила (GelMA) и фибриногена, дополненного ламинином, который представлял оптимальные условия биопечати. Условия 3D-биопечати минимизировали клеточный стресс, способствуя высокой жизнеспособности астроцитов во время процесса, в котором 74,08% ± 1,33% клеток были жизнеспособными сразу после биопечати. После 1 недели инкубации жизнеспособность астроцитов значительно возросла до 83,54% ± 3,00%, что указывает на то, что 3D-конструкция представляет собой подходящую микросреду для роста клеток. Состав биоматериала позволял прикреплять клетки и стимулировал астроцитарное поведение, при этом клетки экспрессировали специфический маркер астроцитов глиального фибриллярного кислого белка (GFAP) и обладали типичной астроцитарной морфологией. Этот воспроизводимый протокол обеспечивает ценный метод биофабрикатного 3D-невроходобной ткани, богатой астроцитами, которая напоминает нативную микросреду клеток, полезный для исследователей, которые стремятся понять функциональность астроцитов и их связь с механизмами, участвующими в неврологических заболеваниях.
Введение
Астроциты являются наиболее распространенным типом клеток в центральной нервной системе (ЦНС) и играют ключевую роль в гомеостазе мозга. В дополнение к устойчивой поддержке нейронов, астроциты отвечают за модуляцию поглощения нейротрансмиттеров, поддержание целостности гематоэнцефалического барьера и регулирование нейронального синаптогенеза1,2. Астроциты также играют существенную роль в воспалении ЦНС, реагируя на травмы головного мозга в процессе, который приводит к астрограционной реактивности или реактивному астроглиозу3,4,образуя глиальный рубец, который препятствует поражению здоровой ткани дегенеративными агентами5. Это событие приводит к изменениям в экспрессии генов астроцитов, морфологии и функции6,7. Поэтому исследования, связанные с функциональностью астроцитов, полезны для разработки методов лечения неврологических расстройств.
Модели in vitro имеют решающее значение для изучения механизмов, связанных с неврологическими травмами, и хотя была установлена успешная изоляция и двумерная (2D) культура корковых астроцитов8,эта модель не может обеспечить реалистичную среду, которая имитирует поведение нативных клеток и воспроизводит сложность мозга9 . В 2D-состоянии плохая механическая и биохимическая поддержка, низкоклеточные и клеточно-матричные взаимодействия и сплющивание клеток, приводящее к отсутствию базально-апикальной полярности, влияют на динамику клеточной сигнализации и экспериментальные результаты, приводящие к изменению морфологии клеток и экспрессии генов, которые ставят под угрозу реакцию на лечение10. Поэтому крайне важно разработать альтернативы, которые обеспечивают более реалистичную нейронную среду, направленную на перевод результатов в клинику.
Трехмерная (3D) клеточная культура представляет собой более продвинутую модель, которая рекапитулирует с повышенной точностью особенности органов и тканей, включая ЦНС11. Что касается глиальной культуры, 3D-модели способствуют поддержанию морфологии астроцитов, базально-апикальной полярности клеток и клеточной сигнализации12,13. Технология 3D-биопечати стала мощным инструментом для контролируемого биофабрикатирования живых тканей 3D с использованием клеток и биоматериалов для воссоздания структуры и свойств нативных тканей. Использование этой технологии привело к существенному улучшению прогнозирования результатов и способствовало регенеративной медицине, применяемой в ЦНС14,15,16.
Протокол, описанный здесь, детализирует выделение и культуру корковых астроцитов. В протоколе также подробно описывается воспроизводимый метод биопечати астроцитов, встроенных в желатин / желатин метанрилоил (GelMA) / фибриноген, дополненный ламинином. В этой работе биопринтер на основе экструзии использовался для печати композиции биоматериала, содержащей корковые астроциты при плотности 1 х 106 клеток/мл. Напряжение сдвига биопечати было сведено к минимуму за счет контроля скорости печати, а астроциты показали высокую жизнеспособность после процесса. Биопечатные конструкции культивировали в течение 1 недели, и астроциты смогли распространяться, прикрепляться и выживать в гидрогеле, сохраняя астроцитарную морфологию и экспрессируя специфический маркер глиального фибриллярного кислого белка (GFAP)4.
Эта процедура совместима с биопринтерами на основе экструзии с поршневым приводом и может быть использована для биопечати астроцитов, полученных из разных источников. Предложенная здесь 3D-биопечатная модель подходит для широкого спектра применений нейронной инженерии, таких как исследования механизмов, участвующих в функциональности астроцитов в здоровых тканях и понимание прогрессирования неврологических патологий и развития лечения.
протокол
Все процедуры с участием животных соответствовали международным руководящим принципам использования животных в исследованиях (http://www.iclas.org) и были одобрены Комитетом по этике в исследованиях Федерального университета Сан-Паулу (CEUA 2019 / 9292090519).
1. Рассечение мозга мышей
- Переложите 10 мл холодного буферного солевого раствора Хэнкса (HBSS) в 100 мм культурную чашку и 1 мл в микротрубку 1,5 мл. Подготовьте по одной микротрубки на каждое животное.
ПРИМЕЧАНИЕ: И культуральное блюдо, и микропробирку нужно держать на льду. - Готовят культуральную среду астроцитов с использованием DMEM F12 + 10% фетальной бычий сыворотки (FBS), 2% глутамина и 1% пенициллина-стрептомицина (P/S). Стерилизуйте среду путем фильтрации с помощью фильтра 0,2 мкм.
- Усыпление детенышей мышей C57Bl/6 (послеродовой день 1) путем обезглавливания с помощью острых операционных ножниц. Используя щипцы, потяните кожу и обнажите череп. Убедитесь, что ножницы и щипцы стерилизованы 70% этанолом.
- Вырежьте череп от большого ямона до макушки головы вдоль сагиттальной плоскости с помощью острых изогнутых наконечников ножниц.
ПРИМЕЧАНИЕ: Убедитесь, что энцефальная ткань не повреждена. - С помощью шпателя, предварительно стерилизованного этанолом 70%, поднимают мозг из полости черепа и помещают его в культуральную посуду, содержащую 10 мл холодного HBSS.
- Поместите культурную чашку, содержащую мозг, под стереомикроскоп и, используя два щипца с тупыми кончиками, удалите мозговые огня из мозга(рисунок 1).
- Отделите кору от остальной части мозга, осторожно откатывая ее от срединной линии мозга с помощью шпателя.
- Соберите обе коры и немедленно перенесите их в одну и ту же микропробирку, содержащую 1 мл холодного HBSS.
2. Выделение и культивировка астроцитов
- Под ламинарным потоком разрежьте кортикальные ткани на мелкие кусочки с помощью изогнутых микронарезами и промыте их 1 мл HBSS путем пипетки вверх и вниз 3x. Подождите, пока ткань осядет. Удалите HBSS и добавьте свежий HBSS, повторив процесс еще два раза.
- Удалить HBSS и инкубировать ткань с 1 мл 0,05% трипсина при 37 °C в течение 5 мин.
ПРИМЕЧАНИЕ: На данный момент достаточно только переваривания трипсина. - Механически диссоциировать ткань, осторожно пипетируя вверх и вниз 15x.
ПРИМЕЧАНИЕ: Полная диссоциация ткани наблюдается за счет увеличения мутности суспензии и отсутствия крупных фрагментов ткани в суспензии. - Переложите раствор в коническую трубку объемом 15 мл, нейтрализуйте активность трипсина, добавив равный объем FBS, и отфильтруйте раствор в фильтре клеточного сетчатого фильтра 0,4 мкм для удаления недиссоциированных фрагментов.
- Промыть фильтр 1 мл астроцитарной среды, собрать клеточную суспензию, прошедшую через ситечко, и центрифугировать ее в течение 5 мин при 200 х г и 25 °С. После центрифугирования отбросьте супернатант и суспендируют гранулу в 1 мл культурального среды астроцитов.
- Переложите клеточную суспензию в колбу для культуры T25, дополним объем среды до 3,5 мл и инкубируют клетки при 37 °C и 5% CO2.
- Убедитесь, что через 24 ч клетки прилипают. Затем замените среду и меняйте ее каждые 3 дня.
- Через 7 дней удаляют микроглию и олигодендроциты из культуры, промыв клетки 2 мл 1x PBS.
- Замените раствор PBS питательной средой астроцитов и оставьте колбу для культивовки в орбитальном шейкере при 180 об/мин на ночь.
ПРИМЕЧАНИЕ: Астроциты образуют слежущего монослоя примерно через 10-12 дней культивации.
3. Синтез желатина метакрилоила (GelMA)
- Взвесьте 10 г желатина, полученного из свиной кожицы, и растворите в 100 мл PBS, давая раствору перемешиваться на нагревательной пластине при 240 об/мин и 50 °C до полного растворения.
- Под капотом добавьте 2 мл метанакрилового ангидрида (МА) для низкой степени функционализации и дайте желатиновой эмульсии перемешаться при 240 об/мин и 50 °C в течение 2 ч.
ВНИМАНИЕ: Заявление об опасности МА: H302 + H332 (вредно при проглатывании или вдыхании), H311 (токсично при контакте с кожей), 314 (вызывает серьезные ожоги кожи и повреждение глаз), 315 (вызывает раздражение кожи), H317 (может вызвать аллергическую кожную реакцию), H318 (вызывает серьезное повреждение глаз), 331 (токсично при вдыхании), H332 (вредно при вдыхании), H335 (может вызвать раздражение дыхательных путей). Рекомендации по обращению: P261 (избегайте вдыхать пыль / дым / газ / туман / пары / распыление), P305 + P351 + P338 + P310 (ЕСЛИ В ГЛАЗАХ: Осторожно смойте водой в течение нескольких минут. Снимите контактные линзы, если они есть и легко сделать. Продолжайте полоскание. Немедленно позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР / врача), P301 + P312 + P330 (ЕСЛИ ПРОГЛОТИЛИ: Позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР / врача, если вы чувствуете недомогание. Прополоскивайте рот).
ПРИМЕЧАНИЕ: Добавляйте MA очень медленно, капля за каплей. - Разбавляют раствор желатина-МА в 100 мл предварительно нагретого PBS (50 °C) до получения 200 мл конечного объема и дают раствору перемешиваться при 240 об/мин и 50 °C в течение 10 мин.
- Отрежьте ~20 см мембраны диализа (молекулярная отсечку 12-14 кДа) и замочите ее в деионизированной воде до мягкости.
ПРИМЕЧАНИЕ: Заполните мембраны деионизированной водой, чтобы убедиться в отсутствии отверстий или дефектов. - С помощью воронки перенесите раствор желатина-МА на мембраны.
ПРИМЕЧАНИЕ: Закройте обе стороны, оставив дополнительное пространство внутри, чтобы можно было смешивать. - Поместите мембраны, содержащие раствор желатина-МА, в емкость с 2 л дистиллированной воды для диализа, давая им перемешиваться при 40 °C в течение 5 дней (500 об/мин).
ПРИМЕЧАНИЕ: Накройте контейнер, чтобы избежать испарения воды. - Меняйте дистиллированную воду два раза в день. Каждый раз переворачивайте мембраны вверх дном для гомогенизации.
- На пятый день смешайте 200 мл предварительно нагретой сверхчистой воды (40 °C) с диализированным желатином-МА и дайте ему перемешаться в течение 15 минут при 40 °C.
- Переложите раствор желатина-МА на конические пробирки по 50 мл до 25 мл и оставить пробирки при -80 °C в течение 2 дней.
ПРИМЕЧАНИЕ: Храните пробирки горизонтально для облегчения лиофилизации. - Лиофилизируйте замороженные растворы в течение 3-5 дней и храните лиофилизированный GelMA, защищенный от влаги.
4. Подготовка биомохнил
ПРИМЕЧАНИЕ: Для получения 1 мл биомотка рекомендуется изготовить не менее 3 мл раствора биоматериала, так как при фильтрации могут возникнуть потери.
- Приготовление раствора фибриногена
- Готовят физиологический раствор (NaCl 0,9%) в деионизированной воде, а 10 мг фибриногена из бычьей плазмы раствора раствора в 1 мл физиологического раствора получают концентрацию 10 мг/мл.
ПРИМЕЧАНИЕ: Поскольку фибриноген адсорбирует стекло, не используйте стеклянные колбы для приготовления раствора фибриногена. - Оставить раствор под перемешиванием при 37 °С до полного растворения фибриногена.
ПРИМЕЧАНИЕ: Для растворения фибриногена используйте ротационную систему, размещенную внутри печи при 37 °C. Также подходит магнитное перемешивание (180 об/мин) фибриногена на конфорочной плите при 37 °C. При этом условии 10 мг/мл фибриногена растворяется примерно 40 мин.
- Готовят физиологический раствор (NaCl 0,9%) в деионизированной воде, а 10 мг фибриногена из бычьей плазмы раствора раствора в 1 мл физиологического раствора получают концентрацию 10 мг/мл.
- Приготовление раствора желатина/гелма
- Взвесьте 0,12 г желатина и добавьте его к 1,9 мл предварительно нагретого PBS (40 °C) для получения конечной концентрации 4% (мас./об.) желатина. Вихрь для облегчения растворения.
- Держите эмульсию при 40 °C до полного растворения.
- Взвесили 0,06 г лиофилизированного GelMA и переложили в желатиновый раствор для получения конечной концентрации 2% (мас./об.) GelMA. Вихрь для облегчения растворения.
- Держите раствор при 40 °C до полного растворения.
- Получение астроцитарных желатиновых/гелма/фибриногенных биоинков
- Пипетку 0,9 мл раствора фибриногена 10 мг/мл и перенос в раствор желатина/гелма с получением конечной концентрации 3 мг/мл фибриногена.
- Взвесьте 0,015 г фотоинициатора (PI) и переложите в раствор желатина/гелма/фибриногена для получения конечной концентрации 0,5% (мас./об.) PI. Перемешайте раствор, перевернув трубку вверх и вниз, и держите ее при 40 °C защищенной от света, чтобы избежать деградации PI.
ПРИМЕЧАНИЕ: Запасивать биомосин при 4 °C в течение максимум 24 ч. - Под ламинарной струей фильтруют раствор с помощью фильтра 0,2 мкм в стерильную коническую трубку 15 мл.
ПРИМЕЧАНИЕ: Раствор биоматериала должен находиться при 37-40 °C для обеспечения фильтрации. - Перенесите 980 мкл раствора биоматериала в коническую трубку 15 мл.
- Развести ламинин в физиологическом растворе для получения запасного раствора 100 мкг/мл.
- Пипетку 20 мкл ламинина и переложить в пробирку, содержащую биочернило, получить конечную концентрацию 2 мкг/мл ламинина.
- Осторожно перемешайте, пипетируя вверх и вниз, избегая пузырьков. Если пузырьки сохраняются, центрифугируют коническую трубку при 200 х г в течение 2 мин. Держите биотрин при 37 °C до тех пор, пока он не смешается с клетками.
- Трипсинизируют первичные астроциты 0,05% трипсином в течение 5 мин.
ПРИМЕЧАНИЕ: Используйте астроциты из проходов от 1 до 3. - Нейтрализуют активность трипсина с помощью FBS в соотношении 1:1 и переносят клетки в коническую трубку 15 мл. Центрифугировать его при 200 х г в течение 5 мин.
- Подсчитайте ячейки и перенесите 1 х 106 клеток в другую коническую трубку. Центрифугировать его при 200 х г в течение 5 мин.
- Удалите супернатант, оставив небольшой объем (~ 200 мкл), чтобы приостановить гранулу клетки, осторожно постукивая по дну конической трубки.
- Переложите 1 мл раствора желатина/гелма/фибриногена в трубку, содержащую клетки, и осторожно пипетку вверх и вниз для гомогенизации, получив конечную концентрацию 1 х 106 клеток/мл.
5. Приготовление раствора сшивателя
- Восстановление тромбина
- Готовят стоковый раствор тромбина 100 Ед/мл в стерильной деионизированной воде с 0,1% (мас./об.) бычным сывороточным альбумином (БСА) в конической пробирке 15 мл. Запас в микротрубках при -20 °C.
ПРИМЕЧАНИЕ: Поскольку тромбин адсорбирует стекло, не используйте стеклянные колбы для приготовления запасного раствора или хранения аликвот.
- Готовят стоковый раствор тромбина 100 Ед/мл в стерильной деионизированной воде с 0,1% (мас./об.) бычным сывороточным альбумином (БСА) в конической пробирке 15 мл. Запас в микротрубках при -20 °C.
- Приготовление раствора тромбина-CaCl2
- Пипетку 100 мкл раствора тромбина и переложить в коническую трубку 50 мл, содержащую 8,9 мл стерильной деионизированной воды для получения конечной концентрации 1 Ед/мл тромбина.
- Приготовьте 10% (мас./об.) раствор CaCl2 в деионизированной воде и стерилизуйте с помощью фильтра 0,2 мкм.
- Переложите 1,1 мл 10% раствораCaCl2 в коническую трубку, содержащую тромбин, чтобы получить конечное соотношение 1:9 (CaCl2 к тромбину).
ПРИМЕЧАНИЕ: Подготовьте раствор сшивателя на том объеме, который будет использоваться в эксперименте, избегая хранения.
6. Биопечать биочернила, нагруженного астроцитами, с использованием биопринтера на основе экструзии
- Дизайн нервной ткани
- Использование G-кода: построить сетку размером 6 х 6 мм (квадратная форма) с расстоянием 1 мм между каждой биопечатной линией по осям X и Y и 6 слоями по оси Z (0,2 мм между каждой линией); установить экструзию (E) на 0,01 мм, увеличивая 0,001 мм на каждом новом слое оси Z; и установите скорость печати (F) на 400 мм/мин(Дополнительная информация).
- Настройка биопринтера
- Подвергайте машину воздействию ультрафиолетового излучения в течение 15 минут, а затем протрите ее этанолом на 70%.
- Включите биопринтер с помощью выключателя питания. Подключите устройство к компьютеру с помощью кабеля USB. Откройте управляющую программу, чтобы подключить ее к биопринтеру и загрузить дизайн файла.
- Подготовка шприца для биопечати
- Перенесите насыщенный астроцитами желатин/гельМА/фибриноген биончи на пластиковый шприц объемом 5 мл с помощью пипетки объемом 1000 мкл.
ПРИМЕЧАНИЕ: Переместите медленно, чтобы избежать образования пузырьков. - Подключите к шприцев стерильной тупой игле 22 г.
ПРИМЕЧАНИЕ: Оставьте шприц при 4 °C в течение 2 мин. - Подключите шприц к печатающей головке биопринтера и вручную промывайте биочернила, чтобы удалить оставшиеся пузырьки.
- Перенесите насыщенный астроцитами желатин/гельМА/фибриноген биончи на пластиковый шприц объемом 5 мл с помощью пипетки объемом 1000 мкл.
- Биопечать
ПРИМЕЧАНИЕ: Биопечать выполнялась вне ламинарного капота.- Поместите 35-миллиметровую культурную чашку на стол биопринтера и расположите иглу на 0,1 мм от поверхности чашки для культивовки, чтобы обеспечить движение иглы.
ПРИМЕЧАНИЕ: Используйте одну 35-миллиметровую культурную тарелку для каждой биопечати. - Нажмите кнопку Печать.
- После того, как биопечать закончится, убедитесь, что шприц отходит от тарелки. Затем закройте блюдо для культуры и подготовьте к процессу сшивания.
ПРИМЕЧАНИЕ: Биопечать одной конструкции занимает примерно 1 мин и 10 с.
- Поместите 35-миллиметровую культурную чашку на стол биопринтера и расположите иглу на 0,1 мм от поверхности чашки для культивовки, чтобы обеспечить движение иглы.
- Сшивание биопечатной конструкции и культуры
- Поместите чашку для культивирования под ультрафиолетовый свет со скоростью 2мВт/см2 в течение 2 x 60 с (вверх и вниз) для сшивания GelMA.
- Под ламинарной струей перенесите биопечатную конструкцию на 24-скважинную пластину с помощью стерильного шпателя.
- Добавьте 500 мкл раствора тромбина/CaCl2 и оставьте на 30 мин, чтобы фибрин сшивал.
- Удалите раствор для сшивания и промыть конструкцию 2 мл PBS 1x. Затем заменить PBS 1 мл культурального носителя астроцитов и инкубировать при 37 °C и 5% CO2. Меняйте среду каждые 3 дня.
7. Оценка жизнеспособности астроцитов
- Жизнеспособность биопечатных астроцитов
- Перенесите биопечатную конструкцию на 35 мм культурную посуду с помощью шпателя.
- Вымойте конструкцию 1 мл 1x PBS.
- Нанесите 100 мкл реагента Live/Dead на конструкцию и держите его при 37 °C в течение 30 минут, сохраняя его защищенным от света.
- Удалите реагент Live/Dead и промыть конструкцию 1 мл 1x PBS.
- Перенесите образец на конфокальную тарелку с помощью шпателя и наблюдайте за клетками внутри конструкции под конфокальным микроскопом, используя возбуждение 488 и 570 нм для получения изображений.
ПРИМЕЧАНИЕ: Используйте увеличение в 10 раз для общей визуализации ячеек в конструкции. - Убедитесь, что образец сидит ровно. При необходимости поместите крышку на образец, чтобы увеличить плоскостность.
ПРИМЕЧАНИЕ: Во время визуализации убедитесь, что конфокальная тарелка хорошо запечатана, чтобы предотвратить высыхание образца. - Рассчитайте количество жизнеспособных (зеленый) и мертвых (красный) с помощью вычислительного программного обеспечения.
- Жизнеспособность культуры 2D астроцитов
- Семена 0,5 х 106 астроцитов (пассаж 1-3) в конфокальной посуде 35 мм, добавляют астроцитарные среды и инкубируют их при 37 °C и 5% CO2.
- Когда клетки сливаются, удалите культурную среду и промыть 1 мл 1x PBS.
- Внесите 200 мкл реагента Live/Dead и держите блюдо при 37 °C в течение 30 минут, защищенных от света.
- Удалите живой/мертвый реагент и промыть клетки 1 мл 1x PBS.
- Отнесите блюдо к конфокальному микроскопу в сочетании с цифровой камерой и используйте возбуждение 488 и 570 нм для получения изображения.
- Рассчитайте количество жизнеспособных (зеленый) и мертвых (красный) с помощью вычислительного программного обеспечения.
8. Иммуноокрашивание астроцитов
- Окрашивание глиальным фибриллярным кислым белком (GFAP) 3D-биопечатных астроцитов
ПРИМЕЧАНИЕ: Чтобы исследовать наличие других клеточных маркеров, измените первичное антитело соответствующим образом.- Извлеките среду из колодца и промыть конструкцию 1 мл 3x PBS.
- Добавьте 4% параформальдегида (PFA) в PBS в скважину до тех пор, пока конструкция не будет полностью покрыта, и оставьте ее на 2 ч при 4 °C.
- Снимите PFA и вымойте конструкцию 1 мл 3x PBS.
ПРИМЕЧАНИЕ: Эта процедура может быть приостановлена на несколько месяцев, если хранится при 4 °C в PBS. Убедитесь, что пластина скважины герметизирована, чтобы избежать испарения PBS. - Обработайте образец глицином 0,1 моль/л в течение 5 минут.
- Промыть 1 мл 1x PBS в течение 5 мин.
- Пермеабилизируют образец PBS, содержащим 0,1% тритона X-100 и 10% FBS в течение 1 ч при 25 °C при орбитальном перемешивании.
- Инкубировать конструкцию с куриным анти-GFAP (первичное разведение антител 1:500) при 4 °C в течение ночи.
- Аспирировать первичное антитело и промыть образец 1 мл PBS в течение 5 мин, 3 раза.
ПРИМЕЧАНИЕ: Первичные антитела могут быть повторно повторно разылены при хранении при 4 °C. - Инкубируют образец с Alexa fluor 488-конъюгированной антикиплодой (вторичное разведение антител 1:500) и 1 мкг/мл DAPI в течение 1 ч при 25 °C при орбитальном перемешивании.
ПРИМЕЧАНИЕ: Держите образец защищенным от света. - Промыть образец 1 мл PBS в течение 5 мин, 3 раза.
- Перенесите конструкцию на 35-миллиметровую конфокальную тарелку.
ПРИМЕЧАНИЕ: Убедитесь, что блюдо хорошо запечатано, чтобы образец не высох.
- Окрашивание глиальным фибриллярным кислым белком (GFAP) культуры 2D астроцитов
- Семена 0,5 х 106 астроцитов (пассаж 1-3) в конфокальной посуде 35 мм, добавляют астроцитарные среды и инкубируют их при 37 °C и 5% CO2.
- Когда клетки слятся, удалите культурную среду и промыть их 1 мл 1x PBS.
- Повторите шаги 8.1.2-8.1.10.
- Окрашивание цитоскелетов астроцитами
- Повторите шаги 8.1.1-8.1.6.
- Добавьте 200 мкл 50 мкг/мл флуоресцентно-конъюгированного раствора фаллоидина в PBS и 1 мкг/мл DAPI поверх конструкции.
- Инкубировать в течение 1 ч при 25 °C при орбитальном перемешивании, сохраняя образец защищенным от света.
- Промыть образец 1 мл PBS в течение 5 мин 3 раза, а конструкцию перенести на конфокальную посуду шпателем.
ПРИМЕЧАНИЕ: Убедитесь, что блюдо хорошо запечатано, чтобы образец не высох.
9. Конфокальная визуализация
- Возьмите посуду к конфокальному микроскопу в сочетании с цифровой камерой для визуализации (возбуждение 359, 488 и 570 нм).
- Используйте увеличение 10x для общей визуализации и 40 или 63x для увеличенных изображений ячеек.
ПРИМЕЧАНИЕ: Убедитесь, что образец сидит ровно. При необходимости поместите крышку на образец, чтобы увеличить плоскостность.
Результаты
Эта работа была направлена на разработку невроподобной ткани с использованием технологии 3D-биопечати для нанесения послойного первичного астроцита, нагруженного желатином / GelMA / фибриногеном биоинке. Астроциты были извлечены и выделены из коры головного мозга детенышей мышей(рисунок 1),добавлены в состав биоматериала, что позволило биофабрикацию живой 3D-конструкции.
Автоматизированное проектирование (CAD) было разработано с использованием G-кода(Дополнительный файл)в виде взаимосвязанной рамы квадратной формы (0,6 x 0,6 мм) с порами 1 мм, с целью облегчения диффузии питательных веществ и кислорода. Рамка состояла из 6 слоев, размещенных друг на друге, изменяемых под углом 90° в каждом слое(рисунок 2A i). Спроектированная структура обладала приблизительно 5 мм высоты(рисунок 2A ii),что позволяло манипулировать тканями. Состав биочернил также позволял изготавливать конструкции различной формы(рисунок 2В).
Приготовление биочернила, состоящего из желатина, гелМА и фибриногена, состояло из двух этапов сшивания. Во-первых, GelMA был сшит под ультрафиолетовым светом, в котором образуются меж- и внутримолекулярные ковалентные связи, за которыми следует сшивание фибрина. На этой ступени тромбин ферментационно расщепляет фибриногенные цепи, в результате чего образуются фибриновые волокна17,реакция стабилизируется ионами Ca2+ 18. Затем волокна GelMA и фибрина образуют стабильную взаимопроникаемую полимерную сеть (IPN), дополненную ламинином, подходящую опору для прикрепления клеток и распространения19,20 (Рисунок 2C).
До биопечати, после 12 дней изоляции, астроциты характеризовались наличием GFAP, белковой составляющей промежуточных нитей астроцитов4 (Рисунок 3A). Затем трипсинизированные астроциты смешивали с раствором желатина/гельМА/фибриногена плотностью 1 х 106 клеток/мл, генерируя насыщенный астроцитами биосин. Биочернило переносили на шприц объемом 5 мл, соединенный с тупой иглой 22 Г, составляющей печатающую головку биопринтера(рисунок 3B i). Игла позволяла экструзию биочернил без засорения и предотвращения высокого напряжения сдвига в клетках.
Благодаря вязкоупругим свойствам желатина, который ведет себя как жидкость при более высоких температурах и как гель при более низких температурах21,биопечатная конструкция сохранила точность формы(рисунок 3B ii). После биопечати двух последовательных слоев биочернил наблюдалось формирование четко определенной структуры(рисунок 3С),с клетками, застрявленными внутри биоматериала.
После процессов биопечати и сшивания конструкцию инкубировали с астроцитарной средой, а после 1 дня биопечати большинство клеток все еще представляли круглую морфологию(рисунок 3D). Биопечатные каркасы сохраняли целостность после 7 дней инкубации, и хотя наблюдались некоторые круглые клетки, большое количество астроцитов распространялось по всей конструкции, представляя астроцитическую морфологию и взаимосвязь(рисунок 3E).
Поскольку параметры биопечати, такие как скорость, могут напрямую влиять на жизнеспособность клеток, были протестированы различные скорости биопечати (400, 600 и 800 мм / мин) и оценена выживаемость астроцитов с использованием анализа Live/Dead с кальциеном-AM (живые клетки, зеленая флуоресценция) и гомодимером этидия III (EthD-II) (мертвые клетки, красная флуоресценция). Процент жизнеспособных клеток был количественно определен с помощью вычислительного программного обеспечения путем расчета количества живых и мертвых клеток. Жизнеспособность клеток оценивали в момент 0 (сразу после биопечати), и результаты показали, что при более низкой скорости, 400 мм/мин, жизнеспособные клетки составляли 74,08% ± 1,33% от общего числа клеток, будучи значительно выше, чем клетки, биопечатанные при 600 и 800 мм/мин (60,25% ± 1,93% и 62,94 ± 6,18% соответственно)(Рисунок 4A). Поэтому в этой работе использовалась скорость 400 мм/мин.
До биопечати 2D культивируемые астроциты характеризовались как процент жизнеспособных клеток, и жизнеспособность биопечатных астроцитов нормализовалась до этого состояния. Результаты показали, что 2D-культура представляла 90,98% ± 0,94% жизнеспособных клеток. Жизнеспособность биопечатных астроцитов (7 день) составила 83,54% ± 3,00%, что составляет 0,92 ± 0,03 от значения 2D, что было значительно выше, чем у 0,81 дня (0,81 ± 0,01)(рисунок 4B). Изображения астроцитов, окрашенных живым/мертвым реагентом, представлены на рисунке 4Си показывают, что после биопечати клетки обладали круглой морфологией(рисунок 4C i). После 1 недели инкубации астроциты распространились по всей конструкции(рисунок 4C ii),показывая отличную морфологию клеток из 2D-культуры(рисунок 4C iii).
Биопечатные астроциты окрашивали, чтобы показать плотность клеток и морфологию клеток внутри конструкции. На рисунке 5А показана биопечатная конструкция после 7 дней инкубации с высокой плотностью астроцитов, окрашенных фаллоидином, красителем F-актина цитоскелета. Хотя наблюдалось мало круглых клеток, астроциты представляли в основном звездообразную морфологию. Биопечатные астроциты показали положительный GFAP при окрашивание после 7 дней биопечати, что указывает на то, что клетки сохраняли свой астроцитарный фенотип(рисунок 5B i). На рисунках 5B ii и 5B iii показаны Z-образные изображения биопечатных астроцитов GFAP+ внутри конструкции. Эти результаты показывают, что композиция биочернила обеспечила биосовместимую микросреду для содействия адгезии, распространению и росту астроцитов.

Рисунок 1:Экстракция разделения мозга и коры головного мозга для культуры первичных астроцитов. Первичные астроциты были выделены из коры головного мозга детенышей мышей C57Bl/6 (послеродовой день 1). После извлечения мозга у животного мозговые окорочка были удалены под микроскопом, а кора отделялась с последующим перевариванием тканей и культурой астроцитов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Схематическая иллюстрация процесса 3D-биопечати. (A) ФАЙЛ CAD, предназначенный для 3D-биопечати нервной ткани, показывающий(i)2 слоя, вид сверху и(ii)6 слоев, вид сбоку, конструкции. (B)Изображения, показывающие способность биочернила печатать структуры различной формы,(i)квадрат,(ii)капилляр и(iii)звезда. (C) Схема сшивания биоматериалов после 3D-биопечати показывает, где GelMA сшивается под ультрафиолетовым светом с последующим сшиванием фибрина в тромбине: Ca2 + ванна. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3:3D-бопринтинг астроцитарных желатиновых /гелевых/фибриногеновых биоинков. (А)Характеристика астроцитов после 12 дней выделения и посева, окрашенных для GFAP, зеленый и DAPI, синий. (B) (i) Установка печатающей головки и (ii) 3D-биопечатная конструкция сразу после биопечати. (B) Двухслойная конструкция, показывающая биопечатную рамку. Увеличение 4x. (C) Изображение биопечатных астроцитов через 1 день после биопечати, показывающее клетки в круглой морфологии. (D) Изображение биопечатных астроцитов через 7 дней после процесса биопечати, показывающее клетки с астроцитарной морфологией с несколькими круглыми клетками, что указывает на их сродство к миметической ткани. Увеличение в 10 раз. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
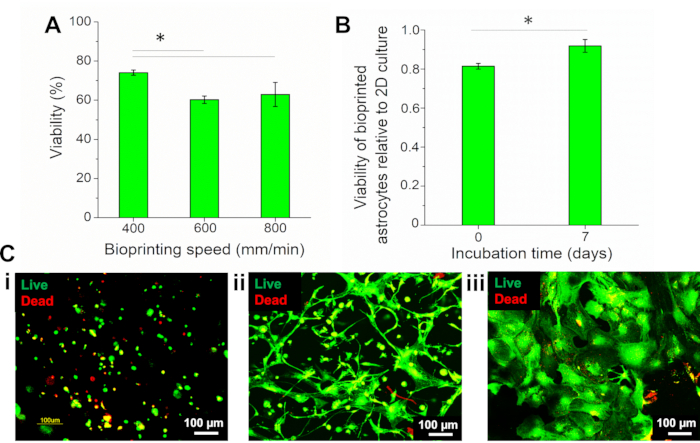
Рисунок 4:Оценка жизнеспособности биопечатных астроцитов. (А) Жизнеспособность биопечати астроцитов с различной скоростью. (B) Жизнеспособность биопечатных астроцитов на(i)день 0 (сразу после биопечати) и(ii)после 7 дней биопечати, нормализованная до жизнеспособности астроцитов в 2D культуре. Статистический анализ с помощью односторонней Ановой с тестом Тукея, n = 3, *p < 0,05. (C) Флуоресцентные изображения астроцитов, окрашенных живым/мертвым реагентом. Биопечать астроцитов на(i)день 0 (сразу после биопечати),(ii)день 7 и(iii)2D культуру астроцитов. Увеличение в 10 раз. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Характеристика 3D биопечатных астроцитов. Иммунофлуоресценция 3D биопечатных астроцитов после 7 дней инкубации окрашенных для(A)F-актина (фаллоидина, красного) и ядер (DAPI, синий) с увеличением 10x и 40x и для(B)GFAP, зеленого(i)с увеличением 10x,(ii)Z-stacked, показывающего ось X-Y-Z биопечатной конструкции, и(iii)изображения, показывающего ось X-Z GFAP+ астроцитов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Технология 3D-биопечати появилась как альтернатива биофабрикации, которая позволяет создавать усовершенствованные конструкции, которые структурно и физиологически напоминают нативныеткани 22,включая мозг23. Биофабрикация нервно-подобных тканей позволяет моделировать in vitro нативную микросреду, являясь важным инструментом для понимания клеточных и молекулярных механизмов, связанных с развитием и лечением многих заболеваний, влияющих на ЦНС11. Из-за важной роли глиальных клеток в нервной функциональности кортикальные астроциты использовались во многих исследованиях, таких как развитие мозга24,транспорт биомолекул25,рост нейритов26и биофабрикация тканей мозга14.
Методы инженерной 3D-культуры астроцитов были сообщены ранее с использованием различных биоматериалов и методов формирования лесов27,28,29. Аналогичным образом, был также представлен метод 3D-биопечати индуцированных человеком плюрипотентных стволовых клеток (hiPSCs), полученных из нейронных агрегатов, и показал способность этих биопечатных клеток дифференцироваться и созревать in vitro30. Однако сообщений о методах биофабрикации 3D-бриопринтированных конструкций астроцитов в литературе нет. Затем этот протокол был направлен на описание воспроизводимого метода 3D-биопечати корковых астроцитов.
В этом протоколе астроциты были выделены из коры головного мозга детенышей мышей C57Bl/6, животной модели, широко используемой в исследованиях31, 32,которые могутбытьзаменены астроцитами, полученными из других источников, таких как hiPSCs и спинной мозг. После выделения, культивации и субкультуры астроциты остаются в пролиферативном состоянии до пассажа 3, что является максимальным числом расщепления, рекомендуемым из-за их внутреннего ограничения пролиферации8. Было подтверждено, что пролиферация астроцитов из прохода 4 была ограничена, что было трудно достичь желаемого количества клеток для 3D-биопечати.
В описанном способе концентрация 1,0 х 106 клеток/мл раствора биоматериала использовалась в качестве доказательства концепции для оценки способности клеток выживать в процессе биопечати и сохранять их жизнеспособность и внутренние свойства во время культивирования в гидрогеле. В предыдущей работе 3D-биопечатная нейроходобная ткань была биофабрикирована путем совместного культивирования астроцитов и нейронов, и для увеличения клеточного взаимодействия концентрация астроцитов составляла 8,0 х 106 клеток/мл14. Затем концентрация клеток может быть оптимизирована для конкретных исследований.
Биотоплив для 3D-биопечати состоит из клеток и биоматериала или комбинации биоматериалов33. В этом протоколе использовалась комбинация желатина/гелма/фибриногена, которая показала, что она благоприятна как для биопечати, так и для поддержания астроцитов в культуре. Производство биопечатываемого биомоха является сложной задачей при использовании метода биопечати на основе экструзии. Композиция биоматериала должна обладать вязкоупругими свойствами, которые в то же время позволяют экструзию биочернила, сохраняя при этом 3D-форму после процесса печати34. Кроме того, он должен быть в состоянии поддерживать жизнеспособность клеток во время процесса, что в зависимости от условий биопечати может вызвать напряжение сдвига клеток, приводящее к смерти35.
Биопечатность была обеспечена желатином, биоматериалом, который обладает оптимальными вязкоупругими свойствами благодаря своей золь-гелевой переходной способности36. Это позволяет макромолекулам желатина перестраиваться и вести себя как жидкость во время экструзии, и как гель после биопечати, сохраняя 3D-структуру. Кроме того, в качестве производного коллагена желатин состоит из глицин-аминокислотных пептидных триплетных повторений, которые обеспечивают клеточнуюспецифичность 21. Однако внутри- и межмолекулярные связи желатина слабы, и из-за своей термопровержимости желатин не имеет стабильности при 37 °C, высвобождаясь из конструкции при клеточной культуре. Поэтому GelMA стал альтернативой в качестве стабильного гидрогеля, благодаря ковалентным связям, образующимся после экспозиции ультрафиолетового света, сохраняя свойства клеточнойспецифичности 19. Физические свойства GelMA, такие как пористость, деградация и модуль упругости, могут быть настроены в соответствии с различными приложениями тканевой инженерии19. Жесткость каркасов GelMA можно контролировать путем изменения метакрилозамещения37,что позволяет достичь жесткости, аналогичной жесткости моделируемой ткани. То есть, уменьшая степень функционализации, можно достичь меньшей жесткости37. Поэтому из-за мягкости мозга мыши38, 39 и прямого влияния жесткости внеклеточного матрикса (ECM) на поведение клеток40,в этом протоколе была предложена низкая степень функционализации желатина. В предыдущих работах сообщалось о способности гидрогелей GelMA имитировать физические особенности ЦНС, демонстрируя высокую пригодность для культивирования астроцитов, нейронов и нервных стволовых клеток14,41,42.
Помимо GelMA, фибриноген, нативный биополимер, который образует волокна фибрина посредством ферментативной реакции, также широко используется для биофабрикатного нейроноподобного ткани, демонстрируя высокую специфичность и предлагая подходящую микросреду для прикрепления и роста нервных клеток30,43,44. Другие биоматериалы, такие как альгинат и хитозан, использовались для биопечати нейроноподобных тканей, смешанных с желатином, гелма и / или фибриногеном, с целью улучшения печатаемости и физических свойств 3D-каркасов14,30. В настоящем способе оптимальная биопечатность, физическая стабильность и клеточная специфичность были достигнуты с использованием желатина, GelMA и фибриногена в качестве компонентов биомолка. Чтобы повысить узнаваемость астроцитов в микросреде, ламинин — компонент ECM мозга — был использован для дополнения биоинка.
В этом протоколе желатин использовали в концентрации 4% (мас./об.), что позволяло золь-гель переходить биомошки при 25 °C в течение приблизительно 10 мин. Более быстрого гелеобразования можно добиться за счет увеличения концентрации желатина. Однако стерилизация путем фильтрации с использованием фильтра 0,2 мкм может быть скомпрометирована. Фильтрация биошока является критическим этапом, подтверждающим, что более высокие концентрации желатина (>5% мас./об.) могут препятствовать фильтрации. Альтернативой для достижения более быстрой точки гелеобразования во время биопечати является оставление шприца, содержащего биочернило, при 4 °C в течение 2 мин, прежде чем подключать его к печатающей головке биопринтера. После биопечати крайне важно поддерживать конструкцию при 25 °C, чтобы избежать дестабилизации 3D-структуры и поддерживать гелеобразное состояние до экспозиции УФ-излучения. Примечательно, что конструкция должна быть твердой, когда раствор сшивающего фибриногена добавляется на пластину. Для сшивания GelMA важно перевернуть образец (2 x 60 с каждой стороны), чтобы обеспечить экспозицию ультрафиолета по всей конструкции. Для сшивки фибриногена раствор сшивателя должен полностью покрывать конструкцию. Поэтому, если используется большая тарелка или тарелка, объем следует регулировать. После сшивания гидрогель должен выглядеть однородным при фазовой контрастной микроскопии и клетки должны быть однородно распределены по всей конструкции, обладая круглой морфологией.
Этот протокол позволил желатиновой /GelMA/фибриногенной биочерниле печатать структуры различной формы, сохраняя целостность и 3D-форму конструкций. В связи с ограничением температуры до 25 °C внутри ламинарного потока, биопечать выполняли в культурной комнате вне ламинарного потока. Время биопечати составляло примерно 1 мин для каждого образца, и во время культивирования клеток не наблюдалось загрязнения.
Целостность клеток может быть нарушена биопечатью, из-за напряжения сдвига, вызванного в процессе35. Это можно контролировать, оптимизируя параметры печати, такие как скорость печати. В этой работе были протестированы различные скорости биопечати, 400, 600 и 800 мм / мин, наблюдая значительное снижение жизнеспособности клеток при увеличении скорости с 400 до 600 мм / мин. При 400 мм/мин около 74% клеток оставались жизнеспособными после биопечати, и это значение значительно увеличилось после 7 дней инкубации (>80%). Поэтому более низкие скорости не использовались для того, чтобы избежать чрезмерного экспонения ячеек в окружающую среду. 2D-культура астроцитов показала более высокую жизнеспособность (~90%) по сравнению с биопечатными клетками. Однако, как показывают флуоресцентные изображения, на морфологию влияет тип культуры. В то время как 2D-клетки были плоскими, астроциты в 3D-среде обладали звездообразной формой, соединяясь друг с другом клеточными процессами.
Примечательно, что миметическое микроокружение было благоприятным для культуры корковых астроцитов, поскольку жизнеспособность клеток значительно увеличилась через 1 неделю, что свидетельствует о пролиферации клеток внутри конструкции. Ламинин, гликопротеин, присутствующий в ECM мозга, был добавлен в биорейк с целью достижения более высокой приверженности астроцитов к гидрогелю14. Окрашивание цитоскелетом F-актина показало, что биопечатные астроциты были в высокой плотности внутри конструкции, что указывает на то, что концентрация клеток, используемая в этом протоколе, позволяла соединять астроциты. Иммуногистохимия для локализации GFAP, маркер, коррелированный с обширной арборизацией астроцитов и клеточной гипертрофией45,подтвержденный окрашиванием F-актином, показал, что клетки представляли типичную астроцитарную морфологию, что указывает на то, что миметическая 3D-система была благоприятной для прикрепления и поведения клеток как в их родной среде.
Протокол, представленный здесь, описывает эффективную и воспроизводимую процедуру 3D-биопечати корковых астроцитов. Из-за важности астроцитов в реакции нейровоспаления на травму, а также в регулировании функциональности нейронов, исследования с участием этой глиальной клетки могут способствовать многим аспектам в понимании заболеваний, которые влияют на ЦНС. Поэтому представленная здесь 3D-модель in vitro полезна в будущих приложениях, направленных на изучение взаимодействий астроцитов и нейронов, функциональности астроцитов при патологиях головного мозга и потенциала астроцитов в качестве терапевтических мишеней.
Раскрытие информации
У авторов нет конфликтов для раскрытия.
Благодарности
Эта работа была поддержана Исследовательским фондом Сан-Паулу (FAPESP), номера грантов 2018/23039-3 и 2018/12605-8; Национальный совет по научно-техническому развитию (CNPq), номера грантов 465656/2014-5 и 309679/2018-4; и Координация по совершенствованию кадров высшего образования (CAPES), финансовый код 001.
Материалы
| Name | Company | Catalog Number | Comments |
| 3D Bioprinter | 3D Biotechnology Solutions | Extrusion-based bioprinter | |
| Blunt-tip forceps | Integra Miltex | 6--30 | Forceps for brain dissection previously sterilized |
| Bovine serum albumin | Sigma-Aldrich | 9048-46-8 | Protease free, fatty acid free, essentially globulin free |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | |
| Cell culture flask | Fisher Scientific | 156340 | Culture flask T25 |
| Cell strainer | Corning Incorporated | 352340 | Cell strainer 40 µm |
| Confocal microscope | Leica | Confocal TCS SP8 microscopy coupled with an Olympus FluoView 300 confocal system | |
| Conical tubes | Thermo Scientific | 339651, 339652 | Sterile tubes of 15 mL and 50 mL |
| DAPI | Abcam | ab224589 | DAPI staining solution |
| DMEM/F12 | Gibco; Life Technologies Corporation | 12500062 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Dyalisis tubing | Sigma-Aldrich | D9527 | Molecular weight cut-off = 14 kDa |
| Ethanol | Fisher Scientific | 64-15-5 | Reagent grade |
| Fetal Bovine Serum | Gibco; Life Technologies Corporation | 12657011 | Research Grade |
| Fibrinogen | Sigma-Aldrich | 9001-32-5 | Fibrinogen cristalline powder from bovine plasma |
| Gelatin | Sigma-Aldrich | 9000-70-8 | Gelatin powder from porcine skin |
| Glycine | Sigma-Aldrich | 56-40-6 | Glycine powder |
| Hanks Buffered Salt Solution (HBSS) | Gibco; Life Technologies Corporation | 14175095 | No calcium, no magnesium, no phenol red |
| L-Glutamine | Sigma-Aldrich | 56-85-9 | L-Glutamine crystalline powder |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin 1-2 mg/mL L in 50 mM Tris-HCl |
| Live dead kit cell imaging kit | Thermo Scientific | R37601 | Green fluorescence in live cells (ex/em 488 nm/515 nm). Red fluorescence in dead cells (ex/em 570 nm/602 nm) |
| Methacrylic anhydride | Sigma-Aldrich | 760-93-0 | For GelMA preparation |
| Microtubes | Corning Incorporated | MCT-150-C | Microtubes of 1,5 mL |
| NaCl | Sigma-Aldrich | 7647-14-5 | |
| Needle 22G | Fisher Scientific | NC1362045 | Sterile blunt needle |
| Operating scissor | Integra Miltex | 05--02 | Sharp scissor for brain dissection previously sterilized |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | Paraformaldehyde powder |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | 15070063 | Pen Strep (5,000 Units/ mL Penicillin; 5,000 ug/mL Streptomycin) |
| Petri dish | Corning Incorporated | 430591, 430588 | Sterile petri dishes of 35 and 100 mm |
| Phalloidin | Abcam | ab176753 | iFluor 488 reagent |
| Photoinitiator | Sigma-Aldrich | 106797-53-9 | 2-Hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone |
| Phosphate buffer saline (PBS) | Gibco; Life Technologies Corporation | 10010023 | PBS 1 x, culture grade, no calcium, no magnesium |
| Poly-L-lysine | Sigma-Aldrich | 25988-63-0 | Poly-L-lysine hydrobromide mol wt 30,000-70,000 |
| Primary antobody | Abcam | ab4674 | Chicken polyclonal to GFAP |
| Secondary antibody | Abcam | ab150176 | Alexa fluor 594 anti-chicken |
| Spatula | Miltex | V973-70 | Number 24 cement spatula previously sterilized |
| Stereomicroscope | Fisherbrand | 3000038 | Microscope for brain dissection |
| Syringe 5 mL | BD | 1222C84 | Sterile syringe |
| Syringe filter 2 µm | Fisher Scientific | 09-740-105 | Polypropylene filter for sterilization |
| Thrombin | Sigma-Aldrich | 9002--04-4 | Thrombin cristalline powder from bovine plasma |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Laboratory grade |
| Trypsin-EDTA | Gibco; Life Technologies Corporation | 15400054 | Trypsin no phenol red 1 x diluted in PBS |
| Versene solution | Gibco; Life Technologies Corporation | 15040066 | Versene Solution (0.48 mM) formulated as 0.2 g EDTA(Na4) per liter of PBS |
| Well plate | Thermo Scientific | 144530 | Sterile 24-well plate |
Ссылки
- Di, L., Mannelli, C., Cuzzocrea, S. Astrocytes: Role and functions in brain pathologies. Frontiers in Pharmacology. 10, 1114(2019).
- Kimelberg, H. K., Nedergaard, M. Functions of astrocytes and their potential as therapeutic targets. Neurotherapeutics. 7 (4), 338-353 (2010).
- Giovannoni, F., Quintana, F. J. The role of astrocytes in CNS inflammation. Trends in Immunology. 41 (9), 805-819 (2020).
- Escartin, C., et al. Reactive astrocyte nomenclature, definitions, and future directions. Nature Neuroscience. 24 (3), 312-325 (2021).
- Carson, M. J., Thrash, J. C., Walter, B. The cellular response in neuroinflammation: The role of leukocytes, microglia and astrocytes in neuronal death and survival. Clinical Neuroscience Research. 6 (5), 237-245 (2006).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Clarke, L. E., et al. Normal aging induces A1-like astrocyte reactivity. Proceedings of the National Academy of Sciences of the Unied States of America. 115 (8), 1896-1905 (2018).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes isolation and culture of mouse cortical astrocytes. Journal of Visualized Experiments: JoVE. (71), e50079(2013).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Knight, E., Przyborski, S. Advances in 3D cell culture technologies enabling tissue-like structures to be created in vitro. Journal of Anatomy. 227 (6), 746-756 (2015).
- Zhuang, P., Sun, A. X., An, J., Chua, C. K., Chew, S. Y. 3D neural tissue models: From spheroids to bioprinting. Biomaterials. 154, 113-133 (2018).
- Balasubramanian, S., Packard, J. A., Leach, J. B., Powell, E. M. Three-dimensional environment sustains morphological heterogeneity and promotes phenotypic progression. Tissue Engineering. Part A. 22 (11-12), 885-898 (2016).
- Watson, P. M. D., Kavanagh, E., Allenby, G., Vassey, M. Bioengineered 3D glial cell culture systems and applications for neurodegeneration and neuroinflammation. SLAS Discovery. 22 (5), 583-601 (2017).
- Li, Y. E., Jodat, Y. A., Samanipour, R., Zorzi, G., Zhu, K. Toward a neurospheroid niche model: optimizing embedded 3D bioprinting for fabrication of neurospheroid brain-like co-culture constructs. Biofabrication. , (2020).
- Zhou, X., et al. Three-dimensional-bioprinted dopamine-based matrix for promoting neural regeneration. ACS Applied Materials & Interfaces. 10 (10), 8993-9001 (2018).
- de la Vega, L., et al. 3D bioprinting human induced pluripotent stem cell-derived neural tissues using a novel lab-on-a-printer technology. Applied Sciences. 8 (12), 2414(2018).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Ariens, R. A. S., Lai, T., Weisel, J. W., Greenberg, C. S., Grant, P. J. Role of factor XIII in fibrin clot formation and effects of genetic polymorphisms. Blood. 100 (3), 743-754 (2002).
- Yue, K., et al. Synthesis, properties, and biomedical applications of Gelatin Methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- de Melo, B. A. G., et al. Strategies to use fibrinogen as bioink for 3D bioprinting fibrin-based soft and hard tissues. Acta Biomaterialia. 117, 60-76 (2020).
- Wang, X., et al. Gelatin-based hydrogels for organ 3D bioprinting. Polymers (Basel). 9 (9), 401(2017).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Naure. Biotechnology. 32 (8), 773-785 (2014).
- de la Vega, L., Lee, C., Sharma, R., Amereh, M., Willerth, S. M. 3D bioprinting models of neural tissues: The current state of the field and future directions. Brain Research Bulletin. 150, 240-249 (2019).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Hanu, R., et al. Monocarboxylic acid transporters, MCT1 and MCT2, in cortical astrocytes in vitro and in vivo. American Journal of Physiology. Cell Physiology. 278 (5), 921-930 (2000).
- Liu, R., Wang, Z. h, Gou, L., Xu, H. A cortical astrocyte subpopulation inhibits axon growth in vitro and in vivo. Molecular Medicine Reports. 12 (2), 2598-2606 (2015).
- Winter, C. C., Cullen, D. K., Donnell, J. C. O., Song, Y. J., Hernandez, N. S. Three-dimensional tissue engineered aligned astrocyte networks to recapitulate developmental mechanisms and facilitate nervous system regeneration. Journal of Visualized Experiments: JoVE. (131), e55848(2018).
- East, E., Golding, J. P., Phillips, J. B. A versatile 3D culture model facilitates monitoring of astrocytes undergoing reactive gliosis. Journal of Tissue Engineering and Regenerative Medicine. 3 (8), 634-646 (2009).
- Hawkinsn, B. T., Grego, S., Sellgren, K. L. Three-dimensional culture conditions differentially affect astrocyte modulation of brain endothelial barrier function in response to transforming growth factor B1. Brain Research. 1608, 167-176 (2015).
- Abelseth, E., et al. 3D printing of neural tissues derived from human induced pluripotent stem cells using a fibrin-based bioink. ACS Biomaterials Science and Engineering. 5 (1), 234-243 (2019).
- Filippo, T. R. M., et al. CXCL12 N-terminal end is sufficient to induce chemotaxis and proliferation of neural stem/progenitor cells. Stem Cell Research. 11 (2), 913-925 (2013).
- Galindo, L. T., et al. Chondroitin sulfate impairs neural stem cell migration through ROCK activation. Molecular Neurobiology. 55 (4), 3185-3195 (2018).
- Groll, J., et al. A definition of bioinks and their distinction from biomaterial inks. Biofabrication. 11 (1), 03001(2018).
- Kyle, S., Jessop, Z. M., Al-sabah, A., Whitaker, I. S. Printability of candidate biomaterials for extrusion-based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), (2017).
- Blaeser, A., et al. Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity. Advanced Healthcare Materials. 5 (3), 326-333 (2016).
- Miyawaki, O., Omote, C., Matsuhira, K. Thermodynamic analysis of sol-gel transition of gelatin in terms of water activity in various solutions. Biopolymers. 103 (12), 685-691 (2015).
- Shirahama, H., Lee, B. H., Tan, L. P., Cho, N. Precise tuning of facile one-pot Gelatin Methacryloyl (GelMA) synthesis. Science Reports. 6, 31036(2016).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Science Reports. 8 (1), 12517(2018).
- Iwashita, M., et al. Comparative analysis of brain stiffness among amniotes using glyoxal fixation and atomic force microscopy. Frontiers in Cell and Developmental Biology. 8, 574619(2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews. 5, 351-370 (2010).
- Ye, W., et al. 3D printing of gelatin methacrylate-based nerve guidance conduits with multiple channels. Materials and Design. 192, 108757(2020).
- Wu, Y., et al. The influence of the stiffness of GelMA substrate on the outgrowth of PC12 cells. Bioscience Reports. 39 (1), 1-9 (2019).
- Edgar, J. M., Robinson, M., Willerth, S. M. Fibrin hydrogels induce mixed dorsal/ventral spinal neuron identities during differentiation of human induced pluripotent stem cells. Acta Biomaterialia. 51, 237-245 (2017).
- Arulmoli, J., et al. Combination scaffolds of salmon fibrin, hyaluronic acid, and laminin for human neural stem cell and vascular tissue engineering. Acta Biomaterialia. 43, 122-138 (2016).
- Brenner, M. Role of GFAP in CNS Injuries. Neuroscience. Letters. 565, 7-13 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены