Method Article
Bioimpression 3D d’astrocytes corticaux murins pour l’ingénierie de tissus de type neural
Dans cet article
Résumé
Nous rapportons ici une méthode de bioimpression 3D d’astrocytes corticaux murins pour la biofabrication de tissus de type neuronal afin d’étudier la fonctionnalité des astrocytes dans le système nerveux central et les mécanismes impliquant les cellules gliales dans les maladies neurologiques et les traitements.
Résumé
Les astrocytes sont des cellules gliales ayant un rôle essentiel dans le système nerveux central (SNC), y compris le soutien et la fonctionnalité neuronals. Ces cellules répondent également aux lésions neurales et agissent pour protéger le tissu contre les événements dégénératifs. Les études in vitro de la fonctionnalité des astrocytes sont importantes pour élucider les mécanismes impliqués dans de tels événements et contribuer au développement de thérapies pour traiter les troubles neurologiques. Ce protocole décrit une méthode pour biofabriquer une structure tissulaire de type neuronal riche en astrocytes par bioimpression 3D d’une bioencaire chargée d’astrocytes. Une bioimprimante 3D à base d’extrusion a été utilisée dans ce travail, et les astrocytes ont été extraits des cortex cérébraux des chiots de souris C57Bl / 6. La bioencentaire a été préparée en mélangeant des astrocytes corticaux jusqu’au passage 3 à une solution de biomatériau composée de gélatine, de gélatine-méthacryloyle (GelMA) et de fibrinogène, complétée par de la laminine, qui présentait des conditions optimales de bioimpression. Les conditions de bio-impression 3D ont minimisé le stress cellulaire, contribuant à la haute viabilité des astrocytes pendant le processus, dans lequel 74,08% ± 1,33% des cellules étaient viables juste après la bioimpression. Après 1 semaine d’incubation, la viabilité des astrocytes a considérablement augmenté à 83,54% ± 3,00%, ce qui indique que la construction 3D représente un microenvironnement approprié pour la croissance cellulaire. La composition du biomatériau a permis l’attachement cellulaire et stimulé le comportement astrocytaire, les cellules exprimant la protéine acide fibrillaire gliale marqueur astrocytaire spécifique des astrocytes (GFAP) et possédant une morphologie astrocytaire typique. Ce protocole reproductible fournit une méthode précieuse pour biofabriquer des tissus de type neuronal 3D riches en astrocytes qui ressemblent au microenvironnement natif des cellules, utile aux chercheurs qui visent à comprendre la fonctionnalité des astrocytes et leur relation avec les mécanismes impliqués dans les maladies neurologiques.
Introduction
Les astrocytes sont le type de cellule le plus abondant dans le système nerveux central (SNC) et jouent un rôle clé dans l’homéostasie cérébrale. En plus de supporter le neurone, les astrocytes sont responsables de la modulation de l’absorption des neurotransmetteurs, du maintien de l’intégrité de la barrière hémato-encéphalique et de la régulation de la synaptogenèse neuronale1,2. Les astrocytes ont également un rôle essentiel dans l’inflammation du SNC, répondant aux lésions cérébrales dans un processus qui conduit à la réactivité astrocitaire ou à l’astrogliose réactive3,4 , formant une cicatriceglialequi empêche l’exposition des tissus sains aux agents dégénératifs5. Cet événement entraîne des changements dans l’expression génique, la morphologie et la fonction des astrocytes6,7. Par conséquent, les études portant sur la fonctionnalité des astrocytes sont utiles pour le développement de thérapies pour traiter les troubles neurologiques.
Les modèles in vitro sont cruciaux pour étudier les mécanismes liés aux lésions neurologiques, et bien que l’isolement réussi et la culture bidimensionnelle (2D) des astrocytes corticaux aient été établis8,ce modèle ne parvient pas à fournir un environnement réaliste qui imite le comportement des cellules natives et à reproduire la complexité du cerveau9 . Dans l’état 2D, le faible soutien mécanique et biochimique, les faibles interactions cellule-cellule et cellule-matrice, et l’aplatissement cellulaire conduisant à l’absence de polarité baso-apicale, affectent la dynamique de signalisation cellulaire et les résultats expérimentaux conduisant à une altération de la morphologie cellulaire et de l’expression des gènes, qui compromettent la réponse aux traitements10. Par conséquent, il est crucial de développer des alternatives qui fournissent un environnement neuronal plus réaliste, visant à traduire les résultats à la clinique.
La culture cellulaire tridimensionnelle (3D) représente un modèle plus avancé qui récapitule avec des caractéristiques de fidélité accrues des organes et des tissus, y compris leSNC 11. En ce qui concerne la culture gliale, les modèles 3D contribuent au maintien de la morphologie des astrocytes, de la polarité baso-apicale cellulaire et de la signalisation cellulaire12,13. La technologie de bio-impression 3D est apparue comme un outil puissant pour biofabriquer des tissus vivants 3D de manière contrôlée en utilisant des cellules et des biomatériaux pour recréer la structure et les propriétés des tissus natifs. L’utilisation de cette technologie a conduit à une amélioration substantielle de la prédiction des résultats et a contribué à la médecine régénérative appliquée au SNC14,15,16.
Le protocole décrit ici détaille l’isolement et la culture des astrocytes corticaux. Le protocole détaille également une méthode reproductible pour bioimprimer des astrocytes incorporés dans de la gélatine / méthacryloyle de gélatine (GelMA) / fibrinogène, complétés par de la laminine. Dans ce travail, une bioimprimante à base d’extrusion a été utilisée pour imprimer la composition de biomatériau contenant des astrocytes corticaux à une densité de 1 x 106 cellules / mL. La contrainte de cisaillement de la bio-impression a été minimisée en contrôlant la vitesse d’impression, et les astrocytes ont montré une viabilité élevée après le processus. Les constructions bioimprimées ont été cultivées pendant 1 semaine, et les astrocytes ont pu se propager, se fixer et survivre dans l’hydrogel, en maintenant la morphologie astrocytaire et en exprimant un marqueur spécifique de la protéine acide fibrillaire gliale (GFAP)4.
Cette procédure est compatible avec les bioimprimantes à base d’extrusion à piston et peut être utilisée pour bioimprimer des astrocytes dérivés de différentes sources. Le modèle bioimprimé en 3D proposé ici convient à un large éventail d’applications d’ingénierie neuronale, telles que l’étude des mécanismes impliqués dans la fonctionnalité des astrocytes dans les tissus sains et la compréhension de la progression des pathologies neurologiques et du développement de traitements.
Protocole
Toutes les procédures impliquant des animaux ont suivi les directives internationales pour l’utilisation des animaux dans la recherche (http://www.iclas.org) et ont été approuvées par le Comité d’éthique de la recherche de l’Universidade Federal de São Paulo (CEUA 2019 / 9292090519).
1. Dissection cérébrale de souris
- Transférer 10 mL de solution saline tamponnée Hanks froide (HBSS) dans une boîte de culture de 100 mm et 1 mL dans un microtube de 1,5 mL. Préparez un microtube par animal.
REMARQUE: La boîte de culture et le microtube doivent être conservés sur la glace. - Préparer le milieu de culture des astrocytes en utilisant DMEM F12 + 10% de sérum fœtal bovin (FBS), 2% de glutamine et 1% de pénicilline-streptomycine (P / S). Stériliser le milieu en filtrant à l’aide d’un filtre de 0,2 μm.
- Euthanasier les chiots souris C57Bl/6 (jour 1 postnatal) par décapitation à l’aide d’un ciseau tranchant. À l’aide d’une pince, tirez la peau et exposez le crâne. Assurez-vous que les ciseaux et les pinces sont stérilisés avec de l’éthanol à 70%.
- Coupez le crâne du foramen magnum au sommet de la tête le long du plan sagittal à l’aide d’un ciseau à pointe incurvée et pointue.
REMARQUE: Assurez-vous que le tissu encéphale n’est pas endommagé. - À l’aide d’une spatule préalablement stérilisée à l’éthanol à 70%, soulevez le cerveau de la cavité crânienne et placez-le dans la boîte de culture contenant 10 mL de HBSS froid.
- Placez la boîte de culture contenant le cerveau sous le stéréomicroscope et, à l’aide de deux pinces à pointe émoussée, retirez les méninges du cerveau (Figure 1).
- Séparez les cortex du reste du cerveau en les faisant rouler doucement loin de la ligne médiane du cerveau à l’aide d’une spatule.
- Recueillir les deux cortex et les transférer immédiatement dans le même microtube contenant 1 mL de HBSS froid.
2. Isolement et culture des astrocytes
- Sous le flux laminaire, coupez le tissu cortical en petits morceaux à l’aide d’un micro-ciseau incurvé et lavez-les avec 1 mL de HBSS en pipetant de haut en bas 3x. Attendez que le tissu s’installe. Retirez HBSS et ajoutez du HBSS frais, en répétant le processus deux fois de plus.
- Retirer HBSS et incuber le tissu avec 1 mL de trypsine à 0,05 % à 37 °C pendant 5 min.
REMARQUE: Seule la digestion de la trypsine est suffisante à ce stade. - Dissocier mécaniquement le tissu en pipetant doucement de haut en bas 15x.
NOTE: La dissociation complète du tissu est observée par l’augmentation de la turbidité de la suspension et par l’absence de gros fragments de tissu dans la suspension. - Transférer la solution dans un tube conique de 15 mL, neutraliser l’activité de la trypsine en ajoutant un volume égal de FBS et filtrer la solution dans un filtre à crépine cellulaire de 0,4 μm pour éliminer les fragments non dissociés.
- Laver le filtre avec 1 mL de milieu astrocytaire, prélever la suspension cellulaire qui a traversé la passoire et la centrifuger pendant 5 min à 200 x g et 25 °C. Après centrifugation, jeter le surnageant et suspendre la pastille dans 1 mL de milieu de culture d’astrocytes.
- Transférer la suspension cellulaire dans une fiole de culture T25, porter le volume du milieu à 3,5 mL et incuber les cellules à 37 °C et 5 % de CO2.
- Assurez-vous qu’après 24 h, les cellules adhèrent. Ensuite, remplacez le support et changez-le tous les 3 jours.
- Après 7 jours, retirer les microglies et les oligodendrocytes de la culture en lavant les cellules avec 2 mL de 1x PBS.
- Remplacer la solution pbS par le milieu de culture des astrocytes et laisser la fiole de culture dans un agitateur orbital à 180 tr/min pendant la nuit.
REMARQUE: Les astrocytes forment une monocouche confluente en environ 10 à 12 jours de culture.
3. Synthèse de la gélatine méthacryloyl (GelMA)
- Peser 10 g de gélatine obtenue à partir de peau de porc et dissoudre dans 100 mL de PBS en laissant la solution remuer sur une plaque chauffante à 240 tr/min et 50 °C jusqu’à dissolution complète.
- Sous une hotte, ajouter 2 mL d’anhydride méthacrylique (AM) pour un faible degré de fonctionnalisation, et laisser l’émulsion de gélatine remuer à 240 tr/min et 50 °C pendant 2 h.
ATTENTION : Mention de danger de l’AM : H302 + H332 (nocif en cas d’ingestion ou d’inhalation), H311 (toxique au contact de la peau), 314 (provoque de graves brûlures cutanées et des lésions oculaires), 315 (provoque une irritation de la peau), H317 (peut provoquer une réaction allergique cutanée), H318 (provoque de graves lésions oculaires), 331 (toxique en cas d’inhalation), H332 (nocif en cas d’inhalation), H335 (peut provoquer une irritation respiratoire). Directives de manipulation: P261 (éviter de respirer de la poussière / fumée / gaz / brouillard / vapeurs / pulvérisation), P305 + P351 + P338 + P310 (SI DANS LES YEUX: Rincer prudemment à l’eau pendant plusieurs minutes. Retirez les lentilles de contact, si elles sont présentes et faciles à faire. Continuez le rinçage. Appelez immédiatement un CENTRE ANTIPOISON / médecin), P301 + P312 + P330 (SI AVALÉ: Appelez un CENTRE ANTIPOISON / médecin si vous ne vous sentez pas bien. Rincer la bouche).
REMARQUE: Ajoutez MA très lentement, goutte à goutte. - Diluer la solution de gélatine-MA dans 100 mL de PBS préchauffé (50 °C) pour obtenir 200 mL de volume final et laisser remuer la solution à 240 tr/min et 50 °C pendant 10 min.
- Coupez ~20 cm de membrane de dialyse (coupure moléculaire 12-14 kDa) et faites-la tremper dans de l’eau désionisée jusqu’à ce qu’elle soit molle.
REMARQUE: Remplissez les membranes avec de l’eau désionisée pour vous assurer qu’il n’y a pas de trous ou de défauts. - À l’aide d’un entonnoir, transférer la solution de gélatine-MA aux membranes.
REMARQUE: Fermez les deux côtés en laissant plus d’espace à l’intérieur pour permettre le mélange. - Placer les membranes contenant la solution de gélatine-MA dans un récipient contenant 2 L d’eau distillée pour la dialyse, en les laissant remuer à 40 °C pendant 5 jours (500 tr/min).
REMARQUE: Couvrez le récipient pour éviter l’évaporation de l’eau. - Changez l’eau distillée deux fois par jour. A chaque fois, retournez les membranes à l’envers pour l’homogénéisation.
- Le cinquième jour, mélanger 200 mL d’eau ultrapure préchauffée (40 °C) à la gélatine-MA dialysée et laisser remuer pendant 15 min à 40 °C.
- Transférer la solution de gélatine-MA dans des tubes coniques de 50 mL jusqu’à 25 mL et laisser les tubes rester à -80 °C pendant 2 jours.
REMARQUE: Stockez les tubes horizontalement pour faciliter la lyophilisation. - Lyophiliser les solutions congelées pendant 3-5 jours et conserver le GelMA lyophilisé à l’abri de l’humidité.
4. Préparation Bioink
REMARQUE: Afin d’obtenir 1 mL de bioencaire, il est recommandé de fabriquer au moins 3 mL de solution de biomatériau, car il peut y avoir des pertes pendant la filtration.
- Préparation de la solution de fibrinogène
- Préparer une solution saline (NaCl 0,9%) dans de l’eau désionisée et dissoudre 10 mg de fibrinogène du plasma bovin dans 1 mL de la solution saline pour obtenir une concentration de 10 mg/mL.
REMARQUE: Comme le fibrinogène s’adsorbe sur le verre, n’utilisez pas de flacons en verre pour préparer la solution de fibrinogène. - Laisser la solution sous agitation à 37 °C jusqu’à dissolution complète du fibrinogène.
REMARQUE: Pour la dissolution du fibrinogène, utilisez un système rotatif placé à l’intérieur d’un four à 37 ° C. L’agitation magnétique (180 tr/min) du fibrinogène sur une plaque chauffante à 37 °C convient également. Dans ces conditions, 10 mg/ mL de fibrinogène prend environ 40 minutes pour se dissoudre.
- Préparer une solution saline (NaCl 0,9%) dans de l’eau désionisée et dissoudre 10 mg de fibrinogène du plasma bovin dans 1 mL de la solution saline pour obtenir une concentration de 10 mg/mL.
- Préparation de la solution de gélatine/GelMA
- Peser 0,12 g de gélatine et l’ajouter à 1,9 mL de PBS préchauffé (40 °C) pour obtenir une concentration finale de 4 % (p/v) de gélatine. Vortex pour faciliter la dissolution.
- Conserver l’émulsion à 40 °C jusqu’à dissolution complète.
- Peser 0,06 g de GelMA lyophilisé et transférer dans la solution de gélatine pour obtenir une concentration finale de GelMA à 2% (p/v). Vortex pour faciliter la dissolution.
- Conserver la solution à 40 °C jusqu’à dissolution complète.
- Préparation de la gélatine chargée d’astrocytes / GelMA / fibrinogène bioink
- Pipeter 0,9 mL de la solution de fibrinogène 10 mg/mL et transférer dans la solution de gélatine/GelMA pour obtenir une concentration finale de 3 mg/mL de fibrinogène.
- Peser 0,015 g de photoinitiateur (IP) et transférer dans la solution de gélatine/GelMA/fibrinogène pour obtenir une concentration finale de 0,5 % (p/v) PI. Mélanger la solution en retournant le tube de haut en bas et le maintenir à 40 °C à l’abri de la lumière pour éviter la dégradation de l’IP.
REMARQUE: Stockez la bioencent à 4 °C pendant un maximum de 24 h. - Sous l’écoulement laminaire, filtrer la solution à l’aide d’un filtre de 0,2 μm dans un tube conique stérile de 15 mL.
REMARQUE: La solution de biomatériau doit être à 37-40 ° C pour permettre la filtration. - Transférer 980 μL de la solution de biomatériau dans un tube conique de 15 mL.
- Diluer la laminine dans une solution saline pour obtenir une solution stock de 100 μg/mL.
- Pipette 20 μL de laminine et transfert dans le tube contenant la bioencaire pour obtenir une concentration finale de 2 μg/mL de laminine.
- Mélanger doucement en pipetant de haut en bas, en évitant les bulles. Si des bulles persistent, centrifugez le tube conique à 200 x g pendant 2 min. Gardez la bioencentée à 37 °C jusqu’à ce qu’elle soit mélangée aux cellules.
- Trypsiniser les astrocytes primaires avec 0,05% de trypsine pendant 5 min.
REMARQUE: Utilisez les astrocytes des passages 1 à 3. - Neutraliser l’activité de la trypsine avec FBS dans un rapport de 1:1 et transférer les cellules dans un tube conique de 15 mL. Centrifugez-le à 200 x g pendant 5 min.
- Comptez les cellules et transférez 1 x 106 cellules dans un autre tube conique. Centrifugez-le à 200 x g pendant 5 min.
- Retirez le surnageant en laissant un petit volume (~200 μL) pour suspendre la pastille cellulaire, en tapotant doucement le fond du tube conique.
- Transférer 1 mL de solution de gélatine/GelMA/fibrinogène dans le tube contenant les cellules et pipeter doucement de haut en bas pour homogénéiser, obtenant une concentration finale de 1 x 106 cellules/mL.
5. Préparation de la solution de réticulation
- Reconstitution de la thrombine
- Préparer une solution stock de thrombine 100 U/mL dans de l’eau désionisée stérile avec 0,1 % (p/v) d’albumine sérique bovine (BSA) dans un tube conique de 15 mL. Stocker en microtubes à -20 °C.
REMARQUE: Comme la thrombine s’adsorbe sur le verre, n’utilisez pas de flacons en verre pour préparer la solution d’emballage ou stocker les aliquotes.
- Préparer une solution stock de thrombine 100 U/mL dans de l’eau désionisée stérile avec 0,1 % (p/v) d’albumine sérique bovine (BSA) dans un tube conique de 15 mL. Stocker en microtubes à -20 °C.
- Préparation de la solution de thrombine-CaCl2
- Pipette 100 μL de solution stock de thrombine et transfert dans un tube conique de 50 mL contenant 8,9 mL d’eau désionisée stérile pour obtenir une concentration finale de 1 U/mL de thrombine.
- Préparer une solution de CaCl2 à10 % (p/v) dans de l’eau désionisée et stériliser à l’aide d’un filtre de 0,2 μm.
- Transférer 1,1 mL de la solution de CaCl2 à 10 % dans le tube conique contenant de la thrombine, afin d’obtenir un rapport final de 1:9 (CaCl2 à la thrombine).
REMARQUE: Préparez la solution de réticulation au volume à utiliser dans l’expérience, en évitant le stockage.
6. Bio-impression d’une bioencaire chargée d’astrocytes à l’aide d’une bioimprimante à base d’extrusion
- Conception du tissu neural
- En utilisant le code G: construire une grille de 6 x 6 mm (forme carrée) avec 1 mm de distance entre chaque ligne bioimprimée sur les axes X et Y, et 6 couches sur l’axe Z (0,2 mm entre chaque ligne); régler l’extrusion (E) sur 0,01 mm, en augmentant de 0,001 mm à chaque nouvelle couche de l’axe Z; et réglez la vitesse d’impression (F) à 400 mm/min(Informations supplémentaires).
- Configuration de la bioimprimante
- Exposez la machine à la lumière UV pendant 15 minutes, puis essuyez-la avec de l’éthanol à 70%.
- Allumez la bioimprimante à l’aide de l’interrupteur d’alimentation. Connectez la machine à l’ordinateur via un câble USB. Ouvrez le logiciel de contrôle pour le connecter à la bioimprimante et charger la conception du fichier.
- Préparation de la seringue de bio-impression
- Transférer la bioensembre de gélatine/GelMA/fibrinogène chargée d’astrocytes dans une seringue en plastique de 5 mL à l’aide d’une pipette de 1 000 μL.
REMARQUE: Transférer lentement pour éviter la formation de bulles. - Connectez une aiguille émoussée stérile de 22 G à la seringue.
REMARQUE: Laissez la seringue à 4 °C pendant 2 min. - Connectez la seringue à la tête d’impression de la bioimprimante et rincez manuellement la bioencaire pour éliminer les bulles restantes.
- Transférer la bioensembre de gélatine/GelMA/fibrinogène chargée d’astrocytes dans une seringue en plastique de 5 mL à l’aide d’une pipette de 1 000 μL.
- Bioimpression
REMARQUE: La bio-impression a été effectuée à l’extérieur de la hotte laminaire.- Placez un plat de culture de 35 mm sur la table de la bioimprimante et placez l’aiguille à 0,1 mm de la surface du plat de culture pour permettre le mouvement de l’aiguille.
REMARQUE: Utilisez un plat de culture de 35 mm pour chaque bio-impression. - Appuyez sur le bouton Imprimer.
- Une fois la bioimpression terminée, assurez-vous que la seringue s’éloigne du plat. Ensuite, fermez le plat de culture et préparez-vous au processus de réticulation.
REMARQUE: La bio-impression d’une construction prend environ 1 min et 10 s.
- Placez un plat de culture de 35 mm sur la table de la bioimprimante et placez l’aiguille à 0,1 mm de la surface du plat de culture pour permettre le mouvement de l’aiguille.
- Réticulation de la construction et de la culture bio-imprimées
- Placez la boîte de culture sous la lumière UV à 2 mW/cm2 pendant 2 x 60 s (haut et bas) pour la réticulation GelMA.
- Sous le flux laminaire, transférer la construction bioimprimée sur une plaque de 24 puits à l’aide d’une spatule stérile.
- Ajouter 500 μL de solution de thrombine/CaCl2 et laisser agir pendant 30 min pour permettre la réticulation de la fibrine.
- Retirez la solution de réticulation et lavez la construction avec 2 mL de PBS 1x. Ensuite, remplacez le PBS par 1 mL de milieu de culture d’astrocytes et incubez à 37 °C et 5% de CO2. Changez le support tous les 3 jours.
7. Évaluation de la viabilité des astrocytes
- Viabilité des astrocytes bioimprimés
- Transférer la construction bioimprimée dans un plat de culture de 35 mm à l’aide d’une spatule.
- Lavez la construction avec 1 mL de 1x PBS.
- Déposez 100 μL du réactif vivant/mort sur la construction et maintenez-le à 37 °C pendant 30 min, en le protégeant de la lumière.
- Retirez le réactif Live/Dead et lavez la construction avec 1 mL de 1x PBS.
- Transférez l’échantillon dans une boîte confocale à l’aide d’une spatule et observez les cellules de la construction sous un microscope confocal en utilisant une excitation de 488 et 570 nm pour l’acquisition d’images.
REMARQUE : Utilisez un grossissement de 10x pour une visualisation globale des cellules de la construction. - Assurez-vous que l’échantillon est à plat. Si nécessaire, placez un couvercle sur l’échantillon pour augmenter la planéité.
REMARQUE: Pendant l’imagerie, assurez-vous que le plat confocal est bien scellé pour éviter que l’échantillon ne se dessèche. - Calculez le nombre de viables (vert) et de morts (rouges) à l’aide d’un logiciel de calcul.
- Viabilité de la culture d’astrocytes 2D
- Ensemencez 0,5 x10 6 astrocytes (passage 1-3) dans un plat confocal de 35 mm, ajoutez le milieu des astrocytes et incubez-les à 37 °C et 5% de CO2.
- Lorsque les cellules sont confluentes, retirer le milieu de culture et laver avec 1 mL de 1x PBS.
- Déposer 200 μL du réactif Vivant/Mort et maintenir la boîte à 37 °C pendant 30 min, à l’abri de la lumière.
- Retirez le réactif Live/Dead et lavez les cellules avec 1 mL de 1x PBS.
- Prenez la parabole dans un microscope confocal couplé à un appareil photo numérique et utilisez une excitation de 488 et 570 nm pour l’acquisition d’images.
- Calculez le nombre de viables (vert) et de morts (rouges) à l’aide d’un logiciel de calcul.
8. Immunocoloration des astrocytes
- Coloration de la protéine acide fibrillaire gliale (GFAP) des astrocytes bioimprimés en 3D
REMARQUE: Pour étudier la présence d’autres marqueurs cellulaires, modifiez l’anticorps primaire en conséquence.- Retirez le milieu du puits et lavez la construction avec 1 mL de 3x PBS.
- Ajouter 4 % de paraformaldéhyde (PFA) dans du PBS au puits jusqu’à ce que la construction soit complètement recouverte et laisser agir pendant 2 h à 4 °C.
- Retirez le PFA et lavez la construction avec 1 mL de PBS 3x.
REMARQUE: Cette procédure peut être suspendue pendant plusieurs mois si elle est stockée à 4 ° C dans PBS. Assurez-vous que la plaque du puits est scellée pour éviter l’évaporation du PBS. - Traiter l’échantillon avec de la glycine 0,1 mol/L pendant 5 min.
- Laver avec 1 mL de 1x PBS pendant 5 min.
- Perméabiliser l’échantillon avec du PBS contenant 0,1 % de Triton X-100 et 10 % de FBS pendant 1 h à 25 °C sous agitation orbitale.
- Incuber la construction avec de l’anti-GFAP de poulet (dilution d’anticorps primaires 1:500) à 4 °C pendant la nuit.
- Aspirer l’anticorps primaire et laver l’échantillon avec 1 mL de PBS pendant 5 min, 3 fois.
REMARQUE: L’anticorps primaire peut être réutilisé plusieurs fois lorsqu’il est stocké à 4 ° C. - Incuber l’échantillon avec de l’anti-poulet conjugué Alexa fluor 488 (dilution des anticorps secondaires 1:500) et 1 μg/mL DAPI pendant 1 h à 25 °C sous agitation orbitale.
REMARQUE: Gardez l’échantillon à l’abri de la lumière. - Lavez l’échantillon avec 1 mL de PBS pendant 5 min, 3 fois.
- Transférer la construction dans un plat confocal de 35 mm.
REMARQUE: Assurez-vous que le plat est bien scellé pour éviter que l’échantillon ne se dessèche.
- Coloration de la protéine acide fibrillaire gliale (GFAP) de la culture d’astrocytes 2D
- Ensemencez 0,5 x10 6 astrocytes (passage 1-3) dans un plat confocal de 35 mm, ajoutez le milieu des astrocytes et incubez-les à 37 °C et 5% de CO2.
- Lorsque les cellules sont confluentes, retirez le milieu de culture et lavez-les avec 1 mL de PBS.
- Répétez les étapes 8.1.2 à 8.1.10.
- Coloration du cytosquelette des astrocytes
- Répétez les étapes 8.1.1 à 8.1.6.
- Ajouter 200 μL de 50 μg/mL de solution de phalloïdine conjuguée par fluorescence dans du PBS et 1 μg/mL de DAPI sur la construction.
- Incuber pendant 1 h à 25 °C sous agitation orbitale, en protégeant l’échantillon de la lumière.
- Lavez l’échantillon avec 1 mL de PBS pendant 5 min 3 fois et transférez la construction dans un plat confocal à l’aide d’une spatule.
REMARQUE: Assurez-vous que le plat est bien scellé pour éviter que l’échantillon ne se dessèche.
9. Imagerie confocale
- Emmenez les plats dans un microscope confocal couplé à un appareil photo numérique pour l’imagerie (excitation de 359, 488 et 570 nm).
- Utilisez un grossissement de 10x pour une visualisation globale et de 40 ou 63x pour les images agrandies des cellules.
REMARQUE: Assurez-vous que l’échantillon est à plat. Si nécessaire, placez un couvercle sur l’échantillon pour augmenter la planéité.
Résultats
Ce travail visait à développer un tissu de type neuronal en utilisant la technologie de bio-impression 3D pour déposer couche par couche de gélatine primaire chargée d’astrocytes / GelMA / fibrinogène bioink. Les astrocytes ont été extraits et isolés du cortex cérébral de chiots souris(Figure 1),ajoutés à une composition de biomatériaux, permettant la biofabrication d’une construction 3D vivante.
La conception assistée par ordinateur (CAO) a été développée en utilisant le code G(fichier supplémentaire)comme un cadre interconnecté de forme carrée (0,6 x 0,6 mm), avec des pores de 1 mm, visant à faciliter la diffusion des nutriments et de l’oxygène. Le cadre était composé de 6 couches placées les unes sur les autres, changeant à un angle de 90° dans chaque couche(Figure 2A i). La structure conçue possédait environ 5 mm de hauteur(Figure 2A ii),permettant la manipulation des tissus. La composition bioink a également permis la fabrication de constructions de différentes formes(Figure 2B).
La préparation de la bioencentielle composée de gélatine, de GelMA et de fibrinogène comprenait deux étapes de réticulation. Tout d’abord, GelMA a été réticulé sous la lumière UV, dans laquelle des liaisons covalentes inter et intramoléculaires sont formées, suivies d’une réticulation de la fibrine. Dans cette étape, la thrombine clivent enzymatiquement les chaînes de fibrinogène, entraînant la formation de fibres de fibrine17,une réaction stabilisée par les ions Ca2+ 18. Ensuite, les fibres de GelMA et de fibrine forment un réseau de polymères interpénétrés stables (IPN) complété par de la laminine, support approprié pour la fixation cellulaire et l’étalement19,20 (Figure 2C).
Avant la bioimpression, après 12 jours d’isolement, les astrocytes étaient caractérisés par la présence de GFAP, un constituant protéique des filaments intermédiaires des astrocytes4 (Figure 3A). Ensuite, des astrocytes trypsinisés ont été mélangés avec la solution de gélatine / GelMA / fibrinogène à une densité de 1 x 106 cellules / mL, générant une bioensembre chargée d’astrocytes. La bioencaisseur a été transférée dans une seringue de 5 mL reliée à une aiguille émoussée de 22 G, composant la tête d’impression de la bioimprimante (Figure 3B i). L’aiguille a permis l’extrusion bioink sans obstruer et empêcher un stress de cisaillement élevé pour les cellules.
En raison des propriétés viscoélastiques de la gélatine, qui se comporte comme un fluide à des températures plus élevées et comme un gel à des températures plus basses21, la construction bio-imprimée a conservé la fidélité de la forme (Figure 3B ii). Après la bioimpression de deux couches consécutives de bioencaire, la formation d’une structure bien définie a été observée(Figure 3C),avec des cellules piégées dans le biomatériau.
Après des processus de bio-impression et de réticulation, la construction a été incubée avec un milieu astrocytaire, et après 1 jour de bioimpression, la plupart des cellules présentaient encore une morphologie ronde(Figure 3D). Les échafaudages bioimprimés ont maintenu leur intégrité après 7 jours d’incubation, et bien que certaines cellules rondes aient été observées, un grand nombre d’astrocytes se sont répandus dans toute la construction, présentant une morphologie astrocytaire et une interconnexion(Figure 3E).
Étant donné que les paramètres de la bioimpression, tels que la vitesse, pourraient affecter directement la viabilité des cellules, différentes vitesses de bioimpression (400, 600 et 800 mm / min) ont été testées et la survie des astrocytes évaluée à l’aide du test Live/ Dead avec la calcéine-AM (cellules vivantes, fluorescence verte) et l’homodimère d’éthidium III (EthD-II) (cellules mortes, fluorescence rouge). Le pourcentage de cellules viables a été quantifié à l’aide d’un logiciel de calcul, en calculant le nombre de cellules vivantes et mortes. La viabilité cellulaire a été évaluée au temps 0 (juste après la bioimpression), et les résultats ont montré qu’à la vitesse inférieure, 400 mm / min, les cellules viables représentaient 74,08% ± 1,33% du total des cellules, étant significativement plus élevées que les cellules bioimprimées à 600 et 800 mm / min (60,25% ± 1,93% et 62,94 ± 6,18%, respectivement) (Figure 4A). Par conséquent, la vitesse de 400 mm / min a été utilisée dans ce travail.
Avant la bioimpression, les astrocytes cultivés en 2D étaient caractérisés comme le pourcentage de cellules viables, et la viabilité des astrocytes bioimprimés était normalisée à cette condition. Les résultats ont montré que la culture 2D présentait 90,98% ± 0,94% des cellules viables. La viabilité des astrocytes bioimprimés (jour 7) était de 83,54 % ± 3,00 %, ce qui représente 0,92 ± 0,03 de la valeur 2D, ce qui était significativement plus élevé que celui du jour 0 (0,81 ± 0,01)(Figure 4B). Des images d’astrocytes colorés avec le réactif vivant/mort sont présentées à la figure 4C, et montrent qu’après bioimpression, les cellules possédaient une morphologie ronde (Figure 4C i). Après 1 semaine d’incubation, les astrocytes se propagent dans toute la construction (Figure 4C ii), montrant une morphologie distincte des cellules issues de la culture 2D ( Figure4C iii).
Les astrocytes bioimprimés ont été colorés pour montrer la densité cellulaire et la morphologie cellulaire dans la construction. La figure 5A montre une construction bioimprimée après 7 jours d’incubation, avec une forte densité d’astrocytes colorés avec de la phalloïdine, un colorant du cytosquelette F-actine. Bien que peu de cellules rondes aient été observées, les astrocytes présentaient principalement une morphologie en étoile. Les astrocytes bioimprimés se sont révélés positifs au GFAP lorsqu’ils étaient colorés après 7 jours de bioimpression, ce qui indique que les cellules ont conservé leur phénotype astrocytaire (Figure 5B i). Les figures 5B ii et 5B iii montrent les images empilées en Z des astrocytes GFAP+ bioimprimés dans la construction. Ces résultats indiquent que la composition bioencrée a fourni un microenvironnement biocompatible pour favoriser l’adhésion, la propagation et la croissance des astrocytes.

Figure 1: Extraction de la séparation du cerveau et du cortex pour la culture d’astrocytes primaires. Les astrocytes primaires ont été isolés du cortex du cerveau des chiots de souris C57Bl/6 (jour 1 postnatal). Après avoir extrait le cerveau de l’animal, les méninges ont été enlevées au microscope et le cortex séparé, suivi d’une digestion tissulaire et d’une culture d’astrocytes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Illustration schématique du procédé de bio-impression 3D. (A) fichier CAO conçu pour la bioimpression 3D de tissu neural montrant (i) 2 couches, vue de dessus, et (ii) 6 couches, vue latérale, de la construction. (B) Images montrant la capacité de la bioense à imprimer des structures de différentes formes (i) carrées, (ii) capillaires et (iii) étoiles. (C) Schéma de réticulation des biomatériaux après bioimpression 3D montrant, où GelMA est réticulé sous la lumière UV suivie d’une réticulation de fibrine dans un bain de thrombine: Ca2+. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3: Boprinting 3D de gélatine/GelMA/fibrinogène chargée d’astrocytes bioensembre. (A) Caractérisation des astrocytes après 12 jours d’isolement et de culture, colorés pour GFAP, vert et DAPI, bleu. (B) (i) Configuration de la tête d’impression et (ii) construction bioimprimée en 3D juste après la bioimpression. (B) Construction à deux couches montrant le cadre bioimprimé. Grossissement de 4x. (C) Image d’astrocytes bioimprimés 1 jour après la bioimpression, montrant des cellules dans une morphologie ronde. (D) Image d’astrocytes bioimprimés 7 jours après le processus de bio-impression, montrant des cellules à morphologie astrocytaire avec peu de cellules rondes, indiquant leur affinité avec le tissu mimétique. Grossissement de 10x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
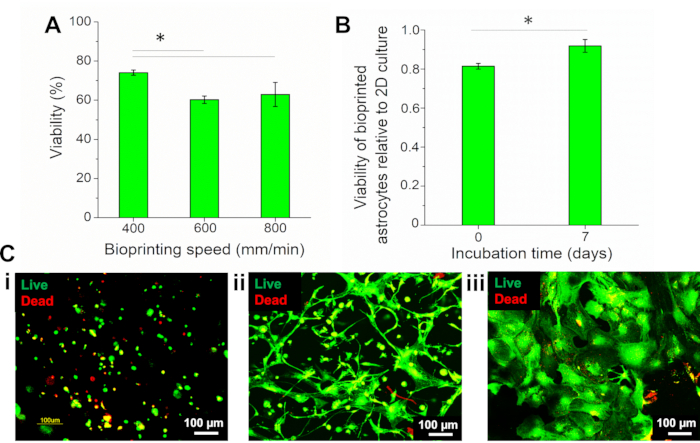
Figure 4: Évaluation de la viabilité des astrocytes bioimprimés. (A) Viabilité des astrocytes bioimprimés à différentes vitesses. (B) Viabilité des astrocytes bioimprimés le (i) jour 0 (juste après la bioimpression) et (ii) après 7 jours de bioimpression, normalisés à la viabilité des astrocytes en culture 2D. Analyse statistique au moyen d’Anova unidirectionnelle avec le test de Tukey, n = 3, *p < 0,05. (C) Images fluorescentes d’astrocytes colorés avec un réactif vivant/mort. Astrocytes bioimprimés le (i) jour 0 (juste après la bioimpression), (ii) jour 7, et (iii) culture 2D d’astrocytes. Grossissement de 10x. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5: Caractérisation des astrocytes bioimprimés en 3D. Immunofluorescence d’astrocytes bioimprimés en 3D après 7 jours d’incubation colorés pour (A) F-actine (phalloïdine, rouge) et noyaux (DAPI, bleu) avec un grossissement de 10x et 40x et pour (B) GFAP, vert (i) avec grossissement de 10x, (ii) Z-empilé montrant l’axe X-Y-Z de la construction bioimprimée, et (iii) image montrant l’axe X-Z des astrocytes GFAP +. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La technologie de bio-impression 3D est apparue comme une alternative de biofabrication qui permet l’ingénierie de constructions raffinées qui ressemblent structurellement et physiologiquement à des tissus natifs22, y compris le cerveau23. La biofabrication de tissus de type neuronal permet une modélisation in vitro du microenvironnement natif, étant un outil important pour comprendre les mécanismes cellulaires et moléculaires associés au développement et au traitement de nombreuses maladies qui affectent leSNC 11. En raison du rôle important des cellules gliales dans la fonctionnalité neuronale, les astrocytes corticaux ont été utilisés dans de nombreuses études, telles que le développement du cerveau24,le transport des biomolécules25,l’excroissance des neurites26et la biofabrication de tissus semblables au cerveau14.
Les méthodes d’ingénierie de la culture 3D d’astrocytes ont été rapportées précédemment, en utilisant différents biomatériaux et techniques d’échafaudage27,28,29. De même, une méthode de bioimpression 3D d’agrégats neuronaux dérivés de cellules souches pluripotentes induites par l’homme (hiPSC) a également été rapportée, et a montré la capacité de ces cellules bioimprimées à se différencier et à mûrir in vitro30. Cependant, il n’y a pas de rapports de méthodes de biofabrication de constructions d’astrocytes brio-imprimées en 3D dans la littérature. Ensuite, ce protocole visait à décrire une méthode reproductible de bioimpression 3D des astrocytes corticaux.
Dans ce protocole, les astrocytes ont été isolés des cortex cérébraux de chiots souris C57Bl/6, un modèle animal largement utilisé dans la recherche31,32, qui peut être remplacé par des astrocytes dérivés d’autres sources, telles que les hiPSC et la moelle épinière. Après isolement, culture et sous-culture, les astrocytes restent dans un état prolifératif jusqu’au passage 3, qui est le nombre maximal de fractionnement recommandé en raison de leur limitation intrinsèque de prolifération8. Il a été vérifié que la prolifération des astrocytes du passage 4 était limitée, étant difficile d’atteindre la quantité souhaitée de cellules pour la bioimpression 3D.
Dans la méthode décrite, une concentration de 1,0 x 106 cellules/mL de solution de biomatériau a été utilisée, comme preuve de concept pour évaluer la capacité des cellules à survivre au processus de bio-impression et à maintenir leur viabilité et leurs propriétés intrinsèques pendant la culture dans l’hydrogel. Dans les travaux précédents, un tissu de type neuronal bioimprimé en 3D a été biofabriqué en co-cultivant des astrocytes et des neurones, et pour augmenter l’interaction cellulaire, la concentration d’astrocytes était de 8,0 x10 6 cellules / mL14. Ensuite, la concentration de cellules peut être optimisée pour des études spécifiques.
Une bioencentielle pour la bioimpression 3D est composée de cellules et d’un biomatériau ou d’une combinaison de biomatériaux33. Dans ce protocole, une combinaison de gélatine / GelMA / fibrinogène a été utilisée, ce qui s’est avéré favorable à la fois à la bioimpression et au maintien des astrocytes en culture. La production d’une bioencentrable bioencaissable est difficile lorsqu’on utilise une technique de bio-impression basée sur l’extrusion. La composition du biomatériau doit posséder des propriétés viscoélastiques qui, en même temps, permettent l’extrusion de la bioencastre, tout en conservant la forme 3D après le processus d’impression34. En outre, il devrait être en mesure de maintenir la viabilité cellulaire pendant le processus, ce qui, selon les conditions de bio-impression, peut provoquer un stress de cisaillement des cellules conduisant à la mort35.
La bioimprimabilité a été assurée par la gélatine, un biomatériau qui possède des propriétés viscoélastiques optimales en raison de sa capacité de transition sol-gel36. Cela permet aux macromolécules de gélatine de se réorganiser et de se comporter comme un fluide pendant l’extrusion, et comme un gel après la bioimpression, en maintenant la structure 3D. De plus, en tant que dérivé du collagène, la gélatine est composée de répétitions de triplets peptidiques glycine-acides aminés, qui assurent la spécificité cellulaire21. Cependant, les liaisons intra et intermoléculaires de la gélatine sont faibles et, en raison de sa thermoréversibilité, la gélatine n’a aucune stabilité à 37 ° C, étant libérée de la construction pendant la culture cellulaire. Par conséquent, GelMA est devenu une alternative en tant qu’hydrogel stable, en raison des liaisons covalentes formées après l’exposition à la lumière UV, maintenant les propriétés de spécificité cellulaire19. Les propriétés physiques de GelMA, telles que la porosité, la dégradation et le module élastique, peuvent être ajustées pour s’adapter à différentes applications d’ingénierie tissulaire19. La rigidité des échafaudages GelMA peut être contrôlée en faisant varier la substitution méthacryloyle37,permettant d’obtenir une rigidité similaire à celle du tissu à modéliser. C’est-à-dire qu’en diminuant le degré de fonctionnalisation, une rigidité plus faible peut être obtenue37. Par conséquent, en raison de la douceur du cerveau de la souris38,39 et de l’effet direct de la rigidité de la matrice extracellulaire (ECM) sur le comportement cellulaire40, dans ce protocole, un faible degré de fonctionnalisation de la gélatine a été proposé. Dans les travaux précédents, la capacité des hydrogels GelMA à imiter les caractéristiques physiques du SNC, montrant une grande aptitude à la culture d’astrocytes, de neurones et de cellules souches neurales14,41,42 a été rapportée.
Outre GelMA, le fibrinogène, un biopolymère natif qui forme des fibres de fibrine par réaction enzymatique, a également été largement utilisé pour biofabriquer des tissus de type neuronal, montrant une grande spécificité et offrant un microenvironnement approprié pour que les cellules neurales se fixent et se développent30,43,44. D’autres biomatériaux, tels que l’alginate et le chitosane, ont été utilisés pour bioimprimer des tissus de type neural, mélangés à de la gélatine, du GelMA et /ou du fibrinogène, dans le but d’améliorer l’imprimabilité et les propriétés physiques des échafaudages3D 14,30. Dans la présente méthode, une bioimpressibilité optimale, une stabilité physique et une spécificité cellulaire ont été obtenues en utilisant la gélatine, le GelMA et le fibrinogène comme composants de la bioencentre. Afin d’augmenter la reconnaissance des astrocytes dans le microenvironnement, la laminine, un composant de l’ECM cérébral, a été utilisée pour compléter la bioencienne.
Dans ce protocole, la gélatine a été utilisée à une concentration de 4% (p/v), ce qui a permis la transition sol-gel de la bioenfanteur à 25 °C en environ 10 min. Une gélification plus rapide peut être obtenue en augmentant la concentration de gélatine. Cependant, la stérilisation par filtration à l’aide d’un filtre de 0,2 μm peut être compromise. La filtration bioink est une étape critique, vérifiant que des concentrations plus élevées de gélatine (>5% p / v) peuvent empêcher la filtration. Une alternative pour obtenir un point de gélification plus rapide pendant la bioimpression est de laisser la seringue contenant la bioencaire à 4 °C pendant 2 min avant de la connecter à la tête d’impression de la bioimprimante. Après la bioimpression, il est crucial de maintenir la construction à 25 °C pour éviter de déstabiliser la structure 3D et maintenir un état de gel avant l’exposition aux UV. Notamment, la construction doit être solide lorsque la solution de réticulation de fibrinogène est ajoutée à la plaque. Pour la réticulation GelMA, il est important de retourner l’échantillon (2 x 60 s de chaque côté) pour assurer une exposition aux UV tout au long de la construction. Pour la réticulation du fibrinogène, la solution de réticulation doit couvrir complètement la construction. Par conséquent, si vous utilisez un plat ou une assiette plus grand, le volume doit être ajusté. Après la réticulation, l’hydrogel doit avoir l’air homogène sous microscopie à contraste de phase et les cellules doivent être réparties de manière homogène dans toute la construction, possédant une morphologie ronde.
Ce protocole a permis à la bioense gélatine/GelMA/fibrinogène d’imprimer des structures de différentes formes, en maintenant l’intégrité et la forme 3D des constructions. En raison des limites de la température pour atteindre 25 ° C à l’intérieur du flux laminaire, la bio-impression a été effectuée dans la salle de culture à l’extérieur du flux laminaire. Le temps de bio-impression était d’environ 1 min pour chaque échantillon, et aucune contamination n’a été observée pendant la culture cellulaire.
L’intégrité cellulaire peut être affectée par la bioimpression, en raison de la contrainte de cisaillement causée dans le processus35. Cela peut être contrôlé en optimisant les paramètres d’impression, tels que la vitesse d’impression. Dans ce travail, différentes vitesses de bio-impression ont été testées, 400, 600 et 800 mm / min, observant une diminution significative de la viabilité des cellules lorsque la vitesse était augmentée de 400 à 600 mm / min. À 400 mm/min, environ 74% des cellules sont restées viables après la bioimpression, et cette valeur a augmenté de manière significative après 7 jours d’incubation (>80%). Par conséquent, des vitesses plus faibles n’ont pas été utilisées afin d’éviter l’exposition excessive des cellules à l’environnement. La culture 2D d’astrocytes a montré une viabilité plus élevée (~ 90%) par rapport aux cellules bioimprimées. Cependant, comme le montrent les images fluorescentes, la morphologie est affectée par le type de culture. Alors que les cellules 2D étaient plates, les astrocytes dans un environnement 3D possédaient une forme d’étoile, s’interconnectant les uns aux autres par des processus cellulaires.
Notamment, le microenvironnement mimétique était favorable à la culture d’astrocytes corticaux, car la viabilité cellulaire augmentait significativement après 1 semaine, suggérant une prolifération cellulaire dans la construction. La laminine, une glycoprotéine présente dans l’ECM cérébral, a été ajoutée à la bioenfanteur dans le but d’obtenir une plus grande adhérence des astrocytes à l’hydrogel14. La coloration du cytosquelette F-actine a montré que les astrocytes bioimprimés étaient en haute densité dans la construction, indiquant que la concentration cellulaire utilisée dans ce protocole permettait l’interconnexion des astrocytes. L’immunohistochimie pour la localisation du GFAP, un marqueur corrélé à l’arborisation extensive des astrocytes et à l’hypertrophie cellulaire45,corroborée par la coloration de la F-actine, a montré que les cellules présentaient une morphologie astrocytaire typique, indiquant que le système 3D mimétique était favorable pour que les cellules se fixent et se comportent comme dans leur environnement natif.
Le protocole présenté ici décrit une procédure efficace et reproductible pour la bioimpression 3D des astrocytes corticaux. En raison de l’importance des astrocytes dans la réponse de neuroinflammation aux blessures, ainsi que dans la régulation de la fonctionnalité neuronale, les études impliquant cette cellule gliale pourraient contribuer à de nombreux aspects dans la compréhension des maladies qui affectent le SNC. Par conséquent, le modèle 3D in vitro présenté ici est utile dans les applications futures qui visent à étudier les interactions astrocyte-neurone, la fonctionnalité des astrocytes dans les pathologies cérébrales et le potentiel des astrocytes en tant que cibles thérapeutiques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit à divulguer.
Remerciements
Ce travail a été soutenu par la Fondation de recherche de São Paulo (FAPESP), numéros de subvention 2018/23039-3 et 2018/12605-8; Conseil national pour le développement scientifique et technologique (CNPq), numéros de subvention 465656/2014-5 et 309679/2018-4; et Coordination pour l’amélioration du personnel de l’enseignement supérieur (CAPES), code financier 001.
matériels
| Name | Company | Catalog Number | Comments |
| 3D Bioprinter | 3D Biotechnology Solutions | Extrusion-based bioprinter | |
| Blunt-tip forceps | Integra Miltex | 6--30 | Forceps for brain dissection previously sterilized |
| Bovine serum albumin | Sigma-Aldrich | 9048-46-8 | Protease free, fatty acid free, essentially globulin free |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | |
| Cell culture flask | Fisher Scientific | 156340 | Culture flask T25 |
| Cell strainer | Corning Incorporated | 352340 | Cell strainer 40 µm |
| Confocal microscope | Leica | Confocal TCS SP8 microscopy coupled with an Olympus FluoView 300 confocal system | |
| Conical tubes | Thermo Scientific | 339651, 339652 | Sterile tubes of 15 mL and 50 mL |
| DAPI | Abcam | ab224589 | DAPI staining solution |
| DMEM/F12 | Gibco; Life Technologies Corporation | 12500062 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Dyalisis tubing | Sigma-Aldrich | D9527 | Molecular weight cut-off = 14 kDa |
| Ethanol | Fisher Scientific | 64-15-5 | Reagent grade |
| Fetal Bovine Serum | Gibco; Life Technologies Corporation | 12657011 | Research Grade |
| Fibrinogen | Sigma-Aldrich | 9001-32-5 | Fibrinogen cristalline powder from bovine plasma |
| Gelatin | Sigma-Aldrich | 9000-70-8 | Gelatin powder from porcine skin |
| Glycine | Sigma-Aldrich | 56-40-6 | Glycine powder |
| Hanks Buffered Salt Solution (HBSS) | Gibco; Life Technologies Corporation | 14175095 | No calcium, no magnesium, no phenol red |
| L-Glutamine | Sigma-Aldrich | 56-85-9 | L-Glutamine crystalline powder |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin 1-2 mg/mL L in 50 mM Tris-HCl |
| Live dead kit cell imaging kit | Thermo Scientific | R37601 | Green fluorescence in live cells (ex/em 488 nm/515 nm). Red fluorescence in dead cells (ex/em 570 nm/602 nm) |
| Methacrylic anhydride | Sigma-Aldrich | 760-93-0 | For GelMA preparation |
| Microtubes | Corning Incorporated | MCT-150-C | Microtubes of 1,5 mL |
| NaCl | Sigma-Aldrich | 7647-14-5 | |
| Needle 22G | Fisher Scientific | NC1362045 | Sterile blunt needle |
| Operating scissor | Integra Miltex | 05--02 | Sharp scissor for brain dissection previously sterilized |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | Paraformaldehyde powder |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | 15070063 | Pen Strep (5,000 Units/ mL Penicillin; 5,000 ug/mL Streptomycin) |
| Petri dish | Corning Incorporated | 430591, 430588 | Sterile petri dishes of 35 and 100 mm |
| Phalloidin | Abcam | ab176753 | iFluor 488 reagent |
| Photoinitiator | Sigma-Aldrich | 106797-53-9 | 2-Hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone |
| Phosphate buffer saline (PBS) | Gibco; Life Technologies Corporation | 10010023 | PBS 1 x, culture grade, no calcium, no magnesium |
| Poly-L-lysine | Sigma-Aldrich | 25988-63-0 | Poly-L-lysine hydrobromide mol wt 30,000-70,000 |
| Primary antobody | Abcam | ab4674 | Chicken polyclonal to GFAP |
| Secondary antibody | Abcam | ab150176 | Alexa fluor 594 anti-chicken |
| Spatula | Miltex | V973-70 | Number 24 cement spatula previously sterilized |
| Stereomicroscope | Fisherbrand | 3000038 | Microscope for brain dissection |
| Syringe 5 mL | BD | 1222C84 | Sterile syringe |
| Syringe filter 2 µm | Fisher Scientific | 09-740-105 | Polypropylene filter for sterilization |
| Thrombin | Sigma-Aldrich | 9002--04-4 | Thrombin cristalline powder from bovine plasma |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Laboratory grade |
| Trypsin-EDTA | Gibco; Life Technologies Corporation | 15400054 | Trypsin no phenol red 1 x diluted in PBS |
| Versene solution | Gibco; Life Technologies Corporation | 15040066 | Versene Solution (0.48 mM) formulated as 0.2 g EDTA(Na4) per liter of PBS |
| Well plate | Thermo Scientific | 144530 | Sterile 24-well plate |
Références
- Di, L., Mannelli, C., Cuzzocrea, S. Astrocytes: Role and functions in brain pathologies. Frontiers in Pharmacology. 10, 1114(2019).
- Kimelberg, H. K., Nedergaard, M. Functions of astrocytes and their potential as therapeutic targets. Neurotherapeutics. 7 (4), 338-353 (2010).
- Giovannoni, F., Quintana, F. J. The role of astrocytes in CNS inflammation. Trends in Immunology. 41 (9), 805-819 (2020).
- Escartin, C., et al. Reactive astrocyte nomenclature, definitions, and future directions. Nature Neuroscience. 24 (3), 312-325 (2021).
- Carson, M. J., Thrash, J. C., Walter, B. The cellular response in neuroinflammation: The role of leukocytes, microglia and astrocytes in neuronal death and survival. Clinical Neuroscience Research. 6 (5), 237-245 (2006).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Clarke, L. E., et al. Normal aging induces A1-like astrocyte reactivity. Proceedings of the National Academy of Sciences of the Unied States of America. 115 (8), 1896-1905 (2018).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes isolation and culture of mouse cortical astrocytes. Journal of Visualized Experiments: JoVE. (71), e50079(2013).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Knight, E., Przyborski, S. Advances in 3D cell culture technologies enabling tissue-like structures to be created in vitro. Journal of Anatomy. 227 (6), 746-756 (2015).
- Zhuang, P., Sun, A. X., An, J., Chua, C. K., Chew, S. Y. 3D neural tissue models: From spheroids to bioprinting. Biomaterials. 154, 113-133 (2018).
- Balasubramanian, S., Packard, J. A., Leach, J. B., Powell, E. M. Three-dimensional environment sustains morphological heterogeneity and promotes phenotypic progression. Tissue Engineering. Part A. 22 (11-12), 885-898 (2016).
- Watson, P. M. D., Kavanagh, E., Allenby, G., Vassey, M. Bioengineered 3D glial cell culture systems and applications for neurodegeneration and neuroinflammation. SLAS Discovery. 22 (5), 583-601 (2017).
- Li, Y. E., Jodat, Y. A., Samanipour, R., Zorzi, G., Zhu, K. Toward a neurospheroid niche model: optimizing embedded 3D bioprinting for fabrication of neurospheroid brain-like co-culture constructs. Biofabrication. , (2020).
- Zhou, X., et al. Three-dimensional-bioprinted dopamine-based matrix for promoting neural regeneration. ACS Applied Materials & Interfaces. 10 (10), 8993-9001 (2018).
- de la Vega, L., et al. 3D bioprinting human induced pluripotent stem cell-derived neural tissues using a novel lab-on-a-printer technology. Applied Sciences. 8 (12), 2414(2018).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Ariens, R. A. S., Lai, T., Weisel, J. W., Greenberg, C. S., Grant, P. J. Role of factor XIII in fibrin clot formation and effects of genetic polymorphisms. Blood. 100 (3), 743-754 (2002).
- Yue, K., et al. Synthesis, properties, and biomedical applications of Gelatin Methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- de Melo, B. A. G., et al. Strategies to use fibrinogen as bioink for 3D bioprinting fibrin-based soft and hard tissues. Acta Biomaterialia. 117, 60-76 (2020).
- Wang, X., et al. Gelatin-based hydrogels for organ 3D bioprinting. Polymers (Basel). 9 (9), 401(2017).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Naure. Biotechnology. 32 (8), 773-785 (2014).
- de la Vega, L., Lee, C., Sharma, R., Amereh, M., Willerth, S. M. 3D bioprinting models of neural tissues: The current state of the field and future directions. Brain Research Bulletin. 150, 240-249 (2019).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Hanu, R., et al. Monocarboxylic acid transporters, MCT1 and MCT2, in cortical astrocytes in vitro and in vivo. American Journal of Physiology. Cell Physiology. 278 (5), 921-930 (2000).
- Liu, R., Wang, Z. h, Gou, L., Xu, H. A cortical astrocyte subpopulation inhibits axon growth in vitro and in vivo. Molecular Medicine Reports. 12 (2), 2598-2606 (2015).
- Winter, C. C., Cullen, D. K., Donnell, J. C. O., Song, Y. J., Hernandez, N. S. Three-dimensional tissue engineered aligned astrocyte networks to recapitulate developmental mechanisms and facilitate nervous system regeneration. Journal of Visualized Experiments: JoVE. (131), e55848(2018).
- East, E., Golding, J. P., Phillips, J. B. A versatile 3D culture model facilitates monitoring of astrocytes undergoing reactive gliosis. Journal of Tissue Engineering and Regenerative Medicine. 3 (8), 634-646 (2009).
- Hawkinsn, B. T., Grego, S., Sellgren, K. L. Three-dimensional culture conditions differentially affect astrocyte modulation of brain endothelial barrier function in response to transforming growth factor B1. Brain Research. 1608, 167-176 (2015).
- Abelseth, E., et al. 3D printing of neural tissues derived from human induced pluripotent stem cells using a fibrin-based bioink. ACS Biomaterials Science and Engineering. 5 (1), 234-243 (2019).
- Filippo, T. R. M., et al. CXCL12 N-terminal end is sufficient to induce chemotaxis and proliferation of neural stem/progenitor cells. Stem Cell Research. 11 (2), 913-925 (2013).
- Galindo, L. T., et al. Chondroitin sulfate impairs neural stem cell migration through ROCK activation. Molecular Neurobiology. 55 (4), 3185-3195 (2018).
- Groll, J., et al. A definition of bioinks and their distinction from biomaterial inks. Biofabrication. 11 (1), 03001(2018).
- Kyle, S., Jessop, Z. M., Al-sabah, A., Whitaker, I. S. Printability of candidate biomaterials for extrusion-based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), (2017).
- Blaeser, A., et al. Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity. Advanced Healthcare Materials. 5 (3), 326-333 (2016).
- Miyawaki, O., Omote, C., Matsuhira, K. Thermodynamic analysis of sol-gel transition of gelatin in terms of water activity in various solutions. Biopolymers. 103 (12), 685-691 (2015).
- Shirahama, H., Lee, B. H., Tan, L. P., Cho, N. Precise tuning of facile one-pot Gelatin Methacryloyl (GelMA) synthesis. Science Reports. 6, 31036(2016).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Science Reports. 8 (1), 12517(2018).
- Iwashita, M., et al. Comparative analysis of brain stiffness among amniotes using glyoxal fixation and atomic force microscopy. Frontiers in Cell and Developmental Biology. 8, 574619(2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews. 5, 351-370 (2010).
- Ye, W., et al. 3D printing of gelatin methacrylate-based nerve guidance conduits with multiple channels. Materials and Design. 192, 108757(2020).
- Wu, Y., et al. The influence of the stiffness of GelMA substrate on the outgrowth of PC12 cells. Bioscience Reports. 39 (1), 1-9 (2019).
- Edgar, J. M., Robinson, M., Willerth, S. M. Fibrin hydrogels induce mixed dorsal/ventral spinal neuron identities during differentiation of human induced pluripotent stem cells. Acta Biomaterialia. 51, 237-245 (2017).
- Arulmoli, J., et al. Combination scaffolds of salmon fibrin, hyaluronic acid, and laminin for human neural stem cell and vascular tissue engineering. Acta Biomaterialia. 43, 122-138 (2016).
- Brenner, M. Role of GFAP in CNS Injuries. Neuroscience. Letters. 565, 7-13 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon