Method Article
Bioprinting 3D di astrociti corticali murini per l'ingegneria del tessuto neurale
In questo articolo
Riepilogo
Qui riportiamo un metodo di bioprinting 3D di astrociti corticali murini per biofabbricare tessuti neurali simili per studiare la funzionalità degli astrociti nel sistema nervoso centrale e i meccanismi che coinvolgono le cellule gliali nelle malattie e nei trattamenti neurologici.
Abstract
Gli astrociti sono cellule gliali con un ruolo essenziale nel sistema nervoso centrale (SNC), compreso il supporto neuronale e la funzionalità. Queste cellule rispondono anche alle lesioni neurali e agiscono per proteggere il tessuto da eventi degenerativi. Gli studi in vitro sulla funzionalità degli astrociti sono importanti per chiarire i meccanismi coinvolti in tali eventi e contribuire allo sviluppo di terapie per il trattamento dei disturbi neurologici. Questo protocollo descrive un metodo per biofabbricare una struttura tissutale simile a quella neurale ricca di astrociti mediante bioink 3D bioprinting carico di astrociti. In questo lavoro è stato utilizzato un bioprinter 3D basato sull'estrusione e gli astrociti sono stati estratti dalle cortecce cerebrali dei cuccioli di topi C57Bl / 6. Il bioink è stato preparato mescolando astrociti corticali fino al passaggio 3 in una soluzione di biomateriale composta da gelatina, gelatina-metacriloile (GelMA) e fibrinogeno, integrata con laminina, che presentava condizioni ottimali di bioprinting. Le condizioni di bioprinting 3D hanno ridotto al minimo lo stress cellulare, contribuendo all'elevata vitalità degli astrociti durante il processo, in cui il 74,08% ± l'1,33% delle cellule erano vitali subito dopo la bioprinting. Dopo 1 settimana di incubazione, la vitalità degli astrociti è aumentata significativamente all'83,54% ± al 3,00%, indicando che il costrutto 3D rappresenta un microambiente adatto per la crescita cellulare. La composizione del biomateriale permetteva l'attaccamento cellulare e stimolava il comportamento astrocitico, con cellule che esprimevano lo specifico marcatore astrocitario della proteina acida fibrillare gliale (GFAP) e possedevano la tipica morfologia astrocitica. Questo protocollo riproducibile fornisce un metodo prezioso per biofabbricare tessuto neurale 3D ricco di astrociti che assomiglia al microambiente nativo delle cellule, utile ai ricercatori che mirano a comprendere la funzionalità degli astrociti e la loro relazione con i meccanismi coinvolti nelle malattie neurologiche.
Introduzione
Gli astrociti sono il tipo di cellula più abbondante nel sistema nervoso centrale (SNC) e svolgono un ruolo chiave nell'omeostasi cerebrale. Oltre a sopportare il supporto neuronale, gli astrociti sono responsabili della modulazione dell'assorbimento dei neurotrasmettitori, del mantenimento dell'integrità della barriera emato-encefalica e della regolazione della sinaptogenesi neuronale1,2. Gli astrociti hanno anche un ruolo essenziale nell'infiammazione del SNC, rispondendo alle lesioni al cervello in un processo che porta alla reattività astrologica o all'astrogliosi reattiva3,4,formando una cicatrice gliale che impedisce l'esposizione di tessuti sani ad agenti degenerativi5. Questo evento provoca cambiamenti nell'espressione genica, nella morfologia e nella funzione degli astrociti6,7. Pertanto, gli studi che coinvolgono la funzionalità degli astrociti sono utili per lo sviluppo di terapie per il trattamento di disturbi neurologici.
I modelli in vitro sono cruciali per lo studio dei meccanismi legati alle lesioni neurologiche e, sebbene siano stati stabiliti un isolamento di successo e una coltura bidimensionale (2D) di astrociti corticali8, questo modello non riesce a fornire un ambiente realistico che imita il comportamento delle cellule native e a riprodurre la complessità del cervello9 . In condizioni 2D, lo scarso supporto meccanico e biochimico, le basse interazioni cellula-cellula e cellula-matrice e l'appiattimento cellulare che porta all'assenza di polarità basale-apicale, influenzano la dinamica della segnalazione cellulare e gli esiti sperimentali che portano a un'alterata morfologia cellulare e all'espressione genica, che compromettono la risposta ai trattamenti10. Pertanto, è fondamentale sviluppare alternative che forniscano un ambiente neurale più realistico, con l'obiettivo di tradurre i risultati in clinica.
La coltura cellulare tridimensionale (3D) rappresenta un modello più avanzato che ricapitola con maggiore fedeltà le caratteristiche di organi e tessuti, tra cui il CNS11. Per quanto riguarda la coltura gliale, i modelli 3D contribuiscono al mantenimento della morfologia degli astrociti, della polarità basale-apicale cellulare e della segnalazione cellulare12,13. La tecnologia di bioprinting 3D è emersa come un potente strumento per biofabbricare tessuti viventi 3D in modo controllato utilizzando cellule e biomateriali per ricreare la struttura e le proprietà dei tessuti nativi. L'utilizzo di questa tecnologia ha portato ad un sostanziale miglioramento della previsione dei risultati e ha contribuito alla medicina rigenerativa applicata al SNC 14,15,16.
Il protocollo qui descritto descrive in dettaglio l'isolamento e la coltura degli astrociti corticali. Il protocollo descrive anche un metodo riproducibile per biostampare astrociti incorporati in gelatina / gelatina metacriloil (GelMA) / fibrinogeno, integrato con laminina. In questo lavoro, una biostampante basata sull'estrusione è stata utilizzata per stampare la composizione del biomateriale contenente astrociti corticali ad una densità di 1 x10 6 cellule / ml. Lo stress di taglio della biostampa è stato ridotto al minimo controllando la velocità di stampa e gli astrociti hanno mostrato un'elevata vitalità dopo il processo. I costrutti biostampati sono stati coltivati per 1 settimana e gli astrociti sono stati in grado di diffondersi, attaccarsi e sopravvivere all'interno dell'idrogel, mantenendo la morfologia astrocitica ed esprimendo uno specifico marcatore della proteina acida fibrillare gliale (GFAP)4.
Questa procedura è compatibile con bioprinter a base di estrusione azionata da pistone e può essere utilizzata per biostampare astrociti derivati da fonti diverse. Il modello biostampato 3D qui proposto è adatto per una vasta gamma di applicazioni di ingegneria neurale, come gli studi dei meccanismi coinvolti nella funzionalità degli astrociti nei tessuti sani e la comprensione della progressione delle patologie neurologiche e lo sviluppo del trattamento.
Protocollo
Tutte le procedure che coinvolgono gli animali hanno seguito le linee guida internazionali per l'uso degli animali nella ricerca (http://www.iclas.org) e sono state approvate dal Comitato per l'etica nella ricerca dell'Universidade Federal de São Paulo (CEUA 2019 / 9292090519).
1. Dissezione cerebrale dei topi
- Trasferire 10 mL di soluzione salina tamponata Hanks (HBSS) fredda in una soluzione di coltura da 100 mm e 1 mL in un microtubo da 1,5 mL. Preparare un microtubo per animale.
NOTA: Sia il piatto di coltura che il microtubo devono essere tenuti sul ghiaccio. - Preparare il terreno di coltura degli astrociti utilizzando DMEM F12 + 10% di siero bovino fetale (FBS), 2% di glutammina e 1% di penicillina-streptomicina (P / S). Sterilizzare il mezzo filtrando utilizzando un filtro da 0,2 μm.
- Eutanasia cuccioli di topi C57Bl/6 (giorno 1 postnatale) per decapitazione usando una forbice affilata. Usando la pince, tirare la pelle ed esporre il cranio. Assicurarsi che sia le forbici che le pinza siano sterilizzate con etanolo al 70%.
- Tagliare il cranio dal foramen magnum alla sommità della testa lungo il piano sagittale usando una forbice a punta ricurva affilata.
NOTA: Assicurarsi che il tessuto encefalico non sia danneggiato. - Utilizzando una spatola precedentemente sterilizzata con etanolo al 70%, sollevare il cervello dalla cavità cranica e posizionarlo nel piatto di coltura contenente 10 ml di HBSS freddo.
- Posizionare il piatto di coltura contenente il cervello sotto lo stereomicroscopio e, usando due pinci a punta smussata, rimuovere le meningi dal cervello (Figura 1).
- Separare le cortecce dal resto del cervello facendole rotolare delicatamente lontano dalla linea mediana del cervello usando una spatola.
- Raccogliere entrambe le cortecce e trasferirle immediatamente nello stesso microtubo contenente 1 mL di HBSS freddo.
2. Isolamento e coltura degli astrociti
- Sotto il flusso laminare, tagliare il tessuto corticale in piccoli pezzi usando una micro forbice curva e lavarli con 1 mL di HBSS tubando su e giù 3x. Attendi che il tessuto si stabilizzi. Rimuovere HBSS e aggiungere HBSS fresco, ripetendo il processo altre due volte.
- Rimuovere HBSS e incubare il tessuto con 1 mL di tripsina allo 0,05% a 37 °C per 5 minuti.
NOTA: Solo la digestione della tripsina è sufficiente a questo punto. - Dissociare meccanicamente il tessuto tubando delicatamente su e giù 15 volte.
NOTA: La completa dissociazione del tessuto è osservata dall'aumento della torbidità della sospensione e dall'assenza di grandi frammenti di tessuto nella sospensione. - Trasferire la soluzione in un tubo conico da 15 mL, neutralizzare l'attività della tripsina aggiungendo un volume uguale di FBS e filtrare la soluzione in un filtro filtrante cellulare di 0,4 μm per rimuovere i frammenti non dissociati.
- Lavare il filtro con 1 mL di mezzo astrocitario, raccogliere la sospensione cellulare che è passata attraverso il filtro e centrifugarla per 5 minuti a 200 x g e 25 °C. Dopo la centrifugazione, scartare il surnatante e sospendere il pellet in 1 mL di terreno di coltura degli astrociti.
- Trasferire la sospensione cellulare in un matraccio di coltura T25, portare il volume del mezzo a 3,5 ml e incubare le cellule a 37 °C e 5% CO2.
- Assicurarsi che dopo 24 ore, le cellule siano aderenti. Quindi, sostituire il mezzo e cambiarlo ogni 3 giorni.
- Dopo 7 giorni, rimuovere microglia e oligodendrociti dalla coltura lavando le cellule con 2 ml di 1x PBS.
- Sostituire la soluzione PBS con il terreno di coltura degli astrociti e lasciare il pallone di coltura in uno shaker orbitale a 180 giri/min durante la notte.
NOTA: Gli astrociti formano un monostrato confluente in circa 10-12 giorni di coltura.
3. Sintesi della gelatina metacriloil (GelMA)
- Pesare 10 g di gelatina ottenuta dalla pelle suina e sciogliere in 100 ml di PBS lasciando che la soluzione si mescolmi su una piastra riscaldante a 240 giri/min e 50 °C fino alla completa dissoluzione.
- Sotto un cappuccio, aggiungere 2 ml di anidride metacrilica (MA) per un basso grado di funzionalizzazione e lasciare che l'emulsione di gelatina si mescoli a 240 giri / min e 50 ° C per 2 ore.
ATTENZIONE: MA indicazione di pericolo: H302 + H332 (nocivo se ingerito o inalato), H311 (tossico a contatto con la pelle), 314 (provoca gravi ustioni cutanee e danni agli occhi), 315 (provoca irritazione cutanea), H317 (può causare una reazione allergica cutanea), H318 (provoca gravi danni agli occhi), 331 (tossico se inalato), H332 (dannoso se inalato), H335 (può causare irritazione respiratoria). Linee guida per la manipolazione: P261 (evitare di respirare polvere / fumi / gas / nebbia / vapori / spray), P305 + P351 + P338 + P310 (SE NEGLI OCCHI: Risciacquare con cautela con acqua per diversi minuti. Rimuovere le lenti a contatto, se presenti e facili da fare. Continuare il risciacquo. Chiamare immediatamente un CENTRO ANTIVELENI / medico), P301 + P312 + P330 (SE INGERITO: Chiamare un CENTRO ANTIVELENI / medico se non si sente bene. Risciacquare la bocca).
NOTA: Aggiungi MA molto lentamente, goccia a goccia. - Diluire la soluzione di gelatina-MA in 100 mL di PBS preriscaldato (50 °C) per ottenere 200 mL di volume finale e lasciare che la soluzione si agiti a 240 giri/min e 50 °C per 10 minuti.
- Tagliare ~ 20 cm di membrana di dialisi (cutoff molecolare 12-14 kDa) e immergerlo in acqua deionizzata fino a quando non è morbido.
NOTA: Riempire le membrane con acqua deionizzata per assicurarsi che non ci siano fori o difetti. - Utilizzando un imbuto, trasferire la soluzione di gelatina-MA alle membrane.
NOTA: Chiudere entrambi i lati lasciando spazio extra all'interno per consentire la miscela. - Posizionare le membrane contenenti la soluzione di gelatina-MA in un contenitore con 2 L di acqua distillata per la dialisi, lasciandole mescolare a 40 °C per 5 giorni (500 giri/min).
NOTA: Coprire il contenitore per evitare l'evaporazione dell'acqua. - Cambiare l'acqua distillata due volte al giorno. Ogni volta, capovolgere le membrane per l'omogeneizzazione.
- Il quinto giorno, mescolare 200 ml di acqua ultrapura preriscaldata (40 °C) alla gelatina-MA dializzata e lasciare mescolare per 15 minuti a 40 °C.
- Trasferire la soluzione di gelatina-MA in tubi conici da 50 mL fino a 25 mL e lasciare che i tubi rimangano a -80 °C per 2 giorni.
NOTA: Conservare i tubi orizzontalmente per facilitare la liofilizzazione. - Liofilizzare le soluzioni congelate per 3-5 giorni e conservare il GelMA liofilizzato al riparo dall'umidità.
4. Preparazione Bioink
NOTA: Per ottenere 1 mL di bioink, si consiglia di fabbricare almeno 3 mL di soluzione di biomateriale, in quanto potrebbero esserci perdite durante la filtrazione.
- Preparazione della soluzione di fibrinogeno
- Preparare la soluzione salina (NaCl 0,9%) in acqua deionizzata e sciogliere 10 mg di fibrinogeno dal plasma bovino in 1 mL di soluzione salina per ottenere una concentrazione di 10 mg/mL.
NOTA: poiché il fibrinogeno assorbe al vetro, non utilizzare palloni di vetro per preparare la soluzione di fibrinogeno. - Lasciare la soluzione sotto agitazione a 37 °C fino alla completa dissoluzione del fibrinogeno.
NOTA: Per la dissoluzione del fibrinogeno, utilizzare un sistema rotante posto all'interno di un forno a 37 °C. È adatta anche l'agitazione magnetica (180 giri/min) del fibrinogeno su una piastra calda a 37 °C. In questa condizione, 10 mg/mL fibrinogen richiede circa 40 minuti per dissolversi.
- Preparare la soluzione salina (NaCl 0,9%) in acqua deionizzata e sciogliere 10 mg di fibrinogeno dal plasma bovino in 1 mL di soluzione salina per ottenere una concentrazione di 10 mg/mL.
- Preparazione della soluzione di gelatina/GelMA
- Pesare 0,12 g di gelatina e aggiungerla a 1,9 ml di PBS preriscaldato (40 °C) per ottenere una concentrazione finale del 4% (p/v) di gelatina. Vortice per facilitare la dissoluzione.
- Mantenere l'emulsione a 40 °C fino alla completa dissoluzione.
- Pesare 0,06 g di GelMA liofilizzato e trasferirlo nella soluzione di gelatina per ottenere una concentrazione finale del 2% (p/v) di GelMA. Vortice per facilitare la dissoluzione.
- Conservare la soluzione a 40 °C fino alla completa dissoluzione.
- Preparazione di bioink gelatina/GelMA/fibrinogeno carico di astrociti
- Pipettare 0,9 mL della soluzione di fibrinogeno da 10 mg/mL e trasferire alla soluzione di gelatina/GelMA per ottenere una concentrazione finale di 3 mg/mL di fibrinogeno.
- Pesare 0,015 g di fotoiniziatore (PI) e trasferirlo nella soluzione di gelatina/GelMA/fibrinogeno per ottenere una concentrazione finale dello 0,5% (p/v) PI. Mescolare la soluzione capovolgendo il tubo su e giù e tenerlo a 40 °C al riparo dalla luce per evitare la degradazione del PI.
NOTA: Immagazzinare il bioink a 4 °C per un massimo di 24 ore. - Sotto il flusso laminare, filtrare la soluzione utilizzando un filtro da 0,2 μm in un tubo conico sterile da 15 mL.
NOTA: la soluzione di biomateriale deve essere a 37-40 °C per consentire la filtrazione. - Trasferire 980 μL della soluzione di biomateriale in un tubo conico da 15 mL.
- Diluire laminina in soluzione salina per ottenere una soluzione stock di 100 μg/mL.
- Pipettare 20 μL di laminina e trasferire al tubo contenente il bioink per ottenere una concentrazione finale di 2 μg/mL di laminina.
- Mescolare delicatamente pipettando su e giù, evitando bolle. Se persistono bolle, centrifugare il tubo conico a 200 x g per 2 minuti. Mantenere il bioink a 37 °C fino a quando non viene miscelato con le cellule.
- Tripsinizzare gli astrociti primari con tripsina 0,05% per 5 minuti.
NOTA: Utilizzare astrociti dai passaggi da 1 a 3. - Neutralizzare l'attività della tripsina con FBS in un rapporto di 1:1 e trasferire le cellule in un tubo conico da 15 ml. Centrifuga a 200 x g per 5 min.
- Contare le cellule e trasferire 1 x 106 celle in un tubo conico diverso. Centrifuga a 200 x g per 5 min.
- Rimuovere il surnatante lasciando un piccolo volume (~200 μL) per sospendere il pellet cellulare, picchiettando delicatamente il fondo del tubo conico.
- Trasferire 1 mL di gelatina/GelMA/soluzione di fibrinogeno nel tubo contenente le cellule e pipettare delicatamente su e giù per omogeneizzare, ottenendo una concentrazione finale di 1 x 106 cellule/mL.
5. Preparazione della soluzione reticolante
- Ricostituzione della trombina
- Preparare una soluzione stock di trombina 100 U/mL in acqua deionizzata sterile con albumina sierica bovina allo 0,1% (p/v) (BSA) in un tubo conico da 15 mL. Stock in microtubi a -20 °C.
NOTA: poiché la trombina assorbe al vetro, non utilizzare palloni di vetro per preparare la soluzione stock o conservare le aliquote.
- Preparare una soluzione stock di trombina 100 U/mL in acqua deionizzata sterile con albumina sierica bovina allo 0,1% (p/v) (BSA) in un tubo conico da 15 mL. Stock in microtubi a -20 °C.
- Preparazione della soluzione di trombina-CaCl2
- Pipettare 100 μL di soluzione stock di trombina e trasferire in un tubo conico da 50 mL contenente 8,9 mL di acqua deionizzata sterile per ottenere una concentrazione finale di 1 U/mL di trombina.
- Preparare una soluzione di CaCl2 al 10% (p/v) in acqua deionizzata e sterilizzare utilizzando un filtro da 0,2 μm.
- Trasferire 1,1 mL della soluzione di CaCl2 al 10% al tubo conico contenente trombina, al fine di ottenere un rapporto finale di 1:9 (CaCl2 a trombina).
NOTA: preparare la soluzione di reticolante al volume da utilizzare nell'esperimento, evitando la memorizzazione.
6. Bioprinting astrocytes-laden bioink utilizzando un bioprinter basato sull'estrusione
- Progettazione del tessuto neurale
- Usando il codice G: costruisci una griglia di 6 x 6 mm (forma quadrata) con 1 mm di distanza tra ogni linea biostampata sull'asse X e Y e 6 strati sull'asse Z (0,2 mm tra ogni linea); impostare l'estrusione (E) a 0,01 mm, aumentando di 0,001 mm ad ogni nuovo strato dell'asse Z; e impostare la velocità di stampa (F) su 400 mm/min (Informazioni supplementari).
- Configurazione di Bioprinter
- Esporre la macchina alla luce UV per 15 minuti, quindi pulirla con etanolo al 70%.
- Accendere la bioprinter utilizzando l'interruttore di alimentazione. Collegare la macchina al computer tramite un cavo USB. Aprire il software di controllo per collegarlo alla bioprinter e caricare il design del file.
- Preparazione della siringa per bioprinting
- Trasferire il bioink di gelatina/GelMA/fibrinogeno carico di astrociti in una siringa di plastica da 5 ml utilizzando una pipetta da 1.000 μL.
NOTA: Trasferire lentamente per evitare la formazione di bolle. - Collegare un ago smussato sterile da 22 G alla siringa.
NOTA: Lasciare la siringa a 4 °C per 2 min. - Collegare la siringa alla testina di stampa della biostampante e lavare manualmente il bioink per rimuovere le bolle rimanenti.
- Trasferire il bioink di gelatina/GelMA/fibrinogeno carico di astrociti in una siringa di plastica da 5 ml utilizzando una pipetta da 1.000 μL.
- Bioprinting
NOTA: La bioprinting è stata eseguita al di fuori della cappa laminare.- Posizionare un piatto di coltura da 35 mm sul tavolo della bioprinter e posizionare l'ago a 0,1 mm di distanza dalla superficie del piatto di coltura per consentire il movimento dell'ago.
NOTA: utilizzare una parabola di coltura da 35 mm per ogni bioprinting. - Premere il pulsante Stampa.
- Una volta terminata la bioprinting, assicurarsi che la siringa si allontani dal piatto. Quindi, chiudi il piatto di cultura e preparati per il processo di reticolazione.
NOTA: La bioprinting di un costrutto richiede circa 1 min e 10 s.
- Posizionare un piatto di coltura da 35 mm sul tavolo della bioprinter e posizionare l'ago a 0,1 mm di distanza dalla superficie del piatto di coltura per consentire il movimento dell'ago.
- Reticolazione del costrutto e della cultura bioprinted
- Posizionare la parabola di coltura sotto luce UV a 2 mW/cm2 per 2 x 60 s (su e giù) per la reticolazione GelMA.
- Sotto il flusso laminare, trasferire il costrutto biostampato su una piastra a 24 pozzetti usando una spatola sterile.
- Aggiungere 500 μL di trombina/soluzione di CaCl2 e lasciare per 30 minuti per consentire la reticolazione della fibrina.
- Rimuovere la soluzione reticolante e lavare il costrutto con 2 ml di PBS 1x. Quindi, sostituire il PBS con 1 mL di terreno di coltura degli astrociti e incubare a 37 °C e 5% CO2. Cambia il mezzo ogni 3 giorni.
7. Valutazione della vitalità degli astrociti
- Vitalità degli astrociti bioprinted
- Trasferire il costrutto biostampato in un piatto di coltura di 35 mm utilizzando una spatola.
- Lavare il costrutto con 1 mL di 1x PBS.
- Depositare 100 μL del reagente Live/Dead sul costrutto e tenerlo a 37 °C per 30 minuti, mantenendolo al riparo dalla luce.
- Rimuovere il reagente Live/Dead e lavare il costrutto con 1 mL di 1x PBS.
- Trasferire il campione su un piatto confocale usando una spatola e osservare le cellule all'interno del costrutto al microscopio confocale utilizzando l'eccitazione a 488 e 570 nm per l'acquisizione delle immagini.
NOTA: utilizzare un ingrandimento di 10 volte per una visualizzazione complessiva delle celle all'interno del costrutto. - Assicurati che il campione sia piatto. Se necessario, posizionare una coverslip sul campione per aumentare la planarità.
NOTA: durante l'imaging, assicurarsi che la parabola confocale sia ben sigillata per evitare che il campione si secchi. - Calcola il numero di vitali (verde) e morti (rosso) utilizzando un software computazionale.
- Vitalità della coltura di astrociti 2D
- Seminare 0,5 x 106 astrociti (passaggio 1-3) in un piatto confocale da 35 mm, aggiungere astrociti in mezzo e incubarli a 37 °C e 5% CO2.
- Quando le cellule sono confluenti, rimuovere il terreno di coltura e lavare con 1 mL di 1x PBS.
- Depositare 200 μL del reagente Vivo/Morto e mantenere il piatto a 37 °C per 30 minuti, al riparo dalla luce.
- Rimuovere il reagente Vivo/Morto e lavare le cellule con 1 mL di 1x PBS.
- Porta il piatto su un microscopio confocale accoppiato con una fotocamera digitale e usa l'eccitazione a 488 e 570 nm per l'acquisizione delle immagini.
- Calcola il numero di vitali (verde) e morti (rosso) utilizzando un software computazionale.
8. Immunostaining degli astrociti
- Colorazione della proteina acida fibrillare gliale (GFAP) degli astrociti bioprinted 3D
NOTA: Per studiare la presenza di altri marcatori cellulari, modificare l'anticorpo primario di conseguenza.- Rimuovere il mezzo dal pozzo e lavare il costrutto con 1 mL di PBS 3x.
- Aggiungere il 4% di paraformaldeide (PFA) in PBS al pozzo fino a quando il costrutto è completamente coperto e lasciarlo per 2 ore a 4 °C.
- Rimuovere il PFA e lavare il costrutto con 1 mL di 3x PBS.
NOTA: questa procedura può essere sospesa per diversi mesi se conservata a 4 °C in PBS. Assicurarsi che la piastra del pozzo sia sigillata per evitare l'evaporazione PBS. - Trattare il campione con glicina 0,1 mol/L per 5 min.
- Lavare con 1 mL di 1x PBS per 5 min.
- Permeabilizzare il campione con PBS contenente 0,1% Triton X-100 e 10% FBS per 1 ora a 25 °C sotto agitazione orbitale.
- Incubare il costrutto con pollo anti-GFAP (diluizione anticorpale primaria 1:500) a 4 °C durante la notte.
- Aspirare l'anticorpo primario e lavare il campione con 1 mL di PBS per 5 minuti, 3 volte.
NOTA: l'anticorpo primario può essere riutilizzato per più volte se conservato a 4 °C. - Incubare il campione con Alexa fluor 488-coniugato anti-pollo (diluizione anticorpale secondaria 1:500) e 1 μg/mL DAPI per 1 ora a 25 °C sotto agitazione orbitale.
NOTA: tenere il campione al riparo dalla luce. - Lavare il campione con 1 mL di PBS per 5 minuti, 3 volte.
- Trasferire il costrutto su una parabola confocale da 35 mm.
NOTA: Assicurarsi che il piatto sia ben sigillato per evitare che il campione si secchi.
- Colorazione della proteina acida fibrillare gliale (GFAP) della coltura di astrociti 2D
- Seminare 0,5 x 106 astrociti (passaggio 1-3) in un piatto confocale da 35 mm, aggiungere astrociti in mezzo e incubarli a 37 °C e 5% CO2.
- Quando le cellule sono confluenti, rimuovere il terreno di coltura e lavarle con 1 mL di 1x PBS.
- Ripetere i passaggi 8.1.2-8.1.10.
- Colorazione del citoscheletro degli astrociti
- Ripetere i passaggi 8.1.1-8.1.6.
- Aggiungere 200 μL di 50 μg/mL di soluzione di falloidina coniugata fluorescente in PBS e 1 μg/mL di DAPI sopra il costrutto.
- Incubare per 1 ora a 25 °C sotto agitazione orbitale, mantenendo il campione al riparo dalla luce.
- Lavare il campione con 1 mL di PBS per 5 min 3 volte e trasferire il costrutto in un piatto confocale usando una spatola.
NOTA: Assicurarsi che il piatto sia ben sigillato per evitare che il campione si secchi.
9. Imaging confocale
- Porta i piatti a un microscopio confocale accoppiato con una fotocamera digitale per l'imaging (eccitazione a 359, 488 e 570 nm).
- Utilizzare l'ingrandimento di 10x per una visualizzazione complessiva e 40 o 63x per le immagini ingrandite delle celle.
NOTA: assicurarsi che il campione sia piatto. Se necessario, posizionare una coverslip sul campione per aumentare la planarità.
Risultati
Questo lavoro mirava a sviluppare un tessuto simile a quello neurale utilizzando la tecnologia di bioprinting 3D per depositare strato per strato la gelatina primaria carica di astrociti / GelMA / fibrinogen bioink. Gli astrociti sono stati estratti e isolati dalla corteccia cerebrale dei cuccioli di topo (Figura 1), aggiunti a una composizione di biomateriale, consentendo la biofabbricazione di un costrutto 3D vivente.
Il computer-aided-design (CAD) è stato sviluppato utilizzando il codice G (File supplementare) come un telaio interconnesso di forma quadrata (0,6 x 0,6 mm), con pori di 1 mm, con l'obiettivo di facilitare la diffusione di nutrienti e ossigeno. Il telaio era composto da 6 strati posti uno sopra l'altro, che cambiavano ad un angolo di 90° in ogni strato (Figura 2A i). La struttura progettata possedeva circa 5 mm di altezza (Figura 2A ii), consentendo la manipolazione dei tessuti. La composizione del bioink ha anche permesso la fabbricazione di costrutti di forme diverse (Figura 2B).
La preparazione del bioink composto da gelatina, GelMA e fibrinogeno comprendeva due fasi di reticolazione. In primo luogo, GelMA è stato reticolato sotto la luce UV, in cui si formano legami covalenti inter e intramolecolari, seguiti da reticolazione della fibrina. In questa fase, la trombina scinde enzimaticamente le catene di fibrinogeno, con conseguente formazione di fibre di fibrina17, una reazione stabilizzata dagli ioni Ca2+ 18. Quindi, le fibre di GelMA e fibrina formano una rete polimerica interpenetrata stabile (IPN) integrata con laminina, supporto adatto per l'attacco cellulare e la diffusione19,20 (Figura 2C).
Prima del bioprinting, dopo 12 giorni di isolamento, gli astrociti erano caratterizzati dalla presenza di GFAP, un costituente proteico dei filamenti intermedi degli astrociti4 (Figura 3A). Quindi, gli astrociti tripsinizzati sono stati miscelati con la soluzione di gelatina / GelMA / fibrinogeno ad una densità di 1 x10 6 cellule / ml, generando un bioink carico di astrociti. Il bioink è stato trasferito su una siringa da 5 ml collegata a un ago smussato da 22 G, componendo la testina di stampa della bioprinter (Figura 3B i). L'ago ha permesso l'estrusione del bioink senza intasamento e prevenendo un elevato stress di taglio alle cellule.
A causa delle proprietà viscoelastiche della gelatina, che si comporta come un fluido a temperature più elevate e come un gel a temperature più basse21, il costrutto biostampato ha mantenuto la fedeltà della forma (Figura 3B ii). Dopo il bioprinting di due strati consecutivi di bioink, è stata osservata la formazione di una struttura ben definita (Figura 3C), con cellule intrappolate all'interno del biomateriale.
Dopo i processi di bioprinting e crosslinking, il costrutto è stato incubato con il mezzo astrocitario e, dopo 1 giorno di bioprinting, la maggior parte delle cellule presentava ancora una morfologia rotonda (Figura 3D). Gli scaffold biostampati hanno mantenuto l'integrità dopo 7 giorni di incubazione e, sebbene siano state osservate alcune cellule rotonde, un gran numero di astrociti si è diffuso in tutto il costrutto, presentando morfologia e interconnessione astrocitica (Figura 3E).
Poiché i parametri del bioprinting, come la velocità, potrebbero influenzare direttamente la vitalità cellulare, sono state testate diverse velocità di bioprinting (400, 600 e 800 mm / min) e la sopravvivenza degli astrociti è stata valutata utilizzando il test Live / Dead con calcein-AM (cellule vive, fluorescenza verde) e ethidium homodimer-III (EthD-II) (cellule morte, fluorescenza rossa). La percentuale di cellule vitali è stata quantificata utilizzando un software computazionale, calcolando il numero di cellule vive e morte. La vitalità cellulare è stata valutata al tempo 0 (subito dopo la bioprinting) e i risultati hanno mostrato che alla velocità inferiore, 400 mm / min, le cellule vitali rappresentavano il 74,08% ± l'1,33% delle cellule totali, essendo significativamente più alte delle cellule biostampati a 600 e 800 mm / min (60,25% ± 1,93% e 62,94 ± 6,18%, rispettivamente) (Figura 4A). Pertanto, la velocità di 400 mm / min è stata utilizzata in questo lavoro.
Prima del bioprinting, gli astrociti in coltura 2D erano caratterizzati come la percentuale di cellule vitali e la vitalità degli astrociti bioprinted era normalizzata a questa condizione. I risultati hanno mostrato che la coltura 2D presentava il 90,98% ± lo 0,94% delle cellule vitali. La vitalità degli astrociti biostampati (giorno 7) è stata dell'83,54% ± del 3,00%, che rappresenta 0,92 ± 0,03 del valore 2D, che era significativamente superiore a quello del giorno 0 (0,81 ± 0,01) (Figura 4B). Immagini di astrociti colorati con il reagente vivo/morto sono presentate in Figura 4Ce mostrano che dopo la bioprinting, le cellule possedevano una morfologia rotonda (Figura 4C i). Dopo 1 settimana di incubazione, gli astrociti si sono diffusi in tutto il costrutto (Figura 4C ii), mostrando una morfologia distinta di cellule da coltura 2D (Figura 4C iii).
Gli astrociti biostampati sono stati colorati per mostrare la densità cellulare e la morfologia cellulare all'interno del costrutto. La Figura 5A mostra un costrutto biostampato dopo 7 giorni di incubazione, con alta densità di astrociti colorati con falloidina, un colorante citoscheletro F-actina. Sebbene siano state osservate poche cellule rotonde, gli astrociti presentavano principalmente una morfologia simile a una stella. Gli astrociti biostampati hanno mostrato di essere positivi al GFAP quando colorati dopo 7 giorni di bioprinting, indicando che le cellule hanno mantenuto il loro fenotipo astrocitico (Figura 5B i). Le figure 5B ii e 5B iii mostrano le immagini impilate Z degli astrociti GFAP+ biostampati all'interno del costrutto. Questi risultati indicano che la composizione del bioink ha fornito un microambiente biocompatibile per promuovere l'adesione, la diffusione e la crescita degli astrociti.

Figura 1: Estrazione della separazione del cervello e della corteccia per la coltura primaria di astrociti. Gli astrociti primari sono stati isolati dalla corteccia cerebrale dei cuccioli di topi C57Bl/6 (giorno 1 post-natale). Dopo aver estratto il cervello dall'animale, le meningi sono state rimosse al microscopio e la corteccia separata seguita dalla digestione dei tessuti e dalla coltura degli astrociti. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Illustrazione schematica del processo di bioprinting 3D. (A) File CAD progettato per la biostampa 3D del tessuto neurale che mostra (i) 2 strati, vista dall'alto e (ii) 6 strati, vista laterale, del costrutto. (B) Immagini che mostrano la capacità del bioink di stampare strutture di diverse forme (i) quadrate, ( ii )capillarie (iii) stelle. (C) Schema di reticolazione dei biomateriali dopo la visualizzazione di bioprinting 3D, in cui GelMA è reticolato sotto luce UV seguito da reticolazione di fibrina in un bagno di trombina: Ca2+. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Boprinting 3D di bioink di gelatina/GelMA/fibrinogeno carico di astrociti. (A) Caratterizzazione di astrociti dopo 12 giorni di isolamento e coltura, colorati per GFAP, verde e DAPI, blu. (B) (i) Configurazione della testina di stampa e (ii) Costrutto biostampato 3D subito dopo la bioprinting. (B) Costrutto a due strati che mostra la cornice biostampata. Ingrandimento di 4x. (C) Immagine di astrociti bioprinted 1 giorno dopo la bioprinting, che mostra le cellule in una morfologia rotonda. (D) Immagine di astrociti biostampati 7 giorni dopo il processo di bioprinting, che mostra cellule con morfologia astrocitica con poche cellule rotonde, indicando la loro affinità con il tessuto mimetico. Ingrandimento di 10x. Fare clic qui per visualizzare una versione più grande di questa figura.
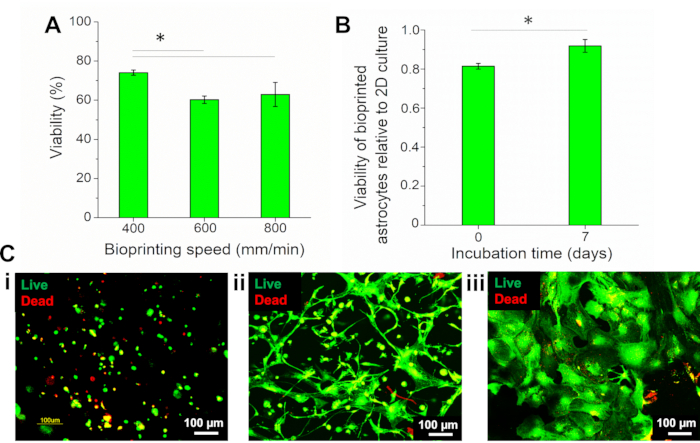
Figura 4: Valutazione della vitalità degli astrociti biostampati. (A) Vitalità degli astrociti biostampati a velocità diverse. (B) Vitalità degli astrociti biostampati al (i) giorno 0 (subito dopo la bioprinting) e (ii) dopo 7 giorni di bioprinting, normalizzata alla vitalità degli astrociti in coltura 2D. Analisi statistica mediante Anova unizionale con test di Tukey, n = 3, *p < 0,05. (C) Immagini fluorescenti di astrociti colorati con reagente Vivo/Morto. Astrociti biostampati il (i) giorno 0 (subito dopo la bioprinting), (ii) giorno 7 e (iii) coltura 2D di astrociti. Ingrandimento di 10x. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Caratterizzazione di astrociti bioprinted 3D. Immunofluorescenza di astrociti bioprinted 3D dopo 7 giorni di incubazione colorati per (A) F-actina (falloidina, rosso) e nuclei (DAPI, blu) con ingrandimento di 10x e 40x e per (B) GFAP, verde (i) con ingrandimento di 10x, (ii) Z-stacked che mostra l'asse X-Y-Z del costrutto biostampato, e (iii) immagine che mostra l'asse X-Z degli astrociti GFAP +. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare. Fare clic qui per scaricare questo file.
Discussione
La tecnologia di bioprinting 3D è emersa come alternativa alla biofabbricazione che consente l'ingegnerizzazione di costrutti raffinati che strutturalmente e fisiologicamente assomigliano ai tessuti nativi22, incluso il cervello23. La biofabbricazione di tessuti simili a quelli neurali consente la modellazione in vitro del microambiente nativo, essendo uno strumento importante per comprendere i meccanismi cellulari e molecolari associati allo sviluppo e al trattamento di molte malattie che colpiscono il SNC11. A causa dell'importante ruolo delle cellule gliali nella funzionalità neurale, gli astrociti corticali sono stati utilizzati in molti studi, come lo sviluppo del cervello24,il trasporto delle biomolecole25,la crescita dei neuriti26e nella biofabbricazione del tessuto simile al cervello14.
I metodi per l'ingegneria della coltura 3D degli astrociti sono stati riportati in precedenza, utilizzando diversi biomateriali e tecniche di impalcatura27,28,29. Allo stesso modo, è stato riportato anche un metodo per la biostampa 3D di aggregati neurali derivati da cellule staminali pluripotenti indotte umane (hiPSC) e ha mostrato la capacità di queste cellule biostampati di differenziarsi e maturare in vitro30. Tuttavia, non ci sono segnalazioni di metodi per la biofabbricazione di costrutti di astrociti brioprinted 3D in letteratura. Quindi, questo protocollo mirava a descrivere un metodo riproducibile per la biostampa 3D degli astrociti corticali.
In questo protocollo, gli astrociti sono stati isolati dalle cortecce cerebrali dei cuccioli di topi C57Bl/6, un modello animale ampiamente utilizzato nella ricerca31,32,che può essere sostituito da astrociti derivati da altre fonti, come hiPSC e midollo spinale. Dopo l'isolamento, la coltura e la sottocultura, gli astrociti rimangono in uno stato proliferativo fino al passaggio 3, che è il numero massimo di scissioni raccomandato a causa della loro intrinseca limitazione della proliferazione8. È stato verificato che la proliferazione degli astrociti dal passaggio 4 era limitata, essendo difficile raggiungere la quantità desiderata di cellule per la bioprinting 3D.
Nel metodo descritto, è stata utilizzata una concentrazione di 1,0 x 10 6 cellule/mL disoluzione di biomateriale, come prova di concetto per valutare la capacità delle cellule di sopravvivere al processo di bioprinting e di mantenere la loro vitalità e proprietà intrinseche durante la coltura all'interno dell'idrogel. Nel lavoro precedente, un tessuto simile neurale biostampato in 3D è stato biofabbricato co-coltivando astrociti e neuroni e, per aumentare l'interazione cellulare, la concentrazione di astrociti era di 8,0 x 106 cellule / mL14. Quindi, la concentrazione di cellule può essere ottimizzata per studi specifici.
Un bioink per il bioprinting 3D è composto da cellule e un biomateriale o una combinazione di biomateriali33. In questo protocollo è stata utilizzata una combinazione di gelatina / GelMA / fibrinogeno, che si è rivelata favorevole sia per la bioprinting che per la manutenzione degli astrociti in coltura. La produzione di un bioink bioprintable è impegnativa quando si utilizza la tecnica di bioprinting basata sull'estrusione. La composizione del biomateriale deve possedere proprietà viscoelastiche che, allo stesso tempo, consentano l'estrusione del bioink, pur mantenendo la forma 3D dopo il processo di stampa34. Inoltre, dovrebbe essere in grado di mantenere la vitalità cellulare durante il processo, che a seconda delle condizioni di bioprinting, può causare stress da taglio alle cellule che portano alla morte35.
La bioprintability è stata assicurata dalla gelatina, un biomateriale che possiede proprietà viscoelastiche ottimali grazie alla sua capacità di transizione sol-gel36. Ciò consente alle macromolecole di gelatina di riorganizzarsi e comportarsi come un fluido durante l'estrusione e come un gel dopo la bioprinting, mantenendo la struttura 3D. Inoltre, come derivato del collagene, la gelatina è composta da ripetizioni di triplette peptidiche glicina-amminoacidiche, che assicurano la specificità cellulare21. Tuttavia, i legami intra e intermolecolari della gelatina sono deboli e, a causa della sua termoreveribilità, la gelatina non ha stabilità a 37 °C, essendo rilasciata dal costrutto durante la coltura cellulare. Pertanto, GelMA è diventato un'alternativa come idrogel stabile, a causa dei legami covalenti formati dopo l'esposizione alla luce UV, mantenendo le proprietà di specificità cellulare19. Le proprietà fisiche di GelMA, come porosità, degradazione e modulo elastico, possono essere regolate per adattarsi a diverse applicazioni di ingegneria tissutale19. La rigidità degli scaffold GelMA può essere controllata variando la sostituzione metacriloil37,permettendo di ottenere una rigidità simile a quella del tessuto da modellare. Cioè, diminuendo il grado di funzionalizzazione, è possibile ottenere una rigidità inferiore37. Pertanto, a causa della morbidezza del cervello di topo38,39 e dell'effetto diretto della rigidità della matrice extracellulare (ECM) sul comportamento cellulare40,in questo protocollo è stato proposto un basso grado di funzionalizzazione della gelatina. Nei lavori precedenti, è stata riportata la capacità degli idrogel GelMA di imitare le caratteristiche fisiche del SNC, mostrando un'elevata idoneità per la coltura di astrociti, neuroni e cellule staminali neurali14,41,42.
Oltre al GelMA, il fibrinogeno, un biopolimero nativo che forma fibre di fibrina attraverso la reazione enzimatica, è stato ampiamente utilizzato anche per biofabbricare il tessuto neurale, mostrando un'elevata specificità e offrendo un microambiente adatto per le cellule neurali per attaccarsi e crescere30,43,44. Altri biomateriali, come l'alginato e il chitosano sono stati utilizzati per biostampare tessuti simili a neurali, mescolati a gelatina, GelMA e / o fibrinogeno, con l'obiettivo di migliorare la stampabilità e le proprietà fisiche degli scaffold 3D14,30. Nel metodo attuale, è stata raggiunta una bioprintability, una stabilità fisica e una specificità cellulare ottimali utilizzando gelatina, GelMA e fibrinogeno come componenti del bioink. Al fine di aumentare il riconoscimento degli astrociti al microambiente, la laminina, un componente dell'ECM cerebrale, è stata utilizzata per integrare il bioink.
In questo protocollo, la gelatina è stata utilizzata ad una concentrazione del 4% (p/v), che ha permesso la transizione sol-gel del bioink a 25 °C entro circa 10 minuti. Una gelificazione più rapida può essere ottenuta aumentando la concentrazione di gelatina. Tuttavia, la sterilizzazione mediante filtrazione mediante filtro da 0,2 μm può essere compromessa. La filtrazione del bioink è un passaggio critico, verificando che concentrazioni più elevate di gelatina (>5% p / v) possano impedire la filtrazione. Un'alternativa per ottenere un punto di gelificazione più veloce durante la bioprinting consiste nel lasciare la siringa contenente il bioink a 4 °C per 2 minuti prima di collegarla alla testina di stampa della bioprinter. Dopo la bioprinting, è fondamentale mantenere il costrutto a 25 °C per evitare di destabilizzare la struttura 3D e mantenere una condizione gelificata prima dell'esposizione UV. In particolare, il costrutto dovrebbe essere solido quando la soluzione di reticolante di fibrinogeno viene aggiunta alla piastra. Per la reticolazione GelMA, è importante capovolgere il campione (2 x 60 s per lato) per garantire l'esposizione ai raggi UV in tutto il costrutto. Per la reticolazione del fibrinogeno, la soluzione del reticolante dovrebbe coprire completamente il costrutto. Pertanto, se si utilizza un piatto o un piatto più grande, il volume deve essere regolato. Dopo la reticolazione, l'idrogel dovrebbe apparire omogeneo al microscopio a contrasto di fase e le cellule dovrebbero essere distribuite in modo omogeneo in tutto il costrutto, possedendo una morfologia rotonda.
Questo protocollo ha permesso al bioink gelatina/GelMA/fibrinogeno di stampare strutture di forme diverse, mantenendo l'integrità e la forma 3D dei costrutti. A causa delle limitazioni della temperatura per raggiungere i 25 °C all'interno del flusso laminare, la bioprinting è stata eseguita nella sala di coltura al di fuori del flusso laminare. Il tempo di bioprinting è stato di circa 1 minuto per ogni campione e non è stata osservata alcuna contaminazione durante la coltura cellulare.
L'integrità cellulare può essere influenzata dalla bioprinting, a causa dello sforzo di taglio causato nel processo35. Questo può essere controllato ottimizzando i parametri di stampa, come la velocità di stampa. In questo lavoro, sono state testate diverse velocità di bioprinting, 400, 600 e 800 mm / min, osservando una significativa diminuzione della vitalità cellulare quando la velocità è stata aumentata da 400 a 600 mm / min. A 400 mm/min, circa il 74% delle cellule è rimasto vitale dopo la bioprinting, e questo valore è aumentato significativamente dopo 7 giorni di incubazione (>80%). Pertanto, non sono state utilizzate velocità inferiori per evitare l'eccessiva esposizione delle cellule all'ambiente. La coltura 2D degli astrociti ha mostrato una maggiore vitalità (~ 90%) rispetto alle cellule biostampate. Tuttavia, come mostrato dalle immagini fluorescenti, la morfologia è influenzata dal tipo di coltura. Mentre le cellule 2D erano piatte, gli astrociti in ambiente 3D possedevano una forma simile a una stella, interconnessa tra loro da processi cellulari.
In particolare, il microambiente mimetico era favorevole per la coltura di astrociti corticali, poiché la vitalità cellulare aumentava significativamente dopo 1 settimana, suggerendo la proliferazione cellulare all'interno del costrutto. La laminina, una glicoproteina presente nell'ECM cerebrale, è stata aggiunta al bioink con l'obiettivo di ottenere una maggiore aderenza degli astrociti all'idrogel14. La colorazione F-actina del citoscheletro ha mostrato che gli astrociti biostampati erano ad alta densità all'interno del costrutto, indicando che la concentrazione cellulare utilizzata in questo protocollo consentiva l'interconnessione degli astrociti. L'immunoistochimica per la localizzazione GFAP, un marcatore correlato con l'estesa arborizzazione degli astrociti e l'ipertrofia cellulare45, corroborata dalla colorazione di F-actina, ha mostrato che le cellule presentavano una morfologia astrocitica tipica, indicando che il sistema 3D mimetico era favorevole per le cellule ad attaccarsi e comportarsi come nel loro ambiente nativo.
Il protocollo qui presentato descrive una procedura efficiente e riproducibile per il bioprinting 3D di astrociti corticali. A causa dell'importanza degli astrociti nella risposta neuroinfiammazione alle lesioni, nonché nella regolazione della funzionalità neuronale, gli studi che coinvolgono questa cellula gliale potrebbero contribuire a molti aspetti nella comprensione delle malattie che colpiscono il SNC. Pertanto, il modello 3D in vitro qui presentato è utile in applicazioni future che mirano a studiare le interazioni astrociti-neuroni, la funzionalità degli astrociti nelle patologie cerebrali e il potenziale degli astrociti come bersagli terapeutici.
Divulgazioni
Gli autori non hanno conflitti da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione per la ricerca di San Paolo (FAPESP), numeri di sovvenzione 2018/23039-3 e 2018/12605-8; Consiglio nazionale per lo sviluppo scientifico e tecnologico (CNPq), numeri di sovvenzione 465656/2014-5 e 309679/2018-4; e Coordinamento per il miglioramento del personale dell'istruzione superiore (CAPES), codice finanziario 001.
Materiali
| Name | Company | Catalog Number | Comments |
| 3D Bioprinter | 3D Biotechnology Solutions | Extrusion-based bioprinter | |
| Blunt-tip forceps | Integra Miltex | 6--30 | Forceps for brain dissection previously sterilized |
| Bovine serum albumin | Sigma-Aldrich | 9048-46-8 | Protease free, fatty acid free, essentially globulin free |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | |
| Cell culture flask | Fisher Scientific | 156340 | Culture flask T25 |
| Cell strainer | Corning Incorporated | 352340 | Cell strainer 40 µm |
| Confocal microscope | Leica | Confocal TCS SP8 microscopy coupled with an Olympus FluoView 300 confocal system | |
| Conical tubes | Thermo Scientific | 339651, 339652 | Sterile tubes of 15 mL and 50 mL |
| DAPI | Abcam | ab224589 | DAPI staining solution |
| DMEM/F12 | Gibco; Life Technologies Corporation | 12500062 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Dyalisis tubing | Sigma-Aldrich | D9527 | Molecular weight cut-off = 14 kDa |
| Ethanol | Fisher Scientific | 64-15-5 | Reagent grade |
| Fetal Bovine Serum | Gibco; Life Technologies Corporation | 12657011 | Research Grade |
| Fibrinogen | Sigma-Aldrich | 9001-32-5 | Fibrinogen cristalline powder from bovine plasma |
| Gelatin | Sigma-Aldrich | 9000-70-8 | Gelatin powder from porcine skin |
| Glycine | Sigma-Aldrich | 56-40-6 | Glycine powder |
| Hanks Buffered Salt Solution (HBSS) | Gibco; Life Technologies Corporation | 14175095 | No calcium, no magnesium, no phenol red |
| L-Glutamine | Sigma-Aldrich | 56-85-9 | L-Glutamine crystalline powder |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin 1-2 mg/mL L in 50 mM Tris-HCl |
| Live dead kit cell imaging kit | Thermo Scientific | R37601 | Green fluorescence in live cells (ex/em 488 nm/515 nm). Red fluorescence in dead cells (ex/em 570 nm/602 nm) |
| Methacrylic anhydride | Sigma-Aldrich | 760-93-0 | For GelMA preparation |
| Microtubes | Corning Incorporated | MCT-150-C | Microtubes of 1,5 mL |
| NaCl | Sigma-Aldrich | 7647-14-5 | |
| Needle 22G | Fisher Scientific | NC1362045 | Sterile blunt needle |
| Operating scissor | Integra Miltex | 05--02 | Sharp scissor for brain dissection previously sterilized |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | Paraformaldehyde powder |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | 15070063 | Pen Strep (5,000 Units/ mL Penicillin; 5,000 ug/mL Streptomycin) |
| Petri dish | Corning Incorporated | 430591, 430588 | Sterile petri dishes of 35 and 100 mm |
| Phalloidin | Abcam | ab176753 | iFluor 488 reagent |
| Photoinitiator | Sigma-Aldrich | 106797-53-9 | 2-Hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone |
| Phosphate buffer saline (PBS) | Gibco; Life Technologies Corporation | 10010023 | PBS 1 x, culture grade, no calcium, no magnesium |
| Poly-L-lysine | Sigma-Aldrich | 25988-63-0 | Poly-L-lysine hydrobromide mol wt 30,000-70,000 |
| Primary antobody | Abcam | ab4674 | Chicken polyclonal to GFAP |
| Secondary antibody | Abcam | ab150176 | Alexa fluor 594 anti-chicken |
| Spatula | Miltex | V973-70 | Number 24 cement spatula previously sterilized |
| Stereomicroscope | Fisherbrand | 3000038 | Microscope for brain dissection |
| Syringe 5 mL | BD | 1222C84 | Sterile syringe |
| Syringe filter 2 µm | Fisher Scientific | 09-740-105 | Polypropylene filter for sterilization |
| Thrombin | Sigma-Aldrich | 9002--04-4 | Thrombin cristalline powder from bovine plasma |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Laboratory grade |
| Trypsin-EDTA | Gibco; Life Technologies Corporation | 15400054 | Trypsin no phenol red 1 x diluted in PBS |
| Versene solution | Gibco; Life Technologies Corporation | 15040066 | Versene Solution (0.48 mM) formulated as 0.2 g EDTA(Na4) per liter of PBS |
| Well plate | Thermo Scientific | 144530 | Sterile 24-well plate |
Riferimenti
- Di, L., Mannelli, C., Cuzzocrea, S. Astrocytes: Role and functions in brain pathologies. Frontiers in Pharmacology. 10, 1114(2019).
- Kimelberg, H. K., Nedergaard, M. Functions of astrocytes and their potential as therapeutic targets. Neurotherapeutics. 7 (4), 338-353 (2010).
- Giovannoni, F., Quintana, F. J. The role of astrocytes in CNS inflammation. Trends in Immunology. 41 (9), 805-819 (2020).
- Escartin, C., et al. Reactive astrocyte nomenclature, definitions, and future directions. Nature Neuroscience. 24 (3), 312-325 (2021).
- Carson, M. J., Thrash, J. C., Walter, B. The cellular response in neuroinflammation: The role of leukocytes, microglia and astrocytes in neuronal death and survival. Clinical Neuroscience Research. 6 (5), 237-245 (2006).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Clarke, L. E., et al. Normal aging induces A1-like astrocyte reactivity. Proceedings of the National Academy of Sciences of the Unied States of America. 115 (8), 1896-1905 (2018).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes isolation and culture of mouse cortical astrocytes. Journal of Visualized Experiments: JoVE. (71), e50079(2013).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Knight, E., Przyborski, S. Advances in 3D cell culture technologies enabling tissue-like structures to be created in vitro. Journal of Anatomy. 227 (6), 746-756 (2015).
- Zhuang, P., Sun, A. X., An, J., Chua, C. K., Chew, S. Y. 3D neural tissue models: From spheroids to bioprinting. Biomaterials. 154, 113-133 (2018).
- Balasubramanian, S., Packard, J. A., Leach, J. B., Powell, E. M. Three-dimensional environment sustains morphological heterogeneity and promotes phenotypic progression. Tissue Engineering. Part A. 22 (11-12), 885-898 (2016).
- Watson, P. M. D., Kavanagh, E., Allenby, G., Vassey, M. Bioengineered 3D glial cell culture systems and applications for neurodegeneration and neuroinflammation. SLAS Discovery. 22 (5), 583-601 (2017).
- Li, Y. E., Jodat, Y. A., Samanipour, R., Zorzi, G., Zhu, K. Toward a neurospheroid niche model: optimizing embedded 3D bioprinting for fabrication of neurospheroid brain-like co-culture constructs. Biofabrication. , (2020).
- Zhou, X., et al. Three-dimensional-bioprinted dopamine-based matrix for promoting neural regeneration. ACS Applied Materials & Interfaces. 10 (10), 8993-9001 (2018).
- de la Vega, L., et al. 3D bioprinting human induced pluripotent stem cell-derived neural tissues using a novel lab-on-a-printer technology. Applied Sciences. 8 (12), 2414(2018).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Ariens, R. A. S., Lai, T., Weisel, J. W., Greenberg, C. S., Grant, P. J. Role of factor XIII in fibrin clot formation and effects of genetic polymorphisms. Blood. 100 (3), 743-754 (2002).
- Yue, K., et al. Synthesis, properties, and biomedical applications of Gelatin Methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- de Melo, B. A. G., et al. Strategies to use fibrinogen as bioink for 3D bioprinting fibrin-based soft and hard tissues. Acta Biomaterialia. 117, 60-76 (2020).
- Wang, X., et al. Gelatin-based hydrogels for organ 3D bioprinting. Polymers (Basel). 9 (9), 401(2017).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Naure. Biotechnology. 32 (8), 773-785 (2014).
- de la Vega, L., Lee, C., Sharma, R., Amereh, M., Willerth, S. M. 3D bioprinting models of neural tissues: The current state of the field and future directions. Brain Research Bulletin. 150, 240-249 (2019).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Hanu, R., et al. Monocarboxylic acid transporters, MCT1 and MCT2, in cortical astrocytes in vitro and in vivo. American Journal of Physiology. Cell Physiology. 278 (5), 921-930 (2000).
- Liu, R., Wang, Z. h, Gou, L., Xu, H. A cortical astrocyte subpopulation inhibits axon growth in vitro and in vivo. Molecular Medicine Reports. 12 (2), 2598-2606 (2015).
- Winter, C. C., Cullen, D. K., Donnell, J. C. O., Song, Y. J., Hernandez, N. S. Three-dimensional tissue engineered aligned astrocyte networks to recapitulate developmental mechanisms and facilitate nervous system regeneration. Journal of Visualized Experiments: JoVE. (131), e55848(2018).
- East, E., Golding, J. P., Phillips, J. B. A versatile 3D culture model facilitates monitoring of astrocytes undergoing reactive gliosis. Journal of Tissue Engineering and Regenerative Medicine. 3 (8), 634-646 (2009).
- Hawkinsn, B. T., Grego, S., Sellgren, K. L. Three-dimensional culture conditions differentially affect astrocyte modulation of brain endothelial barrier function in response to transforming growth factor B1. Brain Research. 1608, 167-176 (2015).
- Abelseth, E., et al. 3D printing of neural tissues derived from human induced pluripotent stem cells using a fibrin-based bioink. ACS Biomaterials Science and Engineering. 5 (1), 234-243 (2019).
- Filippo, T. R. M., et al. CXCL12 N-terminal end is sufficient to induce chemotaxis and proliferation of neural stem/progenitor cells. Stem Cell Research. 11 (2), 913-925 (2013).
- Galindo, L. T., et al. Chondroitin sulfate impairs neural stem cell migration through ROCK activation. Molecular Neurobiology. 55 (4), 3185-3195 (2018).
- Groll, J., et al. A definition of bioinks and their distinction from biomaterial inks. Biofabrication. 11 (1), 03001(2018).
- Kyle, S., Jessop, Z. M., Al-sabah, A., Whitaker, I. S. Printability of candidate biomaterials for extrusion-based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), (2017).
- Blaeser, A., et al. Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity. Advanced Healthcare Materials. 5 (3), 326-333 (2016).
- Miyawaki, O., Omote, C., Matsuhira, K. Thermodynamic analysis of sol-gel transition of gelatin in terms of water activity in various solutions. Biopolymers. 103 (12), 685-691 (2015).
- Shirahama, H., Lee, B. H., Tan, L. P., Cho, N. Precise tuning of facile one-pot Gelatin Methacryloyl (GelMA) synthesis. Science Reports. 6, 31036(2016).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Science Reports. 8 (1), 12517(2018).
- Iwashita, M., et al. Comparative analysis of brain stiffness among amniotes using glyoxal fixation and atomic force microscopy. Frontiers in Cell and Developmental Biology. 8, 574619(2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews. 5, 351-370 (2010).
- Ye, W., et al. 3D printing of gelatin methacrylate-based nerve guidance conduits with multiple channels. Materials and Design. 192, 108757(2020).
- Wu, Y., et al. The influence of the stiffness of GelMA substrate on the outgrowth of PC12 cells. Bioscience Reports. 39 (1), 1-9 (2019).
- Edgar, J. M., Robinson, M., Willerth, S. M. Fibrin hydrogels induce mixed dorsal/ventral spinal neuron identities during differentiation of human induced pluripotent stem cells. Acta Biomaterialia. 51, 237-245 (2017).
- Arulmoli, J., et al. Combination scaffolds of salmon fibrin, hyaluronic acid, and laminin for human neural stem cell and vascular tissue engineering. Acta Biomaterialia. 43, 122-138 (2016).
- Brenner, M. Role of GFAP in CNS Injuries. Neuroscience. Letters. 565, 7-13 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon