Method Article
Bioimpressão 3D de astrócitos cortical de murina para engenharia de tecido neural
Neste Artigo
Resumo
Aqui relatamos um método de bioimpressão 3D de astrócitos cortical de murina para biofabricagem de tecidos neurais para estudar a funcionalidade dos astrócitos no sistema nervoso central e os mecanismos que envolvem células gliais em doenças neurológicas e tratamentos.
Resumo
Os astrócitos são células gliais com um papel essencial no sistema nervoso central (SNC), incluindo suporte neuronal e funcionalidade. Essas células também respondem a lesões neurais e agem para proteger o tecido de eventos degenerativos. Estudos in vitro da funcionalidade dos astrócitos são importantes para elucidar os mecanismos envolvidos nesses eventos e contribuir para o desenvolvimento de terapias para tratar distúrbios neurológicos. Este protocolo descreve um método para biofabricar uma estrutura de tecido neural rica em astrócitos por bioimizades 3D carregados de astrócitos. Uma bioimpressora 3D baseada em extrusão foi usada neste trabalho, e os astrócitos foram extraídos dos cortices cerebrais dos filhotes de C57Bl/6. O bioink foi preparado pela mistura de astrócitos cortical de até a passagem 3 para uma solução biomaterial composta de gelatina, gelatina-methacryloyl (GelMA) e fibrinogênio, complementado com laminina, que apresentava condições ótimas de bioimpressão. As condições de bioimpressão 3D minimizaram o estresse celular, contribuindo para a alta viabilidade dos astrócitos durante o processo, em que 74,08% ± 1,33% das células eram viáveis logo após a bioimpressão. Após 1 semana de incubação, a viabilidade dos astrócitos aumentou significativamente para 83,54% ± 3,00%, indicando que o construto 3D representa um microambiente adequado para o crescimento celular. A composição do biomatélmico permitiu o apego celular e estimulou o comportamento astrócito, com células expressando os astrócitos específicos marcador de proteína ácida fibrilar glicial (GFAP) e possuindo morfologia astróctica típica. Este protocolo reprodutível fornece um método valioso para biofabricar tecido neural 3D rico em astrócitos que se assemelha ao microambiente nativo das células, útil para pesquisadores que visam entender a funcionalidade dos astrócitos e sua relação com os mecanismos envolvidos em doenças neurológicas.
Introdução
Os astrócitos são o tipo celular mais abundante no Sistema Nervoso Central (SNC) e desempenham um papel fundamental na homeostase cerebral. Além do suporte neuronal duradouro, os astrócitos são responsáveis por modular a absorção de neurotransmissores, manter a integridade da barreira hematoencefálica e regular a sinapstogênese neuronal1,2. Os astrócitos também têm um papel essencial na inflamação do SNC, respondendo a lesões no cérebro em um processo que leva à reatividade astrocativa ou astrogliose reativa3,4, formando uma cicatriz gliar que impede a exposição saudável do tecido aos agentes degenerativos5. Este evento resulta em mudanças na expressão genética dos astrócitos, morfologia e função6,7. Portanto, estudos envolvendo a funcionalidade dos astrócitos são úteis para o desenvolvimento de terapias para tratar distúrbios neurológicos.
Modelos in vitro são cruciais para estudar mecanismos relacionados a lesões neurológicas, e embora o isolamento bem sucedido e a cultura bidimensional (2D) dos astrócitos cortical tenham sido estabelecidos8,este modelo não fornece um ambiente realista que imita o comportamento celular nativo e para reproduzir a complexidade do cérebro9 . Em condição 2D, o fraco suporte mecânico e bioquímico, as interações de células baixas e matriz celular e o achatamento celular, levando à ausência de polaridade basal-apical, afetam a dinâmica de sinalização celular e os desfechos experimentais levando à alteração da morfologia celular e expressão genética, que comprometem a resposta aos tratamentos10. Por isso, é fundamental desenvolver alternativas que proporcionem um ambiente neural mais realista, visando traduzir os resultados para a clínica.
A cultura celular tridimensional (3D) representa um modelo mais avançado que recapitula com características de fidelidade aumentadas de órgãos e tecidos, incluindo o CNS11. Em relação à cultura gliana, os modelos 3D contribuem para a manutenção da morfologia dos astrócitos, polaridade basal-apical celular e sinalização celular12,13. A tecnologia de bioimpressão 3D surgiu como uma poderosa ferramenta para biofabritor tecidos vivos 3D de forma controlada, usando células e biomateriais para recriar a estrutura e propriedades dos tecidos nativos. O uso dessa tecnologia levou a uma melhoria substancial da previsão de resultados e contribuiu para a medicina regenerativa aplicada ao CNS14,15,16.
O protocolo descrito aqui detalha o isolamento e a cultura dos astrócitos cortical. O protocolo também detalha um método reprodutível para bioimpressão de astrócitos embutidos em gelatina/gelatina methacryloyl (GelMA)/fibrinogen, complementado com laminina. Neste trabalho, uma bioimpressora baseada em extrusão foi usada para imprimir a composição biomaterial contendo astrócitos cortical a uma densidade de 1 x106 células/mL. O estresse da tesoura de bioimpressão foi minimizado pelo controle da velocidade de impressão, e os astrócitos apresentaram alta viabilidade após o processo. Construções bioimpressadas foram cultivadas por 1 semana, e os astrócitos foram capazes de se espalhar, anexar e sobreviver dentro do hidrogel, mantendo a morfologia astróctica e expressando um marcador específico de proteína ácida fibrilar (GFAP)4.
Este procedimento é compatível com bioimpressoras baseadas em extrusão orientadas por pistão e pode ser usado para bioimpressão de astrócitos derivados de diferentes fontes. O modelo bioimpresso 3D proposto aqui é adequado para uma ampla gama de aplicações de engenharia neural, como estudos dos mecanismos envolvidos na funcionalidade de astrócitos em tecidos saudáveis e compreensão da progressão de patologias neurológicas e desenvolvimento do tratamento.
Protocolo
Todos os procedimentos envolvendo animais seguiram diretrizes internacionais para uso de animais em pesquisa (http://www.iclas.org) e foram aprovados pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo (CEUA 2019/9292090519).
1. Dissecção cerebral de camundongos
- Transfira 10 mL de solução de sal tampão hanks frio (HBSS) para um prato de cultura de 100 mm e 1 mL para um microtubo de 1,5 mL. Prepare um microtubo por animal.
NOTA: Tanto o prato de cultura quanto o microtubo precisam ser mantidos no gelo. - Prepare o meio de cultura dos astrócitos utilizando DMEM F12 + 10% de Soro Bovino Fetal (FBS), 2% glutamina e 1% Penicilina-Estreptomicina (P/S). Esterilize o meio filtrando usando um filtro de 0,2 μm.
- Euthanize filhotes de camundongos C57Bl/6 (pós-natal dia 1) por decapitação usando uma tesoura de operação afiada. Usando fórceps, puxe a pele e exponha o crânio. Certifique-se de que tanto a tesoura quanto as fórceps estão esterilizadas com 70% de etanol.
- Corte o crânio do forame magnum até o topo da cabeça ao longo do plano sagital usando uma tesoura de ponta curva afiada.
NOTA: Certifique-se de que o tecido encefálico não está danificado. - Usando uma espátula previamente esterilizada com etanol 70%, levante o cérebro da cavidade craniana e coloque-o no prato de cultura contendo 10 mL de HBSS frio.
- Coloque o prato de cultura contendo o cérebro sob o estereóscópio, e usando dois fórceps de ponta sem corte, remova as meninges do cérebro(Figura 1).
- Separe os cortices do resto do cérebro, enrolando-os suavemente para longe da linha mediana do cérebro usando uma espátula.
- Colete os dois cortices e transfira-os imediatamente para o mesmo microtubo contendo 1 mL de HBSS frio.
2. Isolamento e cultura de astrócitos
- Sob o fluxo laminar, corte o tecido cortical em pequenos pedaços usando uma micro tesoura curvada, e lave-os com 1 mL de HBSS por tubulação para cima e para baixo 3x. Espere o tecido se acalmar. Remova o HBSS e adicione HBSS fresco, repetindo o processo mais duas vezes.
- Retire o HBSS e incuba o tecido com 1 mL de trippsina de 0,05% a 37 °C por 5 min.
NOTA: Apenas a digestão de trippsina é suficiente neste momento. - Dissociar mecanicamente o tecido, encanar suavemente para cima e para baixo 15x.
NOTA: A dissociação completa do tecido é observada pelo aumento da turbidez da suspensão e pela ausência de grandes fragmentos de tecido na suspensão. - Transfira a solução para um tubo cônico de 15 mL, neutralize a atividade de trippsina adicionando um volume igual de FBS e transfira a solução em um filtro de filtro de filtro de célula de 0,4 μm para remover fragmentos não dissociados.
- Lave o filtro com 1 mL de meio de astrócitos, colete a suspensão celular que passou pelo coador e centrífugue por 5 min a 200 x g e 25 °C. Após a centrifugação, descarte o supernatante e suspenda a pelota em 1 mL de meio de cultura de astrócitos.
- Transfira a suspensão celular para um frasco de cultura T25, compor o volume do médio para 3,5 mL e incubar as células a 37 °C e 5% de CO2.
- Certifique-se de que depois de 24 horas, as células são aderentes. Em seguida, substitua o meio e troque-o a cada 3 dias.
- Após 7 dias, remova microglia e oligodendrócitos da cultura lavando as células com 2 mL de 1x PBS.
- Substitua a solução PBS pelo meio de cultura de astrócitos e deixe o frasco de cultura em um agitador orbital a 180 rpm durante a noite.
NOTA: Os astrócitos formam uma monocamada confluente em aproximadamente 10-12 dias de cultura.
3. Síntese de gelatina methacryloyl (GelMA)
- Pese 10 g de gelatina obtida da pele suína e dissolva em 100 mL de PBS deixando a solução mexer em uma placa de aquecimento a 240 rpm e 50 °C até a dissolução completa.
- Sob um capô, adicione 2 mL de anidrido de metacríclico (MA) para um baixo grau de funcionalização, e deixe a emulsão de gelatina mexer a 240 rpm e 50 °C por 2h.
ATENÇÃO: Declaração de risco ma: H302 + H332 (prejudicial se engolido ou inalado), H311 (tóxico em contato com a pele), 314 (causa queimaduras graves na pele e danos oculares), 315 (causa irritação na pele), H317 (pode causar reação alérgica à pele), H318 (causa danos oculares graves), 331 (tóxico se inalado), H332 (prejudicial se inalado), H335 (pode causar irritação respiratória). Orientações de manuseio: P261 (evite respirar poeira/vapor/gás/névoa/vapores/spray), P305 + P351 + P338 + P310 (IF IN EYES: Enxágue com cautela com água por vários minutos. Remova as lentes de contato, se estiver presente e fácil de fazer. Ligue imediatamente para um CENTRO/MÉDICO DE VENENO), P301 + P312 + P330 (SE ENGOLIDO: Ligue para um CENTRO/médico de veneno se você se sentir mal. Enxágüe a boca).
NOTA: Adicione MA muito lentamente, gota a gota. - Diluir a solução gelatin-MA em 100 mL de PBS pré-aquecido (50 °C) para obter 200 mL de volume final e deixar a solução mexer a 240 rpm e 50 °C por 10 min.
- Corte ~20 cm de membrana de diálise (corte molecular de 12-14 kDa) e mergulhe-a em água deionizada até ficar macia.
NOTA: Encha as membranas com água desionizada para certificar-se de que não há orifícios ou defeitos. - Usando um funil, transfira a solução gelatina-MA para as membranas.
NOTA: Feche ambos os lados deixando espaço extra dentro para permitir a mistura. - Coloque as membranas que contêm a solução gelatina-MA em um recipiente com 2 L de água destilada para diálise, deixando-as mexer a 40 °C por 5 dias (500 rpm).
NOTA: Cubra o recipiente para evitar a evaporação da água. - Troque a água destilada duas vezes por dia. Cada vez, vire as membranas de cabeça para baixo para homogeneizar.
- No quinto dia, misture 200 mL de água ultrauso pré-aquecido (40 °C) à gelatina dialisada-MA, e deixe mexer por 15 min a 40 °C.
- Transfira a solução gelatin-MA para tubos cônicos de 50 mL até 25 mL e deixe os tubos permanecerem a -80 °C por 2 dias.
NOTA: Armazene os tubos horizontalmente para facilitar a liofilização. - Lyophilize as soluções congeladas por 3-5 dias e armazene o GelMA liofilizado protegido da umidade.
4. Preparação de bioink
NOTA: Para obter 1 mL de bioink, recomenda-se fabricar pelo menos 3 mL de solução biomaterial, pois pode haver perdas durante a filtragem.
- Preparação da solução fibrinogênio
- Prepare a solução salina (NaCl 0,9%) em água deionizada e dissolva 10 mg de fibrinogênio do plasma bovino em 1 mL da solução salina para obter uma concentração de 10 mg/mL.
NOTA: Como adsorbs fibrinogen para vidro, não use frascos de vidro para preparar a solução fibrinogênio. - Deixe a solução em agitação a 37 °C até a dissolução completa da fibrinogênio.
NOTA: Para dissolução de fibrinogênio, utilize um sistema rotativo colocado dentro de um forno a 37 °C. A agitação magnética (180 rpm) de fibrinogênio em uma placa quente a 37 °C também é adequada. Nesta condição, o fibrinênio de 10 mg/mL leva aproximadamente 40 minutos para dissolver.
- Prepare a solução salina (NaCl 0,9%) em água deionizada e dissolva 10 mg de fibrinogênio do plasma bovino em 1 mL da solução salina para obter uma concentração de 10 mg/mL.
- Preparação da solução gelatina/GelMA
- Pesar 0,12 g de gelatina e adicioná-la a 1,9 mL de PBS pré-aquecido (40 °C) para obter uma concentração final de 4% (w/v) gelatina. Vórtice para facilitar a dissolução.
- Mantenha a emulsão a 40 °C até a dissolução completa.
- Pese 0,06 g de GelMA liofphilizado e transfira para a solução de gelatina para obter uma concentração final de 2% (w/v) GelMA. Vórtice para facilitar a dissolução.
- Mantenha a solução a 40 °C até a dissolução completa.
- Preparação de gelatina carregada de astrócitos/GelMA/bioink fibrinogen
- Pipeta 0,9 mL da solução fibrinogênio de 10 mg/mL e transferência para a solução gelatina/GelMA para obter uma concentração final de 3 mg/mL de fibrinogênio.
- Pese 0,015 g de fotoinitiador (PI) e transfira para a solução gelatina/GelMA/fibrinogênio para obter uma concentração final de 0,5% (w/v) PI. Misture a solução lançando o tubo para cima e para baixo e mantenha-o a 40 °C protegido da luz para evitar a degradação da PI.
NOTA: Estoque de bioinque a 4 °C para máxima de 24 horas. - Sob o fluxo laminar, filtre a solução usando um filtro de 0,2 μm em um tubo cônico estéril de 15 mL.
NOTA: A solução de biomateriais deve estar em 37-40 °C para permitir a filtragem. - Transfira 980 μL da solução biomaterial para um tubo cônico de 15 mL.
- Diluir laminina em solução salina para obter uma solução de estoque de 100 μg/mL.
- Pipeta 20 μL de laminina e transferência para o tubo contendo o bioink para obter uma concentração final de 2 μg/mL laminina.
- Misture suavemente por pipetting para cima e para baixo, evitando bolhas. Se alguma bolha persistir, centrifugar o tubo cônico a 200 x g por 2 min. Mantenha o bioink a 37 °C até misturar com as células.
- Trypsinize astrócitos primários com 0,05% de trippsina por 5 min.
NOTA: Use astrócitos das passagens 1 a 3. - Neutralizar a atividade de trippsina com FBS a uma proporção de 1:1 e transferir as células para um tubo cônico de 15 mL. Centrifusá-lo a 200 x g por 5 min.
- Conte as células e transfira 1 x 106 células para um tubo cônico diferente. Centrifusá-lo a 200 x g por 5 min.
- Remova o supernatante deixando um pequeno volume (~200 μL) para suspender a pelota celular, tocando suavemente a parte inferior do tubo cônico.
- Transfira 1 mL de solução de gelatina/GelMA/fibrinogênio para o tubo contendo as células e pipeta suavemente para cima e para baixo para homogeneizar, obtendo uma concentração final de 1 x 106 células/mL.
5. Preparação da solução crosslinker
- Reconstituição de trombina
- Prepare uma solução de estoque de trombina 100 U/mL em água desionizada estéril com albumina de soro bovino de 0,1% (w/v) (BSA) em um tubo cônico de 15 mL. Estoque em microtubos a -20 °C.
NOTA: Como adsorbs de trombo ao vidro, não use frascos de vidro para preparar a solução de estoque ou armazenar as alíquotas.
- Prepare uma solução de estoque de trombina 100 U/mL em água desionizada estéril com albumina de soro bovino de 0,1% (w/v) (BSA) em um tubo cônico de 15 mL. Estoque em microtubos a -20 °C.
- Preparação da solução thrombin-CaCl2
- Pipeta 100 μL de solução de estoque de trombina e transferência para um tubo cônico de 50 mL contendo 8,9 mL de água deionizada estéril para obter uma concentração final de 1 U/mL de trombina.
- Prepare uma solução CaCl2 de 10% (w/v) em água desionizada e esterilize usando um filtro de 0,2 μm.
- Transfira 1,1 mL da solução cacl2 de 10% para o tubo cônico contendo trombina, a fim de obter uma razão final de 1:9 (CaCl2 para trombina).
NOTA: Prepare a solução crosslinker no volume a ser utilizado no experimento, evitando o armazenamento.
6. Bioink carregado de astrócitos bioimpressos com uma bioimpressora baseada em extrusão
- Projeto do tecido neural
- Utilizando o código G: construa uma grade de 6 x 6 mm (forma quadrada) com 1 mm de distância entre cada linha bioimpressora no eixo X e Y, e 6 camadas no eixo Z (0,2 mm entre cada linha); definir a extrusão (E) para 0,01 mm, aumentando 0,001 mm em cada nova camada do eixo Z; e definir a velocidade de impressão (F) para 400 mm/min(Informações Suplementares).
- Bioimpressora configurada
- Exponha a máquina à luz UV por 15 minutos e, em seguida, limpe-a com etanol 70%.
- Ligue a bioimpressora usando o interruptor de alimentação. Conecte a máquina ao computador através de um cabo USB. Abra o software de controle para conectá-lo ao bioimpressor e carregar o design do arquivo.
- Preparação da seringa bioimpressora
- Transfira o bioink de gelatina/GelMA/fibrinogen carregado de astrócitos para uma seringa plástica de 5 mL usando uma pipeta de 1.000 μL.
NOTA: Transfira lentamente para evitar a formação de bolhas. - Conecte uma agulha estéril de 22 G à seringa.
NOTA: Deixe a seringa a 4 °C por 2 minutos. - Conecte a seringa ao cabeçoteiro bioimpressor e lave manualmente o bioink para remover as bolhas restantes.
- Transfira o bioink de gelatina/GelMA/fibrinogen carregado de astrócitos para uma seringa plástica de 5 mL usando uma pipeta de 1.000 μL.
- Bioimpressão
NOTA: A bioimpressão foi realizada fora do capô laminar.- Coloque um prato de cultura de 35 mm na mesa bioimpressora e posicione a agulha 0,1 mm longe da superfície do prato de cultura para permitir o movimento da agulha.
NOTA: Use um prato de cultura de 35 mm para cada bioimpressão. - Pressione o botão Imprimir.
- Uma vez que a bioimpressão sobre, certifique-se de que a seringa se afasta do prato. Em seguida, feche o prato de cultura e prepare-se para o processo de crosslinking.
NOTA: A bioimpressão de uma construção leva aproximadamente 1 min e 10 s.
- Coloque um prato de cultura de 35 mm na mesa bioimpressora e posicione a agulha 0,1 mm longe da superfície do prato de cultura para permitir o movimento da agulha.
- Crosslinking a construção bioimpressora e cultura
- Coloque o prato de cultura sob luz UV a 2 mW/cm2 para 2 x 60 s (para cima e para baixo) para o crosslinking gelma.
- Sob o fluxo laminar, transfira a construção bioimpressora para uma placa de 24 poços usando uma espátula estéril.
- Adicione 500 μL de solução thrombin/CaCl2 e deixe por 30 minutos para permitir a ligação cruzada de fibrinas.
- Remova a solução de crosslinking e lave a construção com 2 mL de PBS 1x. Em seguida, substitua o PBS por 1 mL de cultura de astrócitos médio e incubar a 37 °C e 5% de CO2. Troque o meio a cada 3 dias.
7. Avaliação da viabilidade dos astrócitos
- Viabilidade de astrócitos bioimpressas
- Transfira a construção bioimpressora para um prato de cultura de 35 mm usando uma espátula.
- Lave a construção com 1 mL de 1x PBS.
- Deposite 100 μL do reagente Vivo/Morto sobre a construção e mantenha-o a 37 °C por 30 min, mantendo-o protegido da luz.
- Remova o reagente Vivo/Morto e lave o construto com 1 mL de PBS 1x.
- Transfira a amostra para um prato confocal usando uma espátula, e observe as células dentro do construto sob um microscópio confocal usando excitação de 488 e 570 nm para aquisição de imagens.
NOTA: Use uma ampliação de 10x para uma visualização geral das células dentro da construção. - Certifique-se de que a amostra está sentada plana. Se necessário, coloque uma mancha de cobertura sobre a amostra para aumentar o achatamento.
NOTA: Durante a imagem, certifique-se de que o prato confocal está bem selado para evitar que a amostra seque. - Calcule o número de viável (verde) e morto (vermelho) usando um software computacional.
- Viabilidade da cultura de astrócitos 2D
- Semente 0,5 x 106 astrócitos (passagem 1-3) em um prato confocal de 35 mm, adicione astrócitos médios e incuba-los a 37 °C e 5% de CO2.
- Quando as células estiverem confluentes, remova o meio de cultura e lave com 1 mL de 1x PBS.
- Deposite 200 μL do reagente Vivo/Morto e mantenha o prato a 37 °C por 30 min, protegido da luz.
- Remova o reagente Vivo/Morto e lave as células com 1 mL de PBS 1x.
- Leve o prato para um microscópio confocal juntamente com uma câmera digital, e use excitação de 488 e 570 nm para aquisição de imagem.
- Calcule o número de viável (verde) e morto (vermelho) usando um software computacional.
8. Imunostaining de astrócitos
- Coloração ácida fibrilar gliana (GFAP) de astrócitos bioimpressos bioimpressos 3D
NOTA: Para investigar a presença de outros marcadores celulares, altere o anticorpo primário de acordo.- Retire o meio do poço e lave o construto com 1 mL de PBS 3x.
- Adicione 4% de paraformaldeído (PFA) no PBS ao poço até que a construção esteja completamente coberta e deixe-a por 2h a 4 °C.
- Retire o PFA e lave o construto com 1 mL de PBS 3x.
NOTA: Este procedimento pode ser pausado por vários meses se armazenado a 4 °C em PBS. Certifique-se de que a placa do poço está selada para evitar a evaporação do PBS. - Trate a amostra com glicina 0,1 mol/L por 5 min.
- Lave com 1 mL de 1x PBS por 5 min.
- Permeabilize a amostra com PBS contendo 0,1% Triton X-100 e 10% FBS por 1 h a 25 °C sob agitação orbital.
- Incubar a construção com frango anti-GFAP (diluição de anticorpos primários 1:500) a 4 °C durante a noite.
- Aspire o anticorpo primário e lave a amostra com 1 mL de PBS por 5 minutos e 3 vezes.
NOTA: O anticorpo primário pode ser reutilizado várias vezes quando armazenado a 4 °C. - Incubar a amostra com fluor Alexa 488-conjugado anti-frango (diluição secundária de anticorpos 1:500) e 1 μg/mL DAPI por 1 h a 25 °C sob agitação orbital.
NOTA: Mantenha a amostra protegida contra a luz. - Lave a amostra com 1 mL de PBS por 5 min, 3 vezes.
- Transfira a construção para um prato confocal de 35 mm.
NOTA: Certifique-se de que o prato está bem lacrado para evitar que a amostra seque.
- Coloração ácida fibrilar gliana (GFAP) da cultura de astrócitos 2D
- Semente 0,5 x 106 astrócitos (passagem 1-3) em um prato confocal de 35 mm, adicione astrócitos médios e incuba-los a 37 °C e 5% de CO2.
- Quando as células estiverem confluentes, remova o meio de cultura e lave-as com 1 mL de 1x PBS.
- Repetição de passos 8.1.2-8.1.10.
- Coloração de citrócitos de citoesqueleto
- Repetição passos 8.1.1-8.1.6.
- Adicione 200 μL de 50 μg/mL de solução de faloidagem conjugada fluorescente em PBS e 1 μg/mL de DAPI sobre a construção.
- Incubar por 1h a 25 °C sob agitação orbital, mantendo a amostra protegida da luz.
- Lave a amostra com 1 mL de PBS por 5 min 3 vezes e transfira a construção para um prato confocal usando uma espátula.
NOTA: Certifique-se de que o prato está bem lacrado para evitar que a amostra seque.
9. Imagem confocal
- Leve os pratos para um microscópio confocal aliado a uma câmera digital para imagem (359, 488 e 570 nm de excitação).
- Use ampliação de 10x para uma visualização global e 40 ou 63x para imagens ampliadas de células.
NOTA: Certifique-se de que a amostra está sentada plana. Se necessário, coloque uma mancha de cobertura sobre a amostra para aumentar o achatamento.
Resultados
Este trabalho teve como objetivo desenvolver um tecido neural usando a tecnologia de bioimpressão 3D para depositar gelatina carregada de astrócitos primários de camada por camada/GelMA/fibrinogen bioink. Os astrócitos foram extraídos e isolados do córtex cerebral de filhotes de camundongos(Figura 1),adicionados a uma composição biomaterial, permitindo a biofabricação de uma construção 3D viva.
O design auxiliado por computador (CAD) foi desenvolvido utilizando-se o código G (arquivo suplementar)como um quadro interconectado de forma quadrada (0,6 x 0,6 mm), com poros de 1 mm, visando facilitar a difusão de nutrientes e oxigênio. O quadro foi composto por 6 camadas colocadas em cima uma da outra, mudando em um ângulo de 90° em cada camada (Figura 2A i). A estrutura projetada possuía aproximadamente 5 mm de altura (Figura 2A ii),permitindo a manipulação tecidual. A composição do bioink também permitiu a fabricação de construções de diferentes formas(Figura 2B).
A preparação do bioink composto de gelatina, GelMA e fibrinogênio compreendeu dois passos transligados. Primeiro, o GelMA foi cruzado sob luz UV, na qual se formam ligações covalentes inter e intramolecular, seguidas por crosslinking de fibrina. Nesta etapa, a trombina enzimáticamente corta cadeias fibrinogenais, resultando na formação de fibras fibrinas17, uma reação estabilizada por íons ca2+ 18. Em seguida, as fibras gelma e fibrina formam uma rede de polímero interpenetrada estável (IPN) complementada com laminina, suporte adequado para fixação celular e disseminação19,20 (Figura 2C).
Antes da bioimpressão, após 12 dias de isolamento, os astrócitos eram caracterizados pela presença de GFAP, um componente proteico dos filamentos intermediários de astrócito4 (Figura 3A). Em seguida, os astrócitos trypsinizados foram misturados com a solução de gelatina/GelMA/fibrinogênio a uma densidade de 1 x 106 células/mL, gerando um bioink carregado de astrócitos. O bioink foi transferido para uma seringa de 5 mL conectada a uma agulha cega de 22 G, compondo o cabeçote de impressão bioimpressora(Figura 3B i). A agulha permitiu a extrusão de bioink sem entupir e evitar alto estresse de tesoura para as células.
Devido às propriedades viscoelásticas da gelatina, que se comporta como um fluido a temperaturas mais altas e como gel a temperaturas mais baixas21,a construção bioimpressora retém a fidelidade de forma(Figura 3B ii). Após a bioimpressão de duas camadas consecutivas de bioink, observou-se a formação de uma estrutura bem definida(Figura 3C),com células presas dentro do biomamaterial.
Após processos de bioimpressão e crosslinking, a construção foi incubada com meio astrócito, e após 1 dia de bioimpressão, a maioria das células ainda apresentava uma morfologia redonda(Figura 3D). Andaimes bioimpressos mantiveram a integridade após 7 dias de incubação, e embora algumas células redondas tenham sido observadas, um grande número de astrócitos se espalhou por toda a construção, apresentando morfologia astróctica e interconexão(Figura 3E).
Porque os parâmetros da bioimpressão, como a velocidade, poderia afetar diretamente a viabilidade celular, diferentes velocidades de bioimpressão (400, 600 e 800 mm/min) foram testadas e a sobrevivência dos astrócitos avaliadas usando o ensaio Live/Dead com calceína-AM (células vivas, fluorescência verde) e homodimer-III (EthD-II) (células mortas, fluorescência vermelha). A porcentagem de células viáveis foi quantificada por meio de um software computacional, calculando o número de células vivas e mortas. A viabilidade celular foi avaliada no momento 0 (logo após a bioimpressão), e os resultados mostraram que, na menor velocidade, 400 mm/min, as células viáveis representaram 74,08% ± 1,33% do total das células, sendo significativamente maiores do que as células bioimpressionadas a 600 e 800 mm/min (60,25% ± 1,93% e 62,94 ± 6,18%, respectivamente) (Figura 4A). Portanto, a velocidade de 400 mm/min foi utilizada neste trabalho.
Antes da bioimpressão, os astrócitos cultivados em 2D eram caracterizados como a porcentagem de células viáveis, e a viabilidade dos astrócitos bioimpressados foi normalizada para essa condição. Os resultados mostraram que a cultura 2D apresentou 90,98% ± 0,94% das células viáveis. A viabilidade dos astrócitos bioimpressos (dia 7) foi de 83,54% ± 3,00%, representando 0,92 ± 0,03 do valor 2D, que foi significativamente maior que o do dia 0 (0,81 ± 0,01)(Figura 4B). Imagens de astrócitos manchados com o reagente vivo/morto são apresentadas na Figura 4C, e mostram que após a bioimpressão, as células possuíam uma morfologia redonda(Figura 4C i). Após 1 semana de incubação, os astrócitos se espalharam por toda a construção (Figura 4C ii), mostrando uma morfologia distinta das células da cultura 2D(Figura 4C iii).
Os astrócitos bioimpressos foram manchados para mostrar densidade celular e morfologia celular dentro da construção. A Figura 5A mostra uma construção bioimpressora após 7 dias de incubação, com alta densidade de astrócitos manchados com fhalloidina, um corante de citoesqueleto F-actin. Embora poucas células redondas tenham sido observadas, os astrócitos apresentaram principalmente uma morfologia semelhante a uma estrela. Os astrócitos bioimpressos mostraram-se positivos em GFAP quando manchados após 7 dias de bioimpressão, indicando que as células mantiveram seu fenótipo astrócito(Figura 5B i). As figuras 5B ii e 5B iii mostram as imagens empilhadas em Z dos astrócitos GFAP+ bioimpressos dentro da construção. Esses resultados indicam que a composição do bioink proporcionou um microambiente biocompatível para promover a adesão, disseminação e crescimento dos astrócitos.

Figura 1: Extração da separação cerebral e córtex para a cultura dos astrócitos primários. Os astrócitos primários foram isolados do córtex do cérebro de filhotes de camundongos C57Bl/6 (pós-natal 1). Após extrair o cérebro do animal, as meninges foram removidas sob um microscópio, e o córtex separado seguido pela digestão tecidual e cultura de astrócitos. Clique aqui para ver uma versão maior desta figura.

Figura 2: Ilustração esquemática do processo de bioimpressão 3D. (A) Arquivo CAD projetado para a bioimpressão 3D do tecido neural mostrando(i)2 camadas, visão superior, e(ii)6 camadas, visão lateral, da construção. (B) Imagens que mostram a capacidade do bioink para imprimir estruturas de diferentes formas (i) quadrado, (ii) capilar, e (iii)estrela. (C) Esquema de crosslinking de biomateriais após a exibição de bioimpressão 3D, onde o GelMA é interligado sob luz UV seguido de crosslinking fibrina em um banho thrombin:Ca2+. Clique aqui para ver uma versão maior desta figura.

Figura 3: Boprinting 3D de gelatina carregada de astrócitos/GelMA/fibrinogen bioink. (A) Caracterização de astrócitos após 12 dias de isolamento e cultura, manchadas para GFAP, verde e DAPI, azul. (B)(i) Configuração de cabeçoteiro de impressão e (ii)construção bioimpressora 3D logo após a bioimpressão. (B) Construção em duas camadas mostrando o quadro bioimpresso. Ampliação de 4x. (C) Imagem de astrócitos bioimpressos 1 dia após a bioimpressão, mostrando células em uma morfologia redonda. (D) Imagem de astrócitos bioimpressos 7 dias após o processo de bioimpressão, mostrando células com morfologia astróctica com poucas células redondas, indicando sua afinidade com o tecido mimético. Ampliação de 10x. Clique aqui para ver uma versão maior desta figura.
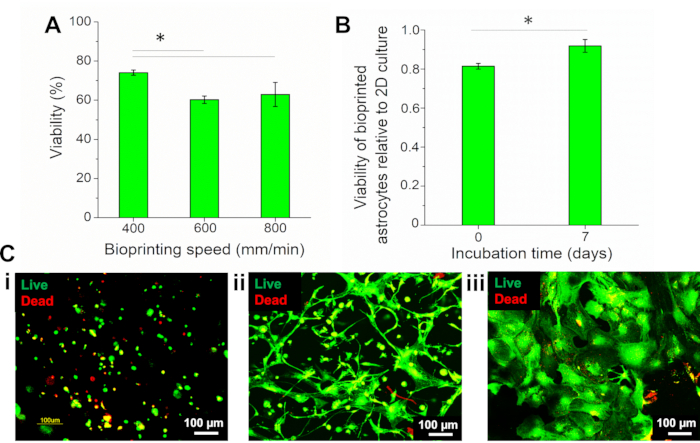
Figura 4: Avaliação da viabilidade dos astrócitos bioimpressas. (A) Viabilidade de astrócitos bioimpressos em velocidades diferentes. (B) Viabilidade de astrócitos bioimpressos no (i) dia 0 (logo após a bioimpressão) e (ii) após 7 dias de bioimpressão, normalizada à viabilidade de astrócitos na cultura 2D. Análise estatística por meio de Anova Unidirecional com teste de Tukey, n = 3, *p < 0,05. (C) Imagens fluorescentes de astrócitos manchados com reagente Vivo/Morto. Astrócitos bioimpressos no(i) dia 0 (logo após a bioimpressão),(ii) dia 7, e (iii) cultura 2D de astrócitos. Ampliação de 10x. Clique aqui para ver uma versão maior desta figura.

Figura 5: Caracterização de astrócitos bioimpostos 3D. Imunofluorescência de astrócitos bioimpressos 3D após 7 dias de incubação manchada para (A) F-actin (fhalloidina, vermelho) e núcleos (DAPI, azul) com ampliação de 10x e 40x e para(B) GFAP, verde (i) com ampliação de 10x,(ii)Z-stacked mostrando o eixo X-Y-Z da construção bioimpressora, e (iii)imagem mostrando o eixo X-Z dos astrócitos GFAP+. Clique aqui para ver uma versão maior desta figura.
Arquivo suplementar. Clique aqui para baixar este Arquivo.
Discussão
A tecnologia de bioimpressão 3D surgiu como uma alternativa de biofabricação que permite a engenharia de construtos refinados que se assemelham estrutural e fisiologicamente aos tecidos nativos22, incluindo o cérebro23. A biofabricação de tecidos neurais permite a modelagem in vitro de microambientes nativos, sendo uma importante ferramenta para a compreensão dos mecanismos celulares e moleculares associados ao desenvolvimento e tratamento de muitas doenças que afetam o CNS11. Devido ao importante papel das células gliais na funcionalidade neural, os astrócitos corticais têm sido utilizados em muitos estudos, como desenvolvimento cerebral24, transporte de biomoléculas25,crescimento de neurita26e biofablicação de tecido cerebral14.
Métodos para engenharia cultura 3D de astrócitos foram relatados anteriormente, utilizando diferentes biomateriais e técnicas de andaimes27,28,29. Da mesma forma, também foi relatado um método para bioimpressão de células-tronco pluripotentes induzidas por humanos (hiPSCs) e mostrou a capacidade dessas células bioimpressoras de diferenciar e amadurecer in vitro30. No entanto, não há relatos de métodos para biofabidade de construtos de astrócitos brioprinted 3D na literatura. Em seguida, este protocolo visava descrever um método reprodutível para astrócitos cortical bioimpressoras 3D.
Neste protocolo, os astrócitos foram isolados dos cortices cerebrais de filhotes de camundongos C57Bl/6, um modelo animal amplamente utilizado na pesquisa31,32, que pode ser substituído por astrócitos derivados de outras fontes, como hiPSCs e medula espinhal. Após o isolamento, cultura e subcultura, os astrócitos permanecem em estado proliferativo até a passagem 3, que é o número máximo de divisão recomendada devido à sua limitação intrínseca de proliferação8. Verificou-se que a proliferação de astrócitos da passagem 4 foi limitada, sendo difícil alcançar a quantidade desejada de células para bioimpressão 3D.
No método descrito, utilizou-se uma concentração de 1,0 x 106 células/mL de solução biomaterial, como prova de conceito para avaliar a capacidade das células de sobreviver ao processo de bioimpressão e manter sua viabilidade e propriedades intrínsecas durante a cultura dentro do hidrogel. No trabalho anterior, um tecido neural bioimpresso 3D foi biofabricado por astrócitos e neurônios co-culturados, e para aumentar a interação celular, a concentração de astrócitos foi de 8,0 x 106 células/mL14. Em seguida, a concentração de células pode ser otimizada para estudos específicos.
Um bioink para bioimpressão 3D é composto de células e um bioma material ou uma combinação de biomateriais33. Neste protocolo, utilizou-se uma combinação de gelatina/GelMA/fibrinogênio, que mostrou-se favorável tanto para a bioimpressão quanto para a manutenção dos astrócitos na cultura. A produção de um bioink bioimpresso é desafiadora ao usar técnica de bioimpressão baseada em extrusão. A composição do biomaterial deve possuir propriedades viscoelásticas que, ao mesmo tempo, permitem a extrusão do bioink, mantendo a forma 3D após o processo de impressão34. Além disso, deve ser capaz de manter a viabilidade celular durante o processo, que dependendo das condições de bioimpressão, pode causar estresse de tesoura nas células que levam à morte35.
A bioimpressão foi assegurada pela gelatina, um biomatéreo que possui propriedades viscoelásticas ideais devido à sua capacidade de transição sol-gel36. Isso permite que as macromoléculas de gelatina reorganizem e se comportem como um fluido durante a extrusão, e como gel após a bioimpressão, mantendo a estrutura 3D. Além disso, como derivado de colágeno, a gelatina é composta de repetições de triplas de peptídeos de glicina-aminoácido, que garantem a especificidade celular21. No entanto, as ligações intra e intermolecular da gelatina são fracas, e devido à sua maior lisibilidade, a gelatina não tem estabilidade a 37 °C, sendo liberada do construto durante a cultura celular. Portanto, o GelMA tornou-se uma alternativa como hidrogel estável, devido às ligações covalentes formadas após a exposição de luz UV, mantendo propriedades de especificidade celular19. As propriedades físicas do GelMA, como porosidade, degradação e módulo elástico podem ser ajustadas para atender a diferentes aplicações de engenharia de tecidos19. A rigidez dos andaimes de GelMA pode ser controlada variando a substituição de metacristaloyl37,permitindo alcançar uma rigidez semelhante à do tecido a ser modelado. Ou seja, ao diminuir o grau de funcionalização, uma rigidez menor pode ser alcançada37. Portanto, devido à maciez do cérebro do camundongo38,39 e ao efeito direto da rigidez da matriz extracelular (ECM) sobre o comportamento celular40, neste protocolo foi proposto um baixo grau de funcionalização da gelatina. Nos trabalhos anteriores, foi relatada a capacidade dos hidrogéis GelMA de imitar características físicas do CNS, mostrando alta adequação para a cultura de astrócitos, neurônios e células-tronco neurais14,41,42.
Além do GelMA, o fibrinogênio, um biopolímero nativo que forma fibras de fibrina através de reação enzimática, também tem sido amplamente utilizado para biofabricar tecido neural, mostrando alta especificidade e oferecendo um microambiente adequado para que as células neurais se conectem e cresçam30,43,44. Outros biomateriais, como alginato e quitossan têm sido usados para bioimpressão de tecidos neurais, misturados à gelatina, GelMA e/ou fibrinogênio, visando melhorar a impressão e as propriedades físicas dos andaimes 3D14,30. No presente método, foi alcançada uma bioimpressão ideal, estabilidade física e especificidade celular utilizando gelatina, GelMA e fibrinogênio como componentes do bioink. A fim de aumentar o reconhecimento dos astrócitos ao microambiente, laminina - um componente do cérebro ECM - foi usado para complementar o bioink.
Neste protocolo, a gelatina foi utilizada em uma concentração de 4% (w/v), o que permitiu a transição sol-gel do bioink a 25 °C dentro de aproximadamente 10 min. Uma gelação mais rápida pode ser alcançada aumentando a concentração de gelatina. No entanto, a esterilização por filtragem usando filtro de 0,2 μm pode ser comprometida. A filtragem de bioink é um passo crítico, verificando se maiores concentrações de gelatina (>5% c/v) podem impedir a filtragem. Uma alternativa para obter um ponto de gelação mais rápido durante a bioimpressão é deixar a seringa contendo o bioink a 4 °C por 2 minutos antes de conectá-lo no cabeçoteiro bioimpressor. Após a bioimpressão, é crucial manter a construção a 25 °C para evitar desestabilizar a estrutura 3D e manter uma condição gelada antes da exposição UV. Notavelmente, a construção deve ser sólida quando a solução transfronteiriço fibrinogen é adicionada à placa. Para o crosslinking gelma, é importante virar a amostra (2 x 60 s cada lado) para garantir a exposição UV durante toda a construção. Para o crosslinking fibrinogênico, a solução crosslinker deve cobrir completamente a construção. Portanto, se usar um prato ou prato maior, o volume deve ser ajustado. Após a ligação cruzada, o hidrogel deve parecer homogêneo sob microscopia de contraste de fase e as células devem ser distribuídas de forma homogênea ao longo da construção, possuindo uma morfologia redonda.
Este protocolo permitiu que o bioink de gelatina/GelMA/fibrinogen imprima estruturas de diferentes formas, mantendo a integridade e a forma 3D dos construtos. Devido às limitações da temperatura chegar a 25 °C dentro do fluxo laminar, a bioimpressão foi realizada na sala de cultura fora do fluxo laminar. O tempo de bioimpressão foi de aproximadamente 1 min para cada amostra, e nenhuma contaminação foi observada durante a cultura celular.
A integridade celular pode ser afetada pela bioimpressão, devido ao estresse da tesoura causado no processo35. Isso pode ser controlado otimizando parâmetros de impressão, como a velocidade de impressão. Neste trabalho, foram testadas diferentes velocidades de bioimpressão, 400, 600 e 800 mm/min, observando uma diminuição significativa na viabilidade celular quando a velocidade foi aumentada de 400 para 600 mm/min. A 400 mm/min, cerca de 74% das células permaneceram viáveis após a bioimpressão, e esse valor aumentou significativamente após 7 dias de incubação (>80%). Portanto, velocidades mais baixas não foram utilizadas para evitar a exposição excessiva de células ao ambiente. A cultura 2D dos astrócitos apresentou maior viabilidade (~90%) em comparação com as células bioimpressoras. No entanto, como mostrado por imagens fluorescentes, a morfologia é afetada pelo tipo de cultura. Enquanto as células 2D eram planas, os astrócitos em ambiente 3D possuíam uma forma semelhante a uma estrela, interligando-se entre si por processos celulares.
Notavelmente, o microambiente mimético foi favorável à cultura dos astrócitos corticais, uma vez que a viabilidade celular aumentou significativamente após uma semana, sugerindo a proliferação celular dentro da construção. Laminina, uma glicoproteína presente no cérebro ECM, foi adicionada ao bioink com o objetivo de alcançar uma maior adesão dos astrócitos ao hidrogel14. A coloração do citoesqueleto F-actin mostrou que os astrócitos bioimpressos estavam em alta densidade dentro do construto, indicando que a concentração celular usada neste protocolo permitia a interconexão dos astrócitos. A imunohistoquímica para localização de GFAP, marcador correlacionado com a arborização extensiva dos astrócitos e hipertrofiacelular 45,corroborada pela coloração da f-actina, mostrou que as células apresentavam morfologia astróiítica típica, indicando que o sistema 3D mimético era favorável para que as células se anexem e se comportassem como em seu ambiente nativo.
O protocolo aqui apresentado descreve um procedimento eficiente e reprodutível para astrócitos cortical bioimpressoras bioimpressoras 3D. Devido à importância dos astrócitos na resposta neuroinflamação à lesão, bem como na regulação da funcionalidade neuronal, estudos envolvendo essa célula gliana poderiam contribuir para muitos aspectos na compreensão de doenças que afetam o SNC. Portanto, o modelo in vitro 3D aqui apresentado é útil em aplicações futuras que visam estudar interações astrocito-neurônio, a funcionalidade dos astrócitos em patologias cerebrais e o potencial dos astrócitos como alvos terapêuticos.
Divulgações
Os autores não têm conflitos para revelar.
Agradecimentos
Este trabalho foi apoiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), números de bolsas 2018/23039-3 e 2018/12605-8; Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), números de bolsas 465656/2014-5 e 309679/2018-4; e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), código financeiro 001.
Materiais
| Name | Company | Catalog Number | Comments |
| 3D Bioprinter | 3D Biotechnology Solutions | Extrusion-based bioprinter | |
| Blunt-tip forceps | Integra Miltex | 6--30 | Forceps for brain dissection previously sterilized |
| Bovine serum albumin | Sigma-Aldrich | 9048-46-8 | Protease free, fatty acid free, essentially globulin free |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | |
| Cell culture flask | Fisher Scientific | 156340 | Culture flask T25 |
| Cell strainer | Corning Incorporated | 352340 | Cell strainer 40 µm |
| Confocal microscope | Leica | Confocal TCS SP8 microscopy coupled with an Olympus FluoView 300 confocal system | |
| Conical tubes | Thermo Scientific | 339651, 339652 | Sterile tubes of 15 mL and 50 mL |
| DAPI | Abcam | ab224589 | DAPI staining solution |
| DMEM/F12 | Gibco; Life Technologies Corporation | 12500062 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Dyalisis tubing | Sigma-Aldrich | D9527 | Molecular weight cut-off = 14 kDa |
| Ethanol | Fisher Scientific | 64-15-5 | Reagent grade |
| Fetal Bovine Serum | Gibco; Life Technologies Corporation | 12657011 | Research Grade |
| Fibrinogen | Sigma-Aldrich | 9001-32-5 | Fibrinogen cristalline powder from bovine plasma |
| Gelatin | Sigma-Aldrich | 9000-70-8 | Gelatin powder from porcine skin |
| Glycine | Sigma-Aldrich | 56-40-6 | Glycine powder |
| Hanks Buffered Salt Solution (HBSS) | Gibco; Life Technologies Corporation | 14175095 | No calcium, no magnesium, no phenol red |
| L-Glutamine | Sigma-Aldrich | 56-85-9 | L-Glutamine crystalline powder |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin 1-2 mg/mL L in 50 mM Tris-HCl |
| Live dead kit cell imaging kit | Thermo Scientific | R37601 | Green fluorescence in live cells (ex/em 488 nm/515 nm). Red fluorescence in dead cells (ex/em 570 nm/602 nm) |
| Methacrylic anhydride | Sigma-Aldrich | 760-93-0 | For GelMA preparation |
| Microtubes | Corning Incorporated | MCT-150-C | Microtubes of 1,5 mL |
| NaCl | Sigma-Aldrich | 7647-14-5 | |
| Needle 22G | Fisher Scientific | NC1362045 | Sterile blunt needle |
| Operating scissor | Integra Miltex | 05--02 | Sharp scissor for brain dissection previously sterilized |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | Paraformaldehyde powder |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | 15070063 | Pen Strep (5,000 Units/ mL Penicillin; 5,000 ug/mL Streptomycin) |
| Petri dish | Corning Incorporated | 430591, 430588 | Sterile petri dishes of 35 and 100 mm |
| Phalloidin | Abcam | ab176753 | iFluor 488 reagent |
| Photoinitiator | Sigma-Aldrich | 106797-53-9 | 2-Hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone |
| Phosphate buffer saline (PBS) | Gibco; Life Technologies Corporation | 10010023 | PBS 1 x, culture grade, no calcium, no magnesium |
| Poly-L-lysine | Sigma-Aldrich | 25988-63-0 | Poly-L-lysine hydrobromide mol wt 30,000-70,000 |
| Primary antobody | Abcam | ab4674 | Chicken polyclonal to GFAP |
| Secondary antibody | Abcam | ab150176 | Alexa fluor 594 anti-chicken |
| Spatula | Miltex | V973-70 | Number 24 cement spatula previously sterilized |
| Stereomicroscope | Fisherbrand | 3000038 | Microscope for brain dissection |
| Syringe 5 mL | BD | 1222C84 | Sterile syringe |
| Syringe filter 2 µm | Fisher Scientific | 09-740-105 | Polypropylene filter for sterilization |
| Thrombin | Sigma-Aldrich | 9002--04-4 | Thrombin cristalline powder from bovine plasma |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Laboratory grade |
| Trypsin-EDTA | Gibco; Life Technologies Corporation | 15400054 | Trypsin no phenol red 1 x diluted in PBS |
| Versene solution | Gibco; Life Technologies Corporation | 15040066 | Versene Solution (0.48 mM) formulated as 0.2 g EDTA(Na4) per liter of PBS |
| Well plate | Thermo Scientific | 144530 | Sterile 24-well plate |
Referências
- Di, L., Mannelli, C., Cuzzocrea, S. Astrocytes: Role and functions in brain pathologies. Frontiers in Pharmacology. 10, 1114(2019).
- Kimelberg, H. K., Nedergaard, M. Functions of astrocytes and their potential as therapeutic targets. Neurotherapeutics. 7 (4), 338-353 (2010).
- Giovannoni, F., Quintana, F. J. The role of astrocytes in CNS inflammation. Trends in Immunology. 41 (9), 805-819 (2020).
- Escartin, C., et al. Reactive astrocyte nomenclature, definitions, and future directions. Nature Neuroscience. 24 (3), 312-325 (2021).
- Carson, M. J., Thrash, J. C., Walter, B. The cellular response in neuroinflammation: The role of leukocytes, microglia and astrocytes in neuronal death and survival. Clinical Neuroscience Research. 6 (5), 237-245 (2006).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Clarke, L. E., et al. Normal aging induces A1-like astrocyte reactivity. Proceedings of the National Academy of Sciences of the Unied States of America. 115 (8), 1896-1905 (2018).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes isolation and culture of mouse cortical astrocytes. Journal of Visualized Experiments: JoVE. (71), e50079(2013).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Knight, E., Przyborski, S. Advances in 3D cell culture technologies enabling tissue-like structures to be created in vitro. Journal of Anatomy. 227 (6), 746-756 (2015).
- Zhuang, P., Sun, A. X., An, J., Chua, C. K., Chew, S. Y. 3D neural tissue models: From spheroids to bioprinting. Biomaterials. 154, 113-133 (2018).
- Balasubramanian, S., Packard, J. A., Leach, J. B., Powell, E. M. Three-dimensional environment sustains morphological heterogeneity and promotes phenotypic progression. Tissue Engineering. Part A. 22 (11-12), 885-898 (2016).
- Watson, P. M. D., Kavanagh, E., Allenby, G., Vassey, M. Bioengineered 3D glial cell culture systems and applications for neurodegeneration and neuroinflammation. SLAS Discovery. 22 (5), 583-601 (2017).
- Li, Y. E., Jodat, Y. A., Samanipour, R., Zorzi, G., Zhu, K. Toward a neurospheroid niche model: optimizing embedded 3D bioprinting for fabrication of neurospheroid brain-like co-culture constructs. Biofabrication. , (2020).
- Zhou, X., et al. Three-dimensional-bioprinted dopamine-based matrix for promoting neural regeneration. ACS Applied Materials & Interfaces. 10 (10), 8993-9001 (2018).
- de la Vega, L., et al. 3D bioprinting human induced pluripotent stem cell-derived neural tissues using a novel lab-on-a-printer technology. Applied Sciences. 8 (12), 2414(2018).
- Scheraga, H. A. The thrombin-fibrinogen interaction. Biophysical Chemistry. 112 (2-3), 117-130 (2004).
- Ariens, R. A. S., Lai, T., Weisel, J. W., Greenberg, C. S., Grant, P. J. Role of factor XIII in fibrin clot formation and effects of genetic polymorphisms. Blood. 100 (3), 743-754 (2002).
- Yue, K., et al. Synthesis, properties, and biomedical applications of Gelatin Methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- de Melo, B. A. G., et al. Strategies to use fibrinogen as bioink for 3D bioprinting fibrin-based soft and hard tissues. Acta Biomaterialia. 117, 60-76 (2020).
- Wang, X., et al. Gelatin-based hydrogels for organ 3D bioprinting. Polymers (Basel). 9 (9), 401(2017).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Naure. Biotechnology. 32 (8), 773-785 (2014).
- de la Vega, L., Lee, C., Sharma, R., Amereh, M., Willerth, S. M. 3D bioprinting models of neural tissues: The current state of the field and future directions. Brain Research Bulletin. 150, 240-249 (2019).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Hanu, R., et al. Monocarboxylic acid transporters, MCT1 and MCT2, in cortical astrocytes in vitro and in vivo. American Journal of Physiology. Cell Physiology. 278 (5), 921-930 (2000).
- Liu, R., Wang, Z. h, Gou, L., Xu, H. A cortical astrocyte subpopulation inhibits axon growth in vitro and in vivo. Molecular Medicine Reports. 12 (2), 2598-2606 (2015).
- Winter, C. C., Cullen, D. K., Donnell, J. C. O., Song, Y. J., Hernandez, N. S. Three-dimensional tissue engineered aligned astrocyte networks to recapitulate developmental mechanisms and facilitate nervous system regeneration. Journal of Visualized Experiments: JoVE. (131), e55848(2018).
- East, E., Golding, J. P., Phillips, J. B. A versatile 3D culture model facilitates monitoring of astrocytes undergoing reactive gliosis. Journal of Tissue Engineering and Regenerative Medicine. 3 (8), 634-646 (2009).
- Hawkinsn, B. T., Grego, S., Sellgren, K. L. Three-dimensional culture conditions differentially affect astrocyte modulation of brain endothelial barrier function in response to transforming growth factor B1. Brain Research. 1608, 167-176 (2015).
- Abelseth, E., et al. 3D printing of neural tissues derived from human induced pluripotent stem cells using a fibrin-based bioink. ACS Biomaterials Science and Engineering. 5 (1), 234-243 (2019).
- Filippo, T. R. M., et al. CXCL12 N-terminal end is sufficient to induce chemotaxis and proliferation of neural stem/progenitor cells. Stem Cell Research. 11 (2), 913-925 (2013).
- Galindo, L. T., et al. Chondroitin sulfate impairs neural stem cell migration through ROCK activation. Molecular Neurobiology. 55 (4), 3185-3195 (2018).
- Groll, J., et al. A definition of bioinks and their distinction from biomaterial inks. Biofabrication. 11 (1), 03001(2018).
- Kyle, S., Jessop, Z. M., Al-sabah, A., Whitaker, I. S. Printability of candidate biomaterials for extrusion-based 3D printing: state-of-the-art. Advanced Healthcare Materials. 6 (16), (2017).
- Blaeser, A., et al. Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity. Advanced Healthcare Materials. 5 (3), 326-333 (2016).
- Miyawaki, O., Omote, C., Matsuhira, K. Thermodynamic analysis of sol-gel transition of gelatin in terms of water activity in various solutions. Biopolymers. 103 (12), 685-691 (2015).
- Shirahama, H., Lee, B. H., Tan, L. P., Cho, N. Precise tuning of facile one-pot Gelatin Methacryloyl (GelMA) synthesis. Science Reports. 6, 31036(2016).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Science Reports. 8 (1), 12517(2018).
- Iwashita, M., et al. Comparative analysis of brain stiffness among amniotes using glyoxal fixation and atomic force microscopy. Frontiers in Cell and Developmental Biology. 8, 574619(2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews. 5, 351-370 (2010).
- Ye, W., et al. 3D printing of gelatin methacrylate-based nerve guidance conduits with multiple channels. Materials and Design. 192, 108757(2020).
- Wu, Y., et al. The influence of the stiffness of GelMA substrate on the outgrowth of PC12 cells. Bioscience Reports. 39 (1), 1-9 (2019).
- Edgar, J. M., Robinson, M., Willerth, S. M. Fibrin hydrogels induce mixed dorsal/ventral spinal neuron identities during differentiation of human induced pluripotent stem cells. Acta Biomaterialia. 51, 237-245 (2017).
- Arulmoli, J., et al. Combination scaffolds of salmon fibrin, hyaluronic acid, and laminin for human neural stem cell and vascular tissue engineering. Acta Biomaterialia. 43, 122-138 (2016).
- Brenner, M. Role of GFAP in CNS Injuries. Neuroscience. Letters. 565, 7-13 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados