Method Article
Tek Bir Bakteride Döteryum Birleşmesinin Uyarılmış Raman Saçılma Görüntülemesi ile Hızlı Antimikrobiyal Duyarlılık Testi
Bu Makalede
Özet
Bu protokol, D 2O metabolizmasının tek hücreli uyarılmış Raman saçılma görüntülemesi ile 2.5 saat içinde hızlı antimikrobiyal duyarlılık testi (AST) testi sunar. Bu yöntem, klinikte hızlı tek hücreli fenotipik AST için dönüştürücü olan idrar veya tam kan ortamındaki bakteriler için geçerlidir.
Özet
Antimikrobiyal dirençli enfeksiyonların yayılmasını yavaşlatmak ve önlemek için, patojenler üzerindeki antimikrobiyal etkileri nicel olarak belirlemek için hızlı antimikrobiyal duyarlılık testine (AST) acil ihtiyaç duyulmaktadır. AST'nin uzun süreli kültüre dayanan geleneksel yöntemlerle tamamlanması genellikle günler alır ve doğrudan klinik örnekler için çalışmazlar. Burada, döteryum oksit (D2O) metabolik katılımının uyarılmış Raman saçılması (SRS) görüntülemesi ile sağlanan hızlı bir AST yöntemi sunulmuştur. D2O'nun biyokütleye metabolik katılımı ve tek bakteri düzeyinde antibiyotiklere maruz kalındığında metabolik aktivite inhibisyonu SRS görüntüleme ile izlenir. Antibiyotiklere maruz kaldıktan sonra bakterilerin tek hücreli metabolizma inaktivasyon konsantrasyonu (SC-MIC), toplam 2.5 saatlik numune hazırlama ve tespitinden sonra elde edilebilir. Ayrıca, bu hızlı AST yöntemi, idrar veya tam kan gibi karmaşık biyolojik ortamlardaki bakteri örneklerine doğrudan uygulanabilir. Döteryum katılımının SRS metabolik görüntülemesi, klinikte hızlı tek hücreli fenotipik AST için dönüştürücüdür.
Giriş
Antimikrobiyal direnç (AMR), bulaşıcı hastalığın etkili tedavisi için büyüyen küresel bir tehdittir1. AMR'nin, antibiyotiğe dirençli bakterilerle mücadele için herhangi bir eylemde bulunulmaması durumunda 2050 yılına kadar yılda 10 milyon ölüme ve 100 trilyon dolarlık küresel GSYİH kaybına neden olacağı tahmin edilmektedir 1,2. Bu, antibiyotiğe dirençli bakterilerin ortaya çıkışını yavaşlatmak ve ilgili ölüm oranını azaltmak için enfeksiyöz bakterilerin antibiyotik duyarlılık testi (AST) için hızlı ve yenilikçi tanı yöntemlerine olan acil ihtiyacı vurgulamaktadır3. Mümkün olan en iyi klinik sonucu sağlamak için, 24 saat içinde etkili tedavinin uygulanması çok önemlidir. Bununla birlikte, disk difüzyonu veya et suyu seyreltme yöntemi gibi mevcut altın standart yöntem, klinik numuneler için ön inkübasyon prosedürü için genellikle en az 24 saat ve minimum inhibitör konsantrasyon (MIC) sonuçlarını elde etmek için ek 16-24 saat gerektirir. Genel olarak, bu yöntemler klinikte bulaşıcı hastalık tedavisi için acil bir karara rehberlik etmek için çok zaman alıcıdır ve bu da antimikrobiyal direncin ortaya çıkmasına ve yayılmasına yol açar4.
Polimeraz zincir reaksiyonu (PCR) tabanlı teknikler5 gibi genotipik AST yöntemleri, hızlı tespit için geliştirilmiştir. Bu tür teknikler, hızlı AST sonuçları sağlamak için spesifik direnç genetik dizilerini ölçer. Zaman alıcı hücre kültürüne güvenmezler; Bununla birlikte, sadece direnci olan bilinen spesifik genetik diziler test edilir. Bu nedenle, uygulaması çeşitli bakteri türleri veya farklı direnç mekanizmaları ile sınırlıdır. Ayrıca, tedavi kararları için MIC sonuçları veremezler 6,7. Ayrıca, bu sınırlamaların üstesinden gelmek için yeni fenotipik yöntemler geliştirilmektedir8, mikroakışkan cihazlar 9,10,11,12,13, optik cihazlar14,15,16, nükleik asitlerin kopya numarası 17,18'i ölçen fenotipik AST ve Raman spektroskopik yöntemler 19, 20,21,22,23,24. Bu yöntemler AST sonuçlarını yönlendirmek için gereken süreyi kısaltır, ancak çoğu doğrudan klinik numunelere değil, yalnızca bakteriyel izolatlara uygulanabilir ve yine de uzun süreli ön inkübasyon gerektirir.
Bu çalışmada, SRS görüntüleme ile hücresel metabolik aktivitenin izlenmesi yoluyla idrar ve tam kandaki bakterilerin duyarlılığının hızlı bir şekilde belirlenmesi için bir yöntem sunuyoruz. Su (H2O), canlı hücrelerdeki temel biyomoleküler sentez süreçlerinin büyük çoğunluğunda yer alır. Bir su izotopologu olarak, NADPH'deki redoks-aktif hidrojen atomu ile D2O'daki D atomu arasındaki enzim katalizörlü H / D değişim reaksiyonu yoluyla, döteryum bir hücre25,26 içindeki biyokütleye dahil edilebilir. Deuterated yağ asidi sentez reaksiyonu, NADPH etiketli döteryum tarafından aracılık edilir. D2O'nun amino asitlerin (AA'lar) reaksiyonlarına dahil edilmesi, deuterated protein üretimi26 ile sonuçlanır (Şekil 1). Bu şekilde, tek mikrobiyal hücrelerde yeni sentezlenen C-D bağı içeren biyomoleküller, tespit edilecek genel bir metabolik aktivite belirteci olarak kullanılabilir. De novo sentezlenmiş C-D bağlarını okumak için, biyomoleküllerin spesifik ve kantitatif kimyasal bilgilerini sağlayan çok yönlü bir analitik araç olan Raman spektroskopisi, antimikrobiyal duyarlılığı belirlemek ve test süresini birkaç saate düşürmek için yaygın olarak kullanılmaktadır27,28,29,30 . Bununla birlikte, Raman saçılma işleminin doğal düşük verimliliği nedeniyle, spontan Raman spektroskopisi düşük algılama hassasiyetine sahiptir. Bu nedenle, spontan Raman spektroskopisi kullanarak gerçek zamanlı görüntü sonuçları elde etmek zordur. Tutarlı anti-Stokes Raman saçılması (CARS) ve uyarılmış Raman saçılması (SRS) dahil olmak üzere tutarlı Raman saçılması (CRS), spontan Raman spektroskopisininkinden daha büyük büyüklük sıraları üretmek için tutarlı ışık alanı nedeniyle yüksek algılama hassasiyetine ulaşmıştır, böylece tek hücre seviyesinde yüksek hızlı, spesifik ve kantitatif kimyasal görüntüleme 31,32,33,34,35 ,36,37,38,39.
Burada, en son çalışmamız40'a dayanarak, bakterilerin normal ortamda, idrarda ve tam kan ortamında tek hücre düzeyinde dahil edilmesinin femtosaniye SRS C-D görüntülemesi ilemetabolik aktivitenin ve antimikrobiyal duyarlılığın hızlı bir şekilde belirlenmesi için bir protokol sunuyoruz. Femtosaniye SRS görüntüleme, 2.5 saat içinde tek bakteri seviyesinde antibiyotiklere karşı tek hücre metabolizması inaktivasyon konsantrasyonunun (SC-MIC) izlenmesini kolaylaştırır. SC-MIC sonuçları, et suyu mikrodilüsyonu yoluyla standart MIC testi ile doğrulanır. Yöntemimiz, bakteri üriner sistem enfeksiyonu (İYE) ve kan dolaşımı enfeksiyonu (BSI) patojenlerinin antimikrobiyal duyarlılığını, geleneksel yönteme göre çok daha kısa bir tahlil süresi ile belirlemek için uygulanabilir olup, klinikte tek hücre düzeyinde hızlı fenotipik AST için fırsat yaratmaktadır.
Protokol
İnsan kan örneklerinin kullanımı, Boston Üniversitesi IRB ve Ulusal Sağlık Enstitüleri (NIH) yönergelerine uygundur. Spesifik olarak, örnekler bir bankadan alınmıştır ve tamamen tanımlanmamıştır. Bu örnekler, Boston Üniversitesi'ndeki kurumsal inceleme kurulu (IRB) ofisi tarafından insan denekler olarak kabul edilmez.
1. Bakteri ve antibiyotik stok çözeltisinin hazırlanması
- Antibiyotik (gentamisin sülfat veya amoksisilin) stok çözeltisini, sterile1x fosfat tamponlu salin (PBS) veya 1.5 mL mikro tüplerde dimetil sülfoksit (DMSO) çözücü içinde çözünmüş 1 mg / mL konsantrasyonda hazırlayın. Gentamisin sülfatı steril PBS çözeltisinde ve amoksisilin steril DMSO çözücüde çözün. Bundan sonra, antibiyotik çözeltisini önerildiği gibi 2-8 ° C'de saklayın.
- Katyon ayarlı Mueller-Hinton Et Suyu (MHB) ortamı içeren D2 O yapmak için,% 100 D 2 O içeren ortam yapmak için 10 mL D2O'ya220mg MHB et suyu baz ekleyin. 200 nm gözenek boyutundaki filtrelerle filtreleyerek çözeltiyi sterilize edin.
NOT: Bu protokolü her zaman sonraki adımlarda ortam çözeltileri yapmak ve sterilize etmek için kullanın. - SRS görüntülemeye bakteri örnekleri hazırlamak için, steril bir yuvarlak tabanlı kültür tüpüne döteryum içermeyen 2 mL normal MHB ortamı ekleyin ve ardından 37 ° C'de önceden ısıtın.
- Triptik soya agar plakası üzerindeki taze kültürden bir bakteri (Escherichia coli BW 25113 veya Pseudomonas aeruginosa ATCC 47085) kolonisi seçmek için steril bir döngü kullanın. Daha sonra önceden ısıtılmış kültür ortamında askıya alın ve bakteri süspansiyonunu hazırlamak için yavaşça vorteks.
- Logaritmik faza ulaşana kadar bakterileri 37 ° C'de bir çalkalayıcıda dakikada 200 devirde (rpm) inkübe edin.
2. D2O antibiyotik varlığında birleştirme tedavisi (Şekil 2a)
- Optik yoğunluğu (OD) 600 nm dalga boyunda bir fotometre ile ölçerek bakteri konsantrasyonunu kontrol edin.
- Bakteriyel çözeltiyi, döteryum içermeyen normal MHB ortamını kullanarak, 8 x 105 CFU / mL'lik bir nihai hücre konsantrasyonuna ulaşmak için seyreltin. Bakteri hücrelerini karıştırmak için yavaşça vorteks.
- Yedi adet 1.5 mL mikro tüpte bakteri çözeltisinin 300 μL alikotunu ve bir 1.5 mL mikro tüpte bakteriyel çözeltinin 600 μL alikotunu hazırlayın.
- Son antibiyotik konsantrasyonunu 8 μg / mL'ye çıkarmak için 600 μL bakteri çözeltisi içeren mikro tüpe 4.8 μL antibiyotik (gentamisin veya amoksisilin) stok çözeltisi (1 mg / mL) ekleyin.
- 8 μg / mL antibiyotik içeren bakteri çözeltisinden 300 μL çözelti alın ve iki kat seyreltilmiş antibiyotik (4 μg / mL) içeren bakteri çözeltisi yapmak için başka bir 300 μL bakteri çözeltisine ekleyin.
- Test antibiyotiklerinin, gentamisinin veya amoksisilinin iki kat seri seyreltilmesini, en düşük konsantrasyona (0.25 μg / mL) sahip mikro tüpe ulaşılana kadar tekrarlayın ve tüpten 300 μL'yi atın. Hem gentamisin hem de amoksisilin için, seri konsantrasyonlar 0.25 μg / mL - 8 μg / mL arasında değişmektedir.
- Boş kontrol için bir tüpü antibiyotiksiz bırakın. Bu, antibiyotik tedavisi olmadan ancak D2O tedavisi ile bakteriyel metabolik aktiviteyi incelemek için pozitif kontrol olacaktır.
- Negatif kontrol için bir tüpü antibiyotik veD2O olmadan bırakın.
- Bakteriyel alikotu 1 saat boyunca MHB ortamı içeren belirli antibiyotik (gentamisin veya amoksisilin) ile inkübe edin.
- Kuluçka sırasında, adım 2.6'da hazırlanan antibiyotiklerin aynı konsantrasyon gradyanı ile% 100D2O içeren ortam ile antibiyotiklerin seri seyreltilmesini hazırlayın. Hem gentamisin hem de amoksisilin için, seri konsantrasyonlar 0.25 μg / mL - 8 μg / mL arasında değişmektedir.
- 1 saatlik antibiyotik tedavisinden sonra, sırasıyla aynı antibiyotik konsantrasyonunda (adım 2.6'da hazırlanan) 300 μL antibiyotik ön işlemden geçirilmiş bakterilere 700 μL seri seyreltilmiş antibiyotik ve% 100 D2O içeren MHB ortamı ekleyin.
- Örneğin, 8 μg / mL antibiyotik ön işlemden geçirilmiş bakterilerin 300 μL'sine 700 μL% 100 D2O içeren MHB ortamı (8 μg / mL antibiyotik içeren) ekleyin. Aynı şekilde, bir sonraki konsantrasyonun karşılık gelen tüplerine aktarın ve birkaç kez yukarı ve aşağı pipetleyerek, homojenize edin.
- Boş bir kontrol olarak 700 μL antibiyotiksiz% 100 D 2O içeren MHB ortamına 300 μL antibiyotiksiz bakteri (adım 2.6.1'de hazırlanmıştır) ekleyin.
- 37 ° C'de 200 rpm'de bir inkübasyon çalkalayıcısında 30 dakika daha inkübe edin.
NOT: Bu adımda, test için ortamdaki son D2O konsantrasyonu% 70'tir.
- İlk önce 1 mL antibiyotik ve D2 O ile muamele edilmiş bakteri örneğini6200 x g'de 4 ° C'de 5 dakika boyunca santrifüj edin ve ardından iki kez arıtılmış suyla yıkayın. Son olarak, numuneleri% 10 formalin çözeltisine sabitleyin ve 4 ° C'de saklayın.
3. İdrar ortamında bakteri hazırlanması (Şekil 2b)
- E. coli BW 25113'ü logaritmik fazda hazırlamak için, 1.4 ve 1.5'teki adımları izleyin.
- OD'yi 600 nm dalga boyunda bir fotometre ile ölçerek bakteri konsantrasyonunu kontrol edin.
- Klinik İYE örneklerini14,18,41 taklit etmek için, E. coli çözeltisini 10 mL tanımlanmamış idrara yükselterek 106 CFU / mL'lik bir nihai hücre konsantrasyonuna ulaşın.
- E. coli çivili idrarını 5 μm'lik bir filtre kullanarak filtreleyin ve ardından bakteri çözeltisini 300 μL alikotlarda yedi adet 1.5 mL mikro tüpe ve bakteri çözeltisinin 600 μL alikotunu bir 1.5 mL mikro tüpte bölün.
- D2 Obirleştirme tedavisini, 2.4'ten 2.10'a kadar önceki adımlarda açıklandığı gibi antibiyotik varlığında ve örnek toplama işleminde gerçekleştirin.
4. Kan ortamında bakterilerin hazırlanması (Şekil 2c)
- Pseudomonas aeruginosa ATCC 47085'i logaritmik fazda hazırlamak için 1.4 ve 1.5'teki adımları izleyin.
- Klinik kan dolaşımı enfeksiyonlarını taklit etmek için42,43 örnek, 107 CFU / mL'lik bir konsantrasyona ulaşmak için 1 mL'lik tanımlanmamış insan kanındaki spike P. aeruginosa.
- Kanı lize etmek için 9 mL steril arıtılmış su ekleyin.
- P. aeruginosa çivili kanını 5 μm filtre kullanarak filtreleyin. Daha sonra bakterileri 4 ° C'de 5 dakika boyunca 6200 x g'de santrifüjleme ile 1 mL hacme kadar hasat edin. Bakteri çözeltisine 9 mL önceden ısıtılmış normal MHB ekleyin ve hafifçe vorteks yapın. Bakterilerin son konsantrasyonu 106 CFU / mL'dir
- P. aeruginosa çivili kan çözeltisini 300 μL alikotta yedi adet 1.5 mL mikro tüpe ve bakteri çözeltisinin 600 μL alikotunu bir 1.5 mL mikro tüpte bölün.
- D2 Obirleştirme tedavisini, 2.4'ten 2.10'a kadar önceki adımlarda açıklandığı gibi antibiyotik varlığında ve örnek toplama işleminde gerçekleştirin.
5. Tek bir bakterideD2O metabolik birleşmesinin SRS görüntülemesi
- 1 mL sabit bakteri çözeltisini arıtılmış suyla yıkayın ve ardından 4 ° C'de 5 dakika boyunca 6200 x g'de santrifüj yapın. Süper natantı çıkarın. Bakteriyel çözeltiyi yaklaşık 20 μL'ye zenginleştirin.
- Bakteriyel çözeltiyi poli-L-lizin kaplı bir kapak camı üzerine koyun. SRS görüntüleme için numuneyi sandviç haline getirin ve kapatın.
- SRS mikroskobu kullanılarak 2168 cm-1'de C-D titreşim frekansındaki bakterileri görüntüleyin.
- Bir bilgisayardaki kontrol yazılımını kullanarak pompa dalga boyunu 852 nm'ye girin ve ayarlayın.
- Bir güç ölçer kullanarak lazer gücünü ölçün. Lazer çıkışının önündeki yarım dalga plakasını ayarlayarak numunedeki pompa lazerinin gücünü ~8 mW'a ve numunedeki Stokes lazerinin gücünü ~40 mW'a ayarlayın.
NOT: SRS mikroskobunda, 80 MHz tekrarlama hızına sahip ayarlanabilir bir femtosaniye lazer, pompa (680 ila 1300 nm) ve Stokes (1045 nm) uyarma lazerlerini sağlar.
- Yansıma aynalarının vidalarını ayarlayarak, pompayı ve Stokes ışınlarını uzamsal olarak hizalayın ve iki kirişi lazer tarama için 2D galvo ayna sistemi ile donatılmış dik bir mikroskopa yönlendirin.
- Pompayı ve Stokes lazerlerini numuneye odaklamak için 60x suya daldırma hedefi kullanın.
- Numuneden gelen sinyalleri ileri yönde toplamak için bir yağ kondenseri kullanın.
- Stokes lazerini bir fotodiyota yönlendirmeden önce filtrelemek için bir bandpass filtresi kullanın.
- Uyarılan Raman sinyalini kilitli bir amplifikatör ile çıkarın ve sinyalleri fotodiyot ile tespit edin.
- Her SRS görüntüsünü, yazılımın kontrol panelinde 200 x 200 piksel ve piksel bekleme süresini 30 μs içerecek şekilde ayarlayın. Bir görüntü için toplam edinme süresi ~ 1,2 sn'dir. Adım boyutunu 150 nm olarak ayarlayın, böylece görüntü boyutu yaklaşık 30 x 30 μm2'dir. Her örnek için en az üç görüntüleme alanı görüntüleyin.
6. Görüntü işleme ve veri analizi ( Şekil 3)
- Ortalama C-D sinyal yoğunluğunu elde etmek için SRS görüntülerini ImageJ yazılımıyla açın ve işleyin.
- İlk olarak, Görüntü |'ni tıklatarak SRS görüntülerini ters renkli 8 bit türünde görüntülere dönüştürün Tip | 8 bit ve ardından | Düzenle ImageJ yazılımındaki düğmeleri tersine çevirin.
- Ardından, İşlem | tıklatarak Gauss bulanıklığına sahip görüntüleri filtreleyin Filtreler | Gauss bulanıklaştırma düğmelerini kullanın ve Sigma'yı (Yarıçap) 1 olarak ayarlayın.
- Bakteri alanını seçmek için görüntü eşiği ayarını kullanın. Resim |'e tıklayın | ayarlama Seçilen bakteri boyutlarının orijinal SRS görüntülerindekilerle eşleştiğinden emin olmak için eşik. Parçacıkları belirlemek için boyut eşiğini ayarlayarak küçük parçacıkları ortadan kaldırın. Apply'ı (Uygula) tıklayın.
- Analyze |'ı Uygula Bakterilerin alanını etiketlemek ve belirlemek için Partikül Analizi düğmeleri.
- YG yöneticisindeki Tümünü Göster düğmesini özgün işlenmemiş SRS görüntüsüne tıklatarak, aynı bakteri alanını etiketleyin, YG yöneticisindeki Ölç düğmesini tıklatarak her veri noktasının ortalama yoğunluğunu belirleyin.
- Orijinal SRS görüntüsündeki arka plan alanını daire içine alın ve arka planın ortalama yoğunluğunu ölçün. Her bakterinin ortalama C-D yoğunlukları, arka plan sinyal yoğunluğu düşülerek elde edilir.
7. SC-MIC ile antimikrobiyal duyarlılığın kantitasyonu
NOT: SC-MIC'yi belirlemek için 0,60'taki kesme değeri, çeşitli konsantrasyonlarda ilaca maruz kalma40 üzerine bakteriler için metabolizma-aktif ve metabolizma-inhibe edilmiş koşulların SRS C-D yoğunluklarının istatistiksel analizine göre belirlenir. Antibiyotiğe duyarlı ve antibiyotiğe dirençli gruplar için C-D yoğunlukları normal dağılımla donatıldı.
- Alıcı çalışma karakteristiği (ROC) eğrisini çizin ve kesme eşiğini 0,60'ta değerlendirin. Bu kesme değerine dayanarak, antibiyotiklerin etkinliğinin bir göstergesi olarak SC-MIC, metabolik olarak inaktif ve metabolik olarak aktif grubu belirlemek için tanımlanabilir.
- SRS görüntüleme verilerini kantitatif olarak analiz etmek için, seri olarak seyreltilmiş antibiyotik konsantrasyonu ile tedavi edilen her bakteri grubu için C-D sinyal yoğunluklarının histogramlarını çizin. Renkli veri noktaları farklı bireysel bakterileri temsil eder.
- Antibiyotik tedavisi uygulanan grubun C-D yoğunluklarını, antibiyotik tedavisi olmadan kontrol grubunun ortalama yoğunluğuna normalleştirin. C-D bölgesindeki SRS sinyal yoğunluklarını 0.60'taki kesme değerini kullanarak çeşitli antibiyotik konsantrasyonlarına karşı ölçerek farklı bakteri ve antibiyotik kombinasyonlarının SC-MIC sonuçlarını belirleyin.
- SC-MIC okumasını, geleneksel et suyu mikrodilüsyon testi kullanılarak belirlenen MIC ile doğrulayın ve karşılaştırın.
- Klinik ve Laboratuvar Standartları Enstitüsü'ne (CLSI) göre, test edilen her bakteri suşu için SRS metabolik görüntüleme sonuçlarına dayanan duyarlılık kategorisi "duyarlı", "dirençli" veya "orta" olarak yorumlanmaktadır.
Sonuçlar
Kuluçka süresinin döteryum infüzyonu üzerindeki etkisi, C-D (2070 ila 2250 cm-1) ve C-H (2.800 ila 3.100 cm-1) bölgesindeki spontan Raman mikrospektroskopisi ile ölçülür (Şekil 4a). % 70 D2O içeren orta maddede kültürlenen P. aeruginosa'nın hızlandırılmış tek hücreli Raman spektrumu, kuluçka süresi boyunca CD / CH yoğunluğunu 0'dan 180 dakikaya çıkardığını göstermektedir. (Şekil 4b) Tek mikrobiyal hücrelerde artan C-D bolluğu,D2O'nun hücre içindeki deuterated biyomoleküllere dahil edildiğini ortaya koymaktadır.
% 50'nin üzerindeki D2O etiketlemesi, 23 saatlik bir kuluçka döneminde bakteri metabolizmasını önemli ölçüde etkiler27. 25 saatlik bir kuluçka döneminde D2O etiketleme konsantrasyonu% 70'in üzerinde olduğunda bakteriyel büyüme inhibisyonu gözlemledik (Şekil S1). Altın standart et suyu seyreltmesi ile MIC uyguladık ve iki P. aeruginosa suşunda (P. aeruginosa ATCC 47085 ve P. aeruginosa 1133) SC-MIC sonuçları elde ettik (Tablo S1). Mevcut sonuçlarımız, %70 D2O'nun P. aeruginosa'daki yöntemimizin performansını etkilemediğini göstermektedir. SC-MIC yöntemimizin geleneksel kültür bazlı yöntemle kategori anlaşması, Tablo S1'de gösterildiği gibi, test edilen tüm P. aeruginosa ve antibiyotik kombinasyonları için% 100'dür. Bu iyi anlaşmayı, SC-MIC tayininde 30 dakikalık inkübasyon süresi boyunca P. aeruginosa üzerinde% 70 D2O'nun minimum toksisitesine bağlıyoruz.
Protokolü takiben, P. aeruginosa 1 saat boyunca seri olarak seyreltilmiş gentamisin ile inkübe edildi ve daha sonra 30 dakika daha fazla% 70D 2O ile inkübe edildi. ~ 2168 cm-1'de SRS metabolik görüntüleme yapıldı (Şekil 5a) yapıldı. Antibiyotik tedavisindeki C-D yoğunlukları, antibiyotik tedavisi olmayan kontrol grubunun ortalama değerine bölünür. Kantitatif istatistiksel analiz (Şekil 5b), P. aeruginosa'nın C-D sinyallerinin 2 μg / mL veya daha yüksek gentamisin konsantrasyonunda, gentamisin tedavisi (0 μg / mL) olmayanlara göre anlamlı derecede daha düşük olduğunu göstermiştir. 0.60'taki kesme eşiği kullanılarak, P. aeruginosa metabolik olarak 2 μg / mL'de ve daha yüksek gentamisin konsantrasyonlarında inhibe edildi. Noktalı çizgi, tanımlanan kesme değerini Şekil 5b'de 0,60'ta gösterir. Bu şekilde, normal MHB ortamında gentamisine karşı P. aeruginosa için SC-MIC'nin 2 μg / mL olduğu belirlenmiştir. Bu SC-MIC değerinin, et suyu mikrodilüsyon yöntemi ile belirlenen MIC (4 μg / mL) ile tek kat fark aralığında olduğu doğrulanmıştır (Şekil 5c). Birlikte ele alındığında, teknolojimiz tarafından belirlenen SC-MIC, antimikrobiyal duyarlılığın ölçülmesini sağlar.
Klinik uygulamalar için, özellikle de en yaygın İYE enfeksiyonu için döteryum metabolik katılımının SRS görüntülemesi ile hızlı AST potansiyelini araştırmak için, İYE enfeksiyonuna neden olan en yaygın patojen olan E. coli'yi kullanarak bakteri çivili idrar örneğini test ettik44. Klinik İYE örneklerini relavent bir bakteri konsantrasyonunda taklit etmek için, E. coli, tanımlanmamış idrara 106 CFU / mL'lik bir son konsantrasyona eklenir. Numune saflaştırmadan sonra, idrar örnekleri amoksisilin ve D2O ile inkübe edildi. SRS görüntülerindeki temiz arka plan, numune hazırlama protokolünün hızlı AST ölçümü için uygulanabilir olduğunu göstermiştir (Şekil 5d). Amoksisilin'e karşı E. coli-çivili idrar örneği için SC-MIC'nin, normal MHB ortamında saf E. coli için geleneksel et suyu seyreltme yöntemi ile MIC (8 μg / mL) ile aynı duyarlılık okumasına sahip olan 4 μg / mL (Şekil 5e) olduğu belirlenmiştir (Şekil 5f). Bu sonuçlar toplu olarak, döteryum metabolik katılımının SRS görüntülemesi ile hızlı AST'nin, İYE enfeksiyöz patojenlerine klinik tanı için büyük potansiyel olduğunu göstermiştir.
İYE enfeksiyonu ile karşılaştırıldığında, BSI patojenleri için hızlı AST, kanda bulunan birçok kan hücresi olarak, bakteriyel metabolik aktivitenin yerinde incelenmesi için çok daha zordur. Klinik BSI örnekleri için D2O metabolik katılımının SRS görüntülemesi ile hızlı AST'nin uygulanabilirliğini araştırmak için, P. aeruginosa, tanımlanmamış insan kanında çivilenmiş olarak tespit edildi. Şekil 5g'de gösterildiği gibi, SRS görüntüsünün 2168 cm-1'deki C-D yoğunluğuna bakteri sinyalleri hakimdi. Kırmızı kan hücreleri, daha fazla biyosentez için D2O'yu almak için metabolik aktiviteye sahip olmadığından, C-D sinyalleri canlı bakterilerin metabolik döteryum katılımından kaynaklanmıştır. Enkaz veya kırmızı kan hücresi türlerinin çapraz faz modülasyonu veya fototermal sinyali, SC-MIC'nin kantitatif analizini etkilemeden zayıf arka plan sinyallerine katkıda bulunmuştur. Kandaki P. aeruginosa için SC-MIC sonucunun 2 μg / mL olduğu belirlenmiştir (Şekil 5h), bu da normal büyüme ortamında P. aeruginosa için geleneksel standart MIC sonucu ile iyi uyuşmaktadır (Şekil 5i). Birlikte ele alındığında, bu sonuçlar döteryum metabolik katılımının SRS metabolik görüntülemesinin, BIS enfeksiyonlarında bakteriler için SC-MIC'yi belirlemek için hızlı bir AST yöntemi olabileceğini göstermiştir.
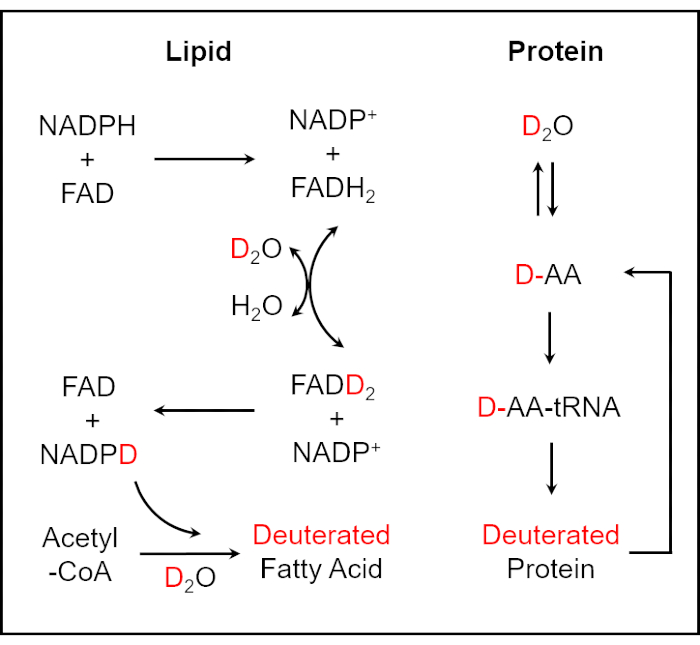
Şekil 1:D2O'nun deuterated lipid ve protein 25,26'ya dahil edilmesi için şema. Döteryum, NADPH'deki redoks-aktif hidrojen atomu ile D2O'daki D atomu arasındaki enzim katalizörlü H / D değişim reaksiyonu yoluyla bir hücre içindeki biyokütleye dahil edilebilir. D2O'nun amino asitlerin reaksiyonlarına dahil edilmesi, deuterated proteinlerin üretimi ile sonuçlanır. Bu şekil ref.40'tan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
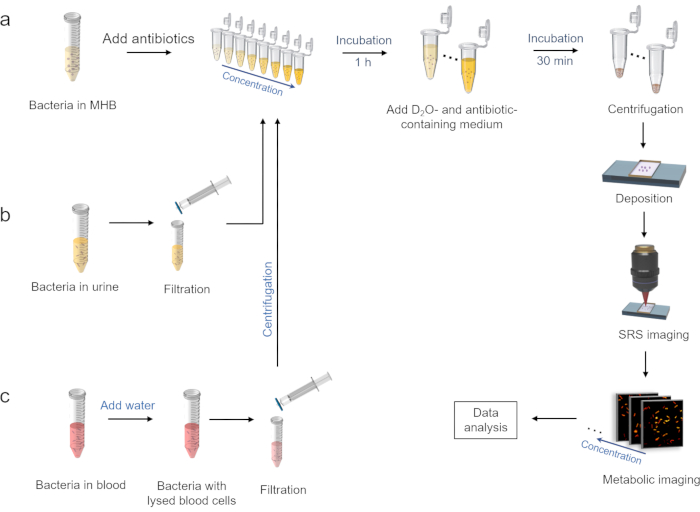
Şekil 2: Döteryum kuruluşunun SRS metabolik görüntülemesi ile hızlı AST iş akışı. (a) MHB ortamında antibiyotik varlığında D2O birleştirme tedavisi ve aşağıdaki SRS görüntüleme prosedürleri. (b) İdrar ortamında bakterilerin hazırlanması. (c) Kan ortamındaki bakterilerin hazırlanması. Bu şekil ref.40'tan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
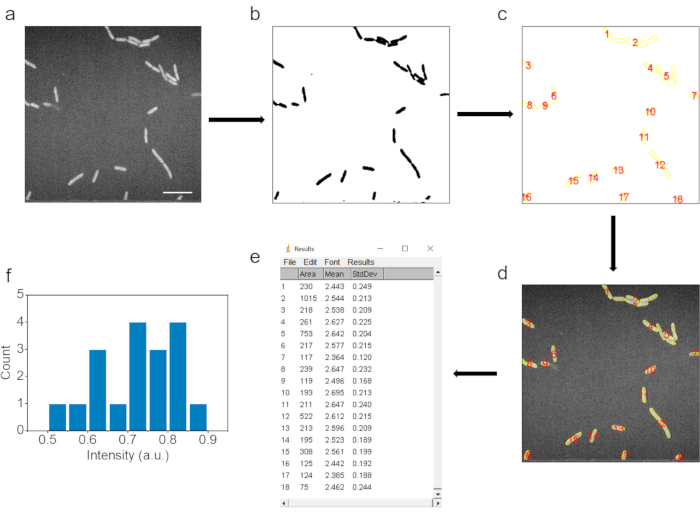
Şekil 3. Otomatik görüntü işleme ve veri yorumlama. (a) Ham SRS görüntüsü. (b) Bakteri hücrelerinin alanını belirlemek için yoğunluk eşiği ayarından sonraki görüntü. (c) Partikül analizi adımından sonra seçilen veri noktaları. (d) İlgili veri noktaları ham görüntüde seçilir. (e) Ham görüntüdeki ilgili veri noktalarının sonuçları. (f) Arka planın çıkarılmasından sonra veri noktalarının ortalama yoğunluğunun istatistiksel sonuçları. Ölçek çubuğu: 10 μm. Bu şekil ref.40'tan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4. Kuluçka süresinin döteryum bakterilere karışması üzerine etkisi. (a) Spontan Raman mikrospektroskopisi (ortalama 20 spektroskopisi) ile C-D (2070 ila 2250 cm-1) ve C-H (2.800 ila 3.100 cm-1) bölgesinde hızlandırılmış ölçüm. (b) CD/CH yoğunluk oranı grafiğinin (a)'daki bakteriler için D2O inkübasyon süresi üzerindeki histogram grafiği. Her renkli nokta, tek bir bakteriden alınan bir ölçüm anlamına gelir. Hata çubukları, ortalamanın (SEM) standart hatasını temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5. Normal ortamda, idrarda ve kan ortamında antibiyotiklere karşı D2O'nun bakteriyel metabolik katılımının SRS görüntülemesi kullanılarak SC-MIC tayini. (a) C-D titreşiminde SRS görüntüleme (2168 cm-1) ve normal MHB ortamında seri olarak seyreltilmiş gentamisin ilavesiyle D2O varlığında P. aeruginosa'nın karşılık gelen iletim görüntüleri. (b) (a)'daki P. aeruginosa'nın SRS C-D yoğunluğunun kantitatif analizi. Histogramdaki renkli veri noktaları, farklı bireysel bakterileri temsil eder. Noktalı çizgi, kesme değerini 0,60 olarak gösterir. (c) SC-MIC okumasının et suyu mikrodilüsyon yöntemi ile MIC ile karşılaştırılması ve CLSI'ye göre P. aeruginosa için duyarlılık kategorisi. (d) C-D titreşiminde SRS görüntüleme (2168 cm-1) ve seri olarak seyreltilmiş amoksisilin ile D2O'da inkübasyondan sonra idrarda E. coli'nin karşılık gelen iletim görüntüleri. (e) SRS C-D yoğunluğunun (d) cinsinden kantitatif analizi. (f) Normal MHB'de ve idrarda E. coli için SC-MIC okuma ve duyarlılık kategorisinin karşılaştırılması. (g) C-D titreşiminde SRS görüntüleme (2168 cm-1) ve seri olarak seyreltilmiş gentamisin ile D2O'da inkübasyondan sonra P. aeruginosa'nın kandaki karşılık gelen iletim görüntüleri. (h) SRS C-D yoğunluğunun (g) cinsinden kantitatif analizi. (i) Normal MHB'de ve kanda P. aeruginosa için SC-MIC okuma ve duyarlılık kategorisinin karşılaştırılması. S: hassas. N hücre sayısı grup başına 10'≥. Hata çubukları SEM'i temsil eder. ölçek çubuğu: 10 μm. Bu şekil ref.40'tan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Sorun | Olası sebep | Çözüm |
| Görüntüleme görüş alanında çok az bakteri hücre sayısı veya hiç bakteri hücre sayısı yok | Çözeltideki bakteri yoğunluğu çok düşük | Bakterileri daha da zenginleştirmek için daha uzun süre santrifüj yapın |
| SRS görüntüleme sırasında bakteri hücrelerinin fotohasarı | Kullanılan lazer gücü çok yüksek | Lazer gücünü uygun bir değere ayarlayın |
| SRS sinyali algılanamaz | Pompanın ve Stokes ışınının mekansal ve zamansal örtüşmesi optimize edilmemiştir | Standart numune deuterated dimetil sülfoksit kullanarak pompayı ve Stokes ışınlarını hizalayın |
Tablo 1: Sorun giderme tablosu.
Şekil S1: Lauria-Bertani (LB) ortamında farklıD2O konsantrasyonlarına sahip P. aeruginosa üzerinde D2O toksisitesinin test edilmesi. Hata çubukları standart sapma değerlerini gösterir (ölçüm sayısı = 5). Bu Rakamı indirmek için lütfen tıklayınız.
Tablo S1. P. aeruginosa'nın normal MHB'sinde SC-MIC'lerin ve MIC'lerin antibiyotik tedavisi ile karşılaştırılması. S: hassas; R: dayanıklı; I: Orta. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Hızlı AST, tek hücreli SRS metabolik görüntüleme kullanılarak antibiyotik tedavisine bakteriyel metabolik aktivitenin yanıtının numuneden SC-MIC sonuçlarına 2,5 saat içinde değerlendirilmesiyle elde edilebilir. Bakteriyel metabolik aktivitenin ve antimikrobiyal duyarlılığın yanıtı, C-D bağlarının SRS görüntülemesi kullanılarak biyomolekül sentezi için D2O'nun metabolik katılımının izlenmesiyle tespit edilebilir. Su, canlı hücrelerde her yerde kullanıldığından, SRS metabolik görüntüleme hızlı AST için evrensel bir yöntem sağlar. Hızlı AST yöntemi, tek bir bakteri seviyesinde idrar veya tam kan gibi karmaşık biyolojik ortamlardaki bakterileri tespit etmek için uygulanabilir. SC-MIC, idrar ve kandaki bakterilerin 1.5 saatlik kültüründen sonra belirlenebilir; bu, İYE ve BSI tanısının paradigmasını zaman alıcı kültüre bağımlı bir prosedürden kültürden bağımsız bir in situ yaklaşıma kaydırmak için dönüştürücü olarak kabul edilir. Bu nedenle, konvansiyonel et suyu mikrodilüsyon yöntemine kıyasla tanı süresinde muazzam bir azalma anlamına gelir ve bu da kesin tedavi için uygun antimikrobiyal ajanların zamanında tanımlanmasına izin veren klinik translasyona giden yolu açar.
Burada açıklanan antibiyotik tedavisi protokolleri, önerilen MHB ortamının genellikle çok çeşitli mikroorganizmaların yetiştirilmesi için kullanılabileceği CLSI'nin yönergelerini takip eder. Önemli bir parametre, antimikrobiyal duyarlılık testi için kullanılan bakteriyel hücre sayısının, CLSI'da önerildiği gibi yaklaşık 5 x 105 CFU / mL'de tutulmasıdır. Bu, doğru ve tekrarlanabilir sonuçlar elde etmek için kritik öneme sahiptir. Antibiyotik tedavi deneylerinde, bakteri konsantrasyonu 8 x 105 CFU / mL olarak ayarlanır. Daha yüksek bakteri konsantrasyonu, MIC sonuçlarında bir artışa neden olabilir. Bakteriyel süspansiyon ayarlandıktan sonra, bakteriyel hücre konsantrasyonundaki değişiklikleri önlemek için 30 dakika içinde kullanılmalıdır.
Daptomisin gibi bir antibiyotiğin duyarlılık testi için, ortama 50 mg / L kalsiyum takviyesi yapılması önerilir. Katyon ayarlı MHB besiyeri 20-25 mg/L Ca 2+içerir. Bu nedenle, ortamın 30 mg / L konsantrasyonunda ek Ca2 + (suda çözünür ve filtre sterilize edilmiş) ile daha da desteklendiğinden emin olun.
Sunulan yöntemdeki bir diğer kritik adım, antibiyotiklere maruz kalma veD2O dahil edilmesi üzerine bakterilerin kuluçka süresidir. Bakteriyel yaşam döngüsünün üretim süresi kabaca 30 ila 60 dakika olduğundan, belirli bir süre antibiyotik maruziyeti üzerine bakteriyel metabolik aktiviteyi etkilemek önemlidir. Bu test, 0.5 h D2O tedavisinden önce 1 saat boyunca antibiyotik maruziyetine çeşitli bakteri-antibiyotik kombinasyonları için değerlendirilmiştir. İlk 1 saatlik antibiyotik tedavisi basamağı, bakteriyel metabolik aktiviteyi etkilemek için gereklidir. Daha sonra, bakterilerD2O içeren ve antibiyotik içeren ortam ile 30 dakika daha inkübe edilir. Son antibiyotik konsantrasyonları aynı seviyede tutulur veD2O'nun nihai konsantrasyonu% 70'e ayarlanır. Genel olarak, 1 saatlik antibiyotik prekültüründen sonra ve 0.5 saatlik D2O ve antibiyotik katılımından sonra, SC-MIC sonuçları bakteriyel metabolik aktivitenin SRS metabolik görüntülemesi ile belirlenir. Bu tasarım, antimikrobiyal aktivitenin bakteriler üzerindeki D2O etkisinin etkisini en aza indirir ve ayrıca SC-MIC sonuçlarının geleneksel yöntemle MIC'lerle karşılaştırılabilir bir şekilde okunmasına yol açar.
SC-MIC ölçümlerinde, her biri aynı anda 8 konsantrasyona sahip 5 farklı antibiyotik de dahil olmak üzere 40 numuneyi paralel olarak hazırlıyoruz. Bununla birlikte, çok sayıda manuel operasyon prosedürü olduğu için, beş farklı bakteri-antibiyotik kombinasyonu için AST'yi tespit etmek için toplam tahlil süresi 2.5 saatten uzundur. Yöntemimizde, ~ 20 ayrı bakteri hücresi içeren her SRS görüntüsü, 30 μs piksel bekleme süresinde tek bir atışta ~ 1.0 s içinde elde edildi. Bir bakteri suşu için 10 antibiyotik üzerinde çalışmak için toplam AST testi süresinin, numuneden SC-MIC okumasına kadar 2,5 saatten az olacağını tahmin ediyoruz, bu da yüksek verim ölçümü yapmak için muazzam bir olasılığa sahip. Gelecekteki çalışmalarda, verimi daha da iyileştirmek için otomatik bir numune hazırlama ve görüntüleme veri toplama yöntemi kullanılacaktır. Sorun giderme ayrıntıları Tablo 1'de verilmiştir.
Geleneksel kültür temelli AST yöntemlerinde, daha ileri ölçümler için bakteriyel izolatlar elde etmek için, klinik numunelerin saatlerce önceden inkübe edilmesi gerekir. Raman spektroskopisi29, nanolitre dizi6 ve dijital nükleik asit nicelleştirmesi18 gibi klinik İYE numunesi için gelişmiş AST yöntemleri, uzun süreli ön inkübasyondan kurtulmak için geliştirilmiştir. İYE enfeksiyonu ile karşılaştırıldığında, BSI veya sepsis, klinikte kesin teşhis için hızlı AST'nin acilen gerekli olduğu çok daha fazla yaşamı tehdit eden 18,45'tir. Pozitif kan kültürlerinden bakteri kolonisi oluşumunu ölçmek için mikroskobik bir görüntüleme yönteminin MIC sonuçlarını sağladığı bildirilmiştir46. Bununla birlikte, AST testini yapmak için bakteri yetiştirmek en az 6 saat sürer. Ayrıca, ticari otomatik sistemler47 ve kütle spektrometresi48,49 stratejileri, pozitif kan kültürlerinden AST okuması sağlayabilir. Bununla birlikte, klinik karar için MIC sonuçları sağlanamamaktadır. AST sonuçları ve MIC okuması, kliniklerde potansiyel yan etkilere neden olmak için hastalara aşırı dozda antibiyotik verilmesini önlemek, antimikrobiyal dirençli enfeksiyonların yayılmasını yavaşlatmak ve önlemek için önemlidir50,51. Mevcut spontan Raman mikroskobu tabanlı AST yöntemleriyle karşılaştırıldığında, teknolojimiz büyüklük sırası sinyal iyileştirmesi nedeniyle veri toplama süresini (yaklaşık 600 kat daha az) büyük ölçüde azaltır. Bu çalışmada, idrar veya tam kan ortamında klinik olarak ilgili bir bakteri konsantrasyonunda (105 ~ 106 CFU / ml) tek bakterilerde döteryum metabolizmasının SRS görüntülemesi ile hızlı AST gösterdik. Önceki sonuçlarda gösterildiği gibi, MIC sonuçları 1 saatlik antibiyotik tedavisi ve 30 dakikalık D2O karışımı ve idrar ve kandaki bakterilere antibiyotik inkübasyonundan sonra belirlenir. Yöntemimiz, 2.5 saat içinde her bir suş-antibiyotik kombinasyonu için MIC'ler ve duyarlılık sınıflandırması sağlayabilir ve bu nedenle klinik çeviri için yeni bir yol açar. Özetlemek gerekirse, prekültürleme ve bakteriyel bölünmeye gerek kalmadan, yöntemimiz bulaşıcı hastalıklarda hızlı ve yüksek verimli AST alanında muazzam bir potansiyele sahiptir.
SRS metabolik görüntüleme ile SC-MIC yöntemimiz, klinik kullanım için bol miktarda suş-antibiyotik kombinasyonu çeşidi ile uğraşırken MIC'leri tespit etmek ve enfeksiyöz patojenler için duyarlılık sınıflandırması sağlamak için uygulanabilir. SC-MIC, idrar ve kandaki bakterilere 30 dakikalıkD2O dahil edildikten sonra belirlenir; bu, preinkübasyon için 16 ila 24 saate mal olan geleneksel et suyu seyreltme yöntemine kıyasla tanı süresinde muazzam bir azalma anlamına gelir. SRS metabolik görüntüleme teknolojisi, klinik karar verme için patojen tanımlama bilgileri sağlamak amacıyla, matris yardımlı lazer desorpsiyon iyonizasyonu-uçuş süresi kütle spektrometrisi49,52,53 gibi hızlı patojen tanımlama yeteneğine sahip tanı platformlarıyla daha da entegre edilebilir. İn situ patojen tanımlaması ve hızlı AST tanısının birleştirilmesi, hassas tedavi için uygun antimikrobiyal ajanların zamanında tanımlanmasına izin veren kliniğe çeviri için büyük bir potansiyel olabilir.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma J.-X.C ve M.S.'ye NIH R01AI141439 ve J.-X.C.'ye R35GM136223 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acousto-optic modulation | Gooch&Housego | R15180-1.06-LTD | Modulating stokes laser beam |
| Amoxicillin | Sigma Aldrich | A8523-5G | |
| Bandpass filter | Chroma | HQ825/150m | Block the stokes laser beam before the photodiode |
| Calcium chloride | Sigma Aldrich | C1016-100G | Cation adjustment |
| Cation-adjusted Mueller-Hinton Broth | Fisher Scientific | B12322 | Antimicrobial susceptibility testing of microorganisms by broth dilution methods |
| Centrifuge | Thermo Scientific | 75002542 | |
| Cover Glasses | VWR | 16004-318 | |
| Culture tube with snap cap | Fisher brand | 149569B | |
| Daptomycin | Acros | A0386346 | |
| Deuterium oxide | 151882 | Organic solvent to dissolve antibiotics | |
| Deuterium oxide-d6 | Sigma Aldrich | 156914 | Organic solvent as a standard to calibrate SRS imaging system |
| Escherichia coli BW 25113 | The Coli Genetic Stock Center | 7636 | |
| Eppendorf polypropylene microcentrifuge tubes 1.5 mL | Fisher brand | 05-408-129 | |
| Gentamicin sulfate | Sigma Aldrich | G4918 | |
| Hydrophilic Polyvinylidene Fluoride filters | Millipore-Sigma | SLSV025NB | pore size 5 µm |
| ImageJ software | NIH | Version: 2.0.0-rc-69/1.52t | Image processing and analysis |
| Incubating orbital shaker set at 37 °C | VWR | 97009-890 | |
| Inoculation loop | Sigma | BR452201-1000EA | |
| InSight DeepSee femtosecond pulsed laser | Spectra-Physics | Model: insight X3 | Tunable laser source and fixed laser source at 1045 nm for SRS imaging |
| Lock-in amplifier | Zurich Instrument | HF2LI | Demodulate the SRS signals |
| Oil condenser | Olympus | U-AAC | NA 1.4 |
| Pseudomonas aeruginosa ATCC 47085 (PAO1) | American Type Culture Collection | ATCC 47085 | |
| Photodiode | Hamamatsu | S3994-01 | Detector |
| Polypropylene conical tube 15 mL | Falcon | 14-959-53A | |
| Polypropylene filters | Thermo Scientific | 726-2520 | pore size 0.2 µm |
| Sterile petri dishes | Corning | 07-202-031 | |
| Syringe 10 mL | Fisher brand | 14955459 | |
| UV/Vis Spectrophotometer | Beckman Coulter | Model: DU 530 | Measuring optical density at wavelength of 600 nm |
| Vortex mixer | VWR | 97043-562 | |
| Water objective | Olympus | UPLANAPO/IR | 60×, NA 1.2 |
Referanslar
- O'Neill, J. Tackling drug-resistant infections globally: final report and recommendations. The review on Antimicrobial Resistance. , (2016).
- Sugden, R., Kelly, R., Davies, S. Combatting antimicrobial resistance globally. Nature Microbiology. 1 (10), 16187 (2016).
- Kumar, A., et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Critical Care Medicine. 34 (6), 1589-1596 (2006).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: a review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Frickmann, H., Masanta, W. O., Zautner, A. E. Emerging rapid resistance testing methods for clinical microbiology laboratories and their potential impact on patient management. BioMed Research International. 2014, 375681 (2014).
- Avesar, J., et al. Rapid phenotypic antimicrobial susceptibility testing using nanoliter arrays. Proceedings of the National Academy of Sciences. 114 (29), 5787-5795 (2017).
- Schoepp, N. G., et al. Digital quantification of DNA replication and chromosome segregation enables determination of antimicrobial susceptibility after only 15 minutes of antibiotic exposure. Angewandte Chemie International Edition. 55 (33), 9557-9561 (2016).
- van Belkum, A., et al. Innovative and rapid antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 18 (5), 299-311 (2020).
- Hou, Z., An, Y., Hjort, K., Sandegren, L., Wu, Z. Time lapse investigation of antibiotic susceptibility using a microfluidic linear gradient 3D culture device. Lab on a Chip. 14 (17), 3409-3418 (2014).
- Choi, J., et al. Rapid antibiotic susceptibility testing by tracking single cell growth in a microfluidic agarose channel system. Lab on a Chip. 13 (2), 280-287 (2013).
- Lu, Y., et al. Single cell antimicrobial susceptibility testing by confined microchannels and electrokinetic loading. Analytical Chemistry. 85 (8), 3971-3976 (2013).
- Kim, S. C., Cestellosblanco, S., Inoue, K., Zare, R. N. Miniaturized antimicrobial susceptibility test by combining concentration gradient generation and rapid cell culturing. Antibiotics. 4 (4), 455-466 (2015).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Baltekin, &. #. 2. 1. 4. ;., Boucharin, A., Tano, E., Andersson, D. I., Elf, J. Antibiotic susceptibility testing in less than 30 min using direct single-cell imaging. Proceedings of the National Academy of Sciences. 114 (34), 9170-9175 (2017).
- Fredborg, M., et al. Real-time optical antimicrobial susceptibility testing. Journal of Clinical Microbiology. 51 (7), 2047-2053 (2013).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Barczak, A. K., Hung, D. T. RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities. Proceedings of the National Academy of Sciences. 109 (16), 6217-6222 (2012).
- Schoepp, N. G., et al. Rapid pathogen-specific phenotypic antibiotic susceptibility testing using digital LAMP quantification in clinical samples. Science Translational Medicine. 9 (410), (2017).
- Novelli-Rousseau, A., et al. Culture-free antibiotic-susceptibility determination from single-bacterium Raman spectra. Scientific Reports. 8 (1), 1-12 (2018).
- Schröder, U. -. C., et al. Detection of vancomycin resistances in enterococci within 3 1/2 hours. Scientific Reports. 5, 8217 (2015).
- Liu, C. -. Y., et al. Rapid bacterial antibiotic susceptibility test based on simple surface-enhanced Raman spectroscopic biomarkers. Scientific Reports. 6 (1), 1-15 (2016).
- Chang, K. -. W., et al. Antibiotic susceptibility test with surface-enhanced raman scattering in a microfluidic system. Analytical Chemistry. 91 (17), 10988-10995 (2019).
- Galvan, D. D., Yu, Q. surface-enhanced raman scattering for rapid detection and characterization of antibiotic-resistant bacteria. Advanced Healthcare Materials. 7 (13), 1701335 (2018).
- Kirchhoff, J., et al. Simple ciprofloxacin resistance test and determination of minimal inhibitory concentration within 2 h using raman spectroscopy. Analytical Chemistry. 90 (3), 1811-1818 (2018).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Berry, D., et al. Tracking heavy water (D2O) incorporation for identifying and sorting active microbial cells. Proceedings of the National Academy of Sciences. 112 (2), 194-203 (2015).
- Tao, Y., et al. Metabolic-activity-based assessment of antimicrobial effects by D2O-labeled single-cell raman microspectroscopy. Analytical Chemistry. 89 (7), 4108-4115 (2017).
- Yang, K., et al. Rapid antibiotic susceptibility testing of pathogenic bacteria using heavy water-labeled single-cell raman spectroscopy in clinical samples. Analytical Chemistry. 91 (9), 6296-6303 (2019).
- Song, Y., et al. Raman-Deuterium Isotope Probing for in-situ identification of antimicrobial resistant bacteria in Thames River. Scientific reports. 7 (1), 16648 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Cheng, J. -. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17, 415-445 (2015).
- Yue, S., Cheng, J. -. X. Deciphering single cell metabolism by coherent Raman scattering microscopy. Current Opinion in Chemical Biology. 33, 46-57 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, Label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- He, R., Liu, Z., Xu, Y., Huang, W., Ma, H., Ji, M. Stimulated Raman scattering microscopy and spectroscopy with a rapid scanning optical delay line. Optics Letters. 42 (4), 659-662 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences. 116 (32), 15842-15848 (2019).
- Camp, C. H., et al. High-Speed Coherent Raman Fingerprint Imaging of Biological Tissues. Nature Photonics. 8, 627-634 (2014).
- Zhang, M., et al. Rapid determination of antimicrobial susceptibility by stimulated raman scattering imaging of D2O metabolic incorporation in a single bacterium. Advanced Science. 7 (19), 2001452 (2020).
- Michael, I., et al. A fidget spinner for the point-of-care diagnosis of urinary tract infection. Nature Biomedical Engineering. 4 (6), 591-600 (2020).
- Bhattacharyya, R. P., et al. Simultaneous detection of genotype and phenotype enables rapid and accurate antibiotic susceptibility determination. Nature Medicine. 25 (12), 1858-1864 (2019).
- Stupar, P., et al. Nanomechanical sensor applied to blood culture pellets: a fast approach to determine the antibiotic susceptibility against agents of bloodstream infections. Clinical Microbiology and Infection. 23 (6), 400-405 (2017).
- Barber, A. E., Norton, J. P., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Cohen, J., et al. Sepsis: a roadmap for future research. The Lancet Infectious Diseases. 15 (5), 581-614 (2015).
- Choi, J., et al. rapid antimicrobial susceptibility test from positive blood cultures based on microscopic imaging analysis. Scientific Reports. 7 (1), 1148 (2017).
- Gherardi, G., et al. Comparative evaluation of the Vitek-2 Compact and Phoenix systems for rapid identification and antibiotic susceptibility testing directly from blood cultures of Gram-negative and Gram-positive isolates. Diagnostic Microbiology and Infectious Disease. 72 (1), 20-31 (2012).
- Machen, A., Drake, T., Wang, Y. F. Same day identification and full panel antimicrobial susceptibility testing of bacteria from positive blood culture bottles made possible by a combined lysis-filtration method with MALDI-TOF VITEK mass spectrometry and the VITEK2 system. Plos One. 9, 87870 (2014).
- Simon, L., et al. Direct identification of 80 percent of bacteria from blood culture bottles by matrix-assisted laser desorption ionization-time of flight mass spectrometry using a 10-minute extraction protocol. Journal of Clinical Microbiology. 57 (2), 01278 (2019).
- Leekha, S., Terrell, C. L., Edson, R. S. General principles of antimicrobial therapy. Mayo Clinic Proceedings. 86 (2), 156-167 (2011).
- Johnson, L., et al. Emergence of fluoroquinolone resistance in outpatient urinary Escherichia coli isolates. The American Journal of Medicine. 121 (10), 876-884 (2008).
- Van Belkum, A., et al. Developmental roadmap for antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 17 (1), 51-62 (2019).
- Dubourg, G., Lamy, B., Ruimy, R. Rapid phenotypic methods to improve the diagnosis of bacterial bloodstream infections: meeting the challenge to reduce the time to result. Clinical Microbiology and Infection. 24 (9), 935-943 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır