Method Article
Test rapidi di sensibilità antimicrobica mediante imaging Raman scattering stimolato dell'incorporazione del deuterio in un singolo batterio
In questo articolo
Riepilogo
Questo protocollo presenta test rapidi di suscettibilità antimicrobica (AST) entro 2,5 ore mediante imaging Raman scattering stimolato da singole cellule del metabolismo di D2O. Questo metodo si applica ai batteri nelle urine o nell'ambiente del sangue intero, che è trasformativo per l'AST fenotipico a singola cellula rapida nella clinica.
Abstract
Per rallentare e prevenire la diffusione di infezioni resistenti agli antimicrobici, è urgente determinare quantitativamente gli effetti antimicrobici sugli agenti patogeni. In genere ci vogliono giorni per completare l'AST con metodi convenzionali basati sulla cultura a lungo termine e non funzionano direttamente per i campioni clinici. Qui, riportiamo un rapido metodo AST abilitato dall'imaging di scattering Raman stimolato (SRS) dell'incorporazione metabolica dell'ossido di deuterio (D2O). L'incorporazione metabolica di D2O nella biomassa e l'inibizione dell'attività metabolica in seguito all'esposizione agli antibiotici a livello di singolo batterio sono monitorate mediante imaging SRS. La concentrazione di inattivazione del metabolismo a singola cellula (SC-MIC) dei batteri dopo l'esposizione agli antibiotici può essere ottenuta dopo un totale di 2,5 ore di preparazione e rilevamento del campione. Inoltre, questo rapido metodo AST è direttamente applicabile a campioni batterici in ambienti biologici complessi, come l'urina o il sangue intero. L'imaging metabolico SRS dell'incorporazione del deuterio è trasformativo per l'AST fenotipico a singola cellula rapida nella clinica.
Introduzione
La resistenza antimicrobica (AMR) è una crescente minaccia globale per il trattamento efficace delle malattie infettive1. Si prevede che la resistenza antimicrobica causerà ulteriori 10 milioni di morti all'anno e una perdita di PIL globale di 100 trilioni di dollari entro il 2050 se non verrà intrapresa alcuna azione per combattere i batteri resistenti agli antibiotici 1,2. Ciò sottolinea l'urgente necessità di metodi diagnostici rapidi e innovativi per i test di sensibilità agli antibiotici (AST) dei batteri infettivi per rallentare la comparsa di batteri resistenti agli antibiotici e ridurre il relativo tasso di mortalità3. Per garantire il miglior risultato clinico possibile, è fondamentale introdurre una terapia efficace entro 24 ore. Tuttavia, l'attuale metodo gold standard, come la diffusione del disco o il metodo di diluizione del brodo, di solito richiede almeno 24 ore per la procedura di preincubazione per i campioni clinici e ulteriori 16-24 ore per ottenere i risultati della concentrazione inibitoria minima (MIC). Nel complesso, questi metodi richiedono troppo tempo per guidare una decisione immediata per il trattamento delle malattie infettive nella clinica, che porta alla comparsa e alla diffusione della resistenza antimicrobica4.
I metodi genotipici AST, come le tecniche basate sulla reazione a catena della polimerasi (PCR)5, sono stati sviluppati per una rapida rilevazione. Tali tecniche misurano le sequenze genetiche specifiche di resistenza al fine di fornire risultati rapidi AST. Non si basano su colture cellulari dispendiose in termini di tempo; Tuttavia, vengono testate solo specifiche sequenze genetiche note con resistenza. Pertanto, la sua applicazione è limitata a varie specie batteriche o diversi meccanismi di resistenza. Inoltre, non possono fornire risultati MIC per le decisioni terapeutiche 6,7. Inoltre, sono in fase di sviluppo nuovi metodi fenotipici per l'AST rapida per superare queste limitazioni8, compresi i dispositivi microfluidici 9,10,11,12,13, i dispositivi ottici14,15,16, l'AST fenotipico che quantifica il numero di copia degli acidi nucleici17,18 e i metodi spettroscopici Raman 19, 20,21,22,23,24. Questi metodi riducono il tempo per guidare i risultati AST, tuttavia, la maggior parte di essi sono applicabili solo agli isolati batterici, non direttamente ai campioni clinici, e richiedono ancora una preincubazione a lungo termine.
In questo lavoro, presentiamo un metodo per determinare rapidamente la suscettibilità dei batteri nelle urine e nel sangue intero attraverso il monitoraggio dell'attività metabolica cellulare mediante imaging SRS. L'acqua (H2O) partecipa alla stragrande maggioranza dei processi essenziali di sintesi biomolecolare nelle cellule viventi. Come isotopologo dell'acqua, attraverso la reazione di scambio H/D catalizzata da enzimi tra l'atomo di idrogeno redox-attivo in NADPH e l'atomo D in D2O, il deuterio può essere incorporato nella biomassa all'interno di una cellula25,26. Una reazione di sintesi degli acidi grassi deuterati è mediata dal deuterio marcato NADPH. L'incorporazione di D2O nelle reazioni degli amminoacidi (AA) provoca la produzione di proteine deuterate26 (Figura 1). In questo modo, le biomolecole contenenti legami C-D appena sintetizzate in singole cellule microbiche possono essere impiegate come marcatore di attività metabolica generale da rilevare. Per leggere i legami C-D sintetizzati de novo, la spettroscopia Raman, uno strumento analitico versatile che fornisce informazioni chimiche specifiche e quantitative delle biomolecole, è ampiamente utilizzata per determinare la suscettibilità antimicrobica e ridurre significativamente il tempo di test a poche ore27,28,29,30 . Tuttavia, a causa della bassa efficienza intrinseca del processo di scattering Raman, la spettroscopia Raman spontanea è di bassa sensibilità di rivelazione. Pertanto, è difficile ottenere risultati di immagini in tempo reale utilizzando la spettroscopia Raman spontanea. Lo scattering Raman coerente (CRS), incluso lo scattering Raman coerente anti-Stokes (CARS) e lo scattering Raman stimolato (SRS), ha raggiunto un'elevata sensibilità di rivelazione a causa del campo luminoso coerente per generare ordini di grandezza più grandi di quello della spettroscopia Raman spontanea, rendendo così l'imaging chimico ad alta velocità, specifico e quantitativo a livello di singola cellula 31,32,33,34,35 ,36,37,38,39.
Qui, sulla base del nostro lavoro più recente40, presentiamo un protocollo per la determinazione rapida dell'attività metabolica e della suscettibilità antimicrobica mediante imaging SRS C-D a femtosecondi dell'incorporazione di D2O di batteri nel mezzo normale, nelle urine e nell'ambiente del sangue intero a livello di singola cellula. L'imaging SRS a femtosecondi facilita il monitoraggio della concentrazione di inattivazione del metabolismo a singola cellula (SC-MIC) contro gli antibiotici a livello di singolo batterio entro 2,5 ore. I risultati SC-MIC sono convalidati dal test MIC standard tramite microdiluizione del brodo. Il nostro metodo è applicabile per determinare la suscettibilità antimicrobica dei batteri infezione del tratto urinario (UTI) e dell'infezione del flusso sanguigno (BSI) patogeni con un tempo di analisi molto ridotto rispetto al metodo convenzionale, che apre l'opportunità di una rapida AST fenotipica nella clinica a livello di singola cellula.
Protocollo
L'uso di campioni di sangue umano è conforme alle linee guida dell'IRB della Boston University e del National Institutes of Health (NIH). Nello specifico, gli esemplari provengono da una banca e sono completamente deidentificati. Questi esemplari non sono considerati soggetti umani dall'ufficio dell'Institutional Review Board (IRB) della Boston University.
1. Preparazione di batteri e antibiotici soluzione madre
- Preparare la soluzione madre di antibiotici (gentamicina solfato o amoxicillina) ad una concentrazione di 1 mg/ml disciolta in soluzione salina sterile1x tamponata fosfato (PBS) o dimetilsolfossido (DMSO) in microprovette da 1,5 ml. Sciogliere gentamicina solfato in soluzione sterile di PBS e amoxicillina in solvente DMSO sterile. Successivamente, conservare la soluzione antibiotica a 2-8 °C come suggerito.
- Perprodurre supporti dibrodo Mueller-Hinton (MHB) contenenti cationi aggiustati, aggiungere 220 mg di base di brodo MHB a 10 ml di D 2 O per ottenere il 100% di terreno contenente D2O. Sterilizzare la soluzione filtrando con filtri di dimensione dei pori di 200 nm.
NOTA: utilizzare sempre questo protocollo per la produzione e la sterilizzazione di soluzioni medie in ulteriori passaggi. - Per preparare campioni batterici per l'imaging SRS, aggiungere 2 ml di normale mezzo MHB, che non contiene deuterio, a una provetta di coltura sterile a fondo rotondo, quindi preriscaldarla a 37 °C.
- Utilizzare un'ansa sterile per selezionare una colonia batterica (Escherichia coli BW 25113 o Pseudomonas aeruginosa ATCC 47085) dalla coltura fresca su una piastra di agar di soia triptica. Quindi sospenderlo nei terreni di coltura preriscaldati e vortice delicatamente per preparare la sospensione batterica.
- Incubare i batteri a 37 °C in uno shaker a 200 giri al minuto (rpm) fino a raggiungere la fase logaritmica.
2. D2Trattamento di incorporazione in presenza di antibiotici (Figura 2a)
- Controllare la concentrazione batterica misurando la densità ottica (OD) con un fotometro ad una lunghezza d'onda di 600 nm.
- Diluire la soluzione batterica utilizzando il normale mezzo MHB, che non contiene deuterio, per raggiungere una concentrazione cellulare finale di 8 x 105 CFU/ml. Vortice delicatamente per mescolare le cellule batteriche.
- Preparare 300 μL di aliquote della soluzione batterica in sette micro provette da 1,5 mL e 600 μL di aliquote della soluzione batterica in una micro provetta da 1,5 ml.
- Aggiungere 4,8 μL di soluzione madre di antibiotico (gentamicina o amoxicillina) (1 mg/ml) nel microtubo contenente 600 μL della soluzione batterica, per ottenere la concentrazione finale di antibiotico a 8 μg/ml.
- Prelevare 300 μL di soluzione dagli 8 μg/ml di soluzione batterica contenente antibiotici e aggiungerli ad altri 300 μL di soluzione batterica, per ottenere una soluzione antibiotica diluita due volte (4 μg/ml) contenente batteri.
- Ripetere la doppia diluizione seriale degli antibiotici in esame, gentamicina o amoxicillina, fino a raggiungere il microtubo con la concentrazione più bassa (0,25 μg/ml) ed eliminare 300 μL dalla provetta. Sia per la gentamicina che per l'amoxicillina, le concentrazioni seriali vanno da 0,25 μg/ml a 8 μg/ml.
- Lasciare un tubo senza antibiotici per il controllo in bianco. Questo sarà il controllo positivo per ispezionare l'attività metabolica batterica senza trattamento antibiotico ma con trattamento D2O.
- Lasciare un tubo senza antibiotici e senza D2O per il controllo negativo.
- Incubare l'aliquota batterica con l'antibiotico specifico (gentamicina o amoxicillina) contenente terreno MHB per 1 ora.
- Durante l'incubazione, preparare una diluizione seriale di antibiotici con terreno contenente D 2 O al 100% con lo stesso gradiente di concentrazione degli antibiotici preparato nella fase2.6. Sia per la gentamicina che per l'amoxicillina, le concentrazioni seriali vanno da 0,25 μg/ml a 8 μg/ml.
- Dopo 1 ora di trattamento antibiotico, aggiungere 700 μL di antibiotico diluito in serie e terreno MHB contenente 100% D 2 O ai 300 μL di batteri pretrattati con antibiotico nella stessa concentrazione di antibiotico (preparati nella fase2.6), rispettivamente.
- Ad esempio, aggiungere 700 μL di mezzo MHB contenente 100% D2O (contenente 8 μg/ml di antibiotico) ai 300 μL di 8 μg/mL di batteri pretrattati con antibiotici. Allo stesso modo, trasferire ai tubi corrispondenti della concentrazione successiva e omogeneizzare pipettando su e giù più volte.
- Aggiungere 700 μL di terreno MHB 100% D 2 Oprivo di antibiotici a 300 μL di batteri privi di antibiotici (preparati nella fase 2.6.1) come controllo in bianco.
- Incubare a 37 °C in uno shaker di incubazione a 200 giri/min per altri 30 minuti.
NOTA: In questa fase, la concentrazione finale di D2O nel mezzo per la prova è del 70%.
- Centrifugare prima 1 mL di campione di antibiotico e D2O trattato a 6200 x g per 5 minuti a 4 °C, quindi lavare due volte con acqua purificata. Infine, fissare i campioni in una soluzione di formalina al 10% e conservarli a 4 °C.
3. Preparazione dei batteri nell'ambiente urinario (Figura 2b)
- Per preparare E. coli BW 25113 nella fase logaritmica, seguire i passaggi 1.4 e 1.5.
- Controllare la concentrazione batterica misurando l'OD con un fotometro ad una lunghezza d'onda di 600 nm.
- Per imitare i campioni clinici di UTI 14,18,41, aggiungere la soluzione di E. coli in 10 ml di urina deidentificata per raggiungere una concentrazione cellulare finale di 10 6 CFU / ml.
- Filtrare l'urina con picco di E. coli utilizzando un filtro da 5 μm, quindi dividere la soluzione batterica in 300 μL di aliquote in sette micro provette da 1,5 ml e 600 μL di aliquote della soluzione batterica in un micro tubo da 1,5 ml.
- Eseguire il trattamentodi incorporazione di D 2 O in presenza di antibiotici e raccolta del campione come descritto nelle fasi precedenti da 2.4 a 2.10.
4. Preparazione dei batteri nell'ambiente sanguigno (Figura 2c)
- Per preparare Pseudomonas aeruginosa ATCC 47085 nella fase logaritmica, seguire i passaggi 1.4 e 1.5.
- Per imitare i campioni clinici di infezioni del flusso sanguigno42,43, spike P. aeruginosa in 1 mL di sangue umano non identificato per raggiungere una concentrazione di 107 CFU / ml.
- Aggiungere 9 ml di acqua purificata sterile per lisare il sangue.
- Filtrare il sangue a spillo di P. aeruginosa utilizzando un filtro da 5 μm. Quindi raccogliere i batteri a 1 mL di volume mediante centrifugazione a 6200 x g per 5 minuti a 4 °C. Aggiungere 9 ml di MHB normale preriscaldato nella soluzione batterica e vortice delicatamente. La concentrazione finale di batteri è 106 CFU/mL
- Dividere la soluzione di sangue a spillo di P. aeruginosa in 300 μL di aliquote in sette micro provette da 1,5 ml e 600 μL di aliquote della soluzione batterica in una micro provetta da 1,5 ml.
- Eseguire il trattamentodi incorporazione di D 2 O in presenza di antibiotici e raccolta del campione come descritto nelle fasi precedenti da 2.4 a 2.10.
5. Imaging SRS dell'incorporazione metabolica di D2O in un singolo batterio
- Lavare 1 mL di soluzione batterica fissa con acqua purificata e quindi centrifugare a 6200 x g per 5 minuti a 4 °C. Rimuovere il surnatante. Arricchire la soluzione batterica a circa 20 μL.
- Depositare la soluzione batterica su un vetro di copertura rivestito di poli-L-lisina. Inserire e sigillare il campione per l'imaging SRS.
- Immagine dei batteri alla frequenza vibrazionale C-D a 2168 cm-1 utilizzando un microscopio SRS.
- Immettere e regolare la lunghezza d'onda della pompa a 852 nm utilizzando il software di controllo su un computer.
- Misurare la potenza del laser utilizzando un misuratore di potenza. Impostare la potenza del laser a pompa sul campione su ~ 8 mW e la potenza del laser Stokes sul campione su ~ 40 mW regolando la piastra a mezza onda davanti all'uscita laser.
NOTA: Nel microscopio SRS, un laser a femtosecondi sintonizzabile con una frequenza di ripetizione di 80 MHz fornisce i laser di eccitazione della pompa (da 680 a 1300 nm) e di Stokes (1045 nm).
- Regolando le viti degli specchi riflettenti, allineare spazialmente la pompa e i raggi Stokes e dirigere i due raggi in un microscopio verticale dotato di sistema di specchi galvo 2D per la scansione laser.
- Utilizzare un obiettivo di immersione in acqua 60x per focalizzare la pompa e i laser Stokes sul campione.
- Utilizzare un condensatore dell'olio per raccogliere i segnali dal campione nella direzione in avanti.
- Utilizzare un filtro passa-banda per filtrare il laser Stokes prima di indirizzarlo in un fotodiodo.
- Estrarre il segnale Raman stimolato da un amplificatore lock-in e rilevare i segnali dal fotodiodo.
- Impostare ogni immagine SRS in modo che contenga 200 x 200 pixel e il tempo di permanenza dei pixel per 30 μs nel pannello di controllo del software. Il tempo totale di acquisizione per un'immagine è ~ 1,2 s. Impostare la dimensione Step su 150 nm, quindi la dimensione dell'immagine è di circa 30 x 30 μm2. Immagine di almeno tre campi di vista per ogni campione.
6. Elaborazione delle immagini e analisi dei dati (Figura 3)
- Per ottenere l'intensità media del segnale C-D, aprire ed elaborare immagini SRS con il software ImageJ.
- Innanzitutto, converti le immagini SRS in immagini di tipo a 8 bit con colore invertito facendo clic su Immagine | Tipo | 8 bit, quindi modificare | Invertire i pulsanti nel software ImageJ.
- Quindi, filtrare le immagini con sfocatura gaussiana facendo clic su Elabora | Filtri | Pulsanti di sfocatura gaussiana e impostare Sigma (raggio) su 1.
- Utilizzare la regolazione della soglia dell'immagine per selezionare l'area batterica. Clicca sull'immagine | Regolare | Soglia per garantire che le dimensioni batteriche selezionate corrispondano a quelle delle immagini SRS originali. Eliminare le particelle piccole regolando la soglia di dimensione per determinare le particelle. Fare clic su Applica.
- Applica Analizza | Pulsanti di analisi delle particelle per etichettare e determinare l'area dei batteri.
- Facendo clic sul pulsante Mostra tutto nel gestore ROI all'immagine SRS originale non elaborata, etichettare la stessa area di batteri, determinare l'intensità media di ciascun punto dati facendo clic sul pulsante Misura nel gestore ROI.
- Cerchiare l'area di sfondo nell'immagine SRS originale e misurare l'intensità media dello sfondo. L'intensità media C-D di ciascun batterio si ottiene deducendo l'intensità del segnale di fondo.
7. Quantificazione della suscettibilità antimicrobica tramite SC-MIC
NOTA: Il valore limite a 0,60 per determinare l'SC-MIC è stabilito in base all'analisi statistica delle intensità SRS C-D delle condizioni attive e inibite dal metabolismo per i batteri su varie concentrazioni di esposizione al farmaco40. Le intensità C-D per i gruppi sensibili agli antibiotici e resistenti agli antibiotici sono state adattate con una distribuzione normale.
- Tracciare la curva delle caratteristiche operative del ricevitore (ROC) e valutare la soglia di cut-off a 0,60. Sulla base di questo valore di cut-off, l'SC-MIC come indicatore dell'efficacia degli antibiotici può essere definito per determinare il gruppo metabolicamente inattivo e metabolicamente attivo.
- Per analizzare quantitativamente i dati di imaging SRS, tracciare gli istogrammi delle intensità del segnale C-D per ciascun gruppo di batteri trattati con la concentrazione di antibiotici diluita in serie. I punti dati colorati rappresentano diversi singoli batteri.
- Normalizzare le intensità C-D del gruppo trattato con antibiotici all'intensità media del gruppo di controllo senza trattamento antibiotico. Determinare i risultati SC-MIC di diversi batteri e combinazioni di antibiotici quantificando le intensità del segnale SRS nella regione C-D rispetto a varie concentrazioni di antibiotici utilizzando il valore di cut-off a 0,60.
- Convalidare e confrontare la lettura SC-MIC con la MIC determinata utilizzando il test di microdiluizione del brodo convenzionale.
- Secondo il Clinical and Laboratory Standards Institute (CLSI), la categoria di suscettibilità basata sui risultati dell'imaging metabolico SRS per ciascun ceppo batterico testato è interpretata come "suscettibile", "resistente" o "intermedio".
Risultati
L'effetto del tempo di incubazione sull'incorporazione del deuterio è misurato mediante microspettroscopia Raman spontanea nella regione C-D (da 2070 a 2250 cm-1) e C-H (da 2.800 a 3.100 cm-1) (Figura 4a). Gli spettri Raman a singola cellula time-lapse di P. aeruginosa coltivati in terreno contenente il 70% di D 2 O mostrano un aumento dell'intensità CD/CH nel tempo di incubazione da 0 a 180 min. (Figura 4b) La crescente abbondanza di C-D nelle singole cellule microbiche rivelache D2O è incorporato nelle biomolecole deuterate all'interno della cellula.
D2O l'etichettatura superiore al 50% influisce significativamente sul metabolismo batterico durante un periodo di incubazione di 23 ore27. Abbiamo osservato l'inibizione della crescita batterica quando la concentrazione di marcatura di D2O è superiore al 70% durante un periodo di incubazione di 25 ore (Figura S1). Abbiamo eseguito MIC mediante diluizione del brodo gold standard e ottenuto risultati SC-MIC in due ceppi di P. aeruginosa (P. aeruginosa ATCC 47085 e P. aeruginosa 1133) (Tabella S1). I nostri risultati attuali mostrano che il 70% di D2O non influisce sulle prestazioni del nostro metodo in P. aeruginosa. L'accordo di categoria del nostro metodo SC-MIC con il metodo convenzionale basato sulla coltura è del 100% per tutte le combinazioni testate di P. aeruginosa e antibiotici, come mostrato nella Tabella S1. Attribuiamo questo buon accordo alla tossicità minima del 70% di D2O su P. aeruginosa durante il periodo di incubazione di 30 minuti nella determinazione di SC-MIC.
Seguendo il protocollo, P. aeruginosa è stata incubata con gentamicina diluita serialmente per 1 ora e poi 70% D2O per ulteriori 30 minuti. È stata condotta l'imaging metabolico SRS a ~ 2168 cm-1 (Figura 5a). Le intensità C-D dopo il trattamento antibiotico sono divise per il valore medio del gruppo di controllo, che è senza trattamento antibiotico. L'analisi statistica quantitativa (Figura 5b) ha mostrato che i segnali C-D di P. aeruginosa erano significativamente più bassi a 2 μg/ml o concentrazione di gentamicina superiore rispetto a quelli senza trattamento con gentamicina (0 μg/ml). Utilizzando la soglia di cut-off a 0,60, la P. aeruginosa è stata inibita metabolicamente a 2 μg/ml e concentrazioni più elevate di gentamicina. La linea tratteggiata mostra il valore limite definito a 0,60 nella Figura 5b. In questo modo, l'SC-MIC per P. aeruginosa contro gentamicina nel normale mezzo MHB è stato determinato essere di 2 μg/ml. Si verifica che questo valore SC-MIC rientri nell'intervallo di differenza di una piega con il MIC (4 μg/ml) determinato dal metodo di microdiluizione del brodo (Figura 5c). Nel loro insieme, SC-MIC determinato dalla nostra tecnologia consente di quantificare la suscettibilità antimicrobica.
Per esplorare il potenziale dell'AST rapido mediante imaging SRS dell'incorporazione metabolica del deuterio per applicazioni cliniche, in particolare per l'infezione UTI più diffusa, abbiamo testato campioni di urina con batteri utilizzando E. coli, l'agente patogeno più comune per causare l'infezione da UTI44. Per imitare i campioni UTI clinici a una concentrazione batterica relativa, E. coli viene aggiunto all'urina deidentificata a una concentrazione finale di 106 CFU / ml. Dopo la purificazione del campione, i campioni di urina sono stati incubati con amoxicillina e D2O. Lo sfondo pulito nelle immagini SRS ha mostrato che il protocollo di preparazione del campione era applicabile per la misurazione rapida di AST (Figura 5d). L'SC-MIC per il campione di urina con picco di E. coli contro amoxicillina è stato determinato essere 4 μg / mL (Figura 5e), che ha la stessa lettura di suscettibilità con il MIC (8 μg / ml) con il metodo di diluizione del brodo convenzionale per E. coli puro in mezzo MHB normale (Figura 5f). Questi risultati hanno mostrato collettivamente che l'imaging rapido AST mediante SRS dell'incorporazione metabolica del deuterio è di grande potenziale per la diagnosi clinica dei patogeni infettivi UTI.
Rispetto all'infezione UTI, l'AST rapido per i patogeni BSI è molto più impegnativo per lo studio in situ dell'attività metabolica batterica, poiché molte cellule del sangue si presentano nel sangue. Per studiare l'applicabilità dell'AST rapido mediante imaging SRS dell'incorporazione metabolica di D2O per campioni clinici di BSI, è stato rilevato un picco di P. aeruginosa nel sangue umano non identificato. Come mostrato nella Figura 5g, l'intensità C-D dell'immagine SRS a 2168 cm-1 era dominata da segnali batterici. Poiché i globuli rossi non hanno attività metabolica per assorbire D2O per un'ulteriore biosintesi, i segnali C-D sono stati originati dall'incorporazione metabolica del deuterio di batteri vivi. La modulazione cross-phase o il segnale fototermico di detriti o specie di globuli rossi ha contribuito ai deboli segnali di fondo, senza influenzare l'analisi quantitativa del SC-MIC. Il risultato SC-MIC per P. aeruginosa nel sangue è stato determinato essere di 2 μg/ml (Figura 5h), che concordava bene con il risultato MIC standard convenzionale per P. aeruginosa nel terreno di crescita normale (Figura 5i). Nel loro insieme, questi risultati hanno mostrato che l'imaging metabolico SRS dell'incorporazione metabolica del deuterio può essere un metodo AST rapido per determinare l'SC-MIC per i batteri nelle infezioni BIS.
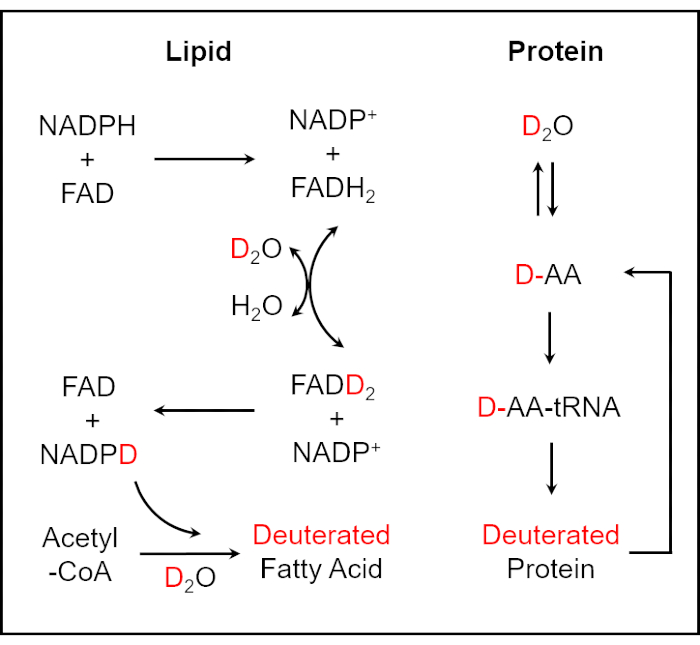
Figura 1: Schema per l'incorporazione di D2O nei lipidi e nelle proteine deuterati25,26. Il deuterio può essere incorporato nella biomassa all'interno di una cellula attraverso la reazione di scambio H/D catalizzata da enzimi tra l'atomo di idrogeno redox-attivo nel NADPH e l'atomo D in D2O. La reazione di sintesi degli acidi grassi deuterati è mediata dal deuterio marcato NADPH. L'incorporazione di D2O nelle reazioni degli amminoacidi provoca la produzione di proteine deuterate. Questa cifra è stata modificata dal rif.40. Fare clic qui per visualizzare una versione ingrandita di questa figura.
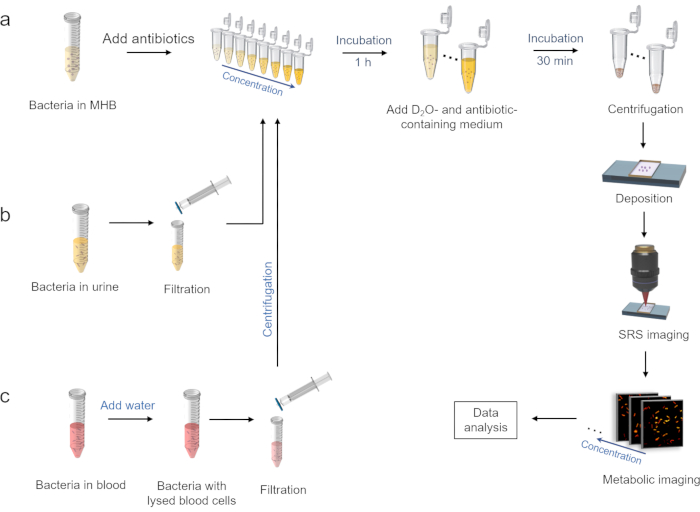
Figura 2: Flusso di lavoro dell'AST rapido mediante imaging metabolico SRS dell'incorporazione del deuterio. a) Trattamento di incorporazione di D2O in presenza di antibiotici nel mezzo MHB e le seguenti procedure di imaging SRS. b) Preparazione di batteri nell'ambiente urinario. c) Preparazione di batteri nell'ambiente sanguigno. Questa cifra è stata modificata dal rif.40. Fare clic qui per visualizzare una versione ingrandita di questa figura.
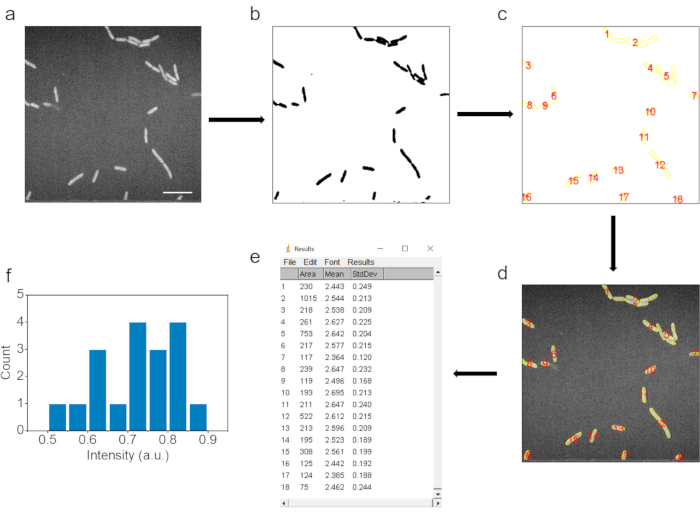
Figura 3. Elaborazione automatizzata delle immagini e interpretazione dei dati. (a) Immagine SRS non elaborata. (b) Immagine dopo aggiustamento della soglia di intensità per determinare l'area delle cellule batteriche. c) Punti dati selezionati dopo la fase di analisi delle particelle. (d) I punti dati corrispondenti sono selezionati nell'immagine raw. (e) Risultati dei punti dati corrispondenti nell'immagine non elaborata. f) Risultati statistici dell'intensità media dei punti dati dopo la sottrazione dello sfondo precedente. Barra scala: 10 μm. Questa cifra è stata modificata dal rif.40. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4. Effetto del tempo di incubazione sull'incorporazione del deuterio nei batteri. (a) Misurazione time-lapse nella regione C-D (da 2070 a 2250 cm-1) e C-H (da 2.800 a 3.100 cm-1) mediante microspettroscopia Raman spontanea (media da 20 spettri). b) Grafico dell'istogramma del rapporto di intensità CD/CH nel tempo di incubazione D2O per i batteri in (a). Ogni punto colorato rappresenta una misurazione da un singolo batterio. Le barre di errore rappresentano l'errore standard della media (SEM). Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5. Determinazione SC-MIC mediante imaging SRS dell'incorporazione metabolica batterica di D2O contro antibiotici in ambiente normale, urinario e sanguigno. (a) Imaging SRS a vibrazione C-D (2168 cm-1) e le corrispondenti immagini di trasmissione di P. aeruginosa in presenza di D2O con aggiunta di gentamicina diluita serialmente in mezzo MHB normale. b) Analisi quantitativa dell'intensità SRS C-D di P. aeruginosa in (a). I punti dati colorati nell'istogramma rappresentano il diverso batterio individuale. La linea tratteggiata indica il valore limite a 0,60. (c) Il confronto della lettura SC-MIC con il metodo MIC mediante microdiluizione del brodo e la categoria di suscettibilità per P. aeruginosa secondo il CLSI. (d) Imaging SRS a vibrazione C-D (2168 cm-1) e corrispondenti immagini di trasmissione di E. coli nelle urine dopo incubazione in D2O con amoxicillina diluita in serie. e) Analisi quantitativa dell'intensità SRS C-D in (d). (f) Il confronto della lettura SC-MIC e della categoria di suscettibilità per E. coli nella MHB normale e nelle urine. g) imaging SRS a vibrazione C-D (2168 cm-1) e corrispondenti immagini di trasmissione di P. aeruginosa nel sangue dopo incubazione in D2O con gentamicina diluita in serie. h) Analisi quantitativa dell'intensità SRS C-D in (g). (i) Il confronto della lettura SC-MIC e della categoria di suscettibilità per P. aeruginosa nell'MHB normale e nel sangue. S: sensibile. Numero di cellule N ≥ 10 per gruppo. Le barre di errore rappresentano il SEM. Barra della scala: 10 μm. Questa cifra è stata modificata dal rif.40. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Problema | Possibile motivo | Soluzione |
| Poco o nessun numero di cellule batteriche nel campo visivo di imaging | La densità batterica nella soluzione è troppo bassa | Centrifugare più a lungo per arricchire ulteriormente i batteri |
| Fotodanneggiamento delle cellule batteriche durante l'imaging SRS | La potenza laser utilizzata è troppo elevata | Ridurre la potenza del laser a un valore appropriato |
| Nessun segnale SRS è rilevabile | La sovrapposizione spaziale e temporale della pompa e del fascio di Stokes non è ottimizzata | Allineare la pompa e le travi di Stokes utilizzando un campione standard di dimetilsolfossido deuterato |
Tabella 1: tabella dei problemi relativi alla risoluzione dei problemi.
Figura S1: Test di tossicità D 2 O su P. aeruginosa coltivato in terreno Lauria-Bertani (LB) con diverse concentrazioni di D2O. Le barre di errore indicano valori di deviazione standard (numero di misurazioni = 5). Clicca qui per scaricare questa figura.
Tabella S1. Confronto di SC-MIC e MIC in MHB normale di P. aeruginosa dopo trattamento antibiotico. S: sensibile; R: resistente; I: Intermedio. Clicca qui per scaricare questa tabella.
Discussione
L'AST rapida può essere ottenuta valutando la risposta dell'attività metabolica batterica al trattamento antibiotico utilizzando l'imaging metabolico SRS a singola cellula entro 2,5 ore dal campione ai risultati SC-MIC. La risposta dell'attività metabolica batterica e della suscettibilità antimicrobica può essere rilevata monitorando l'incorporazione metabolica di D2O per la sintesi di biomolecole utilizzando l'imaging SRS dei legami C-D. Poiché l'acqua è utilizzata ovunque nelle cellule viventi, l'imaging metabolico SRS fornisce un metodo universale per una rapida AST. Il metodo AST rapido è applicabile per rilevare batteri in ambienti biologici complessi, come l'urina o il sangue intero a livello di singolo batterio. La SC-MIC può essere determinata dopo 1,5 ore di coltura di batteri nelle urine e nel sangue, che è considerata trasformativa per spostare il paradigma della diagnosi UTI e BSI da una procedura dipendente dalla coltura che richiede tempo a un approccio in situ indipendente dalla coltura. Pertanto, significa un'enorme riduzione dei tempi di diagnosi rispetto al metodo convenzionale di microdiluizione del brodo, che apre la strada alla traduzione clinica consentendo l'identificazione tempestiva di agenti antimicrobici appropriati per un trattamento preciso.
I protocolli per il trattamento antibiotico qui descritti seguono le linee guida del CLSI, in cui il mezzo MHB suggerito può essere generalmente utilizzato per la coltivazione di un'ampia varietà di microrganismi. Un parametro chiave è che il numero di cellule batteriche utilizzato per i test di sensibilità antimicrobica è mantenuto a circa 5 x 105 CFU / ml come raccomandato in CLSI. Questo è di fondamentale importanza per ottenere risultati accurati e riproducibili. Negli esperimenti di trattamento antibiotico, la concentrazione di batteri è fissata a 8 x 105 CFU / ml. Una maggiore concentrazione di batteri può portare ad un aumento dei risultati della MIC. Una volta regolata la sospensione batterica, deve essere utilizzata entro 30 minuti per evitare cambiamenti nella concentrazione delle cellule batteriche.
Per i test di sensibilità di un antibiotico come la daptomicina, si raccomanda di integrare 50 mg / L di calcio nei media. Il mezzo MHB cationico corretto contiene 20-25 mg/L di Ca2+. Pertanto, assicurarsi che il mezzo sia ulteriormente integrato con Ca2+ aggiuntivo (solubilizzato in acqua e filtrato sterilizzato) nella concentrazione di 30 mg / L.
Un altro passo critico nel metodo presentato è il tempo di incubazione dei batteri dopo l'esposizione agli antibiotici e l'incorporazione di D2O. Poiché il tempo di generazione del ciclo di vita batterico è di circa 30-60 minuti, è importante influenzare l'attività metabolica batterica sull'esposizione agli antibiotici per un certo tempo. Questo test è stato valutato per una varietà di combinazioni batterio-antibiotico all'esposizione agli antibiotici per 1 ora prima del trattamento con 0,5 ore D2O. La prima fase di trattamento antibiotico di 1 ora è essenziale per influenzare l'attività metabolica batterica. Successivamente, i batteri vengono incubati con terreno contenente D2O e contenente antibiotici per ulteriori 30 minuti. Le concentrazioni finali di antibiotici sono mantenute allo stesso livello e la concentrazione finale di D2O viene regolata al 70%. Complessivamente, dopo 1 ora di precoltura antibiotica e dopo 0,5 ore di D2O e incorporazione di antibiotici, i risultati SC-MIC vengono quindi determinati mediante imaging metabolico SRS dell'attività metabolica batterica. Questo disegno riduce al minimo l'impatto dell'influenza di D2O dell'attività antimicrobica sui batteri e porta anche a una lettura comparabile dei risultati SC-MIC con i MIC con il metodo convenzionale.
Nelle misurazioni SC-MIC, prepariamo in parallelo 40 campioni, inclusi 5 diversi antibiotici, ciascuno con 8 concentrazioni contemporaneamente. Tuttavia, poiché ci sono molte procedure operative manuali, il tempo totale di analisi per rilevare l'AST per cinque diverse combinazioni batteriche-antibiotici è più lungo di 2,5 ore. Nel nostro metodo, ogni immagine SRS contenente ~ 20 singole cellule batteriche è stata ottenuta entro ~ 1,0 s in un singolo scatto a 30 μs di tempo di permanenza dei pixel. Stimiamo che il tempo totale di analisi AST per studiare 10 antibiotici per un ceppo batterico sarebbe inferiore a 2,5 ore dal campione alla lettura SC-MIC, che ha un'enorme possibilità di eseguire misurazioni ad alta produttività. Nel lavoro futuro, verrà utilizzato un metodo automatizzato di preparazione dei campioni e acquisizione dei dati di imaging per migliorare ulteriormente la produttività. I dettagli sulla risoluzione dei problemi sono forniti nella Tabella 1.
Nei metodi AST convenzionali basati su coltura, per ottenere isolati batterici per ulteriori misurazioni, è necessario pre-incubare campioni clinici per ore. Sono stati sviluppati metodi AST avanzati per campioni UTI clinici, come la spettroscopia Raman29, l'array di nanolitri6 e la quantificazione digitale dell'acido nucleico18, per eliminare la preincubazione a lungo termine. Rispetto all'infezione UTI, il BSI o sepsi è molto più pericoloso per la vita18,45, dove è urgentemente necessaria una rapida AST per una diagnostica precisa in clinica. Un metodo di imaging microscopico per misurare la formazione di colonie batteriche da colture di sangue positive è stato riportato per fornire risultati MIC46. Tuttavia, ci vogliono almeno 6 ore per far crescere i batteri per condurre il test AST. Inoltre, i sistemi automatici commerciali47 e le strategie di spettrometria di massa48,49 possono fornire la lettura AST da emocolture positive. Tuttavia, i risultati del MIC per la decisione clinica non possono essere forniti. I risultati AST e la lettura MIC sono significativi per evitare un eccesso di dosaggio di antibiotici ai pazienti per causare potenziali effetti collaterali nelle cliniche, per rallentare e prevenire la diffusione delle infezioni resistenti agli antimicrobici50,51. Rispetto agli attuali metodi AST basati sulla microscopia Raman spontanea, la nostra tecnologia riduce enormemente i tempi di acquisizione dei dati (circa 600 volte inferiori) grazie al miglioramento del segnale di ordini di grandezza. In questo lavoro, dimostriamo una rapida AST mediante imaging SRS del metabolismo del deuterio in singoli batteri a una concentrazione batterica clinicamente rilevante (105 ~ 106 CFU / ml) nelle urine o nell'ambiente del sangue intero. Come mostrato nei risultati precedenti, i risultati della MIC sono determinati dopo 1 ora di trattamento antibiotico e 30 minuti di miscela di D2O e incubazione di antibiotici nei batteri nelle urine e nel sangue. Il nostro metodo può fornire MIC e classificazione di suscettibilità per ogni combinazione ceppo-antibiotico entro 2,5 ore e, quindi, apre una nuova strada alla traduzione clinica. Per riassumere, senza la necessità di precoltura e divisione batterica, il nostro metodo ha un enorme potenziale nel campo dell'AST rapido e ad alto rendimento nelle malattie infettive.
Il nostro metodo SC-MIC di imaging metabolico SRS è applicabile per rilevare le MIC e fornire una classificazione di suscettibilità per i patogeni infettivi quando si tratta di abbondanti varietà di combinazioni ceppo-antibiotico per uso clinico. L'SC-MIC viene determinato dopo 30 minuti di incorporazione di D2O nei batteri nelle urine e nel sangue, il che significa un'enorme riduzione dei tempi di diagnosi rispetto al metodo di diluizione del brodo convenzionale che costa da 16 a 24 ore per la preincubazione. Per fornire informazioni sull'identificazione dei patogeni per il processo decisionale clinico, la tecnologia di imaging metabolico SRS può essere ulteriormente integrata con piattaforme diagnostiche in grado di identificare rapidamente i patogeni, come la spettrometria di massa a tempo di volo con ionizzazione del desorbimento laser assistita da matrice 49,52,53. La combinazione dell'identificazione in situ dei patogeni e della diagnosi rapida di AST potrebbe essere di grande potenziale per la traduzione in clinica che consente l'identificazione tempestiva di agenti antimicrobici appropriati per un trattamento preciso.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da NIH R01AI141439 a J.-X.C e M.S, e R35GM136223 a J.-X.C.
Materiali
| Name | Company | Catalog Number | Comments |
| Acousto-optic modulation | Gooch&Housego | R15180-1.06-LTD | Modulating stokes laser beam |
| Amoxicillin | Sigma Aldrich | A8523-5G | |
| Bandpass filter | Chroma | HQ825/150m | Block the stokes laser beam before the photodiode |
| Calcium chloride | Sigma Aldrich | C1016-100G | Cation adjustment |
| Cation-adjusted Mueller-Hinton Broth | Fisher Scientific | B12322 | Antimicrobial susceptibility testing of microorganisms by broth dilution methods |
| Centrifuge | Thermo Scientific | 75002542 | |
| Cover Glasses | VWR | 16004-318 | |
| Culture tube with snap cap | Fisher brand | 149569B | |
| Daptomycin | Acros | A0386346 | |
| Deuterium oxide | 151882 | Organic solvent to dissolve antibiotics | |
| Deuterium oxide-d6 | Sigma Aldrich | 156914 | Organic solvent as a standard to calibrate SRS imaging system |
| Escherichia coli BW 25113 | The Coli Genetic Stock Center | 7636 | |
| Eppendorf polypropylene microcentrifuge tubes 1.5 mL | Fisher brand | 05-408-129 | |
| Gentamicin sulfate | Sigma Aldrich | G4918 | |
| Hydrophilic Polyvinylidene Fluoride filters | Millipore-Sigma | SLSV025NB | pore size 5 µm |
| ImageJ software | NIH | Version: 2.0.0-rc-69/1.52t | Image processing and analysis |
| Incubating orbital shaker set at 37 °C | VWR | 97009-890 | |
| Inoculation loop | Sigma | BR452201-1000EA | |
| InSight DeepSee femtosecond pulsed laser | Spectra-Physics | Model: insight X3 | Tunable laser source and fixed laser source at 1045 nm for SRS imaging |
| Lock-in amplifier | Zurich Instrument | HF2LI | Demodulate the SRS signals |
| Oil condenser | Olympus | U-AAC | NA 1.4 |
| Pseudomonas aeruginosa ATCC 47085 (PAO1) | American Type Culture Collection | ATCC 47085 | |
| Photodiode | Hamamatsu | S3994-01 | Detector |
| Polypropylene conical tube 15 mL | Falcon | 14-959-53A | |
| Polypropylene filters | Thermo Scientific | 726-2520 | pore size 0.2 µm |
| Sterile petri dishes | Corning | 07-202-031 | |
| Syringe 10 mL | Fisher brand | 14955459 | |
| UV/Vis Spectrophotometer | Beckman Coulter | Model: DU 530 | Measuring optical density at wavelength of 600 nm |
| Vortex mixer | VWR | 97043-562 | |
| Water objective | Olympus | UPLANAPO/IR | 60×, NA 1.2 |
Riferimenti
- O'Neill, J. Tackling drug-resistant infections globally: final report and recommendations. The review on Antimicrobial Resistance. , (2016).
- Sugden, R., Kelly, R., Davies, S. Combatting antimicrobial resistance globally. Nature Microbiology. 1 (10), 16187 (2016).
- Kumar, A., et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Critical Care Medicine. 34 (6), 1589-1596 (2006).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: a review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Frickmann, H., Masanta, W. O., Zautner, A. E. Emerging rapid resistance testing methods for clinical microbiology laboratories and their potential impact on patient management. BioMed Research International. 2014, 375681 (2014).
- Avesar, J., et al. Rapid phenotypic antimicrobial susceptibility testing using nanoliter arrays. Proceedings of the National Academy of Sciences. 114 (29), 5787-5795 (2017).
- Schoepp, N. G., et al. Digital quantification of DNA replication and chromosome segregation enables determination of antimicrobial susceptibility after only 15 minutes of antibiotic exposure. Angewandte Chemie International Edition. 55 (33), 9557-9561 (2016).
- van Belkum, A., et al. Innovative and rapid antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 18 (5), 299-311 (2020).
- Hou, Z., An, Y., Hjort, K., Sandegren, L., Wu, Z. Time lapse investigation of antibiotic susceptibility using a microfluidic linear gradient 3D culture device. Lab on a Chip. 14 (17), 3409-3418 (2014).
- Choi, J., et al. Rapid antibiotic susceptibility testing by tracking single cell growth in a microfluidic agarose channel system. Lab on a Chip. 13 (2), 280-287 (2013).
- Lu, Y., et al. Single cell antimicrobial susceptibility testing by confined microchannels and electrokinetic loading. Analytical Chemistry. 85 (8), 3971-3976 (2013).
- Kim, S. C., Cestellosblanco, S., Inoue, K., Zare, R. N. Miniaturized antimicrobial susceptibility test by combining concentration gradient generation and rapid cell culturing. Antibiotics. 4 (4), 455-466 (2015).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Baltekin, &. #. 2. 1. 4. ;., Boucharin, A., Tano, E., Andersson, D. I., Elf, J. Antibiotic susceptibility testing in less than 30 min using direct single-cell imaging. Proceedings of the National Academy of Sciences. 114 (34), 9170-9175 (2017).
- Fredborg, M., et al. Real-time optical antimicrobial susceptibility testing. Journal of Clinical Microbiology. 51 (7), 2047-2053 (2013).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Barczak, A. K., Hung, D. T. RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities. Proceedings of the National Academy of Sciences. 109 (16), 6217-6222 (2012).
- Schoepp, N. G., et al. Rapid pathogen-specific phenotypic antibiotic susceptibility testing using digital LAMP quantification in clinical samples. Science Translational Medicine. 9 (410), (2017).
- Novelli-Rousseau, A., et al. Culture-free antibiotic-susceptibility determination from single-bacterium Raman spectra. Scientific Reports. 8 (1), 1-12 (2018).
- Schröder, U. -. C., et al. Detection of vancomycin resistances in enterococci within 3 1/2 hours. Scientific Reports. 5, 8217 (2015).
- Liu, C. -. Y., et al. Rapid bacterial antibiotic susceptibility test based on simple surface-enhanced Raman spectroscopic biomarkers. Scientific Reports. 6 (1), 1-15 (2016).
- Chang, K. -. W., et al. Antibiotic susceptibility test with surface-enhanced raman scattering in a microfluidic system. Analytical Chemistry. 91 (17), 10988-10995 (2019).
- Galvan, D. D., Yu, Q. surface-enhanced raman scattering for rapid detection and characterization of antibiotic-resistant bacteria. Advanced Healthcare Materials. 7 (13), 1701335 (2018).
- Kirchhoff, J., et al. Simple ciprofloxacin resistance test and determination of minimal inhibitory concentration within 2 h using raman spectroscopy. Analytical Chemistry. 90 (3), 1811-1818 (2018).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Berry, D., et al. Tracking heavy water (D2O) incorporation for identifying and sorting active microbial cells. Proceedings of the National Academy of Sciences. 112 (2), 194-203 (2015).
- Tao, Y., et al. Metabolic-activity-based assessment of antimicrobial effects by D2O-labeled single-cell raman microspectroscopy. Analytical Chemistry. 89 (7), 4108-4115 (2017).
- Yang, K., et al. Rapid antibiotic susceptibility testing of pathogenic bacteria using heavy water-labeled single-cell raman spectroscopy in clinical samples. Analytical Chemistry. 91 (9), 6296-6303 (2019).
- Song, Y., et al. Raman-Deuterium Isotope Probing for in-situ identification of antimicrobial resistant bacteria in Thames River. Scientific reports. 7 (1), 16648 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Cheng, J. -. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17, 415-445 (2015).
- Yue, S., Cheng, J. -. X. Deciphering single cell metabolism by coherent Raman scattering microscopy. Current Opinion in Chemical Biology. 33, 46-57 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, Label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- He, R., Liu, Z., Xu, Y., Huang, W., Ma, H., Ji, M. Stimulated Raman scattering microscopy and spectroscopy with a rapid scanning optical delay line. Optics Letters. 42 (4), 659-662 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences. 116 (32), 15842-15848 (2019).
- Camp, C. H., et al. High-Speed Coherent Raman Fingerprint Imaging of Biological Tissues. Nature Photonics. 8, 627-634 (2014).
- Zhang, M., et al. Rapid determination of antimicrobial susceptibility by stimulated raman scattering imaging of D2O metabolic incorporation in a single bacterium. Advanced Science. 7 (19), 2001452 (2020).
- Michael, I., et al. A fidget spinner for the point-of-care diagnosis of urinary tract infection. Nature Biomedical Engineering. 4 (6), 591-600 (2020).
- Bhattacharyya, R. P., et al. Simultaneous detection of genotype and phenotype enables rapid and accurate antibiotic susceptibility determination. Nature Medicine. 25 (12), 1858-1864 (2019).
- Stupar, P., et al. Nanomechanical sensor applied to blood culture pellets: a fast approach to determine the antibiotic susceptibility against agents of bloodstream infections. Clinical Microbiology and Infection. 23 (6), 400-405 (2017).
- Barber, A. E., Norton, J. P., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Cohen, J., et al. Sepsis: a roadmap for future research. The Lancet Infectious Diseases. 15 (5), 581-614 (2015).
- Choi, J., et al. rapid antimicrobial susceptibility test from positive blood cultures based on microscopic imaging analysis. Scientific Reports. 7 (1), 1148 (2017).
- Gherardi, G., et al. Comparative evaluation of the Vitek-2 Compact and Phoenix systems for rapid identification and antibiotic susceptibility testing directly from blood cultures of Gram-negative and Gram-positive isolates. Diagnostic Microbiology and Infectious Disease. 72 (1), 20-31 (2012).
- Machen, A., Drake, T., Wang, Y. F. Same day identification and full panel antimicrobial susceptibility testing of bacteria from positive blood culture bottles made possible by a combined lysis-filtration method with MALDI-TOF VITEK mass spectrometry and the VITEK2 system. Plos One. 9, 87870 (2014).
- Simon, L., et al. Direct identification of 80 percent of bacteria from blood culture bottles by matrix-assisted laser desorption ionization-time of flight mass spectrometry using a 10-minute extraction protocol. Journal of Clinical Microbiology. 57 (2), 01278 (2019).
- Leekha, S., Terrell, C. L., Edson, R. S. General principles of antimicrobial therapy. Mayo Clinic Proceedings. 86 (2), 156-167 (2011).
- Johnson, L., et al. Emergence of fluoroquinolone resistance in outpatient urinary Escherichia coli isolates. The American Journal of Medicine. 121 (10), 876-884 (2008).
- Van Belkum, A., et al. Developmental roadmap for antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 17 (1), 51-62 (2019).
- Dubourg, G., Lamy, B., Ruimy, R. Rapid phenotypic methods to improve the diagnosis of bacterial bloodstream infections: meeting the challenge to reduce the time to result. Clinical Microbiology and Infection. 24 (9), 935-943 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon