Method Article
単一細菌への重水素取り込みの誘導ラマン散乱イメージングによる迅速抗菌薬感受性試験
要約
このプロトコルは、D2O代謝の単一細胞刺激ラマン散乱イメージングによる2.5時間以内の迅速な抗菌剤感受性試験(AST)アッセイを提示します。この方法は、尿または全血環境の細菌に適用され、診療所での迅速な単一細胞表現型ASTに変化します。
要約
薬剤耐性感染症の拡大を遅らせ、防止するために、病原体に対する抗菌効果を定量的に決定するための迅速な抗菌薬感受性試験(AST)が緊急に必要です。通常、長時間の培養に基づく従来の方法でASTを完了するには数日かかり、臨床サンプルでは直接機能しません。ここでは、酸化重水素(D2O)代謝取り込みの誘導ラマン散乱(SRS)イメージングによって可能になる迅速なAST法について報告する。バイオマスへのD2Oの代謝取り込みおよび単一細菌レベルでの抗生物質への曝露時の代謝活性阻害は、SRSイメージングによってモニターされる。抗生物質への曝露時の細菌の単一細胞代謝不活化濃度(SC-MIC)は、合計2.5時間のサンプル調製および検出後に得ることができます。さらに、この迅速なAST法は、尿や全血などの複雑な生物学的環境の細菌サンプルに直接適用できます。重水素取り込みのSRS代謝イメージングは、臨床における迅速な単一細胞表現型ASTに変革的です。
概要
薬剤耐性(AMR)は、感染症の効果的な治療に対する世界的な脅威として増大しています1。AMRは、抗生物質耐性菌との闘いのための対策を講じなければ、2050年までに年間1,000万人が死亡し、世界のGDPが100兆ドル減少すると予測されています1,2。これは、抗生物質耐性菌の出現を遅らせ、関連する死亡率を低下させるために、感染性細菌の抗生物質感受性試験(AST)のための迅速かつ革新的な診断方法の緊急の必要性を強調しています3。可能な限り最良の臨床転帰を確実にするためには、24時間以内に効果的な治療法を導入することが重要です。ただし、ディスク拡散法やブロス希釈法などの現在のゴールドスタンダード法では、通常、臨床サンプルのプレインキュベーション手順に少なくとも24時間、最小阻害濃度(MIC)結果を得るにはさらに16〜24時間かかります。全体として、これらの方法は時間がかかりすぎて、診療所での感染症治療の即時決定を導くことができず、抗菌薬耐性の出現と拡大につながります4。
迅速な検出のために、ポリメラーゼ連鎖反応(PCR)ベースの技術5などの遺伝子型AST法が開発されています。このような技術は、迅速なAST結果を提供するために、特異的耐性遺伝子配列を測定する。それらは時間のかかる細胞培養に依存しません。ただし、耐性のある特定の既知の遺伝子配列のみがテストされます。したがって、その適用は、さまざまな細菌種またはさまざまな耐性メカニズムに限定されています。また、治療決定のためのMIC結果を提供することはできません6,7。さらに、これらの制限を克服するために、迅速なASTのための新しい表現型法が開発中であり、マイクロ流体デバイス9、10、11、12、13、光学デバイス14、15、16、核酸コピー数17、18、およびラマン分光法19を含む表現型ASTが含まれ、20、21、22、23、24。これらの方法はAST結果を導く時間を短縮しますが、それらのほとんどは細菌分離株にのみ適用でき、臨床検体に直接適用できず、それでも長時間のプレインキュベーションが必要です。
本研究では、SRSイメージングによる細胞代謝活性のモニタリングにより、尿中および全血中の細菌の感受性を迅速に決定する方法を提示します。水(H2O)は、生細胞における必須の生体分子合成プロセスの大部分に関与しています。水の同位体として、NADPHの酸化還元活性水素原子とD2OのD原子との間の酵素触媒H/D交換反応により、重水素を細胞内のバイオマスに取り込むことができる25,26。重水素化脂肪酸合成反応は、重水素標識NADPHによって媒介される。アミノ酸(AAs)の反応へのD2Oの取り込みは、重水素化タンパク質産生をもたらす26(図1)。このようにして、単一の微生物細胞内で新たに合成されたC−D結合含有生体分子は、検出される一般的な代謝活性マーカーとして採用することができる。de novo合成C-D結合を読み取るために、生体分子の特異的で定量的な化学情報を提供する汎用性の高い分析ツールであるラマン分光法は、抗菌剤感受性を決定し、テスト時間を数時間に大幅に短縮するために広く使用されています27,28,29,30.しかしながら、ラマン散乱プロセスの本質的に低い効率のために、自発ラマン分光法は低い検出感度を有する。そのため、自発ラマン分光法を用いてリアルタイムの画像結果を得ることは困難です。コヒーレント反ストークスラマン散乱(CARS)や誘導ラマン散乱(SRS)を含むコヒーレントラマン散乱(CRS)は、自発ラマン分光法よりも桁違いに大きな大きさを生成するコヒーレント光場により、高い検出感度に達し、単一細胞レベルで高速、特異的、定量的な化学イメージングを実現します31,32,33,34,35、36,37,38,39。
ここでは、我々の最新の研究40に基づいて、単一細胞レベルでの正常培地、尿、および全血環境における細菌のD2O取り込みのフェムト秒SRS C−Dイメージングによる代謝活性および抗菌感受性の迅速な決定のためのプロトコルを提示する。フェムト秒SRSイメージングは、2.5時間以内の単一細菌レベルでの抗生物質に対する単一細胞代謝不活化濃度(SC-MIC)のモニタリングを容易にします。SC-MICの結果は、ブロス微量希釈による標準的なMICテストによって検証されます。私たちの方法は、細菌尿路感染症(UTI)および血流感染(BSI)病原体の抗菌薬感受性を決定するために適用可能であり、従来の方法と比較してアッセイ時間が大幅に短縮され、単一細胞レベルでの臨床での迅速な表現型ASTの機会を開きます。
プロトコル
ヒト血液検体の使用は、ボストン大学のIRBおよび国立衛生研究所(NIH)のガイドラインに準拠しています。具体的には、標本は銀行からのものであり、完全に非識別化されています。これらの標本は、ボストン大学の治験審査委員会(IRB)のオフィスではヒトの被験者とは見なされていません。
1.細菌および抗生物質原液の調製
- 抗生物質(硫酸ゲンタマイシンまたはアモキシシリン)ストック溶液を1 mg/mLの濃度で調製し、1.5 mLマイクロチューブ中の滅菌1xリン酸緩衝生理食塩水(PBS)またはジメチルスルホキシド(DMSO)溶媒に溶解します。硫酸ゲンタマイシンを滅菌PBS溶液に溶解し、アモキシシリンを滅菌DMSO溶媒に溶解します。その後、抗生物質溶液を示唆するように2〜8°Cで保存する。
- D2O含有カチオン調整ミューラーヒントンブロス(MHB)培地を作るには、220mgのMHBブロスベースを10mLのD2Oに加え、100%D2O含有培地を作る。200 nmの孔径のフィルターでろ過して溶液を滅菌します。
注:このプロトコルは、以降のステップで培地溶液の製造と滅菌に常に使用してください。 - SRSイメージング用の細菌サンプルを調製するには、重水素を含まない通常のMHB培地2 mLを滅菌丸底培養チューブに加え、37°Cで予熱します。
- 滅菌ループを使用して、トリプシン大豆寒天プレート上の新鮮な培養物から1つの細菌(大腸菌 BW 25113または 緑膿菌 ATCC 47085)コロニーを選択します。次に、それを予熱した培地に懸濁し、穏やかにボルテックスして細菌懸濁液を調製します。
- 細菌を対数相に達するまで、毎分200回転(rpm)のシェーカーで37°Cでインキュベートします。
2.抗生物質の存在下でのD2O取り込み治療(図2a)
- 波長600nmの光度計で光学濃度(OD)を測定して細菌濃度を確認します。
- 重水素を含まない通常のMHB培地を使用して細菌溶液を希釈し、最終細胞濃度8 x 105 CFU / mLに到達します。穏やかに渦を流して細菌細胞を混合します。
- 7本の1.5 mLマイクロチューブに300 μLの細菌溶液を調製し、1本の1.5 mLマイクロチューブに600 μLの細菌溶液を調製します。
- 抗生物質(ゲンタマイシンまたはアモキシシリン)ストック溶液(1 mg/mL)を600 μLの細菌溶液を含むマイクロチューブに4.8 μL加え、抗生物質の最終濃度を8 μg/mLにします。
- 抗生物質含有細菌溶液8 μg/mLから300 μLの溶液を取り出し、さらに300 μLの細菌溶液に加えて、2倍希釈した抗生物質(4 μg/mL)含有細菌溶液を作ります。
- 試験抗生物質、ゲンタマイシン、またはアモキシシリンの2倍の段階希釈を、最低濃度(0.25 μg/mL)のマイクロチューブに達するまで繰り返し、チューブから300 μLを廃棄します。ゲンタマイシンとアモキシシリンの両方について、連続濃度は0.25μg/ mL〜8μg/ mLの範囲です。
- ブランクコントロールのために抗生物質を含まない1本のチューブを残します。これは、抗生物質治療なしでD2O治療で細菌代謝活性を検査するためのポジティブコントロールになります。
- ネガティブコントロールのために、抗生物質とD2Oを含まないチューブを1本残します。
- 細菌アリコートを特定の抗生物質(ゲンタマイシンまたはアモキシシリン)含有MHB培地と1時間インキュベートします。
- インキュベーション中に、ステップ2.6で調製した抗生物質と同じ濃度勾配を有する100%D2O含有培地で抗生物質の段階希釈を調製する。ゲンタマイシンとアモキシシリンの両方について、連続濃度は0.25μg/ mL〜8μg/ mLの範囲です。
- 1時間の抗生物質処理後、700μLの段階希釈抗生物質および100%D2O含有MHB培地を、それぞれ同じ抗生物質濃度(ステップ2.6で調製)の抗生物質前処理細菌300μLに加える。
- 例えば、抗生物質前処理細菌300 μLに700 μLの100%D2O含有MHB培地(抗生物質8 μg/mLを含む)を追加します。同様にして、次の濃度の対応するチューブに移し、数回上下にピペッティングしてホモジナイズする。
- ブランクコントロールとして、抗生物質を含まない100%D2O含有MHB培地700 μLを抗生物質を含まない細菌300 μL(ステップ2.6.1で調製)に追加します。
- インキュベーションシェーカーで37°C、200rpmでさらに30分間インキュベートします。
注:このステップでは、試験用培地中のD2Oの最終濃度は70%です。
- まず、抗生物質1 mLおよびD2O処理細菌サンプルを6200 x g で4°Cで5分間遠心分離し、次に精製水で2回洗浄します。最後に、サンプルを10%ホルマリン溶液に固定し、4°Cで保存します。
3.尿環境における細菌の調製(図2b)
- 対数段階で 大腸菌 BW 25113を調製するには、1.4および1.5の手順に従います。
- 波長600nmの光度計でODを測定して細菌濃度を確認します。
- 臨床UTIサンプル14、18、41を模倣するには、 大腸菌 溶液を10 mLの非同定尿にスパイクして、最終細胞濃度106 CFU / mLに到達します。
- 5 μmフィルターを使用して 大腸菌 添加尿をろ過し、300 μLアリコートの細菌溶液を7つの1.5 mLマイクロチューブに分割し、600 μLの細菌溶液を1つの1.5 mLマイクロチューブに分割します。
- 抗生物質の存在下でD2O取り込み処理を行い、2.4から2.10までの前の工程で説明したようにサンプル収集を行う。
4.血液環境中の細菌の調製(図2c)
- 緑 膿 菌ATCC 47085を対数相で調製するには、1.4および1.5の手順に従います。
- 臨床血流感染サンプル42,43を模倣するために、1mLの非同定ヒト血液中の緑膿菌をスパイクして、107 CFU / mLの濃度に達する。
- 9mLの滅菌精製水を加えて血液を溶解します。
- 緑 膿 菌のスパイク血液を5μmのフィルターでろ過します。その後、6200 x g で4°Cで5分間遠心分離することにより、細菌を1 mL容量に回収します。 9 mLの予熱した通常のMHBをバクテリア溶液に加え、穏やかにボルテックスします。細菌の最終濃度は106 CFU / mLです
- 緑 膿 菌を添加した血液溶液を300 μLアリコートで7本の1.5 mLマイクロチューブに分割し、600 μLの細菌溶液を1本の1.5 mLマイクロチューブに分割します。
- 抗生物質の存在下でD2O取り込み処理を行い、2.4から2.10までの前の工程で説明したようにサンプル収集を行う。
5. 単一細菌におけるD2O代謝取り込みのSRSイメージング
- 固定菌液1 mLを精製水で洗浄し、6200 x g で4°Cで5分間遠心分離します。 上清を取り除きます。細菌溶液を約20μLに濃縮する。
- ポリL-リジンコーティングされたカバーグラスに細菌溶液を堆積させます。SRSイメージング用のサンプルをサンドイッチして密封します。
- SRS顕微鏡を用いて2168cm-1のC-D 振動周波数で細菌を画像化。
- コンピュータの制御ソフトウェアを使用して、ポンプ波長を852nmに入力および調整します。
- パワーメーターを使用してレーザー出力を測定します。レーザー出力の前の半波長板を調整して、サンプルのポンプレーザーの出力を~8 mWに、サンプルのストークスレーザーの出力を~40 mWに設定します。
注:SRS顕微鏡では、繰り返し周波数が80MHzの調整可能なフェムト秒レーザーがポンプ(680〜1300 nm)とストークス(1045 nm)励起レーザーを提供します。
- 反射ミラーのネジを調整することにより、ポンプとストークスビームを空間的に位置合わせし、2つのビームをレーザースキャン用の2Dガルボミラーシステムを備えた直立顕微鏡に向けます。
- 60倍の水浸対物レンズを使用して、ポンプとストークスレーザーをサンプルに集中させます。
- オイルコンデンサーを使用して、サンプルから順方向に信号を収集します。
- バンドパスフィルターを使用して、ストークスレーザーをフォトダイオードに向ける前にフィルターで除去します。
- ロックインアンプで誘導ラマン信号を抽出し、フォトダイオードで信号を検出します。
- ソフトウェアのコントロールパネルで、各SRS画像に200 x 200ピクセルと30μsのピクセル滞留時間を設定します。1枚の画像の合計取得時間は~1.2秒です。ステップサイズを150nmに設定し、画像サイズを約30×30μm2にします。各サンプルについて少なくとも 3 つの視野を画像化する。
6. 画像処理とデータ解析(図3)
- 平均C-D信号強度を得るには、ImageJソフトウェアでSRS画像を開いて処理します。
- まず、SRS画像を画像|をクリックして、色が反転した8ビットタイプの画像に変換します タイプ|8 ビット、次に 編集| ImageJソフトウェアのボタンを反転します。
- 次に、[プロセス]をクリックしてガウスぼかしで画像をフィルタリング します|フィルター|ガウスぼ かしボタンを選択し、 シグマ(半径) を1に設定します。
- 画像のしきい値調整を使用して、細菌領域を選択します。[ 画像|]|を調整する 選択した細菌のサイズが元のSRS画像のものと一致することを確認するためのしきい値。サイズのしきい値を調整して粒子を決定し、小さな粒子を排除します。[ 適用] をクリックします。
- 分析|の適用粒子分析ボタンを使用して、細菌の領域にラベルを付けて決定します。
- ROIマネージャーの[すべて表示]ボタンをクリックして、元の未処理のSRS画像にラベルを付け、同じ領域の細菌にラベルを付け、ROIマネージャーの[測定]ボタンをクリックして各データポイントの平均強度を決定します。
- 元のSRS画像の背景領域を丸で囲み、背景の平均強度を測定します。各細菌の平均C−D強度は、バックグラウンドシグナル強度を差し引くことによって得られる。
7. SC-MICによる抗菌薬感受性の定量
注:SC-MICを決定するための0.60のカットオフ値は、さまざまな濃度の薬物曝露時の細菌の代謝活性および代謝阻害条件のSRS C-D強度の統計分析に従って確立されます40。抗生物質感受性群と抗生物質耐性群のC-D強度は正規分布に適合した。
- レシーバの動作特性(ROC)曲線をプロットし、カットオフスレッショルドを0.60で評価します。このカットオフ値に基づいて、抗生物質の有効性の指標としてのSC−MICを定義して、代謝的に不活性および代謝的に活性な群を決定することができる。
- SRSイメージングデータを定量的に分析するために、連続希釈抗生物質濃度で処理した各細菌群のC−Dシグナル強度のヒストグラムをプロットします。色付きのデータポイントは、さまざまな個々の細菌を表します。
- 抗生物質治療群のC-D強度を、抗生物質治療なしの対照群の平均強度に正規化します。0.60のカットオフ値を使用して、C-D領域とさまざまな濃度の抗生物質でのSRSシグナル強度を定量することにより、さまざまな細菌と抗生物質の組み合わせのSC-MIC結果を決定します。
- SC-MICの読み出しを検証し、従来のブロス微量希釈アッセイを使用して測定したMICと比較します。
- 臨床検査基準研究所(CLSI)によると、テストされた各細菌株のSRS代謝イメージング結果に基づく感受性カテゴリは、「感受性」、「耐性」、または「中間」と解釈されます。
結果
重水素の取り込みに対するインキュベーション時間の影響は、C-D(2070〜2250 cm-1)およびC-H(2,800〜3,100 cm-1)領域での自発的ラマン顕微鏡法によって測定されます(図4a)。70%D2O含有培地で培養した緑膿菌のタイムラプス単一細胞ラマンスペクトルは、0〜180分のインキュベーション時間にわたってCD/CH強度の増加を示しています(図4b)。 単一微生物細胞におけるC-D存在量の増加は、D2Oが細胞内の重水素化生体分子に取り込まれることを明らかにしています。
50%を超えるD2O標識は、23時間のインキュベーション期間中の細菌代謝に有意に影響を及ぼす27。25時間のインキュベーション期間中にD2O標識濃度が70%を超えると細菌増殖阻害を観察した(図S1)。本発明者らは、ゴールドスタンダードブロス希釈によりMICを実施し、2つの緑膿菌株(緑膿菌ATCC 47085および緑膿菌1133)でSC-MIC結果を得た(表S1)。我々の現在の結果は、70%D2Oが緑膿菌における我々の方法の性能に影響を及ぼさないことを示している。表S1に示すように、当社のSC-MIC法と従来の培養法とのカテゴリー一致は、試験した緑膿菌と抗生物質の組み合わせすべてで100%です。この良好な一致は、SC-MIC測定における30分間のインキュベーション期間中の緑膿菌に対する70%D2Oの最小毒性に起因すると考えています。
プロトコルに従って、 緑膿 菌を段階希釈ゲンタマイシンで1時間インキュベートし、次に70%D2Oでさらに30分間インキュベートし、~2168 cm-1 (図5a)でのSRS代謝イメージングを実施しました。抗生物質治療時のC-D強度は、抗生物質治療なしの対照群の平均値で割ったものです。定量統計解析(図5b)では、 緑膿 菌のC-Dシグナルは、ゲンタマイシン処理なし(0 μg/mL)よりも2 μg/mL以上で有意に低いことが示されました。0.60のカットオフ閾値を使用して、 緑膿菌 は2 μg / mLおよび高濃度のゲンタマイシンで代謝的に阻害されました。.点線は、 図5bの0.60で定義されたカットオフ値を示しています。このようにして、正常MHB培地中のゲンタマイシンに対する 緑膿菌 のSC-MICは2 μg/mLと決定されました。このSC-MIC値は、ブロス微量希釈法で測定したMIC(4 μg/mL)との1倍の差範囲内にあることが確認されています(図5c)。まとめると、当社の技術によって決定されたSC-MICは、抗菌薬感受性の定量化を可能にします。
臨床応用、特に最も一般的なUTI感染症に対する重水素代謝取り込みのSRSイメージングによる迅速なASTの可能性を探るために、UTI感染を引き起こす最も一般的な病原体である 大腸菌を使用して細菌スパイク尿サンプルをテストしました44。関連する細菌濃度で臨床UTIサンプルを模倣するために、 大腸菌 を非識別尿に最終濃度106 CFU / mLまで添加します。試料精製後、尿試料をアモキシシリンおよびD2Oと共にインキュベートした。SRS画像のきれいな背景は、サンプル調製プロトコルが迅速なAST測定に適用可能であることを示しました(図5d)。アモキシシリンに対する 大腸菌添加尿サンプルのSC-MICは4 μg/mLと決定され(図5e)、これは通常のMHB培地中の純粋な 大腸菌 の従来のブロス希釈法によるMIC(8 μg/mL)と同じ感受性測定値を有する(図5f)。これらの結果は、重水素代謝取り込みのSRSイメージングによる迅速なASTが、UTI感染性病原体の臨床診断に大きな可能性を秘めていることを総合的に示した。
UTI感染と比較して、BSI病原体の迅速なASTは、多くの血球が血液中に存在するため、細菌代謝活性のその場研究にとってはるかに困難です。臨床BSIサンプルに対するD2O代謝取り込みのSRSイメージングによる迅速なASTの適用性を調べるために、非同定ヒト血液中にスパイクされた緑膿菌が検出された。図5gに示すように、2168cm-1におけるSRS画像のC-D強度は細菌シグナルによって支配されていた。赤血球はさらなる生合成のためにD2Oを取り込む代謝活性を有していないので、C−Dシグナルは生細菌の代謝重水素取り込みに由来する。破片または赤血球種の交差相変調または光熱信号は、SC-MICの定量分析に影響を与えることなく、弱いバックグラウンド信号に寄与しました。血中緑膿菌のSC-MIC結果は2 μg/mLと決定され(図5h)、正常増殖培地中の緑膿菌の従来の標準MIC結果とよく一致しました(図5i)。まとめると、これらの結果は、重水素代謝取り込みのSRS代謝イメージングが、BIS感染症における細菌のSC-MICを決定するための迅速なAST法になり得ることを示した。
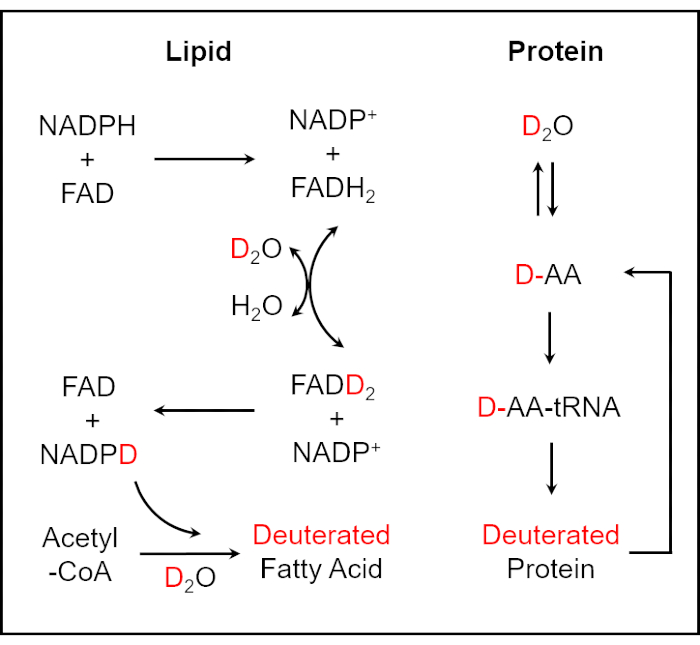
図1:重水素化脂質およびタンパク質へのD2Oの取り込みのためのスキーム25、26。 重水素は、NADPHの酸化還元活性水素原子とD2OのD原子との間の酵素触媒H/D交換反応を介して細胞内のバイオマスに組み込むことができ、重水素化脂肪酸合成反応は重水素標識NADPHによって媒介される。アミノ酸の反応へのD2Oの取り込みは、重水素化タンパク質産生をもたらす。この図は ref.40 から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。
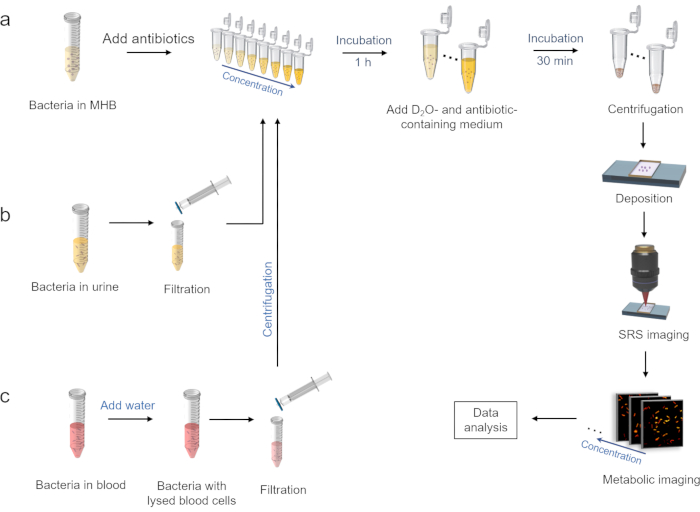
図2:重水素取り込みのSRS代謝イメージングによる迅速なASTのワークフロー。 (a)MHB培地に抗生物質の存在下でのD2O取り込み処理、および以下のSRSイメージング手順。(b)尿環境における細菌の調製。(c)血液環境中の細菌の調製。この図は ref.40 から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。
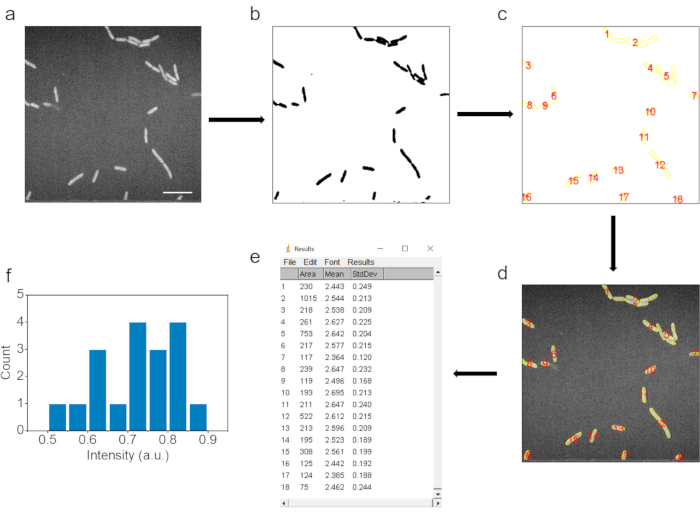
図 3.自動化された画像処理とデータ解釈。 (a) 生の SRS イメージ。(b)細菌細胞の面積を決定するための強度閾値調整後の画像。(c)粒子分析ステップ後に選択されたデータポイント。(d)対応するデータポイントが生の画像で選択されます。(e)生画像内の対応するデータポイントの結果。(f)バックグラウンドを差し引いた後のデータポイントの平均強度の統計結果。スケールバー:10μm。この図は ref.40 から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。

図 4.細菌への重水素取り込みに及ぼすインキュベーション時間の影響。(a)顕微自然ラマン分光法によるC-D(2070〜2250cm-1)およびC-H(2,800〜3,100cm-1)領域でのタイムラプス測定(20スペクトルから平均)。(b)(a)における細菌のD2Oインキュベーション時間にわたるCD/CH強度比プロットのヒストグラムプロット。各色付きのポイントは、単一の細菌からの測定値を表します。エラーバーは、平均(SEM)の標準誤差を表します。この図の拡大版を表示するには、ここをクリックしてください。

図 5.正常培地、尿および血液環境における抗生物質に対するD2Oの細菌代謝取り込みのSRSイメージングを用いたSC−MIC決定。(a)C-D振動(2168cm-1)でのSRSイメージングと、通常のMHB培地に段階希釈ゲンタマイシンを添加したD2Oの存在下での緑膿菌の対応する透過画像。(b)(a)における緑膿菌のSRS C-D強度の定量解析。ヒストグラムの色付きのデータ ポイントは、個々の細菌を表します。点線は0.60のカットオフ値を示す。(c)ブロス微量希釈法によるSC-MIC読み出しとMICの比較、およびCLSIによる緑膿菌の感受性カテゴリー。(d)C-D振動(2168cm-1)でのSRSイメージング、および段階希釈アモキシシリンとのD2O中でのインキュベーション後の尿中の大腸菌の対応する透過画像。(e)(d)におけるSRS C-D強度の定量分析。(f)正常なMHBおよび尿中の大腸菌のSC-MIC測定値と感受性カテゴリーの比較。(g)C-D振動(2168cm-1)でのSRSイメージング、および段階希釈ゲンタマイシンとのD2O中でのインキュベーション後の血液中の緑膿菌の対応する透過画像。(h)(g)におけるSRS C-D強度の定量分析。(i)正常MHBおよび血中の緑膿菌のSC-MIC測定値と感受性カテゴリーの比較。S:敏感。グループあたりのセル数はN≥10です。エラーバーはSEMを表します。 スケールバー:10μm。この図は ref.40 から変更されています。この図の拡大版を表示するには、ここをクリックしてください。
| 問題 | 考えられる理由 | 解決 |
| イメージング視野内の細菌細胞数がほとんどまたはまったくない | 溶液中の細菌密度が低すぎる | 細菌をさらに濃縮するために長時間遠心分離する |
| SRSイメージング中の細菌細胞の光損傷 | 使用するレーザー出力が高すぎる | レーザー出力を適切な値に調整します |
| SRS信号が検出されない | ポンプとストークスビームの空間的および時間的オーバーラップが最適化されていない | 標準サンプル重水素化ジメチルスルホキシドを使用してポンプとストークスビームの位置合わせ |
表1:トラブルシューティングの表。
図S1:異なるD2O濃度を有するラウリア・ベルタニ(LB)培地で培養した緑膿菌に対するD2O毒性の試験。エラーバーは標準偏差値を示します(測定数 = 5)。この図をダウンロードするには、ここをクリックしてください。
表 S1. 抗生物質投与時の緑膿菌の正常MHBにおけるSC-MICとMICの比較。S:敏感;R:耐性;I:中級です。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
迅速なASTは、サンプルからSC-MIC結果までの2.5時間以内のシングルセルSRS代謝イメージングを使用して、抗生物質治療に対する細菌代謝活性の応答を評価することによって得ることができます。細菌の代謝活性および抗菌感受性の応答は、C−D結合のSRSイメージングを用いて生体分子合成のためのD2Oの代謝取り込みをモニターすることによって検出することができる。水は生細胞に遍在しているため、SRS代謝イメージングは迅速なASTのための普遍的な方法を提供します。ラピッドAST法は、尿や全血などの複雑な生物学的環境にある細菌を単一の細菌レベルで検出するために適用できます。SC-MICは、尿および血液中の細菌の1.5時間培養後に決定することができ、UTIおよびBSI診断のパラダイムを時間のかかる培養依存の手順から培養に依存しない in situ アプローチにシフトするための変革的であると考えられています。したがって、従来のブロス微量希釈法と比較して診断時間が大幅に短縮され、臨床翻訳への道が開かれ、正確な治療のための適切な抗菌剤を時間通りに特定できるようになります。
ここで説明する抗生物質治療のプロトコルは、CLSIのガイドラインに従っており、提案されたMHB培地は、さまざまな微生物の培養に一般的に使用できます。重要なパラメータは、抗菌剤感受性試験に使用される細菌細胞数が、CLSIで推奨されているように約5 x 105 CFU / mLに保たれることです。これは、正確で再現性のある結果を得るために非常に重要です。抗生物質治療実験では、細菌濃度は8 x 105 CFU / mLに設定されています。細菌濃度が高いほど、MICの結果が増加する可能性があります。細菌懸濁液を調整したら、細菌細胞濃度の変化を避けるために30分以内に使用する必要があります。
ダプトマイシンなどの抗生物質の感受性試験では、培地中の50 mg / Lのカルシウムを補給することをお勧めします。カチオン調整MHB培地には、20〜25 mg / LのCa2+が含まれています。したがって、培地に30 mg/Lの濃度の追加のCa2+( 水に可溶化され、フィルター滅菌済み)がさらに補充されていることを確認してください。
提示された方法における別の重要なステップは、抗生物質曝露およびD2O取り込み時の細菌のインキュベーション時間である。細菌の生活環の発生時間は約30〜60分であるため、抗生物質を一定時間曝露すると細菌の代謝活動に影響を与えることが重要です。この試験は、0.5時間D2O処理の前の1時間の抗生物質曝露に対するさまざまな細菌と抗生物質の組み合わせについて評価されています。最初の1時間の抗生物質治療ステップは、細菌の代謝活性に影響を与えるために不可欠です。次に、細菌をD2O含有培地および抗生物質含有培地と共にさらに30分間インキュベートする。最終抗生物質濃度は同じレベルに維持され、D2Oの最終濃度は70%に調整される。全体として、抗生物質前培養の1時間後およびD2Oおよび抗生物質の取り込みの0.5時間後、SC−MIC結果は、次いで、細菌代謝活性のSRS代謝イメージングによって決定される。この設計は、細菌に対する抗菌活性のD2Oの影響を最小限に抑え、また、従来の方法によるMICsとのSC-MIC結果の同等の読み出しをもたらす。
SC-MIC測定では、5種類の抗生物質を含む40個のサンプルを並行して調製し、それぞれ8つの濃度を同時に調製します。ただし、手動操作手順が多いため、5つの異なる細菌と抗生物質の組み合わせのASTを検出するための合計アッセイ時間は2.5時間より長くなります。我々の方法では、~20個の個々の細菌細胞を含む各SRS画像は、30μsピクセルの滞留時間で1回のショットで~1.0秒以内に取得されました。1つの細菌株に対して10種類の抗生物質を研究するためのASTアッセイの合計時間は、サンプルからSC-MIC読み出しまで2.5時間未満であると推定されており、ハイスループット測定を実行する可能性が非常に高いです。今後の研究では、スループットをさらに向上させるために、自動サンプル調製およびイメージングデータ取得方法を採用する予定です。トラブルシューティングの詳細を 表 1 に示します。
従来の培養ベースのAST法では、さらなる測定のために細菌分離株を得るために、臨床検体を何時間もプレインキュベートする必要があります。ラマン分光法29、ナノリットルアレイ6、デジタル核酸定量18などの臨床UTIサンプル用の高度なASTメソッドは、長時間のプレインキュベーションを取り除くために開発されました。UTI感染と比較して、BSIまたは敗血症ははるかに生命を脅かす18,45であり、診療所での正確な診断には迅速なASTが緊急に必要です。陽性の血液培養から細菌コロニー形成を測定する顕微鏡イメージング法は、MIC結果を提供することが報告されています46。ただし、ASTアッセイを実施するために細菌を増殖させるには少なくとも6時間かかります。さらに、市販の自動システム47および質量分析48、49戦略は、陽性血液培養からのAST読み出しを提供することができる。ただし、臨床決定のMIC結果は提供できません。ASTの結果とMICの読み出しは、診療所で潜在的な副作用を引き起こす患者への抗生物質の過剰投与を回避し、抗菌剤耐性感染症の拡大を遅らせて防止するために重要です50,51。既存の自発的なラマン顕微鏡ベースのAST法と比較して、当社の技術は、桁違いの信号増強により、データ取得時間を大幅に短縮します(約600分の1)。本研究では、尿または全血環境における臨床的に関連する細菌濃度(105~106 CFU/ml)での単一細菌の重水素代謝のSRSイメージングによる迅速なASTを実証します。以前の結果に示されるように、MIC結果は、尿および血液中の細菌へのD2Oおよび抗生物質のインキュベーションの1時間および30分間の抗生物質処理後に決定される。私たちの方法は、2.5時間以内に各菌株と抗生物質の組み合わせのMICと感受性分類を提供できるため、臨床翻訳への新しい道が開かれます。要約すると、前培養や細菌分割を必要とせずに、私たちの方法は感染症における迅速かつハイスループットASTの分野で大きな可能性を秘めています。
SRSメタボリックイメージングによるSC-MIC法は、臨床使用のための豊富な種類の菌株と抗生物質の組み合わせを扱う際に、MICの検出と感染性病原体の感受性分類に適用できます。SC-MICは、尿および血液中の細菌へのD2O取り込みの30分後に測定され、これは、プレインキュベーションに16〜24時間かかる従来のブロス希釈法と比較して、診断時間の大幅な短縮を意味します。臨床的意思決定のための病原体同定情報を提供するために、SRS代謝イメージング技術は、マトリックス支援レーザー脱離イオン化飛行時間型質量分析49、52、53などの迅速な病原体同定が可能な診断プラットフォームとさらに統合することができる。in situ病原体の同定と迅速なAST診断を組み合わせることで、正確な治療のための適切な抗菌剤を時間通りに特定できるクリニックへの翻訳に大きな可能性があります。
開示事項
著者は開示する利益相反を持っていません。
謝辞
この作業は、NIH R01AI141439からJ.-X.CおよびM.S、およびR35GM136223からJ.-X.C.のサポートを受けました。
資料
| Name | Company | Catalog Number | Comments |
| Acousto-optic modulation | Gooch&Housego | R15180-1.06-LTD | Modulating stokes laser beam |
| Amoxicillin | Sigma Aldrich | A8523-5G | |
| Bandpass filter | Chroma | HQ825/150m | Block the stokes laser beam before the photodiode |
| Calcium chloride | Sigma Aldrich | C1016-100G | Cation adjustment |
| Cation-adjusted Mueller-Hinton Broth | Fisher Scientific | B12322 | Antimicrobial susceptibility testing of microorganisms by broth dilution methods |
| Centrifuge | Thermo Scientific | 75002542 | |
| Cover Glasses | VWR | 16004-318 | |
| Culture tube with snap cap | Fisher brand | 149569B | |
| Daptomycin | Acros | A0386346 | |
| Deuterium oxide | 151882 | Organic solvent to dissolve antibiotics | |
| Deuterium oxide-d6 | Sigma Aldrich | 156914 | Organic solvent as a standard to calibrate SRS imaging system |
| Escherichia coli BW 25113 | The Coli Genetic Stock Center | 7636 | |
| Eppendorf polypropylene microcentrifuge tubes 1.5 mL | Fisher brand | 05-408-129 | |
| Gentamicin sulfate | Sigma Aldrich | G4918 | |
| Hydrophilic Polyvinylidene Fluoride filters | Millipore-Sigma | SLSV025NB | pore size 5 µm |
| ImageJ software | NIH | Version: 2.0.0-rc-69/1.52t | Image processing and analysis |
| Incubating orbital shaker set at 37 °C | VWR | 97009-890 | |
| Inoculation loop | Sigma | BR452201-1000EA | |
| InSight DeepSee femtosecond pulsed laser | Spectra-Physics | Model: insight X3 | Tunable laser source and fixed laser source at 1045 nm for SRS imaging |
| Lock-in amplifier | Zurich Instrument | HF2LI | Demodulate the SRS signals |
| Oil condenser | Olympus | U-AAC | NA 1.4 |
| Pseudomonas aeruginosa ATCC 47085 (PAO1) | American Type Culture Collection | ATCC 47085 | |
| Photodiode | Hamamatsu | S3994-01 | Detector |
| Polypropylene conical tube 15 mL | Falcon | 14-959-53A | |
| Polypropylene filters | Thermo Scientific | 726-2520 | pore size 0.2 µm |
| Sterile petri dishes | Corning | 07-202-031 | |
| Syringe 10 mL | Fisher brand | 14955459 | |
| UV/Vis Spectrophotometer | Beckman Coulter | Model: DU 530 | Measuring optical density at wavelength of 600 nm |
| Vortex mixer | VWR | 97043-562 | |
| Water objective | Olympus | UPLANAPO/IR | 60×, NA 1.2 |
参考文献
- O'Neill, J. Tackling drug-resistant infections globally: final report and recommendations. The review on Antimicrobial Resistance. , (2016).
- Sugden, R., Kelly, R., Davies, S. Combatting antimicrobial resistance globally. Nature Microbiology. 1 (10), 16187 (2016).
- Kumar, A., et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Critical Care Medicine. 34 (6), 1589-1596 (2006).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: a review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Frickmann, H., Masanta, W. O., Zautner, A. E. Emerging rapid resistance testing methods for clinical microbiology laboratories and their potential impact on patient management. BioMed Research International. 2014, 375681 (2014).
- Avesar, J., et al. Rapid phenotypic antimicrobial susceptibility testing using nanoliter arrays. Proceedings of the National Academy of Sciences. 114 (29), 5787-5795 (2017).
- Schoepp, N. G., et al. Digital quantification of DNA replication and chromosome segregation enables determination of antimicrobial susceptibility after only 15 minutes of antibiotic exposure. Angewandte Chemie International Edition. 55 (33), 9557-9561 (2016).
- van Belkum, A., et al. Innovative and rapid antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 18 (5), 299-311 (2020).
- Hou, Z., An, Y., Hjort, K., Sandegren, L., Wu, Z. Time lapse investigation of antibiotic susceptibility using a microfluidic linear gradient 3D culture device. Lab on a Chip. 14 (17), 3409-3418 (2014).
- Choi, J., et al. Rapid antibiotic susceptibility testing by tracking single cell growth in a microfluidic agarose channel system. Lab on a Chip. 13 (2), 280-287 (2013).
- Lu, Y., et al. Single cell antimicrobial susceptibility testing by confined microchannels and electrokinetic loading. Analytical Chemistry. 85 (8), 3971-3976 (2013).
- Kim, S. C., Cestellosblanco, S., Inoue, K., Zare, R. N. Miniaturized antimicrobial susceptibility test by combining concentration gradient generation and rapid cell culturing. Antibiotics. 4 (4), 455-466 (2015).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Baltekin, &. #. 2. 1. 4. ;., Boucharin, A., Tano, E., Andersson, D. I., Elf, J. Antibiotic susceptibility testing in less than 30 min using direct single-cell imaging. Proceedings of the National Academy of Sciences. 114 (34), 9170-9175 (2017).
- Fredborg, M., et al. Real-time optical antimicrobial susceptibility testing. Journal of Clinical Microbiology. 51 (7), 2047-2053 (2013).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Barczak, A. K., Hung, D. T. RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities. Proceedings of the National Academy of Sciences. 109 (16), 6217-6222 (2012).
- Schoepp, N. G., et al. Rapid pathogen-specific phenotypic antibiotic susceptibility testing using digital LAMP quantification in clinical samples. Science Translational Medicine. 9 (410), (2017).
- Novelli-Rousseau, A., et al. Culture-free antibiotic-susceptibility determination from single-bacterium Raman spectra. Scientific Reports. 8 (1), 1-12 (2018).
- Schröder, U. -. C., et al. Detection of vancomycin resistances in enterococci within 3 1/2 hours. Scientific Reports. 5, 8217 (2015).
- Liu, C. -. Y., et al. Rapid bacterial antibiotic susceptibility test based on simple surface-enhanced Raman spectroscopic biomarkers. Scientific Reports. 6 (1), 1-15 (2016).
- Chang, K. -. W., et al. Antibiotic susceptibility test with surface-enhanced raman scattering in a microfluidic system. Analytical Chemistry. 91 (17), 10988-10995 (2019).
- Galvan, D. D., Yu, Q. surface-enhanced raman scattering for rapid detection and characterization of antibiotic-resistant bacteria. Advanced Healthcare Materials. 7 (13), 1701335 (2018).
- Kirchhoff, J., et al. Simple ciprofloxacin resistance test and determination of minimal inhibitory concentration within 2 h using raman spectroscopy. Analytical Chemistry. 90 (3), 1811-1818 (2018).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Berry, D., et al. Tracking heavy water (D2O) incorporation for identifying and sorting active microbial cells. Proceedings of the National Academy of Sciences. 112 (2), 194-203 (2015).
- Tao, Y., et al. Metabolic-activity-based assessment of antimicrobial effects by D2O-labeled single-cell raman microspectroscopy. Analytical Chemistry. 89 (7), 4108-4115 (2017).
- Yang, K., et al. Rapid antibiotic susceptibility testing of pathogenic bacteria using heavy water-labeled single-cell raman spectroscopy in clinical samples. Analytical Chemistry. 91 (9), 6296-6303 (2019).
- Song, Y., et al. Raman-Deuterium Isotope Probing for in-situ identification of antimicrobial resistant bacteria in Thames River. Scientific reports. 7 (1), 16648 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Cheng, J. -. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17, 415-445 (2015).
- Yue, S., Cheng, J. -. X. Deciphering single cell metabolism by coherent Raman scattering microscopy. Current Opinion in Chemical Biology. 33, 46-57 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, Label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- He, R., Liu, Z., Xu, Y., Huang, W., Ma, H., Ji, M. Stimulated Raman scattering microscopy and spectroscopy with a rapid scanning optical delay line. Optics Letters. 42 (4), 659-662 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences. 116 (32), 15842-15848 (2019).
- Camp, C. H., et al. High-Speed Coherent Raman Fingerprint Imaging of Biological Tissues. Nature Photonics. 8, 627-634 (2014).
- Zhang, M., et al. Rapid determination of antimicrobial susceptibility by stimulated raman scattering imaging of D2O metabolic incorporation in a single bacterium. Advanced Science. 7 (19), 2001452 (2020).
- Michael, I., et al. A fidget spinner for the point-of-care diagnosis of urinary tract infection. Nature Biomedical Engineering. 4 (6), 591-600 (2020).
- Bhattacharyya, R. P., et al. Simultaneous detection of genotype and phenotype enables rapid and accurate antibiotic susceptibility determination. Nature Medicine. 25 (12), 1858-1864 (2019).
- Stupar, P., et al. Nanomechanical sensor applied to blood culture pellets: a fast approach to determine the antibiotic susceptibility against agents of bloodstream infections. Clinical Microbiology and Infection. 23 (6), 400-405 (2017).
- Barber, A. E., Norton, J. P., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Cohen, J., et al. Sepsis: a roadmap for future research. The Lancet Infectious Diseases. 15 (5), 581-614 (2015).
- Choi, J., et al. rapid antimicrobial susceptibility test from positive blood cultures based on microscopic imaging analysis. Scientific Reports. 7 (1), 1148 (2017).
- Gherardi, G., et al. Comparative evaluation of the Vitek-2 Compact and Phoenix systems for rapid identification and antibiotic susceptibility testing directly from blood cultures of Gram-negative and Gram-positive isolates. Diagnostic Microbiology and Infectious Disease. 72 (1), 20-31 (2012).
- Machen, A., Drake, T., Wang, Y. F. Same day identification and full panel antimicrobial susceptibility testing of bacteria from positive blood culture bottles made possible by a combined lysis-filtration method with MALDI-TOF VITEK mass spectrometry and the VITEK2 system. Plos One. 9, 87870 (2014).
- Simon, L., et al. Direct identification of 80 percent of bacteria from blood culture bottles by matrix-assisted laser desorption ionization-time of flight mass spectrometry using a 10-minute extraction protocol. Journal of Clinical Microbiology. 57 (2), 01278 (2019).
- Leekha, S., Terrell, C. L., Edson, R. S. General principles of antimicrobial therapy. Mayo Clinic Proceedings. 86 (2), 156-167 (2011).
- Johnson, L., et al. Emergence of fluoroquinolone resistance in outpatient urinary Escherichia coli isolates. The American Journal of Medicine. 121 (10), 876-884 (2008).
- Van Belkum, A., et al. Developmental roadmap for antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 17 (1), 51-62 (2019).
- Dubourg, G., Lamy, B., Ruimy, R. Rapid phenotypic methods to improve the diagnosis of bacterial bloodstream infections: meeting the challenge to reduce the time to result. Clinical Microbiology and Infection. 24 (9), 935-943 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved