Method Article
اختبار الحساسية السريع لمضادات الميكروبات عن طريق التصوير المحفز لنثر رامان لدمج الديوتيريوم في بكتيريا واحدة
In This Article
Summary
يقدم هذا البروتوكول اختبار الحساسية السريع لمضادات الميكروبات (AST) في غضون 2.5 ساعة عن طريق تصوير تشتت رامان المحفز بخلية واحدة لعملية التمثيل الغذائي D2O. تنطبق هذه الطريقة على البكتيريا الموجودة في البول أو بيئة الدم الكاملة ، والتي تعد تحويلية للنمط الظاهري السريع أحادي الخلية AST في العيادة.
Abstract
لإبطاء ومنع انتشار العدوى المقاومة لمضادات الميكروبات ، هناك حاجة ماسة إلى اختبار الحساسية السريع لمضادات الميكروبات (AST) لتحديد التأثيرات المضادة للميكروبات على مسببات الأمراض كميا. عادة ما يستغرق الأمر أياما لإكمال AST بالطرق التقليدية القائمة على الثقافة طويلة الأمد ، ولا تعمل مباشرة للعينات السريرية. هنا ، نبلغ عن طريقة AST سريعة تم تمكينها عن طريق التصوير المحفز لتشتت رامان (SRS) لدمج التمثيل الغذائي لأكسيد الديوتيريوم (D2O). تتم مراقبة الدمج الأيضي ل D2O في الكتلة الحيوية وتثبيط النشاط الأيضي عند التعرض للمضادات الحيوية على مستوى البكتيريا المفردة بواسطة تصوير SRS. يمكن الحصول على تركيز تعطيل التمثيل الغذائي أحادي الخلية (SC-MIC) للبكتيريا عند التعرض للمضادات الحيوية بعد ما مجموعه 2.5 ساعة من تحضير العينة واكتشافها. علاوة على ذلك ، فإن طريقة AST السريعة هذه قابلة للتطبيق مباشرة على العينات البكتيرية في البيئات البيولوجية المعقدة ، مثل البول أو الدم الكامل. يعد التصوير الأيضي SRS لدمج الديوتيريوم تحويليا للنمط الظاهري السريع أحادي الخلية AST في العيادة.
Introduction
تشكل مقاومة مضادات الميكروبات تهديدا عالميا متزايدا للعلاج الفعال للأمراض المعدية1. من المتوقع أن تتسبب مقاومة مضادات الميكروبات في 10 ملايين حالة وفاة إضافية سنويا وخسارة 100 تريليون دولار في الناتج المحلي الإجمالي العالمي بحلول عام 2050 إذا لم يتم اتخاذ أي إجراء لمكافحة البكتيريا المقاومة للمضادات الحيوية 1,2. وهذا يؤكد الحاجة الملحة لطرق تشخيص سريعة ومبتكرة لاختبار حساسية البكتيريا المعدية للمضادات الحيوية (AST) لإبطاء ظهور البكتيريا المقاومة للمضادات الحيوية وتقليل معدل الوفيات ذات الصلة3. لضمان أفضل نتيجة سريرية ممكنة ، من الضروري إدخال علاج فعال في غضون 24 ساعة. ومع ذلك ، فإن الطريقة القياسية الذهبية الحالية ، مثل طريقة نشر القرص أو طريقة تخفيف المرق ، تتطلب عادة 24 ساعة على الأقل لإجراء الحضانة المسبقة للعينات السريرية و 16-24 ساعة إضافية للحصول على الحد الأدنى من نتائج التركيز المثبط (MIC). بشكل عام ، تستغرق هذه الطرق وقتا طويلا للغاية بحيث لا يمكن توجيه قرار فوري لعلاج الأمراض المعدية في العيادة ، مما يؤدي إلى ظهور وانتشار مقاومة مضادات الميكروبات4.
تم تطوير طرق AST للنمط الجيني ، مثل التقنيات القائمة على تفاعل البوليميراز المتسلسل (PCR)5 ، للكشف السريع. تقيس هذه التقنيات التسلسلات الجينية للمقاومة المحددة من أجل توفير نتائج AST سريعة. أنها لا تعتمد على ثقافة الخلايا التي تستغرق وقتا طويلا. ومع ذلك ، يتم اختبار التسلسلات الجينية المعروفة فقط مع المقاومة. لذلك ، يقتصر تطبيقه على الأنواع البكتيرية المختلفة أو آليات المقاومة المختلفة. أيضا ، لا يمكنهم تقديم نتائج MIC لقرارات العلاج 6,7. إلى جانب ذلك ، يتم تطوير طرق النمط الظاهري الجديدة ل AST السريع للتغلب على هذه القيود8 ، بما في ذلك أجهزة الموائع الدقيقة9،10،11،12،13 ، والأجهزة البصرية 14،15،16 ، AST المظهري الذي يحدد كمية نسخة الأحماض النوويةرقم 17،18 ، وطرق رامان الطيفية 19 ، 20،21،22،23،24. تقلل هذه الطرق من الوقت اللازم لتوجيه نتائج AST ، ومع ذلك ، فإن معظمها ينطبق فقط على العزلات البكتيرية ، وليس مباشرة على العينات السريرية ، ولا يزال يتطلب حضانة طويلة الأمد.
في هذا العمل ، نقدم طريقة لتحديد سريع لحساسية البكتيريا في البول والدم الكامل من خلال مراقبة النشاط الأيضي الخلوي عن طريق التصوير SRS. يشارك الماء (H2O) في الغالبية العظمى من عمليات التوليف الجزيئي الحيوي الأساسية في الخلايا الحية. كإيزوتوبولوج للماء ، من خلال تفاعل التبادل H / D المحفز بالإنزيم بين ذرة الهيدروجين النشطة للأكسدة والاختزال في NADPH والذرة D في D2O ، يمكن دمج الديوتيريوم في الكتلة الحيوية داخل الخلية25,26. يتم التوسط في تفاعل تخليق الأحماض الدهنية المديوتيريوم المسمى NADPH. ينتج عن دمج D2O في تفاعلات الأحماض الأمينية (AAs) إنتاج البروتين المثبط26 (الشكل 1). وبهذه الطريقة ، يمكن استخدام الجزيئات الحيوية المحتوية على رابطة C-D المركبة حديثا في الخلايا الميكروبية المفردة كعلامة عامة للنشاط الأيضي ليتم اكتشافها. لقراءة روابط C-D المركبة من جديد ، يستخدم التحليل الطيفي Raman ، وهو أداة تحليلية متعددة الاستخدامات توفر معلومات كيميائية محددة وكمية للجزيئات الحيوية ، على نطاق واسع لتحديد الحساسية لمضادات الميكروبات وتقليل وقت الاختبار بشكل كبير إلى بضع ساعات27،28،29،30 . ومع ذلك ، نظرا للكفاءة المنخفضة المتأصلة في عملية تشتت رامان ، فإن التحليل الطيفي التلقائي لرامان ذو حساسية كشف منخفضة. لذلك ، من الصعب الحصول على نتائج الصور في الوقت الفعلي باستخدام التحليل الطيفي التلقائي لرامان. وصل تشتت رامان المتماسك (CRS) ، بما في ذلك تشتت رامان المتماسك المضاد لستوكس (CARS) وتشتت رامان المحفز (SRS) ، إلى حساسية عالية للكشف بسبب مجال الضوء المتماسك لتوليد أوامر بحجم أكبر من مطيافية رامان التلقائية ، وبالتالي تقديم تصوير كيميائي عالي السرعة ومحدد وكمي على مستوى الخلية الواحدة31،32،33،34،35 ، 36،37،38،39.
هنا ، بناء على أحدث أعمالنا40 ، نقدم بروتوكولا للتحديد السريع للنشاط الأيضي والحساسية لمضادات الميكروبات عن طريق تصوير الفيمتو ثانية SRS C-D لدمج D2O للبكتيريا في الوسط الطبيعي والبول وبيئة الدم الكاملة على مستوى الخلية الواحدة. يسهل تصوير الفيمتو ثانية SRS مراقبة تركيز تعطيل التمثيل الغذائي للخلية الواحدة (SC-MIC) ضد المضادات الحيوية على مستوى البكتيريا المفردة في غضون 2.5 ساعة. يتم التحقق من صحة نتائج SC-MIC عن طريق اختبار MIC القياسي عن طريق التخفيف الدقيق للمرق. طريقتنا قابلة للتطبيق لتحديد حساسية مضادات الميكروبات للبكتيريا عدوى المسالك البولية (UTI) ومسببات عدوى مجرى الدم (BSI) مع وقت فحص أقل بكثير مقارنة بالطريقة التقليدية ، مما يفتح الفرصة ل AST النمط الظاهري السريع في العيادة على مستوى الخلية الواحدة.
Protocol
يتوافق استخدام عينات الدم البشري مع إرشادات IRB بجامعة بوسطن والمعاهد الوطنية للصحة (NIH). على وجه التحديد ، العينات من بنك وتم تحديد هويتها بالكامل. لا تعتبر هذه العينات موضوعات بشرية من قبل مكتب مجلس المراجعة المؤسسية (IRB) في جامعة بوسطن.
1. تحضير محلول مخزون البكتيريا والمضادات الحيوية
- تحضير محلول مخزون المضادات الحيوية (كبريتات الجنتاميسين أو الأموكسيسيلين) بتركيز 1 مجم / مل مذاب في محلول ملحي معقم 1x مخزن بالفوسفات (PBS) أو مذيب ثنائي ميثيل سلفوكسيد (DMSO) في أنابيب صغيرة سعة 1.5 مل. قم بإذابة كبريتات الجنتاميسين في محلول PBS المعقم والأموكسيسيلين في مذيب DMSO المعقم. بعد ذلك ، قم بتخزين محلول المضادات الحيوية في درجة حرارة 2-8 درجة مئوية كما هو مقترح.
- لجعل D 2O يحتوي على وسائط مرق مولر-هينتون (MHB) المعدلة حسب الكاتيون ، أضف 220 مجم من قاعدة مرق MHB إلى 10 مل من D 2 O لجعل 100٪ D2O يحتوي على وسط. تعقيم الحل عن طريق التصفية مع مرشحات من حجم المسام 200 نانومتر.
ملاحظة: استخدم هذا البروتوكول دائما لصنع وتعقيم المحاليل المتوسطة في خطوات أخرى. - لتحضير عينات بكتيرية لتصوير SRS ، أضف 2 مل من وسائط MHB العادية ، التي لا تحتوي على الديوتيريوم ، إلى أنبوب زراعة معقم مستدير القاع ، ثم قم بتسخينه عند 37 درجة مئوية.
- استخدم حلقة معقمة لاختيار مستعمرة بكتيرية واحدة (الإشريكية القولونية BW 25113 أو Pseudomonas aeruginosa ATCC 47085) من الثقافة الطازجة على طبق أجار الصويا tryptic. ثم قم بتعليقه في وسائط الاستزراع قبل التسخين والدوامة برفق لتحضير تعليق البكتيريا.
- احتضان البكتيريا عند 37 درجة مئوية في شاكر بسرعة 200 دورة في الدقيقة (دورة في الدقيقة) حتى تصل إلى المرحلة اللوغاريتمية.
2. D2 O علاج الدمج في وجود المضادات الحيوية (الشكل 2 أ)
- تحقق من تركيز البكتيريا عن طريق قياس الكثافة البصرية (OD) باستخدام مقياس ضوئي بطول موجي يبلغ 600 نانومتر.
- قم بتخفيف المحلول البكتيري باستخدام وسط MHB العادي ، الذي لا يحتوي على الديوتيريوم ، للوصول إلى تركيز الخلية النهائي 8 × 105 CFU / mL. دوامة بلطف لخلط الخلايا البكتيرية.
- تحضير 300 ميكرولتر من المحلول البكتيري في سبعة أنابيب صغيرة سعة 1.5 مل ، و 600 ميكرولتر من المحلول البكتيري في أنبوب صغير واحد سعة 1.5 مل.
- أضف 4.8 ميكرولتر من محلول مخزون المضادات الحيوية (جنتاميسين أو أموكسيسيلين) (1 مجم / مل) إلى الأنبوب الصغير الذي يحتوي على 600 ميكرولتر من المحلول البكتيري ، لجعل التركيز النهائي للمضادات الحيوية 8 ميكروغرام / مل.
- خذ 300 ميكرولتر من المحلول من 8 ميكروغرام / مل من محلول البكتيريا المحتوية على المضادات الحيوية ، وأضفه إلى 300 ميكرولتر أخرى من المحلول البكتيري ، لصنع مضاد حيوي مخفف مزدوج (4 ميكروغرام / مل) يحتوي على محلول بكتيري.
- كرر التخفيف التسلسلي المزدوج للمضادات الحيوية الاختبارية ، الجنتاميسين ، أو الأموكسيسيلين ، حتى يتم الوصول إلى الأنبوب الصغير بأقل تركيز (0.25 ميكروغرام / مل) ، وتخلص من 300 ميكرولتر من الأنبوب. بالنسبة لكل من الجنتاميسين والأموكسيسيلين ، تتراوح التركيزات التسلسلية من 0.25 ميكروغرام / مل - 8 ميكروغرام / مل.
- اترك أنبوبا واحدا بدون مضادات حيوية للتحكم الفارغ. سيكون هذا هو التحكم الإيجابي لفحص نشاط التمثيل الغذائي البكتيري دون علاج بالمضادات الحيوية ولكن مع علاج D2O.
- اترك أنبوبا واحدا بدون مضادات حيوية ولا يوجد D2O للتحكم السلبي.
- احتضان القسمة البكتيرية مع بعض المضادات الحيوية (جنتاميسين أو أموكسيسيلين) التي تحتوي على وسط MHB لمدة 1 ساعة.
- أثناء الحضانة ، قم بإعداد تخفيف تسلسلي للمضادات الحيوية بنسبة 100٪ D 2 O تحتوي على وسط بنفس تدرج تركيز المضادات الحيوية المحضرة في الخطوة2.6. بالنسبة لكل من الجنتاميسين والأموكسيسيلين ، تتراوح التركيزات التسلسلية من 0.25 ميكروغرام / مل - 8 ميكروغرام / مل.
- بعد 1 ساعة من العلاج بالمضادات الحيوية ، أضف 700 ميكرولتر من المضادات الحيوية المخففة بشكل متسلسل و 100٪ D 2 O المحتوي على MHB المتوسط إلى 300 ميكرولتر من البكتيريا المعالجة بالمضادات الحيوية في نفس تركيز المضادات الحيوية (أعدت في الخطوة2.6) ، على التوالي.
- على سبيل المثال ، أضف 700 ميكرولتر من وسط MHB المحتوي على 100٪ D2O (يحتوي على 8 ميكروغرام / مل من المضادات الحيوية) إلى 300 ميكرولتر من 8 ميكروغرام / مل من البكتيريا المعالجة بالمضادات الحيوية. بنفس الطريقة ، انقل إلى الأنابيب المقابلة للتركيز التالي ، وقم بالتجانس عن طريق السحب لأعلى ولأسفل عدة مرات.
- أضف 700 ميكرولتر من وسط MHB المحتوي على 100٪ D2 الخالي من المضادات الحيوية إلى 300 ميكرولتر من البكتيريا الخالية من المضادات الحيوية (المحضرة في الخطوة 2.6.1) كعنصر تحكم فارغ.
- احتضن عند 37 درجة مئوية في شاكر الحضانة عند 200 دورة في الدقيقة لمدة 30 دقيقة إضافية.
ملاحظة: في هذه الخطوة ، يكون التركيز النهائي ل D2O في الوسط للاختبار 70٪.
- أولا بالطرد المركزي 1 مل من المضادات الحيوية و D2O عينة بكتيرية معالجة عند 6200 × جم لمدة 5 دقائق عند 4 درجات مئوية ، ثم يغسل مرتين بالماء النقي. أخيرا ، قم بإصلاح العينات في محلول فورمالين 10٪ وقم بتخزينها في 4 درجات مئوية.
3. تحضير البكتيريا في بيئة البول (الشكل 2 ب)
- لتحضير E. coli BW 25113 في المرحلة اللوغاريتمية ، اتبع الخطوات في 1.4 و 1.5.
- تحقق من تركيز البكتيريا عن طريق قياس OD باستخدام مقياس ضوئي بطول موجي 600 نانومتر.
- لتقليد عينات التهاب المسالك البولية السريرية14،18،41 ، قم برفع محلول الإشريكية القولونية إلى 10 مل من البول غير المحدد للوصول إلى تركيز الخلية النهائي البالغ 10 6 CFU / mL.
- قم بتصفية البول المسننة بالإشريكية القولونية باستخدام مرشح 5 ميكرومتر ، ثم قسم المحلول البكتيري في 300 ميكرولتر إلى سبعة أنابيب صغيرة سعة 1.5 مل ، و 600 ميكرولتر من المحلول البكتيري في أنبوب صغير واحد سعة 1.5 مل.
- إجراء علاج الدمج D 2 O في وجود المضادات الحيوية وجمع العينات كما هو موضح في الخطوات السابقة من 2.4 إلى2.10.
4. تحضير البكتيريا في بيئة الدم (الشكل 2 ج)
- لتحضير Pseudomonas aeruginosa ATCC 47085 في المرحلة اللوغاريتمية ، اتبع الخطوات عند 1.4 و 1.5.
- لتقليد عينات عدوى مجرى الدم السريرية42,43 ، ارتفاع P. aeruginosa في 1 مل من دم الإنسان غير المحدد للوصول إلى تركيز 107 CFU / mL.
- أضف 9 مل من الماء النقي المعقم لتحلل الدم.
- قم بتصفية الدم المسننة P. aeruginosa باستخدام مرشح 5 ميكرومتر. ثم حصاد البكتيريا إلى حجم 1 مل عن طريق الطرد المركزي عند 6200 × جم لمدة 5 دقائق عند 4 درجات مئوية. أضف 9 مل من MHB العادي الذي تم تسخينه مسبقا إلى محلول البكتيريا ودوامة برفق. التركيز النهائي للبكتيريا هو 106 CFU / مل
- قسم محلول الدم P. aeruginosa المسنن في 300 ميكرولتر من القسمة إلى سبعة أنابيب صغيرة سعة 1.5 مل ، و 600 ميكرولتر من المحلول البكتيري في أنبوب صغير واحد سعة 1.5 مل.
- إجراء علاج الدمج D 2 O في وجود المضادات الحيوية وجمع العينات كما هو موضح في الخطوات السابقة من 2.4 إلى2.10.
5. تصوير SRS لدمج التمثيل الغذائي D2O في بكتيريا واحدة
- اغسل 1 مل من محلول البكتيريا الثابتة بالماء النقي ثم جهاز طرد مركزي عند 6200 × جم لمدة 5 دقائق عند 4 درجات مئوية. إزالة طاف . إثراء الحل البكتيري إلى حوالي 20 ميكرولتر.
- قم بإيداع المحلول البكتيري على غطاء زجاجي مطلي ب poly-L-lysine. شطيرة وختم العينة للتصوير SRS.
- صورة البكتيريا عند تردد اهتزاز C-D عند 2168 سم -1 باستخدام مجهر SRS.
- أدخل واضبط الطول الموجي للمضخة على 852 نانومتر باستخدام برنامج التحكم على جهاز كمبيوتر.
- قم بقياس طاقة الليزر باستخدام مقياس الطاقة. اضبط قوة ليزر المضخة عند العينة على ~ 8 ميجاوات وقوة ليزر ستوكس عند العينة على ~ 40 ميجاوات عن طريق ضبط لوحة نصف الموجة أمام خرج الليزر.
ملاحظة: في مجهر SRS ، يوفر ليزر الفيمتو ثانية القابل للضبط بمعدل تكرار 80 ميجاهرتز ليزر الإثارة (680 إلى 1300 نانومتر) و Stokes (1045 نانومتر).
- من خلال ضبط مسامير مرايا الانعكاس ، قم بمحاذاة المضخة مكانيا وحزم ستوكس وتوجيه الحزمتين إلى مجهر عمودي مجهز بنظام مرآة 2D galvo للمسح بالليزر.
- استخدم هدف الغمر في الماء 60x لتركيز المضخة وليزر ستوكس على العينة.
- استخدم مكثف الزيت لجمع الإشارات من العينة في الاتجاه الأمامي.
- استخدم مرشح تمرير النطاق الترددي لتصفية ليزر ستوكس قبل توجيهه إلى الصمام الثنائي الضوئي.
- استخرج إشارة رامان المحفزة بواسطة مضخم قفل واكتشف الإشارات بواسطة الصمام الثنائي الضوئي.
- اضبط كل صورة SRS لتحتوي على 200 × 200 بكسل ووقت بقاء البكسل لمدة 30 ميكروثانية في لوحة تحكم البرنامج. إجمالي وقت الاستحواذ لصورة واحدة هو ~ 1.2 ثانية. اضبط حجم الخطوة على 150 نانومتر ، بحيث يكون حجم الصورة حوالي 30 × 30 ميكرومتر2. قم بتصوير ثلاثة مجالات عرض على الأقل لكل عينة.
6. معالجة الصور وتحليل البيانات (الشكل 3)
- للحصول على متوسط شدة إشارة C-D ، افتح صور SRS ومعالجتها باستخدام برنامج ImageJ.
- أولا ، قم بتحويل صور SRS إلى صور من النوع 8 بت بألوان مقلوبة بالنقر فوق Image | اكتب | 8 بت، ثم تحرير | عكس الأزرار في برنامج ImageJ.
- بعد ذلك ، قم بتصفية الصور باستخدام تمويه Gaussian بالنقر فوق معالجة | الفلاتر | أزرار طمس Gaussian وتعيين سيغما (نصف القطر) إلى 1.
- استخدم ضبط عتبة الصورة لتحديد المنطقة البكتيرية. انقر على الصورة | ضبط | عتبة للتأكد من تطابق أحجام البكتيريا المحددة مع تلك الموجودة في صور SRS الأصلية. تخلص من الجسيمات الصغيرة عن طريق ضبط عتبة الحجم لتحديد الجسيمات. انقر على تطبيق.
- تطبيق تحليل | أزرار تحليل الجسيمات لتسمية وتحديد منطقة البكتيريا.
- بالنقر فوق الزر إظهار الكل في مدير عائد الاستثمار إلى صورة SRS الأصلية غير المعالجة ، قم بتسمية نفس المنطقة من البكتيريا ، وحدد متوسط كثافة كل نقطة بيانات بالنقر فوق الزر قياس في مدير عائد الاستثمار.
- ضع دائرة حول منطقة الخلفية في صورة SRS الأصلية وقم بقياس متوسط كثافة الخلفية. يتم الحصول على متوسط شدة C-D لكل بكتيريا عن طريق خصم شدة إشارة الخلفية.
7. تحديد كمية الحساسية لمضادات الميكروبات عن طريق SC-MIC
ملاحظة: تم تحديد القيمة الحدية عند 0.60 لتحديد SC-MIC وفقا للتحليل الإحصائي لشدة SRS C-D للظروف النشطة الأيضية والمثبطة لعملية التمثيل الغذائي للبكتيريا عند تركيزات مختلفة من التعرض للدواء40. تم تزويد كثافة C-D للمجموعات الحساسة للمضادات الحيوية والمقاومة للمضادات الحيوية بالتوزيع الطبيعي.
- ارسم منحنى خاصية تشغيل جهاز الاستقبال (ROC) وقم بتقييم عتبة القطع عند 0.60. بناء على هذه القيمة الفاصلة ، يمكن تعريف SC-MIC كمؤشر لفعالية المضادات الحيوية لتحديد المجموعة غير النشطة الأيضية والنشطة الأيضية.
- لتحليل بيانات تصوير SRS كميا ، ارسم الرسوم البيانية لشدة إشارة C-D لكل مجموعة بكتيريا معالجة بتركيز المضادات الحيوية المخففة بشكل متسلسل. تشير نقاط البيانات الملونة إلى بكتيريا فردية مختلفة.
- تطبيع شدة C-D للمجموعة المعالجة بالمضادات الحيوية إلى متوسط كثافة المجموعة الضابطة دون علاج بالمضادات الحيوية. تحديد نتائج SC-MIC لمجموعات مختلفة من البكتيريا والمضادات الحيوية عن طريق تحديد شدة إشارة SRS في منطقة C-D مقابل تركيزات مختلفة من المضادات الحيوية باستخدام قيمة القطع عند 0.60.
- تحقق من صحة ومقارنة قراءات SC-MIC مع MIC المحددة باستخدام مقايسة التخفيف الدقيق للمرق التقليدية.
- وفقا لمعهد المعايير السريرية والمخبرية (CLSI) ، يتم تفسير فئة الحساسية بناء على نتائج التصوير الأيضي SRS لكل سلالة بكتيرية تم اختبارها على أنها "حساسة" أو "مقاومة" أو "متوسطة".
النتائج
يتم قياس تأثير وقت الحضانة على دمج الديوتيريوم بواسطة التحليل الطيفي الدقيق لرامان التلقائي في منطقة C-D (2070 إلى 2250 سم -1) و C-H (2800 إلى 3100 سم -1) (الشكل 4 أ). تظهر أطياف رامان أحادية الخلية ذات الفاصل الزمني ل P. aeruginosa المزروعة في 70٪ D 2 O التي تحتوي على وسط زيادة كثافة CD / CH خلال وقت الحضانة من 0 إلى 180 دقيقة. (الشكل 4 ب) تكشف وفرة C-D المتزايدة في الخلايا الميكروبية المفردة أن D2O مدمج في الجزيئات الحيوية المثبطة داخل الخلية.
D2O وضع العلامات فوق 50٪ يؤثر على التمثيل الغذائي البكتيري بشكل كبير خلال فترة حضانة 23 ساعة27. لاحظنا تثبيط نمو البكتيريا عندما يكون تركيز وضع العلامات D2O أعلى من 70٪ خلال فترة حضانة 25 ساعة (الشكل S1). لقد أجرينا MIC عن طريق تخفيف المرق القياسي الذهبي وحصلنا على نتائج SC-MIC في سلالتين من P. aeruginosa (P. aeruginosa ATCC 47085 و P. aeruginosa 1133) (الجدول S1). تظهر نتائجنا الحالية أن 70٪ D2O لا يؤثر على أداء طريقتنا في P. aeruginosa. اتفاق الفئة لطريقة SC-MIC الخاصة بنا مع الطريقة التقليدية القائمة على الثقافة هو 100٪ لجميع تركيبات P. aeruginosa والمضادات الحيوية المختبرة ، كما هو موضح في الجدول S1. نعزو هذا الاتفاق الجيد إلى الحد الأدنى من السمية بنسبة 70٪ D2O على P. aeruginosa خلال فترة الحضانة البالغة 30 دقيقة في تحديد SC-MIC.
باتباع البروتوكول ، تم تحضين P. aeruginosa مع جنتاميسين مخفف بشكل متسلسل لمدة 1 ساعة ثم 70٪ D2O لمدة 30 دقيقة إضافية. يتم تقسيم شدة C-D عند العلاج بالمضادات الحيوية على القيمة المتوسطة للمجموعة الضابطة ، والتي لا تحتوي على علاج بالمضادات الحيوية. أظهر التحليل الإحصائي الكمي (الشكل 5 ب) أن إشارات C-D ل P. aeruginosa كانت أقل بكثير عند تركيز 2 ميكروغرام / مل أو تركيز جنتاميسين أعلى من تلك التي لم تعالج بالجنتاميسين (0 ميكروغرام / مل). باستخدام عتبة القطع عند 0.60 ، تم تثبيط P. aeruginosa أيضيا عند 2 ميكروغرام / مل وتركيزات أعلى من الجنتاميسين. يظهر الخط المنقط قيمة القطع المحددة عند 0.60 في الشكل 5 ب. وبهذه الطريقة، تم تحديد SC-MIC ل P. aeruginosa ضد الجنتاميسين في وسط MHB العادي ليكون 2 ميكروغرام/مل. تم التحقق من أن قيمة SC-MIC هذه تقع ضمن نطاق الفرق بمقدار ضعف واحد مع MIC (4 ميكروغرام / مل) الذي تحدده طريقة التخفيف الدقيق للمرق (الشكل 5 ج). مجتمعة ، SC-MIC التي تحددها تقنيتنا تمكن من القياس الكمي لحساسية مضادات الميكروبات.
لاستكشاف إمكانات AST السريع عن طريق تصوير SRS لدمج التمثيل الغذائي للديوتيريوم للتطبيقات السريرية ، خاصة بالنسبة لعدوى المسالك البولية الأكثر انتشارا ، اختبرنا عينة بول مسننة بالبكتيريا باستخدام الإشريكية القولونية ، العامل الممرض الأكثر شيوعا الذي يسبب عدوى المسالك البولية44. لتقليد عينات التهاب المسالك البولية السريرية بتركيز بكتيري مرتبط ، تضاف الإشريكية القولونية إلى البول غير المحدد إلى تركيز نهائي قدره 106 CFU / mL. بعد تنقية العينة ، تم تحضين عينات البول مع أموكسيسيلين و D2O. أظهرت الخلفية النظيفة في صور SRS أن بروتوكول تحضير العينة كان قابلا للتطبيق لقياس AST السريع (الشكل 5 د). تم تحديد SC-MIC لعينة البول المسننة بالإشريكية القولونية ضد الأموكسيسيلين على أنها 4 ميكروغرام / مل (الشكل 5 ه) ، والتي لها نفس قراءات الحساسية مع MIC (8 ميكروغرام / مل) بطريقة تخفيف المرق التقليدية للإشريكية القولونية النقية في وسط MHB العادي (الشكل 5f). أظهرت هذه النتائج مجتمعة أن AST السريع عن طريق التصوير SRS لدمج التمثيل الغذائي للديوتيريوم له إمكانات كبيرة للتشخيص السريري لمسببات الأمراض المعدية لالتهاب المسالك البولية.
بالمقارنة مع عدوى التهاب المسالك البولية ، فإن AST السريع لمسببات الأمراض BSI يمثل تحديا أكبر بكثير للدراسة الموقعية للنشاط الأيضي البكتيري ، حيث تظهر الكثير من خلايا الدم في الدم. للتحقيق في قابلية تطبيق AST السريع عن طريق تصوير SRS لدمج التمثيل الغذائي D2O لعينات BSI السريرية ، تم اكتشاف P. aeruginosa في دم بشري مجهول الهوية. كما هو موضح في الشكل 5g ، سيطرت الإشارات البكتيرية على شدة C-D لصورة SRS عند 2168 سم -1. نظرا لأن خلايا الدم الحمراء ليس لها نشاط استقلابي لامتصاص D2O لمزيد من التخليق الحيوي ، فقد نشأت إشارات C-D من دمج الديوتيريوم الأيضي للبكتيريا الحية. وساهم التشكيل عبر الطور أو الإشارة الحرارية الضوئية لأنواع الحطام أو خلايا الدم الحمراء في ضعف إشارات الخلفية، دون التأثير على التحليل الكمي ل SC-MIC. تم تحديد نتيجة SC-MIC ل P. aeruginosa في الدم لتكون 2 ميكروغرام / مل (الشكل 5h) ، والتي تتفق بشكل جيد مع نتيجة MIC القياسية التقليدية ل P. aeruginosa في وسط النمو الطبيعي (الشكل 5i). مجتمعة ، أظهرت هذه النتائج أن التصوير الأيضي SRS لدمج التمثيل الغذائي للديوتيريوم يمكن أن يكون طريقة AST سريعة لتحديد SC-MIC للبكتيريا في عدوى BIS.
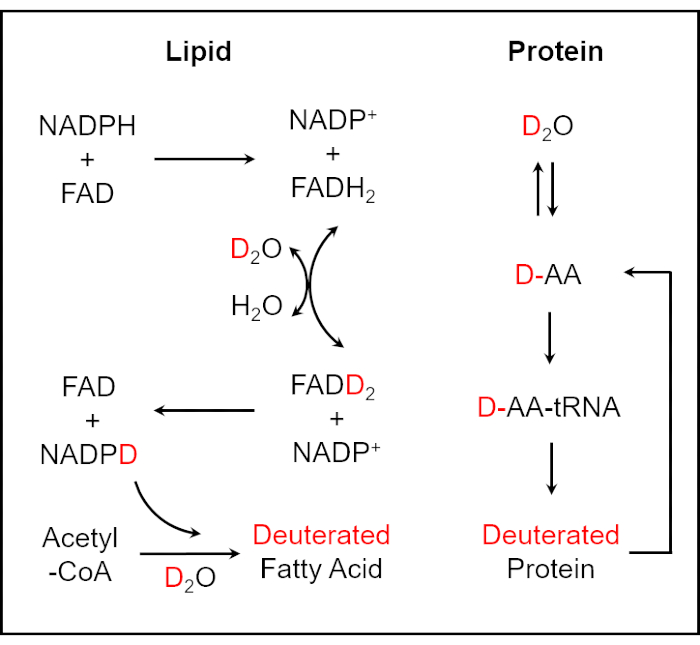
الشكل 1: مخطط لدمج D2O في الدهون والبروتين المخففين25,26. يمكن دمج الديوتيريوم في الكتلة الحيوية داخل الخلية من خلال تفاعل تبادل H / D المحفز بالإنزيم بين ذرة الهيدروجين النشطة للأكسدة والاختزال في NADPH والذرة D في D2O. يتم التوسط في تفاعل تخليق الأحماض الدهنية Deuterated بواسطة الديوتيريوم المسمى NADPH. يؤدي دمج D2O في تفاعلات الأحماض الأمينية إلى إنتاج البروتينات المثقوبة. تم تعديل هذا الرقم من المرجع 40. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
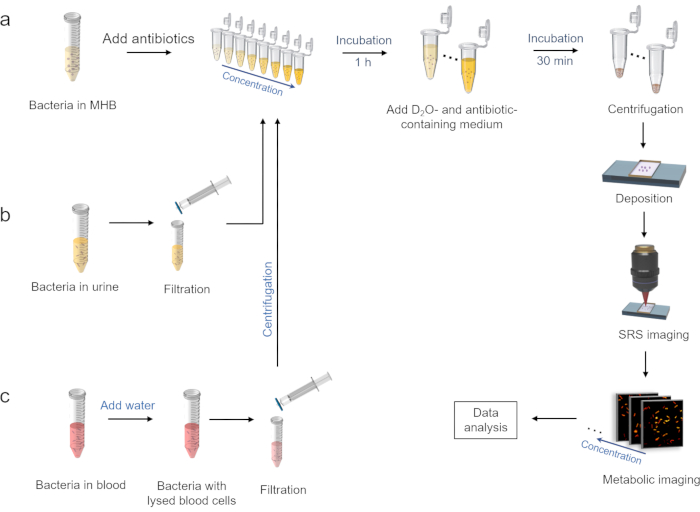
الشكل 2: سير عمل AST السريع بواسطة التصوير الأيضي SRS لدمج الديوتيريوم. (أ) D2O العلاج بالدمج في وجود المضادات الحيوية في وسط MHB ، وإجراءات التصوير SRS التالية. (ب) تحضير البكتيريا في بيئة البول. (ج) تحضير البكتيريا في بيئة الدم. تم تعديل هذا الرقم من المرجع 40. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
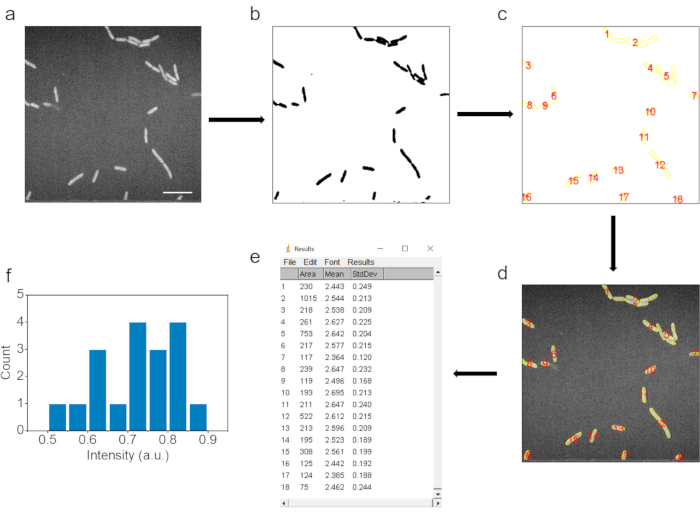
الشكل 3. المعالجة الآلية للصور وتفسير البيانات. (أ) صورة SRS خام. (ب) الصورة بعد تعديل عتبة الشدة لتحديد مساحة الخلايا البكتيرية. (ج) نقاط البيانات المختارة بعد خطوة تحليل الجسيمات. (د) يتم اختيار نقاط البيانات المقابلة في الصورة الخام. (ه) نتائج نقاط البيانات المقابلة في الصورة الخام. (و) النتائج الإحصائية لمتوسط كثافة نقاط البيانات بعد طرح الخلفية. شريط المقياس: 10 ميكرومتر. تم تعديل هذا الرقم من المرجع 40. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4. تأثير وقت الحضانة على دمج الديوتيريوم في البكتيريا. (أ) قياس الفاصل الزمني في منطقة C-D (2070 إلى 2250 cm-1) و C-H (2800 إلى 3100 cm-1) بواسطة التحليل الطيفي المجهري Raman التلقائي (متوسط من 20 طيفا). (ب) مخطط الرسم البياني لمخطط نسبة كثافة CD / CH على مدى وقت حضانة D2Oللبكتيريا في (أ). كل نقطة ملونة تعني قياسا من بكتيريا واحدة. تمثل أشرطة الخطأ الخطأ المعياري للمتوسط (SEM). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5. تحديد SC-MIC باستخدام تصوير SRS لدمج التمثيل الغذائي البكتيري ل D2O ضد المضادات الحيوية في الوسط الطبيعي والبول وبيئة الدم. (أ) تصوير SRS عند اهتزاز C-D (2168 سم-1) وصور الإرسال المقابلة ل P. aeruginosa في وجود D2O مع إضافة الجنتاميسين المخفف بشكل متسلسل في وسط MHB العادي. (ب) التحليل الكمي لشدة SRS C-D من المتصورة الزنجارية في (أ). تشير نقاط البيانات الملونة في الرسم البياني إلى البكتيريا الفردية المختلفة. يشير الخط المنقط إلى قيمة القطع عند 0.60. (ج) مقارنة قراءات SC-MIC مع MIC بواسطة طريقة التخفيف الدقيق للمرق ، وفئة الحساسية ل P. aeruginosa وفقا ل CLSI. (د) تصوير SRS عند اهتزاز C-D (2168 سم-1) وصور الإرسال المقابلة للإشريكية القولونية في البول بعد الحضانة في D2O مع الأموكسيسيلين المخفف بشكل متسلسل. (ه) التحليل الكمي لكثافة SRS C-D في (د). (و) مقارنة قراءات SC-MIC وفئة الحساسية للإشريكية القولونية في MHB العادي وفي البول. (ز) تصوير SRS عند اهتزاز C-D (2168 cm-1) وصور الإرسال المقابلة ل P. aeruginosa في الدم بعد الحضانة في D2O مع الجنتاميسين المخفف بشكل متسلسل. (ح) التحليل الكمي لكثافة SRS C-D في (ز). (ط) مقارنة قراءات وحساسية العقدية الزنجارية في MHB العادي وفي الدم. S: حساسة. عدد الخلايا N ≥ 10 لكل مجموعة. تمثل أشرطة الخطأ SEM. شريط المقياس: 10 ميكرومتر. تم تعديل هذا الرقم من المرجع 40. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| مشكلة | السبب المحتمل | حل |
| عدد قليل أو معدوم من الخلايا البكتيرية في مجال الرؤية التصويرية | الكثافة البكتيرية في المحلول منخفضة للغاية | جهاز طرد مركزي لفترة أطول لزيادة إثراء البكتيريا |
| التلف الضوئي للخلايا البكتيرية أثناء تصوير SRS | طاقة الليزر المستخدمة عالية جدا | قم بضبط طاقة الليزر إلى قيمة مناسبة |
| لا توجد إشارة SRS قابلة للاكتشاف | لم يتم تحسين التداخل المكاني والزماني للمضخة وشعاع ستوكس | قم بمحاذاة المضخة وعوارض ستوكس باستخدام عينة قياسية من ثنائي ميثيل سلفوكسيد المخفض |
الجدول 1: جدول استكشاف الأخطاء وإصلاحها.
الشكل S1: اختبار سمية D 2 O على P. aeruginosa المستزرعة في وسط Lauria-Bertani (LB) بتركيزات مختلفة من D2O. تشير أشرطة الخطأ إلى قيم الانحراف المعياري (عدد القياسات = 5). الرجاء الضغط هنا لتنزيل هذا الشكل.
الجدول S1. مقارنة بين SC-MICs و MICs في MHB العادي من P. aeruginosa عند العلاج بالمضادات الحيوية. S: حساسة. R: مقاومة. I: متوسط. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
يمكن الحصول على AST السريع من خلال تقييم استجابة النشاط الأيضي البكتيري للعلاج بالمضادات الحيوية باستخدام التصوير الأيضي SRS أحادي الخلية في غضون 2.5 ساعة من العينة إلى نتائج SC-MIC. يمكن الكشف عن استجابة النشاط الأيضي البكتيري والحساسية لمضادات الميكروبات من خلال مراقبة الدمج الأيضي ل D2O لتخليق الجزيئات الحيوية باستخدام تصوير SRS لروابط C-D. نظرا لاستخدام الماء في كل مكان في الخلايا الحية ، يوفر التصوير الأيضي SRS طريقة عالمية ل AST السريع. طريقة AST السريعة قابلة للتطبيق للكشف عن البكتيريا في البيئات البيولوجية المعقدة ، مثل البول أو الدم الكامل على مستوى بكتيريا واحد. يمكن تحديد SC-MIC بعد 1.5 ساعة من زراعة البكتيريا في البول والدم ، والتي تعتبر تحويلية لتحويل نموذج تشخيص التهاب المسالك البولية و BSI من إجراء يعتمد على الثقافة يستغرق وقتا طويلا إلى نهج مستقل عن الثقافة في الموقع . لذلك ، فهذا يعني انخفاضا هائلا في وقت التشخيص مقارنة بطريقة التخفيف الدقيق للمرق التقليدية ، مما يمهد الطريق نحو الترجمة السريرية مما يسمح بتحديد العوامل المضادة للميكروبات المناسبة في الوقت المحدد للعلاج الدقيق.
تتبع بروتوكولات العلاج بالمضادات الحيوية الموصوفة هنا إرشادات CLSI ، حيث يمكن استخدام وسيط MHB المقترح بشكل عام لزراعة مجموعة واسعة من الكائنات الحية الدقيقة. المعلمة الرئيسية هي أن رقم الخلية البكتيرية المستخدم في اختبار الحساسية لمضادات الميكروبات يتم الاحتفاظ به عند حوالي 5 × 105 CFU / mL على النحو الموصى به في CLSI. هذا أمر بالغ الأهمية للحصول على نتائج دقيقة وقابلة للتكرار. في تجارب العلاج بالمضادات الحيوية ، يتم ضبط تركيز البكتيريا على 8 × 105 CFU / mL. يمكن أن يؤدي ارتفاع تركيز البكتيريا إلى زيادة نتائج MIC. بمجرد ضبط المعلق البكتيري ، يجب استخدامه في غضون 30 دقيقة لتجنب التغيرات في تركيز الخلايا البكتيرية.
لاختبار الحساسية لمضاد حيوي مثل دابتومايسين ، يوصى بتكملة 50 مجم / لتر من الكالسيوم في الوسائط. يحتوي وسط MHB المعدل بالكاتيون على 20-25 مجم / لتر من الكالسيوم2+. لذلك ، تأكد من استكمال الوسط بمزيد من الكالسيوم2+ (قابل للذوبان في الماء ومرشح معقم) بتركيز 30 مجم / لتر.
خطوة أخرى حاسمة في الطريقة المقدمة هي وقت حضانة البكتيريا عند التعرض للمضادات الحيوية ودمج D2O. نظرا لأن وقت توليد دورة حياة البكتيريا يتراوح من 30 إلى 60 دقيقة تقريبا ، فمن المهم التأثير على نشاط التمثيل الغذائي البكتيري عند التعرض للمضادات الحيوية لفترة معينة. تم تقييم هذا الاختبار لمجموعة متنوعة من تركيبات البكتيريا والمضادات الحيوية للتعرض للمضادات الحيوية لمدة 1 ساعة قبل علاج 0.5 ساعة D2O. أول خطوة علاج بالمضادات الحيوية 1 ساعة ضرورية للتأثير على نشاط التمثيل الغذائي البكتيري. بعد ذلك ، يتم تحضين البكتيريا بوسط يحتوي على D2O ويحتوي على مضادات حيوية لمدة 30 دقيقة إضافية. يتم الحفاظ على تركيزات المضادات الحيوية النهائية عند نفس المستوى ، ويتم ضبط التركيز النهائي ل D2O إلى 70٪. بشكل عام ، بعد 1 ساعة من الزراعة المسبقة للمضادات الحيوية وبعد 0.5 ساعة من D2O ودمج المضادات الحيوية ، يتم تحديد نتائج SC-MIC عن طريق التصوير الأيضي SRS للنشاط الأيضي البكتيري. يقلل هذا التصميم من تأثير تأثير D2O للنشاط المضاد للميكروبات على البكتيريا ويؤدي أيضا إلى قراءة مماثلة لنتائج SC-MIC مع MICs بالطريقة التقليدية.
في قياسات SC-MIC ، نقوم بإعداد 40 عينة بالتوازي ، بما في ذلك 5 مضادات حيوية مختلفة ، لكل منها 8 تركيزات في نفس الوقت. ومع ذلك ، نظرا لوجود الكثير من إجراءات التشغيل اليدوي ، فإن إجمالي وقت الفحص للكشف عن AST لخمس مجموعات مختلفة من البكتيريا والمضادات الحيوية أطول من 2.5 ساعة. في طريقتنا ، تم الحصول على كل صورة SRS تحتوي على ~ 20 خلية بكتيرية فردية في غضون ~ 1.0 ثانية في لقطة واحدة في وقت بقاء بكسل 30 μs. نقدر أن إجمالي وقت فحص AST لدراسة 10 مضادات حيوية لسلالة بكتيرية واحدة سيكون أقل من 2.5 ساعة من العينة إلى قراءات SC-MIC ، والتي لديها إمكانية هائلة لإجراء قياس عالي الإنتاجية. في العمل المستقبلي ، سيتم استخدام طريقة مؤتمتة لإعداد العينات والحصول على بيانات التصوير لزيادة تحسين الإنتاجية. يتم توفير تفاصيل استكشاف الأخطاء وإصلاحها في الجدول 1.
في طرق AST التقليدية القائمة على الثقافة ، للحصول على عزلات بكتيرية لمزيد من القياسات ، من الضروري احتضان العينات السريرية مسبقا لساعات. تم تطوير طرق AST المتقدمة لعينة التهاب المسالك البولية السريرية ، مثل مطيافية رامان29 ، ومجموعة نانولتر6 ، والقياس الكمي الرقميللحمض النووي 18 ، للتخلص من الحضانة المسبقة لفترة طويلة. بالمقارنة مع عدوى التهاب المسالك البولية ، فإن BSI أو الإنتان أكثر تهديدا للحياة18,45 ، حيث هناك حاجة ماسة إلى AST السريع للتشخيص الدقيق في العيادة. تم الإبلاغ عن طريقة تصوير مجهرية لقياس تكوين مستعمرة بكتيرية من مزارع الدم الإيجابية لتوفير نتائج MIC46. ومع ذلك ، يستغرق الأمر 6 ساعات على الأقل لزراعة البكتيريا لإجراء فحص AST. علاوة على ذلك ، يمكن أن توفر الأنظمة الأوتوماتيكية التجارية47 واستراتيجيات قياس الطيف الكتلي48،49 قراءات AST من مزارع الدم الإيجابية. ومع ذلك ، لا يمكن تقديم نتائج MIC للقرار السريري. تعتبر نتائج AST وقراءات MIC مهمة لتجنب الجرعة الزائدة من المضادات الحيوية للمرضى لإحداث آثار جانبية محتملة في العيادات ، لإبطاء ومنع انتشار العدوى المقاومة لمضادات الميكروبات50,51. بالمقارنة مع طرق AST الحالية القائمة على الفحص المجهري العفوي لرامان ، فإن تقنيتنا تقلل بشكل كبير من وقت الحصول على البيانات (حوالي 600 مرة أقل) بسبب تحسين إشارة الحجم. في هذا العمل ، نظهر AST السريع بواسطة تصوير SRS لأيض الديوتيريوم في البكتيريا المفردة بتركيز بكتيري ذي صلة سريريا (105 ~ 106 CFU / ml) في البول أو بيئة الدم الكاملة. كما هو موضح في النتائج السابقة ، يتم تحديد نتائج MIC بعد 1 ساعة من العلاج بالمضادات الحيوية و 30 دقيقة من خليط D2O وحضانة المضادات الحيوية في البكتيريا في البول والدم. يمكن أن توفر طريقتنا MICs وتصنيف الحساسية لكل تركيبة من سلالات المضادات الحيوية في غضون 2.5 ساعة ، وبالتالي تفتح طريقا جديدا للترجمة السريرية. للتلخيص ، دون الحاجة إلى الزراعة المسبقة والانقسام البكتيري ، فإن طريقتنا لديها إمكانات هائلة في مجال AST سريع وعالي الإنتاجية في الأمراض المعدية.
طريقة SC-MIC الخاصة بنا عن طريق التصوير الأيضي SRS قابلة للتطبيق للكشف عن MICs وتوفير تصنيف الحساسية لمسببات الأمراض المعدية عند التعامل مع أنواع وفيرة من تركيبات المضادات الحيوية للاستخدام السريري. يتم تحديد SC-MIC بعد 30 دقيقة من دمج D2O في البكتيريا في البول والدم ، مما يعني انخفاضا هائلا في وقت التشخيص مقارنة بطريقة تخفيف المرق التقليدية التي تكلف 16 إلى 24 ساعة للحضانة المسبقة. لتقديم معلومات تحديد مسببات الأمراض لاتخاذ القرارات السريرية ، يمكن دمج تقنية التصوير الأيضي SRS بشكل أكبر مع منصات التشخيص القادرة على التعرف السريع على مسببات الأمراض ، مثل قياس الطيف الكتلي للامتزاز بالليزر بمساعدة المصفوفة49،52،53. يمكن أن يكون الجمع بين تحديد مسببات الأمراض في الموقع والتشخيص السريع ل AST ذا إمكانات كبيرة للترجمة إلى العيادة التي تسمح بتحديد العوامل المضادة للميكروبات المناسبة في الوقت المناسب للعلاج الدقيق.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل NIH R01AI141439 إلى J.-X.C و MS ، و R35GM136223 إلى J.-X.C.
Materials
| Name | Company | Catalog Number | Comments |
| Acousto-optic modulation | Gooch&Housego | R15180-1.06-LTD | Modulating stokes laser beam |
| Amoxicillin | Sigma Aldrich | A8523-5G | |
| Bandpass filter | Chroma | HQ825/150m | Block the stokes laser beam before the photodiode |
| Calcium chloride | Sigma Aldrich | C1016-100G | Cation adjustment |
| Cation-adjusted Mueller-Hinton Broth | Fisher Scientific | B12322 | Antimicrobial susceptibility testing of microorganisms by broth dilution methods |
| Centrifuge | Thermo Scientific | 75002542 | |
| Cover Glasses | VWR | 16004-318 | |
| Culture tube with snap cap | Fisher brand | 149569B | |
| Daptomycin | Acros | A0386346 | |
| Deuterium oxide | 151882 | Organic solvent to dissolve antibiotics | |
| Deuterium oxide-d6 | Sigma Aldrich | 156914 | Organic solvent as a standard to calibrate SRS imaging system |
| Escherichia coli BW 25113 | The Coli Genetic Stock Center | 7636 | |
| Eppendorf polypropylene microcentrifuge tubes 1.5 mL | Fisher brand | 05-408-129 | |
| Gentamicin sulfate | Sigma Aldrich | G4918 | |
| Hydrophilic Polyvinylidene Fluoride filters | Millipore-Sigma | SLSV025NB | pore size 5 µm |
| ImageJ software | NIH | Version: 2.0.0-rc-69/1.52t | Image processing and analysis |
| Incubating orbital shaker set at 37 °C | VWR | 97009-890 | |
| Inoculation loop | Sigma | BR452201-1000EA | |
| InSight DeepSee femtosecond pulsed laser | Spectra-Physics | Model: insight X3 | Tunable laser source and fixed laser source at 1045 nm for SRS imaging |
| Lock-in amplifier | Zurich Instrument | HF2LI | Demodulate the SRS signals |
| Oil condenser | Olympus | U-AAC | NA 1.4 |
| Pseudomonas aeruginosa ATCC 47085 (PAO1) | American Type Culture Collection | ATCC 47085 | |
| Photodiode | Hamamatsu | S3994-01 | Detector |
| Polypropylene conical tube 15 mL | Falcon | 14-959-53A | |
| Polypropylene filters | Thermo Scientific | 726-2520 | pore size 0.2 µm |
| Sterile petri dishes | Corning | 07-202-031 | |
| Syringe 10 mL | Fisher brand | 14955459 | |
| UV/Vis Spectrophotometer | Beckman Coulter | Model: DU 530 | Measuring optical density at wavelength of 600 nm |
| Vortex mixer | VWR | 97043-562 | |
| Water objective | Olympus | UPLANAPO/IR | 60×, NA 1.2 |
References
- O'Neill, J. Tackling drug-resistant infections globally: final report and recommendations. The review on Antimicrobial Resistance. , (2016).
- Sugden, R., Kelly, R., Davies, S. Combatting antimicrobial resistance globally. Nature Microbiology. 1 (10), 16187(2016).
- Kumar, A., et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Critical Care Medicine. 34 (6), 1589-1596 (2006).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: a review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Frickmann, H., Masanta, W. O., Zautner, A. E. Emerging rapid resistance testing methods for clinical microbiology laboratories and their potential impact on patient management. BioMed Research International. 2014, 375681(2014).
- Avesar, J., et al. Rapid phenotypic antimicrobial susceptibility testing using nanoliter arrays. Proceedings of the National Academy of Sciences. 114 (29), 5787-5795 (2017).
- Schoepp, N. G., et al. Digital quantification of DNA replication and chromosome segregation enables determination of antimicrobial susceptibility after only 15 minutes of antibiotic exposure. Angewandte Chemie International Edition. 55 (33), 9557-9561 (2016).
- van Belkum, A., et al. Innovative and rapid antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 18 (5), 299-311 (2020).
- Hou, Z., An, Y., Hjort, K., Sandegren, L., Wu, Z. Time lapse investigation of antibiotic susceptibility using a microfluidic linear gradient 3D culture device. Lab on a Chip. 14 (17), 3409-3418 (2014).
- Choi, J., et al. Rapid antibiotic susceptibility testing by tracking single cell growth in a microfluidic agarose channel system. Lab on a Chip. 13 (2), 280-287 (2013).
- Lu, Y., et al. Single cell antimicrobial susceptibility testing by confined microchannels and electrokinetic loading. Analytical Chemistry. 85 (8), 3971-3976 (2013).
- Kim, S. C., Cestellosblanco, S., Inoue, K., Zare, R. N. Miniaturized antimicrobial susceptibility test by combining concentration gradient generation and rapid cell culturing. Antibiotics. 4 (4), 455-466 (2015).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Baltekin, Ö, Boucharin, A., Tano, E., Andersson, D. I., Elf, J. Antibiotic susceptibility testing in less than 30 min using direct single-cell imaging. Proceedings of the National Academy of Sciences. 114 (34), 9170-9175 (2017).
- Fredborg, M., et al. Real-time optical antimicrobial susceptibility testing. Journal of Clinical Microbiology. 51 (7), 2047-2053 (2013).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Barczak, A. K., Hung, D. T. RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities. Proceedings of the National Academy of Sciences. 109 (16), 6217-6222 (2012).
- Schoepp, N. G., et al. Rapid pathogen-specific phenotypic antibiotic susceptibility testing using digital LAMP quantification in clinical samples. Science Translational Medicine. 9 (410), (2017).
- Novelli-Rousseau, A., et al. Culture-free antibiotic-susceptibility determination from single-bacterium Raman spectra. Scientific Reports. 8 (1), 1-12 (2018).
- Schröder, U. -C., et al. Detection of vancomycin resistances in enterococci within 3 1/2 hours. Scientific Reports. 5, 8217(2015).
- Liu, C. -Y., et al. Rapid bacterial antibiotic susceptibility test based on simple surface-enhanced Raman spectroscopic biomarkers. Scientific Reports. 6 (1), 1-15 (2016).
- Chang, K. -W., et al. Antibiotic susceptibility test with surface-enhanced raman scattering in a microfluidic system. Analytical Chemistry. 91 (17), 10988-10995 (2019).
- Galvan, D. D., Yu, Q. surface-enhanced raman scattering for rapid detection and characterization of antibiotic-resistant bacteria. Advanced Healthcare Materials. 7 (13), 1701335(2018).
- Kirchhoff, J., et al. Simple ciprofloxacin resistance test and determination of minimal inhibitory concentration within 2 h using raman spectroscopy. Analytical Chemistry. 90 (3), 1811-1818 (2018).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995(2018).
- Berry, D., et al. Tracking heavy water (D2O) incorporation for identifying and sorting active microbial cells. Proceedings of the National Academy of Sciences. 112 (2), 194-203 (2015).
- Tao, Y., et al. Metabolic-activity-based assessment of antimicrobial effects by D2O-labeled single-cell raman microspectroscopy. Analytical Chemistry. 89 (7), 4108-4115 (2017).
- Yang, K., et al. Rapid antibiotic susceptibility testing of pathogenic bacteria using heavy water-labeled single-cell raman spectroscopy in clinical samples. Analytical Chemistry. 91 (9), 6296-6303 (2019).
- Song, Y., et al. Raman-Deuterium Isotope Probing for in-situ identification of antimicrobial resistant bacteria in Thames River. Scientific reports. 7 (1), 16648(2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Cheng, J. -X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zhang, C., Zhang, D., Cheng, J. -X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17, 415-445 (2015).
- Yue, S., Cheng, J. -X. Deciphering single cell metabolism by coherent Raman scattering microscopy. Current Opinion in Chemical Biology. 33, 46-57 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, Label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- He, R., Liu, Z., Xu, Y., Huang, W., Ma, H., Ji, M. Stimulated Raman scattering microscopy and spectroscopy with a rapid scanning optical delay line. Optics Letters. 42 (4), 659-662 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences. 116 (32), 15842-15848 (2019).
- Camp, C. H., et al. High-Speed Coherent Raman Fingerprint Imaging of Biological Tissues. Nature Photonics. 8, 627-634 (2014).
- Zhang, M., et al. Rapid determination of antimicrobial susceptibility by stimulated raman scattering imaging of D2O metabolic incorporation in a single bacterium. Advanced Science. 7 (19), 2001452(2020).
- Michael, I., et al. A fidget spinner for the point-of-care diagnosis of urinary tract infection. Nature Biomedical Engineering. 4 (6), 591-600 (2020).
- Bhattacharyya, R. P., et al. Simultaneous detection of genotype and phenotype enables rapid and accurate antibiotic susceptibility determination. Nature Medicine. 25 (12), 1858-1864 (2019).
- Stupar, P., et al. Nanomechanical sensor applied to blood culture pellets: a fast approach to determine the antibiotic susceptibility against agents of bloodstream infections. Clinical Microbiology and Infection. 23 (6), 400-405 (2017).
- Barber, A. E., Norton, J. P., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Cohen, J., et al. Sepsis: a roadmap for future research. The Lancet Infectious Diseases. 15 (5), 581-614 (2015).
- Choi, J., et al. rapid antimicrobial susceptibility test from positive blood cultures based on microscopic imaging analysis. Scientific Reports. 7 (1), 1148(2017).
- Gherardi, G., et al. Comparative evaluation of the Vitek-2 Compact and Phoenix systems for rapid identification and antibiotic susceptibility testing directly from blood cultures of Gram-negative and Gram-positive isolates. Diagnostic Microbiology and Infectious Disease. 72 (1), 20-31 (2012).
- Machen, A., Drake, T., Wang, Y. F. Same day identification and full panel antimicrobial susceptibility testing of bacteria from positive blood culture bottles made possible by a combined lysis-filtration method with MALDI-TOF VITEK mass spectrometry and the VITEK2 system. Plos One. 9, 87870(2014).
- Simon, L., et al. Direct identification of 80 percent of bacteria from blood culture bottles by matrix-assisted laser desorption ionization-time of flight mass spectrometry using a 10-minute extraction protocol. Journal of Clinical Microbiology. 57 (2), 01278(2019).
- Leekha, S., Terrell, C. L., Edson, R. S. General principles of antimicrobial therapy. Mayo Clinic Proceedings. 86 (2), 156-167 (2011).
- Johnson, L., et al. Emergence of fluoroquinolone resistance in outpatient urinary Escherichia coli isolates. The American Journal of Medicine. 121 (10), 876-884 (2008).
- Van Belkum, A., et al. Developmental roadmap for antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 17 (1), 51-62 (2019).
- Dubourg, G., Lamy, B., Ruimy, R. Rapid phenotypic methods to improve the diagnosis of bacterial bloodstream infections: meeting the challenge to reduce the time to result. Clinical Microbiology and Infection. 24 (9), 935-943 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved