Method Article
단일 박테리아에 혼입된 중수소의 자극된 라만 산란 이미징에 의한 신속한 항균 감수성 테스트
요약
이 프로토콜은D2O대사의 단일 세포 자극 라만 산란 이미징에 의해 2.5시간 이내에 신속한 항균 감수성 테스트(AST) 분석을 제공합니다. 이 방법은 소변 또는 전혈 환경의 박테리아에 적용되며, 이는 클리닉에서 신속한 단일 세포 표현형 AST를 변형시킵니다.
초록
항생제 내성 감염의 확산을 늦추고 예방하기 위해 병원균에 대한 항균 효과를 정량적으로 결정하기 위해 신속한 항균 감수성 검사 (AST)가 시급합니다. 전형적으로 장기간 배양에 기초한 통상적인 방법으로 AST를 완성하는 데 며칠이 걸리며, 이들은 임상 샘플에 대해 직접 작용하지 않는다. 여기에서는 산화중수소(D2O) 대사 혼입의 자극된 라만 산란(SRS) 이미징에 의해 가능해진 신속한 AST 방법을 보고합니다. 바이오매스로의D2O의 대사 혼입 및 단일 박테리아 수준에서 항생제에의 노출에 따른 대사 활성 억제는 SRS 영상화에 의해 모니터링된다. 항생제 노출 시 박테리아의 단일 세포 대사 불활성화 농도(SC-MIC)는 총 2.5시간의 샘플 준비 및 검출 후에 얻을 수 있습니다. 또한이 신속한 AST 방법은 소변이나 전혈과 같은 복잡한 생물학적 환경의 박테리아 샘플에 직접 적용 할 수 있습니다. 중수소 혼입의 SRS 대사 영상화는 클리닉에서 신속한 단일 세포 표현형 AST에 대한 변형입니다.
서문
항생제 내성(AMR)은감염성 질환의 효과적인 치료에 대한 전 세계적으로 증가하는 위협입니다1. 항생제 내성 박테리아 퇴치를 위한 조치가 취해지지 않으면 AMR로 인해 연간 1,000만 명이 추가로 사망하고 2050년까지 전 세계 GDP 1,00조 달러의 손실이 발생할 것으로 예상됩니다.1,2. 이는 항생제 내성 박테리아의 출현을 늦추고 관련사망률을 줄이기 위해 감염성 박테리아의 항생제 감수성 검사(AST)를 위한 신속하고 혁신적인 진단 방법의 시급한 필요성을 강조합니다3. 최상의 임상 결과를 보장하려면 24시간 이내에 효과적인 치료법을 도입하는 것이 중요합니다. 그러나 디스크 확산 또는 브로스 희석 방법과 같은 현재의 금 표준 방법은 일반적으로 임상 샘플의 사전 배양 절차에 최소 24시간이 필요하고 최소 억제 농도(MIC) 결과를 얻기 위해 추가로 16-24시간이 필요합니다. 전반적으로, 이러한 방법은 클리닉에서 전염병 치료에 대한 즉각적인 결정을 안내하기에는 너무 시간이 많이 걸리며, 이는 항생제 내성의 출현 및 확산으로 이어집니다4.
중합효소연쇄반응(PCR)기반 기술5과 같은 유전형 AST 방법이 신속한 검출을 위해 개발되었습니다. 이러한 기술은 빠른 AST 결과를 제공하기 위해 특정 저항 유전자 서열을 측정합니다. 그들은 시간이 많이 걸리는 세포 배양에 의존하지 않습니다. 그러나 내성이있는 특정 알려진 유전자 서열 만 테스트됩니다. 따라서, 그 적용은 다양한 박테리아 종 또는 다른 저항 메커니즘으로 제한됩니다. 또한 치료 결정 6,7에 대한 MIC 결과를 제공 할 수 없습니다. 게다가, 이러한 한계를 극복하기 위해 신속한 AST를 위한 신규한 표현형 방법이 개발 중이다(8), 미세유체 장치 9,10,11,12,13, 광학 장치14,15,16, 핵산 복제 번호 17,18, 및 라만 분광법(19)을 포함하는 표현형 AST, 20,21,22,23,24. 이러한 방법은 AST 결과를 안내하는 시간을 단축하지만 대부분은 임상 표본에 직접 적용되지 않고 박테리아 분리에만 적용되며 여전히 오랜 시간 사전 배양이 필요합니다.
이 연구에서는 SRS 영상에 의한 세포 대사 활동의 모니터링을 통해 소변 및 전혈에서 박테리아의 감수성을 신속하게 결정하는 방법을 제시합니다. 물 (H2O)은 살아있는 세포에서 필수적인 생체 분자 합성 과정의 대다수에 참여합니다. 물의 동위 원소로서, NADPH의 산화 환원 활성 수소 원자와 D2O의 D 원자 사이의 효소 촉매 H / D 교환 반응을 통해, 중수소는 세포 (25,26) 내부의 바이오 매스로 통합 될 수있다. 중수 소화 지방산 합성 반응은 중수소 표지 NADPH에 의해 매개됩니다. 아미노산 (AA)의 반응에D2O가 혼입되면 중수 소화 단백질 생산 (26)이 발생합니다 (그림 1). 이와 같이, 단일 미생물 세포에서 새롭게 합성된 C-D 결합 함유 생체분자는 검출하고자 하는 일반적인 대사활성 마커로 채용될 수 있다. de novo 합성 C-D 결합을 판독하기 위해 생체 분자의 구체적이고 정량적인 화학 정보를 제공하는 다목적 분석 도구인 Raman 분광법은 항균 감수성을 결정하고 테스트 시간을 몇 시간으로 크게 단축하는 데 널리 사용됩니다.27,28,29,30 . 그러나, 라만 산란 공정의 고유한 낮은 효율로 인해, 자발적 라만 분광법은 검출 감도가 낮다. 따라서 자발적인 라만 분광법을 사용하여 실시간 이미지 결과를 얻는 것은 어려운 일입니다. 코히어런트 안티-스톡스 라만 산란(CARS) 및 자극 라만 산란(SRS)을 포함한 코히어런트 라만 산란(CRS)은 자발적 라만 분광법보다 훨씬 더 큰 크기를 생성하는 코히어런트 라이트 필드로 인해 높은 검출 감도에 도달하여 단일 셀 수준에서 고속, 특이적 및 정량적 화학 이미징을 렌더링합니다. 31,32,33,34,35 ,36,37,38,39.
여기에서, 우리의 가장 최근의 연구(40)에 기초하여, 우리는 단일 세포 수준에서 정상 배지, 소변 및 전혈 환경에서 박테리아의D2O혼입의 펨토초 SRS C-D 이미징에 의한 대사 활성 및 항균 감수성의 신속한 결정을 위한 프로토콜을 제시한다. 펨토초 SRS 이미징은 2.5시간 이내에 단일 박테리아 수준에서 항생제에 대한 단일 세포 대사 불활성화 농도(SC-MIC)를 쉽게 모니터링할 수 있습니다. SC-MIC 결과는 브로스 미세 희석을 통한 표준 MIC 테스트에 의해 검증됩니다. 당사의 방법은 기존 방법에 비해 분석 시간이 훨씬 단축된 박테리아 요로 감염(UTI) 및 혈류 감염(BSI) 병원체의 항균 감수성을 측정하는 데 적용할 수 있으며, 이는 단일 세포 수준에서 클리닉에서 빠른 표현형 AST의 기회를 열어줍니다.
프로토콜
인간 혈액 표본의 사용은 보스턴 대학의 IRB와 국립 보건원 (NIH)의 지침에 따릅니다. 특히, 표본은 은행에서 왔으며 완전히 식별되지 않습니다. 이 표본은 보스턴 대학의 기관 검토위원회 (IRB) 사무실에서 인간 대상으로 간주되지 않습니다.
1. 박테리아 및 항생제 원액의 제조
- 1.5mL 마이크로 튜브의 멸균 1x 인산완충식염수(PBS) 또는 디메틸설폭사이드(DMSO) 용매에 용해된 1mg/mL 농도의 항생제(황산겐타마이신 또는 아목시실린) 원액을 준비합니다. 겐타 마이신 설페이트를 멸균 PBS 용액에 녹이고 아목시실린을 멸균 DMSO 용매에 용해시킨다. 그 후, 항생제 용액을 제안된 대로 2-8°C에서 저장한다.
- D2O함유 양이온 조정 뮐러-힌튼 브로스(MHB) 배지를 만들기 위해, 10mL의 D2O에 220mg의 MHB 브로스 베이스를 첨가하여 100%D2O함유 배지를 만든다. 200nm 공극 크기의 필터로 여과하여 용액을 멸균합니다.
알림: 이 프로토콜은 항상 추가 단계에서 배지 용액을 만들고 살균하는 데 사용하십시오. - SRS 이미징을 위해 박테리아 샘플을 준비하려면 중수소가 포함되지 않은 일반 MHB 배지 2mL를 멸균 둥근 바닥 배양 튜브에 추가한 다음 37°C에서 예열합니다.
- 멸균 루프를 사용하여 트립신 대두 한천 플레이트의 신선한 배양물로부터 하나의 박테리아(대장균 BW 25113 또는 녹농 균 ATCC 47085) 콜로니를 선택합니다. 그런 다음 예열 된 배양 배지에 현탁하고 부드럽게 와동하여 박테리아 현탁액을 준비합니다.
- 박테리아가 대수 단계에 도달할 때까지 셰이커에서 분당 200회전(rpm)으로 37°C에서 배양합니다.
2. 항생제 존재 하에서의D2O혼입 처리(도 2a)
- 파장 600nm에서 광도계로 광학 밀도 (OD)를 측정하여 박테리아 농도를 확인하십시오.
- 중수소를 포함하지 않는 일반 MHB 배지를 사용하여 박테리아 용액을 희석하여 최종 세포 농도 8 x 105 CFU/mL에 도달합니다. 박테리아 세포를 부드럽게 혼합하기 위해 와동.
- 7개의 1.5mL 마이크로 튜브에 박테리아 용액의 300μL 분취량을 준비하고, 하나의 1.5mL 마이크로 튜브에 박테리아 용액의 600μL 분취량을 준비합니다.
- 4.8μL의 항생제(겐타마이신 또는 아목시실린) 원액(1mg/mL)을 600μL의 박테리아 용액이 포함된 마이크로 튜브에 추가하여 최종 항생제 농도를 8μg/mL로 만듭니다.
- 항생제 함유 박테리아 용액 8μg/mL에서 용액 300μL를 취하고 박테리아 용액 300μL를 더 추가하여 2배 희석된 항생제(4μg/mL) 함유 박테리아 용액을 만듭니다.
- 최저 농도(0.25μg/mL)의 마이크로 튜브에 도달할 때까지 테스트 항생제, 겐타마이신 또는 아목시실린의 2배 연속 희석을 반복하고 튜브에서 300μL를 버립니다. 겐타 마이신과 아목시실린 모두의 경우 연속 농도 범위는 0.25 μg / mL - 8 μg / mL입니다.
- 빈 통제를 위해 항생제가없는 튜브 하나를 남겨 두십시오. 이는 항생제 처리 없이D2O처리로 박테리아 대사 활성을 검사하는 양성 대조군이 될 것이다.
- 음성 대조군을 위해 항생제가없고 D2O가없는 튜브 하나를 남겨 두십시오.
- 박테리아 분취량을 MHB 배지를 함유하는 특정 항생제 (겐타 마이신 또는 아목시실린)와 함께 1 시간 동안 배양한다.
- 배양 동안, 단계 2.6에서 제조된 항생제와 동일한 농도구배를 갖는 100%D2O함유 배지로 항생제의 연속 희석액을 준비한다. 겐타 마이신과 아목시실린 모두의 경우 연속 농도 범위는 0.25 μg / mL - 8 μg / mL입니다.
- 1시간 항생제 처리 후, 동일한 항생제 농도(단계 2.6에서 제조)의 항생제 전처리 박테리아 300μL에 각각 연속 희석된 항생제 700μL와 100%D2O함유 MHB 배지를 첨가한다.
- 예를 들어, 700μL의 100%D2O-함유 MHB 배지(8μg/mL의 항생제 함유)를 300μL의 8μg/mL 항생제 전처리 박테리아에 추가합니다. 동일한 방식으로 다음 농도의 해당 튜브로 옮기고 여러 번 위아래로 피펫팅하여 균질화합니다.
- 블랭크 대조군으로서 300μL의 무항생제 박테리아(단계 2.6.1에서 제조됨)에 700μL의 무항생제 100%D2O-함유 MHB 배지를 추가합니다.
- 200 rpm의 인큐베이션 쉐이커에서 37°C에서 추가 30분 동안 인큐베이션합니다.
참고: 이 단계에서, 시험용 배지 중D2O의 최종 농도는 70%이다.
- 먼저 항생제 1 mL와 D2O 처리된 박테리아 시료를6200x g 에서 4°C에서 5분 동안 원심분리한 다음, 정제수로 2회 세척하였다. 마지막으로 샘플을 10 % 포르말린 용액에 고정하고 4 ° C에서 보관하십시오.
3. 소변 환경에서 박테리아의 준비 (그림 2b)
- 대장 균 BW 25113을 로그 단계에서 준비하려면 1.4 및 1.5의 단계를 따르십시오.
- 600 nm의 파장에서 광도계로 OD를 측정하여 박테리아 농도를 확인하십시오.
- 임상 UTI 샘플14,18,41을 모방하려면 대장균 용액을 식별되지 않은 소변 10mL에 스파이크하여 최종 세포 농도 10 6 CFU/mL에 도달합니다.
- 5μm 필터를 사용하여 대장균 스파이크된 소변을 여과한 다음 300μL 분취량의 박테리아 용액을 7개의 1.5mL 마이크로 튜브로, 1개의 1.5mL 마이크로 튜브에 박테리아 용액의 600μL 분취량을 나눕니다.
- 항생제의 존재하에D2O혼입 처리를 수행하고 2.4 내지 2.10의 이전 단계에서 설명한 바와 같이 샘플 수집을 수행한다.
4. 혈액 환경에서 박테리아의 준비 (그림 2c)
- 녹 농균 ATCC 47085를 로그 단계에서 준비하려면 1.4 및 1.5의 단계를 따르십시오.
- 임상 혈류 감염 샘플42,43을 모방하기 위해 식별되지 않은 인간 혈액 1mL에 녹농균을 스파이크하여 107CFU/mL의 농도에 도달합니다.
- 혈액을 용해시키기 위해 멸균 정제수 9mL를 추가합니다.
- 녹농균 스파이크된 혈액을 5 μm 필터를 사용하여 여과한다. 그런 다음 4°C에서 5분 동안 6200 x g에서 원심분리하여 박테리아를 1mL 부피로 수확합니다. 미리 예열된 일반 MHB 9mL를 박테리아 용액에 넣고 부드럽게 소용돌이칩니다. 박테리아의 최종 농도는 106 CFU/mL입니다.
- 녹 농균 스파이크된 혈액 용액을 300μL 분취액으로 7개의 1.5mL 마이크로 튜브로 나누고, 600μL 분취량을 1.5mL 마이크로 튜브에 나눕니다.
- 항생제의 존재하에D2O혼입 처리를 수행하고 2.4 내지 2.10의 이전 단계에서 설명한 바와 같이 샘플 수집을 수행한다.
5. 단일 박테리아에서D2O대사 혼입의 SRS 이미징
- 고정 박테리아 용액 1mL를 정제수로 세척한 다음 6200 x g 에서 4°C에서 5분 동안 원심분리합니다. 상청액을 제거하십시오. 박테리아 용액을 약 20 μL로 농축한다.
- 박테리아 용액을 폴리 -L- 라이신 코팅 커버 글라스에 증착하십시오. SRS 이미징을 위해 샘플을 샌드위치하고 밀봉합니다.
- SRS 현미경을 사용하여 2168cm-1에서 C-D 진동 주파수에서 박테리아를 이미지화합니다.
- 컴퓨터의 제어 소프트웨어를 사용하여 펌프 파장을 852nm로 입력하고 조정합니다.
- 파워 미터를 사용하여 레이저 출력을 측정합니다. 레이저 출력 앞의 반파 플레이트를 조정하여 샘플에서 펌프 레이저의 출력을 ~8mW로 설정하고 샘플에서 Stokes 레이저의 출력을 ~40mW로 설정합니다.
참고: SRS 현미경에서 80MHz 반복률의 조정 가능한 펨토초 레이저는 펌프(680 - 1300nm) 및 Stokes(1045nm) 여기 레이저를 제공합니다.
- 반사 거울의 나사를 조정하여 펌프와 Stokes 빔을 공간적으로 정렬하고 두 빔을 레이저 스캐닝을 위한 2D 갈보 미러 시스템이 장착된 직립 현미경으로 향하게 합니다.
- 60x 수침 대물렌즈를 사용하여 펌프와 Stokes 레이저를 샘플에 집중시킵니다.
- 오일 콘덴서를 사용하여 샘플에서 정방향으로 신호를 수집합니다.
- 대역 통과 필터를 사용하여 Stokes 레이저를 포토 다이오드로 향하게하기 전에 필터링하십시오.
- 잠금 증폭기로 자극된 라만 신호를 추출하고 광 다이오드로 신호를 감지합니다.
- 소프트웨어의 제어판에서 각 SRS 이미지가 200 x 200 픽셀과 30μs 동안 픽셀 체류 시간을 포함하도록 설정합니다. 하나의 이미지에 대한 총 획득 시간은 ~1.2초입니다. 스텝 크기를 150nm로 설정하면 이미지 크기가 약 30 x 30μm2가 됩니다. 각 샘플에 대해 최소 3개의 보기 필드를 이미지화합니다.
6. 이미지 처리 및 데이터 분석 (그림 3)
- 평균 C-D 신호 강도를 얻으려면 ImageJ 소프트웨어로 SRS 이미지를 열고 처리하십시오.
- 먼저 이미지 | 클릭하여 SRS 이미지를 반전 된 색상의 8 비트 유형 이미지로 변환합니다. 유형 | 8비트 및 | 편집 ImageJ 소프트웨어의 버튼을 반전합니다.
- 그런 다음 프로세스 | 클릭하여 가우시안 블러로 이미지를 필터링합니다. 필터 | 가우스 흐림 버튼을 누르고 시그마(반지름) 를 1로 설정합니다.
- 이미지 임계값 조정을 사용하여 박테리아 영역을 선택합니다. 이미지 | 클릭 | 조정 선택한 박테리아 크기가 원본 SRS 이미지의 크기와 일치하는지 확인하기 위한 임계값입니다. 입자를 결정하기 위해 크기 임계값을 조정하여 작은 입자를 제거합니다. 적용을 클릭합니다.
- 분석 | 적용 입자 분석 버튼을 사용하여 박테리아의 영역을 표시하고 결정합니다.
- ROI 관리자에서 모두 표시 버튼을 클릭하여 처리되지 않은 원본 SRS 이미지에 레이블을 지정하고 동일한 박테리아 영역에 레이블을 지정하고 ROI 관리자에서 측정 버튼을 클릭하여 각 데이터 포인트의 평균 강도를 결정합니다.
- 원본 SRS 이미지의 배경 영역에 동그라미를 치고 배경의 평균 강도를 측정합니다. 각 박테리아의 평균 C-D 강도는 배경 신호 강도를 공제하여 얻습니다.
7. SC-MIC를 통한 항균 감수성 정량
참고: SC-MIC를 결정하기 위한 0.60에서의 컷오프 값은 다양한 농도의 약물 노출시 박테리아에 대한 대사 활성 및 대사 억제 조건의 SRS C-D 강도의 통계 분석에 따라 설정됩니다(40). 항생제 감수성 및 항생제 내성 그룹에 대한 C-D 강도는 정규 분포로 적합했습니다.
- 수신기 작동 특성(ROC) 곡선을 플로팅하고 차단 임계값을 0.60으로 평가합니다. 이러한 컷오프 값에 기초하여, 항생제의 효능의 지표로서 SC-MIC는 대사적으로 비활성 및 대사적으로 활성인 그룹을 결정하기 위해 정의될 수 있다.
- SRS 이미징 데이터를 정량적으로 분석하려면 연속적으로 희석된 항생제 농도로 처리된 각 박테리아 그룹에 대한 C-D 신호 강도의 히스토그램을 플로팅합니다. 색상이 지정된 데이터 포인트는 서로 다른 개별 박테리아를 나타냅니다.
- 항생제 처리군의 C-D 강도를 항생제 처리하지 않은 대조군의 평균 강도로 표준화합니다. 0.60의 컷오프 값을 사용하여 다양한 항생제 농도와 비교하여 C-D 영역의 SRS 신호 강도를 정량화하여 다양한 박테리아 및 항생제 조합의 SC-MIC 결과를 결정합니다.
- SC-MIC 판독값을 검증하고 기존 브로스 미세 희석 분석을 사용하여 측정된 MIC와 비교합니다.
- 임상 및 실험실 표준 연구소(CLSI)에 따르면 테스트된 각 박테리아 균주에 대한 SRS 대사 영상 결과를 기반으로 한 감수성 범주는 "감수성", "내성" 또는 "중간"으로 해석됩니다.
결과
중수소 혼입에 대한 배양 시간의 영향은 C-D (2070-2250 cm-1) 및 CH (2,800-3,100 cm-1) 영역에서 자발적 라만 미세 분광법으로 측정됩니다 (그림 4a). 70% D2O 함유 배지에서 배양된 녹농균의 타임랩스 단일 세포 라만 스펙트럼은 0분에서 180분까지의 배양 시간에 걸쳐 CD/CH 강도가 증가하는 것을 보여줍니다(그림 4b) 단일 미생물 세포에서 증가하는 C-D 풍부도는D2O가 세포 내부의 중수소화 생체분자에 통합됨을 보여줍니다.
50% 이상의D2O표지는 23시간 잠복기 동안 박테리아 대사에 유의하게 영향을 미친다27. 25시간 배양 기간 동안D2O표지 농도가 70% 이상일 때 박테리아 성장 억제를 관찰하였다(그림 S1). 우리는 금 표준 브로스 희석에 의해 MIC를 수행하였고, 2개의 녹농균 균주(P. 녹농균 ATCC 47085 및 P. aeruginosa 1133)에서 SC-MIC 결과를 얻었다(표 S1). 우리의 현재 결과는 70 % D2O가 녹농균에서 우리 방법의 성능에 영향을 미치지 않는다는 것을 보여줍니다. 당사의 SC-MIC 방법과 기존 배양 기반 방법의 범주 일치는 표 S1에 표시된 바와 같이 테스트된 모든 녹농균 및 항생제 조합에 대해 100%입니다. 우리는 이러한 양호한 일치가 SC-MIC 결정에서 30분 배양 기간 동안 녹농균에 대한 녹농균 상의 70%D2O의 최소 독성에 기인한다고 생각한다.
프로토콜에 따라, 녹농균을 1 시간 동안 연속적으로 희석 된 겐타 마이신과 함께 인큐베이션 한 다음, 70 % D2O를 추가 30 분 동안 배양 하였다. ~ 2168 cm-1 (그림 5a)에서 SRS 대사 영상이 수행되었다. 항생제 치료시 C-D 강도는 항생제 치료를받지 않은 대조군의 평균값으로 나뉩니다. 정량적 통계 분석(그림 5b)에 따르면 녹농균 의 C-D 신호는 겐타마이신 처리(0μg/mL)를 처리하지 않은 경우보다 2μg/mL 이상의 겐타마이신 농도에서 유의하게 낮았습니다. 0.60의 컷오프 역치를 사용하여 녹농균은 2μg/mL 이상의 겐타마이신 농도에서 대사적으로 억제되었습니다. 점선은 그림 5b에서 0.60에서 정의된 컷오프 값을 보여줍니다. 이와 같이, 정상 MHB 배지에서 겐타마이신에 대한 녹농균에 대한 SC-MIC는 2μg/mL로 측정되었다. 이 SC-MIC 값은 브로스 미세 희석 방법으로 측정된 MIC(4μg/mL)와의 1배 차이 범위 내에 있는 것으로 확인됩니다(그림 5c). 종합하면, 당사의 기술로 결정된 SC-MIC는 항균 감수성의 정량화를 가능하게 합니다.
임상 적용, 특히 가장 널리 퍼진 UTI 감염에 대한 중수소 대사 통합의 SRS 이미징에 의한 신속한 AST의 잠재력을 탐구하기 위해 UTI 감염을 유발하는 가장 흔한 병원체인 대장균을 사용하여 박테리아가 급증한 소변 샘플을 테스트했습니다44. 관련 박테리아 농도에서 임상 UTI 샘플을 모방하기 위해 E. coli는 식별되지 않은 소변에 최종 농도 106 CFU / mL로 추가됩니다. 샘플 정제 후, 소변 샘플을 아목시실린 및D2O와 함께 인큐베이션하였다. SRS 이미지의 깨끗한 배경은 샘플 준비 프로토콜이 신속한 AST 측정에 적용 가능하다는 것을 보여주었습니다(그림 5d). 아목시실린에 대한 대장균 스파이크 소변 샘플에 대한 SC-MIC는 4μg/mL(그림 5e)로 측정되었으며, 이는 정상 MHB 배지에서 순수한 대장균에 대한 기존의 브로스 희석 방법에 의해 MIC(8μg/mL)와 동일한 감수성 판독값을 갖습니다(그림 5f). 이러한 결과는 중수소 대사 혼입의 SRS 영상화에 의한 신속한 AST가 UTI 감염성 병원체에 대한 임상 진단에 큰 잠재력을 가지고 있음을 총체적으로 보여주었습니다.
UTI 감염과 비교할 때 BSI 병원체에 대한 빠른 AST는 혈액에 존재하는 많은 혈액 세포와 같이 박테리아 대사 활동에 대한 현장 연구에서 훨씬 더 어렵습니다. 임상 BSI 샘플에 대한D2O대사 혼입의 SRS 영상화에 의한 신속한 AST의 적용가능성을 조사하기 위해, 비식별화된 인간 혈액에서 스파이크된 녹농균이 검출되었다. 도 5g에 도시된 바와 같이, 2168 cm-1에서의 SRS 이미지의 C-D 강도는 박테리아 신호에 의해 지배되었다. 적혈구는 추가 생합성을 위해D2O를 흡수하는 대사 활성을 갖지 않기 때문에, C-D 신호는 살아있는 박테리아의 대사성 중수소 혼입으로부터 유래하였다. 파편 또는 적혈구 종의 교차 위상 변조 또는 광열 신호는 SC-MIC의 정량 분석에 영향을 미치지 않고 약한 배경 신호에 기여했습니다. 혈액 내 녹농균에 대한 SC-MIC 결과는 2μg/mL로 결정되었으며(그림 5h), 이는 정상 성장 배지에서 녹농균에 대한 기존의 표준 MIC 결과와 잘 일치했습니다(그림 5i). 종합하면, 이들 결과는 중수소 대사 혼입의 SRS 대사 영상화가 BIS 감염에서 박테리아에 대한 SC-MIC를 결정하는 신속한 AST 방법이 될 수 있음을 보여주었다.
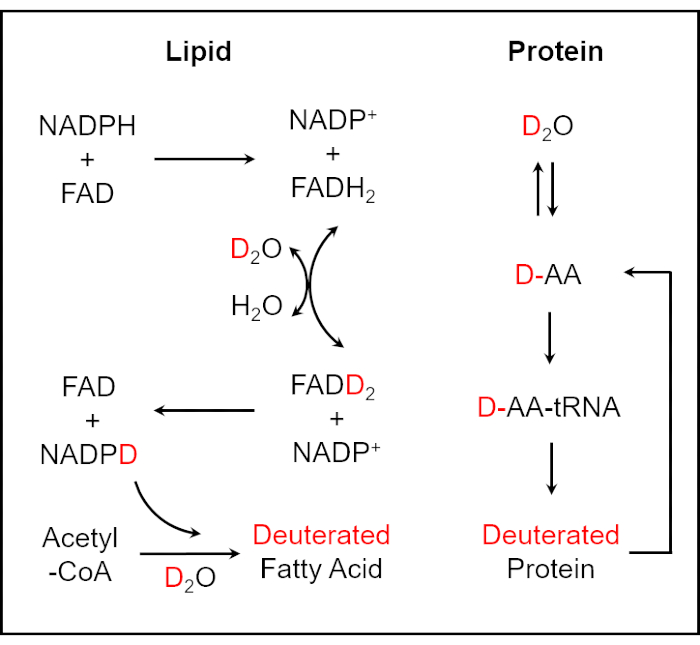
그림 1: 중수소화 지질과 단백질25,26으로의D2O혼입 계획. 중수소는 NADPH의 산화 환원 활성 수소 원자와 D2O의 D 원자 사이의 효소 촉매 H / D 교환 반응을 통해 세포 내부의 바이오 매스에 통합 될 수 있습니다. 중수 소화 지방산 합성 반응은 중수소 표지 NADPH에 의해 매개됩니다. 아미노산의 반응으로의D2O혼입은 중수소화 단백질 생산을 초래한다. 이 그림은 ref.40에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
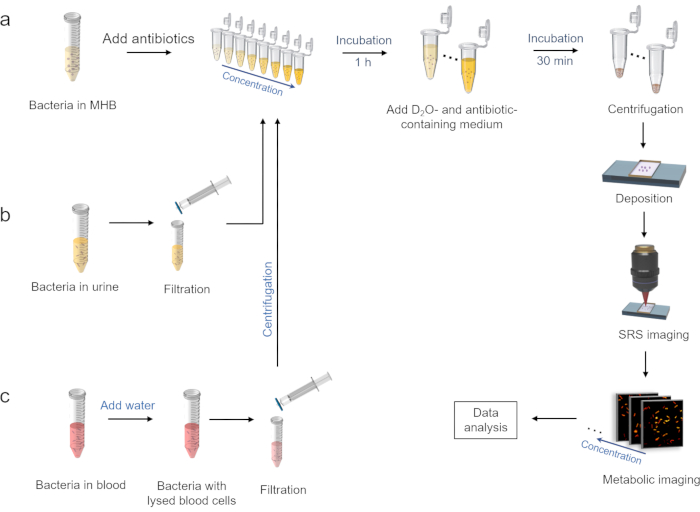
그림 2: 중수소 혼입의 SRS 대사 영상에 의한 신속한 AST의 워크플로우. (a) MHB 배지 중의 항생제의 존재 하에D2O혼입 처리, 및 다음의 SRS 영상화 절차. (b) 소변 환경에서 박테리아의 준비. (c) 혈액 환경에서 박테리아의 준비. 이 그림은 ref.40에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
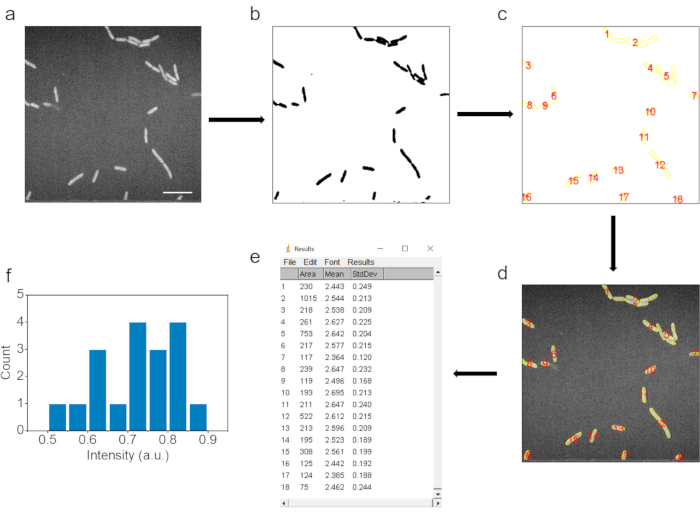
그림 3. 자동화된 이미지 처리 및 데이터 해석. (a) 원시 SRS 이미지. (b) 박테리아 세포의 면적을 결정하기 위한 강도 역치 조정 후 이미지. (c) 입자 분석 단계 후에 선택된 데이터 포인트. (d) 해당 데이터 포인트가 원시 이미지에서 선택됩니다. (e) 원시 이미지에서 해당 데이터 포인트의 결과. (f) 배경 뺄셈 후 데이터 포인트의 평균 강도에 대한 통계 결과. 스케일 바: 10 μm. 이 그림은 ref.40에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4. 박테리아로의 중수소 혼입에 대한 배양 시간의 영향. (a) 자발적 라만 미세 분광법 (20 스펙트럼에서 평균)에 의한 C-D (2070-2250 cm-1) 및 CH (2,800-3,100 cm-1) 영역에서의 타임 랩스 측정. (b) (a)에서 박테리아에 대한D2O배양 시간에 대한 CD/CH 강도비 플롯의 히스토그램 플롯. 각 컬러 포인트는 단일 박테리아의 측정을 나타냅니다. 오차 막대는 평균(SEM)의 표준 오차를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 정상 배지, 소변 및 혈액 환경에서 항생제에 대한D2O의 박테리아 대사 혼입의 SRS 이미징을 사용한 SC-MIC 측정. (a) C-D 진동 (2168 cm-1)에서의 SRS 이미징 및 정상 MHB 배지에 연속 희석 된 겐타 마이신을 첨가하여 D2O의 존재하에 녹농균의 상응하는 투과 이미지. (b) (a)에서 녹농균의 SRS C-D 강도의 정량 분석. 히스토그램의 색상이 지정된 데이터 포인트는 다른 개별 박테리아를 나타냅니다. 점선은 0.60에서의 컷오프 값을 나타냅니다. (c) CLSI에 따른 녹농균에 대한 SC-MIC 판독과 브로스 미세 희석 방법에 의한 MIC의 비교 및 감수성 범주. (d) C-D 진동 (2168 cm-1)에서의 SRS 이미징 및 연속적으로 희석 된 아목시실린으로 D2O에서 배양 한 후 소변에서 대장균의 상응하는 투과 이미지. (e) (d)에서 SRS C-D 강도의 정량 분석. (f) 정상 MHB와 소변에서 대장균에 대한 SC-MIC 판독 및 감수성 범주의 비교. (g) C-D 진동 (2168 cm-1)에서의 SRS 이미징 및 연속적으로 희석 된 겐타 마이신과 함께 D2O에서 배양 한 후 혈액 내 녹농균의 상응하는 투과 이미지. (h) (g)에서 SRS C-D 강도의 정량 분석. (i) 정상 MHB와 혈액에서 녹농균에 대한 SC-MIC 판독 및 감수성 범주의 비교. S : 민감합니다. 그룹당 셀 수 N ≥ 10개입니다. 오차 막대는 SEM을 나타냅니다. 스케일 바: 10 μm. 이 그림은 ref.40에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 문제 | 가능한 이유 | 용액 |
| 이미징 시야에서 박테리아 세포 수가 거의 또는 전혀 없음 | 용액의 박테리아 밀도가 너무 낮습니다. | 박테리아를 더욱 풍부하게하기 위해 더 오랜 시간 동안 원심 분리기 |
| SRS 이미징 중 박테리아 세포의 광손상 | 사용된 레이저 출력이 너무 높습니다. | 레이저 출력을 적절한 값으로 조정 |
| 감지할 수 있는 SRS 신호가 없습니다. | 펌프와 Stokes 빔의 공간적, 시간적 중첩이 최적화되지 않았습니다. | 표준 시료 중수소화 디메틸설폭사이드를 사용하여 펌프와 Stokes 빔을 정렬합니다. |
표 1: 문제 해결 표.
그림 S1 :D2O농도가 다른 Lauria-Bertani (LB) 배지에서 배양 된 녹농균에 대한 D2O 독성 테스트. 오차 막대는 표준 편차 값(측정 개수 = 5)을 나타냅니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
표 S1. 항생제 치료시 녹농균의 정상 MHB에서 SC-MIC와 MIC의 비교. S: 민감한; R: 내성; I: 중급. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
신속한 AST는 샘플에서 SC-MIC 결과까지 2.5시간 이내에 단일 세포 SRS 대사 영상을 사용하여 항생제 치료에 대한 박테리아 대사 활성의 반응을 평가함으로써 얻을 수 있습니다. 박테리아 대사 활성 및 항미생물 감수성의 반응은 C-D 결합의 SRS 이미징을 사용하여 생체 분자 합성을 위한D2O의 대사 혼입을 모니터링함으로써 검출될 수 있다. 물은 살아있는 세포에서 어디에나 사용되기 때문에 SRS 대사 영상은 신속한 AST를위한 보편적 인 방법을 제공합니다. 신속한 AST 방법은 단일 박테리아 수준에서 소변이나 전혈과 같은 복잡한 생물학적 환경에서 박테리아를 검출하는 데 적용 할 수 있습니다. SC-MIC는 소변 및 혈액에서 박테리아의 1.5시간 배양 후 측정할 수 있으며, 이는 UTI 및 BSI 진단의 패러다임을 시간 소모적인 배양 의존적 절차에서 배양 독립적인 현장 접근 방식으로 전환하는 혁신적인 것으로 간주됩니다. 따라서 기존의 브로스 미세 희석 방법에 비해 진단 시간이 크게 단축되어 정확한 치료를 위한 적절한 항균제를 적시에 식별할 수 있는 임상 번역이 가능합니다.
여기에 설명된 항생제 치료를 위한 프로토콜은 제안된 MHB 배지가 일반적으로 다양한 미생물의 배양에 사용될 수 있는 CLSI의 지침을 따릅니다. 핵심 파라미터는 항균 감수성 테스트에 사용되는 박테리아 세포 수가 CLSI에서 권장하는 대로 약 5 x 105 CFU/mL로 유지된다는 것입니다. 이는 정확하고 재현 가능한 결과를 얻는 데 매우 중요합니다. 항생제 처리 실험에서 박테리아 농도는 8 x 105 CFU/mL로 설정됩니다. 박테리아 농도가 높을수록 MIC 결과가 증가할 수 있습니다. 박테리아 현탁액이 조정되면 박테리아 세포 농도의 변화를 피하기 위해 30분 이내에 사용해야 합니다.
daptomycin과 같은 항생제의 감수성 검사를 위해 배지에서 칼슘 50mg / L를 보충하는 것이 좋습니다. 양이온 조정 MHB 배지는 20-25 mg / L의Ca 2+를 함유한다. 따라서 배지에 30mg/L 농도의 추가Ca2+ (물에 용해되고 필터 멸균)가 추가로 보충되었는지 확인하십시오.
제시된 방법에서 또 다른 중요한 단계는 항생제 노출 및D2O혼입시 박테리아의 배양 시간이다. 박테리아 수명주기의 생성 시간은 대략 30-60 분이므로 특정 시간 동안 항생제 노출시 박테리아 대사 활동에 영향을 미치는 것이 중요합니다. 이 시험은 0.5 hD2O처리 전 1 시간 동안 항생제 노출에 대한 다양한 박테리아-항생제 조합에 대해 평가되었다. 처음 1 시간 항생제 치료 단계는 박테리아 대사 활동에 영향을 미치는 데 필수적입니다. 다음에, 박테리아를 추가의 30분 동안D2O-함유 및 항생제-함유 배지와 함께 인큐베이션한다. 최종 항생제 농도는 동일한 수준으로 유지되고,D2O의 최종 농도는 70%로 조정된다. 전반적으로, 1 시간 항생제 예비배양 후 및 0.5 시간의D2O및 항생제 혼입 후, SC-MIC 결과는 박테리아 대사 활성의 SRS 대사 영상화에 의해 결정된다. 이러한 설계는 박테리아에 대한 항미생물 활성의D2O영향의 영향을 최소화하고, 또한 종래의 방법에 의한 MICs와 SC-MIC 결과의 비교 가능한 판독을 유도한다.
SC-MIC 측정에서 우리는 각각 8 가지 농도의 5 가지 항생제를 포함하여 40 개의 샘플을 동시에 준비합니다. 그러나 수동 조작 절차가 많기 때문에 5가지 다른 박테리아-항생제 조합에 대한 AST를 검출하기 위한 총 분석 시간은 2.5시간보다 깁니다. 우리의 방법에서, ~ 20 개의 개별 박테리아 세포를 포함하는 각 SRS 이미지는 30 μs 픽셀 체류 시간에 한 번의 샷으로 ~ 1.0 초 이내에 얻어졌습니다. 우리는 하나의 박테리아 균주에 대해 10개의 항생제를 연구하는 데 걸리는 총 AST 분석 시간이 샘플에서 SC-MIC 판독까지 2.5시간 미만일 것으로 추정하며, 이는 높은 처리량 측정을 수행할 수 있는 엄청난 가능성이 있습니다. 향후 작업에서는 처리량을 더욱 향상시키기 위해 자동화된 샘플 준비 및 이미징 데이터 수집 방법이 사용될 것입니다. 문제 해결 세부 정보는 표 1에 나와 있습니다.
기존의 배양 기반 AST 방법에서는 추가 측정을 위해 박테리아 분리물을 얻으려면 임상 표본을 몇 시간 동안 사전 배양해야 합니다. 라만 분광법29, 나노리터 어레이6 및 디지털 핵산 정량18과 같은 임상 UTI 샘플에 대한 고급 AST 방법은 오랜 시간 사전 배양을 제거하기 위해 개발되었습니다. UTI 감염과 비교할 때 BSI 또는 패혈증은 훨씬 더 생명을 위협합니다18,45, 클리닉에서 정확한 진단을 위해 신속한 AST가 시급히 필요합니다. 양성 혈액 배양물로부터 박테리아 콜로니 형성을 측정하기 위한 현미경 이미징 방법이 MIC 결과46을 제공하는 것으로 보고되었다. 그러나 AST 분석을 수행하기 위해 박테리아를 성장시키는 데 최소 6시간이 걸립니다. 더욱이, 상업적 자동 시스템(47) 및 질량 분석법(48,49) 전략은 양성 혈액 배양으로부터 AST 판독값을 제공할 수 있다. 그러나 임상 결정에 대한 MIC 결과는 제공 할 수 없습니다. AST 결과 및 MIC 판독은 클리닉에서 잠재적인 부작용을 일으키는 환자에게 항생제의 과량 투여를 피하고, 항생제 내성 감염50,51의 확산을 늦추고 방지하는데 유의하다. 기존의 자발적 라만 현미경 기반 AST 분석법과 비교할 때, 당사의 기술은 대규모 신호 향상으로 인해 데이터 수집 시간(약 600배 감소)을 크게 단축합니다. 이 연구에서 우리는 소변 또는 전혈 환경에서 임상 적으로 관련된 박테리아 농도 (105 ~ 106 CFU / ml)에서 단일 박테리아의 중수소 대사에 대한 SRS 이미징을 통해 신속한 AST를 입증합니다. 이전 결과에서 보는 바와 같이, MIC 결과는 1시간 항생제 처리 및D2O및 항생제 혼합물의 30분 혼합물 및 소변 및 혈액에서 박테리아 내로 배양한 후에 결정된다. 당사의 방법은 2.5시간 이내에 각 균주-항생제 조합에 대한 MIC 및 감수성 분류를 제공할 수 있으므로 임상 번역에 새로운 길을 열어줍니다. 요약하면, 사전 배양 및 박테리아 분열이 필요 없는 당사의 방법은 전염병에서 빠르고 처리량이 많은 AST 분야에서 엄청난 잠재력을 가지고 있습니다.
SRS 대사 영상에 의한 당사의 SC-MIC 방법은 MIC를 검출하고 임상 사용을 위한 다양한 종류의 균주-항생제 조합을 처리할 때 감염성 병원체에 대한 감수성 분류를 제공하는 데 적용할 수 있습니다. SC-MIC는 소변과 혈액에서 박테리아에D2O가 혼입된 후 30분 후에 측정되며, 이는 사전 배양에 16-24시간이 소요되는 기존의 브로스 희석 방법에 비해 진단 시간이 크게 단축됨을 의미합니다. 임상 의사 결정을 위한 병원체 식별 정보를 전달하기 위해, SRS 대사 영상 기술은 매트릭스-보조 레이저 탈착 이온화-비행 시간 질량 분석법(49,52,53)과 같은 신속한 병원체 식별이 가능한 진단 플랫폼과 더욱 통합될 수 있다. 현장 병원체 식별과 신속한 AST 진단을 결합하면 정확한 치료를 위해 적절한 항균제를 적시에 식별할 수 있는 클리닉으로 번역할 수 있는 큰 잠재력이 될 수 있습니다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
이 작업은 NIH R01AI141439에서 J.-X.C 및 M.S로, R35GM136223에서 J.-X.C.로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acousto-optic modulation | Gooch&Housego | R15180-1.06-LTD | Modulating stokes laser beam |
| Amoxicillin | Sigma Aldrich | A8523-5G | |
| Bandpass filter | Chroma | HQ825/150m | Block the stokes laser beam before the photodiode |
| Calcium chloride | Sigma Aldrich | C1016-100G | Cation adjustment |
| Cation-adjusted Mueller-Hinton Broth | Fisher Scientific | B12322 | Antimicrobial susceptibility testing of microorganisms by broth dilution methods |
| Centrifuge | Thermo Scientific | 75002542 | |
| Cover Glasses | VWR | 16004-318 | |
| Culture tube with snap cap | Fisher brand | 149569B | |
| Daptomycin | Acros | A0386346 | |
| Deuterium oxide | 151882 | Organic solvent to dissolve antibiotics | |
| Deuterium oxide-d6 | Sigma Aldrich | 156914 | Organic solvent as a standard to calibrate SRS imaging system |
| Escherichia coli BW 25113 | The Coli Genetic Stock Center | 7636 | |
| Eppendorf polypropylene microcentrifuge tubes 1.5 mL | Fisher brand | 05-408-129 | |
| Gentamicin sulfate | Sigma Aldrich | G4918 | |
| Hydrophilic Polyvinylidene Fluoride filters | Millipore-Sigma | SLSV025NB | pore size 5 µm |
| ImageJ software | NIH | Version: 2.0.0-rc-69/1.52t | Image processing and analysis |
| Incubating orbital shaker set at 37 °C | VWR | 97009-890 | |
| Inoculation loop | Sigma | BR452201-1000EA | |
| InSight DeepSee femtosecond pulsed laser | Spectra-Physics | Model: insight X3 | Tunable laser source and fixed laser source at 1045 nm for SRS imaging |
| Lock-in amplifier | Zurich Instrument | HF2LI | Demodulate the SRS signals |
| Oil condenser | Olympus | U-AAC | NA 1.4 |
| Pseudomonas aeruginosa ATCC 47085 (PAO1) | American Type Culture Collection | ATCC 47085 | |
| Photodiode | Hamamatsu | S3994-01 | Detector |
| Polypropylene conical tube 15 mL | Falcon | 14-959-53A | |
| Polypropylene filters | Thermo Scientific | 726-2520 | pore size 0.2 µm |
| Sterile petri dishes | Corning | 07-202-031 | |
| Syringe 10 mL | Fisher brand | 14955459 | |
| UV/Vis Spectrophotometer | Beckman Coulter | Model: DU 530 | Measuring optical density at wavelength of 600 nm |
| Vortex mixer | VWR | 97043-562 | |
| Water objective | Olympus | UPLANAPO/IR | 60×, NA 1.2 |
참고문헌
- O'Neill, J. Tackling drug-resistant infections globally: final report and recommendations. The review on Antimicrobial Resistance. , (2016).
- Sugden, R., Kelly, R., Davies, S. Combatting antimicrobial resistance globally. Nature Microbiology. 1 (10), 16187 (2016).
- Kumar, A., et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Critical Care Medicine. 34 (6), 1589-1596 (2006).
- Reller, L. B., Weinstein, M., Jorgensen, J. H., Ferraro, M. J. Antimicrobial susceptibility testing: a review of general principles and contemporary practices. Clinical Infectious Diseases. 49 (11), 1749-1755 (2009).
- Frickmann, H., Masanta, W. O., Zautner, A. E. Emerging rapid resistance testing methods for clinical microbiology laboratories and their potential impact on patient management. BioMed Research International. 2014, 375681 (2014).
- Avesar, J., et al. Rapid phenotypic antimicrobial susceptibility testing using nanoliter arrays. Proceedings of the National Academy of Sciences. 114 (29), 5787-5795 (2017).
- Schoepp, N. G., et al. Digital quantification of DNA replication and chromosome segregation enables determination of antimicrobial susceptibility after only 15 minutes of antibiotic exposure. Angewandte Chemie International Edition. 55 (33), 9557-9561 (2016).
- van Belkum, A., et al. Innovative and rapid antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 18 (5), 299-311 (2020).
- Hou, Z., An, Y., Hjort, K., Sandegren, L., Wu, Z. Time lapse investigation of antibiotic susceptibility using a microfluidic linear gradient 3D culture device. Lab on a Chip. 14 (17), 3409-3418 (2014).
- Choi, J., et al. Rapid antibiotic susceptibility testing by tracking single cell growth in a microfluidic agarose channel system. Lab on a Chip. 13 (2), 280-287 (2013).
- Lu, Y., et al. Single cell antimicrobial susceptibility testing by confined microchannels and electrokinetic loading. Analytical Chemistry. 85 (8), 3971-3976 (2013).
- Kim, S. C., Cestellosblanco, S., Inoue, K., Zare, R. N. Miniaturized antimicrobial susceptibility test by combining concentration gradient generation and rapid cell culturing. Antibiotics. 4 (4), 455-466 (2015).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Baltekin, &. #. 2. 1. 4. ;., Boucharin, A., Tano, E., Andersson, D. I., Elf, J. Antibiotic susceptibility testing in less than 30 min using direct single-cell imaging. Proceedings of the National Academy of Sciences. 114 (34), 9170-9175 (2017).
- Fredborg, M., et al. Real-time optical antimicrobial susceptibility testing. Journal of Clinical Microbiology. 51 (7), 2047-2053 (2013).
- Choi, J., et al. A rapid antimicrobial susceptibility test based on single-cell morphological analysis. Science Translational Medicine. 6 (267), (2014).
- Barczak, A. K., Hung, D. T. RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities. Proceedings of the National Academy of Sciences. 109 (16), 6217-6222 (2012).
- Schoepp, N. G., et al. Rapid pathogen-specific phenotypic antibiotic susceptibility testing using digital LAMP quantification in clinical samples. Science Translational Medicine. 9 (410), (2017).
- Novelli-Rousseau, A., et al. Culture-free antibiotic-susceptibility determination from single-bacterium Raman spectra. Scientific Reports. 8 (1), 1-12 (2018).
- Schröder, U. -. C., et al. Detection of vancomycin resistances in enterococci within 3 1/2 hours. Scientific Reports. 5, 8217 (2015).
- Liu, C. -. Y., et al. Rapid bacterial antibiotic susceptibility test based on simple surface-enhanced Raman spectroscopic biomarkers. Scientific Reports. 6 (1), 1-15 (2016).
- Chang, K. -. W., et al. Antibiotic susceptibility test with surface-enhanced raman scattering in a microfluidic system. Analytical Chemistry. 91 (17), 10988-10995 (2019).
- Galvan, D. D., Yu, Q. surface-enhanced raman scattering for rapid detection and characterization of antibiotic-resistant bacteria. Advanced Healthcare Materials. 7 (13), 1701335 (2018).
- Kirchhoff, J., et al. Simple ciprofloxacin resistance test and determination of minimal inhibitory concentration within 2 h using raman spectroscopy. Analytical Chemistry. 90 (3), 1811-1818 (2018).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nature Communications. 9 (1), 2995 (2018).
- Berry, D., et al. Tracking heavy water (D2O) incorporation for identifying and sorting active microbial cells. Proceedings of the National Academy of Sciences. 112 (2), 194-203 (2015).
- Tao, Y., et al. Metabolic-activity-based assessment of antimicrobial effects by D2O-labeled single-cell raman microspectroscopy. Analytical Chemistry. 89 (7), 4108-4115 (2017).
- Yang, K., et al. Rapid antibiotic susceptibility testing of pathogenic bacteria using heavy water-labeled single-cell raman spectroscopy in clinical samples. Analytical Chemistry. 91 (9), 6296-6303 (2019).
- Song, Y., et al. Raman-Deuterium Isotope Probing for in-situ identification of antimicrobial resistant bacteria in Thames River. Scientific reports. 7 (1), 16648 (2017).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Cheng, J. -. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), (2015).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17, 415-445 (2015).
- Yue, S., Cheng, J. -. X. Deciphering single cell metabolism by coherent Raman scattering microscopy. Current Opinion in Chemical Biology. 33, 46-57 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Ji, M., et al. Rapid, Label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- He, R., Liu, Z., Xu, Y., Huang, W., Ma, H., Ji, M. Stimulated Raman scattering microscopy and spectroscopy with a rapid scanning optical delay line. Optics Letters. 42 (4), 659-662 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences. 116 (32), 15842-15848 (2019).
- Camp, C. H., et al. High-Speed Coherent Raman Fingerprint Imaging of Biological Tissues. Nature Photonics. 8, 627-634 (2014).
- Zhang, M., et al. Rapid determination of antimicrobial susceptibility by stimulated raman scattering imaging of D2O metabolic incorporation in a single bacterium. Advanced Science. 7 (19), 2001452 (2020).
- Michael, I., et al. A fidget spinner for the point-of-care diagnosis of urinary tract infection. Nature Biomedical Engineering. 4 (6), 591-600 (2020).
- Bhattacharyya, R. P., et al. Simultaneous detection of genotype and phenotype enables rapid and accurate antibiotic susceptibility determination. Nature Medicine. 25 (12), 1858-1864 (2019).
- Stupar, P., et al. Nanomechanical sensor applied to blood culture pellets: a fast approach to determine the antibiotic susceptibility against agents of bloodstream infections. Clinical Microbiology and Infection. 23 (6), 400-405 (2017).
- Barber, A. E., Norton, J. P., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Cohen, J., et al. Sepsis: a roadmap for future research. The Lancet Infectious Diseases. 15 (5), 581-614 (2015).
- Choi, J., et al. rapid antimicrobial susceptibility test from positive blood cultures based on microscopic imaging analysis. Scientific Reports. 7 (1), 1148 (2017).
- Gherardi, G., et al. Comparative evaluation of the Vitek-2 Compact and Phoenix systems for rapid identification and antibiotic susceptibility testing directly from blood cultures of Gram-negative and Gram-positive isolates. Diagnostic Microbiology and Infectious Disease. 72 (1), 20-31 (2012).
- Machen, A., Drake, T., Wang, Y. F. Same day identification and full panel antimicrobial susceptibility testing of bacteria from positive blood culture bottles made possible by a combined lysis-filtration method with MALDI-TOF VITEK mass spectrometry and the VITEK2 system. Plos One. 9, 87870 (2014).
- Simon, L., et al. Direct identification of 80 percent of bacteria from blood culture bottles by matrix-assisted laser desorption ionization-time of flight mass spectrometry using a 10-minute extraction protocol. Journal of Clinical Microbiology. 57 (2), 01278 (2019).
- Leekha, S., Terrell, C. L., Edson, R. S. General principles of antimicrobial therapy. Mayo Clinic Proceedings. 86 (2), 156-167 (2011).
- Johnson, L., et al. Emergence of fluoroquinolone resistance in outpatient urinary Escherichia coli isolates. The American Journal of Medicine. 121 (10), 876-884 (2008).
- Van Belkum, A., et al. Developmental roadmap for antimicrobial susceptibility testing systems. Nature Reviews Microbiology. 17 (1), 51-62 (2019).
- Dubourg, G., Lamy, B., Ruimy, R. Rapid phenotypic methods to improve the diagnosis of bacterial bloodstream infections: meeting the challenge to reduce the time to result. Clinical Microbiology and Infection. 24 (9), 935-943 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유