Method Article
Kemik iliği kaynaklı makrofajların izolasyonu, kültürü, polarizasyonu ve glikolitik karakterizasyonu için kapsamlı bir yüksek verimli protokol
Bu Makalede
Özet
Bu protokol, canlı kemik iliği kaynaklı makrofajların (BMDM'ler) izolasyonu, kültürü, polarizasyonu ve glikolitik metabolik durumunun ölçümü için ayrıntılı ve kapsamlı yöntemler sağlar. Bu makale, BMDM'lerin gerçek zamanlı olarak iş akışı ve glikolitik değerlendirmesi için gerçekçi görsel çizimlerle adım adım talimatlar sağlar.
Özet
Makrofajlar en önemli antijen sunan hücreler arasındadır. Makrofajların birçok alt kümesi, benzersiz metabolik imzalarla tanımlanmıştır. Makrofajlar genellikle M1 benzeri (inflamatuar) ve M2 benzeri (antienflamatuar) alt tipler olarak sınıflandırılır. M1 benzeri makrofajlar, LPS ve / veya INF-γ, IL-12 ve IL-2 gibi pro-inflamatuar sitokinler tarafından aktive edilen pro-inflamatuar makrofajlardır. M1 benzeri polarize makrofajlar, konağın çeşitli bakteri ve virüslere karşı savunmasına aracılık ederek çeşitli hastalıklarda rol oynar. Bu, LPS'nin neden olduğu M1 benzeri makrofajları ve enflamatuar hastalıklardaki metabolik durumlarını incelemek için çok önemlidir. M2 benzeri makrofajlar, anti-inflamatuar sitokinler ve stimülatörler tarafından aktive edilen anti-inflamatuar makrofajlar olarak kabul edilir. Pro-inflamatuar durum altında, makrofajlar glikolitik fonksiyonda artmış glikoliz gösterir. Glikolitik fonksiyon, hücre dışı akı (XF) analizörleri kullanılarak glikoliz, glikolitik kapasite, glikolitik rezerv, telafi edici glikoliz veya glikolitik olmayan asitleştirme bağlamında aktif olarak araştırılmıştır.
Bu makale, kemik iliğinden türetilmiş makrofajlar (BMDM'ler) solunum yaparken, tüketirken ve enerji üretirken glikolitik durumların takip etmesi kolay adımlarla gerçek zamanlı olarak nasıl değerlendirileceğini göstermektedir. Bu protokolde spesifik glikoliz inhibitörleri ve aktivatörleri kullanarak, hücrelerdeki glikolitik metabolik süreçlerin sistemik ve eksiksiz bir görünümünün nasıl elde edileceğini ve daha doğru ve gerçekçi sonuçların nasıl sağlanacağını gösteriyoruz. Birden fazla glikolitik fenotipi ölçebilmek için, BMDM'lerin polarizasyon değerlendirmesi için kolay, hassas, DNA tabanlı bir normalizasyon yöntemi sunuyoruz. BMDM'lerin fenotipinin ve metabolik durumunun kültürlenmesi, aktivasyonu / polarizasyonu ve tanımlanması, birçok farklı hastalık türünün araştırılmasına yardımcı olabilecek çok önemli tekniklerdir.
Bu yazıda, saf M0 makrofajlarını sırasıyla LPS ve IL4 ile M1 benzeri ve M2 benzeri makrofajlara polarize ettik ve hücre dışı akı analizi ve glikolitik aktivatörler ve inhibitörler kullanarak BMDM'lerde gerçek zamanlı ve zaman içinde uzunlamasına kapsamlı bir glikolitik parametre seti ölçtük.
Giriş
Makrofajlar, doğuştan gelen bağışıklık sistemi M1'in en kritik hücrelerinden biridir. Bulaşıcı hastalıkların, fagositozun, antijen sunumunun ve inflamasyonun düzenlenmesinde rol oynarlar2. Ayrıca, makrofajların salgıladıkları çeşitli sitokinler aracılığıyla diğer bağışıklık hücrelerini düzenlemeleri gerekir3. Makrofaj fenotiplerinde büyük bir spektrum vardır4. Makrofajların maruz kaldığı sinyallere bağlı olarak, farklı enflamatuar ve metabolik durumlara doğru polarize olurlar5. Makrofajlar, makrofajların hangi dokuda bulunduğuna bağlı olarak çeşitli hastalıklarda metabolik değişiklikler gösterir6. Polarize makrofajlar, glikolitik metabolizmalarını, lipid metabolizmalarını, amino asit metabolizmalarını ve mitokondriyal oksidatif fosforilasyonlarını (OXPHOS) yeniden programlama veya değiştirme yeteneğine sahiptir7,8. Klasik olarak aktive edilmiş M1 benzeri makrofajlar ve alternatif olarak aktive edilmiş M2 benzeri makrofajlar, makrofajların en çok çalışılan iki fenotipidir3. Aktive edilmemiş hareketsiz makrofajlar M0 makrofajları olarak adlandırılır. M0 makrofajlarının M1 benzeri bir fenotipe doğru polarizasyonu, naif BMDM'lerin bakteriyel lipopolisakkarit (LPS) ile uyarılmasıyla indüklenebilir9. PI3K-AKT-mTOR-HIF1a sinyal yolu, enflamatuar sitokinler, interferon-gama (IFN γ,) veya tümör nekroz faktörü (TNF)10 varlığında makrofajlarda aktive edilebilir. M1 benzeri makrofajlar, glikoliz metabolizması seviyelerinde artışa, oksidatif fosforilasyon (OXPHOS) seviyelerinde azalmaya, bulaşıcı ve enflamatuar hastalıklarda rol oynayan inflamatuar sitokinler üretmeyesahiptir 8. Öte yandan, M2 benzeri fenotipe doğru polarizasyon, İnterlökin (IL)-4, JAK-STAT, PPAR ve AMPK yolları yoluyla veya (IL)-13 ve TGFβ yolları11,12 ile indüklenebilir.
M1 benzeri makrofajların aksine, M2 benzeri makrofajlar glikolizi azaltmış ve OXPHOS'u arttırmıştır ve anti-parazitik ve doku onarım aktivitelerinde rol oynarlar 8,13. BMDM'ler, kemik iliği kök hücrelerinden türetilen makrofajların incelenmesi için yaygın olarak kullanılan bir sistemdir. Glikoliz ve OXPHOS, hücrelerde önde gelen iki enerji üretim yoludur14. Mikro çevrelerine bağlı olarak, BMDM'ler bu yollardan herhangi birini kullanmayı seçebilir; Bazı durumlarda, birinden diğerine geçin veya her iki yoluda kullanın 14. Bu çalışmada aktive olmuş proinflamatuar makrofajlarda glikoliz metabolizması üzerine odaklandık. Sitoplazmadaki glikoz piruvata ve daha sonra laktata dönüştürüldüğünde, hücreler ortamda, M1 benzeri hücrelerin5 çevrili ortamında asitleşme oranında bir yükselmeye neden olan protonlar üretir. Hücre ortamının asitleşme hızını ölçmek için bir hücre dışı akı analizörü kullanıldı. Sonuçlar Hücre Dışı Asitleşme Hızı (ECAR) veya Proton Akış Hızı olarak rapor edilir.
Polarize makrofajlarda glikoliz seviyelerine erişmek için optimize edilmiş, hızlı ve kolay bir yöntem, glikolitik fenotipi, metabolit değişikliklerini ve inhibitörlerin/aktivatörlerin ve ilaçların polarize makrofajlar üzerindeki etkilerini belirlemek için gereklidir. Bu yazıda açıklanan yöntem, spesifik glikoliz faktörleri (Glikoliz, Glikolitik kapasite, Glikolitik rezerv ve glikolitik olmayan asitleşme) ve ayrıca glikolitik metabolizmanın metabolik yeniden programlanması hakkında bilgi vermek için optimize edilmiştir. Bu çalışmada kullanılan inhibitör (2DG) açıkça glikoliz yolunu hedefler.
Bu optimize edilmiş protokol, yayınlanmış bir protokol16, üreticinin kullanıcı kılavuzlarının glikolitik tahlillerinin hücre dışı akı analizi ve üreticinin Ar-Ge bilim adamları ile doğrudan iletişimin kombinasyonuna dayalı olarak değiştirilmiş ve geliştirilmiştir.
Protokol
Fareler, Laboratuvar Hayvanları Bakımının Değerlendirilmesi ve Akreditasyonu (AAALAC) ve Amerikan Laboratuvar Hayvanları Bilimi Derneği (AALAS) yönergelerine göre ve Texas A&M Üniversitesi kurumsal hayvan bakımı ve kullanımı komitesi (IACUC) tarafından onaylanan protokoller kullanılarak insancıl bir şekilde sakrifiye edildi.
1. Fareler, kemik iliği hasadı ve BMDM kültürü
- Fareyi kurban edin (6-10 haftalık C57Bl / 6 fareler bu protokoldeydi) ve ventral tarafına yatırın, cildi ve periton tabakasını kesin ve bacaklarını nazikçe soyun.
NOT: Fareyi ötenazi yapmak için CO2 gazına maruz kalma kullanın. - Her iki arka bacağınızı kalçadan aşağıya doğru ayırın, kemiği kesmemeye dikkat edin.
- Tüm bacağınızı 50 mL'lik boş bir konik tüpe yerleştirin (daha sonra çıkarmak için kolay bir tutuş sağlamak için ayaklar yukarı bakacak şekilde) ve her iki bacağınızı da fareden almaya devam edin.
2. Femur maruziyeti
NOT: Bir biyogüvenlik kabininde aşağıdaki adımları gerçekleştirin.
- Her bacaktan kaval kemiğini keserek uyluk kemiğini kesin ve uyluk kemiğini çevreleyen dokuyu makas ve laboratuvar kağıdı ile mümkün olduğunca fazla dokuyla çıkarın.
- HaŞedilmiş, "temizlenmiş" uyluk kemiğini, doku kültürü (TC) ortamı veya PBS ile doyurulmuş bir laboratuvar kağıdı parçası içeren 10 cm'lik bir plakaya yerleştirin. Onları buzun üzerine yerleştirin.
- Yıkama aşamasına geçmeden önce femurları toplamaya ve tüm femurlardan doku çıkarmaya devam edin (Şekil 1A).
3. İlik yıkama
- Femurlardan iliği temizlemek için, TC besiyeri ile doldurulmuş 3 mL'lik bir şırınga veya 23G iğneli PBS kullanın. İliği açığa çıkarmadan önce şırıngayı doldurun.
- Femurun en ucunu her iki epifizde keserek iliği ortaya çıkarmak için makas kullanın.
- İğne ucunu uyluk kemiğine sokun ve iliği nazikçe 10 cm'lik bir tabağa boşaltın.
- İğneyi uyluk kemiğinin tüm uzunluğu boyunca gezdirin ve kemik rengi beyaza dönene kadar yıkayın. Genellikle, çoğu ilik 2-3 mL besiyeri ile yıkanabilir.
- Tüm uyluk kemiklerini yıkayın ve kemik iliğini tabakta toplayın. Görünür kümeleri kırmak için bir iğne kullanın. İliği 50 mL'lik konik bir tüpe süzün (Şekil 1A).
4. RBC lizisi
- İliği 10 dakika boyunca 190 x g'da döndürün. Süpernatanı aspire edin.
- Peletleri bir pipet ile 4 mL ACK lizis tamponunda yeniden süspanse edin. RBC lizis tamponunun oda sıcaklığında 5 dakika çalışmasına izin verin.
- İlik süspansiyonuna 2-merkaptoetanol, gentamisin, streptomisin ve %10 FCS ile desteklenmiş 4 mL TC orta RPMI-C %10 (RPMI 1640 -GlutaMAX) ekleyin ve 10 dakika boyunca 1300 x g'da döndürün.
- RBC kalıntılarını çıkarmak için tekrar süzün ve saymak için %10'luk küçük bir RPMI-C hacminde yeniden askıya alın.
- Hücreleri bir hücre sayacı ile sayın (Şekil 1B). Süspansiyondaki hücrelerin sayısını ve canlılığını belirlemek için bir Vi-Hücre Sayacı kullanıldı.
5. Kaplama ve kültür
- 10 mL RPMI-C %10 + 10 ng/mL M-CSF (Makrofaj Koloni Uyarıcı Faktör, monosit/makrofaj proliferasyonu, farklılaşması ve sağkalımının temel düzenleyicisi) istediğiniz kadar 10 cm'lik plakaya ekleyin.
- Her 10 cm'lik plaka 1 x 106 hücre içerecek şekilde uygun hacimde sayılan hücre ekleyin. Plakaları 37 °C'lik bir inkübatöre koyun (0. gün olarak tanımlanır).
- 3. günde, her bir tabağa yavaşça 5 mL taze RPMI-C %10 + 10 ng/mL M-CSF ekleyin.
NOT: 7. günde, BMDM'ler test için hazır olmalıdır (Şekil 1C).
6. Plakalardan hasat
- Çoğu hücrenin plakalara yapıştığını doğrulamak için bir ışık mikroskobu kullanın.
- Ortamı nazikçe aspire edin. Ardından 3 mL PBS ekleyin ve plakayı hafifçe döndürün. Kalan yapışmayan hücreleri çıkarmak için bunu iyice aspire edin.
- Plakaya 7-10 mL soğuk PBS ekleyin, plakaların altını yıkamak için bir P1000 pipeti kullanın ve kalan tüm hücreleri bir toplama tüpüne toplayın.
NOT: Makrofajlar çok sıkı bir şekilde yapıştığından ve tüpün içine yapışacağından tüpleri buz üzerinde tutun. Hücreler soğuk tutulursa, daha az sıkı bir şekilde yapışırlar. - Deneyler için santrifüj, sayım ve plaka hücreleri (Şekil 1D). Flow sitometrisi kullanılarak, elde edilen hücreler CD11b ve F4/80 için %>95 pozitif olmalıdır. (makrofaj polarizasyonu, CD38, TNF-a'nın M1 benzeri belirteçleri ve CD206'nın MCP-1 ve M2 benzeri belirteçleri ile boyanarak belirlendi.
NOT: Biyogüvenlik kabininde 6.1-6.3 adımlarını ve tezgah üzerinde 6.4 adımını gerçekleştirin. Prosedür boyunca aseptik teknikleri koruyun.

Şekil 1: BM'den Türetilmiş Makrofajların fare kemik iliği kültürünün grafiksel iş akışı. (A) Bacak hasadı, Femur maruziyeti ve ilik yıkaması; (b) RBC Lizisi; (C) Kaplama ve kültür; (D) Plakalardan hücre hasadı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. Metabolik akı analizörü testinden bir gün önce: glikolitik test için hücrelerin tohumlanması ve polarizasyonu
- Cihazı açarak Metabolik Akı Analizörünü 37 °C'ye ısıtın.
- 200 μL'lik bir Kalibrant Çözeltisi ekleyerek bir kartuşu nemlendirin ve kartuşu gece boyunca CO2 olmayan bir inkübatörde inkübe edin (Şekil 2A). CO2 olmayan inkübatörün nemi, kartuş hidrasyonu için önemli değildir.
- Deneyden bir saat önce, plakayı birkaç kez yukarı ve aşağı batırın, bu da hava kabarcıklarının giderilmesine yardımcı olacaktır.
- Testin talimatını takip ederek, varsayılan glikoliz stres testi-akut enjeksiyonda yazılım üzerindeki plaka haritasını tasarlayın.
- Yazılım simgesine tıklayın ve ardından Glikoliz stres-akut enjeksiyon testine tıklayın. Grup tanımı simgesinde, grup adları oluşturun.
- 18 dakikalık bir süre ve dört enjeksiyon ile beş ölçüm döngüsü vardır. Port A'nın enjeksiyonunu Glikoz'a, port B'yi Oligomisin'e, Port C'yi Rotenone ve antimisin A'ya (Rot / AA) ve Port D'yi 2DG'ye değiştirin.
- Hücreleri RPMI-C% 10 ortamında yeniden askıya alın ve plakanın dört kenarı (A1, A12, H1 ve H12; Yalnızca ortam ekleyin, hücre yok) bir Metabolik Akı Analizörü mikroplakasında 100 μL'lik bir nihai hacme kadar Normalde bu testi yapmak için en az 40 bin hücre gerekir.
- Hücrelerin kenar etkisini önlemek için hücrelerin oda sıcaklığında 45 dakika oturmasına izin verin. Kenar etkisi, plakanın çevresinden gelen ortamın kısmen buharlaşmasıdır, bu da hacim ve konsantrasyon değişikliklerine neden olur ve hücre canlılığını azaltır.
- Naif makrofajları M1 benzeri hücrelere doğru polarize etmek için 10 ng / mL LPS ekleyin ve onları M2 benzeri hücrelere doğru polarize etmek için 20 ng / ml IL-4 ekleyin. Koşul başına en az 3 ila 6 kuyu kullanın (Şekil 2B).
- Hücreleri mikroskop altında kontrol edin ve plakayı 24 saat boyunca 37 ° C ve% 5 CO2'de bir inkübatöre yerleştirin.
Şekil 2: Hücrelerin tohumlanması ve polarizasyonunun grafiksel gösterimi. (A) Hücre dışı akı analizörü kurulumu ve kartuş hidrasyonu; (B) Hücrelerin polarizasyonu ve gece boyunca inkübasyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
8. Tahlil günü: XF Orta ve bileşik hazırlama
- 100 mL XF RPMI (pH 7.4) test ortamını 2 mM glutamin ile tamamlayın.
- 0,2 μm vakumlu filtre sistemi kullanarak ortamı filtreyle sterilize edin.
- Tahlil ortamını 20 dakika boyunca 37 ° C'lik bir su banyosuna yerleştirin.
- Kaplanmış hücreleri 37 °C,% 5 CO2 inkübatörden çıkarın. Hücreleri tahlil ortamı ile iki kez yıkayın ve önceki ortamı 180 μL'lik son hacme kadar tahlil ortamı ile değiştirin.
- Tüm kuyucukların birleşen hücrelere sahip olduğundan emin olmak için bir mikroskop kullanın ve pipetlemeden kaynaklanan herhangi bir çizik olan kuyucukları işaretleyin. Herhangi bir çizik varsa, analiz etmeden önce o plakayı çıkarın.
- Hücre içeren plakayı COolmayan bir 2 inkübatöre 45 dakika boyunca yerleştirin (Şekil 3A).
- Glikoz (100 mM), Oligomisin (100 μM), Rot / AA (50 μM) ve 2DG (500 mM) stok çözeltileri yapmak için bileşiklerin ve tahlil ortamının kullanılması (Tablo 1).
- Tahlil ortamı kullanarak her bileşiğin 10x enjeksiyon karışımını yapın (Tablo 2).
| Enjeksiyon Stokları (Kitlerde bulunur) | Komple tahlil ortamı ekleyin (mL) | Nihai Stok konsantrasyonu (μM) |
| Glikoz | 3 | 100 bin |
| Oligomisin | 0.72 | 100 |
| 2-DG | 3 | 100 bin |
Tablo 1. Enjeksiyon stokları
| Kartuş üzerindeki bağlantı noktaları | Stok çözümleri | Stok hacmi ekle | Tahlil ortamı ekleyin | Enjeksiyonların son konsantrasyonu (10x) | Bu hacmi belirlenen bağlantı noktasına (μL) ekleyin | Her kuyucuğa enjeksiyondan sonra son konsantrasyon |
| A | Glikoz (100 mM) | 3000 μL + 0 μL | 100 milyon | 20 | 10 milyon | |
| B | Oligomisin (100 μM) | 300 μL + 2700 μL | 10 μM | 22 | 1,0 μM | |
| C | Rotenon / Antimisin A (50 μM) | 300 μL + 2700 μL | 5 μM | 25 | 0,5 μM | |
| D | 2-DG (500 mM) | 300 μL + 0 μL | 500 milyon | 28 | 50 milyon | |
Tablo 2. Son Enjeksiyon Konsantrasyonları
9. Test günü: Polarize makrofajlar üzerinde akut glikolitik testin yapılması
- Kaydedilen Glikoliz stres testi (Akut enjeksiyon) şablonunu yazılımdan açın. Varsayılan Akut Gliko-Stres Testi, her enjeksiyondan önce 3 dakikalık karışım ve ölçüme sahiptir.
- Şablonu ve tahlil ayrıntılarını kontrol edin ve hazır olduğunuzda Çalıştır'a tıklayın ve varsayılan tahlilin talimatını izleyin. Ancak, tüm parametreler özelleştirilebilir.
- Sensör Kartuşunu CO2 olmayan inkübatörden çıkarın, kapağı çıkarın ve kartuş plakasının A1 kuyusu makinenin yerleştirme panelinin sol üst köşesine düşecek şekilde alete yerleştirin. Genellikle kalibrasyon 20 ila 45 dakika sürer.
- Kalibrasyonu bitirdikten sonra, cihaz kalibant solüsyonunu içeren plakayı çıkaracak ve sensör kartuşunu tutacaktır. Plakayı içeren kalibrantı çıkarın.
- Hücre plakasını CO2 olmayan inkübatörden çıkarın, plaka kapağını çıkarın ve makineye yerleştirin. Çalıştır'a tıklayın (Şekil 3B).
- Test tamamlandığında, makine hücre plakasını ve sensör kartuşunu çıkaracaktır.
- Ortamı plakadan çıkarın ve daha fazla normalleştirme için -20 °C'de dondurun.
- Hücreleri normalleştirmek için ticari hücre proliferasyon test kitini (örneğin, CyQUANT) kullanın.
- 19 mL nükleaz içermeyen damıtılmış suya 1 mL Bileşik B veya lizis tamponu ekleyin.
- Yukarıda belirtilen çözeltiye 100 μL Bileşik A veya GR çalışma çözeltisi ekleyin.
- Plakadaki hücrelerin çözüldüğünden emin olun ve ardından her bir oyuğa 200 μL çözelti ekleyin.
- Oda sıcaklığında (RT) 5 dakika inkübe edin.
- Bir plaka okuyucu kullanarak floresansı 480 nm uyarma ve 520 nm emisyon dalga boylarında ölçün.
- Yazılımın normalleştirme panelindeki hücreleri normalleştirin.
- Naif makrofaj hücre sayısına dayalı hücreleri normalleştirin (Şekil 3C). Naif makrofajların ortalamasını 1 olarak düşünün (her bir oyuğun hücre sayısını naif makrofajların ortalama hücre sayısına bölerek) ve bunları tüm makrofajlara uygulayın.
Şekil 3: Tahlil günü: besiyeri ve bileşik hazırlama ve tahlilin çalıştırılması. (A) Test için hücre hazırlığı; (B) Bileşiklerin hazırlanması, kalibrasyonu ve tahlilin çalıştırılması; (C) Normalleştirme ve veri analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Glikoliz ve mitokondriyal oksidatif fosforilasyon, hücrelerdeki iki ana ATP üretim yoludur (Şekil 4A). Bazı hücreler, enerji taleplerini karşılamak için bu iki yol arasında geçiş yapma yeteneğine sahiptir. Glikozun sitoplazmada piruvata dönüştürülmesine glikoliz denir. Pirüvatın iki kaderi vardır; ya laktata dönüştürülecek ya da TCA döngüsü boyunca ve sonunda daha fazla ATP üretmek için elektron taşıma zinciri (ETC) yoluyla daha fazla metabolize edilecektir. Hücrelerin glikolitik parametrelerinin en iyi şekilde anlaşılmasını sağlamak için, mitokondriyal ATP sentaz için bir inhibitör olan oligomisin kullanarak OXPHOS yolaklarını en aza indiriyoruz. Ayrıca, hücredeki maksimum glikolitik kapasiteyi ve telafi edici glikolizi değerlendirmek için ETC'yi tamamen kapatmak için Rot / AA enjekte ediyoruz (Şekil 4A). Glikoz, glikolizin birincil yakıtıdır. XF tahlil ortamı herhangi bir glikoz veya glutamin içermediğinden, tahlildeki ilk üç ölçüm, asitleşmenin göstergesi olan ancak glikozun laktata dönüşümü ile ilgili olmayan glikolitik olmayan asitleşme oranının bir göstergesi olacaktır (Şekil 4B,C). Port A'dan glukoz enjeksiyonundan sonra, artan ECAR seviyeleri glikoliz oranlarının göstergeleridir (ölçüm 4,5 ve 6). Daha sonra, B portundan oligomisin enjeksiyonu ve C portundan Rot/AA enjeksiyonu ile ETC inhibe edilir ve artan ECAR miktarları, hücrelerin glikolitik kapasitesinin ve telafi edici glikoliz oranlarının bir göstergesidir (Şekil 4B,C). BMDM'lerin telafi edici glikoliz oranları, mitokondriyal stres koşulları altında hücresel enerji yönetimi yeteneğini göstermektedir. Başka bir deyişle, bu parametre mitokondriyal solunum inhibe edildiğinde enerji talebinin telafisini gösterir. Son enjeksiyon, glikozun rekabetçi bir inhibitörü olan port D'den 2 deoksiglukoz veya 2DG'dir.
Şekil 4B,C'de alternatif bir hesaplama, özellikle 3 ölçüm arasında büyük hatalar varsa, her enjeksiyondan önceki son veri noktasının ölçülebilmesi ve verilerdeki gereksiz hataların ve varyasyonların önlenebilmesidir.
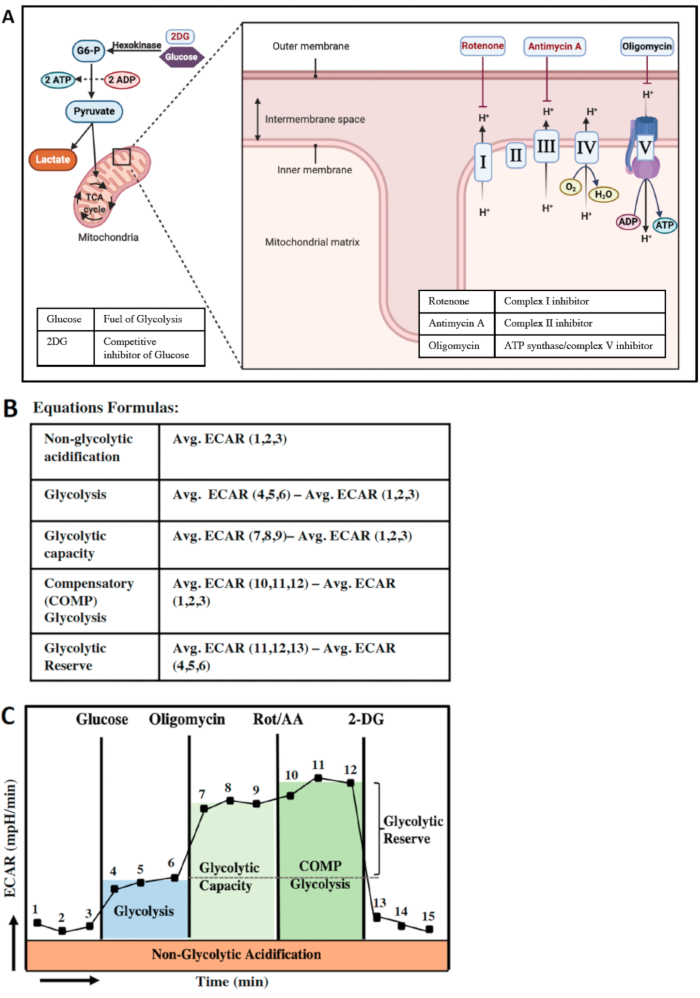
Şekil 4: Hücrede enerji üretimi ve glikolitik parametreler. (A) hücredeki en önemli iki enerji üretim yolunun şematik görünümü; Glikoliz (solda) ve mitokondriyal oksidatif fosforilasyon (sağda). Glikoliz, glikozun piruvata dönüştürülmesidir. XF analizörü, piruvatın laktata dönüştürülmesiyle üretilen protonları ECAR (mpH/dk) seviyeleri olarak tespit edebilir. ATP sentazın inhibisyonu ve ardından mitokondriyal elektron taşıma zincirindeki kompleks I ve II'nin inhibisyonu, OCR yoluyla ATP üretimini ve proton akışını ortadan kaldıracaktır. (B) glikolitik parametrelerin hesaplanması. (C) Her bileşik enjeksiyondan sonra glikolitik fonksiyon parametreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Genel olarak, polarize makrofajlar, naif M0 makrofajlarına kıyasla daha fazla glikolitik aktiviteye sahiptir. LPS ile indüklenen M1 benzeri makrofajlar en yüksek glikolitik aktiviteye sahiptir. Polarize makrofajlar, OCR yedek solunum kapasitelerinde (16) burada gösterilmemiş olan daha belirgin ayrımlara sahip olsalar da, glikolitik metabolizmaları da tamamen ayırt edilebilir. LPS'nin neden olduğu M1 benzeri polarize BMDM'lerde ECAR'daki bir artışın, diğer M1 benzeri polarize makrofaj türleri (LPS + INF-γ veya PAMP ile indüklenen M1 benzeri makrofajlar gibi) için kesin bir özellik olmadığını ve glikolitik stres olmadan ECAR'ı artıramayacağını veya değiştiremeyebileceğini not etmek önemlidir. Beklendiği gibi, glikolitik olmayan aktivitenin göstergesi olan ilk üç ölçümde, polarize makrofajlar önemli bir fark göstermez çünkü ortamın herhangi bir glikoz veya piruvat kaynağı yoktur (Şekil 5). Glikoz enjeksiyonundan sonra, polarize BMDM'ler, saf BMDM'lerden daha yüksek glikoliz seviyelerini gösterir ve M1 benzeri BMDM'ler, M0 ve M1 benzerlerine kıyasla en yüksek glikoliz seviyelerini gösterir.
Tipik olarak, glikolitik metabolizma, M1 benzeri makrofajlar tarafından kullanılan tercih edilen ATP üretim yoludur ve OXPHOS, M2 benzeri makrofajlar için ana ATP üretim yoludur. Oligomisin enjeksiyonundan sonra, BMDM'lerin mitokondriyal elektron taşıma zincirindeki ATP sentaz kompleksi kapanacaktır; Böylece hücreler enerji taleplerini karşılamak için glikolize güvenmeye başlayacaktır. Ortamda glikoz bulunduğundan, polarize BMDM'lerin glikolitik kapasitesi karşılaştırılabilir olacaktır. Yine, LPS kaynaklı M1 benzeri BMDM'ler en yüksek glikolitik kapasiteye sahip olacaktır. M2 benzeri ve M0 sırasıyla daha düşük glikolitik kapasitelere sahip olacaktır (Şekil 5). Rot / AA enjeksiyonu, mitokondriyal ETC'nin Kompleks I ve III'ünü inhibe edecek ve OXPHOS'u tamamen kapatacak ve telafi edici glikolizin bir göstergesi olan ECAR seviyelerinde biraz daha yüksek bir artış olacaktır. Yine M1 benzeri BMDM'ler bu adımda en yüksek ECAR seviyelerine sahip olacak; son olarak, rekabetçi bir glikoz inhibitörü ve glikoliz için negatif kontrol olan 2DG, Glikoliz yolunu tamamen kapatacaktır.

Şekil 5: Naif M0 ve polarize M1 benzeri (LPS kaynaklı) ve M2 benzeri (IL4 kaynaklı) BMDM'lerin glikolitik fonksiyonları. Polarize makrofajların glikolitik parametreleri ECAR (mpH/dk) olarak belirtilmiştir. (A) M0, M1 benzeri ve M2 benzeri BMDM'lerde glikolitik olmayan asitleşme oranı, Glikoliz, Glikolitik kapasite ve ECAR (mpH/dak) olarak telafi edici glikoliz. Portların enjeksiyonları aşağıdaki gibidir → port A: Glikoz, Port B: Oligomisin, Port C: Rotenon artı antimisin A ve port D: 2 Deoksi Glikoz (B) M0, M1 benzeri ve M2 benzeri BMDM'ler için her parametrenin çubuk grafikleri. Gösterilen veriler, deney başına 4-6 kültür kuyusundan alınmıştır. Ölçümler ortalama + SEM'e dayanmaktadır. Gruplar arasındaki istatistiksel anlamlılık tek yönlü ANOVA'ya dayanmaktadır ve Tukey'in çoklu karşılaştırma testi "*" p < 0.05, anlamlılık "**" p < 0.01, anlamlılık "****" p < 0.001, anlamlılık "****" p < 0.0001'dir. Hata çubukları standart sapmadan türetilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Daha önce de belirtildiği gibi, hücre dışı akı analizörü makinesi, mitokondriyal OXPHOS aktivitesinin bir göstergesi olan OCR'yi (oksijen tüketim oranı) ve glikolizin bir göstergesi olan ECAR'ı (hücre dışı asitleşme hızı) ölçerek hücrelerin iki ana enerji üreten yolu hakkında gerçek zamanlı bilgi sağlayabilir. Makrofajlar, mikro çevrelerine bağlı olarak her iki yolu da kullanabilirler. Ayrıca enerji üretim yollarını da değiştirebilirler17,18. Makrofajların enerjik durumlarını ve farklı ilaçlara, sitokinlere, inhibitörlere, aktivatörlere vb. verdikleri yanıtları anlamak, bu hücrelerin metabolik durumlarının daha iyi anlaşılmasını sağlayacaktır. Glikoliz, M1 benzeri makrofaj türlerinde aktive olan en kritik yollardan biri olduğundan, gerçek zamanlı glikolizle ilgili bilgiler, farklı in vitro koşullarda M1 benzeri polarize BMDM'lerin değişikliklerinin izlenmesine yardımcı olabilir19. ATP gerçek zamanlı hız testinin hücre dışı akı analizi, polarize BMDM'lerin20 ATP üretimini değerlendirmenin bir yolu olarak kabul edilmektedir. Burada sunulan protokol, deneysel ihtiyaçlara uyarlanabilecek kapsamlı bir protokol olarak hizmet etmek için iş akışının görsel bir gösterimi ile teknik ayrıntılar ve yaklaşımlar sağlar.
Bu test, bazal koşullar için glikolitik seviyelerin doğru ölçümlerini ve mitokondriyal inhibisyonu takiben telafi edici glikoliz sağlar. Hücre dışı ortamdaki asitleşmenin bir kısmının mitokondriyal bir kaynağa sahip olabileceğine dikkat etmek önemlidir21. Krebs döngüsü veya TCA döngüsü, su molekülleri22 ile reaksiyonu yoluyla ortamı asitleştirebilen CO 2 üretir. Mitokondriyal aktivite inhibe edildiğinde, asitleşme oranları ortamda laktat birikiminin göstergeleridir. Glikolitik stres testinin avantajı, ortamdaki glikoz tedavisinden önce ve sonra glikoliz seviyelerini değerlendirmek için herhangi bir glikoz veya piruvat kaynağı olmayan bir ortama glikoz enjeksiyonudur.
Öte yandan, glikolitik hız testi, mitokondriyal aktiviteyi bloke ederek farklı glikoliz kaynakları hakkında spesifik bilgi sağlar. Başka bir deyişle, glikolitik proton akışı, toplam proton akışından OXPHOS proton akışının çıkarılmasıyla hesaplanabilir. Bu protokolde, glikolitik tahlilleri tek bir tahlilde birleştirdik ve glikoliz, glikolitik kapasite, glikolitik rezerv, telafi edici glikoliz ve glikolitik olmayan asitlendirme sonuçları elde etmek için glikolitik verileri maksimize ettik. Bu parametreler, hücrelerin metabolik durumlarının ve glikolitik fenotipinin daha iyi anlaşılmasını sağlayacaktır. Optimize edilmiş hızlı ve kolay bir normalizasyon yöntemi ile glikolitik metabolizma ve metabolik yeniden programlama hakkında daha doğru bilgi elde etmek mümkün olacaktır 21,22,23.
Yeni kombine sistemde glikolitik rezervin anlamı değişmese de, yöntemdeki hesaplama şemasının biraz değiştirildiğine dikkat etmek önemlidir. Kombine sistemde (Şekil 4B), glikolitik rezerv Ort. ECAR (10,11,12)-Ort. ECAR (4,5,6). Ancak kombine olmayan yöntemlerde glikolitik rezerv Ort. ECAR (7,8,9)-Ort. ECAR (4,5,6) formülü ile hesaplanır. Her iki hesaplama da çok benzer sonuçlar verir ve glikolitik rezervi yansıtır.
Ayrıca, hücre dışı akı analizörlerinde hücre dışı asitlenmelerin farklı metrikleri olduğunu belirtmekte fayda var. Hücre dışı akı analizörlerindeki glikolitik analizlerin sonuçları, ECAR (mpH/dk), PPR (pmol H+/dk) ve PER (pmol H+/dk) bazlı olarak analiz edilebilir. Avantajları ve dezavantajları vardır, ancak genel olarak ECAR, hücre dışı asitlenme verilerini görüntülemenin en tipik yoludur.
Laboratuvarımız, mikrobiyota metabolitlerinin bağışıklık hücreleri üzerindeki rolünü incelemektedir. Makrofajlar, ateroskleroz 23,24,25 gibi kronik enflamatuar hastalıklarda bağışıklık sisteminin temel bileşenlerinden biri olduğundan, mikrobiyom metabolitlerinin makrofajların, özellikle doymuş yağ asitleri, modifiye LDL'ler gibi farklı proaterojenik sinyaller tarafından indüklenen inflamatuar polarize makrofajların polarizasyonu üzerindeki rolünü incelemekle ilgileniyoruz. ve zararlı bağırsak mikrobiyotası kaynaklı veya bağımlı metabolitler. Akış sitometrisi ve qPCR kullanarak BMDM'lerin M1 benzeri ve M2 benzeri yüzey ve hücre içi belirteçler ile polarizasyonunu doğruluyoruz. Çalışmalarda hücre dışı akı deneylerini fonksiyonel okumalar olarak kabul ediyoruz. Laktat testi ile gerçek zamanlı olmayan glikoliz faktörlerini ölçerek tamamlayıcı çalışmalar gerçekleştiriyoruz.
LPS ile indüklenen M1 benzeri polarizasyon veya LPS + IFNγ ile indüklenen M1 benzeri polarizasyon, makrofajlarda en yaygın klasik M1 benzeri aktivasyon yoludur. M1 benzeri polarizasyonda, LPS'ye IFNγ eklenmesi veya LPS konsantrasyonunun arttırılması, mitokondriyal elektron taşıma zincirindeki yedek solunum kapasitesinin azalmasını artıracaktır. IFNγ'un M1 benzeri bir fenotipi indüklediği bilinmektedir, ancak genellikle IFNγ tek başına yeterli değildir ve fenotipi indüklemek için ek TLR agonistleri gerektirir. Ancak bu, belirli bir durumla ilgili hastalıklara ve M1 benzeri polarizasyona bağlıdır. Örneğin, IFNγ ile indüklenen M1 benzeri makrofajlar, LPS veya LPS / IFNγ ile indüklenen makrofajlara benzer NO ve inflamatuar sitokinler üretemez26.
Makrofajların inflamatuar polarizasyondan korunmasını sağlayan ilaçlar, aterosklerozu önleme ve kontrol etme potansiyeline sahiptir. M1 makrofajlarının metabolik yolaklarını, enerjilerini ve fenotipik özelliklerini anlamak, farklı endojen ve eksojen ilaçların rolünü incelemek için çok önemlidir. Glikoliz, M1 benzeri makrofajlarda baskın enerji üreten yoldur24,27.
Bu basitleştirilmiş çalışma, polarize BMDM'lerin sadece glikolitik enerjik durumlarına odaklanmaktadır. Bu yazıda kullanılan dozlar, üreticinin tavsiyesi üzerine inşa edilmiştir ve deneyin takip edilmesini çok daha kolay hale getirir. Ayrıca, bu çalışmada kullanılan bileşiklerin çoğu, üretici firmadan alınan standart kitte sağlanmaktadır; Bu, zamandan tasarruf etmeye ve deneylerin tutarlılığını artırmaya yardımcı olur. Bileşik dozlardaki, hücre sayılarındaki ve inkübasyon sürelerindeki küçük farklılıkların deney sonuçlarını etkileyebileceğini bilmek önemlidir. Ayrıca, her deneyci, bu koşulların hücre dışı akı analizörü üzerinde nasıl performans gösterdiğini anlamak için kendi hücre tipi ve koşulları için bir hücre titrasyonu, doz-yanıt ve kinetik analiz yapmalıdır.
Besiyeri değişimi, yıkama ve normalizasyon adımları sırasında bazı hücrelerin pipetleme veya sıvı basıncı ile çıkabileceği unutulmamalıdır. Hücrelerin birleşmesi mikroskop altında her zaman tespit edilebilir. Bu kuyucukların, hücrelerde herhangi bir çizik veya tükenme belirtisi varsa, çalışmadan çıkarılması gerekir.
Kuyu başına minimum sayıda hücreye sahip 96 kuyulu mikroplaka kullanıyoruz, bu da pozitif ve negatif kontrollerin yanı sıra farklı koşulların tek bir plakada test edilmesine izin veriyor; Bu nedenle, bu tahlil, hücre dışı akı analizi için çok zaman kazandıran ve uygun maliyetlidir. Bu çalışma, dokuda yerleşik makrofajlardan, peritoneal makrofajlardan ve makrofaj hücre hatlarından farklı olan BMDM için optimize edilmiştir.
Bu protokolde öncelikle proinflamatuar durumla ilişkili glikolizde hücre dışı akı analizinin uygulanmasına odaklanırken, hücre dışı akı analizi ayrıca toplam solunum, bazal mitokondriyal solunum, ATP üretimi, proton sızıntısı, maksimal solunum ve yedek solunum kapasitesi gibi mitokondriyal fonksiyon özelliklerini değerlendirmek için de kullanılabilir. Mitokondri, makrofajın metabolik yeniden programlanmasında önemli bir rol oynar. Hücrelerin oksijen tüketim oranını ölçerek mitokondriyal stresi ve yağ asidi oksidasyonunu değerlendirmek için hücre dışı akı analizörleri kullanılmıştır16.
Sonuç olarak, burada BMDM'lerin izolasyonu, kültürü, polarizasyonu ve glikolitik fonksiyonel analizi için kapsamlı bir protokol sağladık. Tüm adımlar için ayrıntılı adım adım prosedürler ve görsel gösterimler sağlandı. Bu protokolün, araştırmacıların analizlerini düzene koymalarına ve BMDM'lerin glikolitik fonksiyonunu yüksek kalite ve verimlilikle değerlendirmelerine yardımcı olacağını umuyoruz.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Editoryal yardımı için Bayan Joanna Rocha'ya teşekkür ederiz. Çalışma kısmen Ulusal Sağlık Enstitüleri (NIH) R01DK118334 (Dr. Sun ve Alaniz'e) ve (NIH) R01A11064Z (Dr. Jayaraman ve Alaniz'e) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
Referanslar
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. . The Autoimmune Diseases. , 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084 (2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993 (2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846 (2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628 (2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886 (2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. . Metabolic Signaling. , 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. . Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464 (2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657 (2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878 (2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383 (2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
ISSN 2689-3649
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
Sitemizdeki deneyiminizi iyileştirmek için çerezleri kullanıyoruz
Sitemizi kullanmaya devam ederek ya da "Devam et" butonuna tıklayarak, çerezleri kabul edebilirsiniz.
