Method Article
用于骨髓来源巨噬细胞分离、培养、极化和糖酵解表征的全面高效方案
摘要
该方案为活骨髓来源的巨噬细胞 (BMDM) 的分离、培养、极化和糖酵解代谢状态的测量提供了详细而全面的方法。本文为实时 BMDM 的工作流程和糖酵解评估提供了带有逼真视觉插图的分步说明。
摘要
巨噬细胞是最重要的抗原呈递细胞之一。巨噬细胞的许多亚群已被鉴定为具有独特的代谢特征。巨噬细胞通常分为 M1 样(炎症)和 M2 样(抗炎)亚型。M1样巨噬细胞是促炎巨噬细胞,被LPS和/或促炎细胞因子如INF-γ、IL-12和IL-2激活。M1 样极化巨噬细胞通过介导宿主对多种细菌和病毒的防御而参与各种疾病。这对于研究 LPS 诱导的 M1 样巨噬细胞及其在炎症性疾病中的代谢状态非常重要。M2 样巨噬细胞被认为是抗炎巨噬细胞,由抗炎细胞因子和刺激剂激活。在促炎状态下,巨噬细胞在糖酵解功能中表现出糖酵解增加。使用细胞外通量 (XF) 分析仪在糖酵解、糖酵解能力、糖酵解储备、补偿性糖酵解或非糖酵解酸化的背景下,已经积极研究了糖酵解功能。
本文演示了当骨髓来源的巨噬细胞 (BMDM) 呼吸、消耗和产生能量时,如何通过易于遵循的步骤实时评估糖酵解状态。在该方案中使用糖酵解的特异性抑制剂和激活剂,我们展示了如何获得细胞中糖酵解代谢过程的系统和完整视图,并提供更准确和真实的结果。为了能够测量多种糖酵解表型,我们提供了一种简单、灵敏、基于 DNA 的标准化方法,用于 BMDM 的极化评估。BMDM 表型和代谢状态的培养、激活/极化和鉴定是有助于研究许多不同类型疾病的关键技术。
在本文中,我们用 LPS 和 IL4 分别将幼稚的 M0 巨噬细胞极化为 M1 样和 M2 样巨噬细胞,并使用细胞外通量分析和糖酵解激活剂和抑制剂实时和纵向测量 BMDM 中的一组全面的糖酵解参数随时间变化。
引言
巨噬细胞是先天免疫系统 M1 样细胞中最关键的细胞之一。它们参与清除传染病、吞噬作用、抗原呈递和炎症调节2。此外,巨噬细胞需要通过它们释放的各种细胞因子来调节其他免疫细胞3。巨噬细胞表型的谱很广4。根据巨噬细胞暴露的信号,它们会朝着不同的炎症和代谢状态极化5。巨噬细胞在各种疾病中表现出代谢改变,具体取决于巨噬细胞所在的组织6。极化巨噬细胞具有重编程或转换其糖酵解代谢、脂质代谢、氨基酸代谢和线粒体氧化磷酸化 (OXPHOS) 的能力7,8。经典激活的 M1 样巨噬细胞和选择性激活的 M2 样巨噬细胞是研究最多的两种巨噬细胞表型3。未活化的静止巨噬细胞被称为 M0 巨噬细胞。M0 巨噬细胞向 M1 样表型的极化可以通过用细菌脂多糖 (LPS) 刺激幼稚 BMDM 来诱导9。在炎性细胞因子、干扰素-γ (IFN γ) 或肿瘤坏死因子 (TNF) 存在下,PI3K-AKT-mTOR-HIF1a 信号通路可在巨噬细胞中被激活10。M1 样巨噬细胞糖酵解代谢水平升高,氧化磷酸化 (OXPHOS) 水平降低,产生参与感染和炎症性疾病的炎性细胞因子8。另一方面,白细胞介素 (IL)-4 可通过 JAK-STAT、PPAR 和 AMPK 通路或 (IL)-13 和 TGFβ 通路诱导向 M2 样表型的极化11,12。
与 M1 样巨噬细胞相比,M2 样巨噬细胞的糖酵解降低,OXPHOS 增加,并参与抗寄生虫和组织修复活性 8,13。BMDM 是一种广泛用于研究源自骨髓干细胞的巨噬细胞的系统。糖酵解和 OXPHOS 是细胞中的两种主要能量产生途径14。根据它们的微环境,BMDM 可以选择使用这些途径中的任何一种;在某些情况下,从一种途径切换到另一种途径,或同时使用两种途径14。在这项研究中,我们专注于活化的促炎巨噬细胞中的糖酵解代谢。当细胞质中的葡萄糖转化为丙酮酸,然后转化为乳酸时,细胞会在培养基中产生质子,从而导致 M1 样细胞周围培养基中的酸化速率升高5。使用细胞外通量分析仪测量细胞培养基的酸化速率。结果报告为细胞外酸化率 (ECAR) 或质子流出率。
一种优化的快速简便的方法来获取极化巨噬细胞中的糖酵解水平,对于确定糖酵解表型、代谢物变化以及抑制剂/激活剂和药物对极化巨噬细胞的影响至关重要。本手稿中描述的方法已经过优化,可提供有关特定糖酵解因子(糖酵解、糖酵解能力、糖酵解储备和非糖酵解酸化)以及糖酵解代谢的代谢重编程的信息。本研究中使用的抑制剂 (2DG) 明确靶向糖酵解途径。
该优化的方案已根据已发布的方案16、制造商用户指南的糖酵解测定的细胞外通量分析以及与制造商研发科学家的直接沟通相结合进行了修改和改进。
研究方案
根据实验动物护理评估和认证 (AAALAC) 和美国实验动物科学协会 (AALAS) 指南,并使用德克萨斯 A&M 大学机构动物护理和使用委员会 (IACUC) 批准的方案,对小鼠进行人道处死。
1. 小鼠骨髓采集和 BMDMs 培养
- 牺牲小鼠(6-10 周龄的 C57Bl/6 小鼠在该方案中)并将其放在腹侧,切开皮肤和腹膜层,轻轻剥下腿部。
注意:使用 CO2 气体暴露对鼠标实施安乐死。 - 将两条后腿与臀部以下分开,注意不要割伤骨头。
- 将整条腿放入冰上的 50 mL 空锥形管中(脚朝上,以便稍后轻松拉出),然后继续从小鼠身上收获两条腿。
2. 股骨暴露
注意:在生物安全柜中执行以下步骤。
- 通过切断每条腿的胫骨来收获股骨,并用剪刀和实验室纸去除尽可能多的股骨周围的组织。
- 将收获的、“清洁”的股骨放入一个 10 cm 的板中,该板含有一张用组织培养 (TC) 培养基或 PBS 饱和的实验室纸。将它们放在冰上。
- 在进入冲洗阶段之前,继续收获股骨并从所有股骨中取出组织(图 1A)。
3. 骨髓冲洗
- 要从股骨中冲洗骨髓,请使用装有 TC 培养基或 PBS 的 3 mL 注射器和 23G 针头。在暴露骨髓之前填充注射器。
- 用剪刀剪断两个骨骺处的股骨末端,露出骨髓。
- 将针尖插入股骨,轻轻地将骨髓冲洗到 10 厘米的培养皿中。
- 将针头穿过股骨的整个长度,并冲洗,直到骨骼颜色变为白色。通常,大多数骨髓可以用 2-3 mL 的培养基冲洗掉。
- 冲洗所有股骨并汇集培养皿中的骨髓。使用针打碎任何可见的团块。将骨髓过滤到 50 mL 锥形管中(图 1A)。
4. 红细胞裂解
- 以 190 x g 旋转骨髓 10 分钟。吸出上清液。
- 用移液管将沉淀重悬于 4 mL ACK 裂解缓冲液中。让 RBC 裂解缓冲液在室温下工作 5 分钟。
- 向骨髓悬液中加入 4 mL 补充有 2-巯基乙醇、庆大霉素、链霉素和 10% FCS 的 TC 培养基 RPMI-C 10% (RPMI 1640 -GlutaMAX),并以 1300 x g 离心 10 分钟。
- 再次过滤以去除 RBC 碎片,并重新悬浮在少量 RPMI-C 10% 中进行计数。
- 用细胞计数器计数细胞(图 1B)。使用 Vi-Cell Counter 测定悬浮液中细胞的数量和活力。
5. 电镀和培养
- 根据需要将 10 mL RPMI-C 10% + 10 ng/mL M-CSF(巨噬细胞集落刺激因子,单核细胞/巨噬细胞增殖、分化和存活的重要调节因子)添加到任意数量的 10 cm 板中。
- 添加适当体积的计数细胞,使每个 10 cm 板包含 1 x 106 个细胞。将板放入 37 °C 培养箱中(定义为第 0 天)。
- 第 3 天,向每个板中轻轻加入 5 mL 新鲜 RPMI-C 10% + 10 ng/mL M-CSF。
注意:第 7 天,BMDM 应该准备好进行测试(图 1C)。
6. 从盘子里收获
- 使用光学显微镜确认大多数细胞已粘附在板上。
- 轻轻吸出培养基。然后加入 3 mL PBS 并轻轻旋转板。充分吸出以去除任何剩余的非贴壁细胞。
- 向板中加入 7-10 mL 冷 PBS,使用 P1000 移液器清洗板底部,并将所有剩余细胞收获到收集管中。
注意:将试管放在冰上,因为巨噬细胞非常紧密地粘附在试管内部。如果细胞保持低温,它们的粘附性就会降低。 - 离心、计数和铺板细胞用于实验(图 1D)。使用流式细胞术,所得细胞的 CD11b 和 F4/80 阳性应为 >95%。(通过用 CD38 、 TNF-a 和 MCP-1 的 M1 样标志物以及 CD206 的 M2 样标志物染色来确定巨噬细胞极化。
注:在生物安全柜中执行步骤 6.1-6.3,在工作台上执行步骤 6.4。在整个手术过程中保持无菌技术。

图 1:BM 来源的巨噬细胞小鼠骨髓培养的图形工作流程。 (A) 腿部收获、股骨暴露和骨髓冲洗; (B) 红细胞裂解; (C) 铺板和培养; (D) 从平板中收获的细胞。 请单击此处查看此图的较大版本。
7. 代谢通量分析仪测定前一天:用于糖酵解试验的细胞的接种和极化
- 打开仪器,将代谢通量分析仪预热至 37 °C。
- 通过添加 200 μL 校准液来水合小柱,并将小柱在非 CO2 培养箱中孵育过夜(图 2A)。非 CO2 培养箱的湿度对于小柱水合并不重要。
- 实验前一小时,将板上下浸泡几次,这将有助于去除气泡。
- 按照测试的说明,在默认的糖酵解应激测试-急性注射中的软件上设计板图。
- 单击软件图标,然后单击 Glycolysis stress-acute injection test。在组定义图标上,生成组名称。
- 有 5 个测量周期,持续时间为 18 分钟,注射 4 次。将端口 A 的注射更改为葡萄糖,将端口 B 更改为寡霉素,将端口 C 更改为鱼藤酮和抗霉素 A (Rot/AA),将端口 D 更改为 2DG。
- 将细胞重悬于 RPMI-C 10% 培养基中,每孔接种 50k 细胞,板的四个边缘(A1、A12、H1 和 H12;仅添加培养基,不添加细胞)至最终体积为 100 μL。通常至少需要 40k 个细胞才能进行此检测。
- 让细胞在室温下静置 45 分钟,以避免细胞的边缘效应。边缘效应是指板周边的培养基部分蒸发,这会导致体积和浓度发生变化并降低细胞活力。
- 添加 10 ng/mL LPS 以将初始巨噬细胞极化至 M1 样细胞,并添加 20 ng/ml IL-4 以将它们极化至 M2 样细胞。每个条件至少使用 3 到 6 个孔(图 2B)。
- 在显微镜下检查细胞,并将板置于 37 °C 和 5% CO2 的培养箱中 24 小时。
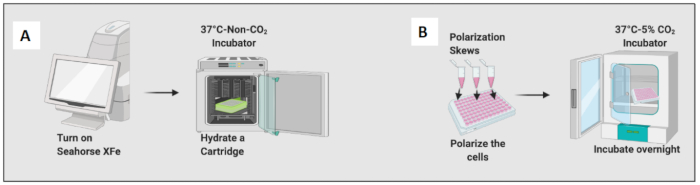
图 2:细胞接种和极化的图形演示。 (A) 细胞外通量分析仪设置和小柱水合; (B) 细胞极化和过夜孵育。 请单击此处查看此图的较大版本。
8. 检测日期:XF 培养基和化合物制备
- 用 2 mM 谷氨酰胺补充 100 mL XF RPMI (pH 7.4) 分析培养基。
- 使用 0.2 μm 真空过滤系统对培养基进行过滤消毒。
- 将检测培养基置于 37°C 水浴中 20 分钟。
- 从 37 °C、5% CO2 培养箱中取出铺板的细胞。用检测培养基洗涤细胞两次,并用检测培养基替换之前的培养基,最终体积为 180 μL。
- 使用显微镜确保所有孔都有汇合细胞,并标记任何因移液而有划痕的孔。如果有任何划痕,请在分析前取下该板。
- 将含有细胞的板放置在非 CO2 培养箱中 45 分钟(图 3A)。
- 使用化合物和测定培养基制备葡萄糖 (100 mM)、寡霉素 (100 μM)、Rot/AA (50 μM) 和 2DG (500 mM) 的储备溶液(表 1)。
- 使用测定培养基制备每种化合物的 10 倍注射混合物(表 2)。
| 注射液(在试剂盒中提供) | 添加完全检测培养基 (mL) | 最终储备液浓度 (μM) |
| 葡萄糖 | 3 | 100K |
| 寡霉素 | 0.72 | 100 |
| 2-DG | 3 | 100 千米 |
表 1.注射原料
| 磁带上的端口 | Stock 解决方案 | 添加毛坯体积 | 添加检测培养基 | 注射的最终浓度 (10x) | 将此体积添加到指定端口 (μL) | 每个孔中进样后的最终浓度 |
| 一个 | 葡萄糖 (100 mM) | 3000 微升 + 0 微升 | 100 毫米 | 20 | 10 毫米 | |
| B | 寡霉素 (100 μM) | 300 μL + 2700 μL | 10 微米 | 22 | 1.0 微米 | |
| C | 鱼藤酮/抗霉素 A (50 μM) | 300 μL + 2700 μL | 5 微米 | 25 | 0.5 微米 | |
| D | 2-DG (500 毫米) | 300 μL + 0 μL | 500 毫米 | 28 | 50 毫米 | |
表 2.最终进样浓度
9. 检测当天:对极化巨噬细胞进行急性糖酵解试验
- 从软件中打开保存的糖酵解应激测定(急性注射)模板。默认的急性糖酵素应激测试在每次注射前有 3 分钟的混合和测量。
- 检查模板和检测详细信息,准备就绪后,单击 Run(运行)并按照默认检测的说明进行作。但是,所有参数都可以自定义。
- 从非 CO2 培养箱中取出传感器柱,取下盖子,然后插入仪器,使柱板的 A1 孔落入机器插入面板的左上角。通常,校准需要 20 到 45 分钟。
- 完成校准后,设备将弹出含有校准液的板并固定传感器探针板。取出含有板的校准液。
- 从非 CO2 培养箱中取出细胞板,取下板盖,然后将其插入机器中。单击运行(图 3B)。
- 检测完成后,机器将弹出细胞板和传感器盒。
- 从板中取出培养基并在-20°C下冷冻以进行进一步归一化。
- 使用市售细胞增殖检测试剂盒(例如 CyQUANT)对细胞进行标准化。
- 将 1 mL 化合物 B 或裂解缓冲液添加到 19 mL 无核酸酶蒸馏水中。
- 向上述溶液中加入 100 μL 化合物 A 或 GR 工作溶液。
- 确保板中的细胞已解冻,然后向每个孔中加入 200 μL 溶液。
- 在室温 (RT) 下孵育 5 分钟。
- 使用读板器测量 480 nm 激发波长和 520 nm 发射波长的荧光。
- 在软件的标准化面板上标准化细胞。
- 根据幼稚巨噬细胞细胞计数标准化细胞(图 3C)。将幼稚巨噬细胞的平均值视为 1(通过将每个孔的细胞数除以幼稚巨噬细胞的平均细胞数)并将它们应用于所有巨噬细胞。
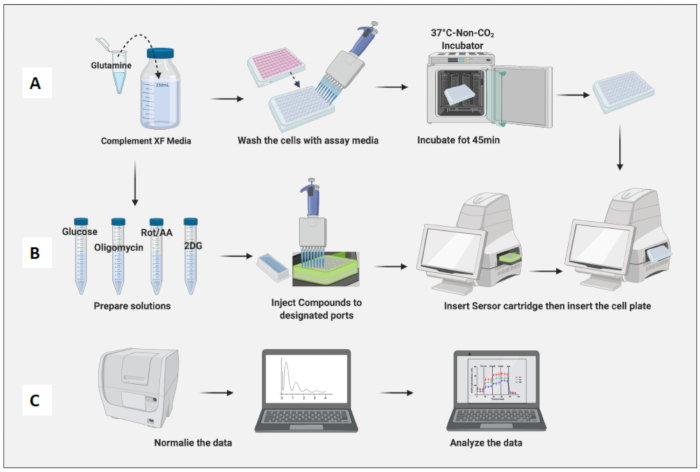
图 3:检测日期:培养基和化合物制备以及运行检测。 (A) 用于检测的细胞制备; (B) 化合物制备、校准和运行分析; (C) 标准化和数据分析。 请单击此处查看此图的较大版本。
结果
糖酵解和线粒体氧化磷酸化是细胞中 ATP 产生的两个主要途径(图 4A)。一些细胞能够在这两种途径之间切换以满足其能量需求。葡萄糖在细胞质中转化为丙酮酸称为糖酵解。丙酮酸有两种命运;它要么转化为乳酸,要么通过 TCA 循环进一步代谢,最终通过电子传递链 (ETC) 产生更多的 ATP。为了最好地了解细胞的糖酵解参数,我们通过使用寡霉素来最小化 OXPHOS 途径,寡霉素是线粒体 ATP 合酶的抑制剂。我们还注射 Rot/AA 以完全关闭 ETC,以评估细胞中的最大糖酵解能力和补偿性糖酵解(图 4A)。葡萄糖是糖酵解的主要燃料。由于 XF 测定培养基不含任何葡萄糖或谷氨酰胺,因此测定中的前三个测量值将是非糖酵解酸化率的指标(图 4B、C),这表明酸化,但与葡萄糖转化为乳酸无关。从A口注射葡萄糖后,ECAR水平升高是糖酵解率的指标(测量值4,5和6)。接下来,通过从端口 B 注射寡霉素和从端口 C 注射 Rot/AA,ETC 被抑制,并且 ECAR 量的增加是糖酵解能力和细胞代偿糖酵解率的指标(图 4B,C)。BMDM 的代偿糖酵解率证明了线粒体应激条件下的细胞能量管理能力。换句话说,该参数表示线粒体呼吸受到抑制时对能量需求的补偿。最后一次注射是来自端口 D 的 2 个脱氧葡萄糖或 2 个 DG,它是葡萄糖的竞争性抑制剂。
在图 4B,C 中,另一种计算方式,特别是如果 3 次测量之间存在较大误差时,可以在每次进样前测量最后一个数据点,并防止数据中出现不必要的错误和变化。
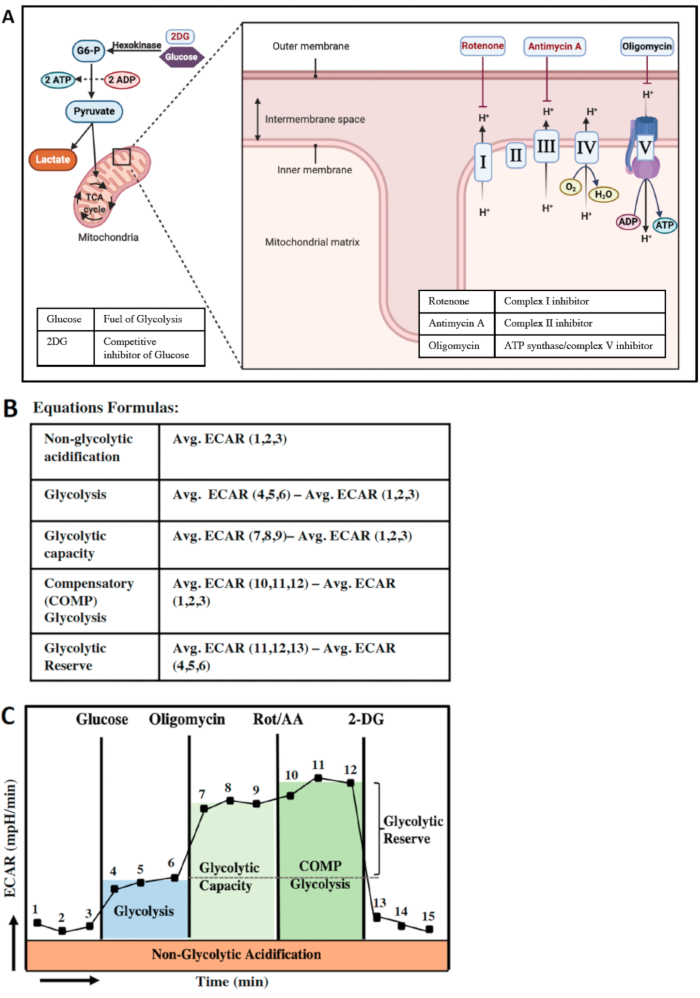
图 4:细胞中的能量产生和糖酵解参数。 (A) 细胞中两个最重要的能量产生途径的示意图;糖酵解(左)和线粒体氧化磷酸化(右)。糖酵解是葡萄糖转化为丙酮酸。XF 分析仪可以检测丙酮酸转化为乳酸产生的质子,如 ECAR (mpH/min) 水平。抑制 ATP 合酶,然后抑制线粒体内电子传递链中的复合物 I 和 II,将通过 OCR 消除 ATP 产生和质子外排。 (B) 糖酵解参数的计算。 (C) 每次化合物注射后的糖酵解功能参数。 请单击此处查看此图的较大版本。
通常,与初始 M0 巨噬细胞相比,极化巨噬细胞具有更多的糖酵解活性。LPS 诱导的 M1 样巨噬细胞具有最高的糖酵解活性。尽管极化巨噬细胞的 OCR 备用呼吸能力 (16) 具有更明显的分离,但此处未显示,但它们的糖酵解代谢也是完全可区分的。需要注意的是,LPS 诱导的 M1 样极化 BMDM 中 ECAR 的增加并不是其他类型的 M1 样极化巨噬细胞(如 LPS + INF-γ 或 PAMP 诱导的 M1 样巨噬细胞)的明确特征,并且它们可能不会在没有糖酵解应激的情况下增加或改变 ECAR。正如预期的那样,在前三个测量值中,这是非糖酵解活性的指标,极化巨噬细胞没有显示出显着差异,因为培养基没有任何葡萄糖或丙酮酸来源(图 5)。注射葡萄糖后,极化 BMDM 表明比幼稚 BMDM 更高水平的糖酵解,与 M0 和 M1 样相比,M1 样 BMDM 表现出最高水平的糖酵解。
通常,糖酵解代谢是 M1 样巨噬细胞首选的 ATP 产生途径,而 OXPHOS 是 M2 样巨噬细胞的主要 ATP 产生途径。注射寡霉素后,BMDM 线粒体电子传递链中的 ATP 合酶复合物将关闭;因此,细胞将开始依赖糖酵解来满足它们的能量需求。由于葡萄糖存在于培养基中,因此极化 BMDM 的糖酵解能力将是相当的。同样,LPS 诱导的 M1 样 BMDM 将具有最高的糖酵解能力。M2 样和 M0 将分别具有较低的糖酵解能力(图 5)。注射 Rot/AA 会抑制线粒体 ETC 的复合物 I 和 III 并完全关闭 OXPHOS,并且 ECAR 水平会略高,这是代偿性糖酵解的指标。同样,在此步骤中,类似 M1 的 BMDM 将具有最高的 ECAR 水平;最后,2DG 是一种竞争性葡萄糖抑制剂和糖酵解阴性对照,将完全关闭糖酵解途径。

图 5:初始 M0 和极化 M1 样(LPS 诱导)和 M2 样(IL4 诱导)BMDM 的糖酵解功能。 极化巨噬细胞的糖酵解参数表示为 ECAR (mpH/min)。(A) M0、M1 样和 M2 样 BMDM 中的非糖酵解酸化速率、糖酵解能力和补偿性糖酵解 (mpH/min) → 端口 A:葡萄糖,端口 B:寡霉素,端口 C:鱼藤酮加抗霉素 A,端口 D:2 脱氧葡萄糖 (B) M0、M1 样和 M2 样 BMDM 的每个参数的条形图。显示的数据来自每个实验 4-6 个培养孔。组间统计显着性基于单向方差分析,Tukey 多重比较检验在“*” p < 0.05,“**” p < 0.01,“***” p < 0.001,“****” p < 0.001。 请单击此处查看此图的较大版本。
讨论
如前所述,细胞外通量分析仪可以通过测量 OCR(耗氧率)(线粒体 OXPHOS 活性的指标)和 ECAR(细胞外酸化率)(糖酵解的指标)来提供有关细胞两个主要能量产生途径的实时信息。巨噬细胞可以使用这两种途径,具体取决于它们的微环境。它们还可以改变能量产生途径17,18。了解巨噬细胞的能量状态及其对不同药物、细胞因子、抑制剂、激活剂等的反应将有助于更好地了解这些细胞的代谢状态。由于糖酵解是在 M1 样巨噬细胞类型中被激活的最关键途径之一,因此实时糖酵解相关信息可以帮助跟踪 M1 样极化 BMDM 在不同体外条件下的变化19。ATP 实时速率测定的细胞外通量分析被高度认为是评估极化 BMDM 的 ATP 产生的一种方法20。本文介绍的方案提供了技术细节和方法,并直观地演示了工作流程,以作为可适应实验需求的综合方案。
该测定法可准确测量基础条件的糖酵解水平和线粒体抑制后的代偿性糖酵解。需要注意的是,细胞外培养基中的一些酸化可能具有线粒体来源21。克雷布斯循环或 TCA 循环产生 CO2 ,它可以通过与水分子22 的反应使介质酸化。当线粒体活性受到抑制时,酸化速率是培养基中乳酸积累的指标。糖酵解负荷试验的优点是在没有任何葡萄糖或丙酮酸来源的培养基中注射葡萄糖,以评估培养基中葡萄糖处理前后的糖酵解水平。
另一方面,糖酵解速率测定通过阻断线粒体活性提供有关糖酵解不同来源的特定信息。换句话说,糖酵解质子外排可以通过从总质子外排中减去 OXPHOS 质子外排来计算。在该方案中,我们将糖酵解测定法合二为一,并最大限度地提高糖酵解数据以获得糖酵解、糖酵解能力、糖酵解储备、补偿性糖酵解和非糖酵解酸化结果。这些参数将更好地了解细胞的代谢状态和糖酵解表型。使用优化的快速简便的归一化方法,可以获得有关糖酵解代谢和代谢重编程的更准确信息 21,22,23。
需要注意的是,尽管糖酵解储备的含义在新的组合系统中没有变化,但该方法中的计算方案已略有改变。在组合系统(图 4B)中,糖酵解储备由平均 ECAR (10,11,12) - 平均 ECAR (4,5,6) 估计。然而,在非组合方法中,糖酵解储备是通过平均 ECAR (7,8,9)-平均 ECAR (4,5,6) 公式计算的。两种计算都提供了非常相似的结果,并反映了糖酵解储备。
此外,值得一提的是,细胞外通量分析仪中存在不同的细胞外酸化指标。细胞外通量分析仪中的糖酵解测定结果可以根据 ECAR (mpH/min)、PPR (pmol H+/min) 和 PER (pmol H+/min) 进行分析。有优点也有缺点,但一般来说,ECAR 是显示细胞外酸化数据的最典型方式。
我们的实验室研究微生物群代谢物对免疫细胞的作用。由于巨噬细胞是动脉粥样硬化等慢性炎症性疾病中免疫系统的关键成分之一 23,24,25,我们有兴趣研究微生物组代谢物对巨噬细胞极化的作用,尤其是由不同的促动脉粥样硬化信号诱导的炎性极化巨噬细胞,如饱和脂肪酸、改性的 LDL, 以及有害的肠道微生物群衍生或依赖代谢物。我们使用流式细胞术和 qPCR 通过 M1 样和 M2 样表面和细胞内标志物确认 BMDM 的极化。我们认为细胞外通量测定是研究中的功能读数。我们通过使用乳酸测定法测量非实时糖酵解因子来进行补充研究。
LPS 诱导的 M1 样极化或 LPS + IFNγ 诱导的 M1 样极化是巨噬细胞中最常见的经典 M1 样激活方式。在 M1 样极化中,向 LPS 中添加 IFNγ 或增加 LPS 浓度会增加线粒体电子传递链中备用呼吸能力的降低。已知 IFNγ 可诱导 M1 样表型,但通常,IFNγ 本身是不够的,需要额外的 TLRs 激动剂来诱导表型。但这取决于疾病和与特定病症有关的 M1 样极化。例如,IFNγ 诱导的 M1 样巨噬细胞不能产生 NO,炎性细胞因子类似于 LPS 或 LPS/IFNγ 诱导的巨噬细胞26。
防止巨噬细胞炎症极化的药物有可能预防和控制动脉粥样硬化。了解 M1 巨噬细胞的代谢途径、能量学和表型特征对于研究不同内源性和外源性药物的作用至关重要。糖酵解是 M1 样巨噬细胞中的主要能量产生途径24,27。
这项简化的研究仅关注极化 BMDM 的糖酵解能量状态。本文中使用的剂量建立在制造商的建议之上,使实验更容易遵循。此外,本研究中使用的大多数化合物均在制造商的标准试剂盒中提供;这有助于节省时间并提高实验的一致性。必须知道化合物剂量、细胞数量和孵育时间的微小差异会影响实验结果。此外,每个实验人员都应针对其特定的细胞类型和条件进行细胞滴定、剂量反应和动力学分析,以了解这些条件在细胞外通量分析仪上的表现。
应该注意的是,在培养基更换、洗涤和归一化步骤中,一些细胞可能会因移液或液体压力而脱落。细胞的汇合度总是可以在显微镜下检测到。如果这些孔有任何划痕或细胞耗竭的迹象,则需要将其排除在研究之外。
我们使用 96 孔微孔板,每孔细胞数量最少,允许在一块板中测试阳性和阴性对照以及不同的条件;因此,该测定对于细胞外通量分析非常节省时间且具有成本效益。本研究针对 BMDM 进行了优化,BMDM 不同于组织驻留的巨噬细胞、腹膜巨噬细胞和巨噬细胞系。
虽然在该方案中我们主要关注细胞外通量分析在促炎状态相关糖酵解中的应用,但细胞外通量分析也可用于评估线粒体功能特征,例如总呼吸、基础线粒体呼吸、ATP 产生、质子泄漏、最大呼吸和备用呼吸能力。线粒体在巨噬细胞代谢重编程中起重要作用。细胞外通量分析仪已用于通过测量细胞的耗氧率来评估线粒体应激和脂肪酸氧化16。
总之,在这里,我们提供了 BMDM 的分离、培养、极化和糖酵解功能分析的综合方案。为所有步骤提供了详细的分步程序和视觉演示。我们希望该协议将帮助研究人员简化他们的分析,并以高质量和高效的方式评估 BMDM 的糖酵解功能。
披露声明
作者没有什么可披露的。
致谢
我们感谢 Joanna Rocha 女士的编辑帮助。这项工作得到了美国国立卫生研究院 (NIH) R01DK118334(Sun 和 Alaniz 博士)和 (NIH) R01A11064Z(Jayaraman 和 Alaniz 博士)的部分支持。
材料
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
参考文献
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. . The Autoimmune Diseases. , 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084 (2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993 (2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846 (2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628 (2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886 (2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. . Metabolic Signaling. , 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. . Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464 (2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657 (2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878 (2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383 (2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。