Method Article
Un protocollo completo ad alta efficienza per l'isolamento, la coltura, la polarizzazione e la caratterizzazione glicolitica dei macrofagi derivati dal midollo osseo
In questo articolo
Riepilogo
Questo protocollo fornisce metodi dettagliati e completi per l'isolamento, la coltura, la polarizzazione e la misurazione dello stato metabolico glicolitico dei macrofagi derivati dal midollo osseo vivo (BMDM). Questo documento fornisce istruzioni dettagliate con illustrazioni visive realistiche per il flusso di lavoro e la valutazione glicolitica dei BMDM in tempo reale.
Abstract
I macrofagi sono tra le più importanti cellule presentanti l'antigene. Molti sottogruppi di macrofagi sono stati identificati con firme metaboliche uniche. I macrofagi sono comunemente classificati come sottotipi M1-like (infiammatori) e M2-like (antinfiammatori). I macrofagi M1-like sono macrofagi pro-infiammatori che vengono attivati da LPS e/o citochine pro-infiammatorie come INF-γ, IL-12 e IL-2. I macrofagi polarizzati M1-like sono coinvolti in varie malattie mediando la difesa dell'ospite contro una varietà di batteri e virus. Questo è molto importante per studiare i macrofagi M1-like indotti da LPS e i loro stati metabolici nelle malattie infiammatorie. I macrofagi M2-like sono considerati macrofagi antinfiammatori, attivati da citochine antinfiammatorie e stimolatori. Nello stato pro-infiammatorio, i macrofagi mostrano un aumento della glicolisi nella funzione glicolitica. La funzione glicolitica è stata attivamente studiata nel contesto della glicolisi, della capacità glicolitica, della riserva glicolitica, della glicolisi compensatoria o dell'acidificazione non glicolitica utilizzando analizzatori di flusso extracellulare (XF).
Questo articolo dimostra come valutare gli stati glicolitici in tempo reale con passaggi facili da seguire quando i macrofagi derivati dal midollo osseo (BMDM) respirano, consumano e producono energia. Utilizzando inibitori e attivatori specifici della glicolisi in questo protocollo, mostriamo come ottenere una visione sistemica e completa dei processi metabolici glicolitici nelle cellule e fornire risultati più accurati e realistici. Per essere in grado di misurare più fenotipi glicolitici, forniamo un metodo di normalizzazione semplice, sensibile e basato sul DNA per la valutazione della polarizzazione dei BMDM. La coltura, l'attivazione/polarizzazione e l'identificazione del fenotipo e dello stato metabolico dei BMDM sono tecniche cruciali che possono aiutare a studiare molti tipi diversi di malattie.
In questo articolo, abbiamo polarizzato i macrofagi M0 naive in macrofagi M1-like e M2-like con LPS e IL4, rispettivamente, e misurato un set completo di parametri glicolitici nei BMDM in tempo reale e longitudinalmente nel tempo, utilizzando l'analisi del flusso extracellulare e attivatori e inibitori glicolitici.
Introduzione
I macrofagi sono una delle cellule più critiche del sistema immunitario innato, simile a M1. Sono coinvolti nell'eliminazione delle malattie infettive, nella fagocitosi, nella presentazione dell'antigene e nella regolazione dell'infiammazione2. Inoltre, i macrofagi sono necessari per regolare altre cellule immunitarie attraverso varie citochine che rilasciano3. C'è un grande spettro nei fenotipi dei macrofagi4. A seconda dei segnali a cui sono esposti, i macrofagi si polarizzano verso diversi stati infiammatori e metabolici5. I macrofagi manifestano alterazioni metaboliche in varie malattie, a seconda del tessuto in cui risiedono i macrofagi6. I macrofagi polarizzati hanno la capacità di riprogrammare o cambiare il loro metabolismo glicolitico, il metabolismo lipidico, il metabolismo degli amminoacidi e la fosforilazione ossidativa mitocondriale (OXPHOS)7,8. I macrofagi M1-like classicamente attivati e i macrofagi M2-like attivati alternativamente sono i due fenotipi dimacrofagi 3 più studiati. I macrofagi quiescenti non attivati sono indicati come macrofagi M0. La polarizzazione dei macrofagi M0 verso un fenotipo simile a M1 può essere indotta dalla stimolazione di BMDM naive con lipopolisaccaride batterico (LPS)9. La via di segnalazione PI3K-AKT-mTOR-HIF1a può essere attivata nei macrofagi in presenza di citochine infiammatorie, interferone-gamma (IFN γ) o fattore di necrosi tumorale (TNF)10. I macrofagi M1-like hanno un aumento dei livelli di metabolismo della glicolisi, una diminuzione dei livelli di fosforilazione ossidativa (OXPHOS), producendo citochine infiammatorie coinvolte nelle malattie infettive e infiammatorie8. D'altra parte, la polarizzazione verso il fenotipo M2-like può essere indotta dall'interleuchina (IL)-4, attraverso le vie JAK-STAT, PPAR e AMPK, o da (IL)-13 e TGFβ pathays11,12.
A differenza dei macrofagi M1-like, i macrofagi M2-like hanno una diminuzione della glicolisi e un aumento dell'OXPHOS e sono coinvolti in attività antiparassitarie e di riparazione tissutale 8,13. I BMDM sono un sistema ampiamente utilizzato per lo studio dei macrofagi derivati dalle cellule staminali del midollo osseo. La glicolisi e l'OXPHOS sono le due principali vie di produzione di energia nelle cellule14. In base al loro microambiente, i BMDM possono scegliere di utilizzare uno di questi percorsi; In alcuni casi, passare da uno all'altro o utilizzare entrambi i percorsi14. In questo studio, ci siamo concentrati sul metabolismo della glicolisi nei macrofagi pro-infiammatori attivati. Quando il glucosio nel citoplasma viene convertito in piruvato e quindi lattato, le cellule producono protoni nel mezzo che causano un aumento del tasso di acidificazione nel mezzo circondato di cellule simili a M15. È stato utilizzato un analizzatore di flusso extracellulare per misurare il tasso di acidificazione dei mezzi cellulari. I risultati sono riportati come tasso di acidificazione extracellulare (ECAR) o come tasso di efflusso protonico.
Un metodo ottimizzato e semplice e veloce per accedere ai livelli di glicolisi nei macrofagi polarizzati è essenziale per determinare il fenotipo glicolitico, i cambiamenti dei metaboliti e gli effetti di inibitori/attivatori e farmaci sui macrofagi polarizzati. Il metodo descritto in questo manoscritto è stato ottimizzato per fornire informazioni su specifici fattori di glicolisi (glicolisi, capacità glicolitica, riserva glicolitica e acidificazione non glicolitica), nonché sulla riprogrammazione metabolica del metabolismo glicolitico. L'inibitore (2DG) che è stato utilizzato in questo studio ha come bersaglio esplicito la via della glicolisi.
Questo protocollo ottimizzato è stato modificato e migliorato sulla base della combinazione di un protocollo16 pubblicato, dell'analisi del flusso extracellulare dei saggi glicolitici delle guide per l'utente del produttore e della comunicazione diretta con gli scienziati di ricerca e sviluppo del produttore.
Protocollo
I topi sono stati sacrificati umanamente secondo le linee guida dell'Assessment and Accreditation of Laboratory Animal Care (AAALAC) e dell'American Association for Laboratory Animal Science (AALAS) e utilizzando protocolli approvati dal comitato istituzionale per la cura e l'uso degli animali della Texas A&M University (IACUC).
1. Raccolta del midollo osseo nei topi e coltura di BMDM
- Sacrificare il topo (6-10 settimane di età i topi C57Bl/6 erano in questo protocollo) e stenderlo sul lato ventrale, tagliare la pelle e lo strato peritoneale e staccare delicatamente le zampe.
NOTA: Utilizzare l'esposizione al gas CO2 per l'eutanasia del topo. - Separare entrambe le zampe posteriori dall'anca in giù, facendo attenzione a non tagliare l'osso.
- Metti l'intera gamba in una provetta conica vuota da 50 ml (con i piedi rivolti verso l'alto per avere una presa facile da estrarre in seguito) sul ghiaccio e procedi con il prelievo di entrambe le gambe dal topo.
2. Esposizione del femore
NOTA: Eseguire i seguenti passaggi in una cabina di biosicurezza.
- Raccogli il femore tagliando la tibia da ciascuna gamba e rimuovi quanto più tessuto possibile che circonda il femore con forbici e carta da laboratorio.
- Mettere i femori raccolti e "puliti" in una piastra di 10 cm contenente un pezzo di carta da laboratorio imbevuto di terreno di coltura tissutale (TC) o PBS. Metteteli sul ghiaccio.
- Continuare a prelevare i femori e rimuovere il tessuto da tutti i femori prima di procedere alla fase di lavaggio (Figura 1A).
3. Vampate di midollo
- Per lavare il midollo dai femori, utilizzare una siringa da 3 ml riempita con terreno TC o PBS con un ago da 23 G. Riempire la siringa prima di esporre il midollo.
- Usa le forbici per esporre il midollo tagliando l'estremità del femore in entrambe le epifisi.
- Inserire la punta dell'ago nel femore e sciacquare delicatamente il midollo in un piatto di 10 cm.
- Far scorrere l'ago su tutta la lunghezza del femore e sciacquare fino a quando il colore dell'osso diventa bianco. Di solito, la maggior parte del midollo può essere espulsa con 2-3 ml di terreno.
- Sciacquare tutti i femori e il midollo osseo nella piastra. Usa un ago per rompere eventuali grumi visibili. Filtrare il midollo in una provetta conica da 50 mL (Figura 1A).
4. Lisi dei globuli rossi
- Centrifugare il midollo a 190 x g per 10 min. Aspirare il surnatante.
- Risospendere il pellet in 4 mL di tampone di lisi ACK con una pipetta. Lasciare agire il tampone di lisi dei globuli rossi per 5 minuti a temperatura ambiente.
- Aggiungere 4 mL di TC medium RPMI-C 10% (RPMI 1640 -GlutaMAX) integrato con 2-mercaptoetanolo, gentamicina, streptomicina e 10% FCS alla sospensione midollare e centrifugare a 1300 x g per 10 min.
- Filtrare nuovamente per rimuovere i detriti di globuli rossi e risospendere in un piccolo volume di RPMI-C 10% per il conteggio.
- Contare le celle con un contatore di celle (Figura 1B). Un contatore di cellule Vi-Cell è stato utilizzato per determinare il conteggio e la vitalità delle cellule nella sospensione.
5. Impiattamento e cultura
- Aggiungere 10 mL di RPMI-C 10% + 10 ng/mL M-CSF (Macrophage Colony Stimulating Factor, un regolatore essenziale della proliferazione, differenziazione e sopravvivenza di monociti/macrofagi) a tutte le piastre da 10 cm desiderate.
- Aggiungere un volume appropriato di celle contate in modo che ogni piastra da 10 cm contenga 1 x 106 cellule. Mettere le piastre in un'incubatrice a 37 °C (giorno 0).
- Il giorno 3, aggiungere delicatamente 5 mL di RPMI-C 10% + 10 ng/mL M-CSF fresco a ciascuna piastra.
NOTA: Il giorno 7, i BMDM dovrebbero essere pronti per il test (Figura 1C).
6. Raccolto da piatti
- Utilizzare un microscopio ottico per verificare che la maggior parte delle cellule abbia aderito alle piastre.
- Aspirare delicatamente il terreno. Quindi aggiungere 3 ml di PBS e agitare delicatamente la piastra. Aspirare bene per rimuovere eventuali cellule non aderenti rimanenti.
- Aggiungere 7-10 mL di PBS freddo alla piastra, utilizzare una pipetta P1000 per lavare il fondo delle piastre e raccogliere tutte le cellule rimanenti in una provetta di raccolta.
NOTA: Tenere le provette sul ghiaccio poiché i macrofagi aderiscono molto strettamente e aderiscono all'interno della provetta. Se le celle fossero mantenute fredde, sarebbero state meno aderenti. - Centrifugare, contare e piastrare, piûą per esperimenti (Figura 1D). Utilizzando la citometria a flusso, le cellule risultanti dovrebbero essere positive al >95% per CD11b e F4/80. (La polarizzazione dei macrofagi è stata determinata mediante colorazione con marcatori M1-like di CD38, TNF-a e MCP-1 e marcatori M2-like di CD206.
NOTA: Eseguire i passaggi 6.1-6.3 nella cabina di biosicurezza ed eseguire il passaggio 6.4 sul piano di lavoro. Mantenere le tecniche asettiche durante tutta la procedura.

Figura 1: Flusso di lavoro grafico della coltura del midollo osseo di topo di macrofagi derivati dal midollo osseo. (A) Prelievo delle zampe, esposizione al femore e lavaggio del midollo; (b) lisi dei globuli rossi; (C) Impiattamento e cultura; (D) Raccolta di cellule dalle piastre. Clicca qui per visualizzare una versione più grande di questa figura.
7. Il giorno prima del test dell'analizzatore di flusso metabolico: semina e polarizzazione delle cellule per il test glicolitico
- Riscaldare l'analizzatore di flusso metabolico a 37 °C accendendo lo strumento.
- Idratare una cartuccia aggiungendo 200 μl di una soluzione calibrante e incubare la cartuccia in un incubatore senza CO2 per una notte (Figura 2A). L'umidità dell'incubatrice senza CO2 non è importante per l'idratazione della cartuccia.
- Un'ora prima dell'esperimento, immergi la piastra un paio di volte su e giù, il che aiuterà a rimuovere le bolle d'aria.
- Progetta la mappa della piastra sul software nel test da sforzo di glicolisi predefinito-iniezione acuta, seguendo le istruzioni del test.
- Fare clic sull'icona del software, quindi fare clic su Test di iniezione acuta da stress glicolisi. Sull'icona di definizione del gruppo, generare i nomi dei gruppi.
- Ci sono cinque cicli di misurazione con una durata di 18 minuti e quattro iniezioni. Cambiare l'iniezione della porta A in glucosio, della porta B in oligomicina, della porta C in rotenone e antimicina A (Rot/AA) e della porta D in 2DG.
- Risospendere le cellule in terreno RPMI-C al 10% e seminare 50k cellule per pozzetto, ad eccezione dei quattro bordi della piastra (A1, A12, H1 e H12; Aggiungere solo terreni, senza cellule) in una micropiastra dell'analizzatore di flusso metabolico fino a un volume finale di 100 μl. Normalmente è necessario un minimo di 40k cellule per condurre questo saggio.
- Lasciare riposare le celle a temperatura ambiente per 45 minuti per evitare l'effetto bordo delle celle. L'effetto bordo si verifica quando il fluido intorno al perimetro della piastra evapora parzialmente, causando variazioni di volume e concentrazione e riducendo la vitalità cellulare.
- Aggiungere 10 ng/mL di LPS per polarizzare i macrofagi naïve verso le cellule M1-like e aggiungere 20 ng/ml di IL-4 per polarizzarli verso le cellule M2-like. Utilizzare almeno 3-6 pozzetti per condizione (Figura 2B).
- Controllare le cellule al microscopio e posizionare la piastra in un incubatore a 37 °C e 5% di CO2 per 24 ore.
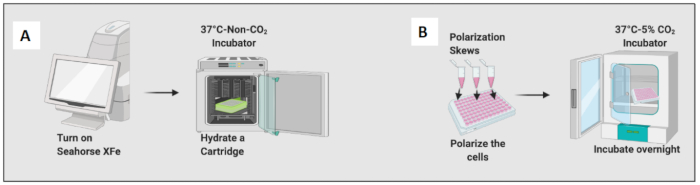
Figura 2: Dimostrazione grafica della semina e della polarizzazione delle cellule. (A) Messa a punto dell'analizzatore di flusso extracellulare e idratazione della cartuccia; (B) Polarizzazione delle cellule e incubazione notturna. Clicca qui per visualizzare una versione più grande di questa figura.
8. Giorno del saggio: XF Medium e preparazione del composto
- Integrare 100 mL di terreno di prova XF RPMI (pH 7,4) con 2 mM di glutammina.
- Sterilizzare il mezzo utilizzando un sistema di filtraggio sottovuoto da 0,2 μm.
- Immergere il terreno di coltura in un bagnomaria a 37 °C per 20 minuti.
- Rimuovere le celle piastrate dall'incubatore a 37 °C, 5% CO2 . Lavare due volte le cellule con il terreno di prova e sostituire il terreno precedente con il terreno di analisi fino al volume finale di 180 μL.
- Utilizzare un microscopio per assicurarsi che tutti i pozzetti abbiano celle confluenti e contrassegnare tutti i pozzetti che presentano graffi dovuti al pipettaggio. In caso di graffi, rimuovere la piastra prima di analizzare.
- Posizionare la piastra contenente le cellule in un incubatore non contenente CO2 per 45 minuti (Figura 3A).
- Utilizzo dei composti e dei terreni di analisi per produrre soluzioni madre di glucosio (100 mM), oligomicina (100 μM), Rot/AA (50 μM) e 2DG (500 mM) (Tabella 1).
- Preparare una miscela per iniezione 10x di ciascun composto utilizzando il terreno di analisi (Tabella 2).
| Scorte di iniezione (fornite nei kit) | Aggiungere un terreno di prova completo (mL) | Concentrazione finale dello stock (μM) |
| Glucosio | 3 | 100 mila |
| Oligomicina | 0.72 | 100 |
| 2-DG | 3 | 100mila |
Tabella 1. Scorte di iniezione
| Porte sulla cartuccia | Soluzioni a magazzino | Aggiungi volume di stock | Aggiunta di terreni di analisi | Concentrazione finale delle iniezioni (10x) | Aggiungere questo volume alla porta designata (μL) | Concentrazione finale dopo l'iniezione in ogni pozzetto |
| Un | Glucosio (100 mM) | 3000 μl + 0 μl | 100 mM | 20 | 10 mM | |
| B | Oligomicina (100 μM) | 300 μl + 2700 μl | 10 μM | 22 | 1,0 μM | |
| C | Rotenone/ Antimicina A (50 μM) | 300 μl + 2700 μl | 5 μM | 25 | 0,5 μM | |
| D | 2-DG (500 mM) | 300 μl + 0 μl | 500 mM | 28 | 50 mM | |
Tabella 2. Concentrazioni finali di iniezione
9. Giorno del test: Esecuzione del test glicolitico acuto su macrofagi polarizzati
- Aprire il modello salvato del test da stress di glicolisi (iniezione acuta) dal software. Il test di glicostress acuto predefinito prevede 3 minuti di miscelazione e misurazione prima di ogni iniezione.
- Controlla il modello e i dettagli del test e, quando sei pronto, fai clic su Esegui e segui le istruzioni del test predefinito. Tuttavia, tutti i parametri possono essere personalizzati.
- Rimuovere la cartuccia del sensore dall'incubatrice senza CO2 , rimuovere il coperchio e inserirla nello strumento in modo che il pozzetto A1 della piastra della cartuccia cada nell'angolo in alto a sinistra del pannello di inserimento della macchina. Di solito, la calibrazione dura dai 20 ai 45 minuti.
- Al termine della calibrazione, il dispositivo espellerà la piastra contenente la soluzione calibrante e manterrà la cartuccia del sensore. Rimuovere il calibrante contenente la piastra.
- Rimuovere la piastra cellulare dall'incubatore non CO2 , rimuovere il coperchio della piastra e inserirla nella macchina. Fare clic su Esegui (Figura 3B).
- Al termine del test, la macchina espelle la piastra cellulare e la cartuccia del sensore.
- Rimuovere il supporto dalla piastra e congelarlo a -20 °C per un'ulteriore normalizzazione.
- Utilizzare il kit di test di proliferazione cellulare commerciale (ad es. CyQUANT) per normalizzare le cellule.
- Aggiungere 1 mL di Composto B o tampone di lisi a 19 mL di acqua distillata priva di nucleasi.
- Aggiungere 100 μl di soluzione di lavoro composta A o GR alla soluzione sopra menzionata.
- Assicurarsi che le celle della piastra siano scongelate, quindi aggiungere 200 μl di soluzione a ciascun pozzetto.
- Incubare per 5 minuti a temperatura ambiente (RT).
- Misura la fluorescenza in lunghezze d'onda di eccitazione di 480 nm e di emissione di 520 nm utilizzando un lettore di piastre.
- Normalizza le celle sul pannello di normalizzazione del software.
- Normalizzare le cellule in base alla conta delle cellule dei macrofagi naive (Figura 3C). Considera la media dei macrofagi naïve come 1 (dividendo il numero di cellule di ciascun pozzetto per il numero medio di cellule dei macrofagi naïve) e applicali a tutti i macrofagi.
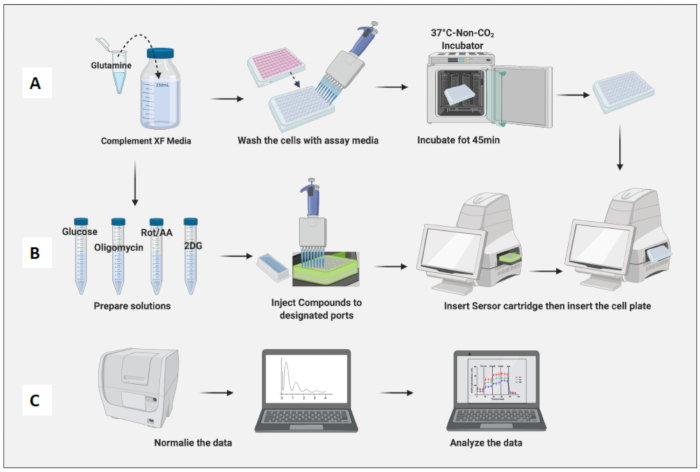
Figura 3: Giorno del saggio: preparazione del terreno e del composto ed esecuzione del saggio. (A) Preparazione delle cellule per il saggio; (B) Preparazione, calibrazione ed esecuzione del saggio dei composti; (C) Normalizzazione e analisi dei dati. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
La glicolisi e la fosforilazione ossidativa mitocondriale sono le due principali vie di produzione di ATP nelle cellule (Figura 4A). Alcune cellule hanno la capacità di passare da un percorso all'altro per soddisfare le loro richieste di energia. La conversione del glucosio in piruvato nel citoplasma è chiamata glicolisi. Il piruvato ha due destini; verrà convertito in lattato o ulteriormente metabolizzato attraverso il ciclo TCA e infine attraverso la catena di trasporto degli elettroni (ETC) per produrre più ATP. Al fine di ottenere la migliore comprensione dei parametri glicolitici delle cellule, minimizziamo le vie OXPHOS utilizzando l'oligomicina, che è un inibitore dell'ATP sintasi mitocondriale. Iniettiamo anche Rot/AA per spegnere completamente l'ETC per valutare la massima capacità glicolitica e la glicolisi compensatoria nella cellula (Figura 4A). Il glucosio è il carburante principale della glicolisi. Poiché il terreno di prova XF non contiene glucosio o glutammina, le prime tre misurazioni del test saranno un indicatore del tasso di acidificazione non glicolitica (Figura 4B, C), che è indicativo di acidificazione ma non correlato alla conversione del glucosio in lattato. Dopo l'iniezione di glucosio dalla porta A, l'aumento dei livelli di ECAR è un indicatore dei tassi di glicolisi (misure 4, 5 e 6). Successivamente, mediante iniezione di oligomicina dalla porta B e iniezione di Rot/AA dalla porta C, l'ETC viene inibito e l'aumento delle quantità di ECAR è un indicatore della capacità glicolitica e dei tassi di glicolisi compensatoria delle cellule (Figura 4B, C). I tassi di glicolisi compensatoria dei BMDM dimostrano la capacità di gestione dell'energia cellulare in condizioni di stress mitocondriale. In altre parole, questo parametro indica la compensazione della domanda di energia quando la respirazione mitocondriale è inibita. L'ultima iniezione è 2 deossiglucosio o 2DG dalla porta D che è un inibitore competitivo del glucosio.
Nella Figura 4B, C un calcolo alternativo, soprattutto se ci sono grossi errori tra 3 misurazioni, è che si può misurare l'ultimo punto dati prima di ogni iniezione e prevenire errori e variazioni inutili nei dati.
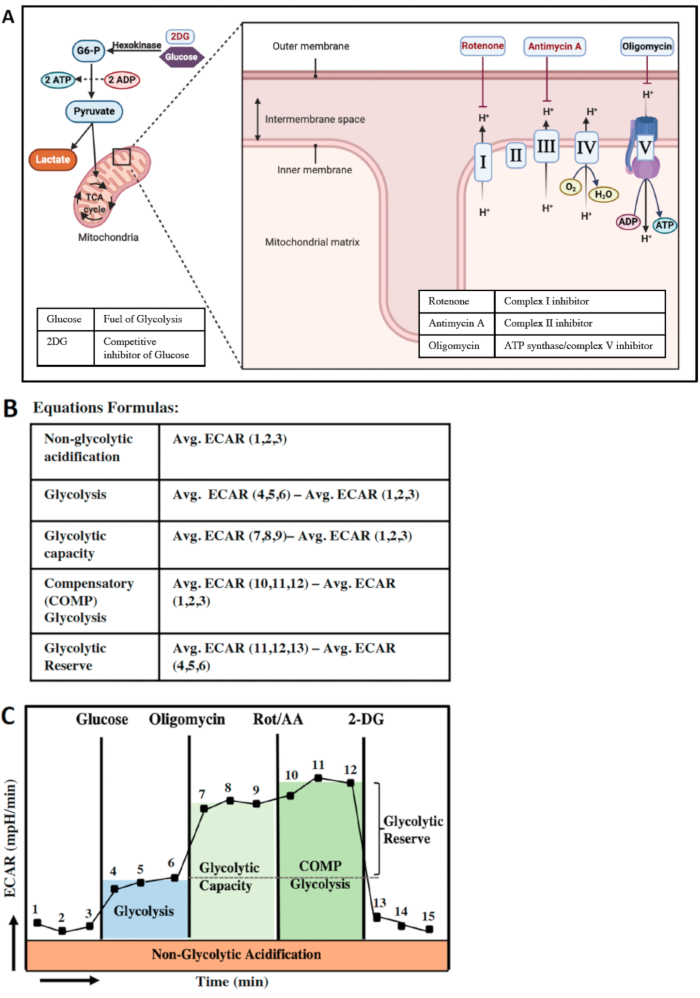
Figura 4: Produzione di energia nella cellula e parametri glicolitici. (A) visione schematica delle due più importanti vie di produzione di energia nella cellula; Glicolisi (a sinistra) e fosforilazione ossidativa mitocondriale (a destra). La glicolisi è la conversione del glucosio in piruvato. L'analizzatore XF è in grado di rilevare i protoni prodotti dalla conversione del piruvato in lattato come livelli di ECAR (mpH/min). L'inibizione dell'ATP sintasi seguita dall'inibizione dei complessi I e II, la catena di trasporto degli elettroni mitocondriale, eliminerà la produzione di ATP e l'efflusso di protoni attraverso l'OCR. (B) calcolo dei parametri glicolitici. (C) Parametri di funzione glicolitica dopo ogni iniezione di composto. Clicca qui per visualizzare una versione più grande di questa figura.
Generalmente, i macrofagi polarizzati hanno più attività glicolitiche rispetto ai macrofagi M0 naive. I macrofagi M1-like indotti da LPS possiedono la più alta attività glicolitica. Sebbene i macrofagi polarizzati abbiano separazioni più distinte nella loro capacità respiratoria di riserva OCR (16), che non è stata mostrata qui, anche il loro metabolismo glicolitico è del tutto distinguibile. È importante notare che un aumento dell'ECAR nei BMDM polarizzati M1-like indotti da LPS non è una caratteristica definita per altri tipi di macrofagi polarizzati M1-like (come LPS + INF-γ o i macrofagi M1-like indotti da PAMP), e potrebbero non aumentare o modificare l'ECAR senza stress glicolitico. Come previsto, nelle prime tre misurazioni, che è l'indicatore dell'attività non glicolitica, i macrofagi polarizzati non mostrano una differenza significativa perché i mezzi non hanno fonti di glucosio o piruvato (Figura 5). Dopo l'iniezione di glucosio, i BMDM polarizzati indicano livelli più elevati di glicolisi rispetto ai BMDM naive e i BMDM simili a M1 dimostrano i livelli più elevati di glicolisi rispetto a M0 e M1-simili.
Tipicamente, il metabolismo glicolitico è la via di produzione di ATP preferita utilizzata dai macrofagi M1-like e OXPHOS è la principale via di produzione di ATP per i macrofagi M2-like. Dopo l'iniezione di oligomicina, il complesso ATP sintasi nella catena di trasporto degli elettroni mitocondriali dei BMDM si spegne; Pertanto, le cellule inizieranno a fare affidamento sulla glicolisi per soddisfare le loro richieste energetiche. Poiché il glucosio è presente nel mezzo, la capacità glicolitica dei BMDM polarizzati sarà paragonabile. Ancora una volta, i BMDM M1-like indotti da LPS avranno la più alta capacità glicolitica. M2-like e M0 avranno capacità glicolitiche inferiori, rispettivamente (Figura 5). L'iniezione di Rot/AA inibirà i complessi I e III dell'ETC mitocondriale e spegnerà completamente l'OXPHOS, e ci sarà un aumento leggermente superiore dei livelli di ECAR, che è un indicatore della glicolisi compensatoria. Anche in questo caso, i BMDM M1-like avranno i livelli di ECAR più elevati in questa fase; infine, il 2DG, un inibitore competitivo del glucosio e un controllo negativo per la glicolisi, spegnerà completamente la via della glicolisi.

Figura 5: Funzioni glicolitiche di M0 naive e BMDM polarizzati M1-like (indotti da LPS) e M2-like (indotti da IL4). Parametri glicolitici dei macrofagi polarizzati indicati come ECAR (mpH/min). (A) Tasso di acidificazione non glicolitica, glicolisi, capacità glicolitica e glicolisi compensatoria come ECAR (mpH/min) nei BMDM M0, M1-like e M2-like. Le iniezioni delle porte sono le seguenti: → porta A: glucosio, porta B: oligomicina, porta C: Rotenone più antimicina A e porta D: 2 Deossi glucosio (B) Grafici a barre di ciascun parametro per BMDM M0, M1-like e M2-like. I dati mostrati provengono da 4-6 pozzetti di coltura per esperimento. La significatività statistica tra i gruppi si basa sull'ANOVA unidirezionale con il test di confronto multiplo di Tukey a "*" p < 0,05, la significatività a "**" p < 0,01, la significatività a "***" p < 0,001, la significatività a "****" p < 0,0001.Le barre di errore derivano dalla deviazione standard. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Come accennato in precedenza, la macchina analizzatrice di flusso extracellulare può fornire informazioni in tempo reale su due principali percorsi di produzione di energia delle cellule misurando l'OCR (tasso di consumo di ossigeno), un indicatore dell'attività OXPHOS mitocondriale, e l'ECAR (tasso di acidificazione extracellulare) che è un indicatore della glicolisi. I macrofagi possono utilizzare entrambe le vie, a seconda del loro microambiente. Possono anche cambiare i loro percorsi di produzione di energia17,18. Comprendere gli stati energetici dei macrofagi e le loro risposte a diversi farmaci, citochine, inibitori, attivatori, ecc. fornirà una migliore comprensione degli stati metabolici di queste cellule. Poiché la glicolisi è una delle vie più critiche che vengono attivate nei tipi di macrofagi M1-like, le informazioni relative alla glicolisi in tempo reale possono aiutare a tracciare i cambiamenti dei BMDM polarizzati M1-like in diverse condizioni in vitro19. L'analisi del flusso extracellulare del saggio del tasso di ATP in tempo reale è molto apprezzata come un modo per valutare la produzione di ATP dei BMDM polarizzati20. Il protocollo qui presentato fornisce dettagli tecnici e approcci con una dimostrazione visiva del flusso di lavoro per fungere da protocollo completo che può essere adattato alle esigenze sperimentali.
Questo test fornisce misurazioni accurate dei livelli glicolitici per le condizioni basali e la glicolisi compensatoria dopo l'inibizione mitocondriale. È importante notare che parte dell'acidificazione nei mezzi extracellulari può avere una fonte mitocondriale21. Il ciclo di Krebs o ciclo TCA produce CO2 che può acidificare il mezzo attraverso la sua reazione con le molecole d'acqua22. Quando l'attività mitocondriale è inibita, i tassi di acidificazione sono indicatori dell'accumulo di lattato nel terreno. Il vantaggio del test da stress glicolitico è l'iniezione di glucosio in un terreno che non ha fonti di glucosio o piruvato per valutare i livelli di glicolisi prima e dopo il trattamento del glucosio nel terreno.
D'altra parte, il saggio del tasso glicolitico fornisce informazioni specifiche sulle diverse fonti di glicolisi bloccando l'attività mitocondriale. In altre parole, l'efflusso di protoni glicolitico può essere calcolato sottraendo l'efflusso di protoni OXPHOS dall'efflusso di protoni totale. In questo protocollo, abbiamo combinato i saggi glicolitici in un unico saggio e massimizzato i dati glicolitici per ottenere risultati di glicolisi, capacità glicolitica, riserva glicolitica, glicolisi compensatoria e acidificazione non glicolitica. Questi parametri consentiranno di comprendere meglio gli stati metabolici e il fenotipo glicolitico delle cellule. Con un metodo di normalizzazione ottimizzato e semplice e veloce, sarebbe possibile ottenere informazioni più accurate sul metabolismo glicolitico e sulla riprogrammazione metabolica 21,22,23.
È importante notare che, sebbene l'implicazione della riserva glicolitica non cambi nel nuovo sistema combinato, lo schema di calcolo del metodo è stato leggermente modificato. Nel sistema combinato (Figura 4B), la riserva glicolitica è stimata da Media ECAR (10,11,12)-Media ECAR (4,5,6). Tuttavia, nei metodi non combinati, la riserva glicolitica è calcolata con la formula media ECAR (7,8,9)-media ECAR (4,5,6). Entrambi i calcoli forniscono risultati molto simili e riflettono la riserva glicolitica.
Inoltre, vale la pena ricordare che ci sono diverse metriche di acidificazioni extracellulari negli analizzatori di flusso extracellulare. I risultati dei saggi glicolitici negli analizzatori di flusso extracellulare possono essere analizzati in base a ECAR (mpH/min), PPR (pmol H+/min) e PER (pmol H+/min). Ci sono vantaggi e svantaggi, ma in generale, l'ECAR è il modo più tipico di visualizzare i dati di acidificazione extracellulare.
Il nostro laboratorio studia il ruolo dei metaboliti del microbiota sulle cellule immunitarie. Poiché i macrofagi sono uno dei componenti chiave del sistema immunitario nelle malattie infiammatorie croniche come l'aterosclerosi 23,24,25, siamo interessati a studiare il ruolo dei metaboliti del microbioma sulla polarizzazione dei macrofagi, in particolare dei macrofagi polarizzati infiammatori che sono stati indotti da diversi segnali proaterogeni come acidi grassi saturi, LDL modificati, e metaboliti dannosi derivati dal microbiota intestinale o dipendenti. Confermiamo la polarizzazione dei BMDM da parte di marcatori di superficie e intracellulari M1-like e M2-like utilizzando la citometria a flusso e la qPCR. Consideriamo i saggi di flusso extracellulare come letture funzionali negli studi. Eseguiamo studi complementari misurando i fattori di glicolisi non in tempo reale con un dosaggio del lattato.
La polarizzazione M1-like indotta da LPS o la polarizzazione M1-like indotta da LPS + IFNγ sono la modalità di attivazione M1-like classica più comune nei macrofagi. Nella polarizzazione M1-like, l'aggiunta di IFNγ all'LPS o l'aumento della concentrazione di LPS aumenterà la riduzione della capacità respiratoria di riserva nella catena di trasporto degli elettroni mitocondriali. L'IFNγ è noto per indurre un fenotipo M1-simile, ma, di solito, l'IFNγ da solo non è sufficiente e richiede ulteriori agonisti dei TLR per indurre il fenotipo. Ma questo dipende dalle malattie e dalla polarizzazione M1-like relativa a una condizione specifica. Ad esempio, i macrofagi M1-like indotti da IFNγ non possono produrre NO e citochine infiammatorie simili a LPS o macrofagi indotti da LPS/IFNγ26.
I farmaci che prevengono la polarizzazione infiammatoria dei macrofagi hanno il potenziale per prevenire e controllare l'aterosclerosi. Comprendere le vie metaboliche, l'energia e le caratteristiche fenotipiche dei macrofagi M1 è essenziale per studiare il ruolo di diversi farmaci endogeni ed esogeni. La glicolisi è la via dominante per la produzione di energia nei macrofagi M1-like24,27.
Questo studio semplificato si concentra solo sugli stati energetici glicolitici dei BMDM polarizzati. Le dosi utilizzate in questo articolo si basano sulle raccomandazioni del produttore e rendono l'esperimento molto più facile da seguire. Inoltre, la maggior parte dei composti utilizzati in questo studio sono forniti nel kit standard del produttore; Questo aiuta a risparmiare tempo e a migliorare la coerenza degli esperimenti. È essenziale sapere che lievi differenze nelle dosi dei composti, nel numero di cellule e nei tempi di incubazione possono influenzare i risultati dell'esperimento. Inoltre, ogni sperimentatore dovrebbe eseguire una titolazione cellulare, una dose-risposta e un'analisi cinetica per il proprio tipo di cellula e le condizioni particolari per capire come si comportano tali condizioni sull'analizzatore di flusso extracellulare.
Si noti che durante le fasi di cambio del terreno, lavaggio e normalizzazione, alcune cellule possono staccarsi a causa del pipettaggio o della pressione del fluido. La confluenza delle cellule è sempre rilevabile al microscopio. Questi pozzetti devono essere esclusi dallo studio se presentano segni di graffi o esaurimento delle cellule.
Utilizziamo micropiastre a 96 pozzetti con un numero minimo di cellule per pozzetto, consentendo di testare controlli positivi e negativi, nonché condizioni diverse in un'unica piastra; Pertanto, questo test consente di risparmiare molto tempo ed è efficiente in termini di costi per l'analisi del flusso extracellulare. Questo studio è stato ottimizzato per i BMDM, che sono diversi dai macrofagi residenti nei tessuti, dai macrofagi peritoneali e dalle linee cellulari di macrofagi.
Mentre in questo protocollo ci siamo concentrati principalmente sull'applicazione dell'analisi del flusso extracellulare nella glicolisi associata allo stato pro-infiammatorio, l'analisi del flusso extracellulare può essere utilizzata anche per valutare le caratteristiche della funzione mitocondriale come la respirazione totale, la respirazione mitocondriale basale, la produzione di ATP, la perdita di protoni, la respirazione massimale e la capacità respiratoria di riserva. I mitocondri svolgono un ruolo importante nella riprogrammazione metabolica dei macrofagi. Gli analizzatori di flusso extracellulare sono stati utilizzati per valutare lo stress mitocondriale e l'ossidazione degli acidi grassi misurando il tasso di consumo di ossigeno delle cellule16.
In conclusione, qui, abbiamo fornito un protocollo completo per l'isolamento, la coltura, la polarizzazione e l'analisi funzionale glicolitica dei BMDM. Sono state fornite procedure dettagliate passo-passo e dimostrazioni visive per tutte le fasi. Ci auguriamo che questo protocollo aiuti i ricercatori a semplificare le loro analisi e a valutare la funzione glicolitica dei BMDM con alta qualità ed efficienza.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo la signora Joanna Rocha per l'assistenza editoriale. Il lavoro è stato parzialmente sostenuto dal National Institutes of Health (NIH) R01DK118334 (ai dottori Sun e Alaniz) e (NIH) R01A11064Z (ai dottori Jayaraman e Alaniz).
Materiali
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
Riferimenti
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. . The Autoimmune Diseases. , 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084 (2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993 (2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846 (2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628 (2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886 (2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. . Metabolic Signaling. , 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. . Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464 (2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657 (2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878 (2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383 (2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.