Method Article
Luciferase Tabanlı Büyüme Testini Kullanarak Hücre İçi Toksoplazma Gondii Büyümesine Karşı Kimyasal Inhibitör Verimliliğin Belirlenmesi
Bu Makalede
Özet
Burada sunulan bir luciferase tabanlı büyüme tsay kullanarak Toxoplasma gondii in vitro hücre içi büyümeye karşı kimyasal bileşiklerin inhibisyon etkinliğini değerlendirmek için bir protokoldür. Bu teknik, ilgili hedef genin genetik olarak silinmesi ile inhibisyon özgüllüğünü doğrulamak için kullanılır. LHVS'nin TgCPL proteaza karşı inhibisyonu örnek olarak değerlendirilmektedir.
Özet
Toksoplazma gondii yaygın insan popülasyonu etkileyen bir protozoon patojendir. Klinik toksoplazmoz tedavisinde kullanılan mevcut antibiyotikler sınırlıdır. Buna ek olarak, insanların bazı gruplarda yan etkiler sergilerler. Bu nedenle, klinik toksoplazmoz için yeni terapötik lerin keşfi zorunludur. Yeni antibiyotik gelişiminin ilk adımı, yüksek verim tarama stratejisi kullanarak parazit büyümesinin inhibisyonunda yüksek etkinlik gösteren kimyasal bileşikleri belirlemektir. Zorunlu bir hücre içi patojen olarak, Toxoplasma sadece konak hücreleri içinde çoğalabilir, bu da büyümenin hızlı bir göstergesi olarak optik emici ölçümlerin kullanımını yasaklar. Burada luciferase tabanlı büyüme test için ayrıntılı bir protokol sunulmaktadır. Örnek olarak, bu yöntem yabani tip Toxoplazma parazitlerinin iki katına saatini hesaplamak ve parazit intrasellüler büyümein inhibisyonu ile ilgili morolinurea-lucyl-homophenyl-vinil sülfone fenilin (LHVS, bir sistein proteaz hedefleme siper-hedefleme bileşiği) etkinliğini ölçmek için kullanılır. Ayrıca, homolojiye bağımlı rekombinasyon (HDR) için 50 bp homolog bölgeler kullanılarak Toxoplasma'da CRISPR-Cas9 tabanlı gen deletion protokolü de tanımlanmıştır. Yabani tip ve TgCPL (Toxoplasma cathepsin L benzeri proteaz) -eksik parazitlerde LHVS inhibisyon etkinliğini ölçerek, LHVS'nin Δcpl büyümesine göre yabani tip parazit büyümesini daha verimli bir şekilde engellediğini ve TGCPL'nin Toxoplasma'daLHVS'nin bağlanan bir hedef olduğunu düşündürmektedir. Bu luciferase bazlı büyüme testinin yüksek hassasiyeti ve kolay çalışması, Toxoplasma proliferasyonunun izlenmesi ve ilaç etkinliğinin yüksek verim li bir şekilde değerlendirilmesi için uygundur.
Giriş
Toksoplazma gondii insan nüfusunun yaklaşık üçte birini enfekte eden son derece başarılı bir hücre içi parazittir. Yüksek iletim hızı ağırlıklı olarak az pişmiş et tüketimi, memeli rezervuarlarına maruz kalma ve doğum sırasında konjenital iletim de dahil olmak üzere çeşitli iletim yolları kaynaklanmaktadır. T. gondii esas olarak immünazasyonlu bireylerde şiddetli morbidite ve mortaliteye yol açabilir fırsatçı enfeksiyonlara neden olur1,2,3,4,5,6. Şu anda akut toksoplazmoz tedavisinde kullanılan antibiyotikler konjenital ve gizli enfeksiyonların tedavisinde özellikle verimsiz ve bazı kişilerde şiddetli reaksiyonlara neden3,7,8. Böylece, acil bir ihtiyaç yeni terapötik belirlemek için var. Toxoplasma ve ev sahibi içindeki hücre altı süreçlerdeki farklılıkların anlaşılması potansiyel uyuşturucu hedeflerinin belirlenmesine yardımcı olacaktır. Bu nedenle, toxoplasmaiçinde bireysel genlerin rollerini incelemek için etkili ve uygun genom manipülasyon teknikleri gereklidir. Ayrıca, Toxoplasma phylum Apicomplexa aittir, Plasmodium spp. ve Cryptosporidium spp gibi diğer birçok önemli insan patojenleri içerir. Bu nedenle, Toxoplasma diğer apicomplexan parazitler temel biyoloji çalışmaya yardımcı olmak için bir model organizma olarak kullanılabilir.
Mikrobiyal patojenlere karşı yeni antibiyotikleri belirlemek için, mikrobiyal büyümenin bastırılmasında etkinliğini belirlemek için başlangıçta kimyasal bileşikler kütüphanesinin yüksek verim taraması yapılır. Şimdiye kadar, T hücre içi büyümesini ölçmek için çeşitli mikroplaka tabanlı büyüme tahlilleri geliştirilmiştir. gondii (yani, radyoaktif 3H-urasil kuruluş tabanlınicel9, t. gondii-spesifik antikorlar 10 kullanarak kantitatif ELISA tabanlı parazit tespiti10,11, β-galaktosidaz veya YFP ifade toksoplazma suşları12,13, ve son zamanlarda geliştirilen yüksek içerikli görüntüleme assay14).
Bu bireysel stratejilerin hepsinin benzersiz avantajları vardır; ancak, bazı sınırlamalar da uygulamalarını kısıtlar. Örneğin, Toxoplasma sadece çekirdekli hayvan hücrelerinde çoğalabildiği için, otofloresans veanti-T. gondii antikorlarının hücreleri barındırmak için spesifik olmayan bağlanması floresan bazlı ölçümlerde parazite neden olur. Ayrıca, radyoaktif izotopların kullanımı özel güvenlik uyumluluğu ve potansiyel güvenlik sorunları gerektirir. Bu tahlillerden bazıları, büyümeyi sürekli izlemek yerine büyümeyi tek bir zaman diliminde değerlendirmek için daha uygundur.
Burada sunulan hücre içi Toksoplazma büyüme nin nicelleştirilmesi için luciferase tabanlı bir protokoldür. Bir önceki çalışmada, NanoLuc luciferase geni Toxoplasma tubulin organizatörü altında klonlanmış ve bu luciferase ekspresyonu yapısı yabani tip (RHΔku80Δhxg suşu) parazitler içine bir RHΔku80Δhxgoluşturmak için transfeced oldu ::NLuc suşu (RHΔku80olarak anılacaktır ::NLuc afterafter)15. Bu suş bu çalışmada hücre içi büyüme tayini ve gen deletion için ebeveyn zorlanma olarak görev yaptı. RHΔku80kullanılarak ::NLuc suşu, insan sünnet derisi fibroblastlarında parazit büyümesi (HFF) parazit katlama süresini hesaplamak için 96 saatlik bir enfeksiyon sonrası dönemde izlendi.
Buna ek olarak, Parazit büyümesine karşı LHVS inhibisyonu etkinliği, IC50 değerini belirlemek için seri LHVS konsantrasyonlarına karşı Toxoplasma büyüme oranları çizilerek belirlenebilir. Önceki literatürtgCPL parazitlerde LHVS önemli bir hedef olduğunu ve LHVS ile tedavi akut ve kronik Toksoplazma enfeksiyonları16,17,,18,19gelişimini azalttığını bildirmiştir. Ayrıca, RHΔku80::NLuc bir TgCPL-eksik suşu oluşturmak için genom modifikasyonu için ebeveyn zorlanma olarak kullanılmıştır (RHΔku80Δcpl::NLuc), ve LHVS inhibisyonu bu mutant karşı ölçüldü. TgCPL-eksikparazitlerde LHVS için IC50 değerlerinin WT suşuna göre yükseltilerek, TgCPL'nin lhvs tarafından in vivo olarak hedeflendirildi.
Bu protokolde, RHΔku80::NLuc etkili bir homolog olmayan son birleştirme yolu (NHEJ) yoksun ebeveyn suşu olarak kullanılır, böylece çift crossover homoloji bağımlı rekombinasyon kolaylaştırmak (HDR)20,21. Ayrıca, 50 bp homolog bölgeler PCR tarafından bir ilaç direnci kaset her iki ucunda çevrilidir. PCR ürünü CRISPR-Cas9 tabanlı genom düzenleme araçları kullanarak HDR üzerinden tüm gen locus kaldırmak için bir onarım şablonu olarak hizmet vermektedir. Bu tür kısa homolog bölgeler kolayca astariçine dahil edilebilir, onarım şablonu üretimi için uygun bir strateji sağlayan. Bu protokol, evrensel gen silme ve endojen gen etiketleme gerçekleştirmek için değiştirilebilir.
Örneğin, en son yayınımızda, üç proteaz gen, TgCPL, TgCPB (Toxoplasma cathepsin B benzeri proteaz) ve TgSUB1 (Toxoplasma subtilisin benzeri proteaz 1), genetik olarak TgCRT (Toxoplasma kloroquine-direnç taşıyıcı) -bu yöntemi kullanarak eksik parazitler15. Ayrıca, TgAMN (bir putatif aminopeptidaz N [TgAMN, TGGT1_221310]) endojenetiketli 15. Lourido laboratuarı da benzer bir yöntem kullanarak Toxoplasma genomunda site yönelimli gen mutasyonu ve endojen gen etiketleme giriş için 40-43 bp aralığında kısa homolog bölgeler kullanılarak rapor22. Bu başarılı genom modifikasyonları, Toxoplasma gondii'dekigenom manipülasyonunu büyük ölçüde kolaylaştıran TgKU80-eksiksuşunda 40-50 bp homolog bölgenin verimli DNA rekombinasyonları için yeterli olduğunu göstermektedir.
Protokol
Toksoplazma gondii Risk Grubu 2'de sınıflandırılır ve Biyogüvenlik Düzey 2'de (BSL-2) kullanılmalıdır. Protokol Clemson Üniversitesi Kurumsal Biyogüvenlik Komitesi tarafından gözden geçirildi ve onaylandı.
1. Luciferase tabanlı Toxoplasma büyüme test
- Tohum insan sünnet derisi fibroblastlar (HFFs) 1 hafta önce parazit aşısı ev sahibi hücrelerin tam olarak konca olduğundan emin olmak için. Parazitlerin değerlendirme süresi boyunca hücre içi kalmasını sağlamak için şeffaf bir plaka içinde sahte bir tetki gerçekleştirin.
NOT: Burada, titreci 96 kuyu mikroplakasında yapılır. Deneysel ihtiyaçlara göre 384 veya 1536 kuyu mikroplakasına kadar ölçeklendirilebilir. - Toxoplasma parazitlerini kullanımdan 2 gün önce ~ 0.3-0.4 mL tamamen lized edilmiş parazitleri T25 şişesine aktararak confluent HF'lere geçirin. Enfekte konak hücreleri 37 °C'de %5 CO2 ile 2 gün boyunca kuluçkaya yatırın.
- Şırınga 5 mL taze lized parazitler 21 G güvenlik iğnesi ile hücre içi parazitleri kurtarmak için 5x, sonra konak hücre enkaz kaldırmak için 3 μm filtre geçmek. 7 mL fenol kırmızısız D10 ortamı kullanarak şişeden kalan parazitleri durulayın, ardından tekrar filtreden geçirin.
- Oda sıcaklığında 10 dk (RT) için 1000 x g centrifuge parazitler. Supernatant dökün ve fenol kırmızı içermeyen D10 medya 10 mL pelet resuspend.
- Konsantrasyonu belirlemek için hemositometre kullanan parazitleri sayın.
- Yabani tip (WT) suşu için parazitleri 1 x 104 parazit/mL'ye seyreltin. Büyüme eksikliği parazit suşları için, buna göre luciferase sinyalleri önemli bir artış gözlemlemek için konsantrasyonu artırmak.
- Aspirasyon ortamı, HF'lerle önceden tohumlanmış 96 kuyu mikroplakasından dikkatlice asetin ve üç teknik çoğaltma ve beş zaman noktasını temsil eden üç sütun ve beş satırlık bir biçimde 150 μL parazit süspansiyonu kuyulara aşılayın.
- Mikro plakayı 37 °C'de ve %5 CO2'yi 4 saat kuluçkaya yatırın.
- İşgal edilmeyen parazitleri gidermek için kuyulardan ortam aspirasyon, ardından kuyuları her satırda RT fenol kırmızısız ortamla doldurun (ilk satır hariç).
- Eşit hacimlerde PBS ve 2x luciferase tsay tamponu karıştırın ve luciferase substratını 12,5 μM'ye seyreltin.
- Üst sıranın her bir kuyunun içine 100 μL seyreltik luciferase substrat ekleyin. Hücrelerin tamamen düzgün ceremesini sağlamak için mikroplakaları 10 dk boyunca RT'de kuluçkaya yatırın.
- Bir mikroplaka okuyucu kullanarak luciferase aktivitesini ölçün. Plaka okuyucu ayarları Tablo 1'delistelenmiştir. Her okuma 4 saat sonrası enfeksiyon da işgal parazitlerin ilk sayısını temsil eder.
- Orta yı değiştirmeden her 24 saat boyunca her satır için 1,9-1,12 adımlarını 4 gün boyunca tekrarlayın. Bu ölçümler, 24 saat, 48 h, 72 h ve 96 saat enfeksiyon sonrası çoğalan parazitlerin toplam sayısını yansıtır.
- Her zaman noktasında ortalama okumaları hesaplayın ve zaman içinde parazit büyümesindeki kıvrım değişikliklerini belirlemek için 4 saat ortalama okumalara bölün.
- Grafik yazılımı kullanarak verileri çizin. Temsili büyüme okuma tablosu ve RHΔku80'inarsaları ::NLuc parazitleri Şekil 1A,B'degösterilmiştir.
- Katlama süresini hesaplamak için, kuluçka süresi boyunca tek tek zaman noktalarında kat değişikliklerinin log2 değerlerini çizin. Eğimi hesaplamak için doğrusal bir regresyon işlevi kullanın, bu da her türün iki katına çıkma süresini temsil eder(Şekil 1A,C).
2. Toksoplazma büyümesine karşı kimyasal bileşik inhibisyonu etkinliğinin değerlendirilmesi
NOT: Burada Toxoplasma büyümesinde LHVS inhibisyonunun değerlendirilmesi örnek olarak sunulmuştur. Sekiz farklı LHVS konsantrasyonu test edilir ve her iki RHΔku80için üç biyolojik çoğaltmaların her biri için üç teknik kopya yapılır::NLuc ve RHΔku80Δcpl::NLuc suşları.
- Parazit enfeksiyonundan önce, tohum HFF'leri her bir bileşim başına bir biyolojik çoğaltma için üç satır ve dokuz sütun biçiminde 96 kuyu mikroplakasına uğrama gelir. Ana bilgisayar hücrelerinin kullanılmadan önce en az 7 gün büyümesine izin verilir.
- PASS RHΔku80::NLuc ve RHΔku80Δcpl::NLuc parazitler kullanmadan önce 2 gün. Parazit arınması ve nicelleştirme için 1.2-1.6 adımlarını izleyin. Fenol kırmızısız ortamdaki parazitleri 1 x 104 parazit/mL'de yeniden askıya alın.
- Confluent HF'ler içeren bir plakadan aspirasyon ortamı ve her kuyuyu 150 μL parazit resuspension ile aşılayın. Mikro plakayı 37 °C'de ve %5 CO2'yi 4 saat kuluçkaya yatırın.
- Seri seyreltme ile 12 kuyu rezervuarında sekiz farklı konsantrasyonda LHVS hazırlayın. Genellikle, konsantrasyonları seri seyreltme şekilde üç kat azalır.
NOT: En düşük konsantrasyon en yüksek konsantrasyona göre 6.561 kat azalır. Seyreltmenin kıvrım değişimi, bileşiklerin farklı özelliklerine göre ayarlanabilir. - 4 saat enfeksiyon sonrası, aspire medya olmayan işgal parazitleri kaldırmak ve farklı konsantrasyonlarda LHVS ile desteklenen medya 150 μL ile sütun 2-9 her iyi doldurmak. Tedavi edilmeyen bir kontrol olarak hizmet vermek için normal ortam la dolu ilk sütunu bırakın.
- Mikro plakayı 37 °C ve %5 CO2'de ilave 96 saat kuluçkaya yatırın.
- 1.9-1.11 adımlarını gerçekleştirin ve tek tek kuyuların luciferase aktivitesini ölçün.
- Her bir LHVS konsantrasyonunun kuyularından üç teknik kopyanın ortalama luciferase aktivitesi.
- Normalleştirilmiş luciferase aktivitesini yüzde olarak hesaplamak için her LHVS konsantrasyonu için ortalama luciferase aktivitesini işlenmemiş parazitlerden elde edilen ortalama luciferase aktivitesine bölün.
- Grafik yazılımı kullanarak tek tek LHVS konsantrasyonlarına karşı normalleştirilmiş luciferase etkinliklerini çizin (Şekil 2). Parazit büyümesine karşı pirimethamin inhibisyonu da bir kontrol olarak ölçülür. Pyrimethamine Toxoplasmafolik asit metabolizmasını inhibe ederek akut toksoplazmoz tedavisinde kullanılan bir klinik antibiyotiktir.
- "Doz-yanıt-inhibisyon" regresyon programı altında, grafik yazılımında gömülü yöntemi, normalleştirilmiş yanıt vs .[inhibitör], tek tek bileşikler için IC50 değerlerini hesaplayın. IC50 aşağıdaki formül kullanılarak hesaplanır:
Y = 100/(1 + X/IC50)
Nerede: Y inhibitörü farklı konsantrasyonlarda enfekte hücrelerin normalleştirilmiş luciferase faaliyetlerini temsil eder, ve X inhibitör bireysel konsantrasyonları temsil eder.
3. Toxoplazma parazitlerinde CRISPR-Cas9 bazlı gen delemesi
- İlgi çekici bir geni silen bir plazmid yapının oluşturulması
- www.ToxoDB.org gidin ve 1.5 kb 5'-UTR ve 3'-UTR (çevrilmemiş bölgeler) ile birlikte intronlar ve ekonlar da dahil olmak üzere tüm gen kodlama dizisini alın.
NOT: Burada, TgCPL (TGGT1_321530) temsili bir örnek olarak hedeflenmiştir. - Alınan TgCPL sırasını sıra analizi yazılımına kopyalayın (ad ve sürüm için Malzeme Tablosu'na bakın) ve 5'- ve 3'-UTR bölgelerini etiketleyin.
- Üst menü çubuğundaki Araçlar simgesini seçin ve ardından Klonlama | CRISPR Siteleri bul.
- PAM site konumu için 3'(Cas9)' seçeneğini belirleyin ve özgüllük puanlama bölümünde Toxoplasma genom dizisini içeren klasörü seçin. Ayarların geri kalanını varsayılan olarak bırakın.
- Aşağıdaki iki kritere sahip bir sgRNA seçin: 1) genellikle >%98 ve 2) bir protospacer bitişik motif (PAM) dizisi olan NGG'den sonra G'den yoksun yüksek özgüllük puanı gösterir. Seçilen sgRNA genellikle ilgi geninin başlangıç ve durdurma kodonlarına yakın yerlerde bulunur.
- Seçili sgRNA'nın sırasını kopyalayın ve aşağıdaki astar şablonuna yapıştırın.

Kırmızı daki kısım seçilen TgCPL sgRNA dizisini temsil eder. İlgi çekici çeşitli genler için farklı sgRNA'lar ile değiştirilebilir.
NOT: Seçili sgRNA G ile başlamazsa, ifadesini geliştirmeye yardımcı olmak için sgRNA'nın başında G ekleyin. - Tablo 2'deverilen ayarlarla birlikte PCR premixini kullanarak Toxoplasma uracil phosphoribosiltransferaz (TgUPRT) geni23'ü hedefleyen önceden var olan plazmid ifade eden sgRNA(Şekil 3A)değiştirmek için PCR reaksiyonu gerçekleştirin.
- Başarılı amplifikasyon onaylamak için bir agarose jel üzerinde PCR ürün çalıştırın. 10 kb PCR ürün amplifikatör olması beklenmektedir (Şekil 3B).
- PCR ürününü DNA jeli çıkarma kiti kullanarak ayıklayın ve site yönelimli mutagenez kiti kullanarak daireselleştirin. Tarif için Tablo 3'e bakın. RT'de 10-20 dk için reaksiyon kuluçka.
- Dairesel PCR ürününün E. coli'ye dönüştürülmesini ve tasarlanan sgRNA'nın daha fazla doğrulanması için 10 klon seçin.
- İki klon büyüt ve plazmidleri ayıkla. BamHI ve EcoRV ile saflaştırılmış plazmidleri kesin. Aday plazmidler 2.4 kb ve 7.2 kb(Şekil 3C)olmak üzere iki bant verecektir.
- TgUPRT sgRNA'nın tasarlanan sgRNA(Şekil 3D)ile başarılı bir şekilde değiştirilmesini onaylamak için M13 ters astarkullanarak Sanger dizilimi için plazmidleri gönderin.
- www.ToxoDB.org gidin ve 1.5 kb 5'-UTR ve 3'-UTR (çevrilmemiş bölgeler) ile birlikte intronlar ve ekonlar da dahil olmak üzere tüm gen kodlama dizisini alın.
- HDR mekanizması ile gen delemesi için onarım şablonu oluşturma
- Seçilen sgRNA'nın hedefleme bölgelerine göre homolojiye bağımlı rekombinasyon için hedef genin 50 bp'sini veya 3'-UTR'larını bulunuz (HDR, tartışma bölümüne bakın). Bölgelerin seçimi, sgRNA hedeflerinin bulunduğu yere bağlı olarak aşağıda listelenen kriterleri izler.
- Cas9'un dekolte alanı başlangıç kodonundan yukarı doğru ysa, aşağıdakileri seçin: sol HDR bölgesi olarak bölünme bölgesinden yukarı doğru 50 bp'lik bir DNA dizisi ve sağ HDR bölgesi olarak stop codon'dan aşağı doğru 50 bp DNA dizisi.
- Cas9'un dekolte alanı başlangıç ve durdurma kodonları arasındaysa, aşağıdakileri seçin: sol HDR bölgesi olarak başlangıç kodonundan yukarı doğru 50 bp'lik BIR DNA dizisi ve sağ HDR bölgesi olarak stop codon'dan aşağı doğru 50 bp DNA dizisi.
- Cas9'un dekolte alanı dur kodonundan aşağı doğru ysa, aşağıdakileri seçin: sol HDR bölgesi olarak başlangıç kodonundan yukarı doğru 50 bp'lik BIR DNA dizisi ve sağ HDR bölgesi olarak dekolte bölgesinden aşağı doğru 50 bp DNA dizisi.
NOT: TgCPL geni için dekolte alanı başlangıç ve durdurma kodonları arasında yer alır. Böylece, aşağıdaki astarlar bir pirimethamin direnç kasetkodlar şablon olarak pMDC64 kullanarak onarım şablonu yükseltmek için tasarlanmıştır. PCR amplifikasyon için pMDC64 plazmid siyah anneal dizileri. Kırmızı etiketli bölgeler homolog rekombinasyon için TgCPL'yeözgü dizilerdir.
- PcR'yi Tablo 4'teaçıklanan PCR koşullarında PCR premixini kullanarak gerçekleştirin.
- PCR ürününü bir agarose jel(Şekil 3E),ardından jel ekstraksiyonu ve standart nükleik asit niceleme prosedürleri üzerinde çalıştırın.
NOT: Beklenen bant başarılı bir şekilde yükseltilemezse, PCR koşullarını optimize edin ve/veya astar çiftlerini değiştirin.
- Seçilen sgRNA'nın hedefleme bölgelerine göre homolojiye bağımlı rekombinasyon için hedef genin 50 bp'sini veya 3'-UTR'larını bulunuz (HDR, tartışma bölümüne bakın). Bölgelerin seçimi, sgRNA hedeflerinin bulunduğu yere bağlı olarak aşağıda listelenen kriterleri izler.
- Toksoplazma transfeksiyonu
- PASS RHΔku80::NLuc parazitler 2 gün boyunca bir T25 şişesi confluent HFFs içeren. Tam olarak lized parazitlerden oluşan bir T25 şişesi 2-3 transfections için yeterlidir.
- 1.2. adımda açıklandığı gibi şırınga ve filtre temizleyici parazitler. Sitomik tampondaki parazitleri yeniden askıya alın ve RT'de 10 dk için 1.000 x g'de aşağı doğru döndürün.
- 10 mL sitomik tampon ile peletli parazitleri yıkayın ve parazitleri 10 dk'da 10 dakika boyunca 1.000 x g'da aşağı çevirin.
- Supernatant'ı dikkatlice dökün ve aynı tampondaki parazitleri 1 x 108 parazit/mL konsantrasyonla yeniden askıya alın.
- 2 μg onarım şablonu DNA'sını sgRNA/Cas9 ekspresyonu plazmidlerinin 20 g'ı ile karıştırın (kütle oranı = 1:5, 1:3 molar oranına eşdeğer). Onarım şablonunun amplifikasyon verimi düşükse, her iki DNA parçasının da girişini buna göre azaltın. En az 0,5 μg onarım şablonu kullanılabilir.
- 1,5 mL santrifüj tüpte 400 μL parazit resuspension, DNA ve 5 μL 200 mM ATP/500 mM azaltılmış glutatyon (GSH) karıştırın. Gerekirse sitomix tamponu ile toplam hacmi 500 μL'ye getirin.
- Parazit ve DNA karışımını bir elektroporasyon cuvette (4 mm boşluk genişliği) aktarın ve elektroporasyon cihazı kullanarak elektroporasyon (2 kV voltaj, 50 Ω direnç) gerçekleştirin.
- Elektrohaplanmış parazitleri taze D10 ortamlarında confluent HF içeren bir T25 şişesine aktarın. 24 saat sonra ilaç seçimi için uygun antibiyotik uygulayın.
- Transgenik parazitlerin büyümesi istikrarlı olana kadar ilaç seçici basıncı nı koruyun.
- Nakavt popülasyonundaki genomik DNA'yı arındırın ve pirimethamin direnci kasetinin PCR ile TgCPL çekirgesine entegrasyonunu kontrol edin. Doğrulandıktan sonra bölüm 3.4'e devam edin. Değilse, parazit transfeksiyonu ve ilaç seçimi başka bir tur gerçekleştirin. İlaç direnci kasetinin doğru entegrasyonunu tespit edememe, genellikle hedef genin gerekli olduğunu veya gen lokusunun erişilebilir olmadığını göstermektedir.
- Nakavt parazitlerinin klonlanması
- Parazitleri klonlamadan önce 1 hafta boyunca 37 °C ve %5 CO2'de HFF hücreleri ile iki tane 96 kuyu mikroplakası tohumlayın.
- Fluent HF'ler içeren bir T25 şişesinde transgenik parazit popülasyonunun ~0.3-0.4 mL'sini geçirin ve 2 gün boyunca yetiştirin. Mutant büyüme kusurları gösteriyorsa daha fazla parazit geçen düşünün.
NOT: En iyi verim ve canlılığı elde etmek için konak hücreler parazitler tarafından yoğun bir şekilde enfekte olur ve parazitlerin çoğu hücre içi evrede tutulur. - Şırınga enfekte konak hücreleri ve filtre-taze lized parazitler adım 1.3 belirtildiği gibi arındırMak. D10 orta parazitleri resuspend ve RT 10 dakika için 1.000 x g onları aşağı spin.
- 10 mL D10 orta peletli parazitleri yeniden askıya alın.
- Parazit konsantrasyonunu belirlemek için hemositometre kullanan parazitleri sayın.
- Uygun antibiyotik ile desteklenen D10 ortamda 10 parazit/mL konsantrasyonu getirmek için iki aşamalı bir seyreltme gerçekleştirin. Genellikle, ilk parazit resuspension 1.000 kat seyreltilir, 10 parazit / mL ikinci bir seyreltme izledi.
- Confluent HF'ler içeren 96 kuyu mikroplakasından aspire ortamı ve her kuyuya 150°L seyreltilmiş parazit aşılanır.
- 37 °C'de %5 CO2 ile 7 gün boyunca plak oluşumuna izin vermeden kuluçka plakaları. Transgenik parazitlerde büyüme kusurları varsa kuluçka süresi daha uzun olabilir.
- Plakaları faz-kontrast mikroskobu kullanarak tarayanın ve yalnızca tek bir plak içeren kuyuları işaretleyin.
- Doğru klonları tanımlamak için koloni PCR gerçekleştirin.
- Enfekte HFF monolayers kaldırmak için her kuyunun alt kazımak için pipet ipuçları kullanın.
- Pipet 75 μL hücre süspansiyon her biri iyi işaretlenmiş 1.5 mL mikrosantrifüj tüpler.
- RT'de maksimum hızda 10 dakika boyunca santrifüj tüpleri supernatant'ı dikkatlice aspire edin ve kitinde sağlanan seyreltme tamponu ve DNA salınım katkı maddesi içeren 10.25 μL lysis tamponunda peleti yeniden askıya alın(Malzeme Tablosu).
- Örnekleri RT'de 4 dakika, 98 °C'de 2 dk kuluçkaya yatırın. Daha sonra, numuneler PCR için kullanılabilir veya kullanıma kadar -20 °C'de saklanabilir. İlaç direnci kasetinin entegrasyonu ve ilgi geninin kaybını test etmek için üç set PCR reaksiyonu kullanılır(Şekil 4A). PCR reaksiyon kurulumu için Tablo 5'e ve termocycler ayarları için Tablo 6'ya bakın.
- Doğru klonları belirleyin ve dört klonu enfluent HFF içeren T25 şişelerine aktarın.
- Bireysel klonlar lyse konak hücreleri sonra, daha fazla PCR doğrulama için genomik DNA arındırın.
- İlgi proteinini tanıyan bir antikor varsa, doğru Toxoplasma nakavtlarında hedef proteinin kaybını doğrulamak için standart bir immünoblotlama prosedürü uygulayın. TgCPL-silme mutantı tarama için temsili görüntüler Şekil 4B,C'degösterilmiştir.
Sonuçlar
Şekil 1, RHΔku80için bir büyüme eğrisi örneğini temsil eder::NLuc gerinim ve iki katına çıkarma süresi için türetilmiş hesaplama. Genel olarak, titreşme luciferase aktivite okumalarının varyasyonları için hesap üç biyolojik çoğaltmaher biri için üç teknik çoğaltmalar gerçekleştirilir. Parazit büyümesinin normalleştirilmiş kıvrım değişimini hesaplamak için, enfeksiyon sonrası 24-96 h'deki her okuma, ilk okuma ile 4 saat sonrası enfeksiyon ayarı olan canlı parazitlerin başlangıç miktarını yansıtmaktadır(Şekil 1A,B). Parazit inkatlama süresini belirleme açısından, parazit büyümesinin normalleştirilmiş kıvrım değişimlerinin log2 değerleri her zaman noktasına göre çizilmiştir. Daha sonra, çizim iki katına zamanı temsil eden eğimi elde etmek için doğrusal bir regresyon işlevine tabi tutuldu (Şekil 1C).
Yabani tip ve Δcpl suşlarında LHVS inhibisyonu etkinliği Şekil 2'dekisekiz inhibitör konsantrasyonuna karşı luciferase aktivitelerinin çizilmesi ile belirlendi . Bu test ham luciferase faaliyetlerinin normalleştirilmesi için inhibitör tedavisi olmadan enfekte hücreleri dahil etmek esastır. Buna ek olarak, parazitlerin deneme süresinin sonunda hücre içi aşamada hala olduğundan emin olmak için, net bir mikroplaka içinde yapılan sahte bir deney gereklidir.
Şekil3'te, TgCPL'yi hedefleyen bir sgRNA ifadesinin oluşturulması ve doğrulanması ve TgCPL silme için bir onarım şablonu üretimi gösterilmiştir. Orijinal plazmidde kodlanan TgUPRT geniile eşleşen 20 bp sgRNA, PCR tabanlı site yönelimli mutagenez aracılığıyla TgCPL genini hedefleyen DNA dizisine mutasyona uğradı. Bunu başarmak için, farklı genleri tanıyan sgRNA'lar için kodlayan DNA dizileri ileri astara göre tasarlanmış, ters astar ise astar tasarımını basitleştirmek için değişmeden tutulmuştur.
Şekil 3A, orijinal şablon plazmidinde TgUPRT genini hedefleyen sgRNA DNA dizilerinin yakınlaştırılmış bölgesini ve doğrusallaştırılmış sgRNA ifade vektörünün üretimi için kullanılan astar kümesini gösterir. Şekil 3B doğrusallaştırılmış TgCPL-hedefleme sgRNA ekspresyonu plazmid temsili bir jel resmi gösterir. Şekil 3C, dairesel tgCPL-hedefleme sgRNA ekspresyonu plazmidinin restriksiyon endokleaz sindirimini gösterir. Bir M13 ters astar belirli gen için oluşturulan sgRNA ifade vektöriçinde dahil kılavuz RNA dizilimi için kullanılmıştır. Şekil 3D'de,sekanslı DNA bölgesi başarılı mutagenezin intihal intihal için plazmid şablonuna hizalanmış. Şekil 3E, pirimethamin direnci kasetinin başlangıç ve bitiş bölgelerini göstererek, astarların TgCPL gen delemesi için onarım şablonunun üretimi için nerede anneal olabileceğini gösterir. Onarım şablonu PCR-güçlendirilmiş ve boyut doğrulama ve jel çıkarma için% 1 agarose jel içine yüklendi.
TgCPL nakavt üretimi ve taraması için genel strateji Şekil 4'tegösterilmiştir. Şekil 4A'da gösterilen üç astar kümesi, 5'- ve 3'-ARM'ların doğru entegrasyonu ve TgCPLkodlama dizisinin silinmesi için TgCPL-silme parazitlerini taramak için kullanılmıştır. Şekil 4B'degösterildiği gibi, genellikle tarama için başlangıçta yedi ila sekiz klon seçilir. Tarama genellikle ilgi geni için kodlama dizisinin silinmesini kontrol etmekle başlar. Bunu 5' ve 3'-ARM'ların algılanması takip eder, bu da taranacak toplam klon sayısını en aza indirmeye yardımcı olur. Hedef proteini tanıyan bir antikor varsa Şekil 4C'de görüntülenen immünoblotile daha fazla doğrulama tamamlanabilir.

Şekil 1: Luciferase tabanlı bir yöntem kullanılarak Toxoplazma parazitleri için hücre içi büyüme niceliği. (A) Elektronik tablo yazılımındaki ham luciferase etkinlik okumaları. 24 saat, 48 h, 72 h ve 96 saat enfeksiyon sonrası ölçümler, parazit büyümesindeki kıvrım değişikliklerinin hesaplanması için 4 saat sonrası enfeksiyon sonrası ilk okumalara göre normalleştirildi. (B) Normalleştirilmiş veriler ortalamaya alındı ve çizildi. (C) Kıvrım değişikliklerinin log2 değerleri de çizilmiş ve parazitin katlama zamanının belirlenmesi için doğrusal regresyona tabi tutulmuşdur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
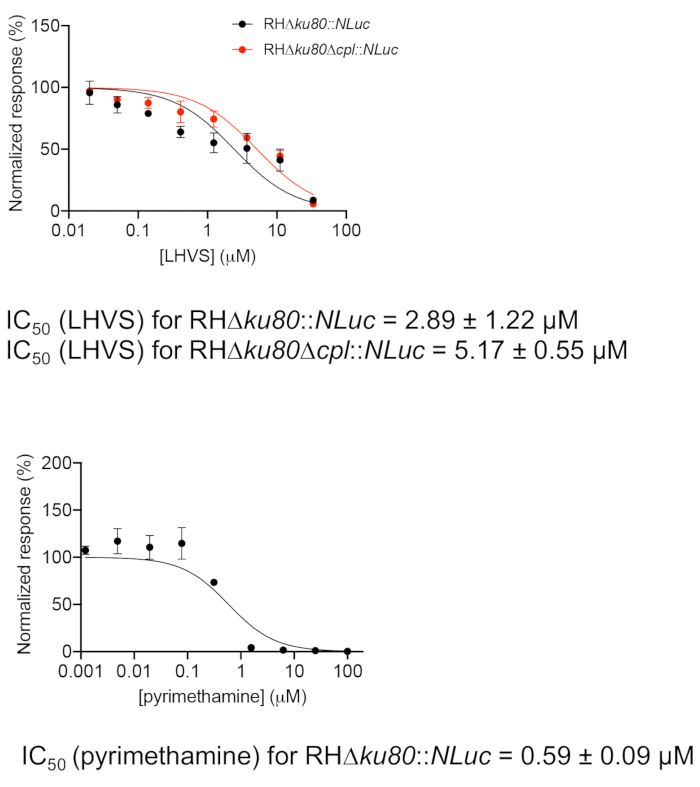
Şekil 2: LHVS ve pirimethamin inhibisyon etkinliği değerlendirmesi luciferase tabanlı büyüme testini kullanarak. Parazitler konak hücrelerinin istilasına izin vermek için 4 saat boyunca 96 kuyulu bir mikroplakaya aşılandı. İşgal edilmeyen parazitler yıkandı ve plaka farklı lhvs veya pirimemem içeren ortamlarla dolduruldu ve luciferase aktivitesi nin belirlenmesinden önce ek bir 96 saat kuluçkaya yatırıldı. Bireysel inhibitör konsantrasyonları ile tedavi edilen parazitler için ölçülen luciferase okumaları, tedavi edilmeyen parazitlerden saptanan sinyale karşı normalleştirildi. Veriler bir grafik programında çizildi ve IC50 tayini için bir regresyon analizi yapıldı. Titre, her biri üç teknik kopya ile üç biyolojik kopyada tekrarlandı. Veriler ortalama ± SEM, n = 3 biyolojik kopyaları temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
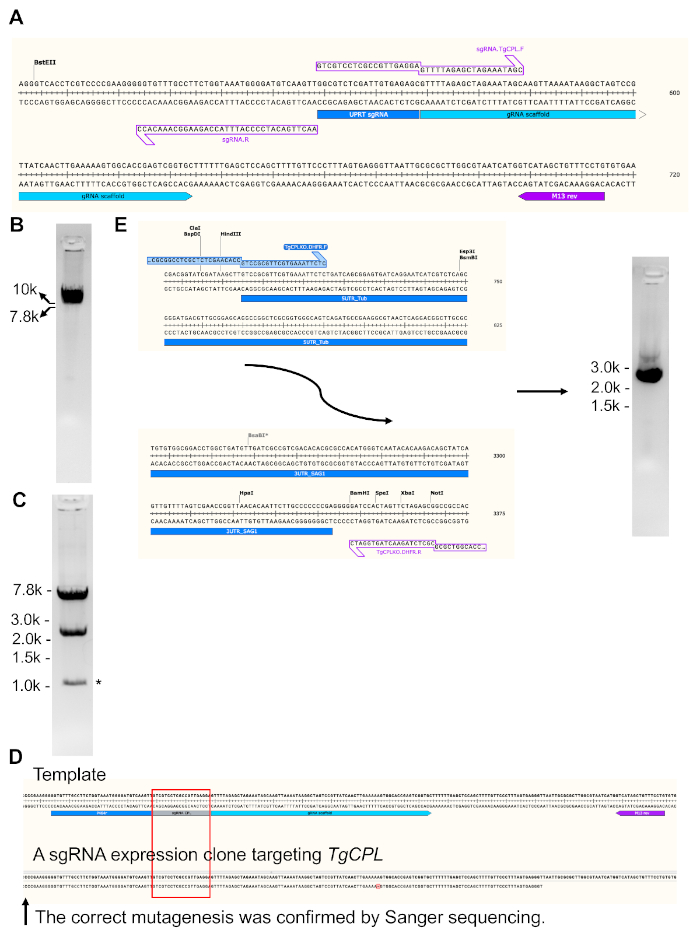
Şekil 3: TgCPL'yi hedefleyen sgRNA'yı ifade eden plazmid yapının üretimi ve TgCPL silme için bir onarım şablonu üretimi. (A) Orijinal pSAG1-Cas9-sgRNA-UPRT plazmid23 TgCPL tgUPRT geni hedefleyen sgRNA yerine bir site yönelimli mutagenez kiti ile değiştirildi . SGRNA kodlama bölgesi, astarların anneal olduğu alanları göstermek için büyütülür. PCR sonra, mutasyona uğramış plazmid doğrusallaştırıldı ve başarılı amplifikasyon doğrulaması için% 1 agarose jel içine yüklendi, jel çıkarma takip. (B) PCR amplifiye doğrusallaştırılmış sgRNA ifade yapısının jel görüntüsü. (C) Jel ekstraksiyonundan sonra PCR ürünü daireselleştirildi ve daha sonra E. coli'ye dönüştürüldü. Beklenen plazmidleri içeren klonlar restriksiyon endokleaz sindirimi ve DNA dizilimi ile tarandı. DNA sindirimi sonrası bant boyutları 7.2 bp ve 2.4 kb idi. Endonükleazlardan nonspesifik dekolte tarafından oluşturulan bant yıldız işareti ile etiketlenir. (D) Şekilde etiketlenmiş M13 ters astar, oluşturulan TgCPL-hedefleme sgRNA ifade vektörü içinde mutasyona uğramış kılavuz RNA bölgesini sıralamak için kullanılmıştır. Sekanslı DNA bölgesi, başarılı mutagenezi doğrulamak için plazmid şablonuna hizalanmış. (E) Bu çalışmada, TgCPL'nin 5'- ve 3'-UTR'larına uyan 50 bp homolog bölge, onarım şablonunun yükseltilmesi için astarlara dönüştürüldü ve PCR tarafından pyrimethamine direnç kasetinin 5'- ve 3'-uçlarıile kuşatıldı. Agarose jel elektroforez jel çıkarma dan önce PCR ürünün doğru boyutunu doğrulamak için kullanılmıştır. Onarım şablonunun beklenen boyutu ~2,7 kb'dir. Genellikle 200 μL PCR reaksiyonundan 5-6 μg onarım şablonu elde edilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
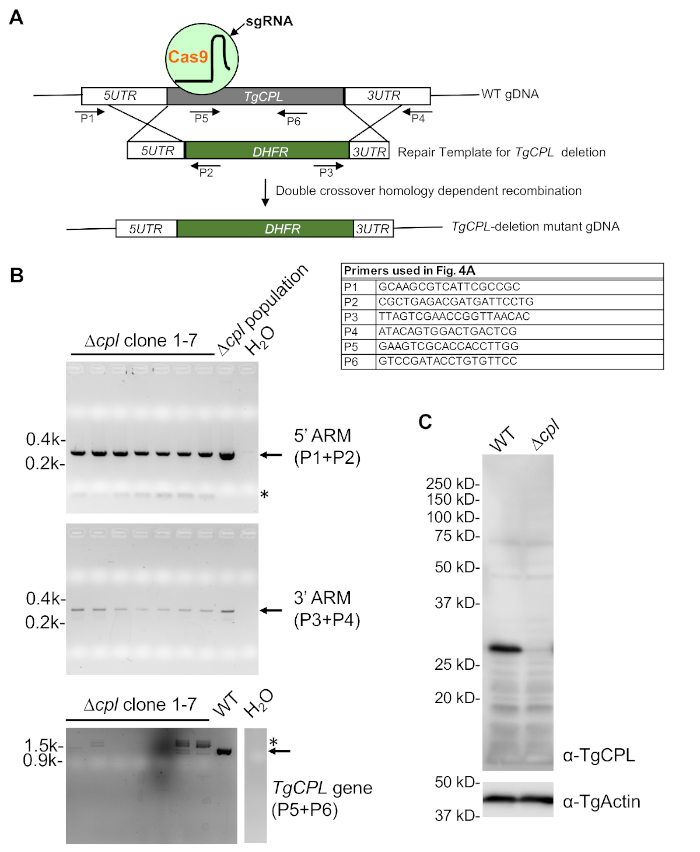
Şekil 4: PcR ve tgCPL-eksik parazitlerin immünoblot onayı. (A) Toxoplasma'da TgCPL-silmenin genel stratejilerini ve doğru TgCPL nakavt klonların PCR tabanlı taramasını gösteren şematik bir diyagram. Tarama için kullanılan astarlar etiketlenir. (B) PCR ve agarose jel elektroforezi, pirimethamin direnci kasetinin TgCPL lokusa doğru entegrasyonunu ve TgCPL geninin kaybını içeren klonları seçmek için kullanıldı. Δcpl popülasyonunun genomik DNA'sı 5'- ve 3'-ARM tespiti için pozitif kontrol görevi alırken, WT genomik DNA'sı tgCPL geninin pozitif kontrol olarak saptanmasında kullanıldı. Negatif kontrol olarak hizmet vermek için PCR reaksiyonlarında DNA şablonu yerine su kullanılmıştır. Beklenen bantlar oklarla gösterilirken, spesifik olmayan PCR amplifikasyonları yıldız işaretleriyle etiketlenir. (C) PCR taraması ile tanımlanan klon 1, hücre lisatpresini hazırlama ve nakavtta TgCPL ekspresyonunun kaybını doğrulamak için daha fazla immünoblot analizi için doku kültüründe yetiştirildi. TgActin yükleme kontrolü olarak kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Luciferase: | Bitiş noktası |
| Entegrasyon süresi: | 1 s |
| Filtre Seti - Emisyon: | Tam ışık |
| Optik: | Sayfanın Üstü |
| Kazanç: | 135 |
| Okuma hızı: | Normal |
| Gecikme: | 100 ms |
| Okuma yüksekliği: | 4,5 mm |
Tablo 1: Luciferase tabanlı Toxoplasma büyüme testinde luciferase aktivite ölçümü için mikroplaka okuyucu ayarları.
| İlk denatürasyon: | 5 dk için 98 °C |
| 25 döngü | |
| Denaturing: | 5 s için 98 °C |
| Tavlama: | 15 s için 60 °C |
| Uzantısı: | 1 dk için 72 °C |
| Son uzantı: | 10 dk için 72 °C |
Tablo 2: SgRNA ifade vektörü üretimi için termocycler ayarları.
| Örnek | Hacim (3l) |
| PCR ürün (10-50 ng) | 1 |
| 2X KLD (kinasi, ligaz, DpnI) Reaksiyon Tampon | 5 |
| 10X KLD Enzim Karışımı | 1 |
| Nükleaziçermeyen su | 3 |
| Toplam | 10 |
Tablo 3: SGRNA ifade vektörünün daireselleştirilmesi için reaksiyon tarifi.
| İlk denatürasyon: | 5 dk için 98 °C |
| 35 döngü | |
| Denaturing: | 15 s için 98 °C |
| Tavlama: | 15 s için 58 °C |
| Uzantısı: | Kb başına 30 s için 72 °C |
| Son uzantı: | 10 dk için 72 °C |
Tablo 4: Onarım şablonu üretimi için termocycler ayarı.
| Örnek | Hacim (3l) |
| toplam Toksoplazma genomik DNA | 1 |
| İleri astar (25 μM) | 0.2 |
| Ters astar (25 μM) | 0.2 |
| 2x PCR ana premix | 5 |
| Nükleaziçermeyen su | 3.6 |
| Toplam | 10 |
Tablo 5: Tek Toxoplasma klonları tarama için Colony PCR reaksiyon tarifi.
| İlk denatürasyon: | 5 dk için 98 °C |
| 35 döngü | |
| Denaturing: | 5 s için 98 °C |
| Tavlama: | 55 - 62 °C 5 s |
| Uzantısı: | Kb başına 20 s için 72 °C |
| Son uzantı: | 1 dk için 72 °C |
Tablo 6: Tek Toxoplazma klonların taranması için termocycler ayarı.
| Cytomix tampon | 25 mM HEPES, pH 7.6, 120 mM KCl, 10 mMKCl,10 mM KCl 2 HPO4/KH2PO4, 5 mM MgCl2, 0.015 mM CaCl2ve 2 mM EGTA. |
| D10 orta | DMEM 1X (Corning, Cat #: 10-013-CV), 10 mM HEPES, 10% (v/v) Kozmik Buzağı Serumu (Hyclone, Cat #: SH30087.03), 1 mM sodyum piruvat, 4 mM L-glutamin, 100 adet/mL penisilin ve 100 μg/mL streptomisinc. |
| Fenol kırmızıiçermeyen orta | DMEM/ Yüksek Modifiye (Hyclone, Cat #: SH30284.02), 10 mM HEPES, %10 (v/v) Kozmik Buzağı Serumu (Hyclone, Cat #: SH30087.03), 1 mM sodyum piruvat, 4 mM L-glutamin, 100 adet/mL penicillin ve 100 μg/mLrepstin stcto. |
| 2X NLuc Arabellek | 100 mM MES, pH 6.0, 1mM CDTA, 0.5% Tergitol, 0.05% Mazu DF 204, 150 mM KCl, 1 mM DTT, 35 mM Thiourea. |
Ek Tablo 1: Arabellek tarifleri.
Tartışmalar
++Bu protokol, hücre içi Toksoplazma büyümesini değerlendirmek ve parazit büyümesine karşı kimyasal bileşiklerin inhibisyonu etkinliğini değerlendirmek için luciferase tabanlı bir protokolü tanımlar. Hücre içi Toksoplazma büyümesini ölçmek için mevcut stratejilerle karşılaştırıldığında, bu yöntem yüksek duyarlılık ve özgüllük sergiler. Parazit büyümesini izlerken, test edilen suşun değerlendirme süresinin bitiminden önce konak hücrelerini erken denemediğini doğrulamak için 96 kuyumikroplakasında sahte bir test önerilir. Aksi takdirde, Lüminesans okumaları parazit büyümesini doğru bir şekilde yansıtmaz, çünkü Toxoplasma sadece konak hücrelerinde çoğalır.
Fenol kırmızısı boyanın luciferase aktivitesini hızla bastırdığı ve plaka okuyucunun bireysel kuyu ölçümlerinde gecikme nedeniyle teknik kopyalar arasında luciferase okumalarında önemli farklılıklara yol açabileceği gözlenmiştir. Bu nedenle, 96 kuyu mikroplakaları tohumlama önce fenol kırmızı-serbest ortamda HFS hazırlamak için en uygun. Ayrıca, yüksek luciferase aktivitesi durumunda, çapraz iyi girişim güçlü luciferase aktivitesi sergileyen komşu kuyular arasında önemli farklılıklara yol açabilir. Bu nedenle, her zorlanma arasında boş bir sütun yerleştirmek için önerilir.
Özellikle, RHΔku80için ::NLuc suşu, 1.500 parazit büyüme tetkik için her kuyuiçine aşılanır. WT Toxoplasma parazitleri için iki katına zaman ~ 6-8 h24olduğundan, 24 saat sonrası 24 saat luciferase aktivitesinde 8-16 kat artış görmesi beklenmektedir. Ancak, önemli büyüme kusurları ile bazı suşları sadece luciferase aktivitesinde hafif bir artış verecektir. Bu nedenle, ilk parazit inokül düşük ise, luciferase aktivitesinde doğal varyasyon büyüme döneminde parlaklık bir artış gözlem maske olacaktır. Bu nedenle, büyüme eksiklikleri olan suşları için doğru bir kat değişimi elde etmek için parazitlerin daha yüksek sayıda aşılamak için tavsiye edilir.
Protokolde, kılavuz RNA tasarımı memeli hücrelerinde CRISPR-Cas9 tabanlı genom modifikasyonu için kullanılan genel kurallara uyar25. Şu anda, yazılım ve online platformlar birçok türde chopchop26,E-CRISP27ve EuPaGDT28gibi çeşitli organizmalar, kılavuz RNA tasarımı için hizmet vermektedir. Burada sgRNA'nın tasarımında ticari yazılım(Malzeme Tablosu)kullanılmaktadır. Daha önce bahsedilen çevrimiçi programlar ile karşılaştırıldığında, bu yazılım sgRNA tasarımı için yerel bir ortam sağlar. Daha önce yayınlanmış bir algoritma25,29kullanarak her aday sgRNA için etkinlik ve özgüllük puanları hesaplar .
Teknik olarak, yüksek özgüllük skoru içeren bir ilgi geni içinde bulunan herhangi bir sgRNA verimli downstream homoloji bağımlı rekombinasyon için genomik DNA bölünmesi aracılık edebilirsiniz. Uygulamada, start veya stop kodonuna yakın bir bölgeyi hedefleyen SGNA tercih edilir. İlgi genleri endojen epitop-sgRNA kullanılarak etiketlenmiş olabilir, hangi genin sonunda bir çift iplikçikli boşluk oluşturur. Bir genin silinmeden önce endojen olarak etiketlemesi, ilgi çeken proteine karşı bir antikor bulunmadığı durumlarda immünoblotlama tespiti yoluyla gen kaybını doğrulamaya yardımcı olacaktır. Bir genin epitop etiketleme de immünükoper mikroskopi yoluyla ilgi proteinin in hücre altı konumunu belirlemeye yardımcı olabilir. Ayrıca, hedef gen gerekli ise, sgRNA genin başlangıç bölgesi tanıyan bir tetrasiklin duyarlı organizatörü bir tetrasiklin duyarlı organizatörü yerine koşullu nakavt oluşturmak için kullanılabilir.
Ayrıca protokol, TgCPL geninin yerine pirimethamin direnci kaseti getirilerek Toxoplasma'da gen delemesi tekniğini tanımlar. Araştırmacılar, diğer ilaç direnci kasetlerini kodlayan farklı plazmid şablonları kullanarak, PCR aracılığıyla diğer antibiyotik direnci genlerini onarım şablonuna dahil etmek için astar dizilerini değiştirebilirler. Ayrıca, bu protokol endojen gen etiketleme, organizatör replasmanı ve site yönelimli mutagenez gibi diğer genom modifikasyonları gerçekleştirmek için değiştirilebilir. Bu protokolde kullanılan homolog bölgelerin sadece 50 bp uzunluğunda olması dikkat çekicidir. Ayrı bir çalışmada 40-43 bp homolog DNA dizileri tek nükleotit mutasyonları ve gen epitop etiketleme toxoplasma parazitleri tanıtmak için kullanılır22. Bu kadar kısa uzunluktaki homolog DNA dizileri astarlara kolayca dahil edilebilir. Biz nicel homolog bölgenin bu özel uzunluğu için HDR verimliliğini değerlendirmek olmasa da, bir 40-50 bp bölge TgKu80verimli DNA rekombinasyon için yeterli olduğu gibi görünüyor -eksik Toksoplazma suşu, son zamanlarda elde edilen çeşitli genlerin başarılı genetik manipülasyon kanıtlandığı gibi15,22.
Kimyasal bileşiklerin etkinliğinin belirlenmesi sırasında, prospektif ilaç hedef geni gerekliyse, yabani tip ve nakavt suşları arasındaki IC50 değerlerindeki kaymaların karşılaştırılması pratik değildir. Bu senaryoda, ilaçların etkinliğini ve özgüllüğünü değerlendirmek için kimyasal bileşiklerin rekombinant protein aktivitesini inhibe etme yeteneğini doğrudan ölçen bir töz gereklidir. Son literatürde bir genom geniş CRISPR ekran30gerçekleştirerek Toxoplasma bireysel genlerin fitness puanları rapor , hangi ilgi geni için düz bir nakavt mutant oluşturma nın zorluk değerlendirmek için bir rehber olarak hizmet verebilir.
Birlikte ele alındığında, protokol luciferase tabanlı hücre içi Toksoplazma büyüme testinin başarıyla tamamlanmasını ve Toksoplazma büyümesine karşı kimyasal inhibitörler için bir değerlendirme stratejisini tanımlar. Ayrıca, toksoplazma parazitlerinde gen delemesi için CRISPR-Cas9 tabanlı genom düzenleme protokolü de ayrıntılı olarak kullanılmaktadır. Bireysel laboratuvarlar, açıklanan protokolü endojen gen etiketleme, ilaç seçim işaretlerini değiştirme ve hücre içi parazit büyümesi için değerlendirme süresini değiştirme gibi deneysel ihtiyaçlara göre değiştirebilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar pSAG1-Cas9-sgRNA-TgUPRT plazmid ve anti-TgCPL ve TgActin antikorları paylaşımı için Dr Sibley ve Carruthers teşekkür etmek istiyorum. Bu çalışma Clemson Startup fonu (Z.D.'ye), Knights Templar Eye Foundation Pediatrik Oftalmoloji Kariyer-Başlangıç Araştırma Hibesi (Z.D.'ye), NIH COBRE hibep20GM109094 (Z.D.'ye) ve NIH R01AI143707 (Z.D.'ye) tarafından desteklenmiştir. Fon layıcıların çalışma tasarımı, veri toplama ve analiz, makalenin yayımlama kararı veya hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose gel extraction kit | New England BioLabs | T1020L | |
| BamHI | New England BioLabs | R0316S | |
| Biotek Synergy H1 Hybrid Multi-Mode Microplate Reader | BioTek Instuments | ||
| BTX Gemini Twin Waveform Electroporation System | Harvard Apparatus | ||
| Chemically competent E. coli cells | New England BioLabs | C29871 | |
| CloneAmp HiFi PCR premix | Takara Bio | 639298 | |
| Coelenterazine h | Prolume | 301-10 hCTZ | |
| EcoRV | New England BioLabs | R3195S | |
| Phire Tissue Direct PCR Master Mix | Thermo Scientific | F170L | |
| Plasmid miniprep kit | Zymo Research | D4054 | |
| Q5 Site-Directed Mutagenesis kit | New England BioLabs | E0554S | |
| Software | |||
| Geneious software for sgRNA design (version: R11) | |||
| GraphPad Prism software (8th version) | |||
| SnapGene for molecular cloning (version: 4.2.11) |
Referanslar
- Blader, I. J., Coleman, B. I., Chen, C. T., Gubbels, M. J. Lytic Cycle of Toxoplasma gondii: 15 Years Later. Annual Review of Microbiology. 69 (1), 1-23 (2014).
- Jones, J. L., Kruszon-Moran, D., Rivera, H., Price, C., Wilkins, P. P. Toxoplasma gondii Seroprevalence in the United States 2009-2010 and Comparison with the Past Two Decades. The American Journal of Tropical Medicine and Hygiene. 90 (6), (2014).
- Kieffer, F., Wallon, M. Congenital toxoplasmosis. Handbook of Clinical Neurology. 112, 1099-1101 (2013).
- Hoffmann, S., Batz, M. B., Morris, G. J. Annual cost of illness and quality-adjusted life year losses in the United States due to 14 foodborne pathogens. Journal of Food Protection. 75 (7), 1292-1302 (2012).
- Dubey, J. Toxoplasmosis. Journal of the American Veterinary Medical Association. 205 (11), 1593-1598 (1994).
- Lindsay, D., Dubey, J. Toxoplasma gondii: the changing paradigm of congenital toxoplasmosis. Parasitology. 138 (14), 1-3 (2011).
- Deng, Y., Wu, T., Zhai, S., Li, C. Recent progress on anti-Toxoplasma drugs discovery: Design, synthesis and screening. European Journal of Medicinal Chemistry. 183, 111711 (2019).
- Butler, N. J., Furtado, J. M., Winthrop, K. L., Smith, J. R. Ocular toxoplasmosis II: clinical features, pathology and management. Clinical & Experimental Ophthalmology. 41 (1), 95-108 (2013).
- Pfefferko, E., Pfefferko, L. C. Specific Labeling of Intracellular Toxoplasma gondii with Uracil. Journal of Eukaryotic Microbiology. 24 (3), 449-453 (1977).
- Merli, A., Canessa, A., Melioli, G. Enzyme immunoassay for evaluation of Toxoplasma gondii growth in tissue culture. Journal of Clinical Microbiology. 21 (1), 88-91 (1985).
- Derouin, F., Chastang, C. Enzyme immunoassay to assess effect of antimicrobial agents on Toxoplasma gondii in tissue culture. Antimicrobial Agents and Chemotherapy. 32 (3), 303-307 (1988).
- McFadden, D., Seeber, F., Boothroyd, J. Use of Toxoplasma gondii expressing beta-galactosidase for colorimetric assessment of drug activity in vitro. Antimicrobial Agents and Chemotherapy. 41 (9), 1849-1853 (1997).
- Gubbels, M. J., Li, C., Striepen, B. High-Throughput Growth Assay for Toxoplasma gondii Using Yellow Fluorescent Protein. Antimicrobial Agents and Chemotherapy. 47 (1), 309-316 (2003).
- Touquet, B., et al. High-content imaging assay to evaluate Toxoplasma gondii infection and proliferation: A multiparametric assay to screen new compounds. PLoS ONE. 13 (8), e0201678 (2018).
- Thornton, L. B., et al. An ortholog of Plasmodium falciparum chloroquine resistance transporter (PfCRT) plays a key role in maintaining the integrity of the endolysosomal system in Toxoplasma gondii to facilitate host invasion. PLOS Pathogens. 15 (6), e1007775 (2019).
- Larson, E. T., et al. Toxoplasma gondii cathepsin L is the primary target of the invasion-inhibitory compound morpholinurea-leucyl-homophenyl-vinyl sulfone phenyl. The Journal of Biological Chemistry. 284 (39), 26839-26850 (2009).
- Dou, Z., McGovern, O. L., Cristina, M., Carruthers, V. B. Toxoplasma gondii Ingests and Digests Host Cytosolic Proteins. mBio. 5 (4), e01188-14 (2014).
- Cristina, M., et al. Toxoplasma depends on lysosomal consumption of autophagosomes for persistent infection. Nature Microbiology. 2, 17096 (2017).
- Parussini, F., Coppens, I., Shah, P. P., Diamond, S. L., Carruthers, V. B. Cathepsin L occupies a vacuolar compartment and is a protein maturase within the endo/exocytic system of Toxoplasma gondii. Molecular Microbiology. 76 (6), 1340-1357 (2010).
- Huynh, M. H., Carruthers, V. B. Tagging of endogenous genes in a Toxoplasma gondii strain lacking Ku80. Eukaryotic cell. 8 (4), 530-539 (2009).
- Fox, B. A., Ristuccia, J. G., Gigley, J. P., Bzik, D. J. Efficient gene replacements in Toxoplasma gondii strains deficient for nonhomologous end joining. Eukaryotic Cell. 8 (4), 520-529 (2009).
- Sidik, S. M., Hackett, C. G., Tran, F., Westwood, N. J., Lourido, S. Efficient Genome Engineering of Toxoplasma gondii Using CRISPR/Cas9. PLoS ONE. 9 (6), e100450 (2014).
- Shen, B., Brown, K. M., Lee, T. D., Sibley, D. L. Efficient Gene Disruption in Diverse Strains of Toxoplasma gondii Using CRISPR/CAS9. mBio. 5 (3), e01114-14 (2014).
- Radke, J. R., et al. Defining the cell cycle for the tachyzoite stage of Toxoplasma gondii. Molecular and Biochemical Parasitology. 115 (2), 165-175 (2001).
- Ran, A. F., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Labun, K., Montague, T. G., Gagnon, J. A., Thyme, S. B., Valen, E. CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Research. 44 (W1), W272-W276 (2016).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 2812 (2014).
- Peng, D., Tarleton, R. EuPaGDT: a web tool tailored to design CRISPR guide RNAs for eukaryotic pathogens. Microbial Genomics. 1 (4), e000033 (2015).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. 32 (12), 1262-1267 (2014).
- Sidik, S. M., et al. A Genome-wide CRISPR Screen in Toxoplasma Identifies Essential Apicomplexan Genes. Cell. 166 (6), 1423-1435 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır