Method Article
Maya Toksisitesi ve Bastırıcı Ekranlar Kullanılarak Bakteriyel Efektör Proteinlertarafından Hedeflenen Konak Yollarının Belirlenmesi
Bu Makalede
Özet
Bakteriyel patojenler, önemli biyolojik süreçleri hedef alan konakiçine protein salgılarlar. Bakteriyel efektör proteinlertarafından hedeflenen konak yollarının belirlenmesi moleküler patogenezi ele almanın anahtarıdır. Burada, toksik bakteriyel efektör proteinlertarafından hedeflenen konak yollarını açıklamak için modifiye edilmiş maya bastırıcı ve toksisite ekranı kullanılarak kullanılan bir yöntem tanımlanmıştır.
Özet
Hücre içi bakteriler, konak proteinleri ve/veya bunların ilişkili biyolojik yollarını bakterinin yararına bozmak için harekete giren konak sitosola efektör proteinler adı verilen virülans faktörleri salgılarlar. Putatif bakteriyel efektör proteinlerinin tanımlanması, bakteri genom dizilimindeki gelişmeler ve salgı adaylarını ve/veya ökaryotik benzeri genlerin silico olarak tanımlanmasına olanak sağlayan algoritmaların ortaya çıkması yla daha yönetilebilir hale gelmiştir. Etki alanları. Ancak, bu önemli virülans faktörlerinin belirlenmesi sadece bir başlangıç adımıdır. Doğal olarak, amaç efektör proteinlerin moleküler fonksiyonunu belirlemek ve konak ile nasıl etkileşime açıklanır. Son yıllarda, maya iki melez ekran ve kütle spektrometresi ile birleştiğinde büyük ölçekli immünopretri gibi teknikler protein-protein etkileşimlerinin belirlenmesinde yardımcı olması. Bir konak bağlayıcı ortağın tanımlanması, bakteriyel efektör proteinin moleküler işlevini niçin açıklığa kavuşturmaya yönelik önemli bir ilk adım olsa da, bazen konak proteinin birden fazla biyolojik işlevi olduğu saptandı (örneğin, aktin, klathrin, tubulin), veya bakteriyel protein, konak proteinlerini fiziksel olarak bağlamayabilir, bu da araştırmacıyı manipüle edilen kesin konak yolu hakkında önemli bilgilerden mahrum bırakabilir. Bir bastırıcı ekran ile birleştiğinde modifiye maya toksisite ekranı bakteriyel efektör proteinler tarafından etkilenen konak yollarını belirlemek için adapte edilmiştir. Toksisite ekranı, genellikle büyüme kusuru olarak kendini gösteren konak biyolojik yolları etkileyen efektör proteinin neden olduğu mayadaki toksik etkiye dayanır. Bir maya genomik kütüphane ifadesi bakteriyel efektör proteintoksisitesini bastırmak ve böylece etkici protein hedefleri yolunda proteinleri belirlemek konak faktörleri tanımlamak için kullanılır. Bu protokol hem toksisite hem de bastırıcı ekranlar için ayrıntılı talimatlar içerir. Bu teknikler moleküler klonlama ve maya ve Escherichia coliekimi yeteneğine sahip herhangi bir laboratuvarda yapılabilir.
Giriş
Burada sunulan benzer prosedürlerin ilk raporu Legionella pnömofili tip IV efektör SidD karakterize,Rab11 değiştirir bir deAMPylase . Karşılaştırılabilir teknikler birkaç L. pnömofili efektörlerinin karakterizasyonu için kullanılmıştır1,2,3. Bir Coxiella burnetii tip IV efektör proteinkarakterizeetmek için yapılan tetkik, ve son zamanlarda bu tekniğin yararı Klamidya trachomatis inklüzum membran proteinlerin karakterizasyonu için genişletildi5 .
Bu protokol iki ana bölüme ayrılabilir: 1) hangi ilgi bakteriyel efektör protein ifade edilir maya toksisite ekranı ve klonlar bir büyüme defekti ile kanıtlandığı gibi toksik bir fenotip için taranır, ve 2) maya bastırıcı ekran , hangi toksik fenotip toksik suşu bir maya genomik kütüphane ifadesi ile bastırılır. Böylece, toksisite ekranı ilgi bakteriyel etkisi aşırı ifade edildiğinde büyüme kusurları olarak tezahür toksik fenotipler için bir ekrandır. Toksik klonlar, başarıyla dönüştürülmüş ve bakteriyel efektör ifade, seçilir ve bir sonraki adım için kaydedilir. İkinci büyük adım toksik maya klon kısmen sindirilmiş maya genomik kütüphane overexpressing içerir. Bu protokolde kullanılmak üzere önerilen maya genomik kütüphanesini oluşturan plazmidler, genellikle tüm plazmidlerde ~1,5 kb ortalama gen boyutuna karşılık gelen ve tüm maya genomunu kaplayan 5−20 kb ek uçlar taşırlar. yaklaşık 10x. Amaç bakteriyel efektör proteinin toksisitesini bastırmak için olduğu gibi, testin bu bölümü, bastırıcı ekran denir. Potansiyel bastırıcı plazmidler mayadan izole edilir, dizilir ve baskılayıcı ORF'ler tanımlanır. Bastırıcı ekranın altında yatan mantık, efektör proteinin hedefaldığı ana yol bileşenlerini bağlaması, etkileşimi ve/veya bunaltmasi ve bu konak proteinlerinin aşırı olarak geri sağlanmasının yol üzerindeki toksik etkiyi kurtarabileceği ve böylece, büyüme kusuru. Böylece, toksisiteyi baskılayan tanımlanmış ORF'ler genellikle bir ana yolun birden fazla katılımcıyı temsil eder. Ortogonal deneyler daha sonra bakteriyel efektör gerçekten karıştığı yol ile etkileşime doğrudoğrulamak için yapılır. Bu proteinler çok sayıda konak sürecine dahil olduğundan, clathrin veya aktin gibi bağlayıcı bir ortak tespit edildiyse bu özellikle gereklidir. Daha sonra daha fazla deney enfeksiyon sırasında efektör proteinfizyolojik işlevini açıklayabilir. Toksisite ve bastırıcı ekranlar aynı zamanda, konak proteinlerini immünoprepitasyon la tespit etmeye yetecek yakınlıklarla fiziksel olarak bağlamayan veya bir maya-iki hibrid ekran tarafından tespit olmayabilir enzimatik vur-çalıştır etkileşimleri ev sahibi.
Bastırıcı ekran bakteriyel efektör proteinler ve konak yolları arasındaki potansiyel fizyolojik etkileşimleri ortaya çıkarmak için güçlü bir yöntem olsa da, bakteriyel efektör protein maya bir büyüme defekti neden olmalıdır, aksi takdirde kullanarak bastırıcı ekran çok az kullanım olacaktır. Ayrıca, toksik fenotip büyüme en az 2−3 log10 açığı neden olmalıdır ya da bastırıcılar belirlemek zor olacaktır. Bir laboratuvar hücre kültürü için kurulmuşsa, HeLa gibi ortak hücre hatlarında toksisite için tarama efektörü proteinler genellikle maya toksisite ekran ile devam etmek için çaba değer olup olmadığı konusunda fikir verebilir. HeLa hücrelerinde efektör proteinin ektopik ekspresyonu bazen bu ekranlar için kullanılan maya suşundaki toksisite ile çok güçlü bir şekilde ilişkili toksisite ile sonuçlanır4. HeLa hücrelerinde stres gözlemlenebilir özellikleri stres liflerinin kaybı dahil, plaka hücre ayrılması, ve apoptosis gösteren nükleer yoğuşma. HeLa hücrelerinde stres herhangi bir görsel göstergesi ilgi protein maya bir büyüme defekti indüklemek için iyi bir aday yapmak, hangi çok daha hızlı çoğaltmak ve böylece daha gerekli yolların tedirginlik duyarlı.
Bu bastırıcı ekran her zaman bastırıcı olarak konak bağlayıcı ortakları tanımlamak değil unutulmamalıdır, ama yine de hedeflenen konak yolu (lar) kritik bileşenleri ima edebilir, biyolojik süreçlerin bütünsel bir görünüm elde bakteriyel efektör protein. Yüzeyde, bu mantıksız görünüyor, çünkü aşırı efektör protein bağlayıcı ortağı sağlayan büyüme defekti kurtarmak için beklenebilir. C. trachomatis efektör protein CT229 (CpoS) tarafından hedeflenen yolları belirlemek için çabalar, hangi enfeksiyon sırasında en az 10 farklı Rab GTPases bağlanır5, Rab bağlayıcı ortakların hiçbiri CT229 toksisitesini bastırılmış. Ancak, clathrin kaplı vezikül (CCV) ticaretinde yer alan çok sayıda bastırıcı tespit edilmiştir ve bu da CT229'un özellikle Rab bağımlı CCV ticaretini bozan çalışmalara yol açmıştır. Benzer şekilde, C. burnetii efektör protein Cbu0041 (CirA) maya büyüme defekti kurtarıldı birkaç Rho GTPases araştırırken tespit edildi, ve daha sonra RhoA için bir GTPase aktive protein (GAP) olarak CirA fonksiyonları bulundu4.
Bakteriyel efektör proteinler tarafından hedeflenen konak yollarının aydınlatılması için maya bastırıcı ekranın yararlılığı abartılamaz ve hücre içi bakteriyel efektör proteinlerini karakterize etmeye çalışan diğer araştırmacılar bundan büyük ölçüde fayda sağlayabilirler. bu teknikler. İmmünenyağışlar ve/veya maya-iki hibrid ekranlar bağlayıcı bir ortak bulamamışsa ve hangi yolların bakteriyel efektör protein tarafından hedeflendiğini açıklayabilirse bu tahliller değerlidir. Burada, hücre içi bakteriyel efektör proteinlertarafından hedeflenen konak biyolojik yollarını belirlemek için toksisite ve bastırıcı ekranlar için ayrıntılı protokoller, ayrıca bu tahliller ve bunların kullanımında karşılaşılan ortak engellerden bazıları sağlanır. ilgili çözümler.
Protokol
1. Ortam ve reaktiflerin hazırlanması
NOT: Plakalar tisme gününden önce hazırlanmalı ve 1 ay boyunca iyi olacaktır. Medya ve reaktifler herhangi bir noktada yapılabilir ve 1 ay boyunca iyidir.
- 1,000 mL'lik bir kabın içinde 800 mL distile suda 100 g D-(+)-glikozu eriterek glikoz çözeltisinin 1 L'sini (%10 w/v) hazırlayın. Distile su ile hacmi 1 L olarak ayarlayın. Steril 1 L ortam depolama şişesine 0,2 m steril filtreden süzün.
- 1 L kabında 800 mL distile su damıtılmış su 100 g D-(+)- galaktoz eriterek galaktoz çözeltisinin 1 L'sini (%10 w/v) hazırlayın. Distile su kullanarak sesi 1 mL'ye ayarlayın ve 0,2 m steril filtreden steril 1.000 mL ortam depolama şişesine filtre uygulayın.
- 10 g maya ekstresi, 20 gr pepton, 20 g glikoz ve 1000 mL distile suda 20 g agar eriterek 1 L maya özü peptroz (YPD) agar hazırlayın. 20 dk için otoklav ve 56 °C su banyosunda soğudukadar soğutuldu. Plaka başına ~20 mL ortam kullanarak 100 mm plakaya dökün.
- 10 g maya ekstresi, 20 g pepton ve 1000 mL distile suda 20 g glikoz eriterek 1 L YPD suyu hazırlayın. 20 dk için otoklav.
- Sentetik dropout (SD) urasil (Ura-) glikoz agar hazırlayın. 1 L için, amino asitler olmadan 6,7 g maya azot tabanı, urasil olmadan 1,9 g bırakma takviyesi ve 800 mL distile su damıtılmış su 15 g agar çözünür. Otoklav 20 dakika ve sıcaklık ~ 50−60 °C olana kadar 56 °C su banyosunda serin. 50 mL serolojik pipet veya steril bir silindir kullanarak, adım 1.1'de hazırlanan glikoz çözeltisinin 200 mL'sini ekleyin. Yavaşça girdap veya karıştırma plakası üzerinde yer tarafından iyice karıştırın. Plaka başına ~20 mL ortam kullanarak 100 mm plakaya dökün.
- Sentetik dropout (SD) urasil (Ura-) galaktoz agar hazırlayın. 1 L için, amino asitler olmadan 6,7 g maya azot tabanı, urasil olmadan 1,9 g bırakma takviyesi ve 800 mL distile su damıtılmış su 15 g agar çözünür. Otoklav 20 dakika ve sıcaklık ~ 50−60 °C olana kadar 56 °C su banyosunda serin. 50 mL serolojik pipet veya steril mezun silindir kullanarak, adım 1.2'de hazırlanan galaktoz çözeltisinin 200 mL'sini ekleyin. Yavaşça girdap veya karıştırma plakası üzerinde yer tarafından iyice karıştırın. Plaka başına ~20 mL ortam kullanarak 100 mm plakaya dökün.
- Sentetik damla (SD) urasil (Ura-) glikoz suyu hazırlayın. 1 L için, amino asitler olmadan 6,7 g maya azot tabanı ve 800 mL distile suurasil olmadan 1,9 g damlama takviyesi çözün. Otoklav 20 dakika ve sıcaklık ~ 50−60 °C olana kadar 56 °C su banyosunda serin. 50 mL serolojik pipet veya steril bir silindir kullanarak, adım 1.1'de hazırlanan glikoz çözeltisinin 200 ml'sini ekleyin.
- Sentetik dropout (SD) urasil (Ura-) lösin (Leu-) glikoz agar hazırlayın. 1 L için, amino asitler olmadan maya azot tabanının 6.7 g çözünür; Urasil olmadan 1.9 g bırakma takviyesi, lösin, ve triptofan; 15 g agar; ve 800 mL distile suda 0.076 g triptofan. Otoklav 20 dakika ve sıcaklık ~ 50−60 °C olana kadar 56 °C su banyosunda serin. 50 mL serolojik pipet veya steril bir silindir kullanarak, adım 1.1'de hazırlanan glikoz çözeltisinin 200 mL'sini ekleyin. Plaka başına ~20 mL ortam kullanarak 100 mm plakaya dökün.
- Sentetik dropout (SD) urasil (Ura-) lösin (Leu-) galaktoz agar hazırlayın. 1 L için, amino asitler olmadan maya azot baz 6.7 g çözünür; Urasil olmadan 1.9 g bırakma takviyesi, lösin, ve triptofan; 15 g agar; ve 800 mL distile suda 0.076 g triptofan. Otoklav 20 dakika ve sıcaklık ~ 50−60 °C olana kadar 56 °C su banyosunda serin. 50 mL serolojik pipet veya steril mezun silindir kullanarak, adım 1.2'de hazırlanan galaktoz çözeltisinin 200 mL'sini ekleyin. Yavaşça dönerveya bir karıştırma plakası üzerine yerleştirerek iyice karıştırın. Plaka başına ~20 mL ortam kullanarak 100 mm plakaya dökün.
- Sentetik dropout (SD) urasil (Ura-) lösin (Leu-) glikoz suyu hazırlayın. 1 L için, amino asitler olmadan maya azot baz 6.7 g çözünür; Urasil olmadan 1.9 g bırakma takviyesi, lösin, triptofan; ve 800 mL distile suda 0.076 g triptofan. Otoklav 20 dk ve sıcaklık ~ 50 °C olana kadar 56−60 °C su banyosunda soğutun. 50 mL serolojik pipet veya steril bir silindir kullanarak, adım 1.1'de hazırlanan glikoz çözeltisinin 200 mL'sini ekleyin.
- Polietilen glikol (PEG) çözeltisi hazırlayın. Distile suya %50 w/v polietilen glikol 3350 ekleyin. Otoklavlama ile sterilize edin.
- 1 M lityum asetat (LiAc) 10,2 g lityum asetat dehidrat 200 mL distile su eriterek hazırlayın. Otoklavlama ile sterilize edin.
- Ringa spermi DNA'sını hazırlayın. Seyreltin 10 mg /mL ringa sperm DNA'sı 2 mg/mL distile su kullanılarak. Isı 100 °C'de 5 dk ve hemen 5 dk buz üzerine yerleştirin.
2. Maya toksisitesi plazmid pYesNTA-Kan içine ilgi gen klonlama
NOT: Şu anda, çeşitli maya toksisite vektörleri hem ticari hem de akademik olarak mevcuttur. Maya bastırıcı ekran ilgi efektör protein ifade plazmid sağlanan bu vektörlerin çoğu ile birlikte kullanılabilir urasil dışında bir bırakma seçimi ve BlaRdışında bir antibiyotik belirteci kullanır . Bu çalışmada, potansiyel bastırıcılar için daha kolay tarama için kanamisin direnci kaseti içeren değiştirilmiş bir pYesNTA vektör4,5 kullanılmıştır. Klonlama şeması efektör proteinin Gal organizatörü ve Onun Tag ile aynı çerçevede olmasını beklemelidir. Klamidya trachomatis inkasyon membran proteini CT229 bu tahliller için prensip kanıtı olarak kullanılmıştır.
- CT229 +1 Kpn F (CCGGTACCAATGAGCTGTTAATGTTATCAGGT) ve CT229 XhoI R (CCCTCTCGAGTTTTTACGACGGGATGCC) astarları kullanarak üreticinin talimatları na göre C. trachomatis genomik DNA'dan CT229'u yükseltmek için PCR'yi kullanın. Aşağıdaki PCR koşullarını kullanın: (1) 30 s için 98 °C; (2) 10 s için 98 °C, 30 s için 55 °C, 2 dk için 72 °C; (3) 25x toplam için adım 2 tekrarlayın; (4) 10 dk için 72 °C; ve (5) 4 °C tutun.
- PCR ürününün 5 μL'sini %1 agarose jel üzerinde analiz edin (Şekil 1).
- Üreticinin talimatlarına uyarak pcr arıtma kiti kullanarak kalan 45 μL DNA'yı arındırın.
- KpnI-HF ve XhoI-HF kullanarak bir su banyosunda 37 °C'de 1 saat boyunca 50 μL saflaştırılmış PCR kesici uç ve pYesNTA-Kan(Şekil 2)sindirin.
NOT: pYesNTA-Kan için, 5 μL KpnI-HF, 5 l XhoI-HF ve 6 μL tampon toplam hacmi 60 μL kullanarak 5 μg plazmid sindirin. Kesici uç için, 2 μL KpnI-HF, 2 μL XhoI-HF ve 6 μL arabellek kullanarak saflaştırılmış PCR ürününün tamamını sindirin. - % 1 agarose jel üzerinde tüm plazmid sindirim çalıştırın. Üreticinin talimatları na göre bir jel çıkarma kiti kullanarak sindirilmiş plazmid saflaştırma gerçekleştirin.
- Üreticinin talimatlarına uyarak bir PCR temizleme kiti kullanarak sindirilmiş PCR kesici uç arındırın.
- 2 μL pYesNTA-Kan (adım 2.5), 2 μL DNA ligaz tamponu, 1 μL T4 ligaz ve 15 μL insert (adım 2.6) kullanarak pYesNTA-Kan'a kesici uç yerleştirin. 1 saat oda sıcaklığında kuluçka.
- Tüm klonlama reaksiyonunu 50 μL E. coli yetkili hücrelere ekleyin ve dönüşüm reaksiyonunu gerçekleştirin.
- 100 μg/mL karbenicillin içeren bir LB plakasında tüm dönüşüm reaksiyonu plakası.
- Üç ayrı koloniile 100 μg/mL karbenicillin içeren LB'nin 10 mL'sini inoküle edin. 150 rpm sallayarak 37 °C'de bir gecede kuluçka.
- Plazmidi üreticinin talimatlarına uyarak plazmid miniprep kiti kullanarak izole edin.
- Gen lere özgü astarlar kullanarak izole plazmidleri sırala (adım 2.1).
3. Mayat toksisite için ilgi protein test edin
- İz Saccharomyces cerevisiae W303 YPD agar (adım 1.3) izole koloniler elde etmek için. 30 °C'de 24 saat kuluçkaya yatırın.
- 10 mL YPD suyu (adım 1.4) agar plakasından tek bir koloni ile inoculate (adım 3.1). 30 °C'de bir gecede 150 rpm'de titreyerek kuluçkaya yat.
- YPD suyu 10 mL (adım 1.4) ve 4 saat için 150 rpm sallayarak 30 °C'de kuluçkaya yatırın.
- 4 °C'de 10 dk için 3.000 x g'da 10 mL kültür pelet.
- 1 mL steril suda peleti yeniden askıya alın, mikrosentrifuge tüpüne aktarın ve oda sıcaklığında 1 dk için 3.000 x g pelet.
- 1 mM lityum asetat (LiAc) ve 3.000 x g'de 1 mL oda sıcaklığında peleti yeniden askıya alın.
- LiAc yıkama 2x tekrarlayın.
- Yıkamayı çıkarın. Peletin 2,4 mL'si %50 PEG 3350'de yeniden askıya alın. 360 μL 1M LiAc, 500 μL 2 mg/mL ringa spermi DNA'sı ve 400 μL steril su ekleyin.
NOT: Bu 20 dönüşüm için yeterlidir. - 3.3.5 adımdan 5 μL pYesNTA-Kan CT229 plazmid DNA'sını (100−500 ng) içeren mikrosantrifüj tüpüne dönüşüm karışımının 180 μL'sini 2,12'den ekleyin.
- 30 dakika boyunca 30 °C'de bir su banyosunda kuluçka.
- 30 dakika boyunca 42 °C'de bir su banyosunda kuluçka.
- Oda sıcaklığında 1 dk için 3.000 x g pelet.
- Transformasyon karışımını pipetle çıkarın. 100 μL steril suda peleti yeniden askıya alın. Plaka SD Ura üzerinde dönüşüm- glikoz (adım 1.5) ile agar.
- 30 °C'de 48 saat boyunca kuluçka plakaları.
- 5 mL SD Ura inoculate- et suyu içeren glikoz (adım 1.7) plaka tek bir koloni ile. 150 rpm sallayarak 30 °C'de bir gecede kuluçka. Negatif kontrol olarak tek başına vektör ile dönüştürülmüş maya içerir.
- 96 kuyu plakasının (A2−A6) 5 kuyuya 180°L steril su ekleyin.
- Girdap gece kültürü karıştırmak için.
- İlk kuyuya (A1) 180 μL maya ekleyin. Seri seyreltilmiş 1:10 (seyreltilmemiş dahil olmak üzere toplam altı örnek).
- Çok kanallı bir pipet kullanarak, SD Ura üzerinde her seyreltme 5 μL nokta- glikoz (adım 1.5) ve Ura- galaktoz (adım 1.6) agar plakaları. 30 °C'de 48 saat kuluçkaya yatırın.
- Toksisiteyi, galaktoz içeren ortam üzerinde yetişen ilginin etki edici proteinini, sadece vektörü ifade eden mayanın büyümesiile karşılaştırarak toksisiteyi değerlendirin.
- Batı lekeleme ile His-tag füzyon proteinekspresyonu doğrulayın.
4. Maya genomik kütüphane ile toksik maya dönüştürmek
- 100 mL SD Ura inoculate- glikoz suyu (adım 1.7) adım 3.4 gelen stok 1 mL kullanarak. 30 °C'de 16−24 saat boyunca 150 rpm'de sallayarak kuluçkaya yatırın. Ortamı önceden ısıtmak için bir gecede 900 mL SD Ura- glikoz suyu 30 °C'ye yerleştirin.
- Önceden ısınmış 1 L şişeye gecelik kültürün tüm 100 mL'sini ekleyin. 30 °C'de 4−5 saat boyunca 150 rpm'de sallayarak kuluçkaya yatırın.
- 4 °C'de 10 dk için 6.000 x g'da pelet kültürü.
- Supernatant atın. 250 mL steril suda peleti yeniden askıya alın. 4 °C'de 5 dk için 6.000 x g'da pelet kültürü.
- Supernatant atın. 1 mM LiAc'ın 250 mL'lik peletini yeniden askıya alın. 4 °C'de 5 dk için 6.000 x g'da pelet kültürü.
- LiAc'ı çıkarın ve peleti 9,6 mL %50 PEG 3350'de yeniden askıya alın. 1.44 mL 1M LiAc, 2 mL 2 mg/mL ringa spermi DNA'sı, 50 μg pYep13 genomik kütüphane (ATCC 37323) ekleyin. Hacim15 mL steril su ile ayarlayın. Ters çevrilerek hafifçe karıştırın.
- 30 dakika boyunca 30 °C'de bir su banyosunda kuluçka.
- Dönüşüm verimliliğini artırmak için 750 μL dimetil sülfoksit (DMSO) ekleyin. 30 dk. Her 10 dakikada bir yumuşak inversiyon ile karıştırın 42 °C'de bir su banyosunda kuluçka.
- Oda sıcaklığında 5 dk için 3.000 x g maya pelet.
- Supernatant atın ve steril su 10 mL pelet resuspend. Oda sıcaklığında 5 dk için 3.000 x g pelet.
- 8 mL steril suda peleti yeniden askıya alın.
- Dönüşüm verimliliğini belirlemek için, SD Ura -Leu - glukoz agar (adım 1.8) üzerindeki her seyreltmenin 1:10 ve plaka 100°L'sini seyreltin.
- Plaka 200 μL SD Ura üzerinde örnek- Leu- galaktoz agar (adım 1.9) plakalar. Toplam 50 tabak kullanın.
- 48−96 saat boyunca 30 °C'de veya koloniler ortaya çıkana kadar kuluçkaya yatırın.
NOT: Koloniler genellikle 48−72 h'de glikoz agar plakalarında, galaktoz agar plakalarında ise 72−96 h'de görünürler.
- Yama kolonileri (potansiyel kurtarma) SD Ura- Leu- galaktoz agar (adım 1.9) genişletmek ve stok yapmak. 24−48h için 30 °C'de kuluçka.
- Yama nın bir kısmını kullanarak 5 mL SD Ura- Leu- glikoz suyu (adım 1.10) inoculate. Gece boyunca 26 °C'de 150 rpm'de sallayarak kuluçkaya yatırın.
- 96 kuyu plakasının (A2−A6) 5 kuyuya 180°L'lik steril su ekleyin.
- Girdap gece kültürü karıştırmak için.
- İlk kuyuya (A1) 180 μL maya ekleyin. Seri seyreltilmiş 1:10 (seyreltilmemiş dahil olmak üzere toplam altı örnek).
- Çok kanallı pipet kullanarak, SD Ura üzerinde her seyreltme 5 μL nokta- glikoz ve SD Ura- galaktoz agar plakaları. Bir kontrol olarak tek başına toksik efektör ekleyin.
- 30 °C'de 48 saat kuluçkaya yatırın.
- Potansiyel bastırıcılar içeren maya tek başına toksik efektörü ifade maya büyüme karşılaştırın. Sadece tek başına efektör ifade maya ile karşılaştırıldığında toksisite azalmış potansiyel bastırıcılar ile devam edin.
5. Bastırıcıları tanımlamak ve onaylamak
- 5 mL SD Ura- Leu- glukoz suyu (adım 1.10) adım 4.4'ten 100 μL maya ile inoculate ve 150 rpm sallayarak 30 °C gecede kuluçka.
- Oda sıcaklığında 2 dk için 3.000 x g maya pelet. Bir pipet kullanarak supernatant'ı yavaşça atın.
- Üreticinin talimatları na göre bir maya plazmid miniprep kiti ile plazmid izole.
- İzole plazmidi E. coli yetkili hücrelere dönüştürün ve LB agar'daki tüm dönüşümü 100 μg/mL karbenicillin ile plakalayın. 37 °C'de 24 saat kuluçkaya yatırın.
- 100 μg/mL carbenicillin içeren 10 mL LB suyu aşılayın, plakadan üç koloni ile ve 150 rpm'de sallayarak bir gecede 37 °C'de kuluçkaya yatırın.
- Oda sıcaklığında 10 dk için 3.000 x g pelet kültürleri. Üreticinin talimatlarına uyarak bir miniprep kiti kullanarak plazmid izole edin.
- Protokol 3.
- Dönüşüm plakasından bir koloni ile 5 mL SD Ura- Leu- glikoz suyu aşılamak. 150 rpm sallayarak 30 °C'de bir gecede kuluçka.
- Ura Spot- Leu- glikoz ve galaktoz agar toksisite bastırma onaylamak için.
- Maya ORF'lerini tanımlamak için pYep13 F (ACTACGCGATCATGGCGA) ve pYep13 R (TGATGCCGGCCACGATGC) astarları kullanaraksıra.
Sonuçlar
Gerçek maya bastırıcı ekran yapılabilir önce, ilgi efektör protein maya toksisite için test edilmelidir. Bu bir galaktoz indükleyici kontrolü altında maya ilgi protein ifade ederek gerçekleştirilir. Glikozda büyüme (nonindücing koşulları) öncelikle toksisite özellikle ilgi proteininin ekspresyonundan kaynaklandığından ve genel bir kusur olmadığından emin olmak için karşılaştırılmalıdır. Şekil 3'tegösterildiği gibi toksisite daha küçük koloniler ve/veya büyümenin azalması olarak kendini gösterir. Maya büyümesinde 2−3 günlük azalma maya bastırıcı ekranlar için idealdir.
Şekil 4'tegösterildiği gibi, toksisite ve bastırıcı ekran protokol bölümünde açıklanan yöntemler kullanılarak sekiz adımda gerçekleştirilebilir. İlgi geni uygun bir vektör1'eklonlanır ve ortaya çıkan yapılar toksisiteyi değerlendirmek için mayaya dönüştürülür. Bu çalışmada CT229 ilgi geni, pYesNTA-Kan vektör olarak kullanılmıştır. Ayrıca, His-tagged füzyon proteininin ekspresyonu Batı lekeleme ile doğrulandı. İdeal olarak, galaktoz içeren ortamda yetişen mayada 2−3 log azalma gözlenmelidir. Eğer ilgi proteini maya için toksik ise(Şekil 3 ve Şekil 4),bastırıcı ekran, maya genomik kütüphane pYep13 ile toksik suşu dönüştürerek yapılabilir. Transformatörler dönüşüm verimliliğini belirlemek için glikoz agar ve potansiyel bastırıcılar belirlemek için galaktoz agar üzerine kaplanır. Bu protokol kullanılarak, galaktoz agar üzerinde toplam 10−250 koloni ile minimum dönüşüm verimliliği 5 x 105'e ulaşılmıştır. SD Ura bu koloniler Patching- Leu- galaktoz agar(Şekil 4)gerçek bastırıcıların belirlenmesinde yardımcı, birçok yanlış pozitif yamalı büyümek olmaz çünkü. Burada 50 koloni yamalı ve bastırılmış efektör toksisite olan sekiz klon elde edilmiştir(Şekil 4). SD Ura üzerinde spotisörler ilerlür- Leu- galaktoz agar toksisite bastırma onaylamak için yapıldı. Şekil 4'tegösterildiği gibi, pSup1 ve pSup 2 efektör proteinin toksisitesini bastırırken, pSup3 yoktu. Bu nedenle, pSup3 atıldı. Plazmidler daha sonra bastırıcılardan izole edildi ve plazmid verimini artırmak için E. coli'ye dönüştürüldü. Plazmid daha sonra izole plazmid kesinlikle etki veya toksisite bastırır onaylamak için toksik maya dönüştürülebilir(Şekil 4). İzole plazmidlerin çoğu toksisiteyi kurtarmalıyken, bazen toksisiteye dönüşdüğünde toksisiteyi bastırmayan bir plazmid elde edilir. Bu plazmidler atılır ve sadece yeniden dönüşümden sonra toksisiteyi baskılayanlar sıralanmalıdır.
İzole plazmid birden fazla maya ORFsiçerecektir 4. Gerçek bastırıcı hangisi olduğunu belirlemek için, her ORF ayrı ayrı klonlanmış ve daha önce açıklandığı gibi toksik maya suşu ifade edilebilir1,2,3,4.

Şekil 1: Hedef genin PCR amplifikasyonu. Klamidya trachomatis serovar L2'den CT229 genomik DNA'dan güçlendirilmiş PCR idi. PCR ürünleri ethidyum bromür ile boyanmış %1 agarose jel üzerinde analiz edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
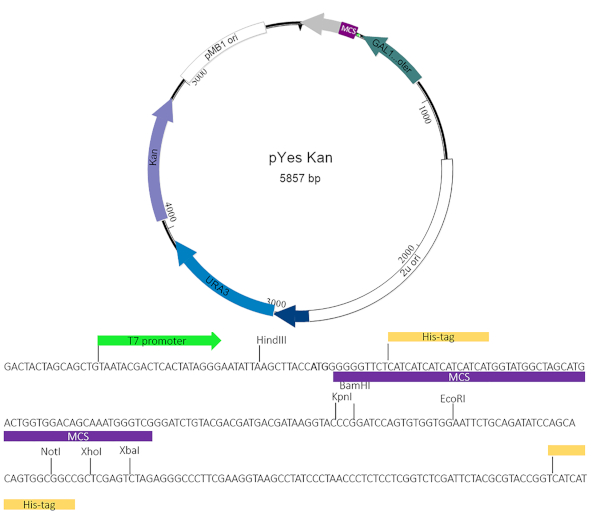
Şekil 2: pYesNTA-Kan plazmid haritası. E. coli'de seçilim için pYesNTA-Kan. Kanamisin'in çoklu klonlama bölgesine (MCS) ilgi lenen hedef gen klonlandı ve S. cerevisiae'de urasil okulu bırakma seçiminde kullanıldı. His-tagged füzyon proteininin ekspresyonu Batı lekeleme ile doğrulandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Temsili maya toksisitesi sonuçları. İlgi çekici proteinler pYesNTA-Kan'a klonlandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Maya bastırıcı ekrana genel bakış. Hedef gen pYesNTA-Kan'a klonlanmış ve plazmidler S. cerevisiae'yedönüştürülmüştür. Transformantlar seri seyreltilmiş ve Ura benekli- glikoz ve galaktoz agar toksisite değerlendirmek için. Toksik efektör proteinin hedeflenen yolu belirlemek için, toksik proteini ifade eden maya suşu bir maya genomik kitaplığı ile dönüştürülmüştür. Koloniler Ura- Leu- galaktoz agar üzerinde yamalı ve toksisite değerlendirmek için tespit edildi. Plazmidler, efektör proteinin toksisitesini baskılayanlardan izole edildi. Plazmidler izole plazmid bir bastırıcı olduğunu doğrulamak için toksik maya suşu içine yeniden dönüştürülmüştür. Baskılayıcılardan plazmidler mevcut maya ORF'leri tanımlamak için sıralandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, modifiye edilmiş maya toksisitesi ve bastırıcı ekran kullanarak bakteriyel efektör proteinler tarafından hedeflenen konak biyolojik yollarını belirlemek için adım adım prosedürleri özetliyor. Kullanılan maya suşu, S. cerevisiae W303, hem urasil hem de lösin için yardımcı dır. Suş urasil auxotrophy pYesNTA-Kan vektörü üzerinde ilgi protein taşıyan maya seçmek için kullanılır ise lösin ekofofimaya genomik kütüphane vektör pYep13 seçmek için kullanılır. Maya genomik kütüphane plazmidleri 3−13 ORF taşır, bu nedenle her ORF ayrı ayrı p415-ADH vektör6 veya benzer bir vektör içine klonlanmış ve gerçek bastırıcı olduğunu belirlemek için toksik maya yeniden dönüştürülmelidir. Bir konak biyolojik yolu temsil eden birkaç bastırıcıbelirlemek için tipiktir. Bastırıcılar bazen ilgi bakteriyel protein doğrudan bağlayıcı ortakları olabilir, ama her zaman değil.
pYesNTA-Kan'da bakteriyel protein taşıyan maya klonları üretmek ilk önemli adımdır ve toksik taşıyan maya için güçlü negatif seçim olduğu için bu klonların bütünlüğünü en kısa sürede korumaya özen proteinler, kasıtlı galaktoz indüksiyon olmadan bile, ve plazmid kaybedebilir. Bazen maya bırakma medya üzerinde seçim altında muhafaza bile plazmid kaybı vardır. Daha önce vektörü doğrusallaştırarak ve mayagenomu 1'eentegre ederek plazmid kaybının oluşumunu azaltan bir yöntem bildirilmiştir.
Bu tekniklerin önemli bir dezavantajı, bastırıcı ekran sadece bakteriyel efektör protein aşırı ekspresyon maya gözlemlenebilir ve tutarlı bir büyüme defekti tetikler eğer anlamlı veri verir. Bu yöntemde birincil zorluk hiçbir bastırıcılar tespit edilir. Bastırıcıların tespit edilmemesinin biyolojik nedenlerden mi yoksa teknik sorunlardan mı kaynaklandığını belirlemek zordur. Biyolojik açıdan bakıldığında, ilgi proteini o kadar zehirli olabilir ki genomik kütüphanedeki proteinler toksisiteyi önemli ölçüde bastıramaz, hedeflenen yol kurtarılamaz olabilir, ya da çok sayıda birlikte ifade edilebilir. faktörlertoksik etkisi aşmak için gerekli olabilir. Parçalanmak için birçok tanımlanmamış değişken olduğu için biyolojik açıklamaya yaklaşmak zordur. Kurulmuş bir protokol olduğundan, teknik açıklamaları keşfetmek çok daha çekici bir yaklaşımdır. Teknik açıdan bakıldığında, bastırıcıların tespit edilmemesi, maya genomik kitaplığın düşük dönüşüm verimliliğinin bir sonucudur. Bu protokol, pYEp13'te kısmen sindirilmiş genomik kütüphanede ATCC S. cerevisiae AB320'yi kullanab13. Diğer kitaplıklar diğer vektörlerin yanı sıra yeterli olabilir, ancak bu protokol özellikle ATCC kitaplığını kullanır ve şu anda alternatif kitaplık veya vektör kaynaklarını bildiren hiçbir çalışma yayınlanmamıştır. Maya genomunun kapsamının en az 10x olması veya yetersiz temsilin bastırıcıların tanımlanmasını engelleyebileceği şiddetle tavsiye edilir. Dönüşüm verimliliğinin azalması bu sayıları 1x'in altına getirebilir. Bu nedenle, maya genomunun bazı bölümleri bastırıcı ekranda temsil edilemeyebilir. Düşük dönüşüm verimliliği, kötü reaktifler veya kötü kitaplık hazırlığı da dahil olmak üzere birçok sorundan kaynaklanabilir. Bu yöntem büyük ölçüde Ilk Hill ve ark.7tarafından ortaya konulan DMSO / LiAc dönüşüm yöntemine bağlıdır. Yeni DMSO, %50 PEG ve taze ringa spermi DNA'sının satın alınıp dönüşümler için hazırlanması ve reaktiflerin kalitesinin kontaminasyonunu veya bozulmasını azaltmak için sadece bu tahliller için kullanılması önerilir. DMSO son derece higroskopik ve kolayca atmosferden su emer. Bu nedenle, birçok bireysel kullanım aliquots yapma bir konteyner kapağı nın tekrarlanan açılması ve atmosfere maruz kalma önlemek için tavsiye edilir. Yüksek kaliteli ringa spermDNA 'sı -20 °C'de saklanabilir ve her dönüşüm için stoktan yeni bir hazırlık hazırlanması gerekirken, birkaç yıl boyunca kullanıma uygun kalır. Bir kez haşlanmış ve soğutulmuş, ringa sperm DNA yeniden kaynatılır veya yeniden olmamalıdır, bu yüzden sadece ne gerekli kaldırmak ve mevcut dönüşüm için gerekli olandan daha fazla yapmaktan kaçınmak en iyisidir. Detaylara dikkat büyük ölçüde maya dönüşüm verimliliğini artırmak ve bir bastırıcı belirleme şansını artırabilir.
Maya pYep13 vektörünün 3−13 farklı maya ORF'si taşıdığı düşünülürse, yanlış pozitif plazmidlerin sayısını azaltmak bastırıcıları tanımlamak için çok önemlidir. Maya, benzer vektörlerin birden fazla kopyasını alabilir ve barındırabilir, plazmid uyumsuzluğu ile ilişkili genel bilgelik geleneksel olarak E. coli'nin bir seferde aynı plazmid türüne (ORI) sahip olduğunu belirtirken, bu her zaman böyle olmasa da. Bu bastırıcı adayları belirlemek için çalışırken önemli bir sorun haline gelebilir. Bastırıcı maya klonları tespit edilirse, plazmidler ayıklanır ve yayılım ve sonraki sıralama için E. coli'ye dönüştürülür. Aday bastırıcı plazmid izole edilip E. coli'yedönüştürüldükten sonra, en az beş E. coli kolonisinin sıralama için seçilmesi şiddetle tavsiye edilir, çünkü tek tek klonların farklı plazmidler. E. coli bir seferde sadece bir plazmid yaymak gerekir, maya izolasyon birden fazla plazmid ler verimleri, plaka üzerinde farklı E. coli klonlar bir seferde bunlardan sadece birini taşımalıdır. Bu nedenle E. coli'de normal dönüşüm verimliliğine göre beş koloninin toplanması, klonların aynı veya farklı plazmidleri taşıyıp taşımadığını göstermelidir. Birden fazla plazmidler E. coliplazmidlerin dizilişi sonrasında ortaya çıkarsa, o zaman her biri toksik maya klon dönüştürülmelidir ve büyüme kusur kurtarma için değerlendirilmelidir. Ayrıca, sadece tek bir bastırıcı plazmid tespit edilse bile, plazmidin toksik klona tekrarlanması ve katılığı teşvik edilir.
Maya bastırıcı tayı çok büyük bir deneydir ve uygun zaman ve malzemeler buna göre planlanmalıdır. Bu protokol kesinlikle uyulması gereken birçok ayrıntı içerir ve bu tahlilleri yapan araştırmacının bir tahlilbaşlatmadan önce protokolü dikkatle okuması ve izlemesi önerilir. Bu farklı sıcaklıklarda yetiştirilmesi gereken bakteri ve maya hem de dahil olmak üzere çok partili bir işlemdir. Plazmidlerin mayadan izolasyonu bazen sert hücre duvarı nedeniyle zor olabilir ve DMSO kullanımı daha yüksek dönüşüm verimliliği elde edilmesine yardımcı olur.
Maya toksisitesi ve bastırıcı ekranın en büyük avantajlarından biri, bakteriyel efektör fiziksel olarak zaman herhangi bir takdir miktarı için konak substratlar için bağlamak gerekmez hedefli putatif yolu tespit etmektir. Çalışmaların sadece küçük bir avuç bu veya benzer bir teknik1-5kullanarak bildirdin. Ancak, konak yollarını tanımlayan teknikler ve bakteriyel efektör proteinlerin bağlayıcı ortakları için tarama için birçok teknik raporları vardır. Kramer ve ark. bakteriyel efektör proteinler tarafından hedeflenen yolları belirlemek için yeni bir sistem biyoloji yaklaşım bildirdi8. Bu teknik, Shigella efektörü Osp4'e duyarlı mutantları taramak için S. cerevisiae'nin haploid silme gerinim koleksiyonunu kullandı. Bu tekniği kullanarak, Osp4 MAPK sinyaldüzenlenmesi ve konak hücrelerde doğuştan gelen bağışıklık zayıflatılması ile bağlantılıydı. Dizi tabanlı, yüksek iş sahibi, otomatik maya-iki hibrid ekranlar artık hızla ev sahibiproteinlerinmilyonlarca karşı aynı anda birçok tarama tarafından putatif bakteriyel efektör bağlayıcı ortakları tespit edebilirsiniz 9 . Benzer şekilde, kütle spektrometresi ile birleştiğinde yüksek iş itimat immünopreplitler bakteriyel efektör proteinlerin tüm ailelerin putatif bağlayıcı ortakları belirlemek için kitle kullanılmaktadır10. Bu çalışmaların çoğu efektör protein karakterizasyonu takvimini hızlandırabilse de, nadiren fizyolojik süreçlerin hangi şekilde manipüle edildiği ve bu etkileşimlerin bütünsel sonucunun ne olduğu hakkında fikir verir. Bu nedenle, maya toksisitesi ve bastırıcı ekran gibi teknikler bu efektör proteinler tarafından manipüle edilen hücresel süreçleri aydınlatmak için gereklidir. Bir noktada, bakteriyel efektör proteinler tarafından hedeflenen bağlayıcı ortakları veya yolları belirleyen gözlemler, bu in vitro bulguların fizyolojik olarak ilgili senaryolarda doğru olup olmadığını belirlemek için hücresel enfeksiyon modellerine geri dönülmelidir. C. trachomatis gibi zorunlu hücre içi patojenlerin genetik manipülasyonu yakın zamana kadar önemli bir engel olmuştur11-15 ve etkileyici proteinleri incelemek için bölgeye özgü mutantların üretimi mümkün değildi. Ancak son birkaç yıl içinde, klamydial mutantlar üreten bir devrim, onları tamamlayan, ve hedef proteinlerin aşırı ifade. Bu son gelişmeler büyük ölçüde toksisite ve bastırıcı ekranlar kullanarak çalışmalardan elde edilen bilgilerin değerini artırmış, çünkü artık sonuçların geçerliliğini araştırmak için doğrudan mantardan enfeksiyona geçmek mümkün.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan.
Teşekkürler
Shelby Andersen, Abby McCullough ve Laurel Woods'a bu tekniklerle ilgili yardımları için teşekkür ederiz. Bu çalışma, Iowa Üniversitesi Mikrobiyoloji ve İmmünoloji Bölümü'nden Mary M. Weber'e başlangıç fonları tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agar | Fisher Scientific | BP2641500 | |
| Galactose | MilliporeSigma | G0750-1KG | |
| GeneJet Gel extraction kit | ThermoFisher Scientific | K0691 | |
| GeneJet PCR purification kit | ThermoFisher Scientific | K0701 | |
| GeneJet plasmid miniprep kit | Thermo | K0503 | |
| Glucose | MilliporeSigma | G8270-1KG | |
| Herring Sperm DNA | Promega | D1811 | |
| KpnI-HF | New England Biolabs | R3142S | |
| Lithium acetate dihydrate | MilliporeSigma | L6883-250G | |
| Peptone | Fisher Scientific | ||
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530 | |
| Poly(ethylene glycol) 3350 | MilliporeSigma | 1546547-1G | |
| pYep13 | ATCC | 37323 | |
| T4 DNA ligase | New England Biolabs | M0202S | |
| Tryptophan | MilliporeSigma | 470031-1G | |
| XhoI-HF | New England Biolabs | R0146S | |
| Yeast extract | Fisher Scientific | BP1422-500 | |
| Yeast miniprep kit | Zymo | D2001 | |
| Yeast nitrogen base without amino acids | MilliporeSigma | Y0626-250G | |
| Yeast Synthetic Drop-out Medium Supplements | MilliporeSigma | Y1501-20G | without uracil |
| Yeast Synthetic Drop-out Medium Supplements | MilliporeSigma | Y1771-20G | without uracil, leucine, tryptophan |
Referanslar
- Tan, Y., Luo, Z. Q. Legionella pneumophila SidD is a deAMPylase that modifies Rab1. Nature. 475 (7357), 506-509 (2011).
- Guo, Z., Stephenson, R., Qiu, J., Zheng, S., Luo, Z. A Legionella effector modulates host cytoskeletal structure by inhibiting actin polymerization. Microbes and Infection. 16 (3), 225-236 (2014).
- Tan, Y., Arnold, R. J., Luo, Z. -Q. Legionella pneumophila regulates the small GTPase Rab1 activity by reversible phosphorylcholination. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 21212-21217 (2011).
- Weber, M. M., et al. The type IV secreted effector protein CirA stimulates the GTPase activity of RhoA and is required for virulence in a mouse model of Coxiella burnetii infection. Infection and Immunity. 84, (2016).
- Faris, R., et al. Chlamydia trachomatis CT229 subverts Rab GTPase-dependent CCV trafficking pathways to promote chlamydial infection. Cell Reports. 26, 3380-3390 (2019).
- Mumberg, D., Müller, R., Funk, M. Yeast vectors for the controlled expression of heterologous proteins in different genetic backgrounds. Gene. 156, 119(1995).
- Hill, J., Donald, K. A. G., Griffiths, D. E. DMSO-enhanced whole cell yeast transformation. Nucleic Acids Research. 19 (20), 41070(1991).
- Kramer, R. W., et al. Yeast Functional Genomic Screens Lead to Identification of a Role for a Bacterial Effector in Innate Immunity Regulation. PLoS Pathogens. 3 (2), 21(2007).
- Häuser, R. T. S., Rajagopala, S. V., Uetz, P. Array-Based Yeast Two-Hybrid Screens: A Practical Guide. Two Hybrid Technologies: Methods and Protocols, Methods in Molecular Biology. , 21-38 (2012).
- Mirrashidi, K. M., et al. Global mapping of the inc-human interactome reveals that retromer restricts chlamydia infection. Cell Host and Microbe. 18 (1), 109-121 (2015).
- Wang, Y., et al. Development of a transformation system for chlamydia trachomatis: Restoration of glycogen biosynthesis by acquisition of a plasmid shuttle vector. PLoS Pathogens. 7 (9), 1002258(2011).
- Mueller, K. E., Wolf, K., Fields, K. A. Gene deletion by fluorescence-reported allelic exchange mutagenesis in Chlamydia trachomatis. mBio. 7 (1), 1-9 (2016).
- Johnson, C. M., Specific Fisher, D. J. Site-Specific, Insertional Inactivation of incA in Chlamydia trachomatis Using a Group II Intron. PLoS ONE. 8 (12), 83989(2013).
- Weber, M. M., et al. Absence of specific Chlamydia trachomatis inclusion membrane proteins triggers premature inclusion membrane lysis and host cell death. Cell Reports. 19 (7), 1406-1417 (2017).
- Weber, M. M., et al. A functional core of IncA is required for Chlamydia trachomatis inclusion fusion. Journal of Bacteriology. 198 (8), 1347-1355 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır