Method Article
זיהוי של מסלולים מארחים ממוקד על ידי חלבונים בקטריות אפקטור באמצעות רעילות שמרים מסכי מדכא
In This Article
Summary
פתוגנים חיידקיים מפרישות חלבונים לתוך המחשב המארח המטרה תהליכים ביולוגיים קריטיים. זיהוי מסלולים המארחים ממוקד על ידי חלבונים החיידק אפקטור הוא המפתח לטיפול פתוגנזה מולקולרית. כאן, שיטה באמצעות מדכא שמרים שונה ומסך רעילות כדי להבהיר מסלולים מארחים ממוקד על ידי חלבונים בקטריות אפקטור רעיל מתואר.
Abstract
חיידקים תאיים להפריש גורמים התקפה אלימה הנקרא אפקטור חלבונים לתוך ציטוסול מארח כי לפעול לחתור מארחים חלבונים ו/או מסלולים ביולוגיים הקשורים שלהם לטובת החיידק. זיהוי של חלבונים בקטריאלי החיידק אפקטור הפכה יותר לניהול בשל ההתקדמות ברצף הגנום החיידקי ואת הופעתו של אלגוריתמים המאפשרים זיהוי סיליקו של גנים קידוד הפרשת מועמדים ו/או eukaryotic כמו תחומים. עם זאת, זיהוי של גורמים והתקפה אלימה אלה הוא רק צעד התחלתי. באופן טבעי, המטרה היא לקבוע את התפקוד המולקולרי של החלבונים של אפקטור ולהבהיר כיצד הם מתקשרים עם המארח. בשנים האחרונות, טכניקות כמו מסך שני שמרים היברידית בקנה מידה גדול immunoprecipitations בשילוב עם ספקטרומטר המסה סייעו בזיהוי של אינטראקציות חלבונים חלבון. למרות שזיהוי של שותף כריכה מארח הוא הצעד הראשון המכריע לקראת הבעת המצאת הפונקציה המולקולרית של חלבון אפקטור חיידקי, לפעמים חלבון מארח נמצא יש פונקציות ביולוגיות מרובות (למשל, actin, clathrin טובולין), או חלבון חיידקי לא יכול פיזית לאגד חלבונים מארחים, לשלול את החוקר של מידע חיוני על מסלול מארח מדויק להיות מניפולציות. הרעלת שמרים שונה מסך בשילוב עם מסך משתיק קול הותאם כדי לזהות מסלולים מארחים המושפעים על ידי חלבונים החיידק אפקטור. מסך רעילות מסתמך על השפעה רעילה של שמרים הנגרמת על ידי חלבון אפקטור מפריעה המסלולים הביולוגיים המארחים, אשר לעתים קרובות מתבטא כפגם גדילה. ביטוי של הספרייה גנומית שמרים משמש כדי לזהות גורמים מארחים לדכא את רעילות של חלבון אפקטור חיידקי, ובכך לזהות חלבונים במסלול כי החלבון מטרות מטרה. פרוטוקול זה כולל הוראות מפורטות עבור מסכי רעילות ומדכא. ניתן לבצע טכניקות אלה בכל מעבדה המסוגלת לשכפול מולקולרי וטיפוח של שמרים ומסלול קולי.
Introduction
הדו ח הראשון של ההליכים הדומים לאלה שהוצגו כאן אפיינו את הלגיונרים האלה מסוג העירוי הרביעי, שהוא deAMPylase שמשנה Rab11. טכניקות דומות שימשו לאפיון של מספר L. משאבה מנועי 1,2,3. השיטה הותאמה כדי לאפיין את הסוג Coxiella בורנתיבי הרביעיחלבון,ולאחרונה את השירות של טכניקה זו הורחבה לאפיון של כלמידיה trachomatis ממברנה חלבונים5 .
פרוטוקול זה ניתן לפרוץ לשני חלקים עיקריים: 1) את המסך רעילות שמרים, שבה חלבון החומר החיידקי של עניין מתבטא שמרים שיבוטים מוקרן לפנוטיפ רעיל כפי שמעידים על ידי פגם גדילה, ו 2) מסך מדכא שמרים , שבו הפנוטיפ הרעיל מדוכאים על ידי ביטוי של ספרייה גנומית שמרים במתח הרעיל. כך, את המסך רעילות היא מסך עבור פנוטיפים רעילים המניפסט כמו ליקויים בגדילה כאשר החיידק החיידקי של העניין הוא ביטוי יתר. שיבוטים רעילים, השתנה בהצלחה עם וביטוי האפקטור חיידקי, נבחרו ונשמר לשלב הבא. הצעד העיקרי השני כרוך יתר על הביטוי בספרייה גנומית חלקית שמרים מתעכל בשכפול שמרים רעילים. פלמידים ממציא את הספרייה גנומית שמרים הציע לשימוש בפרוטוקול זה לשאת 5-20 kb מוסיף, בדרך כלל מתאים 3-13 שמרים לקרוא מסגרות לקריאה (ORF) של גודל הגן הממוצע של ~ 1.5 kb על פני כל פלמידים, המייצגים גנום שמרים כולו מכוסה כ-10x. חלק זה של השיטת נקרא מסך מדכא, כמו המטרה היא לדכא את רעילות של חלבון אפקטור חיידקי. הפלמיונים הפוטנציאליים של מדכא מבודדים משמרים, ברצף ומזוהים הדיכוי ORFs. הרציונל הנמצא בבסיס מסך מדכא הוא כי חלבון האפקטור נקשר, אינטראקציה עם, ו/או להתמקד ברכיבים של מסלול מארח זה מטרות, וכי מתן אלה חלבונים מארחים בחזרה עודף יכול להציל את ההשפעה הרעילה על השביל ולכן, פגם הגדילה. כך, מזוהה ORFs כי לדכא רעילות לעתים קרובות מייצגים משתתפים רבים של מסלול מארח. ניסויים אורתוגונאליות מבוצעים לאחר מכן כדי לוודא כי האפקטור חיידקי אכן אינטראקציה עם השביל מעורבים. הדבר הכרחי במיוחד אם התגלתה שותפה מחייבת כגון clathrin או אקטין, משום שחלבונים אלה מעורבים בהמון תהליכים מארחים. ניסויים נוספים יכולים להבהיר את התפקוד הפיזיולוגי של חלבון האפקטור במהלך הזיהום. רעילות מסכי מדכא הם גם כלים רבי עוצמה לפענוח התפקוד הפיזיולוגי של חלבונים אפקטור חיידקי כי לא לאגד פיזית מארח חלבונים עם מספיק כדי לזהות על ידי immunoprecipitation או כי אינטראקציה עם ארח באינטראקציות פגע וברח אנזימטיות שאינן מזוהות על-ידי מסך היברידי משני שמרים.
למרות מסך מדכא יכול להיות שיטה רבת עוצמה כדי לחשוף אינטראקציות פיזיולוגיות פוטנציאליות בין חלבונים אפקטור חיידקים ומסלולים מארחים, חלבון אפקטור חיידקי חייב לגרום לפגם גדילה שמרים, אחרת באמצעות זה ב מסך משתיק קול יהיה שימוש קטן. יתר על כן, הפנוטיפ הרעיל חייב לגרום לפחות 2-3 יומן רישום10 הגרעון בצמיחה או יהיה קשה לזהות דכאי. אם המעבדה מוגדרת לתרבות התאים, הקרנת חלבונים לרעילות בקווי תאים משותפים כגון הלה יכולה לעתים קרובות להעניק תובנה לגבי המאמץ להמשיך במסך הרעילות לשמרים. ביטוי חוץ רחמי של חלבון אפקטור בתאי הלה לפעמים גורמת לרעילות כי מתאים מאוד רעילות בזן שמרים המשמש מסכים אלה4. סימני ההיכר של הלחץ בתאי הלה כוללים אובדן סיבי לחץ, ניתוק תאים מהצלחת, ועיבוי גרעיני המציין אפופטוזיס. כל אינדיקציה חזותית של מתח בתאי הלה להפוך את החלבון של עניין מועמד טוב לגרימת פגם גדילה בשמרים, אשר לשכפל הרבה יותר במהירות, ולכן מגיבים יותר להפרעות חיוניות של מסלולים חיוניים.
יצוין כי מסך מדכא לא תמיד לזהות שותפים איגוד מארח כמו דכאי, אבל זה עדיין יכול לסבך רכיבים קריטיים של מסלול מארח (s) ממוקדות, מניב השקפה הוליסטית של התהליכים הביולוגיים נחטף על ידי ה חלבון אפקטור חיידקי. על פני השטח, זה נראה מנוגד לאינטואיציה, משום שמתן שותף מחייב בחלבון האפקטור המיותר צפוי להציל את הפגם בגדילה. במאמצים לזהות מסלולים המיועדים על ידי C. trachomatis אפקטור חלבון CT229 (cpos), אשר נקשר לפחות 10 שונים רב GTPases במהלך זיהום5, אף אחד מהשותפים מחייב ראב לדכא את רעילות של CT229. עם זאת, מדכאי רבים המעורבים בסחר בסמים (CCV) מצופים, אשר הובילו לעבודה נוספת הממחיש כי CT229 במפורש פוגעת בסחר בנשק CCV. באופן דומה, בעת חקירת ה -C. burנתיבי אפקטור חלבון Cbu0041 (cira) כמה Rho GTPases כי הצילה את הפגם בגידול שמרים זוהו, ומאוחר יותר נמצא כי cira פונקציות כמו Gtpases הפעלת חלבון (גאפ) עבור rhoa4.
השימושיות של מסך מדכא שמרים להסבר מסלולים מארחים ממוקד על ידי חלבונים בקטריות אפקטור לא יכול להיות יתר על המידה, וחוקרים אחרים מנסה לאפיין חלבונים תאיים אפקטור חיידקים יכול להפיק תועלת רבה מ טכניקות אלה. אלה מספרים הם בעלי ערך אם immunoprecipitations ו/או שמרים-שני מסכי היברידית לא הצליחו למצוא שותף מחייב והוא יכול להבהיר איזה מסלולים מיועדים על ידי חלבון אפקטור חיידקי. כאן, פרוטוקולים מפורטים עבור מסכי רעילות ומדכא כדי לזהות מסלולים ביולוגיים מארחים ממוקד על ידי חלבונים בקטריאלי תאיים אפקטור מסופקים, כמו גם כמה מכשולים נפוצים מנוסים בעת שימוש אלה בחני וה פתרונות תואמים.
Protocol
1. הכנת מדיה וריאגנטים
הערה: לוחיות הרישוי צריכות להיות מוכנות לפני היום, וטובות לחודש אחד. מדיה וריאגנטים ניתן לעשות בכל שלב וטוב לחודש 1.
- להכין 1 L של תמיסת גלוקוז (10% w/v) על ידי המסת 100 g של D-(+)-גלוקוז ב 800 מ ל של מים מזוקקים בגביע 1, 000 mL. כוונן את אמצעי האחסון ל-1 ל' עם מים מזוקקים. סנן דרך מסנן סטרילי 0.2 יקרומטר לתוך בקבוק אחסון מדיה מעוקר 1 L.
- הכינו 1 ל' לפתרון הגלקטוז (10% w/v) על ידי המסת 100 גרם של D-(+)-גלקטוז ב 800 מ ל של מים מזוקקים בגביע L 1. כוונן את עוצמת הקול ל-1 mL באמצעות מים מזוקקים וסנן באמצעות מסנן סטרילי 0.2 יקרומטר לתוך בקבוק אחסון מדיה סטרילי 1,000 mL.
- להכין 1 L של תמצית שמרים peptone דקסטרוז (YPD) אגר על ידי המסת 10 גרם של תמצית שמרים, 20 גרם של peptone, 20 גרם של גלוקוז, ו 20 גרם של אגר ב 1,000 mL של מים מזוקקים. אוטוקלב עבור 20 דקות וקריר באמבט מים 56 ° c עד לקירור. יוצקים לתוך 100 מ"מ לוחות באמצעות ~ 20 מ ל של מדיה לצלחת.
- הכן 1 L של ציר YPD על ידי המסת 10 גרם של תמצית שמרים, 20 גרם של peptone, ו 20 גרם של גלוקוז ב 1,000 מ ל של מים מזוקקים. אוטוקלב עבור 20 דקות.
- להכין את הנושרת סינתטי (SD) אורציל (אורה-) גלוקוז אגר. עבור 1 L, לפזר 6.7 g של בסיס חנקן שמרים ללא חומצות אמינו, 1.9 g של תוספת הנושרת ללא uracil, ו 15 גרם של אגר ב 800 mL של מים מזוקקים. אוטוקלב במשך 20 דקות וקריר באמבט מים ב56 ° c עד הטמפרטורה היא ~ 50-60 ° c. באמצעות הפיאוולוגית 50 mL או צילינדר לסיים סטרילי, להוסיף 200 mL של פתרון גלוקוז הכין בשלב 1.1. מערבבים היטב על ידי מתערבל בעדינות או מקום על צלחת מהומה. יוצקים לתוך 100 מ"מ לוחות באמצעות ~ 20 מ ל של מדיה לצלחת.
- הכינו את הנושרת הסינתטית (SD) אורציל (אורה-) גלקטוז אגר. עבור 1 L, לפזר 6.7 g של בסיס חנקן שמרים ללא חומצות אמינו, 1.9 g של תוספת הנושרת ללא uracil, ו 15 גרם של אגר ב 800 mL של מים מזוקקים. אוטוקלב במשך 20 דקות וקריר באמבט מים ב56 ° c עד הטמפרטורה היא ~ 50-60 ° c. שימוש בפיפטה מ50 mL או בצילינדר הדרגתי סטרילי, מוסיפים 200 מ ל של פתרון הגלקטוז שהוכן בשלב 1.2. מערבבים היטב על ידי מתערבל בעדינות או מקום על צלחת מהומה. יוצקים לתוך 100 מ"מ לוחות באמצעות ~ 20 מ ל של מדיה לצלחת.
- הכנת הנושרת הסינתטית (SD) אורציל (אורה-) ציר גלוקוז. עבור 1 L, לפזר 6.7 g של בסיס חנקן שמרים ללא חומצות אמינו ו 1.9 g של תוספת הנושרת ללא אורציל 800 mL של מים מזוקקים. אוטוקלב במשך 20 דקות וקריר באמבט מים ב56 ° c עד הטמפרטורה היא ~ 50-60 ° c. באמצעות הפיאוולוגית 50 mL או צילינדר לסיים סטרילי, להוסיף 200 מ ל של פתרון גלוקוז הכין בשלב 1.1.
- הכינו את הנושרת הסינתטית (SD) אורציל (יורה-) לאוצין (Leu-) גלוקוז אגר. עבור 1 L, לפזר 6.7 g של בסיס חנקן שמרים ללא חומצות אמינו; 1.9 גרם של תוספת הנושרת ללא uracil, leucine, ו טריפטופן; 15 גר' אגר; ו 0.076 g של טריפטופן ב 800 מ ל של מים מזוקקים. אוטוקלב במשך 20 דקות וקריר באמבט מים ב56 ° c עד הטמפרטורה היא ~ 50-60 ° c. באמצעות הפיאוולוגית 50 mL או צילינדר לסיים סטרילי, להוסיף 200 mL של פתרון גלוקוז הכין בשלב 1.1. יוצקים לתוך 100 מ"מ לוחות באמצעות ~ 20 מ ל של מדיה לצלחת.
- הכנת נושרת סינתטית (SD) אורציל (אורה-) לאוצין (Leu-) גלקטוז אגר. עבור 1 L, לפזר 6.7 גרם של בסיס חנקן שמרים ללא חומצות אמינו; 1.9 גרם של תוספת הנושרת ללא uracil, leucine, ו טריפטופן; 15 גר' אגר; ו 0.076 g של טריפטופן ב 800 מ ל של מים מזוקקים. אוטוקלב במשך 20 דקות וקריר באמבט מים ב56 ° c עד הטמפרטורה היא ~ 50-60 ° c. שימוש בפיפטה מ50 mL או בצילינדר הדרגתי סטרילי, מוסיפים 200 מ ל של פתרון הגלקטוז שהוכן בשלב 1.2. מערבבים היטב על ידי מתערבל בעדינות או הצבת על צלחת מהומה. יוצקים לתוך 100 מ"מ לוחות באמצעות ~ 20 מ ל של מדיה לצלחת.
- הכנת נושרת סינתטית (SD) אורציל (אורה-) לאוצין (Leu-) מרק גלוקוז. עבור 1 L, לפזר 6.7 גרם של בסיס חנקן שמרים ללא חומצות אמינו; 1.9 גרם של תוספת של הנושרת ללא uracil, לאוצין, טריפטופן; ו 0.076 g של טריפטופן ב 800 מ ל של מים מזוקקים. אוטוקלב במשך 20 דקות וקריר באמבט מים של 56 עד 60 ° c עד שטמפרטורת הטמפרטורה היא ~ 50 ° c. באמצעות הפיאוולוגית 50 mL או צילינדר לסיים סטרילי, להוסיף 200 mL של פתרון גלוקוז הכין בשלב 1.1.
- להכין פוליאתילן גליקול (יתד) פתרון. הוסף 50% w/v של פוליאתילן גליקול 3350 מים מזוקקים. . לחטא על ידי אוטוקלינג
- להכין ליתיום אצטט 1 M (LiAc) על ידי המסת 10.2 g של אצטט ליתיום מייבשים ב 200 mL של מים מזוקקים. . לחטא על ידי אוטוקלינג
- . הכן דנ א של זרע הרינג לדלל 10 mg/mL זרע הרינג DNA ל 2 מ"ג/mL באמצעות מים מזוקקים. חום ב 100 ° צ' עבור 5 דקות ומיד מקום על הקרח עבור 5 דקות.
2. שיבוט הגן של עניין לתוך הרעלה רעילות שמרים pYesNTA-קאן
הערה: כיום, יש מגוון וקטורים רעילות שמרים זמינים הן מסחרית ומבחינה אקדמית. מסך מדכא שמרים ניתן להשתמש בשילוב עם רבים של וקטורים אלה בתנאי הפלבאמצע לבטא את החלבון אפקטור של הריבית משתמשת בחירת נושרת אחר מאשר אורציל וסמן אנטיביוטי אחר מאשר BlaR. עבודה זו השתמשה שונה pyesnta וקטור4,5 הכולל קלטת ההתנגדות kanamycin להקרנה קלה יותר עבור דכאי פוטנציאליים. מערכת השיבוט חייבת לאפשר לחלבון האפקטור להיות במסגרת עם היזם גל והתגית שלו. הכלמידיה הCT229 בחלבון קרום הממברנה שימש כהוכחה לעיקרון עבור מספר זה.
- השתמש ב-PCR כדי להגביר את הCT229 מ -C. trachomatis דנ א גנומית בעקבות הוראות היצרן באמצעות CT229 + 1 kpn F (ccggtacgtgccatpacatppppacpppppppppppppppppppppppp השתמש בתנאי ה-PCR הבאים: (1) 98 ° צ' עבור 30 ס מ; (2) 98 ° צ' עבור 10 ס מ, 55 ° צ' עבור 30 s, 72 ° צ' עבור 2 דקות; (3) חזור על שלב 2 עבור סכום כולל של 25x; (4) 72 ° צ' במשך 10 דקות; ו-(5) 4 ° c להחזיק.
- ניתוח 5 μL של מוצר ה-PCR ב-1% צמח ג'ל (איור 1).
- לטהר את הנותרים 45 μL של ה-DNA באמצעות ערכת טיהור PCR בעקבות הוראות היצרן.
- לעכל את 50 μL של הוספת PCR מטוהרים ו pYesNTA-Kan (איור 2) עבור 1 h ב 37 ° c באמבט מים באמצעות kpni-hf ו-XHOI-hf.
הערה: עבור pYesNTA-Kan, לעכל 5 μg של פלבאמצע באמצעות 5 μL של KpnI-HF, 5 μl של XhoI-HF, ו 6 μL של מאגר בנפח כולל של 60 μL. עבור התוספת, לעכל את כולו 50 μL של מוצר PCR מטוהרים באמצעות 2 μL של KpnI-HF, 2 μL של XhoI-HF, ו-6 μL של מאגר. - הפעל את התקציר כולו על 1% ג'ל. לבצע טיהור של הפלסמיד מתעכל באמצעות ערכת החילוץ ג'ל לאחר הוראות היצרן.
- לטהר את הוספת ה-PCR מתעכל באמצעות ערכת טיהור ה-PCR בעקבות הוראות היצרן.
- שיבוט להכניס pyesnta-kan באמצעות 2 μl של pyesnta-kan (שלב 2.5), 2 μl של מאגר ליגאז DNA, 1 μl של T4 ליגאז, ו 15 μl של הוספה (שלב 2.6). . בטמפרטורת החדר במשך 1 שעות
- להוסיף את תגובת השיבוט כולו כדי 50 μL של E. coli תאים מוכשרים ולבצע את תגובת טרנספורמציה.
- צלחת תגובת שינוי כולו על צלחת LB המכיל 100 μg/mL של carbenicillin.
- האיחסן 10 מ ל של LB המכיל 100 μg/mL של carbenicillin עם שלוש מושבות נפרדות. דגירה לילה ב 37 ° c עם טלטול ב 150 סל ד.
- בודד את הפלסטלינה באמצעות ערכת המינימום של הציוד לאחר הוראות היצרן.
- רצף את הפלמידים המבודדים בעזרת הצבעי היסוד הספציפיים לגנים (שלב 2.1).
3. מבחן חלבון העניין רעילות בשמרים
- מW303 על YPD אגר (שלב 1.3) כדי להשיג מושבות מבודדות. מודטה ב -30 ° c עבור 24 שעות.
- איחסן 10 מ ל של ציר YPD (שלב 1.4) עם מושבה אחת מהצלחת אגר (שלב 3.1). מודטה ב 30 ° c עם טלטול ב 150 rpm לילה.
- הוסף 0.5 mL של התרבות לילה ל 10 מ ל של ציר YPD (שלב 1.4) ו-דגירה ב 30 ° c עם טלטול ב 150 rpm עבור 4 h.
- גלולה 10 מ ל של התרבות ב 3,000 x g עבור 10 דקות ב 4 ° c.
- להשעות את הגלולה ב 1 מ ל של מים סטרילי, להעביר לצינור מיקרוצנטריפוגה, ואת הגלולה ב 3,000 x g עבור 1 דקות בטמפרטורת החדר.
- השהה מחדש את הגלולה ב 1 מ ל של 1 מילימטר ליתיום אצטט (LiAc) ואת הגלולה ב 3,000 x g עבור 1 דקות בטמפרטורת החדר.
- . חזור על השטיפה השנייה
- . הסר את הכביסה השהה מחדש את הגלולה ב 2.4 mL של 50% יתד 3350. הוסף 360 μL של 1M LiAc, 500 μl של 2 מ"ג/mL של DNA זרע הרינג, ו 400 μL של מים סטריליים.
הערה: הדבר מספיק ל-20 שינויי צורה. - הוסף 180 μL של ערבוב השינוי משלב 3.3.5 לצינור מיקרוצנטריפוגה המכיל 5 μL של pYesNTA-Kan-קן CT229 פלמיד DNA (100-500 ng) משלב 2.12.
- דגירה באמבט מים 30 ° c עבור 30 דקות.
- דגירה באמבט מים ב 42 ° c עבור 30 דקות.
- גלולה ב 3,000 x g עבור 1 דקות בטמפרטורת החדר.
- הסירו את ערבוב הטרנספורמציה עם הפיפטה. השהה מחדש את הגלולה ב-100 μL של מים סטריליים. צלחת הטרנספורמציה על SD Ura- אגר עם גלוקוז (שלב 1.5).
- לוחיות הדגירה ב 30 ° c עבור 48 h.
- איחסן 5 מ ל של SD Ura- ציר המכיל גלוקוז (שלב 1.7) עם מושבה אחת מן הצלחת. דגירה הלילה ב 30 ° צ' עם טלטול ב 150 סל ד. כלול שמרים השתנה עם וקטור לבד כפקד שלילי.
- להוסיף 180 μL של מים סטריליים ל 5 בארות של 96 צלחת הבאר (A2-A6).
- מערבולת התרבות הלילה לערבב.
- הוסף 180 μL של שמרים לבאר הראשונה (A1). סרילית לדלל 1:10 (6 דגימות בסך הכל כולל ללא מדולל).
- שימוש בפיפטה רב-ערוצית, ספוט 5 μL של כל דילול ב- SD Ura-גלוקוז (שלב 1.5) ואורה- גלקטוז (שלב 1.6) לוחות אגר. מודטה ב 30 ° c עבור 48 h.
- העריכו את הרעילות על ידי השוואת התפתחותם של השמרים המבטאים את חלבון האפקטור של הריבית הגדלה על המדיה המכילה את גלקטוז לצמיחת שמרים המבטאים את הווקטור בלבד.
- אשר את הביטוי של חלבון היתוך שלו על ידי הכתמים המערביים.
4. שינוי צורה של שמרים רעילים עם הספרייה גנומית שמרים
- איחסן 100 mL של ה-SD Ura- ציר גלוקוז (שלב 1.7) באמצעות 1 mL של המניה משלב 3.4. המשך 16-עד 24 שעות ב 30 ° צ' עם טלטול ב 150 סל ד. מקום 900 mL של ה- SD Ura-ציר גלוקוז ב 30 ° c ללילה כדי לחמם את התקשורת.
- להוסיף את כל 100 mL של התרבות לילה לבקבוקון prewarmed 1. המשך 4 עד 5 שעות ב 30 ° צ' עם טלטול ב 150 סל ד.
- מצנע את התרבות ב-6,000 x g במשך 10 דקות ב -4 ° c.
- . מחק את הסופרנטאנט השהה את הגלולה ב-250 מ ל של מים סטריליים. מצנע את התרבות ב-6,000 x g עבור 5 דקות ב -4 ° c.
- . מחק את הסופרנטאנט השהה מחדש את הגלולה ב 250 מ ל של 1 מ"מ LiAc. מצנע את התרבות ב-6,000 x g עבור 5 דקות ב -4 ° c.
- הסר LiAc והשהה מחדש את הגלולה ב 9.6 mL של 50% יתד 3350. הוסף 1.44 mL של 1M LiAc, 2 מ ל 2 מ"ג/mL זרע הרינג DNA, 50 μg של הספרייה הגנומית pYep13 (ATCC 37323). כוונן את עוצמת הקול ל-15 מ"ל עם מים סטריליים. מערבבים בעדינות על-ידי היפוך.
- דגירה באמבט מים 30 ° c עבור 30 דקות.
- הוסף 750 μL של diמתיל סולפוקסיד (DMSO) כדי לשפר את יעילות השינוי. דגירה באמבט מים ב 42 ° c עבור 30 דקות. מערבבים באמצעות היפוך עדין כל 10 דקות.
- גלולה השמרים ב 3,000 x g עבור 5 דקות בטמפרטורת החדר.
- השמט את הסופרנטאנט והשהה מחדש את הגלולה ב -10 מ ל של מים סטריליים. גלולה ב 3,000 x g עבור 5 דקות בטמפרטורת החדר.
- השהה את הגלולה ב -8 מ ל. של מים סטריליים
- כדי לקבוע את יעילות השינוי, לדלל 1:10 ו צלחת 100 μL של כל דילול ב-SD Ura- Leu- גלוקוז אגר (שלב 1.8).
- צלחת 200 μL של המדגם על SD Ura- Leu- גלקטוז אגר (שלב 1.9) צלחות. השימוש 50 צלחות בסך הכל.
- מודטה ב -30 ° c עבור 48 עד 96 שעות או עד שמושבות מופיעות.
הערה: המושבות מופיעות בדרך כלל על לוחיות הגלוקוז ב-48-72 שעות ובצלחות גלז אגר ב-72 עד 96.
- תיקון מושבות (מציל פוטנציאליים) על SD Ura- Leu- גלקטוז אגר (שלב 1.9) כדי להרחיב ולעשות מניות. מודטה ב -30 מעלות צלזיוס עבור 24 שעות.
- איחסן 5 מ ל של SD Ura- Leu- ציר גלוקוז (שלב 1.10) באמצעות החלק של התיקון. דגירה הלילה ב 26 ° צ' עם טלטול ב 150 סל ד.
- להוסיף 180 μL של מים סטרילי ל 5 בארות של 96 צלחת הבאר (A2-A6).
- מערבולת התרבות הלילה לערבב.
- הוסף 180 μL של שמרים לבאר הראשונה (A1). סרילית לדלל 1:10 (6 דגימות בסך הכל כולל ללא מדולל).
- באמצעות פיפטה רב-ערוצי, ספוט 5 μL של כל דילול ב-SD Ura- גלוקוז ו-sd ura- גלז אגר צלחות. כלול אפקטור רעיל לבד כפקד.
- מודטה ב 30 ° c עבור 48 h.
- להשוות את הצמיחה של שמרים לבטא את האפקטור רעיל לבד שמרים המכילים את דכאי פוטנציאליים. רק להמשיך עם דכאי פוטנציאליים כי יש רעילות מופחתת לעומת שמרים לבטא את האפקטור לבד.
5. זיהוי ואישור דכאי
- האיחסן 5 מ ל של SD Ura- Leu- ציר גלוקוז (שלב 1.10) עם 100 μl של שמרים משלב 4.4 ו-דגירה לילה ב 30 ° צ' עם טלטול ב 150 rpm.
- גלולה השמרים ב 3,000 x g עבור 2 דקות בטמפרטורת החדר. מחק בעדינות את הסופרנטנט בעזרת פיפטה.
- בודד את הפלסמיד עם ערכת המינימנה של שמרים פלסטלינה לאחר הוראות היצרן.
- הפוך את הפלביניים המבודד לתוך התאים E. coli מוסמך צלחת הטרנספורמציה כולה על LB אגר עם 100 μg/mL של carbenicillin. מודטה ב 37 ° c עבור 24 שעות.
- האיחסן 10 מ ל של מרק LB המכיל 100 μg/mL של carbenicillin, עם שלוש מושבות מן הצלחת ו דגירה ב 37 ° c לילה עם טלטול ב 150 rpm.
- התרבויות גלולה ב 3,000 x g עבור 10 דקות בטמפרטורת החדר. בודד פלסמיד באמצעות ערכת miniprep לאחר הוראות היצרן.
- שינוי מחדש של שמרים רעילים עם פלמידים מבודדים משלב 5.3.1 בעקבות השלבים בחלק 3 של הפרוטוקול.
- איחסן 5 מ ל של SD Ura- Leu- ציר גלוקוז עם מושבה מלוחית השינוי. דגירה הלילה ב 30 ° צ' עם טלטול ב 150 סל ד.
- ספוט באורה- מLeu- גלוקוז וגלקטוז אגר לאישור דיכוי הרעילות.
- רצף באמצעות pYep13 F (ACTACGCGA) ו-pYep13 R (TGATGCCGGCGC) התחל לזהות ORFs שמרים.
תוצאות
לפני מסך מדכא שמרים בפועל ניתן לבצע, חלבון הריבית של אפקטור העניין חייב להיבדק עבור רעילות בשמרים. זה מושגת על ידי ביטוי חלבון העניין של שמרים תחת שליטתה של מקדם גלקטוז-inducible. הצמיחה על גלוקוז (תנאים שאינם מחייבים) יש להשוות תחילה כדי להבטיח רעילות היא במיוחד בשל ביטוי של חלבון הריבית והוא לא פגם כללי. כפי שמוצג באיור 3, רעילות מתבטאת כמושבות קטנות יותר ו/או צמיחה מופחתת. ירידה של 2-3 הרישום בצמיחה שמרים הוא אידיאלי עבור מסכי מדכא שמרים.
בדומה למוצג באיור 4, ניתן לבצע את מספר הרעילות ומשתיק הקול בשמונה שלבים באמצעות השיטות המתוארות בסעיף הפרוטוקולים. הגן של עניין משוכפל לתוך וקטור מתאים1, ואת המבנים המתקבלים הופכים שמרים להעריך רעילות. מחקר זה בשימוש CT229 כמו גן הריבית pYesNTA-Kan כמו וקטור. בנוסף, הביטוי של חלבון היתוך שלו-מתויג אושרה על ידי בלוק המערבי. באופן אידיאלי, יש להקפיד על הפחתת כניסה של שמרים בעלי מדיה המכילה הגדלת השמרים בגלקטוז. אם חלבון העניין הוא רעיל שמרים (איור 3 ואיור 4), מסך מדכא יכול להתבצע על ידי שינוי המתח הרעיל עם הספריה גנומית שמרים pYep13. Transformants מצופים על גלוקוז אגר כדי לקבוע את יעילות ההמרה ואת גלקטוז אגר כדי לזהות דכאי פוטנציאליים. באמצעות פרוטוקול זה, יעילות השינוי המינימלי של 5 x 105 הושגה עם סך של 10-250 מושבות על גלקטוז אגר. תיקון מושבות אלה על SD Ura- Leu- גלקטוז אגר (איור 4) בעזרת זיהוי של דכאי אמיתי, כי תוצאות חיוביות שווא רבות לא יגדל כאשר תוקנו. כאן, 50 מושבות היו תוקנו ו שמונה שיבוטים שדיכא רעילות אפקטור הושגו (איור 4). האיתור דכאי על SD Ura- Leu- גלקטוז אגר נעשה כדי לאשר דיכוי הרעילות. כפי שמוצג באיור 4, pSup1 ו-psup 2 דיכאו את הרעילות של חלבון האפקטור, בעוד pSup3 לא. לכן, pSup3 הושלך. פלמידים מבודדים לאחר מכן מדכאי והפכו לאי קולי כדי להגדיל את התפוקה הפלסרית. לאחר מכן ניתן להפוך את הפלמיד לתוך השמרים הרעילים כדי לאשר כי הפלסטיות המבודד בהחלט מדכא רעילות של אפקטור (איור 4). בעוד רוב הפלמידים מבודדים צריך להציל רעילות, מדי פעם באמצע, כי לא לדכא רעילות כאשר מחדש לתוך הנבג שמרים רעילים מושגת. הפלמידים האלה נמחקים, ורק אלה הדיכוי רעילות לאחר השינוי החוזר צריכים להיות ברצף.
פלסטלינה מבודדת יכיל מספר שמרים ORFs4. כדי לזהות מהו משתיק הקול האמיתי, כל orf יכול להיות משוכפל בנפרד ומבוטא בנבג שמרים רעילים כפי שמתואר בעבר1,2,3,4.

איור 1: הגברה הPCR של גן היעד. CT229 מ כלמידיה trachomatis serovar היה ה-PCR הוגדל מ-DNA גנומית. מוצרי ה-PCR נותחו על 1% ג'ל מוכתם עם אתידיום ברומיד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
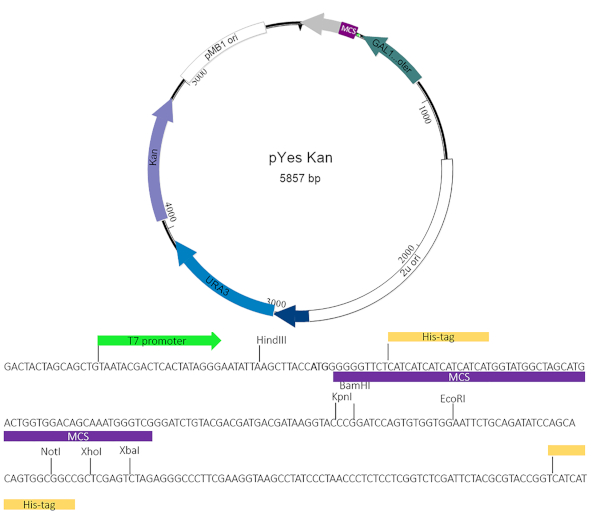
איור 2: מפת pYesNTA-קאן פלמיד. הגן היעד של עניין שוכפל באתר שיבוט מרובים (mcs) של pyesnta-Kan. קאנאמיצין שימש לבחירה ב E. coli ו אורציל הפיל שימש לבחירה ב- S. cerevisiae. ביטוי של חלבון היתוך שלו-מתויג אומת על ידי בלוק המערבי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: שמרים מייצגים תוצאות רעילות. החלבונים של אפקטור הריבית שוכללו לתוך pYesNTA-קאן. רצף-פלמידים מאומת הפכו ל- S. cerevisiae ס ו transformants היו מדולל בצורה סדרתית ונצפו על מאורה- גלוקוז ו גלקטוז אגר כדי להעריך רעילות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: סקירה של מסך מדכא שמרים. הגן היעד של עניין שוכפל לתוך pYesNTA-Kan ו פלמידים הפכו ל- S. cerevisiae ס. הTransformants באופן מדולל ומאותרת באורה- גלוקוז ובגלקטוז אגר כדי להעריך את הרעילות. כדי לזהות את השביל ממוקד על ידי חלבון אפקטור רעיל, זן שמרים המבטא חלבון רעיל השתנה עם הספרייה גנומית שמרים. מושבות שתוקנו על הקורה- Leu- גלקטוז אגר והבחינו בהערכת הרעילות. פלמידים היו מבודדים מאלה הדיכוי את הרעילות של חלבון האפקטור. פלמידים הפכו מחדש ללחץ שמרים רעילים כדי לוודא כי הפלביניים המבודד הוא מדכא. פלמידים מדכאי היו ברצף כדי לזהות את מתנת השמרים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר הליכים צעד אחר צעד לזיהוי מסלולים ביולוגיים מארחים ממוקד על ידי חלבונים החיידק אפקטור באמצעות הרעלת שמרים שונה מסך מדכא. זן שמרים השתמשו, ס cerevisiae ס W303, הוא auxotrophic עבור אורציל ו leucine. Uracil הגביע של הנבג משמש כדי לבחור שמרים נושאת את החלבון של עניין על pYesNTA-Kan וקטור בעוד לאוסין משמש הגביע משמשת כדי לבחור עבור שמרים הספריה גנומית וקטור pYep13. הספריה הגנומית של הספרייה שמרים לשאת 3 על 13 ORFs, כך כל ORFS צריך להיות משוכפל בנפרד לתוך וקטור p415-ד6 או וקטור דומה ו מחדש לתוך שמרים רעילים כדי לזהות איזה הוא מדכא אמיתי. זה אופייני לזהות מספר דכאי המייצג מסלול ביולוגי מארח. דכאי יכול לפעמים להיות שותפים מחייב ישיר של חלבון חיידקי של עניין, אבל לא תמיד.
יצירת שיבוטים שמרים נושאת את חלבון חיידקי הריבית על pYesNTA-Kan הוא הצעד העיקרי הראשון וטיפול נהדר יש לנקוט כדי לשמר את היושרה של שיבוטים אלה בהקדם האפשרי, כי יש בחירה שלילית חזקה עבור שמרים נושאת רעילים חלבונים, גם ללא האינדוקציה גלקטוז מכוונת, והם עלולים לאבד את הפלביניים. מדי פעם יש הפסד פלמיד גם כאשר שמרים נשמרת תחת בחירה על נשירה מדיה. שיטה דווחה בעבר כדי להקטין את התרחשות הפסד פלאממיד על ידי שינוי הווקטור ושילובם בתוך הגנום שמרים1.
החיסרון העיקרי של טכניקות אלה היא כי המסך משתיק קול רק מניב נתונים משמעותיים אם ביטוי יתר של חלבון אפקטור חיידקי מפעילה פגם הצמיחה הנצפה עקבית בשמרים. הקושי העיקרי בשיטה זו הוא כאשר לא מזוהים דכאי. קשה לקבוע אם כשל בזיהוי דכאי נובע מסיבות ביולוגיות או מבעיות טכניות. מנקודת מבט ביולוגית, יכול להיות מספר גורמים: חלבון העניין יכול להיות כל כך רעיל כי חלבונים מן הספרייה גנומית אינם מסוגלים לדכא באופן משמעותי את הרעילות, מסלול היעד עשוי להיות מסוגל להציל, או רבים שיתוף ביטא גורמים עשויים להידרש כדי להתגבר על ההשפעה הרעילה. התקרבות להסבר הביולוגי מאתגרת, משום שישנם משתנים לא מוגדרים רבים לנתח. בגלל שיש פרוטוקול מבוסס, לחקור הסברים טכניים היא גישה הרבה יותר מעוקב. מבחינה טכנית, כישלון לזהות דכאי היא תוצאה של יעילות שינוי נמוך של הספרייה גנומית שמרים. פרוטוקול זה משתמש ב-ATCC S. cersiae AB320 ספריית גנומית חלקית ב-pYEp13. ספריות אחרות עשויות להיות מספיקות כמו גם וקטורים אחרים, אך פרוטוקול זה משתמש באופן ספציפי בספריית ATCC ואין מחקרים שפורסמו כעת המדווחים על ספריה חלופית או על מקורות וקטוריים. מומלץ מאוד כי כיסוי של הגנום שמרים צריך להיות לפחות 10x, או החלק התחתון עלול לעכב את הזיהוי של דכאי. יעילות שינוי מופחת יכולה להביא מספרים אלה תחת 1x. כך, חלקים של הגנום שמרים עשויים לא להיות מיוצגים במסך מדכא. יעילות שינוי נמוך יכול להיות עקב בעיות רבות, כולל ריאגנטים רע או הכנה הספריה עניים. שיטה זו שומרת בעיקר על שיטת ההמרה DMSO/LiAc הניח תחילה על ידי היל ואח '7. מומלץ כי dmso חדש, 50% פג, ו-DNA זרע הרינג טרי נרכשים ומוכנים להמרות ובשימוש בלעדי עבור אלה בחני להקטין את הזיהום או השפלה של האיכות של ריאגנטים. Dmso הוא מאוד דייב ו סופג מים מן האטמוספירה בקלות. לכן, מומלץ להימנע מפתיחה חוזרת של מכסה וחשיפה של מכולה לאטמוספירה. באיכות גבוהה DNA זרע הרינג יכול להיות מאוחסן ב-20 ° c ונשאר להתאים לשימוש במשך מספר שנים, למרות הכנה טרייה צריך להיות מוכן מהמלאי עבור כל שינוי. פעם מבושל ומקורר, DNA זרע ההרינג לא צריך להיות מבושל או לעשות בו שימוש חוזר, אז עדיף רק להסיר את מה שצריך ולהימנע מלעשות יותר הוא הכרחי לשינוי הנוכחי. תשומת לב לפרטים יכול לשפר במידה ניכרת את יעילות הטרנספורמציה של שמרים ולשפר את הסיכויים לזהות משתיק קול.
בהתחשב בעובדה כי וקטור pYep13 שמרים נושאת 3 על 13 שמרים ORFs שונים, הפחתת מספר הפלמידים שווא-חיוביים העליונה לזיהוי דכאי. שמרים יכולים לקחת והנמל עותקים מרובים של וקטורים דומים, בעוד החוכמה הכללית הקשורה לחוסר התאמה פלמיד מכתיב באופן מסורתי כי E. coli שומר רק סוג אחד של פלמיד עם מקור זהה של השכפול (ORI) בכל פעם, למרות שזה לא תמיד המקרה. הדבר יכול להפוך לבעיה מרכזית בעת ניסיון לזהות מועמדים לאיתור משתיק קול. אם שיבוטים שמרים מדכא מזוהים, הפלמידים יחולצו והפך לתוך E. coli להפצה וברצף הבאים לצורך זיהוי. ברגע שהמדכא משתיק הקול היה מבודד והפך לחיידק E. coli, מומלץ מאוד לפחות חמש מושבות E. coli מובחרת לרצף, משום שייתכן ששיבוטים בודדים עשויים לסחוב פלמידים שונים. מאז E. coli צריך רק להיות מסוגל להפיץ פלמיד אחד בכל פעם, אם בידוד שמרים מניב פלמידים מרובים, שיבוטים E. coli שונים על הלוח צריך לשאת רק אחד מהם בכל פעם. לכן איסוף חמש מושבות המבוססות על יעילות שינוי נורמלי ב -E. coli צריך להראות אם המשובטים נושאים באותו פלמידים או שונים. אם מספר פלמידים מתעוררות בעקבות הרצף של הפלמידים מ -E. coli, אז כל אחד צריך להיהפך לשיבוט שמרים רעילים העריכו להצלת הפגם בגדילה. יתר על כן, גם אם רק מזהה מדכא אחד בלבד מזוהה, עבור הקשיחות המרה מחדש של החומר הפלמיד לתוך שיבוט רעיל הוא מומלץ.
שיטת מדכא שמרים הוא ניסוי גדול מאוד הזמן המתאים וחומרים צריך להיות מתוכנן בהתאם. פרוטוקול זה מכיל פרטים רבים שיש להקפיד עליהם בקפדנות ומומלץ לקרוא בעיון את ההוראות הללו ולראות את הפרוטוקול במלואו לפני התחלת השיטת הפעולה. זהו הליך רב פרטיט, כולל גם חיידקים וגם שמרים שצריכים להיות מעובדים בטמפרטורות שונות. בידוד של פלמידים משמרים יכול לפעמים להיות קשה עקב קיר התא הקשיח שלהם השימוש DMSO מסייע להשיג יעילות שינוי גבוה יותר.
אחד היתרונות הגדולים ביותר של רעילות שמרים והמסך משתיק קול היא כי האפקטור חיידקי לא צריך לאגד פיזית את מצעים מארחים עבור כל כמות ניכרת של זמן כדי לזהות את המסלול הפוקע ממוקד. רק קומץ קטן של מחקרים דיווחו על שימוש בטכניקה זו או דומה1 – 5. עם זאת, ישנם דיווחים של טכניקות המזהות מסלולים מארחים וטכניקות רבות על המסך עבור שותפים מחייב של חלבונים אפקטור חיידקי. קרמר ואח ' דיווח על גישת ביולוגיה של מערכות הרומן כדי לזהות מסלולים המיועדים על ידי חלבונים בקטריאלייםשמונה. הטכניקה השתמשה הנבג מחיקה אוסף הזנים של S. cerevisiae ס על המסך עבור מוטציות רגישות השיגלה אפקטור Osp4. באמצעות טכניקה זו, Osp4 היה קשור לוויסות של איתות MAPK והנחתה של חסינות מולדת בתאים מארחים. מערך מבוסס, תפוקה גבוהה, אוטומטי שמרים-שני מסכי היברידית יכול כעת במהירות לזהות באופן מהיר שותפים בקטריות מחייב בקטריאלי על ידי הקרנת רבים באותו זמן נגד מיליוני חלבונים מארחים9. באופן דומה, תפוקה גבוהה immunoprecipitations בשילוב עם ספקטרומטר המסה משמשים לזיהוי המוני שותפי האיגוד של משפחות שלמות של חלבונים אפקטור חיידקים10. בעוד רבים ממחקרים אלה יכולים להאיץ את לוח הזמנים של האפיון חלבון אפקטור, לעתים נדירות הם מספקים תובנה על מה התהליכים הפיסיולוגיים מניפולציות ומה התוצאה ההוליסטית של אינטראקציות אלה. כך, טכניקות כגון רעילות שמרים ומסך משתיק קול חיוניים להאיר את התהליכים הסלולריים המתמרנים על ידי אלה חלבונים אפקטור. בשלב מסוים, תצפיות זיהוי שותפים מחייב או מסלולים המיועדים על ידי חלבונים מסוימים החיידקים צריך לחזור מודלים זיהום הסלולר כדי לקבוע אם אלה בממצאים מחוץ לגופית להחזיק נכון בתרחישים הרלוונטיים מבחינה פיזיולוגית. מניפולציה גנטית של פתוגנים תאיים כמו C. trachomatis כבר משוכה הגדול עד לאחרונה11-15 והדור של מוטציות ספציפיות לאתר כדי לחקור את החלבונים אפקטור לא היה אפשרי. בשנים האחרונות, למרות, מהפכה בהפקת מוטציות לא, משלימים אותם, ועל הבעת היתר חלבונים היעד התרחשה. אלה ההתפתחויות האחרונות הגדילו מאוד את הערך של המידע נגזר ממחקרים באמצעות מסכי רעילות ומדכא כפי שניתן כעת ללכת משמרים ישירות לתוך זיהום כדי לחקור את תוקפו של התוצאות.
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
אנו מודים לשלבי אנדרסן, אבי מקלאוף, ולורל וודס על עזרתם בטכניקות אלו. מחקר זה מומן על ידי כספי האתחול מאוניברסיטת איווה המחלקה למיקרוביולוגיה ואימונולוגיה כדי מרי מ. וובר.
Materials
| Name | Company | Catalog Number | Comments |
| Agar | Fisher Scientific | BP2641500 | |
| Galactose | MilliporeSigma | G0750-1KG | |
| GeneJet Gel extraction kit | ThermoFisher Scientific | K0691 | |
| GeneJet PCR purification kit | ThermoFisher Scientific | K0701 | |
| GeneJet plasmid miniprep kit | Thermo | K0503 | |
| Glucose | MilliporeSigma | G8270-1KG | |
| Herring Sperm DNA | Promega | D1811 | |
| KpnI-HF | New England Biolabs | R3142S | |
| Lithium acetate dihydrate | MilliporeSigma | L6883-250G | |
| Peptone | Fisher Scientific | ||
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530 | |
| Poly(ethylene glycol) 3350 | MilliporeSigma | 1546547-1G | |
| pYep13 | ATCC | 37323 | |
| T4 DNA ligase | New England Biolabs | M0202S | |
| Tryptophan | MilliporeSigma | 470031-1G | |
| XhoI-HF | New England Biolabs | R0146S | |
| Yeast extract | Fisher Scientific | BP1422-500 | |
| Yeast miniprep kit | Zymo | D2001 | |
| Yeast nitrogen base without amino acids | MilliporeSigma | Y0626-250G | |
| Yeast Synthetic Drop-out Medium Supplements | MilliporeSigma | Y1501-20G | without uracil |
| Yeast Synthetic Drop-out Medium Supplements | MilliporeSigma | Y1771-20G | without uracil, leucine, tryptophan |
References
- Tan, Y., Luo, Z. Q. Legionella pneumophila SidD is a deAMPylase that modifies Rab1. Nature. 475 (7357), 506-509 (2011).
- Guo, Z., Stephenson, R., Qiu, J., Zheng, S., Luo, Z. A Legionella effector modulates host cytoskeletal structure by inhibiting actin polymerization. Microbes and Infection. 16 (3), 225-236 (2014).
- Tan, Y., Arnold, R. J., Luo, Z. -. Q. Legionella pneumophila regulates the small GTPase Rab1 activity by reversible phosphorylcholination. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 21212-21217 (2011).
- Weber, M. M., et al. The type IV secreted effector protein CirA stimulates the GTPase activity of RhoA and is required for virulence in a mouse model of Coxiella burnetii infection. Infection and Immunity. 84, (2016).
- Faris, R., et al. Chlamydia trachomatis CT229 subverts Rab GTPase-dependent CCV trafficking pathways to promote chlamydial infection. Cell Reports. 26, 3380-3390 (2019).
- Mumberg, D., Müller, R., Funk, M. Yeast vectors for the controlled expression of heterologous proteins in different genetic backgrounds. Gene. 156, 119 (1995).
- Hill, J., Donald, K. A. G., Griffiths, D. E. DMSO-enhanced whole cell yeast transformation. Nucleic Acids Research. 19 (20), 41070 (1991).
- Kramer, R. W., et al. Yeast Functional Genomic Screens Lead to Identification of a Role for a Bacterial Effector in Innate Immunity Regulation. PLoS Pathogens. 3 (2), 21 (2007).
- Häuser, R. T. S., Rajagopala, S. V., Uetz, P. Array-Based Yeast Two-Hybrid Screens: A Practical Guide. Two Hybrid Technologies: Methods and Protocols, Methods in Molecular Biology. , 21-38 (2012).
- Mirrashidi, K. M., et al. Global mapping of the inc-human interactome reveals that retromer restricts chlamydia infection. Cell Host and Microbe. 18 (1), 109-121 (2015).
- Wang, Y., et al. Development of a transformation system for chlamydia trachomatis: Restoration of glycogen biosynthesis by acquisition of a plasmid shuttle vector. PLoS Pathogens. 7 (9), 1002258 (2011).
- Mueller, K. E., Wolf, K., Fields, K. A. Gene deletion by fluorescence-reported allelic exchange mutagenesis in Chlamydia trachomatis. mBio. 7 (1), 1-9 (2016).
- Johnson, C. M., Specific Fisher, D. J. Site-Specific, Insertional Inactivation of incA in Chlamydia trachomatis Using a Group II Intron. PLoS ONE. 8 (12), 83989 (2013).
- Weber, M. M., et al. Absence of specific Chlamydia trachomatis inclusion membrane proteins triggers premature inclusion membrane lysis and host cell death. Cell Reports. 19 (7), 1406-1417 (2017).
- Weber, M. M., et al. A functional core of IncA is required for Chlamydia trachomatis inclusion fusion. Journal of Bacteriology. 198 (8), 1347-1355 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved