Method Article
효모 독성 및 억제기 스크린을 사용하여 세균 효과 단백질에 의해 표적으로 한 호스트 통로의 확인
요약
세균성 병원체는 중요한 생물학 프로세스를 표적으로 하는 호스트로 단백질을 은닉합니다. 세균성 이펙터 단백질에 의해 표적으로 한 호스트 통로를 확인하는 것은 분자 병인을 해결하는 열쇠입니다. 여기서, 독성 세균 이펙터 단백질에 의해 표적화된 숙주 경로를 해명하기 위해 변형된 효모 억제기 및 독성 스크린을 사용하는 방법이 기재되어 있다.
초록
세포내 박테리아는 박테리아의 이익을 위해 숙주 단백질 및/또는 관련 생물학적 경로를 전복시키는 역할을 하는 숙주 시토솔로 이펙터 단백질이라고 불리는 독성 인자를 분비합니다. 세균 게놈 시퀀싱의 발전과 분비 후보및/또는 진핵을 코딩하는 유전자의 실리코 식별을 허용하는 알고리즘의 출현으로 인해 가용세균 이펙터 단백질의 식별이 더욱 관리가 용이해졌습니다. 도메인. 그러나, 이러한 중요한 독성 요인의 식별은 초기 단계에 불과합니다. 당연히, 목표는 이펙터 단백질의 분자 기능을 결정하고 호스트와 상호 작용하는 방법을 밝히는 것입니다. 최근 몇 년 동안, 질량 분석과 결합된 효모 2 하이브리드 스크린 및 대규모 면역 침전과 같은 기술은 단백질 단백질 상호 작용의 확인에 원조되었습니다. 숙주 결합 파트너의 식별이 세균 효과 단백질의 분자 기능을 해명하는 중요한 첫 번째 단계이지만, 때로는 숙주 단백질이 여러 생물학적 기능 (예를 들어, 액틴, 클라트린, 튜불린) 또는 세균성 단백질은 호스트 단백질을 물리적으로 묶지 않을 수 있습니다, 조작되는 정확한 호스트 통로에 관하여 중요한 정보의 연구원을 박탈하. 서프레서 스크린과 결합된 변형된 효모 독성 스크린은 세균 효과 단백질에 의해 영향을 받는 숙주 경로를 식별하도록 조정되었습니다. 독성 스크린은 종종 성장 결함으로 명시되는 숙주 생물학적 경로를 방해하는 이펙터 단백질에 의한 효모의 독성 효과에 의존한다. 효모 게놈 라이브러리의 발현은 세균 이펙터 단백질의 독성을 억제하는 숙주 인자를 식별하고 따라서 이펙터 단백질이 표적으로 하는 경로내의 단백질을 식별하는 데 사용된다. 이 프로토콜에는 독성 및 억제기 스크린에 대한 자세한 지침이 포함되어 있습니다. 이러한 기술은 효모 및 대장균의분자 복제 및 재배가 가능한 모든 실험실에서 수행 될 수 있습니다.
서문
여기에 제시된 것과 유사한 절차의 첫번째 보고는 레지오넬라 성 균 타입 IV 이펙터 SidD, Rab11을수정하는 deAMPylase를 특징으로 합니다. 유사한 기술은 여러 L. 폐렴 구이펙터 1,2,3의특성화에 사용되었다. 상기 분석법은 콕시엘라 버네티형 IV 이펙터 단백질4를특성화하도록 적용되었으며, 최근에는 클라미디아 트라코마티스 함유 막 단백질의 특성화를 위해 이 기술의 유용성이 확대되었다5 .
이 프로토콜은 두 가지 주요 부분으로 나눌 수 있습니다: 1) 효모 독성 스크린, 관심 있는 세균 효과 단백질은 효모에서 발현 되고 클론은 성장 결함에 의해 입증된 바와 같이 독성 표현형을 위해 스크리핑되고, 2) 효모 억제기 스크린 , 독성 표현형이 독성 균주에서 효모 게놈 라이브러리의 발현에 의해 억제되는 경우. 따라서, 독성 화는 관심 있는 세균 효과제가 과발현될 때 성장 결함으로 나타나는 독성 표현형에 대한 스크린이다. 세균 이펙터를 성공적으로 변형하고 표현한 독성 클론이 다음 단계를 위해 선택되고 저장됩니다. 두 번째 주요 단계는 독성 효모 클론에서 부분적으로 소화 된 효모 게놈 라이브러리를 과발현하는 것을 포함합니다. 이 프로토콜에서 사용하기 위해 제안된 효모 게놈 라이브러리를 구성하는 플라스미드는 5-20kb 인서트를 가지고 있으며, 일반적으로 모든 플라스미드에서 평균 유전자 크기의 3-13 효모 개방 판독 프레임(ORF)에 해당하며, 전체 효모 게놈을 나타냅니다. 약 10배. 분석의 이 부분은 세균성 이펙터 단백질의 독성을 억제하는 것이 목적이기 때문에 서프레서 스크린이라고 합니다. 전위 억제기 플라스미드는 효모로부터 분리되고, 시퀀싱되고, 식별된 억제 ORFs로부터 분리된다. 서프레서 스크린의 근본적인 근거는 이펙터 단백질이 대상호스트 통로의 성분과 결합, 상호 작용 및/또는 압도하며, 이러한 숙주 단백질을 과도하게 제공하면 경로에 대한 독성 효과를 구출할 수 있다는 것입니다. 성장 결함. 따라서, 독성을 억제하는 확인된 ORF는 종종 숙주 통로의 여러 참가자를 나타낸다. 직교 실험은 세균이 실제로 연루 된 통로와 상호 작용하는지 확인하기 위해 수행됩니다. 이것은 이 단백질이 호스트 프로세스의 다수에서 관련되기 때문에, clathrin 또는 actin와 같은 결합 파트너가 확인된 경우에 특히 필요합니다. 추가 실험은 감염 도중 이펙터 단백질의 생리기능을 해명할 수 있다. 독성 및 억제제 스크린은 또한 면역 침전에 의해 검출하기에 충분한 친화력으로 숙주 단백질을 물리적으로 결합하지 않거나 상호 작용하는 세균 효과 단백질의 생리적 기능을 해독하기 위한 강력한 도구입니다. 효모 2 하이브리드 화면에 의해 감지되지 않을 수 있는 효소 적중 및 실행 상호 작용의 호스트.
서프레서 스크린은 세균 효과단백질과 숙주 경로 사이의 잠재적인 생리적 상호작용을 드러내는 강력한 방법이 될 수 있지만, 세균 이펙터 단백질은 효모에서 성장 결함을 유도해야 하며, 그렇지 않으면 이를 사용하여 서프레서 화면은 거의 사용되지 않습니다. 더욱이, 독성 표현형은 적어도 2-3 log10 의 성장을 초래해야 하거나 억제기를 식별하기 어려울 것이다. 실험실이 세포 배양을 위해 설치되는 경우에, HeLa와 같은 일반적인 세포주에서 독성을 위한 스크리닝 이펙터 단백질은 종종 효모 독성 스크린을 진행하기 위하여 노력가치가 있는지에 대한 통찰력을 줄 수 있습니다. HeLa 세포에서 이펙터 단백질의 자궁내 발현은 때때로 이들 스크린에 사용되는 효모 균주에서 독성과 매우 강하게 상관되는 독성을초래한다 4. HeLa 세포에 있는 긴장의 관찰가능한 특징은 긴장 섬유의 손실, 격판덮개에서 세포 분리 및 apoptosis를 나타내는 핵 응축을 포함합니다. HeLa 세포에 있는 긴장의 어떤 시각적인 표시든지 관심의 단백질은 효모에 있는 성장 결함을 유도하기 위한 좋은 후보를 만듭니다, 이는 훨씬 더 급속하게 복제하고 따라서 필수적인 통로의 교란에 더 반응합니다.
서프레서 스크린이 항상 호스트 바인딩 파트너를 억제자로 식별하지는 않지만 대상 호스트 경로의 중요한 구성 요소를 연루할 수 있으므로 세균 효과 단백질. 표면적으로, 이것은 이펙터 단백질의 결합 파트너를 과도하게 제공하면 성장 결함을 구출할 것으로 예상되기 때문에 직관적이지 않은 것으로 보인다. C. 트라코마티스 이펙터 단백질 CT229(CpoS)에 의해 표적화된 경로를 식별하기 위한 노력의 일환으로, 이는 감염 시 적어도 10개의 상이한 랍 GTPases에결합5,Rab 결합 파트너 중 누구도 CT229의 독성을 억제하지 않았다. 그러나, clathrin 코팅 소포 (CCV) 인신 매매에 관련 된 수많은 억제기 확인 되었다, CT229 특히 Rab 의존 CCV 인신 매매를 전복 하는 추가 작업을 주도. 유사하게, C. burnetii 이펙터 단백질 Cbu0041 (CirA)를 조사할 때 효모 성장 결함을 구출한 몇몇 Rho GTPases가 확인되었고, 나중에 RhoA4에대한 GTPase 활성화 단백질(GAP)으로서 CirA가 기능한다는 것을 발견하였다.
세균 효과 단백질에 의해 표적으로 한 숙주 통로를 해명하기 위한 효모 억제기 스크린의 유용성은 과장될 수 없고, 세포내 세균성 이펙터 단백질을 특성화하는 것을 시도하는 그밖 연구원은 크게 에서 유익할 수 있습니다 이러한 기술. 이 분석실험은 면역침전 및/또는 효모 2개의 하이브리드 스크린이 결합 파트너를 찾아내지 못하고 어떤 통로가 세균성 이펙터 단백질에 의해 표적으로 하는지 해명할 수 있는 경우에 가치가 있습니다. 여기서, 세포내 세균 효과기 단백질에 의해 표적으로 된 숙주 생물학적 경로를 확인하기 위한 독성 및 억제기 스크린에 대한 상세한 프로토콜이 제공되며, 이러한 분석및 이들의 분석및 이들의 사용 시 경험되는 일반적인 장애물들 중 일부가 제공된다. 해당 솔루션을 제공합니다.
프로토콜
1. 매체 및 시약의 준비
참고 : 플레이트는 분석의 날 전에 준비해야하며 1 개월 동안 좋습니다. 미디어 및 시약은 언제든지 만들 수 있으며 1 개월 동안 좋습니다.
- 1, 000 mL 비커에 증류수 800 mL에서 D-(+)-포도당 100 g을 용해시킴으로써 포도당 용액 1L(10% w/v)을 준비합니다. 증류수로 부피를 1L로 조정합니다. 0.2 μm 멸균 필터를 통해 멸균 된 1 L 미디어 저장 병에 걸하십시오.
- 1L 비커에 증류수 800 mL에 100 g의 D-(+)-갈락토스를 용해시켜 갈락토제 용액 1L(10% w/v)을 준비합니다. 증류수를 사용하여 부피를 1mL로 조정하고 0.2 μm 멸균 필터를 통해 멸균 된 1,000 mL 미디어 저장 병에 필터를 적용하십시오.
- 효모 추출물 펩톤 덱스트로스(YPD) 한천 1L를 효모 추출물 10g, 펩톤 20 g, 포도당 20g, 한천 20g을 증류수 1,000 mL에 녹여 준비합니다. 오토클레이브를 20분간 식히고 56°C의 수조에서 식힙니다. 접시 당 ~ 20mL의 매체를 사용하여 100mm 플레이트에 붓습니다.
- 효모 추출물 10g, 펩톤 20g, 포도당 20g을 증류수 1,000 mL에 녹여 YPD 국물 1 L을 준비합니다. 오토클레이브 20분
- 합성 드롭 아웃 (SD) 우라실 (우라-) 포도 당 한천을 준비합니다. 1L의 경우, 아미노산이 없는 효모 질소 염기 6.7 g, 우라실 이없는 드롭아웃 보충제 1.9 g, 증류수 800 mL에 한천 15 g을 녹입니다. 오토클레이브는 20분 동안 56°C의 수조에서 식히고 온도가 ~50-60°C가 될 때까지 식힙니다. 50 mL 혈청학적 파이펫 또는 멸균 된 석판 실린더를 사용하여 1.1 단계에서 제조 된 포도당 용액200 mL을 추가하십시오. 부드럽게 소용돌이치는 것으로 잘 섞거나 저어서 저어주세요. 접시 당 ~ 20mL의 매체를 사용하여 100mm 플레이트에 붓습니다.
- 합성 드롭아웃(SD) 우라실(Ura-) 갈락토제 한천을 준비한다. 1L의 경우, 아미노산이 없는 효모 질소 염기 6.7 g, 우라실 이없는 드롭아웃 보충제 1.9 g, 증류수 800 mL에 한천 15 g을 녹입니다. 오토클레이브는 20분 동안 56°C의 수조에서 식히고 온도가 ~50-60°C가 될 때까지 식힙니다. 50 mL 혈청학적 파이펫 또는 멸균 된 석판 실린더를 사용하여 1.2 단계에서 제조 된 갈락토제 용액200 mL을 추가하십시오. 부드럽게 소용돌이치는 것으로 잘 섞거나 저어서 잘 섞으세요. 접시 당 ~ 20mL의 매체를 사용하여 100mm 플레이트에 붓습니다.
- 합성 드롭아웃(SD) 우라실(Ura-) 포도당 국물을 준비한다. 1L의 경우, 아미노산없이 효모 질소 염기 6.7 g과 증류수 800 mL에 우라실없이 1.9 g의 드롭 아웃 보충제를 녹입니다. 오토클레이브는 20분 동안 56°C의 수조에서 식히고 온도가 ~50-60°C가 될 때까지 식힙니다. 50 mL 혈청학적 파이펫 또는 멸균 된 석판 실린더를 사용하여 1.1 단계에서 제조 된 포도당 용액 200 ml를 추가하십시오.
- 합성 드롭아웃(SD) 우라실(Ura-) 류신(Leu-) 포도당 한천을 준비한다. 1 L의 경우, 아미노산없이 효모 질소 염기 6.7 g을 용해; 우라실없이 드롭 아웃 보충의 1.9 g, 류신, 그리고 트립토판; 한천 15 g; 그리고 0.076 증류수의 800 mL에 트립토판의 g. 오토클레이브는 20분 동안 56°C의 수조에서 식히고 온도가 ~50-60°C가 될 때까지 식힙니다. 50 mL 혈청학적 파이펫 또는 멸균 된 석판 실린더를 사용하여 1.1 단계에서 제조 된 포도당 용액200 mL을 추가하십시오. 접시 당 ~ 20mL의 매체를 사용하여 100mm 플레이트에 붓습니다.
- 합성 드롭 아웃 (SD) 우라실 (우라-) 류신 (Leu-) 갈락토제 한천을 준비합니다. 1 L의 경우, 아미노산없이 효모 질소 염기 6.7 g을 용해하십시오. 우라실없이 드롭 아웃 보충의 1.9 g, 류신, 그리고 트립토판; 한천 15 g; 그리고 0.076 증류수의 800 mL에 트립토판의 g. 오토클레이브는 20분 동안 56°C의 수조에서 식히고 온도가 ~50-60°C가 될 때까지 식힙니다. 50 mL 혈청학적 파이펫 또는 멸균 된 석판 실린더를 사용하여 1.2 단계에서 제조 된 갈락토제 용액200 mL을 추가하십시오. 부드럽게 소용돌이하거나 저어 접시에 놓아 잘 섞으세요. 접시 당 ~ 20mL의 매체를 사용하여 100mm 플레이트에 붓습니다.
- 합성 드롭 아웃 (SD) 우라실 (우라-) 류신 (루-) 포도당 국물을 준비합니다. 1 L의 경우, 아미노산없이 효모 질소 염기 6.7 g을 용해하십시오. 우라실없이 드롭 아웃 보충의 1.9 g, 류신, 트립토판; 그리고 0.076 증류수의 800 mL에 트립토판의 g. 오토클레이브를 20분 동안 56-60°C 수조에서 식히고 온도가 ~50°C가 될 때까지 식힙니다. 50 mL 혈청학적 파이펫 또는 멸균 된 석판 실린더를 사용하여 1.1 단계에서 제조 된 포도당 용액200 mL을 추가하십시오.
- 폴리에틸렌 글리콜 (PEG) 용액을 준비합니다. 증류수에 폴리에틸렌 글리콜 3350을 50% 넣고 추가합니다. 오토클레이브에 의한 살균.
- 증류수 200 mL에서 10.2 g의 리튬 아세테이트 탈수를 용해시킴으로써 1M 리튬 아세테이트(LiAc)를 준비합니다. 오토클레이브에 의한 살균.
- 청어 정자 DNA를 준비합니다. 희석 10 mg/mL 청어 정자 DNA 2 mg/mL 증류수를 사용 하 여. 100 °C에서 5 분 동안 가열하고 즉시 5 분 동안 얼음에 놓습니다.
2. 효모 독성 플라스미드 pYesNTA-칸에 관심 있는 유전자를 복제
참고: 현재, 상업적으로 그리고 학문적으로 모두 이용 가능한 다양한 효모 독성 벡터가 있다. 효모 서프레서드 스크린은 관심 있는 이펙터 단백질을 발현하는 플라스미드가블라R이외의 우라실 및 항생제 마커 이외의 탈락 선택을 사용하였고 이러한 벡터의 많은 것들과 함께 사용될 수 있다. 이러한 작업은 잠재적인 억제제에 대한 보다 쉬운 스크리닝을 위해 카나마이신 저항 성 카세트를 포함하는 변형된 pYesNTA 벡터4,5를 사용했다. 복제 방식은 이펙터 단백질이 Gal 프로모터 및 His-Tag와 함께 프레임 내에 있을 수 있도록 허용해야 합니다. 클라미디아 트라코마티스 포함 막 단백질 CT229는 이들 세포에 대한 원리의 증거로 사용하였다.
- PCR을 사용하여 CT229 +1 Kpn F (CCGGTACCAATCTTTTTTCAGGT)와 CT229 XhoI R (CCCTCTTTTTTTTACGAGGGCC) 프라이머를 사용하여 제조업체의 지침에 따라 C. 트라코마티스 게놈 DNA에서 CT229를 증폭시킴. 다음과 같은 PCR 조건을 사용하십시오: (1) 30초에 98°C; (2) 10초의 경우 98°C, 30초의 경우 55°C, 2분 동안 72°C; (3) 총 25x에 대해 2단계를 반복합니다. (4) 72°C 10분 동안; 및 (5) 4 °C 보류.
- 1% 아가로즈 겔로 PCR 제품의 5 μL을 분석하였다(그림1).
- 제조업체의 지시에 따라 PCR 정제 키트를 사용하여 나머지 45 μL의 DNA를 정화합니다.
- 정제된 PCR 삽입물과 pYesNTA-Kan(그림2)의50 μL을 KpnI-HF 및 XhoI-HF를 사용하여 수조에서 37°C에서 1시간 동안 소화한다.
참고: pYesNTA-Kan의 경우, KpnI-HF 5 μL, XhoI-HF 5 μl, 60 μL의 총 부피에서 완충액 6 μL을 사용하여 플라스미드 5 μg을 소화합니다. 인서트에 대해, KpnI-HF 2 μL, XhoI-HF 2 μL, 버퍼 6 μL을 사용하여 정제된 PCR 제품의 전체 50 μL을 소화합니다. - 전체 플라스미드 다이제스트를 1% 아가로즈 젤에 바르고 드시면 됩니다. 제조업체의 지시에 따라 젤 추출 키트를 사용하여 소화 된 플라스미드의 정제를 수행하십시오.
- 제조업체의 지침에 따라 PCR 정제 키트를 사용하여 소화된 PCR 인서트를 정화합니다.
- pYesNTA-Kan의 2 μL을 사용하여 pYesNTA-Kan내로 삽입을 복제(단계 2.5), DNA 리가제 완충제의 2 μL, T4 리가제의 1 μL, 및 삽입의 15 μL(단계 2.6). 실온에서 1 시간 동안 배양하십시오.
- 전체 복제 반응을 대장균 유능한 세포의 50 μL에 첨가하고 형질전환 반응을 수행한다.
- 카르베니실린의 100 μg/mL를 포함하는 LB 판에 전체 변환 반응을 플레이트.
- 3개의 개별 콜로니와 함께 100 μg/mL의 카베니실린을 함유한 LB의 10 mL을 접종합니다. 150 rpm에서 흔들어 37 °C에서 밤새 배양.
- 제조업체의 지침에 따라 플라스미드 미니프렙 키트를 사용하여 플라스미드를 분리합니다.
- 계열된 플라스미드를 유전자 특이적 프라이머를 사용하여 서열화한다(단계 2.1).
3. 효모의 독성에 대한 관심 단백질 테스트
- Saccharomyces 세레비시아에 YPD 한천 (단계 1.3)에 절연 식민지를 얻을 수 있습니다. 24 시간 동안 30 °C에서 배양하십시오.
- 한천 플레이트로부터 단일 콜로니로 YPD 국물 10 mL(단계 1.4)을 접종한다(단계 3.1). 밤새 150 rpm에서 흔들어 30 °C에서 배양.
- YPD 국물 10 mL(단계 1.4)에 하룻밤 배양의 0.5 mL를 추가하고 30°C에서 배양하고 4시간 동안 150 rpm에서 흔들어.
- 4°C에서 10분 동안 3,000 x g에서 배양10 mL을 펠렛.
- 1 mL의 멸균수로 펠릿을 다시 일시 중단하고, 미세 원심 분리튜브로 옮기고, 펠릿을 실온에서 1분 동안 3,000 x g으로 옮긴다.
- 1 mM의 1 mL의 리튬 아세테이트 (LiAc)와 펠릿을 실온에서 1 분 동안 3,000 x g에서 다시 놓습니다.
- LiAc 세척을 2x 반복합니다.
- 세탁을 제거합니다. 50% PEG 3350의 2.4 mL에서 펠릿을 다시 일시 중단합니다. 청어 정자 DNA의 360 μL, 청어 정자 DNA의 2 mg/mL의 500 μL, 그리고 400 μL의 멸균수를 추가하십시오.
참고: 20개의 변환에 충분합니다. - 2.12단계에서 3.3.5단계에서 5 μL의 pYesNTA-Kan CT229 플라스미드 DNA(100-500 ng)를 함유하는 마이크로원심지 튜브에 180 μL의 변형 혼합을 첨가하였다.
- 30 °C에서 30 분 동안 수조에서 배양하십시오.
- 42 °C에서 30 분 동안 수조에서 배양하십시오.
- 3,000 x g의 펠릿을 실온에서 1분 동안.
- 파이펫으로 변환 믹스를 제거합니다. 100 μL의 멸균수로 펠릿을 다시 놓습니다. 포도당한 한천 (단계 1.5)- SD 우라에 변형을 플레이트.
- 48 시간 동안 30 °C에서 플레이트를 배양하십시오.
- SD 우라의 5 mL을접종- 플레이트로부터 단일 콜로니와 포도당을 함유하는 국물(단계 1.7). 150 rpm에서 흔들어 30 °C에서 밤새 배양. 벡터만으로 변형된 효모를 음수 대조군으로 포함합니다.
- 96웰 플레이트(A2−A6)의 5웰에 멸균수 180μL을 추가합니다.
- 혼합하는 하룻밤 배양을 소용돌이.
- 첫 번째 우물 (A1)에 180 μL의 효모를 추가하십시오. 1:10(원액을 포함한 총 6개의 시료)을 연속적으로 희석합니다.
- 멀티채널 파이펫을 사용하여, SD 우라-포도당(단계 1.5) 및 우라-갈락토제(단계 1.6) 한천 플레이트상상에서 각 희석물의 5 μL을 스팟. 48 시간 동안 30 °C에서 배양하십시오.
- 상기 갈락토제 함유 매체상에서 성장한 관심있는 이펙터 단백질을 발현하는 효모의 성장을 벡터를 단독으로 발현하는 효모의 성장과 비교하여 독성을 평가한다.
- 서양 블로팅에 의한 히태그 융합 단백질의 발현을 확인한다.
4. 효모 게놈 라이브러리로 독성 효모 변형
- SD 우라의 100 mL을접종- 포도당 국물 (단계 1.7) 단계 3.4단계에서 주식의 1 mL를 사용하여. 30°C에서 16-24시간 동안 배양하고 150 rpm에서 흔들어. 900 mL의 SD우라-포도당 국물을 30°C에서 하룻밤 동안 놓고 매체를 미리 데우다.
- 하룻밤 배양물 전체 100 mL을 미리 온난한 1L 플라스크에 추가합니다. 30°C에서 4-5시간 동안 배양하고 150 rpm에서 흔들어.
- 4°C에서 10분 동안 6,000 x g에서 배양한다.
- 상급제는 버리십시오. 250 mL의 멸균수로 펠릿을 다시 놓습니다. 4°C에서 5분 동안 6,000 x g에서 배양하는 펠렛.
- 상급제는 버리십시오. 1 mM LiAc의 250 mL에서 펠릿을 다시 일시 중단하십시오. 4°C에서 5분 동안 6,000 x g에서 배양하는 펠렛.
- LiAc를 제거하고 50% PEG 3350의 9.6 mL에서 펠릿을 다시 일시 중단합니다. 1.44 mL의 1M LiAc, 2 mg /mL 청어 정자 DNA, pYep13 게놈 라이브러리의 50 μg (ATCC 37323)를 추가하십시오. 멸균수로 부피를 15mL로 조정합니다. 반전하여 부드럽게 섞으세요.
- 30 °C에서 30 분 동안 수조에서 배양하십시오.
- 750 μL의 디메틸 설폭사이드(DMSO)를 첨가하여 변혁 효율을 향상시킵니다. 42°C에서 수조에서 30분 동안 배양합니다.
- 실온에서 5 분 동안 3,000 x g의 효모를 펠렛하십시오.
- 상급물을 버리고 멸균수 10 mL에 펠릿을 다시 놓습니다. 3,000 x g의 펠릿을 실온에서 5분 동안.
- 8 mL의 멸균수로 펠릿을 다시 놓습니다.
- 형질전환 효율을 결정하기 위해, SD우라-루-글루코스 한천상에서 각 희석물의 1:10 및 플레이트 100 μL을 희석한다(단계 1.8).
- 플레이트 200 μL SD 우라- 루- 갈락토제 한천 (단계 1.9) 플레이트에 샘플. 총 50 개의 접시를 사용하십시오.
- 48−96시간 동안 또는 식민지가 나타날 때까지 30°C에서 배양합니다.
참고 : 식민지는 일반적으로 48-72 시간에서 포도당 한천 접시에 나타나고 72-96 h에서 갈락토제 한천 접시에 나타납니다.
- SD 우라- 루- 갈락토제 한천 (1.9 단계)에 패치 식민지 (잠재적 인 구조)를 확장하고 재고를 합니다. 24-48h동안 30°C에서 배양합니다.
- 5 mL의 SD 우라-루-글루코스 국물(단계 1.10)을 패치의 일부를 사용하여 접종하였다. 150 rpm에서 흔들어 26 °C에서 밤새 배양.
- 96웰 플레이트(A2−A6)의 5웰에 멸균수 180 μL을 추가합니다.
- 혼합하는 하룻밤 배양을 소용돌이.
- 첫 번째 우물 (A1)에 180 μL의 효모를 추가하십시오. 1:10(원액을 포함한 총 6개의 시료)을 연속적으로 희석합니다.
- 멀티 채널 파이펫을 사용하여, SD 우라- 포도당 및 SD 우라- 갈락토제 한천 플레이트에 각 희석의 5 μL을 자리. 독성 이펙터를 단독으로 대조군으로 포함시다.
- 48 시간 동안 30 °C에서 배양하십시오.
- 독성 이펙터를 단독으로 발현하는 효모의 성장을 전위 억제제를 함유하는 효모와 비교한다. 이펙터를 단독으로 발현하는 효모에 비해 독성이 감소한 잠재적 인 억제기로만 진행하십시오.
5. 서프레서 식별 및 확인
- SD우라-루-글루코스 국물(단계 1.10)의 5 mL을 4.4단계에서 효모100 μL로 접종하고 150 rpm에서 흔들어 30°C에서 밤새 배양한다.
- 실온에서 2 분 동안 3,000 x g에서 효모를 펠렛하십시오. 피펫을 사용하여 상급을 부드럽게 버립니다.
- 제조업체의 지침에 따라 효모 플라스미드 미니프렙 키트로 플라스미드를 분리합니다.
- 분리된 플라스미드를 대장균 유능한 세포로 변형시키고 LB 한천에서 100 μg/mL의 카베니실린으로 전체 변형을 플레이트합니다. 24 시간 동안 37 °C에서 배양하십시오.
- 카르베니실린 100 μg/mL를 함유한 LB 국물 10 mL을 접종하고, 플레이트에서 3개의 콜로니를 가지고 150 rpm에서 150rpm에서 흔들어 밤새 37°C에서 배양합니다.
- 3,000 x g의 펠릿 배양체는 실온에서 10분 동안. 제조업체의 지침에 따라 미니프렙 키트를 사용하여 플라스미드를 분리합니다.
- 프로토콜의 3부에서 단계에 따라 5.3.1 단계에서 단리된 플라스미드로 독성 효모를 변형시킵니다.
- SD 우라 -Leu-포도당 국물을 변형 플레이트로부터 콜로니와 함께 5 mL을 접종한다. 150 rpm에서 흔들어 30 °C에서 밤새 배양.
- 우라에 자리- 루- 포도당과 갈락토제 한천독성 억제를 확인합니다.
- 효모 ORF를 식별하기 위해 pYep13 F (ACTACGATATGCGA) 및 pYep13 R (TGATGCGCGCGATGC)를 사용하여서열.
결과
실제 효모 억제기 스크린을 수행하기 전에 관심 있는 이펙터 단백질이 효모의 독성을 테스트해야 합니다. 이것은 갈락토 유도성 프로모터의 통제 하에 효모에 관심 있는 단백질을 발현함으로써 달성된다. 포도당(noninducing conditions)에 대한 성장은 먼저 독성이 특히 관심 단백질의 발현에 기인하고 일반적인 결함이 아님을 보장하기 위해 비교되어야 한다. 그림 3에나타난 바와 같이, 독성은 더 작은 콜로니 및/또는 감소된 성장으로 나타난다. 효모 성장의 2-3 로그 감소는 효모 억제제 스크린에 이상적입니다.
도 4에도시된 바와 같이, 독성 및 억제기 스크린은 프로토콜 섹션에 기재된 방법을 사용하여 8단계로 달성될 수 있다. 관심있는 유전자는 적합한 벡터1로복제되고, 생성 된 구성은 독성을 평가하기 위해 효모로 변환됩니다. 본 연구는 CT229를 관심 유전자로 사용하고 pYesNTA-Kan을 벡터로 사용하였다. 추가적으로, 그의 태그가 붙은 융합 단백질의 발현은 서양 블로팅에 의해 확인되었다. 이상적으로는 갈락토제 함유 매체에서 자란 효모의 2-3 로그 감소를 관찰해야 합니다. 관심 있는 단백질이 효모에 독성이 있는경우(도 3 및 도 4),억제제 화는 효모 게놈 라이브러리 pYep13으로 독성 균주를 변형시킴으로써 진행될 수 있다. 형질전환제는 포도당 한천에 도금되어 변형 효율을 결정하고 한천을 갈락토오스한천으로 하여 잠재적인 억제제를 식별합니다. 이 프로토콜을 사용하여, 5 x 105의 최소 변환 효율은 은하 한천에 총 10-250 콜로니로 달성되었다. SD우라에 이러한 식민지를 패치 - Leu- galactose 한천(그림 4)많은 거짓 긍정이 패치 될 때 성장하지 않기 때문에, 진정한 억제기의 식별에 도움. 여기서, 50개의 콜로니를 패치하고 8개의 클론을 이펙터 독성을 억제하였다(도4). SD 우라-Leu-galactose 한천에 억제억제를 발견하여 독성 억제를 확인하였습니다. 도 4에나타낸 바와 같이, pSup1 및 pSup 2는 이펙터 단백질의 독성을 억제한 반면, pSup3은 그렇지 않았다. 따라서, pSup3는 폐기되었다. 플라스미드는 이어서 억제기로부터 분리되고 대장균으로 변형되어 플라스미드 수율을 증가시켰다. 플라스미드는 독성 효모로 재형질되어 단리된 플라스미드가 확실히 이펙터 독성을 억제한다는 것을 확인할 수있다(도 4). 대부분의 분리된 플라스미드는 독성을 구출해야 하지만, 때때로 독성 효모 균주로 변형될 때 독성을 억제하지 않는 플라스미드가 얻어진다. 이러한 플라스미드는 폐기되며, 재변환 후 독성을 억제하는 플라스미드만 시퀀스화해야 합니다.
단리된 플라스미드는 다중 효모 ORFs4를포함합니다. 참 억제기인 것을 식별하기 위해, 각 ORF는 앞서 설명한 바와 같이 독성 효모 균주에서 개별적으로 복제및 발현될 수있다 1,2,3,4.

도 1: 표적 유전자의 PCR 증폭. 클라미디아 트라코마티스 세로바르 L2로부터의 CT229는 게놈 DNA로부터 PCR 증폭되었다. PCR 제품은 에티듐 브로마이드로 염색한 1% 아가로즈 젤을 분석하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
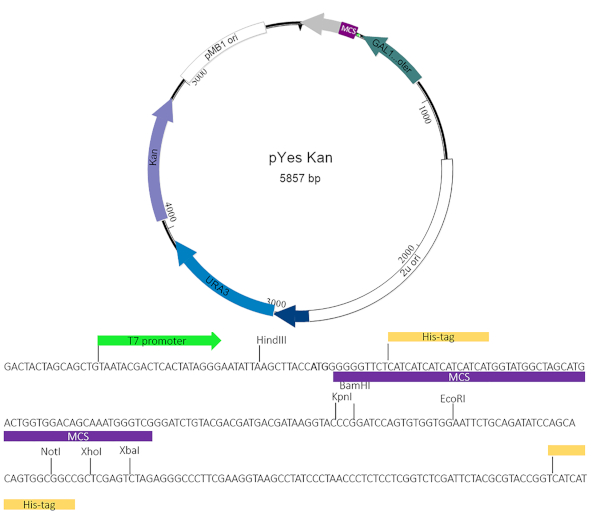
그림 2: pYesNTA-칸 플라스미드 맵. 관심 대상 유전자는 pYesNTA-Kan. 카나마이신의 다중 복제 부위(MCS)로 복제되었고, 대장균 및 우라실 드롭아웃에서 선택을 위해 사용되었고 S. 세레비시아에서 선택을 위해 사용되었다. 그의 태그가 붙은 융합 단백질의 발현은 서양 블로팅에 의해 확인되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 대표적인 효모 독성 결과. 관심 있는 이펙터 단백질을 pYesNTA-Kan. 시퀀스 검증 플라스미드로 복제하였고, 세포세레비시아아로 변형시키고 변질제가 우라-포도당 및 갈락토제 한천에서 연속적으로 희석및 발견되어 독성을 평가하였습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 효모 서프레서드 화면 개요. 관심 대상 유전자를 pYesNTA-Kan으로 복제하고 플라스미드를 S. 세레비시아로변형시켰다. 변질제는 연속적으로 희석되어유라에서 발견되었습니다 - 포도당과 갈락토제 한천은 독성을 평가합니다. 독성 이펙터 단백질에 의해 표적화된 경로를 확인하기 위해, 독성 단백질을 발현하는 효모 균주를 효모 게놈 라이브러리로 형질전환하였다. 식민지는 우라- 루- 갈락토제 한천에 패치하고 독성을 평가하기 위해 발견되었다. 플라스미드는 이펙터 단백질의 독성을 억제하는 것들로부터 분리되었다. 플라스미드는 독성 효모 균주로 변형되어 단리된 플라스미드가 억제기인지 확인하였다. 서프레서로부터의 플라스미드는 존재하는 효모 ORFs를 식별하기 위해 서열되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 변형된 효모 독성 및 억제기 스크린을 사용하여 세균 효과 기 단백질에 의해 표적으로 하는 호스트 생물학 통로를 확인하기 위한 단계별 절차를 설명합니다. 사용되는 효모 균주, S. 세레비시아 W303은 우라실과 류신 모두에 대한 보조 영양입니다. 유라실 보조축은 류신 보조증이 효모 게놈 라이브러리 벡터 pYep13을 선택하기 위해 사용되는 동안 류신 보조증이 사용되는 동안 pYesNTA-Kan 벡터상에서 관심 있는 단백질을 운반하는 효모를 선택하는 데 사용된다. 효모 게놈 라이브러리 플라스미드는 3-13 ORFs를 운반하므로 각 ORF는 p415-ADH 벡터6 또는 이와 유사한 벡터로 개별적으로 복제하고 독성 효모로 재형질하여 진정한 억제자인 것을 식별해야 합니다. 숙주 생물학적 경로를 나타내는 몇몇 억제기를 식별하는 것이 일반적이다. 서프레서들은 때때로 관심 있는 세균성 단백질의 직접적인 결합 파트너가 될 수 있지만, 항상 그런 것은 아니다.
pYesNTA-Kan에 관심 있는 세균성 단백질을 운반하는 효모 클론을 생성하는 것은 첫 번째 주요 단계이며 독성을 운반하는 효모에 대한 강한 부정적인 선택이 있기 때문에 가능한 한 빨리 이러한 클론의 무결성을 보존하기 위해 세심한주의를 기울여야합니다. 의도적 인 갈락토오스 유도없이 단백질, 그리고 그들은 플라스미드를 잃을 수 있습니다. 때때로 효모가 드롭 아웃 미디어에서 선택하에 유지되는 경우에도 플라스미드 손실이 있습니다. 상기 방법은 이전에 벡터를 선형화하고 이를 효모 게놈1내에 통합함으로써 플라스미드 손실의 발생을 감소시키는 것으로 보고되었다.
이러한 기술의 주요 단점은 박테리아 이펙터 단백질의 과발현이 효모에서 관찰 가능하고 일관된 성장 결함을 유발하는 경우에만 서프레서 스크린이 의미 있는 데이터를 산출한다는 것입니다. 이 방법의 주요 어려움은 서프레서가 식별되지 않는 경우입니다. 억제기를 식별하지 못하는 것이 생물학적 이유 또는 기술적 문제로 인한 것인지 여부를 판단하기는 어렵습니다. 생물학적 관점에서 볼 때, 관심 있는 단백질은 유전체 라이브러리의 단백질이 독성을 현저히 억제할 수 없을 정도로 독성이 있을 수 있으며, 표적 경로는 구조할 수 없거나 수많은 공동 발현이 있을 수 있습니다. 독성 효과를 극복하기 위해 필요한 수 있습니다. 해부할 정의되지 않은 변수가 많기 때문에 생물학적 설명에 접근하는 것은 쉽지 않습니다. 확립된 프로토콜이 있기 때문에 기술 설명을 탐색하는 것은 훨씬 더 견인 가능한 접근 방식입니다. 기술적 관점에서 볼 때, 억제기를 식별하지 못하는 것은 효모 게놈 라이브러리의 낮은 변형 효율의 결과일 가능성이 높습니다. 이 프로토콜은 pYEp13에서 ATCC S. 세레비시아 AB320 부분적으로 소화된 게놈 라이브러리를 사용합니다. 다른 라이브러리는 다른 벡터뿐만 아니라 충분할 수 있지만 이 프로토콜은 특히 ATCC 라이브러리를 사용하며 대체 라이브러리 또는 벡터 소스를 보고하는 연구가 현재 게시되지 않았습니다. 효모 게놈의 커버리지가 적어도 10 배여야하거나 과소 표현이 억제제의 식별을 방해 할 수 있음을 강력히 권장합니다. 변환 효율성이 감소하면 이러한 수치가 1배 미만으로 감소할 수 있습니다. 따라서, 효모 게놈의 일부가 억제기 화면에서 표현되지 않을 수 있다. 낮은 변환 효율은 잘못된 시약 이나 열악한 라이브러리 준비를 포함한 많은 문제로 인해 이루어질 수 있습니다. 이 방법은 주로 먼저 힐 외7에의해 제시 DMSO / LiAc 변환 방법을 준수합니다 . 새로운 DMSO, 50% PEG 및 신선한 청어 정자 DNA를 구입하고 변형을 위해 제조하고 시약의 질에 오염 또는 저하를 감소시키기 위하여 이 계산을 위해 독점적으로 이용되는 것이 좋습니다. DMSO는 흡습성이 뛰어나고 대기중의 물을 쉽게 흡수합니다. 따라서 용기 뚜껑이 반복적으로 열리고 대기에 노출되지 않도록 많은 개별 적인 용도로 사용하는 것이 좋습니다. 고품질 청어 정자 DNA는 -20 °C에서 저장될 수 있고 새로운 준비는 각 변환을 위한 주식에서 준비되어야 하더라도, 몇 년 동안 사용하기 위해 적당합니다 남아 있습니다. 일단 끓이고 냉각되면 청어 정자 DNA를 다시 삶거나 재사용해서는 안되므로 필요한 것만 제거하고 현재 변형에 필요한 것보다 더 많은 것을 만들지 않는 것이 가장 좋습니다. 세부 사항에주의하면 효모의 변형 효율을 크게 향상시키고 억제기를 식별 할 수있는 기회를 향상시킬 수 있습니다.
효모 pYep13 벡터가 3−13 개의 다른 효모 ORF를 운반한다는 점을 고려할 때, 가양성 플라스미드의 수를 줄이는 것이 억제기를 식별하는 데 가장 중요합니다. 효모는 유사한 벡터의 여러 복사본을 차지하여 항구할 수 있는 반면, 플라스미드 비호환성과 관련된 일반적인 지혜는 전통적으로 대장균이 한 번에 동일한 복제(ORI)의 기원을 가진 한 가지 유형의 플라스미드만 유지한다는 것을 지시합니다. 항상 그렇지는 않지만. 이는 서프레서 후보를 식별하려고 할 때 주요 문제가 될 수 있습니다. 억제효모 클론이 확인되면 플라스미드가 추출되어 대장균으로 변형되어 번식및 후속 시퀀싱을 통해 식별됩니다. 후보 서프레서 플라스미드가 분리되어 대장균으로변형되면 개별 클론이 운반될 수 있기 때문에 적어도 5개의 대장균 콜로니를 시퀀싱을 위해 선택되는 것이 좋습니다. 다른 플라스미드. 대장균은 한 번에 하나의 플라스미드만 전파할 수 있어야 하기 때문에 효모 분리가 여러 플라스미드를 생성하는 경우 플레이트의 다른 대장균 클론은 한 번에 하나만 운반해야 합니다. 따라서 대장균의 정상적인 변형 효율에 기초하여 5개의 콜로니를 선택하는 것은 클론이 동일하거나 다른 플라스미드를 운반하고 있는지 를 보여주어야 한다. 대장균에서플라스미드의 시퀀싱 후 여러 플라스미드가 발생하면 각각 독성 효모 클론으로 변형되어 성장 결함을 구출하기 위해 평가되어야합니다. 더욱이, 단 하나의 억제기 플라스미드만 확인되더라도, 플라스미드를 독성 클론으로 의한 엄격하고 재현성 재변환을 위해 권장된다.
효모 억제기 분석기는 매우 큰 실험이며 적절한 시간과 물질을 그에 따라 계획해야 한다. 이 프로토콜은 엄격하게 준수해야하는 많은 세부 사항을 포함하고 이러한 분석 실험을 수행하는 연구원은 신중하게 읽고 분석실험을 시작하기 전에 전체 프로토콜을 볼 것이 좋습니다. 이것은 다른 온도에서 경작 될 필요가 박테리아와 효 모를 모두 포함 하 여 다분질 절차. 효모에서 플라스미드를 분리하는 것은 때로는 힘든 세포벽으로 인해 어려울 수 있으며 DMSO를 사용하면 더 높은 변형 효율을 달성할 수 있습니다.
효모 독성 및 억제기 스크린의 가장 큰 장점 중 하나는 세균 이펙터가 표적 화질 검출을 위해 임의의 상당한 양의 시간 동안 숙주 기판에 물리적으로 결합할 필요가 없다는 것이다. 연구의 작은 소수만이 또는 유사한 기술을 사용하여보고1-5. 그러나, 세균성 이펙터 단백질의 결합 파트너를 위해 가리기 위하여 호스트 통로 및 많은 기술을 확인하는 기술의 보고가 있습니다. Kramer 등은 세균 효과 단백질에 의해 표적경로를 확인하기 위한 새로운 시스템 생물학 접근법을 보고했다8. 이 기술은 Shigella 이펙터 Osp4에 민감한 돌연변이체에 대해 스크리너팅하기 위해 S. 세레비시아의 하플로이드 결실 균주 컬렉션을 사용하였다. 이 기술을 사용하여, Osp4는 숙주 세포에서 선천적 면역의 MAPK 신호 및 감쇠의 조절에 연결되었다. 어레이 기반, 높은 처리량, 자동화된 효모-2 하이브리드 스크린은 이제 수백만 개의 숙주 단백질에 대해 동시에 많은 것을 스크리닝함으로써 가식성 세균 효과제 결합 파트너를 신속하게 식별할 수있다 9. 유사하게, 질량 분석과 결합된 고처리량 면역 침전은 세균효과단백질(10)의전체 패밀리의 가설 결합 파트너를 질량으로 식별하는데 사용되고 있다. 이러한 연구의 대부분은 이펙터 단백질 특성화의 시간표를 가속화 할 수 있지만, 그들은 거의 생리 적 과정이 조작되고 이러한 상호 작용의 전체적인 결과가 무엇인지에 대한 통찰력을 제공하지 않습니다. 따라서, 효모 독성 및 억제제 스크린과 같은 기술은 이러한 이펙터 단백질에 의해 조작되는 세포 과정을 조명하는 데 필수적이다. 어떤 시점에서, 세균성 이펙터 단백질에 의해 표적으로 한 결합 파트너 또는 통로를 확인하는 관측은 이 시험관 내 사실 인정이 생리적으로 관련있는 시나리오에서 참을 지 결정하기 위하여 세포 감염 모형으로 돌아갈 필요가 있습니다. C. trachomatis 같이 의무적인 세포내 병원체의 유전 조작은 최근까지 중요한 장애물이 되었습니다11-15 및 이펙터 단백질을 연구하기 위하여 사이트 특정 돌연변이의 생성은 가능하지 않았습니다. 그러나 지난 몇 년 동안, 클라미다이얼 돌연변이를 생성하고, 그(것)들을 보완하고, 표적 단백질을 과발현하는 혁명이 일어났습니다. 이러한 최근의 발전은 독성 및 억제기 스크린을 이용한 연구에서 파생된 정보의 가치를 크게 향상시켰으며, 이제 는 효모에서 감염으로 직접 이동하여 결과의 유효성을 조사할 수 있게 되었다.
공개
저자는 그들이 경쟁 적인 재정적 이익이 없다고 선언합니다.
감사의 말
이러한 기술에 도움을 준 셸비 앤더슨, 애비 맥컬로프, 로렐 우즈에게 감사드립니다. 이 연구는 메리 M. 웨버에 미생물학 및 면역학의 아이오와 대학에서 시작 자금에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| Agar | Fisher Scientific | BP2641500 | |
| Galactose | MilliporeSigma | G0750-1KG | |
| GeneJet Gel extraction kit | ThermoFisher Scientific | K0691 | |
| GeneJet PCR purification kit | ThermoFisher Scientific | K0701 | |
| GeneJet plasmid miniprep kit | Thermo | K0503 | |
| Glucose | MilliporeSigma | G8270-1KG | |
| Herring Sperm DNA | Promega | D1811 | |
| KpnI-HF | New England Biolabs | R3142S | |
| Lithium acetate dihydrate | MilliporeSigma | L6883-250G | |
| Peptone | Fisher Scientific | ||
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530 | |
| Poly(ethylene glycol) 3350 | MilliporeSigma | 1546547-1G | |
| pYep13 | ATCC | 37323 | |
| T4 DNA ligase | New England Biolabs | M0202S | |
| Tryptophan | MilliporeSigma | 470031-1G | |
| XhoI-HF | New England Biolabs | R0146S | |
| Yeast extract | Fisher Scientific | BP1422-500 | |
| Yeast miniprep kit | Zymo | D2001 | |
| Yeast nitrogen base without amino acids | MilliporeSigma | Y0626-250G | |
| Yeast Synthetic Drop-out Medium Supplements | MilliporeSigma | Y1501-20G | without uracil |
| Yeast Synthetic Drop-out Medium Supplements | MilliporeSigma | Y1771-20G | without uracil, leucine, tryptophan |
참고문헌
- Tan, Y., Luo, Z. Q. Legionella pneumophila SidD is a deAMPylase that modifies Rab1. Nature. 475 (7357), 506-509 (2011).
- Guo, Z., Stephenson, R., Qiu, J., Zheng, S., Luo, Z. A Legionella effector modulates host cytoskeletal structure by inhibiting actin polymerization. Microbes and Infection. 16 (3), 225-236 (2014).
- Tan, Y., Arnold, R. J., Luo, Z. -Q. Legionella pneumophila regulates the small GTPase Rab1 activity by reversible phosphorylcholination. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 21212-21217 (2011).
- Weber, M. M., et al. The type IV secreted effector protein CirA stimulates the GTPase activity of RhoA and is required for virulence in a mouse model of Coxiella burnetii infection. Infection and Immunity. 84, (2016).
- Faris, R., et al. Chlamydia trachomatis CT229 subverts Rab GTPase-dependent CCV trafficking pathways to promote chlamydial infection. Cell Reports. 26, 3380-3390 (2019).
- Mumberg, D., Müller, R., Funk, M. Yeast vectors for the controlled expression of heterologous proteins in different genetic backgrounds. Gene. 156, 119(1995).
- Hill, J., Donald, K. A. G., Griffiths, D. E. DMSO-enhanced whole cell yeast transformation. Nucleic Acids Research. 19 (20), 41070(1991).
- Kramer, R. W., et al. Yeast Functional Genomic Screens Lead to Identification of a Role for a Bacterial Effector in Innate Immunity Regulation. PLoS Pathogens. 3 (2), 21(2007).
- Häuser, R. T. S., Rajagopala, S. V., Uetz, P. Array-Based Yeast Two-Hybrid Screens: A Practical Guide. Two Hybrid Technologies: Methods and Protocols, Methods in Molecular Biology. , 21-38 (2012).
- Mirrashidi, K. M., et al. Global mapping of the inc-human interactome reveals that retromer restricts chlamydia infection. Cell Host and Microbe. 18 (1), 109-121 (2015).
- Wang, Y., et al. Development of a transformation system for chlamydia trachomatis: Restoration of glycogen biosynthesis by acquisition of a plasmid shuttle vector. PLoS Pathogens. 7 (9), 1002258(2011).
- Mueller, K. E., Wolf, K., Fields, K. A. Gene deletion by fluorescence-reported allelic exchange mutagenesis in Chlamydia trachomatis. mBio. 7 (1), 1-9 (2016).
- Johnson, C. M., Specific Fisher, D. J. Site-Specific, Insertional Inactivation of incA in Chlamydia trachomatis Using a Group II Intron. PLoS ONE. 8 (12), 83989(2013).
- Weber, M. M., et al. Absence of specific Chlamydia trachomatis inclusion membrane proteins triggers premature inclusion membrane lysis and host cell death. Cell Reports. 19 (7), 1406-1417 (2017).
- Weber, M. M., et al. A functional core of IncA is required for Chlamydia trachomatis inclusion fusion. Journal of Bacteriology. 198 (8), 1347-1355 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유