Method Article
Otomatik görüntü Işleme kullanarak Fission ve budding yeasts lipid damlacık Içeriğinin Analizi
Bu Makalede
Özet
Burada, floresan mikroorganizma ve tomurcuklanan Maya hücrelerinin floresans mikroskopisi görüntülerinin otomatik algılama ve niceliksel tanımı ile ilgili bir MATLAB uygulaması sunuyoruz.
Özet
Lipid metabolizması ve düzenlenmesi hem temel hem de uygulamalı yaşam bilimleri ve biyoteknolojinin ilgisini çekmektedir. Bu bağlamda, çeşitli maya türleri lipid metabolik araştırma modelleri veya endüstriyel lipid üretimi için kullanılır. Lipid damlacıkları son derece dinamik depolama organları ve onların hücresel içerik lipid metabolik durumun uygun bir okuma temsil eder. Floresan mikroskopisi, hücresel lipid damlacıkları nicel analizinde tercih edilen bir yöntemdir, çünkü yaygın olarak kullanılabilir donanıma dayanır ve bireysel lipid damlacıkları analizine izin verir. Ayrıca, mikroskobik görüntü analizi, genel analiz verimi büyük ölçüde artan otomatik olabilir. Burada, üç farklı model Maya türü içinde bireysel lipid damlacıkları otomatik algılama ve niceliksel açıklaması için deneysel ve analitik bir iş akışı tarif: fisyon Mayalar şizofrik pombe ve Şizofreyeve tomurcuklanan Maya Saccharomyces cerevisiae. Lipid damlacıkları bodipy 493/503 ile görselleştirilebilir ve hücre sınırlarının tanımlanmanıza yardımcı olmak için kültür medyasına hücre geçirmez floresan dekstran eklenir. Hücreler yeşil ve mavi kanallarda 3D epifluorescence mikroskopiye tabi tutulur ve elde edilen z yığını görüntüleri bir MATLAB boru hattı tarafından otomatik olarak işlenir. Prosedür, büyük elektronik tabloda veya istatistiksel paketlerdeki akış analizleri için uygun olan sekmeli bir formatta hücresel lipid damlacık içeriği ve bireysel lipid damlacık özellikleri üzerinde zengin nicel verileri çıkarır. Hücre lipid metabolizmasını etkileyen çeşitli koşullarda lipid damlacık içeriğinin örnek analizlerini sağlıyoruz.
Giriş
Lipidler hücresel enerji ve karbon metabolizması, membran bileşenlerinin sentezini ve biyoaktif maddelerin üretimini önemli roller oynar. Lipid metabolizması çevresel koşullara, besin mevcudiyeti ve hücre döngüsü aşaması1' e göre ince ayarlı. İnsanlarda lipid metabolizması obezite, tip II diyabet ve kanser2gibi hastalıklara bağlı olmuştur. Endüstride, Mayalar gibi mikroorganizmalar tarafından üretilen lipidler, umut verici bir yenilenebilir dizel yakıt kaynağını temsil eder3. Hücreler sözde lipid damlacıkları (LDs) nötr lipidler depolar. Bu evrimsel olarak koruyucu organları triakilgliserler, steril esterler, bir dış fosfolipid Tek tabakalı ve ilişkili proteinler1oluşur. LDs endoplazmik reticulum kaynaklanan, hücre döngüsü veya büyüme faz dinamikleri uygulamak, ve hücresel lipid homeostazı için önemlidir1. LD numarası ve morfoloji, çeşitli büyüme koşullarında veya mutantların bir panelini taramasında lipid metabolizmasını asırken uygun bir vekil olarak kullanılabilir. Dinamik doğası göz önüne alındığında, bireysel LDs özelliklerini analiz yeteneğine teknikleri lipid metabolizması çalışmaları özellikle ilgi vardır.
Çeşitli maya türleri lipid ile ilgili metabolik yolları ve düzenlemeleri tanımlamak için kullanılan, ya da biyoteknolojide ilginç bileşikler veya yakıtlar üretmek için kullanılan1. Ayrıca, model Mayalar için, gibi tomurcuklanan Maya Saccharomyces cerevisiae veya uzaktan ilgili fisyon Maya mıtosaccharomyces pombe, Genom-geniş silme gerinim kütüphaneler kullanılabilir yüksek verim için kullanılabilir ekranlar4,5. Son zamanlarda ld kompozisyon ve dinamikleri S. pombeaçıklanan6,7,8,9, ve lipid metabolizması ile ilgili mutantlar gelişmekte olan model Maya izole edilmiştir Asoaccharomyces multiflorum10.
LD içerik ve dinamikleri incelemek için sayısız teknikler mevcuttur. Çoğu, Nile Red veya BODIPY 493/503 gibi lipophilik boyalar ile LDs boyama çeşit istihdam. İkincisi daha dar uyarma ve emisyon spektrumunu gösterir ve fosfolipidler (membranların)11' in aksine nötr lipidlere (LDs) doğru özgüllüğü artırmıştır. Fluorimetrik ve akış-sitometri yöntemleri, depolama lipid içeriğini etkileyen genler ve büyüme koşullarını ortaya çıkarmak için çeşitli mantar türlerde başarıyla kullanılmıştır12,13,14,15. Bu yöntemler yüksek verimlilik uygulamaları için uygun olmakla beraber, hücrelerde bireysel LDs 'nin sayılar ve morfolojisi ölçülemez, bu da büyüme koşulları ile genotürleri arasında önemli ölçüde farklılık gösterebilir. Tutarlı Raman saçılma veya dijital holografik microskopi ld düzeyinde veri verim, ancak özel pahalı ekipman16,17,18gerektiren etiket içermeyen yöntemlerdir. Diğer taraftan floresans mikroskobu, LD içeriğiyle ilgili ayrıntılı veriler sağlayabilir, yaygın olarak kullanılabilen enstrümanlar ve görüntü analiz yazılım araçlarını kullanarak. Çeşitli analiz iş akışları var ki, görüntü verilerinden hücre/ld algılamada farklı derece sofistike ve otomasyon özelliğine sahiptir ve büyük LDs19,20 ile Metazoan hücreler gibi değişik hücre türleri için optimize edilmiştir , 21ya da tomurcuklanan17,22,23. Bu yaklaşımlardan bazıları yalnızca 2D (örneğin, maksimum projeksiyon görüntülerde) çalışır, bu da hücresel LD içeriğini güvenilir bir şekilde tanımlamayabilir. Bilgi için, herhangi bir alet ld içerik ve morfoloji fisyon Maya mikroskobik veri belirlenmesi için yok. Otomatik ve sağlam LD seviyesi analizlerinin geliştirilmesi, yüksek hassasiyet ve gelişmiş istatistiksel güç getirir ve çoklu Maya türlerinde ideal olarak nötr lipid içeriği hakkında zengin bilgiler sağlar.
Maya hücrelerinin 3D floresan mikroskopisi görüntülerden LD içerik analizi için bir iş akışı geliştirdik. Canlı hücreler, LDs 'nin görselleştirilmesi ve sırasıyla hücre sınırlarını belirlemek için bodipy 493/503 ve Cascade Blue dekstran ile lekelenecektir. Hücreler cam slaytlar üzerinde immobilize ve standart bir epifluorescence mikroskop kullanarak z-yığını görüntüleme tabi tutulur. Görseller, istatistiksel analizler için yaygın olarak kullanılan (ticari) bir paket olan MATLAB 'de uygulanan otomatik bir boru hattı tarafından işlenir. Ardışık düzen, Görüntü önişleme, segmentasyon (hücreler vs. arka plan, ölü hücrelerin kaldırılması) ve LD kimliği gerçekleştirir. LD boyutu ve floresan yoğunluğu gibi zengin LD düzeyinde veriler, daha sonra büyük elektronik tablo yazılım araçlarıyla uyumlu sekmeli bir formatta sağlanır. İş akışı, azot kaynağının mevcudiyeti S. pombe24' te lipid metabolizmasında etkisini belirlemek için başarıyla kullanıldı. Şimdi, s. pombe, s. multiflorum ve s. cerevisiae'deki iş akışının işlevselliğini, hücresel ld içeriğini etkileyen büyüme koşullarını veya mutantları kullanarak gösteriyoruz.
Protokol
1. çözüm ve medyanın hazırlanması
-
Lipid boyama çözeltisi hazırlayın.
- Hisse senedi lipid boyama çözeltisi hazırlamak için 10 mg BODIPY 493/503 susuz DMSO (son konsantrasyon 1 mg/mL) on mL içinde çözülür. Tartım sırasında malzemenin kaybını önlemek için 10 mg BODIPY 493/503 şişenin tüm içeriğini çözün.
Dikkat: DMSO deriden geçebilir. Uygun kişisel koruyucu ekipman giyin. - 1 mg/mL BODIPY 493/503 stok çözeltisi ve 900 μL susuz DMSO (son konsantrasyon 0,1 mg/mL) 100 μL 'yi karıştırarak çalışma lipid boyama çözümünü hazırlayın.
- Hisse senedi ve çalışma çözümlerini ve-20 °C ' de depolayın.
Not: Çözünmüş BODIPY 493/503,-20 °C ' de birkaç yıl istikrarlı. Ancak, çözümün nem ve ışıkta korunması gerekir.
- Hisse senedi lipid boyama çözeltisi hazırlamak için 10 mg BODIPY 493/503 susuz DMSO (son konsantrasyon 1 mg/mL) on mL içinde çözülür. Tartım sırasında malzemenin kaybını önlemek için 10 mg BODIPY 493/503 şişenin tüm içeriğini çözün.
- Hücre sınırı görselleştirme için stok çözüm hazırlamak için, çözülür 25 Cascade mavi dekstran mg (tüm şişe) içinde 2,5 ml deiyonize su (son konsantrasyon 10 mg/ml). Hisse senedi çözümünü ve deposundan-20 °C ' de ışık korumalı.
- Mikroskop slayt kaplama çözeltisi hazırlamak için, 5 mL deiyonize su (son konsantrasyon 1 mg/mL) içinde soya lağı 5 mg çözülür. Ayin solüsyonu ve-80 °C ' de depolar.
Not: Saat-80 °c ' de birkaç yıl boyunca lektin çözeltisi kararlı. Şu anda kullanılmakta olan aliquots-20 °C ' de depolanabilir. -
Yetiştirme medyasını hazırlayın.
- S. pombe ve s. japonicus için karmaşık YES ekimi medyası 400 ml hazırlamak Için, bir 500 ml şişe ve Otoklav içinde deiyonize su 340 ml (auxotrofik mutantlar için gerekirse) maya EKSTRESI ve 0,1 g SP takviyeleri 2 g çözülür. Aseptik koşullarda ayrı olarak Otoklavlanmış veya filtre Sterilized glikoz% 20 (w/v) 60 ml ekleyin.
- S. pombe ve s. japonicus için tanımlanan EMM ekimi Orta 400 ml hazırlamak Için, bir 500 ml şişe ve Otoklav içinde deiyonize su 360 ml dekstroz olmadan EMM suyu 4,9 g çözülür. Aseptik koşullarda ayrı olarak Otoklavlanmış veya filtre Sterilized glikoz% 20 (w/v) 40 ml ekleyin.
Not: S. pombe ve s. multiflorum ekimi genel kurallar için sırasıyla25 ve26bakın. - Saccharomyces cerevisiaeiçin karmaşık YPAD yetiştirme ortamının 300 ml hazırlamak için, bir 500 ml şişe ve Otoklav içinde 270 ml deiyonize su, 6 gr pepton ve 30 mg adenin sülfat, 3 g maya özü, çözülür. Aseptik koşullarda 30 ml% 20 (w/v) ayrı Otoklavlanmış veya filtre sterilize glikoz ekleyin.
- S. cerevisiae için tanımlanan minimal orta 300 ml hazırlamak için, bir 500 ml şişe ve otoklav Içinde 270 ml deiyonize su (amino asitler olmadan) Maya nitrojen tabanı 2 g çözülür. Aseptik koşullarda 30 ml% 20 (w/v) ayrı Otoklavlanmış veya filtre sterilize glikoz ekleyin.
Not: S. cerevisiae ekimi hakkında genel yönergeler için bakınız27.
2. hücre ekimi
-
S. pombe veya s. multiflorum 'u üstel veya erken sabit aşamaya yetiştirmek.
- Sabah, taze fisyon Maya biyokütle ile Evet orta 5 ml aşılamak. 32 °C ' de birkaç saat boyunca sallama (180 rpm) ile kulbe yapın.
Not: Tüm yetiştirmeler için, uygun havalandırma sağlamak için kültür hacmi 10 kat sahip Erlenmeyer şişeler kullanın. Bazı laboratuvarlar 30 °c ' de fisyon mayını büyütmeyi tercih eder, ancak 32 °c ' nin ekimi sıcaklığı hücrelere zararlı etkileri olmadan daha kısa ikiye katlama süreleri ile sonuçlanır, böylece bir deney yapmak için gereken toplam süreyi azaltır25,28 . - Aynı günün geç öğleden sonra (ekimi en az 6 saat sonra), bir 10 mL final kültürü hacim için taze YES orta ile kültür seyreltir böylece istenilen optik yoğunluğa ulaşır (OD) (veya hücre/mL sayısı) ertesi sabah, ve s ile 32 °C içinde kuluçka (180 rpm). Seyreltme faktörü (kullanım denklem 1) doğru belirlemek için her kullanılan gerinim iki katına zaman bilmek avantajdır.

Burada vkültürü seyreltme için gerekli Preculture hacmi, vfinal yeni kültürün toplam hacmi (Standart yetiştirmeler IÇIN 10 ml), odfinal istenilen od ulaşmak için Ertesi sabah, odakım Şu anda ölçülen od preculture, t hasat kadar hücre büyüme zamanı, tlag lag faz süresi (Laboratuvar koşullarına bağlıdır, ihtiyacı ampirik olarak tanımlanabilir) ve tdt gerilimin ikiye katlama zamanı.
Not: Üstel fazlı hücreler analiz edilecek olduğunda, bu dramatik Hücre fizyolojisi (LD içeriği dahil) birkaç sonraki nesiller için değiştirir gibi precultures sabit aşamaya ulaşmak izin vermeyin. - Görüntüleme günü sabahı, kültür gerekli olandan biraz daha yüksek OD ulaştı (üstel fazlı hücreler durumunda), taze Evet ile seyreltmesi ve LDs boyama önce en az iki kat daha fazla kez kuluçka devam. Aksi takdirde doğrudan (Bölüm 3).
- Sabah, taze fisyon Maya biyokütle ile Evet orta 5 ml aşılamak. 32 °C ' de birkaç saat boyunca sallama (180 rpm) ile kulbe yapın.
-
S. cerevisiae 'yi üstel ve sabit aşamaya büyütmeye.
- Öğleden sonra, az miktarda taze tomurcuklanan Maya biyokütle ile 10 ml YPAD orta aşılamak ve sallama (180 rpm) ile 30 °c ' de gece inkük.
- Görüntüleme günü sabahı, 10 mL YPAD Orta içinde OD 0,1 için kültür seyreltmek ve gerekli OD (örneğin, OD 1 üstel faz için) büyür. Adım 2.1.2 ' de açıklandığı gibi herhangi bir kültür seyreltme gerçekleştirin. Boyama işlemine devam edin (Bölüm 3).
3. lipid damlacık boyama
- Her örnek için bir mikroskop kapak kayma hazırlamak görüntülenmiş. Yatay olarak konumlandırılmış pipet ucunun uzun tarafını kullanarak, 1 μL slayt kaplama çözümünü temiz bir kapak fişi üzerine yayın. Kaplama çözümünün tamamen kurumasına izin verin ve kapak fişelerini tozsuz bir ortamda saklayın.
Not: Cam kaydırakları ve kapakların kullanılması gerekirse önce temizlenebilir. Temizlik prosedürü, bulaşık deterjanı ile yıkanmak, su ile durulama, gecede% 3 hidroklorik asit içinde ıslatılması ve distile suyu ile yıkamadan oluşur. Temizlenmiş slaytlar ve coverfiş kullanım kadar saf etanol depolanır. - Hücre kültürünün OD veya hücre/mL sayısı, gerektiği gibi ölçün. Karşılaştırılabilir deneysel koşullar sağlamak için tüm test suşları arasında benzer değerlere ulaşmaya çalışın.
- Her hücre kültürünün 1,5 ml 'Lik mikro santrifüj tüpüne pipet 1 mL. Sadece S. cerevisiae için, slayt kaplama solüsyonu 5 μL ekleyin, kısa bir süre girdap ve 30 °c ' de 5 dak.
- Her kültürüne 1 μL lipid boyama çözeltisi ekleyin ve kısaca Vortex. Ardından 10 μL hücre sınırı görselleştirme çözümü ve Vortex kısaca ekleyin.
Not: Her iki lekelerin önceden karışık çözümlerini, bu BODIPY 493/503 flüoresan aşındırmasına yol açan şekilde hazırlamaz. - Santrifüjleme (1.000 x g, 3 dak, RT) ile hücreleri toplayın ve neredeyse tüm süpernatant Kaldır (~ 950 μL). Geri kalan supernatant hücreleri resuspend.
- 2 μL pipet yoğun hücre süspansiyonunun bir lağı kaplı kapak slip ve temiz bir mikroskop slayt üzerine yerleştirin. Hücreler bir monolayer oluşturmalıdır. Görüntüdeki eserler en aza indirmek için mümkün olduğunca çabuk mikroskobik (Bölüm 4) ilerleyin; aynı anda iki numune en fazla işlem.
4. mikroskop ve görüntüleme ayarı
-
Görüntüleme koşullarını optimize edin.
Not: mikroskobun ayarlanması, numunenin zarar görmesine ve sonuçları eğrilmesine neden olabilecek güçlü ışık kaynaklarına uzun pozlama gerektirir. Bu nedenle, LD ölçümü için daha fazla kullanılamaz özel bir örnek slayt kullanarak görüntüleme koşullarını ayarlayın.- Faz kontrastı veya diferansiyel parazit kontrastı (DıC) kullanarak hücrelere odaklanın.
Not: Faz kontrast veya DıC görüntüleri referans için alınabilir, ancak otomatik görüntü analizi adım sırasında kullanılmaz. - Tüm hücre hacminin yayılma z-yığını ayarlarını ayarlayın. Toplam dikey uzaklık hücre boyutuna bağlıdır; Optik dilim sayısı, hedefin sayısal Diyaframına bağlıdır (z eksenindeki nokta yayılma fonksiyonu). Odağı merkezi odak düzlemine göre taşımak için ayarlayın.
Not: En iyi dilim sayısı genellikle mikroskop kontrol yazılımı tarafından ayarlanır ve el ile hesaplanmalıdır gerekmez. Tipik hücre genişlikleri s. pombeiçin 3-5 μm, s. multiflorumiçin 4-7 μm ve s. cerevisiaeiçin 3-7 μm ' dir. - Görüntü LDs için, yeşil kanalda ışık yoğunluğu ve pozlama süresini ayarlayın (BODIPY 'nin uyarılması ve emisyon Maxima değeri sırasıyla 493 ve 503 nm 'dir).
Not: BODIPY 493/503 çok parlak bir fluorokrom; Ancak, aşırı güçlü ışık yoğunluğu ile hızla ağartabilir alabilirsiniz. Dahası, LDs canlı hücrelerde mobil, böylece pozlama süresini en aza indirmek ve tam yeşil kanal z-yığını ilk yakalama (mavi kanala geçmeden önce) bulanık eserler önlemek için. Ayrıca, doymuş pikselleri önlemek için sinyal yoğunluğu için kameranın doğrusal aralığını dikkate alın. - Görüntü hücre sınırlarını, mavi kanalda ışık yoğunluğu ve pozlama süresini ayarlamak (uyarma ve emisyon Maxima Cascade Blue dekstran vardır 400 ve 420 nm, sırasıyla).
Not: Mavi kanaldaki sinyal yoğunluğu görüntü segmentasyonu için gereklidir, ancak LD ölçümleme için kullanılmaz. Bu nedenle, bu kanalda en iyi ayarları analiz için önemli değildir. - Mümkünse, standart koşullarda birden fazla numunenin görüntülemelerini kolaylaştırmak için mikroskop kontrol yazılımında otomatik deneysel bir iş akışı oluşturun.
- Faz kontrastı veya diferansiyel parazit kontrastı (DıC) kullanarak hücrelere odaklanın.
- Görüntüleme koşulları iyileştirildikten sonra, ölçme için kullanılacak görüntü örnekleri. Hücrelere odaklanın ve bunları yeşil ve mavi kanallarda adım 4,1 ' de açıklandığı şekilde görüntü.
Not: Tüm görüntüler, örnekler arasında karşılaştırmaya izin vermek için aynı ayarları kullanarak elde edilmelidir. Sağlam, temsili veriler elde etmek için örnek başına birden fazla görünüm alanı görüntü. - Mavi ve yeşil kanal z-yığını görüntüleri 16-bit çok katmanlı TIFF dosyaları (yani, görünüm alanı başına iki dosya) olarak kaydedin. İlgili dosya adlarına "yeşil" veya "mavi" sözcükleri ekleyin. Görüntü analizine devam edin (Bölüm 5).
5. görüntü analizi
-
Elde edilen görüntülerin kalitesini görsel olarak kontrol edin.
- Imagej29,30 veya diğer uygun görüntü analiz yazılımında mikroskobik görüntüleri açın.
- Satın alma sırasında taşınan önemli sayıda hücre içeren tüm görüntü yığınlarını kaldırın (ve böylece bulanıklık yapıları oluşturulur).
- Mavi kanalda yüksek floresan hücre içermeyen parçacıklar içeren herhangi bir görüntü yığınını kaldırın (örn., mikroskop kaydırağında kir veya kapak kayma, ekimi ortamında kirleri).
Not: Mavi kanaldaki çok parlak hücre dışı nesneler hücre algılama yapıları oluşturabilir veya çevresindeki hücrelerin algılanmasını engelleyebilir. - Ölü hücrelerin büyük bir kısmını içeren herhangi bir görüntü yığınını kaldırın (yani, canlı hücrelere kıyasla artan mavi floresans içeren hücreler).
Not: Örnekteki ölü hücrelerin küçük bir kısmı varlığı genellikle bir sorun değildir ve bu hücreler analiz sırasında otomatik olarak atılır, bazı ölü veya ölüyor hücreler bazen segmentasyon algoritması tarafından canlı hücreler olarak tanınabilir ve böylece bildirilen sonuçları eğriltme.
-
MATLAB yazılımındaki görüntüleri analiz edin.
- Bir ana klasör oluşturun ve tüm MATLAB komut dosyalarını bu konuma kopyalayın.
- Bir alt klasör ("pombe", "cerevisiae" veya "japonicus") oluşturun ve giriş TIFF görüntü dosyalarını bu konuma kopyalayın.
- MATLAB Başlat, açık Script MAIN. m ve çalıştırın. Menüde analiz edilecek maya türleri seçin ve görüntü işleme başlar.
Not: Hücre ve LD algılama için gerekli parametrelerin bazıları belirli türler için önceden ayarlanmıştır, diğerleri görüntü işleme sırasında otomatik olarak belirlenir. Önceden ayarlanan değerler ampirik olarak belirlendi ve objektif büyütme, kamera tipi ve hassasiyet ve görüntüleme ayarları gibi çeşitli faktörlere bağlıdır. Gerekirse, kullanıcılar kendi deneysel kurulumunu daha iyi yansıtacak şekilde organizmaya özgü hazır ayarları değiştirmek için komut dosyalarını düzenleyebilir. Yani, hücre tanıma kabul edilebilir nesne boyutları "minArea" ve "maxArea" parametreleri tarafından verilir ve nesne sınırları içinde doldurulmuş birimin en az kesir "Solidity" parametresi tarafından verilir. LD tanıma için, parlaklık eşik "TH" parametresi tarafından verilir (değeri çoğunlukla görüntü bit derinliği ve floresan sinyal yoğunluğu tarafından etkilenir), ve maksimum kabul edilebilir LD boyutu "MaxArea" parametresi tarafından verilir. - Elektronik tablo Düzenleyicisini veya istatistiksel paketi kullanarak çıktı dosyalarını gerektiği gibi inceleyin ve işleyin; iş akışı, noktalı virgülle ayrılmış CSV dosyaları ve algılanan hücre nesneleri ve LDs ile bölümlenmiş TIFF dosyaları üretir.
Not: İş akışı, her hücre nesnesinin birden çok bitişik hücreden oluşabileceği arka plan ve hücre nesnelerine görüntüleri kesebilir. Bu nedenle, "xxxx_cells. csv" dosyalarında çıktı tek hücreli verileri temsil etmez ve yalnızca birim-hücre-birim ölçümleri hesaplamak için kullanılmalıdır.
Sonuçlar
Tüm prosedür Şekil 1 ' de (tomurcuklanan Maya iş akışı benzerdir), ve aşağıda biz nasıl iş akışı çeşitli koşullarda üç farklı maya türleri ld içeriği incelemek için kullanılabilir örnekler sağlamak için fisyon mayıları özetlenmiştir bilinen hücresel LD içeriğini etkilemek için. Her örnek tek bir biyolojik deneyi temsil eder.
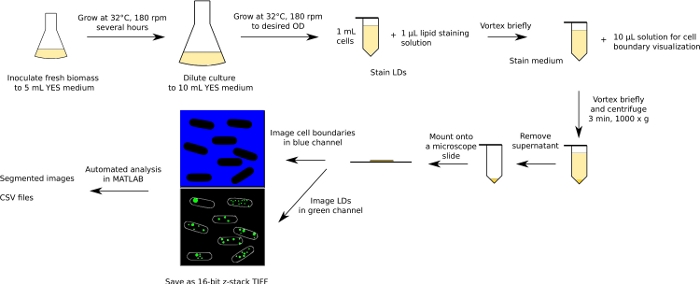
Şekil 1: deneysel ve analitik iş akışının Şematik diyagramı. Fisyon mayıları için iş akışı örnek olarak gösterilir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
İlk olarak S. pombe hücrelerini analiz ettik (Şekil 2). Vahşi tip (WT; h + s) hücreler karmaşık YES orta veya tanımlı EMM ortamında üstel fazda büyüdü. Evet ile karşılaştırıldığında, EMM 'de daha az LDs ve hücre hacmi birimi başına daha yüksek LD boyama yoğunluğu algılandı (Şekil 2a-C). Dahası, EMM ortamında oluşan bireysel LDs daha büyük ve toplam boyama yoğunluğu (Şekil 2D, E) olarak gösterilir. Bu, EMM24' te yetiştirilen hücrelerde artan depolama lipid içeriğinin önceki bulguları ile anlaşılmıştır. Ppc1 geni, koenzim bir sentezi için gerekli olan bir fosfopantothenate-sistein ligaz kodlıyor. Sıcaklığa duyarlı ppc1-88 mutant, düşük BODIPY 493/503 sinyali (Şekil 2a) içeren hücrelerin bir örneğini sağlayarak,31kısıtlayıcı sıcaklıkta yetiştirilen ld içeriğinde belirgin bir düşüş gösterir. Buna göre, Wild tipine kıyasla (32 °C ' de yetiştirilen), 36 °C ' ye (Şekil 2D, E) geçiş sonrasında Evet olarak yetiştirilen ppc1-88 hücrelerinde daha düşük toplam boyama yoğunluğuna sahip küçük LDs tespit edildi birimi (Şekil 2B).
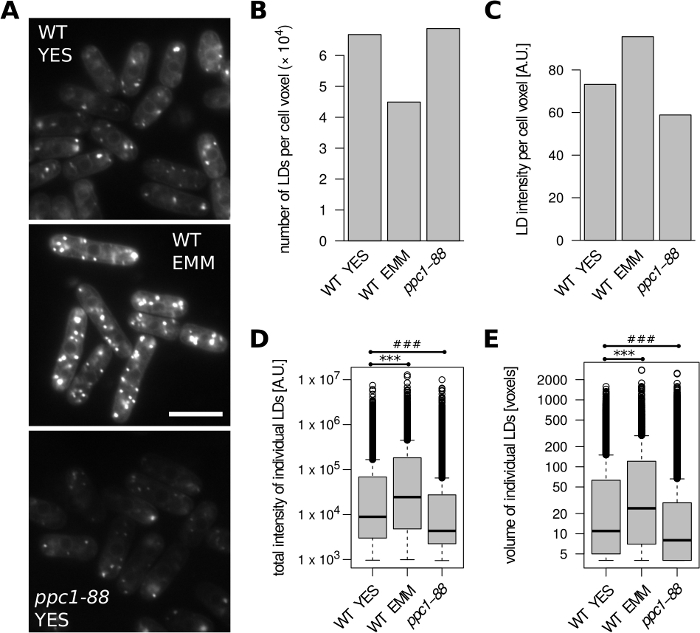
Şekil 2: büyüme ortamının ve lipid metabolizma mutasyonunun ld Içeriğine etkisi S. pombe. Vahşi tip (WT) ve ppc1-88 hücreleri, belirtildiği gıbı, Evet veya tanımlı EMM ortamında üstel aşamaya yetişir. WT hücreleri 32 °C ' de büyüdü. Sıcaklığa duyarlı ppc1-88 hücreler 25 °c ' de büyüdü ve analizinden 2 saat önce 36 °c ' ye geçti. (A) LDS, BODIPY 493/503 ile lekelenmiş temsili işlenmemiş mikroskobik görüntüler. Her koşul için tek bir optik dilim gösterilir; daha iyi hücre sınırlarını görselleştirmek için ters mavi kanal ile% 10 kaplama eklenmiştir. Ölçek çubuğu = 10 μm. (B) hücre hacmi birimi başına tanımlanan LDs sayısı. (C) hücre hacmi birimi başına tanımlanan LDs 'nin floresan yoğunluğu. (D) tanımlanan tüm LDs 'lerin toplam floresan yoğunluklarının dağılımları * * *, # # # eşleştirilmemiş Wilcoxon testi p = 1,7 x 10-107, p = 3,7 x 10-132, sırasıyla. (E) tüm tanımlanan LDs hacimleri dağıtımları. * * *, # # # eşleştirilmemiş Wilcoxon testi p = 6,8 x 10-71, p = 1 x 10-64, sırasıyla. B-E panellerindeki veriler sırasıyla WT YES, WT EMM ve ppc1-88 örnekleri için 242, 124 ve 191 hücre nesnelerinden türetilmiştir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
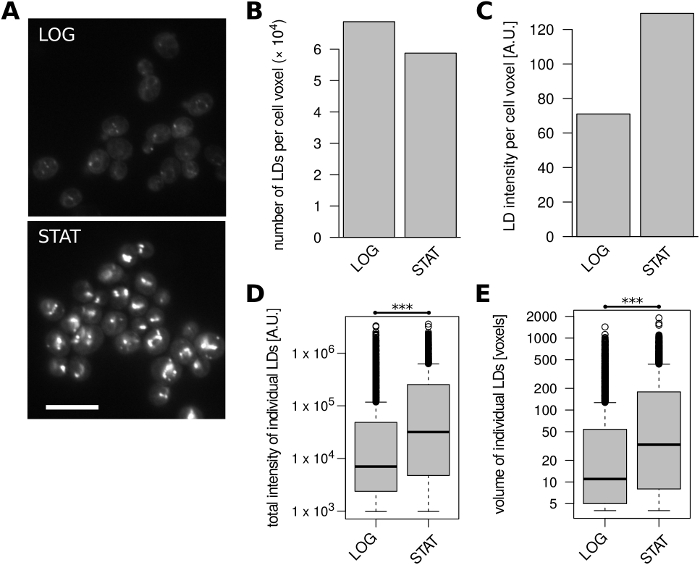
Sonra, S. multiflorum hücrelerinde (h+matsj-2017)32 Evet olarak yetiştirilen üstel ve erken sabit kültürlerden (Şekil 3A) ld içeriğini nicelik olarak belirlenmiştir. Sabit faza giren hücreler, katlanarak büyüyen hücrelere kıyasla hücre hacminin her bir birimi için belirgin olarak azalma gösterdi (Şekil 3B), hacim NORMALLEŞTIRILMIŞ ld floresan yoğunluğu iki koşul arasında biraz azalırken ( Şekil 3c). Erken sabit faz LDs genellikle orta boyutta daha büyüktür ve üstlere büyüyen hücrelerden LDs 'ye kıyasla orta derecede daha yüksek toplam floresan yoğunluğu vardı (şekil 3D, E).

Şekil 3: ld içeriği S. multiflorum hücreler büyüme aşaması ile değişiklikler. Katlanarak büyüyen (LOG) ve erken sabit faz (STAT) hücreleri analiz edildi. (A) LDS, BODIPY 493/503 ile lekelenmiş temsili işlenmemiş mikroskobik görüntüler. Her koşul için tek bir optik dilim gösterilir; daha iyi hücre sınırlarını görselleştirmek için ters mavi kanal ile% 10 kaplama eklenmiştir. Ölçek çubuğu 10 μm temsil eder. (B) hücre hacmi birimi başına tanımlanan LDs sayısı. (C) hücre hacmi birimi başına tanımlanan LDs 'nin floresan yoğunluğu. (D) tanımlanan tüm LDs 'lerin toplam floresan yoğunluklarının dağılımları * * * eşleştirilmemiş Wilcoxon testi p = 1,3 x 10-114. (E) tüm tanımlanan LDs hacimleri dağıtımları. * * * eşleştirilmemiş Wilcoxon testi p = 2,4 x 10-85. B-E panellerdeki veriler, sırasıyla LOG ve STAT örnekleri için 274 ve 187 hücre nesnelerinden türetilmiştir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Son olarak, yaygın olarak kullanılan BY4741 laboratuar gerilimin (MATa His3Δ1 Leu2Δ0 Met15Δ0 ura3Δ0) S. cerevisiae hücrelerini sırasıyla karmaşık YPAD ortamında üstel ve sabit fazlı olarak inceledik. Mantar hücreleri budding genellikle sabit faz1giriş üzerine depolama lipidleri birikir, ve biz bu bulgular özetlemek başardık (Şekil 4). Sabit hücreler, katlanarak büyüyen hücrelere göre birim başına biraz daha az LDs içeriyor (Şekil 4b), ancak hacim NORMALLEŞTIRILMIŞ ld floresan yoğunluğu neredeyse ikiye katlandı (Şekil 4c). Genel LD içeriğindeki bu keskin artış, sabit aşamada çok daha yüksek floresan yoğunluğu ve bireysel LDs hacmi nedeniyle oldu (Şekil 4d, E).
Şekil 4: ld içeriği S. cerevisiae hücreleri büyüme aşaması ile değişir. Katlanarak büyüyen (LOG) ve sabit faz (STAT) hücreleri analiz edildi. (A) LDS, BODIPY 493/503 ile lekelenmiş temsili işlenmemiş mikroskobik görüntüler. Her koşul için tek bir optik dilim gösterilir; daha iyi hücre sınırlarını görselleştirmek için ters mavi kanal ile% 10 kaplama eklenmiştir. Ölçek çubuğu 10 μm temsil eder. (B) hücre hacmi birimi başına tanımlanan LDs sayısı. (C) hücre hacmi birimi başına tanımlanan LDs 'nin floresan yoğunluğu. (D) tanımlanan tüm LDs 'lerin toplam floresan yoğunluklarının dağılımları * * * eşleştirilmemiş Wilcoxon testi p = 4,6 x 10-78. (E) tüm tanımlanan LDs hacimleri dağıtımları. * * * eşleştirilmemiş Wilcoxon testi p = 3,7 x 10-63. B-E panellerdeki veriler, sırasıyla LOG ve STAT örnekleri için 430 ve 441 hücre nesnelerinden türetilmiştir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Böylece, analiz iş akışımız, hücresel LD içeriğini olumlu veya olumsuz etkileyen çeşitli koşullarda üç farklı ve morfolojik olarak ayrı maya türlerinin LD numarası, boyutu ve lipid içeriğindeki değişiklikleri algılayabilir.
Tartışmalar
Lipid metabolizması ve düzenlenmesi anlayışı hem temel biyoloji, hem de klinik ve biyoteknolojik uygulamalar için önemlidir. LD içeriği, hücrelerin lipid metabolizması durumunun uygun bir şekilde okunmasını, Floresan Mikroskobu ise LD içerik belirlenmesi için kullanılan önemli yöntemlerden biri olarak temsil eder. Sunulan protokol, tek LDs 'nin üç farklı ve morfolojik olarak farklı Maya türlerinde otomatik olarak algılanmasını ve niceliksel açıklamasını sağlar. Bizim bilgi için, hiçbir benzer araçlar, fisyon Mayalar için var. Görüntü işleme için gerekli olan MATLAB komut dosyaları ek dosyalar olarak dahildir ve ayrıca Figshare deposundan (DOI 10.6084/M9. figshare. 7745738) Bu makaleden gelen tüm RAW ve işlenmiş görüntü ve sekmeli verilerle birlikte kullanılabilir, CSV çıkış dosyalarının ayrıntılı açıklamaları ve aşağı akış veri analizi ve görselleştirme için R komut dosyaları. Ayrıca, MATLAB komut dosyalarının en son sürümü GitHub 'dan edinilebilir (https://github.com/MartinSchatzCZ/LipidDots-analysis).
Başarılı LD analizi, elde edilen ham floresans görüntülerin kalitesine büyük ölçüde bağlıdır. Segment algoritmalarının optimum performansı için, toz parçacıklarından yoksun temiz cam slaytlar microskopi için kullanılmalıdır, hücreler bir tek tabakalı oluşturmalıdır (görünüm alanı başına gerçek hücre sayısı kritik bir parametre değildir) ve bir Ölü hücrelerin büyük bir oranı. Ayrıca, z-yığını görüntüleme biraz aşağıda başlamalıdır ve hücrelerin biraz üzerinde biter. Belirli mikroskobik kurulumuna bağlı olarak, kullanıcıların bazı görüntü işleme komut dosyalarında parametreleri (örneğin, görüntü arka plan yoğunluğu eşik için "TH") ayarlamanız gerekebilir. Geçerli yöntem, bölümlenmiş hücre nesnelerindeki ayrı LDs algılayabilir ve tanımlayabilirken, tüm hücrelerin otomatik olarak ayrılması ile ilgili zorluklar nedeniyle iş akışı gerçekten tek hücreli veri oluşturmaz. Bunun yerine, tüm örnek için genelleştirilmiş hücre birimi birimi başına LD içeriği bildirilir. Bu sınırlama, heterojen hücre nüfuslarının analizinde veri yorumlamasını engelleyebilir. Ayrıca, küçük moleküllerin değiştirilmiş taşınması ile hücreler ile çalışırken bakım alınmalıdır (örneğin, "effluks" pompa mutantlar), bu hücre içi bodipy 493/503 konsantrasyonu ve ld boyama etkileyebilir gibi, Nil kırmızı lipofilik boya için gözlenen33 , 34.
Hücre geçirmez Cascade mavi floresan dekstran ile orta boyama birçok (Eğer değil tüm) Maya türleri uygulanabilir arka plan35, hücrelerden ayırt etmek için uygun bir yoldur. Aynı zamanda bu boyama üzerine mavi dönecek gibi analiz ölü hücrelerin otomatik kaldırılması ile yardımcı olur. Canlı olarak algılanan herhangi bir ölüm veya hasta (ve böylece kısmen dextran için geçirgen) hücreleri algılanan hücre nesnelerinin "ınstrınsitymedianblue" değerine dayalı veri çözümleme adımları sırasında kaldırılabilir. Prensip olarak, tüm iş akışı DNA onarım odağı gibi çeşitli diğer hücresel yapıları algılamak için kullanılabilir, yapılar uygun fluorophores ile etiketlenmiş olabilir sağlanan. İş akışı, diğer (Maya) türlerinin hücrelerine de uygulanabilir olmalıdır, daha da yardımcı programını genişleterek.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu çalışma Charles Üniversitesi hibe PRIMUS/MED/26, GAUK 1308217 ve SVV 260310 tarafından desteklenmektedir. Biz mikroskobik ve görüntü analizi boru hattı gelişimi ile ilgili yardım için Ondřej Šebesta teşekkür ederiz. S . cerevisiae suşları için regenex laboratuvarına, ve japonet ve Hironori Niki 'nin laboratuvarına s. multiflorum suşlar için teşekkür ederiz. Ppc1-88 strain Maya genetik kaynak merkezi Japonya tarafından sağlandı. Microskopi, Avrupa Bölgesel Kalkınma Fonu ve Çek Cumhuriyeti 'nin devlet bütçesi tarafından finanse edilen Konfokal ve floresans mikroskopi laboratuvarı 'nda yapılmıştır (Proje No. CZ. 1.05/4.1.00/16.0347 ve CZ. 2.16/3.1.00/21515).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 12-bit monochromatic CCD camera Hamamatsu ORCA C4742-80-12AG | Hamamatsu | or equivalent | |
| Adenine hemisulfate salt, ≥99% | Merck | A9126-25G | |
| BODIPY 493/503 (4,4-Difluoro-1,3,5,7,8-Pentamethyl-4-Bora-3a,4a-Diaza-s-Indacene) | Thermo Fisher Scientific | D3922 | for neutral lipid staining |
| D-(+) - Glucose, ≥99.5% | Merck | G7021 | |
| Dextran, Cascade Blue, 10,000 MW, Anionic, Lysine Fixable | Thermo Fisher Scientific | D1976 | for negative staining of cells |
| Dimethyl sulfoxide, ≥99.5% | Merck | D4540 | or higher purity, keep anhydrous on molecular sieves |
| EMM broth without dextrose | Formedium | PMD0405 | medium may also be prepared from individual components |
| Fiji/ImageJ software | NIH | or equivalent; for visual inspection of microscopic data | |
| High precision cover glasses, 22 mm x 22 mm, No 1.5 | VWR | 630-2186 | use any # 1.5 cover glass |
| Image Processing Toolbox for MATLAB, version 10.0 | Mathworks | ||
| Lectin from Glycine max (soybean) | Merck | L1395 | for cell immobilization on slides |
| MATLAB software, version 9.2 | Mathworks | ||
| Microscope slide, 26 mm x 76 mm, 1 mm thickness | Knittel Glass | L762601.2 | use any microscope slide fitting your microscope stage, clean thoroughly before loading cells |
| Olympus CellR microscope with automatic z-axis objective movement | Olympus | or equivalent | |
| Pentaband filter set | Semrock | F66-985 | brightfield, green and blue channels are sufficient |
| Signal Processing Toolbox for MATLAB, version 7.4 | Mathworks | ||
| SP supplements | Formedium | PSU0101 | |
| Standard office computer capable of running MATLAB | |||
| Statistics and Machine Learning Toolbox for MATLAB, version 11.1 | Mathworks | ||
| Universal peptone M66 for microbiology | Merck | 1070431000 | |
| UPLSAPO 60XO objective | Olympus | or equivalent | |
| Yeast extract | Formedium | YEA03 | |
| Yeast nitrogen base without amino acids | Formedium | CYN0405 |
Referanslar
- Koch, B., Schmidt, C., Daum, G. Storage lipids of yeasts: a survey of nonpolar lipid metabolism in Saccharomyces cerevisiae, Pichia pastoris, and Yarrowia lipolytica. FEMS Microbiology Reviews. 38 (5), 892-915 (2014).
- Krahmer, N., Farese, R. V., Walther, T. C. Balancing the fat: lipid droplets and human disease. EMBO Molecular Medicine. 5 (7), 973-983 (2013).
- Lazar, Z., Liu, N., Stephanopoulos, G. Holistic Approaches in Lipid Production by Yarrowia lipolytica. Trends in Biotechnology. 36 (11), 1157-1170 (2018).
- Kim, D. U., et al. Analysis of a genome-wide set of gene deletions in the fission yeast Schizosaccharomyces pombe. Nature Biotechnology. 28 (6), 1628-1629 (2010).
- Giaever, G., Nislow, C. The yeast deletion collection: a decade of functional genomics. Genetics. 197 (2), 451-465 (2014).
- Meyers, A., et al. The protein and neutral lipid composition of lipid droplets isolated from the fission yeast, Schizosaccharomyces pombe. Journal of Microbiology (Seoul, Korea). 55 (2), 112-122 (2017).
- Meyers, A., et al. Lipid Droplets Form from Distinct Regions of the Cell in the Fission Yeast Schizosaccharomyces pombe. Traffic (Copenhagen, Denmark). 17 (6), 657-659 (2016).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic (Copenhagen, Denmark). 13 (5), 705-714 (2012).
- Yang, H. J., Osakada, H., Kojidani, T., Haraguchi, T., Hiraoka, Y. Lipid droplet dynamics during Schizosaccharomyces pombe sporulation and their role in spore survival. Biology Open. , 8(2016).
- Aoki, K., Shiwa, Y., Takada, H., Yoshikawa, H., Niki, H. Regulation of nuclear envelope dynamics via APC/C is necessary for the progression of semi-open mitosis in Schizosaccharomyces japonicus. Genes To Cells: Devoted To Molecular & Cellular Mechanisms. 18 (9), 733-752 (2013).
- Karolin, J., Johansson, L. B. A., Strandberg, L., Ny, T. Fluorescence and Absorption Spectroscopic Properties of Dipyrrometheneboron Difluoride (BODIPY) Derivatives in Liquids, Lipid Membranes, and Proteins. Journal of the American Chemical Society. 116 (17), 7801-7806 (1994).
- Bozaquel-Morais, B. L., Madeira, J. B., Maya-Monteiro, C. M., Masuda, C. A., Montero-Lomeli, M. A new fluorescence-based method identifies protein phosphatases regulating lipid droplet metabolism. PloS One. 5 (10), e13692(2010).
- Sitepu, I. R., et al. An improved high-throughput Nile red fluorescence assay for estimating intracellular lipids in a variety of yeast species. Journal of Microbiological Methods. 91 (2), 321-328 (2012).
- Rostron, K. A., Lawrence, C. L. Nile Red Staining of Neutral Lipids in Yeast. Methods in Molecular Biology (Clifton, N.J.). 1560, 219-229 (2017).
- Romero-Aguilar, L., Montero-Lomeli, M., Pardo, J. P., Guerra-Sánchez, G. Lipid Index Determination by Liquid Fluorescence Recovery in the Fungal Pathogen Ustilago Maydis. Journal of Visualized Experiments. (134), 1-6 (2018).
- Gupta, A., Dorlhiac, G. F., Streets, A. M. Quantitative imaging of lipid droplets in single cells. The Analyst. , (2018).
- Wolinski, H., Bredies, K., Kohlwein, S. D. Quantitative imaging of lipid metabolism in yeast: from 4D analysis to high content screens of mutant libraries. Methods in Cell Biology. , 108-365 (2012).
- Campos, V., Rappaz, B., Kuttler, F., Turcatti, G., Naveiras, O. High-throughput, nonperturbing quantification of lipid droplets with digital holographic microscopy. Journal of Lipid Research. 59 (7), 1301-1310 (2018).
- Ranall, M. V., Gabrielli, B. G., Gonda, T. J. High-content imaging of neutral lipid droplets with 1,6-diphenylhexatriene. BioTechniques. 51 (1), 35-42 (2011).
- Schnitzler, J. G., et al. Nile Red Quantifier: a novel and quantitative tool to study lipid accumulation in patient-derived circulating monocytes using confocal microscopy. Journal of Lipid Research. 58 (11), 2210-2219 (2017).
- Bombrun, M., Gao, H., Ranefall, P., Mejhert, N., Arner, P., Wählby, C. Quantitative high-content/high-throughput microscopy analysis of lipid droplets in subject-specific adipogenesis models. Cytometry. Part A the journal of the International Society for Analytical Cytology. 91 (11), 1068-1077 (2017).
- Capus, A., Monnerat, M., Ribeiro, L. C., de Souza, W., Martins, J. L., Sant’Anna, C. Application of high-content image analysis for quantitatively estimating lipid accumulation in oleaginous yeasts with potential for use in biodiesel production. Bioresource Technology. 203, 309-317 (2016).
- Lv, X., et al. Identification of gene products that control lipid droplet size in yeast using a high-throughput quantitative image analysis. Biochimica et biophysica acta. Molecular and Cell Biology Of Lipids. 1864 (2), 113-127 (2018).
- Zach, R., Tvarůžková, J., Schätz, M., Ťupa, O., Grallert, B., Převorovský, M. Mitotic defects in fission yeast lipid metabolism “cut” mutants are suppressed by ammonium chloride. FEMS Yeast Research. 18 (6), 1-7 (2018).
- Petersen, J., Russell, P. Growth and the Environment of Schizosaccharomyces pombe. Cold Spring Harbor Protocols. 2016 (3), (2016).
- Aoki, K., Furuya, K., Niki, H. Schizosaccharomyces japonicus: A Distinct Dimorphic Yeast among the Fission Yeasts. Cold Spring Harbor Protocols. (12), (2017).
- Curran, B. P. G., Bugeja, V. Basic investigations in Saccharomyces cerevisiae. Methods in Molecular Biology (Clifton, N.J.). , 1-14 (2014).
- Sabatinos, S. A., Forsburg, S. L. Molecular genetics of Schizosaccharomyces pombe. Methods in Enzymology. 470 (10), 759-795 (2010).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Molecular Reproduction and Development. 82 (7-8), 518-529 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Nakamura, T., Pluskal, T., Nakaseko, Y., Yanagida, M. Impaired coenzyme A synthesis in fission yeast causes defective mitosis, quiescence-exit failure, histone hypoacetylation and fragile DNA. Open Biology. 2 (9), 120117(2012).
- Furuya, K., Niki, H. Isolation of heterothallic haploid and auxotrophic mutants of Schizosaccharomyces japonicus. Yeast. 26 (4), 221-233 (2009).
- Ivnitski-Steele, I., et al. Identification of Nile red as a fluorescent substrate of the Candida albicans ATP-binding cassette transporters Cdr1p and Cdr2p and the major facilitator superfamily transporter Mdr1p. Analytical Biochemistry. 394 (1), 87-91 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods in Molecular Biology (Clifton, N.J.). 457 (1), 151-163 (2008).
- Graml, V., et al. A genomic Multiprocess survey of machineries that control and link cell shape, microtubule organization, and cell-cycle progression. Developmental Cell. 31 (2), 227-239 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır