Method Article
تحليل محتوى قطرات الدهون في الانشطار والخمائر الناشئة باستخدام المعالجة الآلية للصور
In This Article
Summary
هنا، نقدم تنفيذ MATLAB للكشف الآلي والوصف الكمي لقطرات الدهون في الصور المجهرية الفلورية من الانشطار وخلايا الخميرة الناشئة.
Abstract
التمثيل الغذائي للدهون وتنظيمها هي ذات أهمية لكل من علوم الحياة الأساسية والتطبيقية والتكنولوجيا الحيوية. في هذا الصدد، وتستخدم أنواع الخميرة المختلفة كنماذج في البحوث الأيضية الدهون أو لإنتاج الدهون الصناعية. قطرات الدهون هي هيئات تخزين ديناميكية للغاية ومحتواها الخلوي يمثل قراءة مريحة للدولة الأيضية الدهون. التنظير المجهري الفلوري هو طريقة مفضلة للتحليل الكمي لقطرات الدهون الخلوية، كما أنه يعتمد على المعدات المتاحة على نطاق واسع ويسمح بتحليل قطرات الدهون الفردية. وعلاوة على ذلك، يمكن أن يكون تحليل الصور المجهرية آلية، مما يزيد إلى حد كبير من الإنتاجية العامة للتحليل. هنا، ونحن نصف سير العمل التجريبية والتحليلية للكشف الآلي والوصف الكمي لقطرات الدهون الفردية في ثلاثة أنواع مختلفة من الخميرة النموذجية: الخمائر الانشطارية Schizosaccharomyces pombe و Schizosaccharomyces japonicus، والخميرة الناشئة Saccharomyces سيريفيسياي. يتم تصور قطرات الدهون مع BODIPY 493/503، ويتم إضافة dextran الفلورسنت غير قابل للنفاذ ية الخلية إلى وسائل الإعلام الثقافية للمساعدة في تحديد حدود الخلية. تخضع الخلايا للميكروسكوب الظهارة ثلاثية الأبعاد في القنوات الخضراء والزرقاء ويتم معالجة الصور z-stack الناتجة تلقائيًا بواسطة خط أنابيب MATLAB. وناتج هذا الإجراء بيانات كمية غنية عن محتوى قطرات الدهون الخلوية وخصائص قطرات الدهون الفردية في شكل جدولي مناسب للتحليلات النهائية في جداول البيانات الرئيسية أو الحزم الإحصائية. نحن نقدم أمثلة تحليلات لمحتوى قطرات الدهون في ظل ظروف مختلفة تؤثر على استقلاب الدهون الخلوية.
Introduction
تلعب الدهون أدوارًا حاسمة في الطاقة الخلوية والتمثيل الغذائي للكربون، وتوليف مكونات الغشاء، وإنتاج المواد النشطة بيولوجياً. يتم ضبط أيض الدهون بدقة وفقا للظروف البيئية، وتوافر المواد الغذائية والمرحلة1دورة الخلية. في البشر، وقد تم ربط التمثيل الغذائي للدهون إلى أمراض، مثل السمنة، والسكري من النوع الثاني والسرطان2. في الصناعة، والدهون التي تنتجها الكائنات الحية الدقيقة، مثل الخمائر، تمثل مصدرا واعدا من وقود الديزل المتجددة3. تخزن الخلايا الدهون المحايدة في ما يسمى قطرات الدهون (LDs). وتتألف هذه الهيئات المحفوظة تطوريا من triacylglycerols، استرات الستيرل، أحادية طبقة فوسفوليبيد الخارجي والبروتينات المرتبطةبها 1. تنشأ الـ LDs في الشبكية الإندوبلازمية، وتمارس دورة الخلايا أو ديناميات مرحلةالنمو، وهي مهمة للبطانة الدهنية 1. يمكن استخدام عدد LD ومورفولوجيا كوكيل مناسب عند اختبار استقلاب الدهون في ظل ظروف النمو المختلفة أو عند فحص لوحة من المتحولين. وبالنظر إلى طبيعتها الديناميكية، فإن التقنيات القادرة على تحليل خصائص الـ LDs الفردية لها أهمية خاصة في دراسات استقلاب الدهون.
وقد استخدمت أنواع الخميرة المختلفة لوصف مسارات التمثيل الغذائي المتعلقة بالدهون وتنظيمها، أو استخدامها في التكنولوجيا الحيوية لإنتاج مركبات مثيرة للاهتمام أو الوقود1. وعلاوة على ذلك، لنماذج الخمائر، مثل الخميرة الناشئة Saccharomyces سيريفيسياي أو الخميرة الانشطارية ذات الصلة البعيدة Schizosaccharomyces pombe، تتوفر مكتبات سلالة الحذف على نطاق الجينوم التي يمكن استخدامها لالإنتاجية العالية شاشات4,5. في الآونة الأخيرة تم وصف تكوين LD والديناميات في S. pombe6,7,8,9, وقد تم عزل المسوخ المتعلقة باستقلاب الدهون في الخميرة نموذج الناشئة شيزوساكاشارومايسيس جابونيكوس10.
تتوفر العديد من التقنيات لدراسة محتوى LD ودينامياتها. معظم توظيف نوع من تلطيخ اللادلس مع الأصباغ lipophilic مثل النيل الأحمر أو BODIPY 493/503. هذا الأخير يظهر الإثارة أكثر ضيقا والأطياف الانبعاثات، وزيادة خصوصية نحو الدهون المحايدة (LDs) بدلا من فوسفوليبيدات (الأغشية)11. وقد استخدمت أساليب قياس الفلورومتري والتدفق والقياس في الخلايا بنجاح في مختلف الأنواع الفطرية للكشف عن الجينات وظروف النمو التي تؤثر على محتوى الدهون التخزين12،13،14،15. في حين أن هذه الأساليب مناسبة للتطبيقات عالية الإنتاجية، فإنها لا يمكن قياس أعداد ومورفولوجيا LDs الفردية في الخلايا، والتي يمكن أن تختلف بشكل كبير بين ظروف النمو والأنماط الجينية. التشتت المتماسك رامان أو المجهرية الثلاثية الأبعاد الرقمية هي أساليب خالية من التسميات التي تنتج البيانات على مستوى LD، ولكن تتطلب معدات متخصصة مكلفة16،17،18. ومن ناحية أخرى، يمكن أن توفر التنظير المجهري الفلوري بيانات مفصلة عن محتوى الـ LD، مع استخدام الأدوات المتاحة عادة وأدوات برامج تحليل الصور. توجد العديد من مهام سير العمل التحليل التي تتميز بدرجات مختلفة من التطور والأتمتة في الكشف عن الخلايا /LD من بيانات الصورة، ويتم تحسينها لأنواع الخلايا المختلفة، مثل الخلايا الميتازوانية مع LDs كبيرة19،20 , 21، أو الخمائر الناشئة17،22،23. بعض هذه النهج تعمل فقط في 2D (على سبيل المثال، على صور الإسقاط القصوى)، والتي قد تفشل في وصف موثوق محتوى LD الخلوية. على حد علمنا، لا توجد أدوات لتحديد محتوى LD ومورفولوجيا من البيانات المجهرية الخميرة الانشطارية. ومن شأن وضع تحليلات آلية وقوية على مستوى الـ LD أن يجلب حساسية متزايدة وقوة إحصائية معززة، وأن يوفر معلومات غنية عن المحتوى المحايد للدهون، من الناحية المثالية في أنواع الخميرة المتعددة.
لقد قمنا بتطوير سير عمل لتحليل محتوى LD من الصور المجهرية الفلورية ثلاثية الأبعاد لخلايا الخميرة. الخلايا الحية ملطخة بـ BODIPY 493/503 وCascade Blue dextran لتصور LDs وتحديد حدود الخلايا، على التوالي. يتم تعطيل الخلايا على الشرائح الزجاجية وتخضع لتصوير z-stack باستخدام مجهر اللافلورية القياسية. ثم تتم معالجة الصور بواسطة خط أنابيب آلي يتم تنفيذه في MATLAB، وهي مجموعة (تجارية) تستخدم على نطاق واسع للتحليلات الإحصائية. يقوم خط الأنابيب بإجراء المعالجة المسبقة للصور، والتجزئة (الخلايا مقابل الخلفية، وإزالة الخلايا الميتة)، وتحديد LD. ثم يتم توفير البيانات الغنية على مستوى LD، مثل حجم LD وكثافة الفلورة، في شكل جدول يتوافق مع أدوات برامج جداول البيانات الرئيسية. تم استخدام سير العمل بنجاح لتحديد تأثير توافر مصدر النيتروجين على استقلاب الدهون في S. pombe24. نحن الآن تبين وظيفة سير العمل في S. pombe, S. japonicus و S. cerevisiae, باستخدام ظروف النمو أو المتحولين التي تؤثر على محتوى LD الخلوية.
Protocol
1. إعداد الحلول ووسائل الإعلام
-
إعداد محلول تلطيخ الدهون.
- لإعداد الأسهم الدهون تلطيخ الحل حل 10 ملغ من BODIPY 493/503 في 10 مل من DMSO اللامائية (التركيز النهائي 1 ملغ / مل). إذابة المحتوى الكامل لقارورة 10 ملغ BODIPY 493/503 لمنع فقدان المواد أثناء الوزن.
تحذير: قد تمر DMSO من خلال الجلد. ارتداء معدات الحماية الشخصية المناسبة. - إعداد حل تلطيخ الدهون العاملة عن طريق خلط 100 درجة مئوية من 1 ملغ / مل BODIPY 493/503 حل الأوراق المالية و 900 درجة مئوية من DMSO اللامائية (التركيز النهائي 0.1 ملغ / مل).
- Aliquot الأسهم وحلول العمل، وتخزينها في -20 درجة مئوية.
ملاحظة: حل BODIPY 493/503 مستقرلعدة سنوات في -20 درجة مئوية. ومع ذلك، يجب حماية الحل من الرطوبة والضوء.
- لإعداد الأسهم الدهون تلطيخ الحل حل 10 ملغ من BODIPY 493/503 في 10 مل من DMSO اللامائية (التركيز النهائي 1 ملغ / مل). إذابة المحتوى الكامل لقارورة 10 ملغ BODIPY 493/503 لمنع فقدان المواد أثناء الوزن.
- لإعداد محلول الأوراق المالية لتصور حدود الخلية، حل 25 ملغ من dextran الأزرق تتالي (قارورة كاملة) في 2.5 مل من المياه منزوعة الأيونات (التركيز النهائي 10 ملغ / مل). Aliquot حل الأسهم وتخزينها في -20 درجة مئوية محمية من الضوء.
- لإعداد المجهر حل طلاء الشريحة، حل 5 ملغ من فول الصويا اللكتين في 5 مل من الماء منزوع الأيونات (التركيز النهائي 1 ملغ / مل). Aliquot الحل اللكتين وتخزينها في -80 درجة مئوية.
ملاحظة: حل اللكتين مستقر لعدة سنوات عند -80 درجة مئوية. يمكن تخزين Aliquots المستخدمة حاليا في -20 درجة مئوية. -
إعداد وسائل الإعلام زراعة.
- لإعداد 400 مل من مجمع YES زراعة المتوسطة لS. pombe و S. japonicus، حل 2 غرام من استخراج الخميرة و 0.1 غرام من مكملات SP (إذا لزم الأمر لمسوخ auxotrophic) في 340 مل من المياه منزوعة الأيونات في زجاجة 500 مل والأوتوكلاف. إضافة 60 مل من 20٪ (ث / الخامس) من الجلوكوز الأوتوكلاف أو معقمة فلتر بشكل منفصل في ظروف العقيم.
- لإعداد 400 مل من EMM محددة متوسط الزراعة لS. pombe و S. japonicus، حل 4.9 غرام من مرق EMM دون سكر العنب في 360 مل من المياه منزوعة الأيونات في زجاجة 500 مل والأوتوكلاف. إضافة 40 مل من 20٪ (ث / الخامس) من الجلوكوز الأوتوكلاف أو معقمة فلتر بشكل منفصل في ظروف العقيم.
ملاحظة: للاطلاع على المبادئ التوجيهية العامة بشأن زراعة S. pombe وS. japonicus انظر25 و26 على التوالي. - لإعداد 300 مل من مجمع YPAD زراعة المتوسطة لSaccharomyces سيريفيسياي، حل 3 غرام من مستخلص الخميرة، 6 غرام من peptone و 30 ملغ من كبريتات الأيدينين في 270 مل من المياه منزوعة الأيونات في زجاجة 500 مل والأوتوكلاف. إضافة 30 مل من 20٪ (ث / الخامس) من الجلوكوز الأوتوكلاف أو معقمة فلتر بشكل منفصل في ظروف العقيم.
- لإعداد 300 مل من الحد الأدنى المحدد من الوسط لS. cerevisiae، حل 2 غرام من قاعدة النيتروجين الخميرة (دون الأحماض الأمينية) في 270 مل من الماء منزوع الأيونات في زجاجة 500 مل والأوتوكلاف. إضافة 30 مل من 20٪ (ث / الخامس) من الجلوكوز الأوتوكلاف أو معقمة فلتر بشكل منفصل في ظروف العقيم.
ملاحظة: للاطلاع على المبادئ التوجيهية العامة بشأن زراعة S. cerevisiae انظر27.
2. زراعة الخلايا
-
النمو S. pombe أو S. japonicus إلى مرحلة الأسي أو ثابتة في وقت مبكر.
- في الصباح، تلقيح 5 مل من نعم المتوسطة مع الكتلة الحيوية الخميرة الانشطارية الطازجة. حضانة في 32 درجة مئوية مع الهز (180 دورة في الدقيقة) لعدة ساعات.
ملاحظة: لجميع الزراعات، استخدم قوارير Erlenmeyer وجود 10 أضعاف حجم الثقافة لضمان التهوية المناسبة. بعض المختبرات تفضل زراعة الخمائر الانشطارية في 30 درجة مئوية، ولكن درجة حرارة الزراعة من 32 درجة مئوية يؤدي في أوقات مضاعفة أقصر دون آثار ضارة على الخلايا، وبالتالي تقليل الوقت الإجمالي اللازم لإجراء تجربة25،28 . - في وقت متأخر من بعد ظهر اليوم نفسه (بعد 6 ساعات على الأقل من الزراعة)، تمييع الثقافة مع وسط YES الطازجة إلى حجم الثقافة النهائية 10 مل بحيث تصل إلى الكثافة البصرية المطلوبة (OD) (أو عدد من الخلايا / مل) في صباح اليوم التالي، واحتضان في 32 درجة مئوية مع ق هاكينغ (180 دورة في الدقيقة). ومن المزايا معرفة الوقت المضاعف لكل سلالة تستخدم لتحديد عامل التخفيف بدقة (استخدام المعادلة 1).

حيث Vالثقافة هو حجم ما قبل الزراعة اللازمة لتخفيف، Vالنهائي هو الحجم الإجمالي للثقافة الجديدة (10 مل للزراعة القياسية)، ODالنهائي هو OD المطلوب أن تصل إلى بعد صباح اليوم، ODالحالي هو OD قياس حاليا من مرحلة ما قبل الزراعة، ر هو وقت نمو الخلايا حتى الحصاد، رتأخر هو مدة مرحلة تأخر (يعتمد على الظروف المختبرية، يحتاج إلى أن تكون محددة تجريبيا) وtDT هو الوقت مضاعفة من سلالة.
ملاحظة: عندما يتم تحليل خلايا المرحلة الأسية، لا تدع الثقافات المسبقة تصل إلى المرحلة الثابتة لأن هذا يغير بشكل كبير فيزيولوجيا الخلايا (بما في ذلك محتوى LD) لعدة أجيال لاحقة. - في صباح يوم التصوير، إذا وصلت الثقافة إلى OD أعلى قليلا مما هو مطلوب (في حالة الخلايا ذات المرحلة الأسية)، تمييعها بنعم جديدة ومواصلة الحضانة لمدة مرتين على الأقل مضاعفة قبل تلطيخ الخصائص. تلطيخ (القسم 3).
- في الصباح، تلقيح 5 مل من نعم المتوسطة مع الكتلة الحيوية الخميرة الانشطارية الطازجة. حضانة في 32 درجة مئوية مع الهز (180 دورة في الدقيقة) لعدة ساعات.
-
المتنامية S. سيريفيسيا إلى مرحلة الأسي وثابتة.
- في فترة ما بعد الظهر، تلقيح 10 مل من YPAD المتوسطة مع كمية صغيرة من الكتلة الحيوية الخميرة الطازجة الناشئة وحضانة بين عشية وضحاها في 30 درجة مئوية مع هز (180 دورة في الدقيقة).
- صباح يوم التصوير، تمييع الثقافة إلى OD 0.1 في 10 مل من YPAD المتوسطة وتنمو إلى OD المطلوبة (على سبيل المثال، OD 1 للمرحلة الأسية). تنفيذ أي تمييع الثقافة كما هو موضح في الخطوة 2.1.2. انتقل إلى تلطيخ (القسم 3).
3. الدهون قطرات تلطيخ
- إعداد زلة غطاء المجهر لكل عينة ليتم تصويرها. انشر 1 ميكرو لتر من محلول طلاء الشرائح على غطاء نظيف باستخدام الجانب الطويل من طرف ماصة موضوع أفقياً. السماح للطلاء الحل لتجف تماما وتخزين زلات الغطاء في بيئة خالية من الغبار.
ملاحظة: يمكن تنظيف الشرائح الزجاجية والأغطية قبل استخدامها إذا لزم الأمر. يتكون إجراء التنظيف من الغسيل مع منظفات غسل الصحون، والتجفيف بالماء، ونقع بين عشية وضحاها في حمض الهيدروكلوريك 3٪، وغسل بالماء المقطر. يتم تخزين الشرائح النظيفة والأغطية في الإيثانول النقي حتى الاستخدام. - قياس OD من ثقافة الخلية أو عدد من الخلايا / مل، كما هو مطلوب. في محاولة للوصول إلى قيم مماثلة بين جميع سلالات اختبار لضمان ظروف تجريبية قابلة للمقارنة.
- ماصة 1 مل من كل ثقافة الخلية إلى أنبوب الطرد المركزي الصغير 1.5 مل. لS. cerevisiae فقط، إضافة 5 ميكرولتر من حل طلاء الشريحة، دوامة لفترة وجيزة، وحضانة في 30 درجة مئوية مع هز لمدة 5 دقائق.
- إضافة 1 درجة مئوية من محلول تلطيخ الدهون إلى كل aliquot الثقافة ودوامة لفترة وجيزة. ثم إضافة 10 درجة مئوية من حل التصور حدود الخلية ودوامة لفترة وجيزة.
ملاحظة: لا تعد الحلول قبل مختلطة من كل من البقع لأن هذا يؤدي إلى تبريد الفلورة من BODIPY 493/503. - جمع الخلايا عن طريق الطرد المركزي (1000 × ز،3 دقيقة، RT) وإزالة تقريبا كل supernatant (~ 950 درجة مئوية). إعادة تعليق الخلايا في supernatant المتبقية.
- ماصة 2 ميكرولتر من تعليق الخلية الكثيفة على زلة غطاء المغلفة اللكتين ووضعها على شريحة المجهر نظيفة. يجب أن تشكل الخلايا طبقة أحادية. الشروع في الفحص المجهري (القسم 4) في أسرع وقت ممكن لتقليل القطع الأثرية في التصوير؛ عملية الحد الأقصى من عينتين في وقت واحد.
4. إعداد المجهر والتصوير
-
تحسين ظروف التصوير.
ملاحظة: إعداد المجهر يتطلب التعرض الطويل لمصادر الضوء القوية التي يمكن أن تسبب ضررا للعينة وانحراف النتائج. لذلك، قم بإعداد شروط التصوير باستخدام شريحة عينة مخصصة لن يتم استخدامها بشكل أكبر لتحديد كمية الـ LD.- التركيز على الخلايا باستخدام تباين المرحلة أو تباين التداخل التفاضلي (DIC).
ملاحظة: قد يتم أخذ تباين المرحلة أو صور DIC كمرجع، ولكن لا يتم استخدامها أثناء خطوة تحليل الصورة التلقائية. - تعيين إعدادات مكدس z لتمتد وحدة تخزين الخلية بأكملها. تعتمد المسافة العمودية الإجمالية على حجم الخلية؛ يعتمد عدد الشرائح البصرية على الفتحة العددية للهدف (وظيفة انتشار النقطة في محور z). تعيين التركيز للتحرك بالنسبة إلى المستوى البؤري المركزي.
ملاحظة: غالباً ما يتم تعيين العدد الأمثل من الشرائح بواسطة برنامج التحكم في المجهر ولا تحتاج إلى أن تحسب يدوياً. عرض الخلية النموذجية هي 3-5 ميكرومتر لS. pombe،4-7 ميكرومتر لS. جابونيكونكوس،و 3-7 ميكرومتر لS. سيريفيسياي. - وللصورة، تُحدّد شدة الضوء ووقت التعرض في القناة الخضراء (الإثارة وانبعاث أقصى من BODIPY هما 493 و503 نانومتر، على التوالي).
ملاحظة: BODIPY 493/503 هو فلوروكروم مشرق جدا. ومع ذلك، فإنه قد تحصل على ابيض بسرعة مع كثافة ضوء قوية للغاية. وعلاوة على ذلك، فإن الـ LDs متحركة في الخلايا الحية، مما يقلل من وقت التعرض ويلتقط المكدس z-stack الكامل ذو القناة الخضراء أولاً (قبل التبديل إلى القناة الزرقاء) لمنع عدم وضوح القطع الأثرية. أيضا، تأخذ في الاعتبار النطاق الخطي للكاميرا لكثافة إشارة لتجنب بكسل المشبعة. - إلى حدود الخلية الصورة، تعيين كثافة الضوء ووقت التعرض في القناة الزرقاء (الإثارة والانبعاث أقصى من dextran الأزرق تتالي هي 400 و 420 نانومتر، على التوالي).
ملاحظة: كثافة الإشارة في القناة الزرقاء مطلوبة لتجزئة الصورة، ولكن لا يتم استخدامها لتحديد الكمية LD نفسها. لذلك، الإعدادات المثلى في هذه القناة ليست حاسمة للتحليل. - إذا كان ذلك ممكنا، إنشاء سير عمل تجريبي الآلي في برنامج التحكم المجهر لتسهيل تصوير عينات متعددة في ظل ظروف موحدة.
- التركيز على الخلايا باستخدام تباين المرحلة أو تباين التداخل التفاضلي (DIC).
- بمجرد تحسين ظروف التصوير، يتم استخدام عينات الصور للقياس الكمي. التركيز على الخلايا وصورتها في القنوات الخضراء والزرقاء كما هو موضح في الخطوة 4.1.
ملاحظة: يجب الحصول على جميع الصور باستخدام نفس الإعدادات للسماح بالمقارنة بين العينات. صورة حقول عرض متعددة لكل عينة للحصول على بيانات تمثيلية قوية. - حفظ الصور z-stack القناة الزرقاء والخضراء كملفات TIFF متعددة الطبقات 16 بت (أي ملفين لكل مجال عرض). تضمين الكلمات "الأخضر" أو "الأزرق" في أسماء الملفات المقابلة. المضي قدما في تحليل الصور (القسم 5).
5. تحليل الصور
-
تحقق بصريا من جودة الصور المكتسبة.
- فتح الصور المجهرية في ImageJ29،30 أو غيرها من برامج تحليل الصور المناسبة.
- إزالة أي مكدسات الصور التي تحتوي على عدد كبير من الخلايا التي انتقلت أثناء الاكتساب (وبالتالي إنشاء نتائج ملموسة ضبابية).
- إزالة أي أكوام صورة تحتوي على جزيئات غير الخلية الفلورسنت للغاية في القناة الزرقاء (على سبيل المثال، الأوساخ على الشريحة المجهر أو زلة غطاء، والشوائب في زراعة المتوسطة).
ملاحظة: قد تقوم الكائنات غير الخلوية المشرقة جداً في القناة الزرقاء بإنشاء نتائج كشف الخلايا أو قد تتداخل مع الكشف عن الخلايا في المناطق المجاورة لها. - إزالة أي مكدسات الصور التي تحتوي على نسبة كبيرة من الخلايا الميتة (أي الخلايا مع زيادة الفلورة الزرقاء مقارنة مع الخلايا الحية).
ملاحظة: في حين أن وجود نسبة صغيرة من الخلايا الميتة في العينة عادة ما لا يكون مشكلة ويتم تجاهل هذه الخلايا تلقائيا أثناء التحليل، قد يتم التعرف على بعض الخلايا الميتة أو المحتضرة في بعض الأحيان كخلايا حية بواسطة خوارزمية التجزئة وبالتالي انحراف النتائج المبلغ عنها.
-
تحليل الصور في برنامج MATLAB.
- إنشاء مجلد رئيسي ونسخ كافة البرامج النصية MATLAB إلى هذا الموقع.
- إنشاء مجلد فرعي ("pombe"، "سيريفيسياي" أو "japonicus") ونسخ ملفات الصور TIFF الإدخال إلى هذا الموقع.
- بدء تشغيل MATLAB، فتح البرنامج النصي MAIN.m وتشغيله. في القائمة حدد أنواع الخميرة لتحليلها وبدء معالجة الصور.
ملاحظة: يتم تعيين بعض المعلمات المطلوبة للكشف عن الخلايا وLD مسبقا لأنواع معينة، ويتم تحديد البعض الآخر تلقائيا أثناء معالجة الصور. تم تحديد القيم المحددة مسبقًا تجريبيًا وتعتمد على عدة عوامل مثل التكبير الموضوعي ونوع الكاميرا والحساسية وإعدادات التصوير. إذا لزم الأمر، يمكن للمستخدمين تحرير ملفات البرنامج النصي لتغيير الإعدادات المسبقة الخاصة بالكائن الحي لتعكس بشكل أفضل الإعداد التجريبي الخاص بهم. أي أثناء التعرف على الخلية يتم إعطاء أحجام الكائنات المقبولة بواسطة معلمات "minArea" و "maxArea" ويتم إعطاء الحد الأدنى من جزء وحدة التخزين المعبأة داخل حدود الكائن بواسطة المعلمة "صلابة". للحصول على التعرف على LD، يتم إعطاء عتبة السطوع بواسطة المعلمة "th" (تتأثر قيمتها في الغالب بعمق بت الصورة وكثافة إشارة الفلورة)، ويتم إعطاء الحد الأقصى لحجم LD المقبول بواسطة المعلمة "MaxArea". - فحص ومعالجة ملفات الإخراج كما هو مطلوب باستخدام محرر جدول بيانات أو حزمة إحصائية؛ ينتج سير العمل ملفات CSV مفصولة بفواصل منقوطة، وملفات TIFF المجزأة مع كائنات الخلايا وLDs التي تم الكشف عنها.
ملاحظة: يقوم سير العمل بتقسيم الصور إلى كائنات الخلفية والخلية، حيث قد يتكون كل كائن خلية من خلايا متجاورة متعددة. لذلك، الإخراج في ملفات "xxxx_cells.csv" لا يمثل بيانات خلية واحدة ويجب أن تستخدم فقط لحساب مقاييس وحدة وحدة الخلية.
النتائج
ويرد موجز للإجراء كله في الشكل 1 للخمائر الانشطارية (سير عمل الخميرة الناشئة مماثلة)، وفيما يلي نقدم أمثلة على كيفية استخدام سير العمل لدراسة محتوى LD في ثلاثة أنواع مختلفة من الخميرة في ظل ظروف مختلفة معروفة للتأثير على محتوى LD الخلوية. ويمثل كل مثال تجربة بيولوجية واحدة.
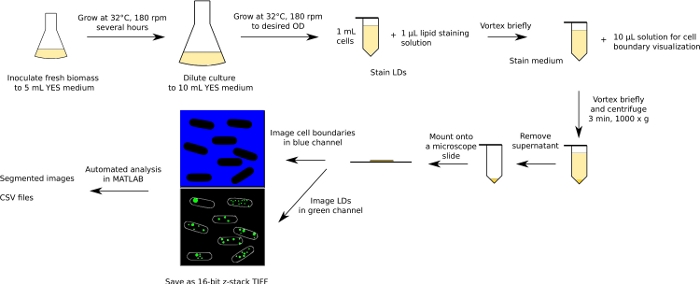
الشكل 1: رسم تخطيطي لسير العمل التجريبي والتحليلي. يظهر سير العمل للخمائر الانشطارية كمثال. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
أولا، قمنا بتحليل خلايا S. pombe (الشكل2). من النوع البري (WT; (ح) +s) نمت الخلايا إلى مرحلة الأسية إما في المتوسط نعم معقدة أو محددة EMM المتوسطة. بالمقارنة مع نعم، تم الكشف عن عدد أقل من الـ LDs وكثافة تلطيخ LD أعلى لكل وحدة من حجم الخلية في EMM (الشكل 2A-C). وعلاوة على ذلك، كانت LDs الفردية التي شكلت في EMM المتوسطة أكبر وعرض زيادة كثافة تلطيخ مجموع (الشكل2D،E). هذا هو اتفاق مع النتائج السابقة لزيادة محتوى الدهون التخزين في الخلايا المزروعة في EMM24. الجين PPC1 ترميز الأربطة فوسفوبوتوثينات سيستين المطلوبة للإنزيم المساعد A التوليف. تظهر متحولة ppc1-88 الحساسة لدرجة الحرارة انخفاضملحوظ في محتوى LD عندما نمت في درجة الحرارة المقيدة31، وتوفير مثال على الخلايا مع إشارة منخفضة BODIPY 493/503 (الشكل2A). وفقا لذلك، بالمقارنة مع نوع البرية (نمت في 32 درجة مئوية)، تم الكشف عن أصغر LDs مع انخفاض كثافة تلطيخ مجموع في خلايا pPC1-88 نمت في نعم بعد التحول إلى 36 درجة مئوية (الشكل2D،E)، دون أي تغيير واضح في عدد LD في وحدة من حجم الخلية (الشكل2B).
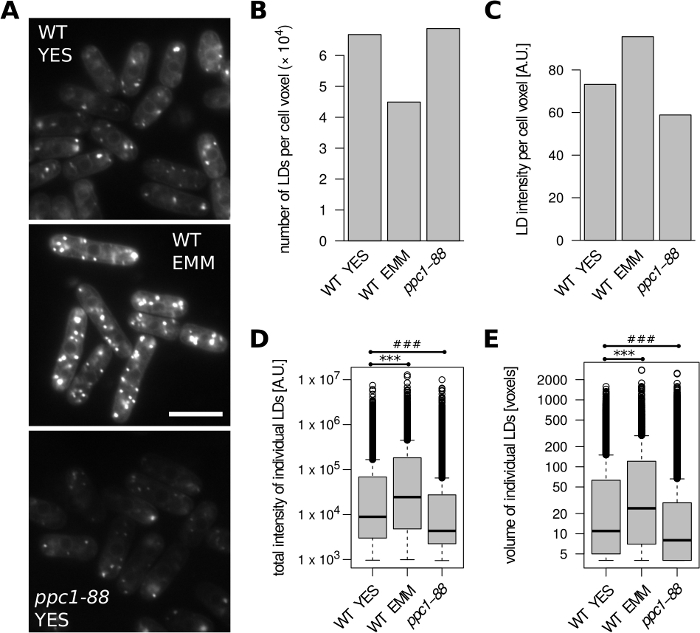
الشكل 2: تأثير نمو وسائل الإعلام وطفرة استقلاب الدهون على محتوى الـ LD في س. بومب. نمت الخلايا البرية من النوع (WT) وppc1-88 إلى مرحلة الأسية في المعقدة YES أو تعريف EMM المتوسطة، كما هو مبين. نمت خلايا WT في 32 درجة مئوية. نمت الخلايا pPC1-88 الحساسة لدرجة الحرارة في 25 درجة مئوية وتحولت إلى 36 درجة مئوية لمدة ساعتين قبل التحليل. (أ) صور مجهرية غير المجهزة من LDs ملطخة BODIPY 493/503. يتم عرض شريحة بصرية واحدة لكل حالة. تمت إضافة تراكب 10٪ مع قناة زرقاء مقلوبة لتصور أفضل حدود الخلية. شريط مقياس = 10 ميكرومتر (B) عدد الـ LDs المحدد لكل وحدة من حجم الخلية. (C) كثافة الفلورة من LDs المحددة لكل وحدة من حجم الخلية. (د) توزيعات الكثافة الإجمالية للفلورة لجميع الخصائص الفلورية المحددة. ***، ### اختبار ويلكوكسون غير المقترن p = 1.7 x 10-107،p = 3.7 x 10-132، على التوالي. (هـ)توزيعات أحجام جميع الـ LDs المحددة.***، ### اختبار ويلكوكسون غير المقترن p = 6.8 x 10-71، p = 1 × 10-64، على التوالي. وقد استمدت البيانات الموجودة في الأفرقة باء - هاء من 242 و124 و191 جسماً من خلايا الأفرقة لعينات WT YES وWT EMM وppc1-88 على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد ذلك، قمنا بتحديد محتوى LD كمياً في خلايا S. japonicus (h+matsj-2017)32 من الثقافات الأسية والثابتة المبكرة التي نمت في YES (الشكل 3A). وأظهرت الخلايا التي تدخل مرحلة ثابتة انخفاض ملحوظ في عدد الـ LDs لكل وحدة من حجم الخلايا مقارنة بالخلايا المتنامية بشكل كبير (الشكل3B)،في حين انخفضت كثافة الفلورة LD التي تم تطبيعها بشكل كبير بشكل طفيف بين الشرطين ( الشكل 3جيم). وكانت الإذاعات الثابتة في مرحلة مبكرة عادة أكبر بشكل معتدل في الحجم وكانت أعلى كثافة الفلورة الإجمالية بشكل معتدل مقارنة بـ LDs من الخلايا المتنامية بشكل كبير (الشكل3D, E).

الشكل 3: محتوى الـ LD في S. خلايا جابونيوس يتغير مع مرحلة النمو. تم تحليل الخلايا المتنامية بشكل كبير (LOG) والمرحلة الثابتة المبكرة (STAT). (أ) صور مجهرية غير المجهزة من LDs ملطخة BODIPY 493/503. يتم عرض شريحة بصرية واحدة لكل حالة. تمت إضافة تراكب 10٪ مع قناة زرقاء مقلوبة لتصور أفضل حدود الخلية. يمثل شريط المقياس 10 ميكرومتر (B) عدد الـ LDs المحدد لكل وحدة من حجم الخلية. (C) كثافة الفلورة من LDs المحددة لكل وحدة من حجم الخلية. (د) توزيعات الكثافة الإجمالية للفلورة لجميع الخصائص الفلورية المحددة. (هاء) توزيع كميات جميع الـ LDs المحددة. *** اختبار ويلكوكسون غير المقترن بـ = 2.4 × 10-85 . وقد استمدت البيانات الموجودة في الأفرقة باء - هاء من 274 و187 كائناً من خلايا عينات السجل والبيانات الإحصائية، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
وأخيرا، قمنا بتحليل خلايا S. سيريفيسياي من سلالة مختبر BY4741 المستخدمة على نطاق واسع (MATahis3Δ1 leu2Δ0 met15Δ0 ura33Δ)نمت إلى مرحلة الأسي وثابتة، على التوالي، في وسط YPAD المعقدة. خلايا الخميرة الناشئة عادة ما تتراكم الدهون التخزين عند الدخول في المرحلة الثابتة1، وكنا قادرين على تلخيص هذه النتائج (الشكل4). كانت الخلايا الثابتة تحتوي على عدد أقل من الـ LDs لكل وحدة من وحدات التخزين مقارنة بالخلايا المتنامية بشكل كبير (الشكل 4B)، ولكن كثافة الفلورة ذات الحجم الطبيعي تضاعفت تقريباً (الشكل 4 C). وتعزى هذه الزيادة الحادة في المحتوى الإجمالي لنقص المدة إلى شدة الفلورة وحجم اللاد الفردية في مرحلة ثابتة (الشكل4D،E).
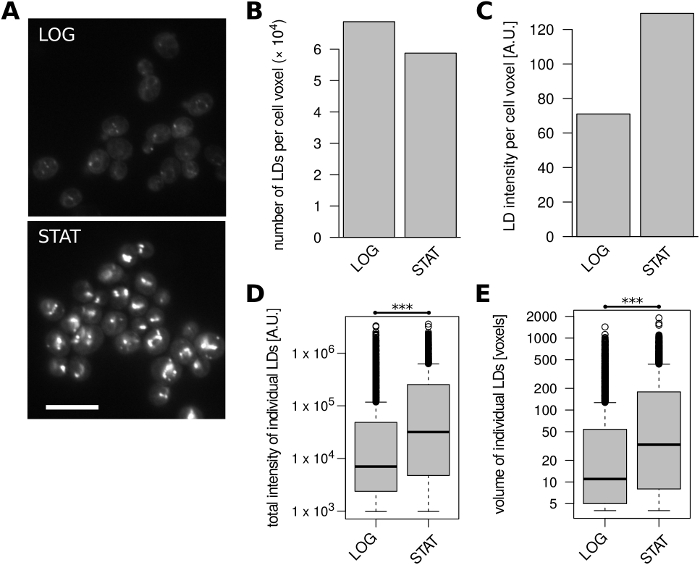
الشكل 4: محتوى الـ LD في S. خلايا سيريفيسياي يتغير مع مرحلة النمو. تم تحليل الخلايا المتنامية بشكل كبير (LOG) والمرحلة الثابتة (STAT). (أ) صور مجهرية غير المجهزة من LDs ملطخة BODIPY 493/503. يتم عرض شريحة بصرية واحدة لكل حالة. تمت إضافة تراكب 10٪ مع قناة زرقاء مقلوبة لتصور أفضل حدود الخلية. يمثل شريط المقياس 10 ميكرومتر (B) عدد الـ LDs المحدد لكل وحدة من حجم الخلية. (C) كثافة الفلورة من LDs المحددة لكل وحدة من حجم الخلية. (د) توزيعات الكثافة الإجمالية للفلورة لجميع الخصائص الفلورية المحددة. (هاء) توزيع كميات جميع الـ LDs المحددة. *** اختبار ويلكوكسون غير المقترن = 3.7 x 10-63 . وقد استمدت البيانات الموجودة في الأفرقة باء - هاء من 430 و441 كائناً من أجسام الخلايا لعينات السجل والبيانات الإحصائية، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
وهكذا، يمكن لسير عمل التحليل لدينا الكشف عن التغيرات في عدد LD والحجم ومحتوى الدهون في ثلاثة أنواع مختلفة ومتميزة من الناحية الشكلية الخميرة في ظل ظروف مختلفة تؤثر بشكل إيجابي أو سلبي على محتوى LD الخلوية.
Discussion
فهم التمثيل الغذائي للدهون وتنظيمها مهم لكل من البيولوجيا الأساسية، والتطبيقات السريرية والتكنولوجية الحيوية. يمثل محتوى LD قراءة مريحة لحالة استقلاب الدهون في الخلية، مع الفحص المجهري الفلوري كونها واحدة من الطرق الرئيسية المستخدمة لتحديد محتوى LD. يسمح البروتوكول المعروض بالكشف الآلي والوصف الكمي للLDs الفردية في ثلاثة أنواع مختلفة ومتميزة من الخميرة. على حد علمنا، لا توجد أدوات مماثلة للخمائر الانشطارية. يتم تضمين البرامج النصية MATLAB المطلوبة لمعالجة الصور كملفات تكميلية، وهي متاحة أيضاً من مستودع Figshare (DOI 10.6084/m9.figshare.7745738) مع جميع البيانات الأولية والمجهزة والجدولية من هذه المخطوطة، وصف مفصل لملفات إخراج CSV والبرامج النصية R لتحليل البيانات النهائية والتصور. أيضا، يتوفر أحدث إصدار من البرامج النصية MATLAB من GitHub (https://github.com/MartinSchatzCZ/LipidDots-analysis).
يعتمد تحليل LD الناجح إلى حد كبير على جودة صور الفلورة الخام التي تم الحصول عليها. للحصول على الأداء الأمثل لخوارزميات التجزئة، يجب استخدام الشرائح الزجاجية النظيفة الخالية من جزيئات الغبار للتنظير المجهري، وينبغي أن تشكل الخلايا طبقة أحادية (العدد الفعلي للخلايا لكل مجال عرض ليس معلمة حرجة)، وينبغي ألا يحتوي على نسبة كبيرة من الخلايا الميتة. أيضا، يجب أن يبدأ التصوير z-كومة قليلا ً تحت وتنتهي قليلاً فوق الخلايا. اعتماداً على الإعداد المجهري معينة، قد يحتاج المستخدمون إلى ضبط بعض المعلمات في البرامج النصية لمعالجة الصور (مثل "ال" لعتبة كثافة خلفية الصورة). في حين أن الأسلوب الحالي قادر على الكشف عن وصف LDs الفردية في كائنات الخلايا المجزأة، لا ينتج سير العمل بيانات خلية واحدة حقاً بسبب صعوبات في الفصل التلقائي لكافة الخلايا الفردية. بدلاً من ذلك، يتم الإعلام عن محتوى LD لكل وحدة من وحدة تخزين الخلية المعممة للعينة بأكملها. وقد يعوق هذا التقييد تفسير البيانات في تحليلات مجموعات الخلايا غير المتجانسة. أيضا، ينبغي توخي الحذر عند العمل مع الخلايا مع تغيير نقل الجزيئات الصغيرة (على سبيل المثال، متحولة مضخة efflux)، لأن هذا قد يؤثر على تركيز BODIPY 493/503 داخل الخلايا وتلطيخ الـ LD، كما لوحظ لصبغة النيل الأحمر الليفيليك33 , 34.
تلطيخ المتوسطة مع خلية غير قابلة للنفاذ تتالي الأزرق الفلورسنت dextran هو وسيلة مريحة للتمييز الخلايا من الخلفية35، والتي يمكن تطبيقها على العديد من أنواع الخميرة (إن لم يكن كل). كما أنه يساعد مع الإزالة الآلية للخلايا الميتة من التحليل لأن هذه سوف تتحول إلى اللون الأزرق على تلطيخ. يمكن إزالة أي خلايا تموت أو مريضة (وبالتالي يمكن نفاذها جزئيًا بالنسبة للخلايا الزائدة) التي تم الكشف عنها على قيد الحياة أثناء خطوات تحليل البيانات استنادًا إلى قيمة "IntensityMedianBlue" لكائنات الخلايا المكتشفة. من حيث المبدأ، يمكن استخدام سير العمل بأكمله للكشف عن مختلف الهياكل الخلوية الأخرى، مثل بؤر إصلاح الحمض النووي، شريطة أن تكون الهياكل يمكن أن توصف بالفلوروفورات المناسبة. وينبغي أيضا أن ينطبق سير العمل على خلايا الأنواع الأخرى (الخميرة)، مما يزيد من توسيع فائدته.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم دعم هذا العمل من قبل جامعة تشارلز المنح PRIMUS/MED/26، GAUK 1308217 و SVV 260310. نشكر Ondřej Šebesta على المساعدة في الفحص المجهري وتطوير خط أنابيب تحليل الصور. نشكر مختبر ReGenEx لسلالات S. سيريفيسياي، ومختبر JapoNet وHironori Niki لسلالات S. japonicus. تم توفير سلالة PPC1-88 من قبل مركز الخميرة للموارد الوراثية في اليابان. وأُجري الفحص المجهري في مختبر الفحص المجهري للبؤرة والفلورة الذي يشترك في تمويله الصندوق الأوروبي للتنمية الإقليمية وميزانية الدولة للجمهورية التشيكية (المشروع رقم. CZ.1.05/4.1.00/16.0347 و CZ.2.16/3.1.00/21515).
Materials
| Name | Company | Catalog Number | Comments |
| 12-bit monochromatic CCD camera Hamamatsu ORCA C4742-80-12AG | Hamamatsu | or equivalent | |
| Adenine hemisulfate salt, ≥99% | Merck | A9126-25G | |
| BODIPY 493/503 (4,4-Difluoro-1,3,5,7,8-Pentamethyl-4-Bora-3a,4a-Diaza-s-Indacene) | Thermo Fisher Scientific | D3922 | for neutral lipid staining |
| D-(+) - Glucose, ≥99.5% | Merck | G7021 | |
| Dextran, Cascade Blue, 10,000 MW, Anionic, Lysine Fixable | Thermo Fisher Scientific | D1976 | for negative staining of cells |
| Dimethyl sulfoxide, ≥99.5% | Merck | D4540 | or higher purity, keep anhydrous on molecular sieves |
| EMM broth without dextrose | Formedium | PMD0405 | medium may also be prepared from individual components |
| Fiji/ImageJ software | NIH | or equivalent; for visual inspection of microscopic data | |
| High precision cover glasses, 22 mm x 22 mm, No 1.5 | VWR | 630-2186 | use any # 1.5 cover glass |
| Image Processing Toolbox for MATLAB, version 10.0 | Mathworks | ||
| Lectin from Glycine max (soybean) | Merck | L1395 | for cell immobilization on slides |
| MATLAB software, version 9.2 | Mathworks | ||
| Microscope slide, 26 mm x 76 mm, 1 mm thickness | Knittel Glass | L762601.2 | use any microscope slide fitting your microscope stage, clean thoroughly before loading cells |
| Olympus CellR microscope with automatic z-axis objective movement | Olympus | or equivalent | |
| Pentaband filter set | Semrock | F66-985 | brightfield, green and blue channels are sufficient |
| Signal Processing Toolbox for MATLAB, version 7.4 | Mathworks | ||
| SP supplements | Formedium | PSU0101 | |
| Standard office computer capable of running MATLAB | |||
| Statistics and Machine Learning Toolbox for MATLAB, version 11.1 | Mathworks | ||
| Universal peptone M66 for microbiology | Merck | 1070431000 | |
| UPLSAPO 60XO objective | Olympus | or equivalent | |
| Yeast extract | Formedium | YEA03 | |
| Yeast nitrogen base without amino acids | Formedium | CYN0405 |
References
- Koch, B., Schmidt, C., Daum, G. Storage lipids of yeasts: a survey of nonpolar lipid metabolism in Saccharomyces cerevisiae, Pichia pastoris, and Yarrowia lipolytica. FEMS Microbiology Reviews. 38 (5), 892-915 (2014).
- Krahmer, N., Farese, R. V., Walther, T. C. Balancing the fat: lipid droplets and human disease. EMBO Molecular Medicine. 5 (7), 973-983 (2013).
- Lazar, Z., Liu, N., Stephanopoulos, G. Holistic Approaches in Lipid Production by Yarrowia lipolytica. Trends in Biotechnology. 36 (11), 1157-1170 (2018).
- Kim, D. U., et al. Analysis of a genome-wide set of gene deletions in the fission yeast Schizosaccharomyces pombe. Nature Biotechnology. 28 (6), 1628-1629 (2010).
- Giaever, G., Nislow, C. The yeast deletion collection: a decade of functional genomics. Genetics. 197 (2), 451-465 (2014).
- Meyers, A., et al. The protein and neutral lipid composition of lipid droplets isolated from the fission yeast, Schizosaccharomyces pombe. Journal of Microbiology (Seoul, Korea). 55 (2), 112-122 (2017).
- Meyers, A., et al. Lipid Droplets Form from Distinct Regions of the Cell in the Fission Yeast Schizosaccharomyces pombe. Traffic (Copenhagen, Denmark). 17 (6), 657-659 (2016).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic (Copenhagen, Denmark). 13 (5), 705-714 (2012).
- Yang, H. J., Osakada, H., Kojidani, T., Haraguchi, T., Hiraoka, Y. Lipid droplet dynamics during Schizosaccharomyces pombe sporulation and their role in spore survival. Biology Open. , 8(2016).
- Aoki, K., Shiwa, Y., Takada, H., Yoshikawa, H., Niki, H. Regulation of nuclear envelope dynamics via APC/C is necessary for the progression of semi-open mitosis in Schizosaccharomyces japonicus. Genes To Cells: Devoted To Molecular & Cellular Mechanisms. 18 (9), 733-752 (2013).
- Karolin, J., Johansson, L. B. A., Strandberg, L., Ny, T. Fluorescence and Absorption Spectroscopic Properties of Dipyrrometheneboron Difluoride (BODIPY) Derivatives in Liquids, Lipid Membranes, and Proteins. Journal of the American Chemical Society. 116 (17), 7801-7806 (1994).
- Bozaquel-Morais, B. L., Madeira, J. B., Maya-Monteiro, C. M., Masuda, C. A., Montero-Lomeli, M. A new fluorescence-based method identifies protein phosphatases regulating lipid droplet metabolism. PloS One. 5 (10), e13692(2010).
- Sitepu, I. R., et al. An improved high-throughput Nile red fluorescence assay for estimating intracellular lipids in a variety of yeast species. Journal of Microbiological Methods. 91 (2), 321-328 (2012).
- Rostron, K. A., Lawrence, C. L. Nile Red Staining of Neutral Lipids in Yeast. Methods in Molecular Biology (Clifton, N.J.). 1560, 219-229 (2017).
- Romero-Aguilar, L., Montero-Lomeli, M., Pardo, J. P., Guerra-Sánchez, G. Lipid Index Determination by Liquid Fluorescence Recovery in the Fungal Pathogen Ustilago Maydis. Journal of Visualized Experiments. (134), 1-6 (2018).
- Gupta, A., Dorlhiac, G. F., Streets, A. M. Quantitative imaging of lipid droplets in single cells. The Analyst. , (2018).
- Wolinski, H., Bredies, K., Kohlwein, S. D. Quantitative imaging of lipid metabolism in yeast: from 4D analysis to high content screens of mutant libraries. Methods in Cell Biology. , 108-365 (2012).
- Campos, V., Rappaz, B., Kuttler, F., Turcatti, G., Naveiras, O. High-throughput, nonperturbing quantification of lipid droplets with digital holographic microscopy. Journal of Lipid Research. 59 (7), 1301-1310 (2018).
- Ranall, M. V., Gabrielli, B. G., Gonda, T. J. High-content imaging of neutral lipid droplets with 1,6-diphenylhexatriene. BioTechniques. 51 (1), 35-42 (2011).
- Schnitzler, J. G., et al. Nile Red Quantifier: a novel and quantitative tool to study lipid accumulation in patient-derived circulating monocytes using confocal microscopy. Journal of Lipid Research. 58 (11), 2210-2219 (2017).
- Bombrun, M., Gao, H., Ranefall, P., Mejhert, N., Arner, P., Wählby, C. Quantitative high-content/high-throughput microscopy analysis of lipid droplets in subject-specific adipogenesis models. Cytometry. Part A the journal of the International Society for Analytical Cytology. 91 (11), 1068-1077 (2017).
- Capus, A., Monnerat, M., Ribeiro, L. C., de Souza, W., Martins, J. L., Sant’Anna, C. Application of high-content image analysis for quantitatively estimating lipid accumulation in oleaginous yeasts with potential for use in biodiesel production. Bioresource Technology. 203, 309-317 (2016).
- Lv, X., et al. Identification of gene products that control lipid droplet size in yeast using a high-throughput quantitative image analysis. Biochimica et biophysica acta. Molecular and Cell Biology Of Lipids. 1864 (2), 113-127 (2018).
- Zach, R., Tvarůžková, J., Schätz, M., Ťupa, O., Grallert, B., Převorovský, M. Mitotic defects in fission yeast lipid metabolism “cut” mutants are suppressed by ammonium chloride. FEMS Yeast Research. 18 (6), 1-7 (2018).
- Petersen, J., Russell, P. Growth and the Environment of Schizosaccharomyces pombe. Cold Spring Harbor Protocols. 2016 (3), (2016).
- Aoki, K., Furuya, K., Niki, H. Schizosaccharomyces japonicus: A Distinct Dimorphic Yeast among the Fission Yeasts. Cold Spring Harbor Protocols. (12), (2017).
- Curran, B. P. G., Bugeja, V. Basic investigations in Saccharomyces cerevisiae. Methods in Molecular Biology (Clifton, N.J.). , 1-14 (2014).
- Sabatinos, S. A., Forsburg, S. L. Molecular genetics of Schizosaccharomyces pombe. Methods in Enzymology. 470 (10), 759-795 (2010).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Molecular Reproduction and Development. 82 (7-8), 518-529 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Nakamura, T., Pluskal, T., Nakaseko, Y., Yanagida, M. Impaired coenzyme A synthesis in fission yeast causes defective mitosis, quiescence-exit failure, histone hypoacetylation and fragile DNA. Open Biology. 2 (9), 120117(2012).
- Furuya, K., Niki, H. Isolation of heterothallic haploid and auxotrophic mutants of Schizosaccharomyces japonicus. Yeast. 26 (4), 221-233 (2009).
- Ivnitski-Steele, I., et al. Identification of Nile red as a fluorescent substrate of the Candida albicans ATP-binding cassette transporters Cdr1p and Cdr2p and the major facilitator superfamily transporter Mdr1p. Analytical Biochemistry. 394 (1), 87-91 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods in Molecular Biology (Clifton, N.J.). 457 (1), 151-163 (2008).
- Graml, V., et al. A genomic Multiprocess survey of machineries that control and link cell shape, microtubule organization, and cell-cycle progression. Developmental Cell. 31 (2), 227-239 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved