Method Article
Анализ содержания капель Lipid в делении и подающих надежды дрожжах с использованием автоматизированной обработки изображений
В этой статье
Резюме
Здесь мы представляем MATLAB реализации автоматизированного обнаружения и количественного описания липидных капель в флуоресценционной микроскопии изображения деления и подающий надежды дрожжевых клеток.
Аннотация
Липидный метаболизм и его регулирование представляют интерес как для фундаментальных, так и для прикладных наук о жизни и биотехнологии. В этой связи различные виды дрожжей используются в качестве моделей в липидных метаболических исследованиях или для промышленного производства липидов. Липидные капли являются высокодинамическими телами хранения, и их клеточное содержание представляет собой удобное считывание липидного метаболического состояния. Флуоресцентная микроскопия является методом выбора для количественного анализа клеточных липидных капель, так как он опирается на широко доступное оборудование и позволяет анализ отдельных липидных капель. Кроме того, микроскопический анализ изображений может быть автоматизирован, что значительно увеличивает общую пропускную мощность анализа. Здесь мы описываем экспериментальный и аналитический рабочий процесс для автоматизированного обнаружения и количественного описания отдельных липидных капель в трех различных видов дрожжей модели: расщепление дрожжей Schizosaccharomyces pombe и Schizosaccharomyces japonicus, и подающий надежды дрожжи Saccharomyces cerevisiae. Липидные капли визуализированы с помощью BODIPY 493/503, а клеточный флуоресцентный декетр добавляется в культурные носители, чтобы помочь определить границы клеток. Клетки подвергаются 3D эпифлюоресценции микроскопии в зеленых и синих каналах и в результате z-стек изображения обрабатываются автоматически трубопровода MATLAB. Процедура выводит богатые количественные данные о содержании клеточных липидных капель и индивидуальных характеристиках липидных капель в табличном формате, пригодном для анализа вниз по течению в основных электронных таблицах или статистических пакетах. Мы предоставляем пример ы анализ содержания липидных капель в различных условиях, которые влияют на клеточный метаболизм липидов.
Введение
Липиды играют решающую роль в клеточной энергии и метаболизме углерода, синтезе мембранных компонентов и производстве биологически активных веществ. Липидный метаболизм дорабатывается в зависимости от условий окружающей среды, наличия питательных веществ и фазы1клеточного цикла. У людей метаболизм липидов был связан с такими заболеваниями, как ожирение, диабет II типа и рак2. В промышленности липиды, производимые микроорганизмами, такими как дрожжи, представляют собой перспективный источник возобновляемого дизельного топлива3. Клетки хранят нейтральные липиды в так называемых липидных каплях (ЛД). Эти эволюционно сохраненные тела состоят из триацилглицерола, стерилового эфира, внешнего фосфолипидного монослойного и связанных с ними белков1. ЛД возникают в эндоплазмической ретикулум, оказывают клеточного цикла или роста фазы динамики, и имеют важное значение для клеточного липидного гомеостаза1. LD номер и морфология может быть использован а также удобный прокси при анализе метаболизма липидов в различных условиях роста или при скрининге панели мутантов. Учитывая их динамичный характер, методы, способные анализировать свойства отдельных ЛД, представляют особый интерес в исследованиях липидного метаболизма.
Различные виды дрожжей были использованы для описания липидов связанных метаболических путей и их регулирования, или используется в биотехнологии для производства интересных соединений или топлива1. Кроме того, для модели дрожжей, таких как подающий надежды дрожжи Saccharomyces cerevisiae или отдаленно связанных деления дрожжей Schizosaccharomyces pombe, генома всей удаления деформации библиотеки доступны, которые могут быть использованы для высокой пропускной вещи экраны4,5. Недавно состав и динамика LD были описаны в S. pombe6,7,8,9,и мутанты, связанные с липидным метаболизмом, были изолированы в новых дрожжах модели Schizosaccharomyces japonicus10.
Многочисленные методы доступны для изучения содержания и динамики Ld. Большинство используют какой-то окрашивания LDs с липофильных красителей, таких как Нил Красный или BODIPY 493/503. Последний показывает более узкое возбуждение и спектры выбросов, а также повышенную специфичность в отношении нейтральных липидов (ЛД), в отличие от фосфолипидов (мембран)11. Фторметрические и цитометрии потока методы были успешно использованы в различных грибковых видов, чтобы раскрыть гены и условия роста, которые влияют на содержание липидовхранения 12,13,14,15. Хотя эти методы подходят для высокопроизводительных приложений, они не могут измерять числа и морфологию отдельных ЛД в клетках, которые могут значительно отличаться между условиями роста и генотипами. Когерентное раганского рассеяния или цифровой голографической микроскопии являются без этикетки методами, которые дают данные ld-уровня, но требуют специализированного дорогостоящего оборудования16,17,18. Флуоресценция микроскопии, с другой стороны, может обеспечить подробные данные о содержании ЛД, используя при этом широко доступные инструменты и программные средства анализа изображений. Существует несколько аналитических рабочих процессов, которые имеют различные степени сложности и автоматизации в обнаружении ячеек/Ld из данных изображений, и оптимизированы для различных типов клеток, таких как метазоановые клетки с большими LDs19,20 , 21, или подающий надежды дрожжи17,22,23. Некоторые из этих подходов работают только в 2D (например, на максимальных проекционных изображениях), которые могут не описать достоверно содержание клеточного ЛП. Насколько нам известно, не существует инструментов для определения содержания ЛД и морфологии от деления дрожжей микроскопических данных. Разработка автоматизированного и надежного анализа на уровне ЛД обеспечит повышенную чувствительность и повышение статистической мощи, а также даст богатую информацию о нейтральном содержании липидов, в идеале в нескольких видах дрожжей.
Мы разработали рабочий процесс для анализа содержания ЛД из 3D флуоресцентной микроскопии изображений дрожжевых клеток. Клетки жизни окрашены С BODIPY 493/503 и Каскад Синий dextran для визуализации LDs и определить границы клеток, соответственно. Клетки обездвижены на стеклянных слайдах и подвергаются z-стек изображений с помощью стандартного эпифлюоресцентного микроскопа. Изображения затем обрабатываются автоматизированным конвейером, внедряемым в MATLAB, широко используемом (коммерческом) пакете для статистического анализа. Конвейер выполняет предобработку изображения, сегментацию (клетки против фона, удаление мертвых ячеек) и идентификацию LD. Богатые данные ld-уровня, такие как размер ЛД и интенсивность флуоресценции, затем предоставляются в табликовом формате, совместимом с основными программными средствами электронной таблицы. Рабочий процесс был успешно использован для определения влияния наличия источников азота на метаболизм липидов в S. pombe24. Теперь мы демонстрируем функциональность рабочего процесса в S. pombe, S. japonicus и S. cerevisiae, используя условия роста или мутанты, которые влияют на содержание клеточного LD.
протокол
1. Подготовка решений и средств массовой информации
-
Подготовка липидного окрашивающего раствора.
- Для приготовления бульонного липидного окрашивающего растворения растворяются 10 мг BODIPY 493/503 в 10 мл ангидроусного ДМСО (окончательная концентрация 1 мг/мл). Растворите все содержание 10 мг bodiPY 493/503 флакон, чтобы предотвратить потерю материала во время взвешивания.
ПРЕДЕКТО: DMSO может проходить через кожу. Носите соответствующее оборудование для индивидуальной защиты. - Приготовьте рабочий раствор для окрабирования липидов путем смешивания 100 л 1 мг/мЛ BODIPY 493/503 стокового раствора и 900 л ангидроусов Огонек (окончательная концентрация 0,1 мг/мл).
- Aliquot запасов и рабочих решений, и хранить на -20 градусов по Цельсию.
ПРИМЕЧАНИЕ: Растворенный БОДИПИ 493/503 стабилен в течение нескольких лет при -20 градусов по Цельсию. Однако раствор должен быть защищен от влаги и света.
- Для приготовления бульонного липидного окрашивающего растворения растворяются 10 мг BODIPY 493/503 в 10 мл ангидроусного ДМСО (окончательная концентрация 1 мг/мл). Растворите все содержание 10 мг bodiPY 493/503 флакон, чтобы предотвратить потерю материала во время взвешивания.
- Для подготовки стокового раствора для визуализации границ клеток растворите 25 мг Каскадного синего декремонта (весь флакон) в 2,5 мл деионизированной воды (окончательная концентрация 10 мг/мл). Aliquot стокового раствора и хранить при -20 градусов по Цельсию защищены от света.
- Для подготовки раствора слайд-покрытия микроскопа растворите 5 мг соевого лектина в 5 мл деионизированной воды (окончательная концентрация 1 мг/мл). Aliquot лектин раствор и хранить при -80 градусов по Цельсию.
ПРИМЕЧАНИЕ: Раствор лектина стабилен в течение нескольких лет при -80 градусах Цельсия. Aliquots в настоящее время в использовании могут храниться при -20 градусов по Цельсию. -
Подготовка культивирования средств массовой информации.
- Для приготовления 400 мл сложного средства выращивания YES для S. pombe и S. japonicus растворите 2 г дрожжевого экстракта и 0,1 г добавок SP (при необходимости для auxotrophic мутантов) в 340 мл деионизированной воды в бутылке 500 мл и автоклаве. Добавьте 60 мл 20% (w/v) отдельно автоматической или фильтростеризованной глюкозы в асептических условиях.
- Для приготовления 400 мл определенной среды выращивания EMM для S. pombe и S. japonicus растворите 4,9 г бульона EMM без декстроза в 360 мл деионизированной воды в бутылке 500 мл и автоклаве. Добавьте 40 мл 20% (w/v) отдельно автоматической или фильтростеризованной глюкозы в асептических условиях.
ПРИМЕЧАНИЕ: Для общих руководящих принципов по S. pombe и S. japonicus культивирования см. - Для подготовки 300 мл сложного среды выращивания YPAD для Saccharomyces cerevisiae,растворить 3 г дрожжевого экстракта, 6 г пептона и 30 мг сульфата аденина в 270 мл деионизированной воды в бутылке 500 мл и автоклаве. Добавьте 30 мл 20% (w/v) отдельно автоматической или фильтростеризованной глюкозы в асептических условиях.
- Для приготовления 300 мл определенной минимальной среды для S. cerevisiae, растворите 2 г дрожжевой азотной базы (без аминокислот) в 270 мл деионизированной воды в бутылке 500 мл и автоклаве. Добавьте 30 мл 20% (w/v) отдельно автоматической или фильтростеризованной глюкозы в асептических условиях.
ПРИМЕЧАНИЕ: Для общих директив на s. cerevisiae культивировании см.
2. Культивирование клеток
-
Выращивание S. pombe или S. japonicus до экспоненциальной или ранней стационарной фазы.
- Утром привить 5 мл среды ДА со свежей биомассой дрожжей деления дрожжей. Инкубировать при 32 градусах Цельсия при встряхивании (180 об/мин) в течение нескольких часов.
ПРИМЕЧАНИЕ: Для всех культивирования, используйте колбы Erlenmeyer имея 10 времен том культуры для того чтобы обеспечить правильную аэрацию. Некоторые лаборатории предпочитают выращивать дрожжи деления при температуре 30 градусов по Цельсию, но температура культивирования 32 градусов по Цельсию приводит к более короткому удвоению времени без пагубного воздействия на клетки, тем самым уменьшая общее время, необходимое для проведения эксперимента25,28 . - Во второй половине дня того же дня (после по крайней мере 6 часов выращивания), разбавить культуру со свежими ДА среды до 10 мл окончательного объема культуры, так что она достигает желаемой оптической плотности (OD) (или количество клеток / мл) на следующее утро, и инкубировать при 32 градусах Цельсия с s хл/с (180 об/мин). Преимуществом является то, что время удвоения каждого используемого штамма точно определяет фактор разбавления (использовать уравнение 1).

Где Vкультура объем прекультуры, необходимых для разбавления, Vфинал является общий объем новой культуры (10 мл для стандартных культивирования), ODфинал является желаемым OD, которые будут достигнуты следующее утро, ODток в настоящее время измеряется OD прекультуры, т это время роста клеток до сбора урожая, тотставание продолжительность фазы лага (зависит от лабораторных условий, необходимо эмпирически определены) и тDT является удвоение времени штамма.
ПРИМЕЧАНИЕ: Когда экспоненциальная фаза клетки должны быть проанализированы, не позволяйте precultures достичь стационарной фазы, как это резко изменяет физиологии клеток (в том числе содержание ЛД) в течение нескольких последующих поколений. - В первой половине дня визуализации, если культура достигла несколько выше ОД, чем требуется (в случае экспоненциальной фазы клеток), разбавить его свежимИ ДА и продолжить инкубацию, по крайней мере еще два раза больше, чем окрашивание LDs. В противном случае перейти непосредственно к окрашивание (раздел 3).
- Утром привить 5 мл среды ДА со свежей биомассой дрожжей деления дрожжей. Инкубировать при 32 градусах Цельсия при встряхивании (180 об/мин) в течение нескольких часов.
-
Выращивание S. cerevisiae к экспоненциальной и стационарной фазе.
- Во второй половине дня, привить 10 мл Среды YPAD с небольшим количеством свежей подающий надежды дрожжевой биомассы и инкубировать на ночь при 30 градусов по Цельсию с тряской (180 об/ ч. ).
- Утром в день визуализации, разбавить культуру до ОД 0,1 в 10 мл Среднего среднего и расти до необходимого ОД (например, OD 1 для экспоненциальной фазы). Выполните любые разбавления культуры, описанные в шаге 2.1.2. Приступайке к окрашиванию (раздел 3).
3. Липид капли окрашивания
- Подготовьте скольжение крышки микроскопа для каждого образца, чтобы быть изображенным. Распространение 1 злицы слайд-покрытие решения на чистую крышку скольжения с помощью длинной стороны горизонтально расположен апогея наконечника. Разрешить покрытие решение полностью высохнуть и хранить крышку скользит в безпылильной среде.
ПРИМЕЧАНИЕ: Стеклянные горки и крышки могут быть очищены до использования, если это необходимо. Процедура очистки состоит из мытья моющего средства для мытья посуды, промывания водой, ночного замачивания в 3% соляной кислоты и мытья дистиллированной водой. Очищенные слайды и крышки хранятся в чистом этаноле до использования. - Измерьте OD культуры клетки или число клеток/мл, по мере необходимости. Попробуйте достичь аналогичных значений среди всех испытанных штаммов, чтобы обеспечить сопоставимые экспериментальные условия.
- Пипетка 1 мл каждой клеточной культуры до микроцентрифуговой трубки 1,5 мл. Только для S. cerevisiae добавьте 5 qL раствора слайд-покрытия, вихрь кратко, и инкубировать при 30 градусах Цельсия с тряской в течение 5 мин.
- Добавьте 1 зл липидного раствора окрашивания к каждой культуре aliquot и вихря кратко. Затем добавьте 10 зл и кратковременный элемент визуализации границ ячейки и вихрь.
ПРИМЕЧАНИЕ: Не подготовьте предварительно смешанные растворы обоих пятен, так как это приводит к закалке флуоресценции BODIPY 493/503. - Соберите клетки центрифугированием (1000 х г,3 мин, RT) и удалите почти все супернатанты (950 евро). Отреприжить клетки в оставшийся супернатант.
- Пипетка 2 Зл плотной подвески клеток на лектин покрытием покрытия скольжения и место на чистый микроскоп слайд. Клетки должны образовывать монослой. Приступить к микроскопии (раздел 4) как можно быстрее, чтобы свести к минимуму артефакты в визуализации; процесс не более двух образцов одновременно.
4. Настройка микроскопа и визуализации
-
Оптимизация условий визуализации.
ПРИМЕЧАНИЕ: Настройка микроскопа требует длительного воздействия сильных источников света, которые могут привести к повреждению образца и перекосу результатов. Таким образом, навеяйте условия визуализации с помощью выделенного образца слайда, который не будет использоваться для количественной оценки LD.- Сосредоточьтесь на клетках, используя фазовый контраст или контраст дифференциальной интерференции (DIC).
ПРИМЕЧАНИЕ: Фазовая контрастность или изображения DIC могут быть сделаны для справки, но они не используются на этапе автоматизированного анализа изображений. - Установите настройки z-стек, чтобы охватить весь объем ячейки. Общее вертикальное расстояние зависит от размера ячейки; количество оптических срезов зависит от численной диафрагмы цели (функция точечного распространения в z-оси). Установите фокус для перемещения относительно центральной фокусной плоскости.
ПРИМЕЧАНИЕ: Оптимальное количество срезов часто устанавливается программным обеспечением управления микроскопом и не нуждается в расчете вручную. Типичная ширина ячейки 3-5 мкм для S. pombe, 4-7 мкм для S. japonicus,и 3-7 мкм для S. cerevisiae. - Для изображения LD, установить интенсивность света и время экспозиции в зеленом канале (возбуждение и максимальная эмиссия BODIPY 493 и 503 нм, соответственно).
ПРИМЕЧАНИЕ: BODIPY 493/503 является очень ярким фторхромом; однако, он может быстро отбелить сястом с чрезмерно сильной интенсивностью света. Кроме того, LD-каналы являются мобильными в живых ячейках, таким образом, сводят к минимуму время экспозиции и захватывают полный зеленый канал z-стек первый (перед переходом на синий канал), чтобы предотвратить размытие артефактов. Кроме того, примите во внимание линейный диапазон камеры для интенсивности сигнала, чтобы избежать насыщенных пикселей. - Для изображения границ ячейки, установить интенсивность света и время экспозиции в синем канале (возбуждение и выбросы максима Каскад Blue dextran 400 и 420 нм, соответственно).
ПРИМЕЧАНИЕ: Интенсивность сигнала в синем канале необходима для сегментации изображений, но она не используется для самой количественной оценки LD. Поэтому оптимальные настройки в этом канале не имеют решающего значение для анализа. - Если это возможно, создайте автоматизированный экспериментальный рабочий процесс в программном обеспечении для управления микроскопом для облегчения визуализации нескольких образцов в стандартизированных условиях.
- Сосредоточьтесь на клетках, используя фазовый контраст или контраст дифференциальной интерференции (DIC).
- После оптимизации условий изображения для количественной оценки используются образцы изображений. Сосредоточьтесь на клетках и образуйте их в зеленых и синих каналах, как описано в шаге 4.1.
ПРИМЕЧАНИЕ: Все изображения должны быть приобретены с использованием одних и тех же настроек, чтобы позволить сравнение между образцами. Изображение нескольких полей зрения в выборке для получения надежных репрезентативных данных. - Сохранить синий и зеленый канал z-стек изображения в виде 16-разрядных многослойных файлов TIFF (т.е. два файла на поле зрения). Включите слова "зеленый" или "синий" в соответствующие имена файлов. Продолжить анализ изображений (раздел 5).
5. Анализ изображений
-
Визуально проверить качество приобретенных изображений.
- Открытые микроскопические изображения в ImageJ29,30 или других подходящих программного обеспечения для анализа изображений.
- Удалите все стеки изображений, содержащие значительное количество ячеек, которые двигались во время приобретения (и таким образом создали размытие артефактов).
- Удалите любые стеки изображений, содержащие высокофлуоресцентные неклеточные частицы в синем канале (например, грязь на слайде микроскопа или крышке скольжения, примеси в среде выращивания).
ПРИМЕЧАНИЕ: Очень яркие неклеточные объекты в синем канале могут создавать артефакты обнаружения ячеек или мешать обнаружению клеток в их окрестностях. - Удалите любые стеки изображений, содержащие большую долю мертвых клеток (т.е. клетки с повышенной синей флуоресценцией по сравнению с живыми клетками).
ПРИМЕЧАНИЕ: В то время как наличие небольшой доли мертвых клеток в образце, как правило, не является проблемой, и эти клетки автоматически отбрасываются во время анализа, некоторые мертвые или умирающие клетки могут иногда быть признаны живыми клетками алгоритмом сегментации и, таким образом, перекос сообщили результаты.
-
Анализ изображений в программном обеспечении MATLAB.
- Создайте основную папку и скопируйте все скрипты MATLAB в этом месте.
- Создайте субпапуру ("pombe", "cerevisiae" или "japonicus") и скопируйте файлы изображений TIFF в этом месте.
- Запустите MATLAB, откройте сценарий MAIN.m и запустите его. В меню выберите дрожжевые виды для анализа и начните обработку изображений.
ПРИМЕЧАНИЕ: Некоторые параметры, необходимые для обнаружения клеток и ЛД, предварительно установлены для конкретного вида, другие определяются автоматически при обработке изображений. Заранее установленные значения были определены эмпирически и зависят от нескольких факторов, таких как объективное увеличение, тип камеры и чувствительность, а также настройки изображения. При необходимости пользователи могут редактировать файлы скриптов, чтобы изменить предустановки, связанные с организмом, чтобы лучше отражать их экспериментальную настройку. А именно, при распознавании ячейки допустимые размеры объектов даются параметрами "minArea" и "maxArea", а минимальная доля заполненного объема в границах объекта дается по параметру "Solidity". Для распознавания LD порог яркости дается по параметру "th" (на его значение влияет в основном глубина бита изображения и интенсивность флуоресценции), а максимально приемлемый размер LD дается параметром "MaxArea". - Проверка и обработка выводных файлов по мере необходимости с помощью редактора электронных таблиц или статистического пакета; рабочий процесс производит разделенные запятой файлы CSV и сегментированные файлы TIFF с обнаруженными объектами ячейки и LD.
ПРИМЕЧАНИЕ: Рабочий процесс сегментирует изображения на фоновые и клеточные объекты, где каждый объект ячейки может состоять из нескольких смежных ячеек. Таким образом, выход в файлах "xxxx'cells.csv" не представляет одноклеточные данные и должен использоваться только для расчета метрик в расчете на единицу-единицу-ячейки-объема.
Результаты
Вся процедура обобщена в рисунке 1 для дрожжей деления (подающий надежды дрожжей рабочий процесс является аналогичным), а ниже мы приведены примеры того, как рабочий процесс может быть использован для изучения содержания ЛД в трех различных видов дрожжей в различных условиях, известных повлиять на содержание сотовой ЛД. Каждый пример представляет собой единый биологический эксперимент.
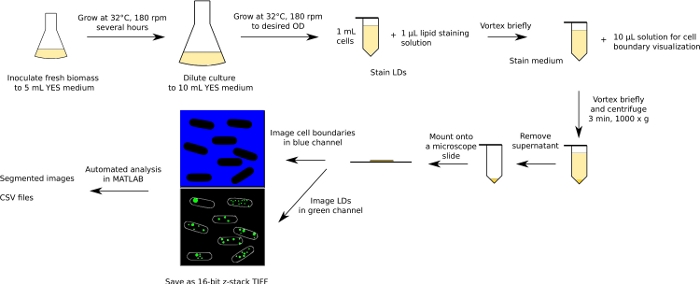
Рисунок 1: Схематическая диаграмма экспериментального и аналитического рабочего процесса. В качестве примера приводится рабочий процесс для дрожжей деления. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Во-первых, мы проанализировали S. pombe клетки(Рисунок 2). Дикий тип (WT; h С) клетки были выращены до экспоненциальной фазы либо в сложной среде YES или определенной среде EMM. По сравнению с YES, меньше LDs и выше LD окрашивания интенсивности на единицу объема клеток были обнаружены в EMM(рисунок 2A-C). Кроме того, отдельные LD, образованные в среде EMM, были крупнее и отображались повышенной общей интенсивности окрашивания(рисунок 2D,E). Это согласуется с предыдущими выводами о повышенном содержании липидов в клетках, выращенных в EMM24. Ген ppc1 кодирует фосфопантотенат-цистеин лигаза, необходимая для синтеза коэнзима А. Чувствительный к температуре ppc1-88 мутант показывает заметное снижение содержания ЛД при выращивании при ограничительной температуре31,что является примером клеток с низким сигналом BODIPY 493/503 (рисунок2A). Соответственно, по сравнению с диким типом (выращенным при 32 градусах Цельсия), меньшие ЛД с более низкой общей интенсивностью окрашивания были обнаружены в клетках ppc1-88, выращенных в ДА после перехода на 36 градусов по Цельсию(рисунок 2D,E), без каких-либо видимых изменений в номере LD на единица объема клеток(рисунок 2B).
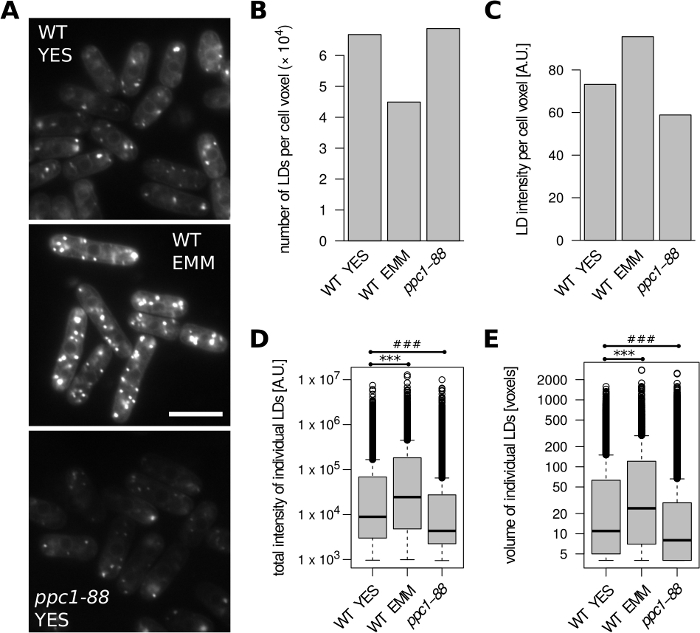
Рисунок 2: Влияние роста носителей и мутации липидного метаболизма на содержание ЛД в S. pombe. Дикий тип (WT) и ppc1-88 клетки были выращены до экспоненциальной фазы в комплексе ДА или определены EMM среды, как указано. Клетки WT были выращены при 32 градусах Цельсия. Чувствительные к температуре ppc1-88 клетки были выращены при температуре 25 градусов по Цельсию и сдвинуты до 36 градусов по Цельсию в течение 2 часов до анализа. (A) Представитель необработанных микроскопических изображений LDs окрашенных с BODIPY 493/503. Для каждого состояния отображается один оптический срез; 10% наложения с перевернутым синим каналом было добавлено, чтобы лучше визуализировать границы клеток. Шкала бар No 10 мкм. (B) Количество выявленных LDs на единицу объема клеток. (C) Интенсивность флуоресценции выявленных ЛД на единицу объема клеток. (D) Распределение общей интенсивности флуоресценции всех выявленных LDs. (E) Распределение объемов всех выявленных LDs. Данные в группах B-E были получены из 242, 124 и 191 клеточных объектов для образцов WT YES, WT EMM и ppc1-88, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Далее, мы количественно содержание ЛД в S. japonicus клеток (чйmatsj-2017)32 из экспоненциальных и раннестационарных культур, выращенных в ДА (Рисунок3A). Клетки, входящие в стационарную фазу, показали заметное снижение количества ЛД на единицу объема клеток по сравнению с экспоненциально растущими клетками(рисунок 3B),в то время как интенсивность нормализованной ЛД флуоресценции несколько снизилась между двумя условиями ( Рисунок 3C). Ранние стационарные фазы LDs, как правило, умеренно больше по размеру и умеренно выше общей интенсивности флуоресценции по сравнению с LDs от экспоненциально растущих клеток (Рисунок 3D, E).

Рисунок 3: Содержание LD в S. japonicus клетки изменяются с фазой роста. Были проанализированы экспоненциально растущие (LOG) и ранние стационарные фазы (STAT). (A) Представитель необработанных микроскопических изображений LDs окрашенных с BODIPY 493/503. Для каждого состояния отображается один оптический срез; 10% наложения с перевернутым синим каналом было добавлено, чтобы лучше визуализировать границы клеток. Шкала бар представляет 10 мкм. (B) Количество выявленных LDs на единицу объема ячейки. (C) Интенсивность флуоресценции выявленных ЛД на единицу объема клеток. (D) Распределение общей интенсивности флуоресценции всех выявленных LDs. (E) Распределение объемов всех выявленных LDs. Данные в группах B-E были получены из 274 и 187 клеточных объектов для образцов LOG и STAT, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Наконец, мы проанализировали S. cerevisiae клетки широко используемого штамма лаборатории BY4741 (MATa his3'1 leu2'0 met15'0 ura3'0) выросли до экспоненциальной и стационарной фазы, соответственно, в сложной среде YPAD. Начинающие дрожжевые клетки обычно накапливают липиды для хранения при вступлении в стационарную фазу1,и мы смогли резюмировать эти выводы (рисунок4). Стационарные клетки содержали несколько меньше LD на единицу объема по сравнению с экспоненциально растущими клетками(Рисунок 4B),но их интенсивность фуорсценсценации LD почти удвоилась (рисунок4C). Это резкое увеличение общего содержания LD было связано с гораздо более высокой интенсивностью флуоресценции и объем отдельных LDs в стационарной фазе(рисунок 4D, E).
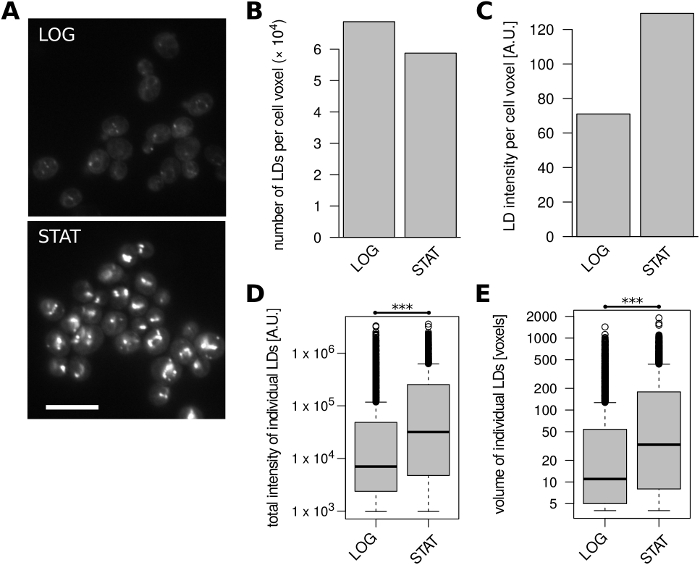
Рисунок 4: Содержание LD в S. cerevisiae клетки изменяются с фазой роста. Были проанализированы экспоненциально растущие (LOG) и стационарные фазы (STAT). (A) Представитель необработанных микроскопических изображений LDs окрашенных с BODIPY 493/503. Для каждого состояния отображается один оптический срез; 10% наложения с перевернутым синим каналом было добавлено, чтобы лучше визуализировать границы клеток. Шкала бар представляет 10 мкм. (B) Количество выявленных LDs на единицу объема ячейки. (C) Интенсивность флуоресценции выявленных ЛД на единицу объема клеток. (D) Распределение общей интенсивности флуоресценции всех выявленных LDs. (E) Распределение объемов всех выявленных LDs. Данные в группах B-E были получены из 430 и 441 ячеек объектов для образцов LOG и STAT, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Таким образом, наш аналитический рабочий процесс может обнаружить изменения в содержании ЛД, размера и содержания липидов в трех различных и морфологически различных видов дрожжей в различных условиях, которые положительно или отрицательно влияют на содержание клеточного ЛД.
Обсуждение
Понимание липидного метаболизма и его регуляции имеет важное значение как для базовой биологии, так и для клинического и биотехнологического применения. Содержание ЛД представляет собой удобное считывание состояния липидного метаболизма клетки, при этом флуоресцентная микроскопия является одним из основных методов, используемых для определения содержания ЛД. Представленный протокол позволяет автоматизированное обнаружение и количественное описание отдельных ЛД в трех различных и морфологически различных видов дрожжей. Насколько нам известно, подобных инструментов для расщепления дрожжей не существует. Скрипты MATLAB, необходимые для обработки изображений, включены в качестве дополнительных файлов, а также доступны в репозитории Figshare (DOI 10.6084/m9.figshare.7745738) вместе со всеми необработанными и обработанными изображениями и табулярными данными из этой рукописи, подробные описания выводных файлов CSV и R-скриптов для анализа и визуализации данных ниже по течению. Также последняя версия скриптов MATLAB доступна на GitHub (https://github.com/MartinSchatzCZ/LipidDots-analysis).
Успешный анализ ЛД во многом зависит от качества полученных изображений с флуоресценцией. Для оптимальной работы алгоритмов сегментации для микроскопии следует использовать чистые стеклянные горки, лишенные частиц пыли, клетки должны образовывать монослой (фактическое количество клеток на поле зрения не является критическим параметром) и не должны содержать большую долю мертвых клеток. Кроме того, z-stack изображения должны начаться немного ниже и конец немного выше клеток. В зависимости от конкретной микроскопической настройки пользователям может потребоваться настроить некоторые параметры в скриптах обработки изображений (например, "th" для порога интенсивности фона изображения). В то время как текущий метод способен обнаруживать и описывать отдельные LD в сегментированных объектах ячейки, рабочий процесс не производит действительно одноклеточных данных из-за трудностей с автоматизированным разделением всех отдельных ячеек. Вместо этого сообщается о содержании LD на единицу объема клеток, обобщенных для всей выборки. Это ограничение может препятствовать интерпретации данных при анализе неоднородных популяций клеток. Кроме того, следует соблюдать осторожность при работе с клетками с измененным транспортом малых молекул (например, мутантов насоса efflux), так как это может повлиять на внутриклеточную концентрацию BODIPY 493/503 и окрашивание ЛД, как это наблюдается в виде липофильных красителей Нила Красных33 , 34.
Окрашивание среды с клетками непроницаемой Каскад Синий флуоресцентный декесцент является удобным способом отличия клеток от фона35, которые могут быть применены ко многим (если не все) дрожжей видов. Он также помогает с автоматизированным удалением мертвых клеток от анализа, поскольку они станут синими при окрашивании. Любые умирающие или больные (и, следовательно, частично проницаемые для декстран) клетки, обнаруженные как живые, могут быть удалены в ходе шагов анализа данных, основанных на значении "IntensityMedianBlue" обнаруженных клеток. В принципе, весь рабочий процесс может быть использован для обнаружения различных других клеточных структур, таких как очаги репарации ДНК, при условии, что структуры могут быть помечены подходящими флюорофорами. Рабочий процесс также должен быть применим к клеткам других (дрожжевых) видов, что еще больше расширяет его полезность.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Чарльзуниверситет гранты PRIMUS/MED/26, GAUK 1308217 и SVV 260310. Мы благодарим Ондржея Зебеста за помощь в микроскопии и разработке конвейера анализа изображений. Мы благодарим лабораторию ReGenEx за штаммы S. cerevisiae, а также лабораторию JapoNet и Хиронари Ники за штаммы S. japonicus. Ppc1-88 штамм был предоставлен Дрожжи генетический ресурсный центр Японии. Микроскопия проводилась в Лаборатории конфокальной и флуоресценцийной микроскопии, совместно финансируемой Европейским фондом регионального развития и государственным бюджетом Чешской Республики (Проект No. К.1.05/4.1.00/16.0347 и КЗ.2.16/3.1.00/21515).
Материалы
| Name | Company | Catalog Number | Comments |
| 12-bit monochromatic CCD camera Hamamatsu ORCA C4742-80-12AG | Hamamatsu | or equivalent | |
| Adenine hemisulfate salt, ≥99% | Merck | A9126-25G | |
| BODIPY 493/503 (4,4-Difluoro-1,3,5,7,8-Pentamethyl-4-Bora-3a,4a-Diaza-s-Indacene) | Thermo Fisher Scientific | D3922 | for neutral lipid staining |
| D-(+) - Glucose, ≥99.5% | Merck | G7021 | |
| Dextran, Cascade Blue, 10,000 MW, Anionic, Lysine Fixable | Thermo Fisher Scientific | D1976 | for negative staining of cells |
| Dimethyl sulfoxide, ≥99.5% | Merck | D4540 | or higher purity, keep anhydrous on molecular sieves |
| EMM broth without dextrose | Formedium | PMD0405 | medium may also be prepared from individual components |
| Fiji/ImageJ software | NIH | or equivalent; for visual inspection of microscopic data | |
| High precision cover glasses, 22 mm x 22 mm, No 1.5 | VWR | 630-2186 | use any # 1.5 cover glass |
| Image Processing Toolbox for MATLAB, version 10.0 | Mathworks | ||
| Lectin from Glycine max (soybean) | Merck | L1395 | for cell immobilization on slides |
| MATLAB software, version 9.2 | Mathworks | ||
| Microscope slide, 26 mm x 76 mm, 1 mm thickness | Knittel Glass | L762601.2 | use any microscope slide fitting your microscope stage, clean thoroughly before loading cells |
| Olympus CellR microscope with automatic z-axis objective movement | Olympus | or equivalent | |
| Pentaband filter set | Semrock | F66-985 | brightfield, green and blue channels are sufficient |
| Signal Processing Toolbox for MATLAB, version 7.4 | Mathworks | ||
| SP supplements | Formedium | PSU0101 | |
| Standard office computer capable of running MATLAB | |||
| Statistics and Machine Learning Toolbox for MATLAB, version 11.1 | Mathworks | ||
| Universal peptone M66 for microbiology | Merck | 1070431000 | |
| UPLSAPO 60XO objective | Olympus | or equivalent | |
| Yeast extract | Formedium | YEA03 | |
| Yeast nitrogen base without amino acids | Formedium | CYN0405 |
Ссылки
- Koch, B., Schmidt, C., Daum, G. Storage lipids of yeasts: a survey of nonpolar lipid metabolism in Saccharomyces cerevisiae, Pichia pastoris, and Yarrowia lipolytica. FEMS Microbiology Reviews. 38 (5), 892-915 (2014).
- Krahmer, N., Farese, R. V., Walther, T. C. Balancing the fat: lipid droplets and human disease. EMBO Molecular Medicine. 5 (7), 973-983 (2013).
- Lazar, Z., Liu, N., Stephanopoulos, G. Holistic Approaches in Lipid Production by Yarrowia lipolytica. Trends in Biotechnology. 36 (11), 1157-1170 (2018).
- Kim, D. U., et al. Analysis of a genome-wide set of gene deletions in the fission yeast Schizosaccharomyces pombe. Nature Biotechnology. 28 (6), 1628-1629 (2010).
- Giaever, G., Nislow, C. The yeast deletion collection: a decade of functional genomics. Genetics. 197 (2), 451-465 (2014).
- Meyers, A., et al. The protein and neutral lipid composition of lipid droplets isolated from the fission yeast, Schizosaccharomyces pombe. Journal of Microbiology (Seoul, Korea). 55 (2), 112-122 (2017).
- Meyers, A., et al. Lipid Droplets Form from Distinct Regions of the Cell in the Fission Yeast Schizosaccharomyces pombe. Traffic (Copenhagen, Denmark). 17 (6), 657-659 (2016).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic (Copenhagen, Denmark). 13 (5), 705-714 (2012).
- Yang, H. J., Osakada, H., Kojidani, T., Haraguchi, T., Hiraoka, Y. Lipid droplet dynamics during Schizosaccharomyces pombe sporulation and their role in spore survival. Biology Open. , 8(2016).
- Aoki, K., Shiwa, Y., Takada, H., Yoshikawa, H., Niki, H. Regulation of nuclear envelope dynamics via APC/C is necessary for the progression of semi-open mitosis in Schizosaccharomyces japonicus. Genes To Cells: Devoted To Molecular & Cellular Mechanisms. 18 (9), 733-752 (2013).
- Karolin, J., Johansson, L. B. A., Strandberg, L., Ny, T. Fluorescence and Absorption Spectroscopic Properties of Dipyrrometheneboron Difluoride (BODIPY) Derivatives in Liquids, Lipid Membranes, and Proteins. Journal of the American Chemical Society. 116 (17), 7801-7806 (1994).
- Bozaquel-Morais, B. L., Madeira, J. B., Maya-Monteiro, C. M., Masuda, C. A., Montero-Lomeli, M. A new fluorescence-based method identifies protein phosphatases regulating lipid droplet metabolism. PloS One. 5 (10), e13692(2010).
- Sitepu, I. R., et al. An improved high-throughput Nile red fluorescence assay for estimating intracellular lipids in a variety of yeast species. Journal of Microbiological Methods. 91 (2), 321-328 (2012).
- Rostron, K. A., Lawrence, C. L. Nile Red Staining of Neutral Lipids in Yeast. Methods in Molecular Biology (Clifton, N.J.). 1560, 219-229 (2017).
- Romero-Aguilar, L., Montero-Lomeli, M., Pardo, J. P., Guerra-Sánchez, G. Lipid Index Determination by Liquid Fluorescence Recovery in the Fungal Pathogen Ustilago Maydis. Journal of Visualized Experiments. (134), 1-6 (2018).
- Gupta, A., Dorlhiac, G. F., Streets, A. M. Quantitative imaging of lipid droplets in single cells. The Analyst. , (2018).
- Wolinski, H., Bredies, K., Kohlwein, S. D. Quantitative imaging of lipid metabolism in yeast: from 4D analysis to high content screens of mutant libraries. Methods in Cell Biology. , 108-365 (2012).
- Campos, V., Rappaz, B., Kuttler, F., Turcatti, G., Naveiras, O. High-throughput, nonperturbing quantification of lipid droplets with digital holographic microscopy. Journal of Lipid Research. 59 (7), 1301-1310 (2018).
- Ranall, M. V., Gabrielli, B. G., Gonda, T. J. High-content imaging of neutral lipid droplets with 1,6-diphenylhexatriene. BioTechniques. 51 (1), 35-42 (2011).
- Schnitzler, J. G., et al. Nile Red Quantifier: a novel and quantitative tool to study lipid accumulation in patient-derived circulating monocytes using confocal microscopy. Journal of Lipid Research. 58 (11), 2210-2219 (2017).
- Bombrun, M., Gao, H., Ranefall, P., Mejhert, N., Arner, P., Wählby, C. Quantitative high-content/high-throughput microscopy analysis of lipid droplets in subject-specific adipogenesis models. Cytometry. Part A the journal of the International Society for Analytical Cytology. 91 (11), 1068-1077 (2017).
- Capus, A., Monnerat, M., Ribeiro, L. C., de Souza, W., Martins, J. L., Sant’Anna, C. Application of high-content image analysis for quantitatively estimating lipid accumulation in oleaginous yeasts with potential for use in biodiesel production. Bioresource Technology. 203, 309-317 (2016).
- Lv, X., et al. Identification of gene products that control lipid droplet size in yeast using a high-throughput quantitative image analysis. Biochimica et biophysica acta. Molecular and Cell Biology Of Lipids. 1864 (2), 113-127 (2018).
- Zach, R., Tvarůžková, J., Schätz, M., Ťupa, O., Grallert, B., Převorovský, M. Mitotic defects in fission yeast lipid metabolism “cut” mutants are suppressed by ammonium chloride. FEMS Yeast Research. 18 (6), 1-7 (2018).
- Petersen, J., Russell, P. Growth and the Environment of Schizosaccharomyces pombe. Cold Spring Harbor Protocols. 2016 (3), (2016).
- Aoki, K., Furuya, K., Niki, H. Schizosaccharomyces japonicus: A Distinct Dimorphic Yeast among the Fission Yeasts. Cold Spring Harbor Protocols. (12), (2017).
- Curran, B. P. G., Bugeja, V. Basic investigations in Saccharomyces cerevisiae. Methods in Molecular Biology (Clifton, N.J.). , 1-14 (2014).
- Sabatinos, S. A., Forsburg, S. L. Molecular genetics of Schizosaccharomyces pombe. Methods in Enzymology. 470 (10), 759-795 (2010).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Molecular Reproduction and Development. 82 (7-8), 518-529 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Nakamura, T., Pluskal, T., Nakaseko, Y., Yanagida, M. Impaired coenzyme A synthesis in fission yeast causes defective mitosis, quiescence-exit failure, histone hypoacetylation and fragile DNA. Open Biology. 2 (9), 120117(2012).
- Furuya, K., Niki, H. Isolation of heterothallic haploid and auxotrophic mutants of Schizosaccharomyces japonicus. Yeast. 26 (4), 221-233 (2009).
- Ivnitski-Steele, I., et al. Identification of Nile red as a fluorescent substrate of the Candida albicans ATP-binding cassette transporters Cdr1p and Cdr2p and the major facilitator superfamily transporter Mdr1p. Analytical Biochemistry. 394 (1), 87-91 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods in Molecular Biology (Clifton, N.J.). 457 (1), 151-163 (2008).
- Graml, V., et al. A genomic Multiprocess survey of machineries that control and link cell shape, microtubule organization, and cell-cycle progression. Developmental Cell. 31 (2), 227-239 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены