Method Article
Analisi del contenuto delle goccioline lipidi in Fissione e lieviti in forati utilizzando l'elaborazione automatizzata delle immagini
In questo articolo
Riepilogo
Qui, presentiamo un'implementazione MATLAB di rilevamento automatico e descrizione quantitativa delle goccioline lipidiche nelle immagini di microscopia a fluorescenza di fissione e cellule di lievito in erba.
Abstract
Il metabolismo dei lipidi e la sua regolamentazione sono di interesse sia per le scienze della vita di base che per le biotecnologie applicate. A questo proposito, varie specie di lievito sono utilizzate come modelli nella ricerca metabolica dei lipidi o per la produzione industriale di lipidi. Le goccioline di lipidi sono corpi di archiviazione altamente dinamici e il loro contenuto cellulare rappresenta una comoda lettura dello stato metabolico lipidico. La microscopia a fluorescenza è un metodo di scelta per l'analisi quantitativa delle goccioline lipidiche cellulari, in quanto si basa su apparecchiature ampiamente disponibili e consente l'analisi delle singole goccioline lipidiche. Inoltre, l'analisi microscopica delle immagini può essere automatizzata, aumentando notevolmente la produttività complessiva dell'analisi. Qui descriviamo un flusso di lavoro sperimentale e analitico per il rilevamento automatizzato e la descrizione quantitativa delle singole goccioline di lipidi in tre diverse specie di lievito modello: i lieviti di fissione Schizosaccharomyces pombe e Schizosaccharomyces japonicus, e il lievito in erba Saccharomyces cerevisiae. Le goccioline di lipidi vengono visualizzate con BODIPY 493/503 e il dextran fluorescente delle cellule viene aggiunto ai mezzi di coltura per aiutare a identificare i confini delle cellule. Le cellule sono sottoposte a microscopia dell'epiorescenza 3D nei canali verde e blu e le immagini z-stack risultanti vengono elaborate automaticamente da una pipeline MATLAB. La procedura emette dati quantitativi dettagliati sul contenuto di gocciolinie di lipidi cellulari e sulle caratteristiche delle singole gocce di lipidi in un formato tabulare adatto per analisi a valle in grandi fogli di calcolo o pacchetti statistici. Forniamo analisi di esempio del contenuto di goccioline lipidiche in varie condizioni che influenzano il metabolismo dei lipidi cellulari.
Introduzione
I lipidi svolgono un ruolo cruciale nel metabolismo dell'energia cellulare e del carbonio, nella sintesi dei componenti della membrana e nella produzione di sostanze bioattive. Il metabolismo dei lipidi viene messo a punto in base alle condizioni ambientali, alla disponibilità di nutrienti e alla fase del ciclo cellulare1. Nell'uomo, il metabolismo dei lipidi è stato collegato a malattie, come l'obesità, il diabete di tipo II e il cancro2. Nell'industria, i lipidi prodotti da microrganismi, come i lieviti, rappresentano una fonte promettente di combustibili diesel rinnovabili3 . Le cellule immagazzinano lipidi neutri nelle cosiddette goccioline di lipidi (LD). Questi corpi evolutivamente conservati sono composti da triacylglycerols, steryl esters, un monostrato esterno di fosfolipidi e proteine associate1. Gli LD hanno origine nel reticolo endoplasmico, esercitano dinamiche del ciclo cellulare o della fase di crescita e sono importanti per l'omeostasi dei lipidi cellulari1. Il numero LD e la morfologia possono essere utilizzati come un comodo proxy quando si analizza il metabolismo dei lipidi in varie condizioni di crescita o durante lo screening di un gruppo di mutanti. Data la loro natura dinamica, tecniche in grado di analizzare le proprietà dei singoli LD sono di particolare interesse negli studi sul metabolismo dei lipidi.
Varie specie di lievito sono state utilizzate per descrivere le vie metaboliche legate ai lipidi e la loro regolazione, o utilizzate nella biotecnologia per produrre composti o combustibili interessanti1. Inoltre, per i lieviti modello, come il lievito in erba Saccharomyces cerevisiae o il lievito di fissione lontano correlato Schizosaccharomyces pombe, sono disponibili librerie di deformazione di delezione a livello di genoma che possono essere utilizzati per schermi4,5. Recentemente la composizione e la dinamica LD sono state descritte in S. pombe6,7,8,9, e mutanti legati al metabolismo dei lipidi sono stati isolati nel lievito modello emergente Schizosaccharomyces japonicus10.
Sono disponibili numerose tecniche per studiare contenuti e dinamiche LD. La maggior parte impiega nodi di colorazione di LD con coloranti lipofili come Nile Red o BODIPY 493/503. Quest'ultimo mostra spettri di eccitazione ed emissione più stretti, e una maggiore specificità verso i lipidi neutri (LD) rispetto ai fosfolipidi (membrane)11. I metodi fluorimetrici e di citometria di flusso sono stati utilizzati con successo in varie specie fungine per scoprire geni e condizioni di crescita che influenzano il contenuto lipidico di immagazzinamento12,13,14,15. Sebbene questi metodi siano adatti per applicazioni ad alta produttività, non possono misurare i numeri e la morfologia dei singoli LD nelle cellule, che possono differire notevolmente tra le condizioni di crescita e i genotipi. La dispersione coerente Raman o la microscopia olografica digitale sono metodi privi di etichette che producono dati a livello di LD, ma richiedono attrezzature costose specializzate16,17,18. La microscopia a fluorescenza, d'altra parte, può fornire dati dettagliati sul contenuto LD, utilizzando al contempo strumenti di analisi delle immagini e strumenti software di analisi delle immagini comunemente disponibili. Esistono diversi flussi di lavoro di analisi che presentano vari gradi di sofisticazione e automazione nel rilevamento di celle/LD dai dati immagine e sono ottimizzati per diversi tipi di cellule, come le celle metazoiconiche con LD di grandi dimensioni19,20 , 21, o lieviti in erba17,22,23. Alcuni di questi approcci funzionano solo in 2D (ad esempio, su immagini di proiezione massima), che potrebbero non riuscire a descrivere in modo affidabile il contenuto LD cellulare. A nostra conoscenza, non esistono strumenti per la determinazione del contenuto di LD e la morfologia da dati microscopici di lievito di fissione. Lo sviluppo di analisi automatizzate e robuste a livello di LD porterebbe una maggiore sensibilità e una maggiore potenza statistica e fornirebbe informazioni dettagliate sul contenuto di lipidi neutri, idealmente in più specie di lieviti.
Abbiamo sviluppato un flusso di lavoro per l'analisi dei contenuti LD da immagini di microscopia a fluorescenza 3D di cellule di lievito. Le celle vive sono colorate con BODIPY 493/503 e dextran Cascade Blue per visualizzare gli LD e determinare i limiti delle celle, rispettivamente. Le cellule sono immobilizzate su vetrini di vetro e sottoposte a imaging z-stack utilizzando un microscopio a epifluorescenza standard. Le immagini vengono poi elaborate da una pipeline automatizzata implementata in MATLAB, un pacchetto (commerciale) ampiamente utilizzato per le analisi statistiche. La pipeline esegue la pre-elaborazione delle immagini, la segmentazione (celle e sfondo, la rimozione delle celle morte) e l'identificazione LD. I dati avanzati a livello Di LD, come le dimensioni LD e l'intensità della fluorescenza, vengono quindi forniti in un formato tabulare compatibile con i principali strumenti software per fogli di calcolo. Il flusso di lavoro è stato utilizzato con successo per determinare l'impatto della disponibilità della fonte di azoto sul metabolismo dei lipidi in S. pombe24. Ora dimostriamo la funzionalità del flusso di lavoro in S. pombe, S. japonicus e S. cerevisiae, utilizzando condizioni di crescita o mutanti che influenzano il contenuto lD cellulare.
Protocollo
1. Preparazione di soluzioni e mezzi di comunicazione
-
Preparare la soluzione di colorazione dei lipidi.
- Per preparare la soluzione di colorazione dei lipidi di riserva sciogliere 10 mg di BODIPY 493/503 in 10 mL di anhydrous DMSO (concentrazione finale 1 mg/mL). Sciogliere l'intero contenuto di una fiala da 10 mg BODIPY 493/503 per evitare la perdita di materiale durante la pesatura.
ATTENZIONE: DMSO può passare attraverso la pelle. Indossare attrezzature protettive personali adeguate. - Preparare la soluzione di colorazione dei lipidi funzionante mescolando 100 luna della soluzione stock 493/503 BODIPY da 1 mg/mL e 900 -L di Anhydrous DMSO (concentrazione finale 0,1 mg/mL).
- le soluzioni di stock e di lavoro, e conservare a -20 gradi centigradi.
NOT: BoDIPY disciolto 493/503 è stabile per diversi anni a -20 gradi centigradi. Tuttavia, la soluzione deve essere protetta dall'umidità e dalla luce.
- Per preparare la soluzione di colorazione dei lipidi di riserva sciogliere 10 mg di BODIPY 493/503 in 10 mL di anhydrous DMSO (concentrazione finale 1 mg/mL). Sciogliere l'intero contenuto di una fiala da 10 mg BODIPY 493/503 per evitare la perdita di materiale durante la pesatura.
- Per preparare la soluzione stock per la visualizzazione dei confini delle cellule, sciogliere 25 mg di Dextran Cascade Blue (intera fiala) in 2,5 mL di acqua deionizzata (concentrazione finale 10 mg/mL). la soluzione di stock e conservare a -20 gradi centigradi protetti dalla luce.
- Per preparare la soluzione di rivestimento scorrevole del microscopio, sciogliere 5 mg di lectina di soia in 5 mL di acqua deionizzata (concentrazione finale 1 mg/mL). Aliquota la soluzione di lectina e conservare a -80 gradi centigradi.
NOT: La soluzione di lectina è stabile per diversi anni a -80 gradi centigradi. Gli aliquote attualmente in uso possono essere immagazzinati a -20 gradi centigradi. -
Preparare i mezzi di coltivazione.
- Per preparare 400 mL di complesso mezzo di coltivazione YES per S. pombe e S. japonicus, sciogliere 2 g di estratto di lievito e 0,1 g di supplementi SP (se necessario per i mutanti auxotrofici) in 340 mL di acqua dionizzata in una bottiglia da 500 mL e autoclave. Aggiungere 60 mL del 20% (w/v) di glucosio autoclaved o sterilizzato a filtro separatamente in condizioni asettiche.
- Per preparare 400 mL di mezzo di coltivazione EMM definito per S. pombe e S. japonicus, sciogliere 4,9 g di brodo EMM senza dextrose in 360 mL di acqua deionizzata in una bottiglia da 500 mL e autoclave. Aggiungere 40 mL del 20% (w/v) di glucosio autoclaved o sterilizzato a filtro separatamente in condizioni asettiche.
NOT: Per le linee guida generali sulla coltivazione S. pombe e S. japonicus vedere25 e26, rispettivamente. - Per preparare 300 mL di complesso YPAD mezzo di coltivazione per Saccharomyces cerevisiae, sciogliere 3 g di estratto di lievito, 6 g di peptone e 30 mg di solfato di adenina in 270 mL di acqua deionizzata in una bottiglia da 500 mL e autoclave. Aggiungere 30 mL del 20% (w/v) di glucosio autoclaved o sterilizzato a filtro separatamente in condizioni asettiche.
- Per preparare 300 mL di mezzo minimo definito per S. cerevisiae, sciogliere 2 g di base di azoto di lievito (senza aminoacidi) in 270 mL di acqua deionizzata in una bottiglia da 500 mL e autoclave. Aggiungere 30 mL del 20% (w/v) di glucosio autoclaved o sterilizzato a filtro separatamente in condizioni asettiche.
NOT: Per le linee guida generali sulla coltivazione S. cerevisiae vedere27.
2. Coltivazione cellulare
-
Crescere S. pombe o S. japonicus alla fase esponenziale o iniziale stazionaria.
- Al mattino, inoculare 5 mL di si medio con biomassa lievito di fissione fresca. Incubare a 32 gradi centigradi con agitazione (180 giri/min) per diverse ore.
NOT: Per tutte le coltivazioni, utilizzare flaconi Erlenmeyer con 10 volte il volume della coltura per garantire una corretta aerazione. Alcuni laboratori preferiscono coltivare lieviti di fissione a 30 gradi centigradi, ma la temperatura di coltivazione di 32 gradi centigradi comporta tempi di raddoppio più brevi senza effetti dannosi per le cellule, riducendo così il tempo totale necessario per eseguire un esperimento25,28 . - Nel tardo pomeriggio dello stesso giorno (dopo almeno 6 ore di coltivazione), diluire la coltura con un nuovo mezzo SI a un volume di coltura finale di 10 mL in modo che raggiunga la densità ottica desiderata (OD) (o numero di cellule/mL) la mattina seguente, e incubare a 32 haking (180 rpm). È vantaggioso conoscere il tempo di raddoppio di ogni ceppo usato per determinare con precisione il fattore di diluizione (utilizzare l'equazione 1).

Se lacultura Vè il volume di precultura necessario per la diluizione, Vfinale è il volume totale della nuova coltura (10 mL per le colture standard), ODfinal è l'OD desiderato da raggiungere la corrente OD è l'OD attualmente misurata della precultura, t è il tempo di crescita cellulare fino alla raccolta, tlag è la durata della fase di ritardo (dipende dalle condizioni di laboratorio, deve essere definito empiricamente) e tDT è il tempo di raddoppio della deformazione.
NOT: Quando le cellule di fase esponenziale devono essere analizzate, non lasciare che le preculture raggiungano la fase stazionaria in quanto questo altera drammaticamente la fisiologia cellulare (compreso il contenuto di LD) per diverse generazioni successive. - Al mattino del giorno dell'imaging, se la coltura raggiungeva OD leggermente superiore a quello richiesto (in caso di cellule di fase esponenziale), diluirlo con nuovi SI e continuare l'incubazione per almeno altri due tempi di raddoppio prima della colorazione degli LD. colorazione (Sezione 3).
- Al mattino, inoculare 5 mL di si medio con biomassa lievito di fissione fresca. Incubare a 32 gradi centigradi con agitazione (180 giri/min) per diverse ore.
-
Crescere S. cerevisiae in fase esponenziale e stazionaria.
- Nel pomeriggio, inoculare 10 mL di YPAD medio con una piccola quantità di biomassa lievito fresco in erba e incubare durante la notte a 30s C con agitazione (180 giri/m).
- La mattina del giorno dell'imaging, diluire la coltura a OD 0.1 in 10 mL di YPAD medio e crescere fino al necessario OD (ad esempio, OD 1 per la fase esponenziale). Eseguire le diluizioni delle impostazioni cultura come descritto nel passaggio 2.1.2. Procedere alla colorazione (Sezione 3).
3. Colorazione delle goccioglie a ibiadi
- Preparare uno slip di copertura al microscopio per ogni campione da immaginare. Stendere 1 - L di rivestimento scorrevole su uno slittamento pulito utilizzando il lato lungo di una punta pipetta posizionata orizzontalmente. Lasciare asciugare completamente la soluzione di rivestimento e conservare gli scivoli di copertura in un ambiente privo di polvere.
NOT: I vetrini di vetro e i copriocchiali possono essere puliti prima dell'uso, se necessario. La procedura di pulizia consiste nel lavaggio con detergente lavastoviglie, risciacquo con acqua, immersione durante la notte in acido cloridrico del 3% e lavaggio con acqua distillata. I vetrini puliti e i copricapi vengono conservati in etanolo puro fino all'uso. - Misurare l'OD della coltura cellulare o il numero di celle/mL, in base alle esigenze. Cercate di raggiungere valori simili tra tutti i ceppi testati per garantire condizioni sperimentali comparabili.
- Pipetta 1 mL di ogni coltura cellulare a un tubo di microcentrifuga da 1,5 mL. Solo per S. cerevisiae, aggiungere 5 le L della soluzione di rivestimento scorrevole, vortice brevemente, e incubare a 30 gradi centigradi con agitazione per 5 min.
- Aggiungere brevemente 1 l della soluzione di colorazione dei lipidi a ciascuna coltura e al vortice. Aggiungere quindi brevemente 10 l della soluzione di visualizzazione dei confini delle celle e del vortice.
NOT: Non preparare soluzioni pre-miste di entrambe le macchie in quanto questo porta allo spegnimento della fluorescenza di BODIPY 493/503. - Raccogliere le cellule mediante centrifugazione (1.000 x g, 3 min, RT) e rimuovere quasi tutti i supernatali (950 dollari l). Risospendere le cellule nel super-nilatante rimanente.
- Pipette 2 - L della sospensione cellulare densa su uno slittamento rivestito in lectin e posto su un vetrino al microscopio pulito. Le cellule dovrebbero formare un monostrato. Procedere alla microscopia (Sezione 4) il più rapidamente possibile per ridurre al minimo i manufatti nell'imaging; elaborazione massima di due campioni alla volta.
4. Impostazione del microscopio e dell'imaging
-
Ottimizzare le condizioni di imaging.
NOTA: la configurazione del microscopio richiede lunghe esposizioni a forti sorgenti luminose che potrebbero causare danni ai risultati del campione e dell'inclinazione. Pertanto, impostare le condizioni di imaging utilizzando una diapositiva campione dedicata che non verrà ulteriormente utilizzata per la quantificazione LD.- Concentrarsi sulle celle utilizzando il contrasto di fase o il contrasto di interferenza differenziale (DIC).
NOT: Il contrasto di fase o le immagini DIC possono essere scattate come riferimento, ma non vengono utilizzate durante la fase di analisi automatica delle immagini. - Impostare le impostazioni dello stack z per coprire l'intero volume della cella. La distanza verticale totale dipende dalle dimensioni della cella; il numero di fette ottiche dipende dall'apertura numerica dell'obiettivo (funzione di diffusione del punto nell'asse z). Impostare lo stato attivo per spostarsi rispetto al piano focale centrale.
NOT: Il numero ottimale di fette è spesso impostato dal software di controllo del microscopio e non deve essere calcolato manualmente. La larghezza tipica delle cellule è di 3-5 m per S. pombe, 4-7 m per S. japonicuse 3-7 m per S. cerevisiae. - Per immagini di LD, impostare l'intensità della luce e il tempo di esposizione nel canale verde (l'eccitazione e il massimo di emissione di BODIPY sono rispettivamente 493 e 503 nm).
NOT: BODIPY 493/503 è un fluorocro molto luminoso; tuttavia, può essere sbiancato rapidamente con intensità di luce eccessivamente forte. Inoltre, gli LD sono mobili nelle celle vive, riducendo così al minimo il tempo di esposizione e catturare l'intero z-stack verde-canale prima (prima di passare al canale blu) per evitare artefatti sfocatura. Inoltre, prendere in considerazione la gamma lineare della fotocamera per l'intensità del segnale per evitare i pixel saturi. - Per immaginare i limiti delle celle, impostare l'intensità della luce e il tempo di esposizione nel canale blu (l'eccitazione e il massimo di emissione di dextran Cascade Blue sono rispettivamente 400 e 420 nm).
NOT: L'intensità del segnale nel canale blu è necessaria per la segmentazione dell'immagine, ma non viene utilizzata per la quantificazione LD stessa. Pertanto, le impostazioni ottimali in questo canale non sono cruciali per l'analisi. - Se possibile, creare un flusso di lavoro sperimentale automatizzato nel software di controllo del microscopio per facilitare l'imaging di più campioni in condizioni standardizzate.
- Concentrarsi sulle celle utilizzando il contrasto di fase o il contrasto di interferenza differenziale (DIC).
- Una volta che le condizioni di imaging sono state ottimizzate, i campioni di immagine da utilizzare per la quantificazione. Concentrarsi sulle celle e visualizzarle in canali verdi e blu, come descritto nel passaggio 4.1.
NOT: Tutte le immagini devono essere acquisite utilizzando le stesse impostazioni per consentire il confronto tra i campioni. Immagine di più campi di visualizzazione per esempio per ottenere dati affidabili e rappresentativi. - Salvate le immagini dello z stack del canale blu e verde come file TIFF multilivello a 16 bit (ad esempio, due file per campo visivo). Includere le parole "verde" o "blu" nei nomi dei file corrispondenti. Procedere con l'analisi dell'immagine (Sezione 5).
5. Analisi delle immagini
-
Controllare visivamente la qualità delle immagini acquisite.
- Aprire immagini microscopiche in ImageJ29,30 o altro software di analisi delle immagini adatto.
- Rimuovere tutte le pile di immagini contenenti un numero considerevole di celle che si sono spostate durante l'acquisizione (e quindi hanno creato artefatti di sfocatura).
- Rimuovere eventuali pile di immagini contenenti particelle non cellulari altamente fluorescenti nel canale blu (ad esempio, sporcizia su vetrino al microscopio o slittamento di copertura, impurità nel mezzo di coltivazione).
NOT: Gli oggetti non cellulari molto luminosi nel canale blu possono creare artefatti di rilevamento delle cellule o interferire con il rilevamento delle cellule nelle loro vicinanze. - Rimuovere tutte le pile di immagini contenenti una grande percentuale di cellule morte (cioè cellule con maggiore fluorescenza blu rispetto alle cellule vive).
NOT: Mentre la presenza di una piccola percentuale di cellule morte nel campione non è in genere un problema e queste cellule vengono automaticamente scartate durante l'analisi, alcune cellule morte o morenti possono occasionalmente essere riconosciute come cellule vive dall'algoritmo di segmentazione e quindi inclinare i risultati riportati.
-
Analizzare le immagini nel software MATLAB.
- Creare una cartella principale e copiare tutti gli script MATLAB in questa posizione.
- Creare una sottocartella ("pombe", "cerevisiaee" o "japonicus") e copiare i file di immagine TIFF di input in questa posizione.
- Avviare MATLAB, aprire lo script MAIN.m ed eseguirlo. Nel menu selezionare le specie di lievito da analizzare e avviare l'elaborazione delle immagini.
NOT: Alcuni dei parametri necessari per il rilevamento delle cellule e l'LD sono preimpostati per la particolare specie, altri vengono determinati automaticamente durante l'elaborazione delle immagini. I valori preimpostati sono stati determinati empiricamente e dipendono da diversi fattori come l'ingrandimento oggettivo, il tipo e la sensibilità della fotocamera e le impostazioni di imaging. Se necessario, gli utenti possono modificare i file di script per modificare i preset specifici dell'organismo per riflettere meglio la loro configurazione sperimentale. Vale a dire, durante il riconoscimento delle celle le dimensioni accettabili degli oggetti sono date dai parametri "minArea" e "maxArea" e la frazione minima del volume riempito all'interno dei limiti dell'oggetto è data dal parametro "Solidity". Per il riconoscimento LD, la soglia di luminosità è data dal parametro "th" (il suo valore è influenzato principalmente dalla profondità del bit dell'immagine e dall'intensità del segnale di fluorescenza) e la dimensione Massima Accettabile LD è data dal parametro "MaxArea". - Ispezionare ed elaborare i file di output come richiesto utilizzando un editor di fogli di calcolo o un pacchetto statistico; il flusso di lavoro produce file CSV separati da punto e virgola e file TIFF segmentati con oggetti cella e LD rilevati.
NOT: Il flusso di lavoro segmenta le immagini in oggetti di sfondo e di cella, in cui ogni oggetto cella può essere composto da più celle adiacenti. Pertanto, l'output nei file "xxxx_cells.csv" non rappresenta dati a cella singola e deve essere utilizzato solo per calcolare le metriche per unità di volume.
Risultati
L'intera procedura è riassunta nella Figura 1 per i lieviti di fissione (il flusso di lavoro del lievito in erba è analogo), e di seguito forniamo esempi di come il flusso di lavoro può essere utilizzato per studiare il contenuto di LD in tre diverse specie di lievito in varie condizioni note per influire sul contenuto LD cellulare. Ogni esempio rappresenta un singolo esperimento biologico.
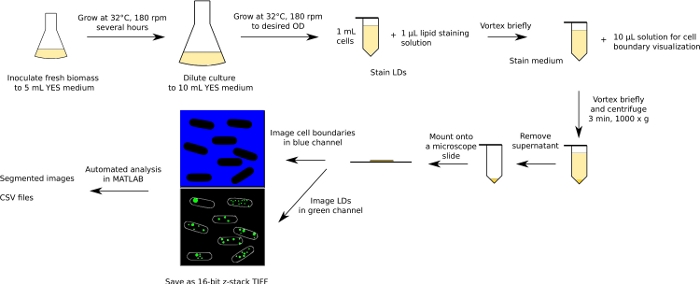
Figura 1: Diagramma schematico del flusso di lavoro sperimentale e analitico. Il flusso di lavoro per i lieviti di fissione viene visualizzato come esempio. Fare clic qui per visualizzare una versione più grande di questa figura.
In primo luogo, abbiamo analizzato le cellule S. pombe (Figura 2). Tipo selvaggio (WT; h s) le cellule sono state coltivate a fase esponenziale nel complesso mezzo SI o nel mezzo definito EMM. Rispetto a YES, nella Figura 2A -C sono stati rilevati meno LD e una maggiore intensità di colorazione LD per unità di volume cellulare (Figura 2A-C). Inoltre, i singoli LD formati in media EMM erano più grandi e mostravano una maggiore intensità di colorazione totale (Figura 2D, E). Questo è in accordo con i precedenti risultati di un aumento del contenuto di lipidi di stoccaggio nelle cellule coltivate in EMM24. Il gene ppc1 codifica una ligase fosfotto-cisteina necessaria per la sintesi coenzima A. Il mutante ppc1-88 sensibile alla temperatura mostra una marcata diminuzione del contenuto LD quando coltivato alla temperatura restrittiva31, fornendo un esempio di cellule con basso segnale BODIPY 493/503 (Figura 2A). Di conseguenza, rispetto al tipo selvaggio (cresciuto a 32 gradi centigradi), sono stati rilevati LD più piccoli con minore intensità di colorazione totale nelle celle ppc1-88 coltivate in SI in seguito a uno spostamento a 36 oC (Figura 2D, E), senza alcuna variazione apparente del numero di LD per unità di volume cellulare (Figura 2B).
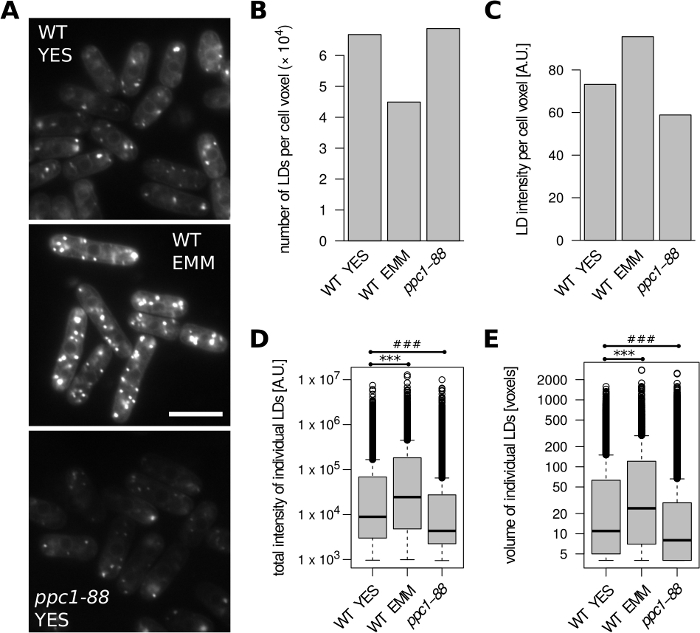
Figura 2: Impatto della crescita dei media e mutazione del metabolismo dei lipidi sul contenuto Di LD S. pombe. Le cellule di tipo selvaggio (WT) e ppc1-88 sono state cresciute fino a passare alla fase esponenziale nel complesso mezzo SI o EMM definito, come indicato. Le cellule WT sono state coltivate a 32 . Le cellule ppc1-88 sensibili alla temperatura sono state coltivate a 25oC e spostate a 36oC per 2 ore prima dell'analisi. (A) Immagini microscopiche non lavorate rappresentative di LD macchiati con BODIPY 493/503. Viene visualizzata una singola sezione ottica per ogni condizione; La sovrapposizione del 10% con canale blu invertito è stata aggiunta per visualizzare meglio i contorni delle celle. Barra della scala - 10 m. (B) Numero di ID identificati per unità di volume cellulare. (C) Intensità di fluorescenza degli LD identificati per unità di volume cellulare. (D) Distribuzioni dell'intensità totale della fluorescenza di tutti gli LD identificati. (E) Distribuzioni di volumi di tutti i LD identificati. I dati nei pannelli B-E sono stati derivati da 242, 124 e 191 oggetti cellulari per i campioni WT YES, WT EMM e ppc1-88, rispettivamente. Fare clic qui per visualizzare una versione più grande di questa figura.
Successivamente, abbiamo quantificato il contenuto LD nelle celle S. japonicus (h-matsj-2017)32 da colture esponenziali e di primo stazionario coltivate in YES (Figura 3A). Le celle che entrano nella fase stazionaria hanno mostrato una riduzione notevole del numero di LD per unità di volume cellulare rispetto alle cellule in crescita esponenziale (Figura3B),mentre l'intensità di fluorescenza LD normalizzata del volume è leggermente diminuita tra le due condizioni ( Figura 3C). I primi LD della fase stazionaria erano in genere di dimensioni moderatamente più grandi e avevano intensità di fluorescenza totale moderatamente più elevata rispetto agli LD provenienti da cellule in crescita esponenziale (Figura 3D, E).

Figura 3: Contenuto LD in Le cellule S. japonicus cambiano con la fase di crescita. Sono state analizzate le cellule di crescita esponenziale (LOG) e della fase stazionaria iniziale (STAT). (A) Immagini microscopiche non lavorate rappresentative di LD macchiati con BODIPY 493/503. Viene visualizzata una singola sezione ottica per ogni condizione; La sovrapposizione del 10% con canale blu invertito è stata aggiunta per visualizzare meglio i contorni delle celle. La barra della scala rappresenta10 m. (B ) Numero di ID identificati per unità di volume cellulare. (C) Intensità di fluorescenza degli LD identificati per unità di volume cellulare. (D) Distribuzioni dell'intensità totale della fluorescenza di tutti i LD identificati. (E) Distribuzioni di volumi di tutti i LD identificati. I dati nei pannelli B-E sono stati derivati da 274 e 187 oggetti cella per i campioni LOG e STAT, rispettivamente. Fare clic qui per visualizzare una versione più grande di questa figura.
Infine, abbiamo analizzato le cellule di S. cerevisiae del ceppo di laboratorio BY4741 ampiamente utilizzato (MATa hisu21 leu2-0 met15-0--0 - 0 ) cresciuto a fase esponenziale e stazionaria, rispettivamente, nel complesso mezzo YPAD. Le cellule di lievito germogliatori in genere accumulano lipidi di stoccaggio al momento dell'ingresso nella fase stazionaria1, e siamo stati in grado di ricapitolare questi risultati (Figura 4). Le celle stazionarie contenevano un po' meno LD per unità di volume rispetto alle celle in crescita esponenziale (Figura 4B), ma la loro intensità di fluorescenza LD normalizzata in volume è quasi raddoppiata (Figura 4C). Questo forte aumento del contenuto complessivo di LD è dovuto all'intensità di fluorescenza molto più elevata e al volume dei singoli LD in fase stazionaria (Figura 4D, E).
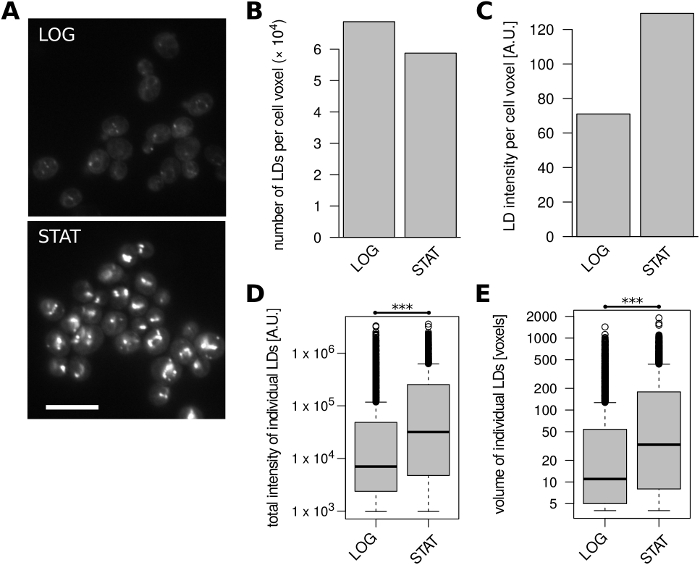
Figura 4: Contenuto LD in S. cellule cerevisiae cambia con la fase di crescita. Sono state analizzate le cellule di crescita esponenziale (LOG) e della fase stazionaria (STAT). (A) Immagini microscopiche non lavorate rappresentative di LD macchiati con BODIPY 493/503. Viene visualizzata una singola sezione ottica per ogni condizione; La sovrapposizione del 10% con canale blu invertito è stata aggiunta per visualizzare meglio i contorni delle celle. La barra della scala rappresenta10 m. (B ) Numero di ID identificati per unità di volume cellulare. (C) Intensità di fluorescenza degli LD identificati per unità di volume cellulare. (D) Distribuzioni dell'intensità totale della fluorescenza di tutti i LD identificati. (E) Distribuzioni dei volumi di tutti i LD identificati. I dati nei pannelli B-E sono stati derivati da 430 e 441 oggetti cella per i campioni LOG e STAT, rispettivamente. Fare clic qui per visualizzare una versione più grande di questa figura.
Così, il nostro flusso di lavoro di analisi può rilevare cambiamenti nel numero LD, dimensioni e contenuti lipidi in tre specie di lievito diverse e morfologicamente distinte in varie condizioni che influenzano positivamente o negativamente il contenuto di LD cellulare.
Discussione
La comprensione del metabolismo dei lipidi e della sua regolazione è importante sia per la biologia di base che per le applicazioni cliniche e biotecnologiche. Il contenuto di LD rappresenta una comoda lettura dello stato del metabolismo dei lipidi della cellula, con la microscopia a fluorescenza uno dei principali metodi utilizzati per la determinazione del contenuto LD. Il protocollo presentato consente il rilevamento automatico e la descrizione quantitativa di singoli LD in tre specie di lievito diverse e morfologicamente distinte. A nostra conoscenza, non esistono strumenti simili per i lieviti di fissione. Gli script MATLAB necessari per l'elaborazione delle immagini sono inclusi come file supplementari e sono disponibili anche dal repository Figshare (DOI 10.6084/m9.figshare.7745738) insieme a tutte le immagini grezze ed elaborate e i dati tabulari di questo manoscritto, descrizioni dettagliate dei file di output CSV e script R per l'analisi e la visualizzazione dei dati downstream. Inoltre, la versione più recente degli script MATLAB è disponibile da GitHub (https://github.com/MartinSchatzCZ/LipidDots-analysis).
Il successo dell'analisi LD dipende in gran parte dalla qualità delle immagini a fluorescenza grezza ottenute. Per prestazioni ottimali degli algoritmi di segmentazione, i vetrini di vetro puliti privi di particelle di polvere devono essere utilizzati per la microscopia, le cellule devono formare un monostrato (il numero effettivo di celle per campo visivo non è un parametro critico) e non devono contenere un gran parte delle cellule morte. Inoltre, l'imaging z-stack dovrebbe iniziare leggermente al di sotto e terminare leggermente sopra le cellule. A seconda della particolare configurazione microscopica, gli utenti potrebbero dover regolare alcuni dei parametri negli script di elaborazione delle immagini (ad esempio "th" per la soglia di intensità di sfondo dell'immagine). Mentre il metodo attuale è in grado di rilevare e descrivere i singoli LD negli oggetti cella segmentati, il flusso di lavoro non produce dati veramente a cella singola a causa di difficoltà con la separazione automatica di tutte le singole celle. Viene invece riportato contenuto LD per unità di volume di cella generalizzato per l'intero campione. Questa limitazione può ostacolare l'interpretazione dei dati nelle analisi di popolazioni cellulari eterogenee. Inoltre, occorre prestare attenzione quando si lavora con cellule con trasporto alterato di piccole molecole (ad esempio, mutanti a pompa di efflusso), in quanto ciò potrebbe influenzare la concentrazione intracellulare BODIPY 493/503 e la colorazione LD, come osservato per la colorazione lipofilica del Nilo rosso33 , 34.
Colorare il mezzo con il dextran fluorescente Cascade Blue impermeabile nelle cellule è un modo conveniente per distinguere le cellule dallo sfondo35, che può essere applicato a molte (se non tutte) specie di lievito. Aiuta anche con la rimozione automatica delle cellule morte dall'analisi come questi si trasformerà blu sulla colorazione. Tutte le cellule morenti o malate (e quindi parzialmente permeabili per dextran) rilevate come vive possono essere rimosse durante le fasi di analisi dei dati in base al valore "IntensityMedianBlue" degli oggetti cella rilevati. In linea di principio, l'intero flusso di lavoro può essere utilizzato per rilevare varie altre strutture cellulari, come i foci di riparazione del DNA, a condizione che le strutture possano essere etichettate con fluorofori adatti. Il flusso di lavoro dovrebbe essere applicabile anche alle cellule di altre specie (lievito), ampliando ulteriormente la sua utilità.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da Charles University sovvenzioni PRIMUS/MED/26, GAUK 1308217 e SVV 260310. Ringraziamo Ond'ej Ebesta per l'aiuto con la microscopia e lo sviluppo della pipeline di analisi delle immagini. Ringraziamo il laboratorio ReGenEx per i ceppi S. cerevisiae e il laboratorio di JapoNet e Hironori Niki per i ceppi S. japonicus. Il ceppo ppc1-88 è stato fornito dal Yeast Genetic Resource Center Japan. La microscopia è stata effettuata nel Laboratorio di microscopia confocale e fluorescenza cofinanziato dal Fondo europeo di sviluppo regionale e dal bilancio statale della Repubblica ceca (Progetto n. 4.1.00/1.00/16.0347 e C.2.16/3.1.00/21515).
Materiali
| Name | Company | Catalog Number | Comments |
| 12-bit monochromatic CCD camera Hamamatsu ORCA C4742-80-12AG | Hamamatsu | or equivalent | |
| Adenine hemisulfate salt, ≥99% | Merck | A9126-25G | |
| BODIPY 493/503 (4,4-Difluoro-1,3,5,7,8-Pentamethyl-4-Bora-3a,4a-Diaza-s-Indacene) | Thermo Fisher Scientific | D3922 | for neutral lipid staining |
| D-(+) - Glucose, ≥99.5% | Merck | G7021 | |
| Dextran, Cascade Blue, 10,000 MW, Anionic, Lysine Fixable | Thermo Fisher Scientific | D1976 | for negative staining of cells |
| Dimethyl sulfoxide, ≥99.5% | Merck | D4540 | or higher purity, keep anhydrous on molecular sieves |
| EMM broth without dextrose | Formedium | PMD0405 | medium may also be prepared from individual components |
| Fiji/ImageJ software | NIH | or equivalent; for visual inspection of microscopic data | |
| High precision cover glasses, 22 mm x 22 mm, No 1.5 | VWR | 630-2186 | use any # 1.5 cover glass |
| Image Processing Toolbox for MATLAB, version 10.0 | Mathworks | ||
| Lectin from Glycine max (soybean) | Merck | L1395 | for cell immobilization on slides |
| MATLAB software, version 9.2 | Mathworks | ||
| Microscope slide, 26 mm x 76 mm, 1 mm thickness | Knittel Glass | L762601.2 | use any microscope slide fitting your microscope stage, clean thoroughly before loading cells |
| Olympus CellR microscope with automatic z-axis objective movement | Olympus | or equivalent | |
| Pentaband filter set | Semrock | F66-985 | brightfield, green and blue channels are sufficient |
| Signal Processing Toolbox for MATLAB, version 7.4 | Mathworks | ||
| SP supplements | Formedium | PSU0101 | |
| Standard office computer capable of running MATLAB | |||
| Statistics and Machine Learning Toolbox for MATLAB, version 11.1 | Mathworks | ||
| Universal peptone M66 for microbiology | Merck | 1070431000 | |
| UPLSAPO 60XO objective | Olympus | or equivalent | |
| Yeast extract | Formedium | YEA03 | |
| Yeast nitrogen base without amino acids | Formedium | CYN0405 |
Riferimenti
- Koch, B., Schmidt, C., Daum, G. Storage lipids of yeasts: a survey of nonpolar lipid metabolism in Saccharomyces cerevisiae, Pichia pastoris, and Yarrowia lipolytica. FEMS Microbiology Reviews. 38 (5), 892-915 (2014).
- Krahmer, N., Farese, R. V., Walther, T. C. Balancing the fat: lipid droplets and human disease. EMBO Molecular Medicine. 5 (7), 973-983 (2013).
- Lazar, Z., Liu, N., Stephanopoulos, G. Holistic Approaches in Lipid Production by Yarrowia lipolytica. Trends in Biotechnology. 36 (11), 1157-1170 (2018).
- Kim, D. U., et al. Analysis of a genome-wide set of gene deletions in the fission yeast Schizosaccharomyces pombe. Nature Biotechnology. 28 (6), 1628-1629 (2010).
- Giaever, G., Nislow, C. The yeast deletion collection: a decade of functional genomics. Genetics. 197 (2), 451-465 (2014).
- Meyers, A., et al. The protein and neutral lipid composition of lipid droplets isolated from the fission yeast, Schizosaccharomyces pombe. Journal of Microbiology (Seoul, Korea). 55 (2), 112-122 (2017).
- Meyers, A., et al. Lipid Droplets Form from Distinct Regions of the Cell in the Fission Yeast Schizosaccharomyces pombe. Traffic (Copenhagen, Denmark). 17 (6), 657-659 (2016).
- Long, A. P., et al. Lipid droplet de novo formation and fission are linked to the cell cycle in fission yeast. Traffic (Copenhagen, Denmark). 13 (5), 705-714 (2012).
- Yang, H. J., Osakada, H., Kojidani, T., Haraguchi, T., Hiraoka, Y. Lipid droplet dynamics during Schizosaccharomyces pombe sporulation and their role in spore survival. Biology Open. , 8(2016).
- Aoki, K., Shiwa, Y., Takada, H., Yoshikawa, H., Niki, H. Regulation of nuclear envelope dynamics via APC/C is necessary for the progression of semi-open mitosis in Schizosaccharomyces japonicus. Genes To Cells: Devoted To Molecular & Cellular Mechanisms. 18 (9), 733-752 (2013).
- Karolin, J., Johansson, L. B. A., Strandberg, L., Ny, T. Fluorescence and Absorption Spectroscopic Properties of Dipyrrometheneboron Difluoride (BODIPY) Derivatives in Liquids, Lipid Membranes, and Proteins. Journal of the American Chemical Society. 116 (17), 7801-7806 (1994).
- Bozaquel-Morais, B. L., Madeira, J. B., Maya-Monteiro, C. M., Masuda, C. A., Montero-Lomeli, M. A new fluorescence-based method identifies protein phosphatases regulating lipid droplet metabolism. PloS One. 5 (10), e13692(2010).
- Sitepu, I. R., et al. An improved high-throughput Nile red fluorescence assay for estimating intracellular lipids in a variety of yeast species. Journal of Microbiological Methods. 91 (2), 321-328 (2012).
- Rostron, K. A., Lawrence, C. L. Nile Red Staining of Neutral Lipids in Yeast. Methods in Molecular Biology (Clifton, N.J.). 1560, 219-229 (2017).
- Romero-Aguilar, L., Montero-Lomeli, M., Pardo, J. P., Guerra-Sánchez, G. Lipid Index Determination by Liquid Fluorescence Recovery in the Fungal Pathogen Ustilago Maydis. Journal of Visualized Experiments. (134), 1-6 (2018).
- Gupta, A., Dorlhiac, G. F., Streets, A. M. Quantitative imaging of lipid droplets in single cells. The Analyst. , (2018).
- Wolinski, H., Bredies, K., Kohlwein, S. D. Quantitative imaging of lipid metabolism in yeast: from 4D analysis to high content screens of mutant libraries. Methods in Cell Biology. , 108-365 (2012).
- Campos, V., Rappaz, B., Kuttler, F., Turcatti, G., Naveiras, O. High-throughput, nonperturbing quantification of lipid droplets with digital holographic microscopy. Journal of Lipid Research. 59 (7), 1301-1310 (2018).
- Ranall, M. V., Gabrielli, B. G., Gonda, T. J. High-content imaging of neutral lipid droplets with 1,6-diphenylhexatriene. BioTechniques. 51 (1), 35-42 (2011).
- Schnitzler, J. G., et al. Nile Red Quantifier: a novel and quantitative tool to study lipid accumulation in patient-derived circulating monocytes using confocal microscopy. Journal of Lipid Research. 58 (11), 2210-2219 (2017).
- Bombrun, M., Gao, H., Ranefall, P., Mejhert, N., Arner, P., Wählby, C. Quantitative high-content/high-throughput microscopy analysis of lipid droplets in subject-specific adipogenesis models. Cytometry. Part A the journal of the International Society for Analytical Cytology. 91 (11), 1068-1077 (2017).
- Capus, A., Monnerat, M., Ribeiro, L. C., de Souza, W., Martins, J. L., Sant’Anna, C. Application of high-content image analysis for quantitatively estimating lipid accumulation in oleaginous yeasts with potential for use in biodiesel production. Bioresource Technology. 203, 309-317 (2016).
- Lv, X., et al. Identification of gene products that control lipid droplet size in yeast using a high-throughput quantitative image analysis. Biochimica et biophysica acta. Molecular and Cell Biology Of Lipids. 1864 (2), 113-127 (2018).
- Zach, R., Tvarůžková, J., Schätz, M., Ťupa, O., Grallert, B., Převorovský, M. Mitotic defects in fission yeast lipid metabolism “cut” mutants are suppressed by ammonium chloride. FEMS Yeast Research. 18 (6), 1-7 (2018).
- Petersen, J., Russell, P. Growth and the Environment of Schizosaccharomyces pombe. Cold Spring Harbor Protocols. 2016 (3), (2016).
- Aoki, K., Furuya, K., Niki, H. Schizosaccharomyces japonicus: A Distinct Dimorphic Yeast among the Fission Yeasts. Cold Spring Harbor Protocols. (12), (2017).
- Curran, B. P. G., Bugeja, V. Basic investigations in Saccharomyces cerevisiae. Methods in Molecular Biology (Clifton, N.J.). , 1-14 (2014).
- Sabatinos, S. A., Forsburg, S. L. Molecular genetics of Schizosaccharomyces pombe. Methods in Enzymology. 470 (10), 759-795 (2010).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Molecular Reproduction and Development. 82 (7-8), 518-529 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Nakamura, T., Pluskal, T., Nakaseko, Y., Yanagida, M. Impaired coenzyme A synthesis in fission yeast causes defective mitosis, quiescence-exit failure, histone hypoacetylation and fragile DNA. Open Biology. 2 (9), 120117(2012).
- Furuya, K., Niki, H. Isolation of heterothallic haploid and auxotrophic mutants of Schizosaccharomyces japonicus. Yeast. 26 (4), 221-233 (2009).
- Ivnitski-Steele, I., et al. Identification of Nile red as a fluorescent substrate of the Candida albicans ATP-binding cassette transporters Cdr1p and Cdr2p and the major facilitator superfamily transporter Mdr1p. Analytical Biochemistry. 394 (1), 87-91 (2009).
- Wolinski, H., Kohlwein, S. D. Microscopic analysis of lipid droplet metabolism and dynamics in yeast. Methods in Molecular Biology (Clifton, N.J.). 457 (1), 151-163 (2008).
- Graml, V., et al. A genomic Multiprocess survey of machineries that control and link cell shape, microtubule organization, and cell-cycle progression. Developmental Cell. 31 (2), 227-239 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon