Method Article
E14-E16 Sprague Dawley Sıçan Embriyosu İzole Karışık Primer Hipokampal ve Kortikal Nöronlardan Nörosfer Lerin Üretimi
Bu Makalede
Özet
Burada sunulan nörosferlerin spontan nesil yüksek yoğunluklu kaplama nöronlardan nöral progenitor hücrelerinde zenginleştirilmiş bir protokoldür. Aynı deney sırasında, nöronlar daha düşük yoğunlukta kaplandığında, protokol aynı zamanda uzun süreli birincil sıçan nöron kültürleri ile sonuçlanır.
Özet
Birincil nöron kültürü nörobilim alanında önemli bir tekniktir. Beyne daha derin mekanik anlayışlar elde etmek için, çeşitli nörobiyoloji çalışmaları için istismar edilebilir sağlam bir in vitro modeli olması esastır. Birincil nöron kültürleri (yani, uzun vadeli hipokampal kültürler) modelleri ile bilim adamları sağlamıştır rağmen, henüz tamamen beyin ağının karmaşıklığını temsil etmez. Bu sınırlamaların ardından, beyin dokusuna daha yakın bir benzerlik taşıyan nörosferler kullanılarak yeni bir model ortaya çıkmıştır. Bu protokol, embriyonik gün 14-16 Sprague Dawley sıçanlarının embriyosundan izole edilmiş karışık kortikal ve hipokampal nöronların yüksek ve düşük yoğunluklarının kaplamasını tanımlar. Bu nörosferler ve uzun vadeli birincil nöron kültürünün üretimi için iki bağımsız platformlar olarak daha fazla çalışma yürütmek için izin verir. Bu süreç son derece basit ve uygun maliyetli, birkaç adım ve reaktifler daha önce nöron kültürü için gerekli kabul en aza indirir gibi. Bu, ulaşılabilen sonuçlarla yapIlebilen ve nöroloji ile ilgili çeşitli çalışmalarda daha fazla kullanılabilen en az gereksinime sahip sağlam bir protokoldür.
Giriş
Beyin nöronal ve non-nöronal hücrelerin karmaşık bir devre olduğunu. Yıllardır, bilim adamları bu karmaşık makine hakkında bilgi edinmeye çalışıyorlar. Bunu yapmak için, nörologlar başlangıçta çeşitli dönüştürülmüş sinir tabanlı hücre hatları soruşturmalar için başvurdu. Ancak, güçlü sinaptik bağlantılar ve uygun akson veya dendritler oluşturmak için bu klonal hücre hatlarıyetersizlik birincil nöron kültürleri1bilimsel ilgi kaymıştır1 ,2. Birincil nöron kültürünün en heyecan verici yönü gözlemlemek ve yaşayan nöronları işlemek için bir fırsat oluştururolmasıdır 3. Ayrıca, nöral doku ile karşılaştırıldığında daha az karmaşıktır, hangi fonksiyon ve çeşitli nöronal proteinlerin taşınması için ideal bir aday yapar. Son zamanlarda, mikroskopik, genomik ve proteomik alanlarında çeşitli gelişmeler nöron kültürleri yararlanmak için nörologlar için yeni fırsatlar yarattık4.
Birincil kültürler nörologların nöral gelişimin arkasındaki moleküler mekanizmaları keşfetmelerine, çeşitli sinirsel sinyal yollarını analiz etmelerine ve sinaps hakkında daha tutarlı bir anlayış geliştirmelerine olanak sağlamıştır. Yöntemlerin bir dizi birincil nöronlar kültürleri rapor olmasına rağmen (çoğunlukla hipokampal kökenli5,6,7), nöronların uzun vadeli kültür sağlayan kimyasal olarak tanımlanmış bir orta ile birleşik bir protokol hala gerekli. Ancak, düşük yoğunluklu kaplama nöronlar en sık gözlenir, hangi uzun vadeli hayatta değil, muhtemelen komşu nöronlar ve glial hücreler tarafından sağlanan trofik destek eksikliği nedeniyle8. Bazı yöntemler bile glial hücreleri ile birincil nöronların co-kültüre önerdi, glial hücreler bir besleyici tabaka olarak kullanılan nerede9. Ancak, glial hücreler bazen nöronal büyüme geçersiz kılınan aşırı büyüme nedeniyle bir çok sorun teşkil10. Bu nedenle, yukarıdaki sorunlar göz önüne alındığında, daha basit ve daha uygun maliyetli birincil nöral kültür protokolü gereklidir, hangi araştırmalar için hem nörobiyologlar ve nörokimyacılar tarafından kullanılabilir.
Birincil nöron kültürü aslında 2D kültür biçimidir ve plastisite temsil etmez, mekansal bütünlük, ya da beynin heterojenlik. Bu nörosferler denilen daha inandırıcı bir 3D modeli için ihtiyaç doğurdu11,12. Nörosferler nörologlar için yeni bir platform mevcut, gerçek daha yakın bir benzerlik ile, in vivo beyin13. Nörosferler nöral kök hücreler (NSCs), nöral progenitor hücreleri (NPCs), nöronlar ve astrositler açısından zengin olan non-adherent 3D hücre kümeleridir. Onlar nöral kök hücreleri ve nöral progenitor hücrelerinizolasyon için mükemmel bir kaynak, çeşitli nöronal ve non-nöronal soylara farklılaşma çalışma için kullanılabilir. Yine, daha önce bildirilen protokoller kullanılarak üretilen nörosfer kültürleri içinde değişkenlik birleşik bir nörosfer kültür protokolü formülasyonu için bir engel sunuyor14.
Bu el yazması, karışık kortikal ve hipokampal kültürden hücre kaplama yoğunluklarını değiştirerek hem 2D hem de 3Boyutlu platformlar oluşturmanın mümkün olduğu bir protokol sunar. 7 gün içinde serbest yüzen nörosferlerin E14-E16 Sprague Dawley sıçan embriyosundan izole edilen yüksek yoğunluklu kaplama nöronlardan elde edildiği ve daha fazla kültür üzerine radyal glial benzeri uzantılar aracılığıyla köprüler ve ara bağlantılar oluşturduğu gözlenmiştir. Benzer şekilde, düşük yoğunluklu kaplama nöronlarda, haftada iki kez bakım ortamı değiştirilerek 30 güne kadar muhafaza edilebilen birincil nöron kültürü elde edilir.
Protokol
Hayvanlarla ilgili tüm deneysel prosedürler CSIR-Indian Institute of Chemical Biology Kurumsal Hayvan Etik Komitesi (IICB/AEC/Meeting/Npr/2018/1) tarafından onaylanmıştır.
1. Reaktif ve ortam hazırlama
- Poli-D-lizin (PDL) çözeltisi: PDL solüsyonları deiyonize suda 0,1 mg/mL konsantrasyonlarda hazırlayın ve kullanıma kadar 4 °C'de saklayın.
- Ayrıştırma ortamı: 1 L steril, filtrelenmiş deiyonize su, ilgili konsantrasyonlarda aşağıdaki bileşenleri birleştirmek: sodyum klorür (8 mg /mL), potasyum klorür (0.4 mg/mL), potasyum fosfat monobasic (0.06 mg/mL), D-glukoz (1 mg/mL), sodyum fosfat dibazisi (0.479 mg/mL) ve 1 M HEPES [4-(2-hidroksitil)-1-piperazineeetanesülik asit; 10 mM]. Girdap uygun karıştırma yardımcı olmak için tüm bileşenleri ve kullanıma kadar 4 ° C'de saklayın.
NOT: Dissociation ortamını, dissosilasyon sırasında buz gibi şeklinde, ancak oda sıcaklığında (RT) yıkama ve diğer amaçlar için kullanın. - Kaplama ortamı: kaplama ortamı aşağıdakilerden oluşur: minimum esansiyel orta (MEM) Earle's Balanced Salt Solution (BSS; %88.4), D-glukoz (%0.6), at serumu (%10) ve penisilin/streptomisin (%1) ile Eagle's. Bileşenleri ilgili oranlarda birleştirin ve steril koşullar altında bir başlık içinde işlemi gerçekleştirin.
NOT: Herhangi bir bileşenin bozulmasını önlemek için her zaman taze hazırlanmış kaplama ortamını kullanın. - Bakım ortamı: aşağıdaki oranları niçin birleştirerek bakım ortamı hazırlamak: nörobazal orta (%97), 0.5 mM ticari glutamin örneği elde, B27 serumsuz takviyesi (%2), ve penisilin / streptomisin (%1). Bileşenleri ilgili oranlarda birleştirin ve steril koşullar altında bir başlık içinde işlemi gerçekleştirin. Tüm bileşenlerin yeni hazırlandığından emin olun.
2. Kapak ların hazırlanması
- 12 mm çapında yuvarlak cam kapak lı slip alın ve 1 M hidroklorik asit (HCl) ile 4 saat bekletin.
- Bir çift forceps kullanarak distile suda kapakları aktarın ve asittamamen kurtulmak için yavaşça girdap.
- Yıkanmış kapakları %100 etanol içeren bir kabın içinde ek bir temizlik turu için aktarın.
- Kapakları kullanmadan önce, kağıt mendil üzerinde tutarak laminar başlık ta iyice kurulayın.
3. Nöron kültürü için poli-D-lizin kaplı plakaların hazırlanması
- İki 24 kuyu plakası alın: biri yüksek yoğunluklu kaplama için, diğeri de düşük yoğunluklu kaplama için. Steril paketleri yalnızca laminar kaputun içinde açın.
- 12 mm'lik steril cam kapakları 24 kuyu plakasında aktarın.
- Her kuyuya 300 μL PDL çözeltisi (deiyonize suda 0,1 mg/mL) dökün, böylece kapak kapaklarının yüzeyini tamamen kaplayın.
- Kurutmayı önlemek için plakaları alüminyum folyo ile sarın ve bir gecede CO2 kuluçka makinesinde saklayın.
- Ertesi gün (kaplamadan önce), PDL çözeltisini aspire edin ve 300 μL steril deiyonize su ile 2-3 kez iyice yıkayın.
- 200 μL taze hazırlanmış kaplama ortamı ekleyin ve tabakları kaplamaya kadar kuvöze geri döndürün.
4. Fetüsün çıkarılması ve kesilmesi
NOT: Alüminyum folyo içinde paketlenmiş tüm cerrahi aletleri 121 °C 'de (15 psi) 30 dakika sterilize edin. Bu künt uçlu makas bir çift içerir, forseps, ince forseps, iki ince makas, ve tüm prosedür için bir arter forseps.
- Nöronlar ve nörosferler üretmek için, zamanlanmış hamile Sprague Dawley sıçan kullanın ve E0 olarak vajinal fiş algılama ile gün işareti.
NOT: Kültür E14-E16 arasında yapılmalıdır. - Kültür gününde, buz üzerine steril bir cam Petri plaka yerleştirin ve soğuk Hank's Balanced Salt Solution (HBSS) ile doldurun.
- 90 mg ketamin/kg vücut ağırlığı ve 10 mg ksilazin/kg intraperitoneal (i.p.) enjeksiyonu ile bir E14-E16 hamile sıçan anestezi, sonra servikal çıkığı gerçekleştirerek kurban.
NOT: Sıçanlar da xylazine veya diazepam ile ketamin aşırı dozda pentobarbital veya aşırı doz da ötenazi olabilir. - % 70 etanol püskürterek baraj karnını sterilize ve steril forceps ve künt uçlu makas bir çift kullanarak karın bölgesinde V şeklinde kesim yapmak.
- Soğuk HBSS çözeltisi ile Petri plaka üzerinde dikkatle embriyonik keseleri alın.
NOT: Sadece deri için kullanılan aynı forseps ve makas kullanmayın, bu iç organları kontamine olacak gibi. İç organlar için farklı bir makas/forseps seti kullanın. - Embriyoları embriyonik keselerden taze ve soğuk HBSS'ye alın.
- Kafanın kafasını steril makasla ayırın.
5. Hipokampus ile beyin ve korteksdi çıkarılması
- Başlamadan önce 90 mm steril Petri kaplarını soğuk ve steril HBSS ile doldurun.
- Steril tabaklarda kafaları steril, künt uçlu pansuman terlikleri kullanarak aktarın.
- Stereomikroskop altında, steril, tırtıklı forceps ile prout bölgeden baş tutun ve deri ve kafatası açık keserek beyin kaldırın.
- HBSS çözeltisinde tüm embriyo beyinlerini aynı şekilde toplayın.
- Beyin sapı tutarak hemisfer ve orta beyin tüm menenjler çıkarın.
- Dikkatle hipokampus ve korteks içeren mantar kapakları benzeyen bozulmamış hemisfer kaldırın.
- 10 mL dissosyasyon ortamı içeren 15 mL konik tüpiçinde korteks ve bozulmamış hipokampus içeren hemisferleri toplayın.
6. Kortikal ve hipokampal dokunun tek nöronlara dissosiyasyonu
- Toplanan dokuların yerleşmesine ve ayrışma ortamına aspire edilmesine izin verin, bu da ortamın %5-10'unu bırakarak.
- Dokuya 10 mL taze dissociation medium ekleyin ve adım 6.1'i iki kez tekrarlayın.
- 4,5 mL dissosyation medium ve 0,5 mL %0,25 (1x) tripsin EDTA (etilen diamin tetraasetat) çözeltisi ekleyin.
- Sindirimin devam etmesi için dokuyu 37 °C'de 20 dk bekletin.
- Orta aspire ve sindirilmiş dokulara ardışık ayrışma ve kaplama orta 10 mL ekleyin.
- Sindirilmiş dokuların yerleşmesine ve dissosilasyon ortamını aspire etmesine izin verin. Kaplama orta 2,5 mL ekleyin ve 90 mm steril çanak tabanına dökün.
- En az hacmi kapamak için 1.000 μL pipet ucu kullanarak yemeğin köşe tabanındaki sindirilmiş dokuları triturate.
- Elde edilen hücre süspansiyonu, doku parçaları hariç, 70 μm hücresüzden geçirin.
- Trypan mavi boya dışlama yöntemini kullanarak canlı hücrelerin yoğunluğunu belirleyin ve otomatik hücre sayacındaki hücre sayısını sayın.
- Trypan mavi boya dışlama yöntemi için, hücre süspansiyonunun 10 μL'sini ve %0,4'lük trypan mavi lekesini alın, iyice karıştırın ve tek kullanımlık oda slaytlarının iki kapalı odasından birine karışımın 10 μL'sini ekleyin.
- Karışımı içeren slaytı hücre sayacına yerleştirin ve okumayı elde edin.
NOT: Trippan mavi boya dışlama yöntemi, canlı hücrelerin (bozulmamış zarları nedeniyle) trypan mavi boyayı dışlayacakları ve bu nedenle trypan mavisini kolayca kaldırabilecek ve mavi görünecek canlı olmayan bir hücreye kıyasla açık bir sitoplazma göstereceği prensibine dayanır. renk15.
- Yüksek yoğunlukiçin 1,5 x 105 hücre/mL ve kaplama ortamının her biri 30 mL içeren iki ayrı tüpte düşük yoğunlukiçin 20.000 hücre/mL plakaelde edilen hücre sayısını seyreltin.
- Her kuyudan daha önce eklenen kaplama ortamını aspire edin ve her kuyuda kaplama ortamına dağılmış 500°L'lik hücrelere alıbın.
- Bundan sonra plakaları 37 °C'de kuvöze, %5 CO 2'ye 4 saat içinde iade edin.
- Kaplamadan sonra 4 saat mikroskop altında yapışma için hücreleri inceleyin.
- Her iki plakadaki hücrelerin uygun şekilde yapışması varsa, her kuyudaki ortamı 500°L taze bakım ortamı ile değiştirin ve 37 °C'de kuluçkaya yatırın.
- Kültür bu nöronlar haftada bakım ortamı 2x değiştirerek 30 gün boyunca düşük yoğunlukta büyüdü.
- Kültür nörosferler ultra-düşük eki plakaları aktararak aynı bakım ortamda yüksek yoğunluklu kaplama nöronların elde.
- Önemli belirteçleri ile onları immünboyama tarafından nöronlar ve nörosferler karakterize. İmmünositokimya için, önce 30 dakika boyunca %4 formaldehit kullanarak hücreleri/nörosferleri düzeltin, sonra hücreleri 10 dakika boyunca %0,1 iyonik olmayan deterjanla geçirin.
- Her iki nöron (anti-Tuj1, GFAP, O4, tau) ve nörosferler (anti-Nestin, GFAP, Tuj1) fosfat tamponlu salin (PBS) için birincil antikorlar ekleyin 1:300 konsantrasyonları ve tüp lüzum gece de 4 °C16.
NOT: Tuj1 (sınıf III β-tubulin) ve tau primer nöronlar için pozitif belirteçler iken, GFAP (glial fibrillary asidik protein) ve O4 (oligodendrocyte marker) primer nöronlar için negatif belirteçlerdir17,18. Nörosferler durumunda, Tuj1, GFAP, ve Nestin tüm olumlu belirteçleri olarak hizmet19,20. - Ertesi gün hücreleri bir veya iki kez PBS ile yıkayın ve 2 saat boyunca RT'de 1:600 konsantrasyonlarda PBS'ye uygun ikincil antikorlar ekleyin.
NOT: Anti-Mouse veya anti-Rabbit ikincil antikorları eklenen birincil antikor konak türüne bağlı olarak seçilir. İkincil antikorların floresan mikroskopi amaçlarına uygun floresan türevlerine konjuge edilmesi gerektiği unutulmamalıdır. - Hücreleri bir veya iki kez PBS ile tekrar yıkayın.
- Hoechst 33258 (deiyonize suda 1 mg/mL stok çözeltisi) ile hücrelerin nükleer boyamasını gerçekleştirin. PBS'deki %0,1 Hoechst çözeltisini stok çözeltisinden hazırlayın ve hücrelere ekleyin.
- Hücreleri 30 dk için %0.1 Hoechst çözeltisi ile inkübe edin, sonra PBS ile tekrar yıkayın.
- Slayta 20 μL PBS (veya montaj ortamı) ekleyin ve pbs içeren slayt alanı nın üzerine lekeli hücreleri içeren kapak kaymasını yavaşça monte edin. Kapak kenarlarını dibutilftalat polistiren ksilen (DPX) ile kapatın.
- 10x ve 40x büyütme bir mikroskop altında sabit hücrelerin görüntüleme gerçekleştirin.
Sonuçlar
Bu protokolde, iki farklı nöral tarama platformundan değişken hücre kaplama yoğunluklarının elde edildiği basit bir strateji ortaya çıkarılmıştır. Şekil 1A,B yüksek ve düşük yoğunluklu kaplamalı hücrelerde nöronların kaplama 4 saat sonra hücrelerin yapışmasını göstermektedir, sırasıyla. Şekil1'de gösterildiği gibi nöronların uygun yapışmasını gözlemleyerek, kaplama ortamı kuyuların her birinde bakım ortamı ile değiştirildi ve böylece 37 °C'de kuvöze geri döndü. Yüksek yoğunluklu kaplama nöronlarda nispeten daha fazla hücre bağlılığı gözlendi. Kaplama 24 saat sonra, hem yüksek hem de düşük yoğunluklu kaplama nöronlar ayrıntılı nöronal uzantıları ve sinaptik ara bağlantılar gösterdi, Şekil 2Adiferansiyel girişim kontrastı gözlenen (DIC) görüntüleri ,B.
Şekil3A'da, kültürde 7 gün sonra düşük yoğunluklu kaplamalı nöronların faz-kontrast görüntüsü temsil edilmektedir. Burada, nöronlar dendritik dallardan oluşan ayrıntılı bir sinaptik ağ geliştirdiler. Bu nöronlar daha karmaşık nöronal ağların geliştirilmesi ile her 3 günde bir bakım ortamı değiştirerek 30 güne kadar muhafaza edilebilir. Şekil 3B,C, immünositokimyasal boyama nöronal belirteçleri Tuj1 (farklılaştırılmış nöronların bir belirteç)21 ve Tau (aksonların bir belirteç) 22 ile boyama tarafından düşük yoğunluklu kültür nöronların nöronal doğasını ortaya çıkarmak için yapıldı22 , sırasıyla. Şekil 3B'deki kırmızı renk Tuj1 boyamanın varlığını gösterir ve Şekil 3C'deki yeşil primer nöronların aksonlarında boyanması temsil eder. Nöronal kültürün saflığı astrositlerin GFAP'si için nöronal olmayan belirteçlerin (Şekil3D)ve oligodendrositlerin O4'ü için boyama olmaması ile gösterilmiştir (Şekil 3E). Mavi renkte gösterilen çekirdekler Hoechst 33258 ile boyanmıştı.
7 gün sonra yüksek yoğunluklu kaplama nöronlar spontan nörosferlerin oluşumu ile işaretlenir, Şekil 4Agözlenen ,B,C,D. 8-10 gün sonra, Şekil 4E'degörüldüğü gibi nörosferler arasında radyal glial benzeri uzantılardan oluşan farklı köprüler gözlenmiştir. Nörosferler zengin NPTs ile donatılmış, hangi coexpress belirteçleri Nestin ve Tuj123. Nörospeheres Nestin ve Tuj pozitif boyama göstermek, Şekil 524gösterildiği gibi . Mavi renkte gösterilen çekirdekler Hoechst 33258 ile lekelenmişti. Bu nörosferler ultra düşük eki plakalar onları culturing tarafından birkaç hafta muhafaza edilebilir. Şekil6'da, yaklaşık 30 gün boyunca kültürlenen nöronların uzun ömürlülüğü değerlendirildi ve hücre canlılığı geleneksel MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-difenyltetrazolium bromür] ile ~5 günlük bir aralıkla ölçüldü. nöronların 30 günlük kültürden sonra bile %90'dan fazla canlılık gösterdiğini ortaya çıkardı.
Daha sonra, yüksek ve düşük yoğunluklu tohumlu kültürlerde astrosit yüzdesi değerlendirildi. Bu metodoloji öncelikle nöronların kültüre yönelik olması nedeniyle, bu yöntemin nöronal olmayan hücreler, özellikle astrositler üzerinde nöronların tercihli büyümesini destekleyip desteklemediğini değerlendirmek önemliydi. Nörosfer oluşturan yüksek yoğunluklu tohumlu kültürde, Şekil 7A'da GFAP boyamanın yeşil rengi ile işaretlenmiş astrosit popülasyonunun varlığı gözlenmiştir; rağmen, tuj1 (kırmızı) lekeli nöronal popülasyona göre önemli ölçüde daha az gözlendi. Bu durum, Tuj1'deki hücrelerin %83'ü ile karşılaştırıldığında, hücrelerin ~%17'sinin GFAP ekspresyonu olduğu Şekil 7B'dekinicel verilerle de teyit edilmiştir.
Astrositik popülasyon da GFAP boyama yoluyla araştırıldı, nöronal popülasyon ile karşılaştırıldığında (Tuj1 boyama) düşük yoğunluklu tohumlu hücrelerde, 7 sürekli gün boyunca. Toplam hücre sayısında anlamlı bir fark gözlenmese de, 7 gün boyunca düşük tohumlama nedeniyle astrosit popülasyonunun da çok düşük olduğu gözlenmiştir (neredeyse hiç veya çok düşük GFAP boyama), çoğunluğu nöronal popülasyon (çok yüksek Tuj1 ifadesi) Şekil8A'da gözlendiği gibi.
Şekil8B'de gösterildiği gibi, astrosit popülasyonunun sadece ~%2-3'ünün ilk olarak gözlendiği cellSens yazılımı yardımıyla mikroskopi ile elde edilen astrosit ve nöronların popülasyonu sayılarak kantitatif analiz yapılmıştır. Büyümesini destekleyecek uygun ortam ve besin eksikliği nedeniyle, astrositlerin bu popülasyonu da zamanla yavaş yavaş yok olurken, en uygun faktörler ve medyanın varlığında nöronlar hızla tüm kültürü ele geçirdiler.
Şekil9'da gösterildiği gibi, NPT'lerin varlığı nedeniyle nörosferlerin de yüksek miktarda astrosit ifade ettiği, gfap'nin güçlü yeşil sinyali ile birlikte daha güçlü bir Tuj1 sinyali ile işaretlendiği gözlenmiştir. Son olarak, bu nörosferlerin zaman içinde genişleyip genişlemediğini gözlemlemek için, 1 haftalık yüksek yoğunluklu kültürden sonra, bu noktada küçük nörosferler oluşmaya başladı, birkaçı ultra düşük ek plakalarla aktarıldı ve büyümeleri her 5 günde bir izlendi. 15 gün.
Canlı/ölü hücre tonu da calcein (yeşil) ve propidium iyodür (kırmızı) kullanılarak hücrelerin sağlığını kontrol etmek için yapıldı. Genişleyen nörosferlerin kırmızı lekesiz yeşil floresan büyük miktarda gösterdiği gözlenmiştir, şekil 10A'dasunulduğu gibi, kültürde en az 15 gün boyunca nörosferlerde ölüm meydana gelmediğini gösterir. Şekil 10B'degösterildiği gibi, 15 güne kadar kültürde her 5 günde bir nörosferlerin hacimsel genişlemesi gözlendi. Nörosferlerin hacmindeki nihai artışı temsil eden çizgi grafiğini çizmek için (her zaman noktası için), 50 nörosfer incelenmiş ve ortalamaları her zaman noktasında nörosfer hacimlerini elde etmek için kullanılmıştır.

Şekil 1 : 4 saat kaplamadan sonra hücre bağlılığının temsili. (A) Yüksek Yoğunluklu kaplama nöronlarda hücre yapışması. (B) Düşük Yoğunluklu kaplamalı nöronlarda hücre bağlılığı. (A,B) ölçek çubuğu 200 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2 : Kaplama 24 saat sonra nöronların hücre morfolojisi. (A) Yüksek yoğunluklu kaplamanların hücre morfolojisi. (B) Düşük yoğunluklu kaplamanların hücre morfolojisi. (A, B) ölçek çubukları 20 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
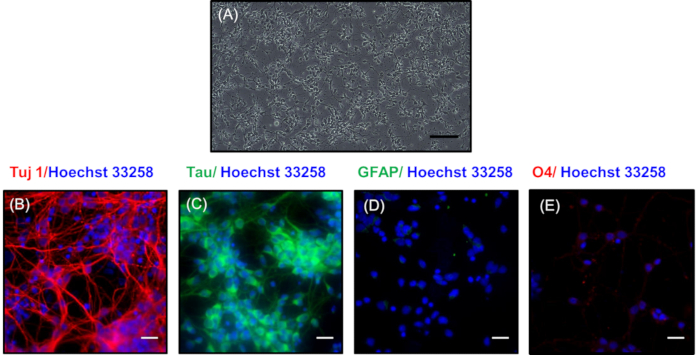
Şekil 3 : Morfolojisi ve düşük yoğunluklu kaplama nöronların karakterizasyonu 7 gün sonra. (A) Geniş filizlenme gösteren nöronların faz-kontrast görüntü. Ölçek çubuğu 200 μm. Nöronal proteinleriçin ifade gösteren yer kaplaması görüntüleri temsil eder (B) Tuj1 (kırmızı)ve (C) tau (yeşil). İmmnunositokimya nöronal olmayan proteinlerde (D) GFAP (yeşil) ve (E) O4 (kırmızı) lekelenme yokluğunu açıkça gösterir. Çekirdekleri Hoechst 33258 (mavi) ile lekeli idi. (B, C, D, E) ölçek çubukları 20 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4 : 7 gün sonra yüksek yoğunluklu kaplama nöronlarda nörosfer oluşumu. (A-D) Yüksek yoğunluklu kaplama nöronlardan kültürde 7 gün sonra kendiliğinden nörosferler üretilir. (E) Siyah oklarla gösterildiği gibi, yeni oluşan iki nörosfer arasında radyal glial benzeri uzantıların oluşumu. (A, B, C, D, E) ölçek çubukları 200 μm'yi temsil eder.
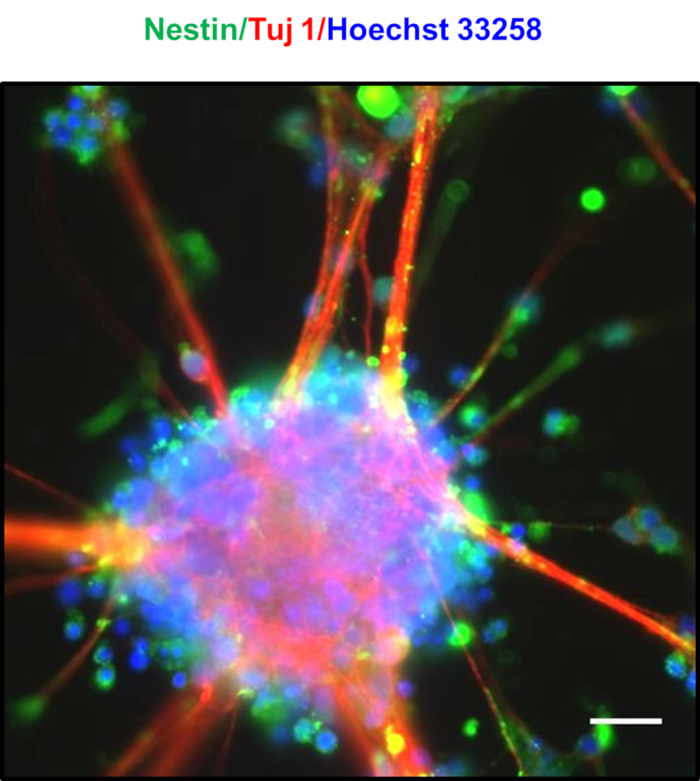
Şekil 5 : Elde edilen nörosferlerin karakterizasyonu. Nöronal protein Tuj1 (kırmızı) ve nöralkök hücre belirteci Nestin (yeşil) için ekspresyon gösteren nörosferlerin yer kaplaması görüntü, Bir NPC açısından zengin nüfus gösteren. Çekirdekleri Hoechst 33258 (mavi) ile lekeli edildi. Ölçek çubuğu 20 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6 : Primer nöronların hücre canlılığı. Çubuk grafik, 5 gün aralıklarla 30 güne kadar MTT tpatı kullanılarak değerlendirilen birincil nöronların hücre canlılığını temsil eder. Hata çubuğu değerin SD'sini temsil eder (*p < 0.05). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7 : Nöronal marker Tuj1 ve astrosit marker GFAP ile nörosfer oluşturan yüksek yoğunluklu kültürlerin karakterizasyonu. (A) Görüntü yüksek yoğunluklu tohumlu hücreleri gösterir (DIC modunda), hangi nöropsheres hem GFAP ifade üretir (astrositler için) ve Tuj1 (nöronlar için). Çekirdekler Hoechst 33258 ile lekelendi. Ölçek çubuğu 20 μm.(B) Çubuk grafiği, yüksek yoğunluklu hücreler üreten nörosferdeki Tuj1 ifade eden hücrelerin ve GFAP ifade eden hücrelerin popülasyonunun yüzdesini temsil eder. Hata çubuğu SD'yi temsil eder (*p < 0.05). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8 : Nöronal marker Tuj1 ve astrosit marker GFAP ile primer nöron kültürü için düşük yoğunluklu kaplama hücrelerin karakterizasyonu 7 güne kadar sürekli. (A) Görüntü dört farklı kanalda düşük yoğunluklu tohumlu hücreleri gösterir (yani, DIC, mavi kanal [Hoechst 33258 tarafından nükleer boyama gösterir], yeşil kanal [GFAP boyama], ve kırmızı kanal [Tuj1 boyama için]) 7 gün boyunca sürekli. Ölçek çubuğu 20 μm.'yi temsil eder. (B) Çubuk grafiği, Tuj1 ifade eden hücrelerin popülasyonlarının, birincil nöron kültürü için 7 gün boyunca düşük yoğunluklu tohumlu hücrelerdeki GFAP ifade eden hücrelere oranını temsil eder. Hata çubuğu SD'yi temsil eder (*p < 0.05). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 9 : GFAP ve Tuj1 ile elde edilen nörosferlerin immünboylab1. Elde edilen nörosferlerin görüntüleri DIC modunda (A) , (B) Nucleus Boyama Hoechst 33258, (C) astrosit marker GFAP (yeşil) ve (D) nöronal marker Tuj1 (kırmızı) bulunmaktadır. Ölçek çubuğu 20 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 10 : 15 gün içinde nörosferlerin büyüme ve canlı/ölü hücre tonu. (A) Görüntü DIC modunda 5 günlük aralıklarla 15 gün boyunca bir nörosferin büyümesini gösterir, yanı sıra kalcein ile boyama (yeşil canlı hücreleri gösterir) ve PI (kırmızı renkli propidium iyodür ölü hücreleri gösterir). Ölçek çubuğu 20 μm. (B) Grafik, 5 günlük aralıklarla 15 günlük bir süre içinde düşük yapışma plakalarında yetişen nörosferlerin büyüklüğündeki artışı temsil eder. Hata çubuğu SD'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, primer nöronların hücre kaplama yoğunluklarını değiştirerek iki değişken nöronal platformun nasıl elde edildiğini açıklar. Bu basit bir yöntem olmasına rağmen, istenilen sonuçları elde etmek için her adım titizlikle yapılmalıdır. Diğer önceki yöntemler ya uzun vadeli primer nöron kültürleri veya nörosfer kültürleri bildirilmiştir. En birincil nöron kültür protokolleri için hipokampal nöronların kültürdahil 3-5 hafta, ama çoğu başarısız oldu, nöronlar ölmek ve bağlantı kaybı nedeniyle solmaya gibi. Protokolün bir diğer avantajı, nöronların herhangi bir glial besleyici tabakasına ihtiyaç duymadan kültürlü olması, dolayısıyla nöronların saflığını korumalarıdır.
Ancak, istenilen sonuçları elde etmek için birkaç kritik adım dikkatle izlenmelidir. İlk olarak, boyunca steril koşulları korumak kesinlikle gereklidir. Başlamadan önce laminar başlıkta çoğu adımı gerçekleştirmenin yanı sıra tüm levhaları, aletleri ve cerrahi aletleri %70 alkolle önceden temizlemesi tavsiye edilir; aksi takdirde, bakteri ve mantarlar tarafından kontaminasyon nedeniyle başarısızlık daha yüksek bir şans vardır. Daha sonra, E14-16 embriyoları izole etmek önemlidir; bu nedenle, vajinal fiş algılama adımı dikkatle yapılmalıdır. Embriyonik gün arttıkça, nöronal olmayan hücreler tarafından kontaminasyon şansı ne kadar yüksektir. Hemisferlerden menenjlerin tamamen çıkarılması, nöronal olmayan hücrelerin kültüre müdahalesini azaltmak için son derece önemlidir. Her bileşen önemli bir rol oynadığından, hem kaplama hem de bakım ortamı tüm bileşenlerle birlikte yeni olarak hazırlanmalıdır. Akılda tutulması gereken bir diğer faktör, elde edilen birincil nöronların, çoğalan nöronların besin kaynağının sabit kalması için bakım ortamının haftada 2 x değiştirilerek korunması gerektiğidir.
Henüz denenmese de, hafif modifikasyonlar ile bu protokol fare embriyonik nöronlar da yararlı olabilir. İstenilen nöronlar veya nörosferler bu teknik aşağıdaki elde edilmezse, yararlı olabilir birkaç sorun giderme ipuçları vardır. Dokuları canlı tutmak için, diseksiyon buz gibi HBSS yapılmalıdır. Diseksiyon hbss tampon yerine buz gibi Krebs tampon yapılabilir. Diseksiyonun hızlı bir şekilde gerçekleştirilmesi, doku canlılığını korumanın anahtarıdır. 10x tripsin kullanımı dokunun aşırı hazımsızlığa yol açacaktır. Bu nedenle, 10x tripsin-EDTA çözeltisi sindirim den önce dissosyasyon tampon 1x seyreltilmelidir. Hücrelere buz gibi orta nın eklenmesi, donma şokuna neden olunması, ne pahasına olursa olsun kaçınılmalı ve RT'ye ulaştıktan sonra ortam kullanılmalıdır. En önemlisi, kapakları her zaman PDL ile kaplı olmalıdır, aksi takdirde nöronlar coverlips eklemez. Triturasyon adımını (yani doku düzgün sindirilmese) yaparken herhangi bir zorluk durumunda, 10 dk boyunca 0,5 mL 1 DNase eklenerek sindirim yapılabilir. Nöronal olmayan hücreler tarafından yüksek derecede kontaminasyonla karşılaşılırsa, nöronal olmayan hücrelerin büyümesini önlemek için ~5 μM sitozin arabinoside (araC) eklenmelidir.
Birden fazla avantajına rağmen, bu teknik birkaç sınırlamadan muzdarip. Bu tekniğin kendiliğinden nörosferler ürettiği bilinmektedir (ancak, tetikleyici moleküler mekanizmalar bilinmemektedir); ancak, bu teknik ile ilgili birkaç belirsizlikkalır, oluşan nörosferlerin tam boyutu ve nörosferlerin yeterli sayıda oluşturmak için gerekli gün tam sayısı gibi. Çoğunlukla, boyutu sorundur. Nörosferlerin zamanla hacim olarak genişlediği gözlenmiş olsa da, elde edilen ilk nörosferler değişken boyutlardadır. Yararlı olsa da, senkronize bir çalışma yapmak zorlaştırır. Bu nörosfer üretim protokolünü diğerlerinden ayıran şey sağlamlığı ve sadeliğidir. Özel orta gereksinimler ve kültür koşulları gerektiren nöropherelerin kültüre alınması ve yayılması için daha önce bildirilen protokoller vardır ve bunların hiçbiri bu protokolde gerekli değildir. Bu daha önce bildirilen protokollerde, nörosferler oluşturmak isteyenler için hemen hemen herhangi bir tekdüzelik yoktur.
Genel olarak, bu protokol sadece E14-E16 Sprague Dawley sıçanların embriyolarından izole primer nöronların hücre kaplama yoğunlukları değiştirerek hem 2D ve 3D nöronal platformların üretimi için benzersiz bir strateji açıklar. Bu yöntem, basit bir kurulumla gerçekleştirilebildiği ve çok daha az reaktif ve adım gerektirdiğiiçin diğer yöntemlerle karşılaştırıldığında uygun maliyetlidir. Bu nörologlar için ilgi çeşitli uygulamalar sağlayabilir. Bu çeşitli nöro-terapötik yol için tarama platformları olarak kullanılabilir, çeşitli nöronal kargo proteinlerinin rollerini gözlemleyerek, birçok nörodejeneratif hastalıklarda hücresel yolların araştırmaları, ve diğer birçok uygulama. Nörosferler daha çeşitli nöral ayırıcı ajanların taranması ve in vitro25,26nöral gelişimin erken aşamalarında çalışma için kullanılabilir.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları beyan.
Teşekkürler
CSIR-IICB hayvan tesisine teşekkür ederiz. G. D. teşekkür ICMR, J. K. ve V. G. teşekkür DST Inspire, ve D. M. teşekkür DBT, Hindistan onların burs için. S. G. mali destek sağladığı için Serb (EMR/2015/002230) Hindistan'ı kabul eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anti-GFAP | Abcam | AB7260 | |
| Anti- Nestin | Abcam | AB92391 | |
| Anti-O4 | Millipore | MAB345 | |
| Anti-Tau | Abcam | AB76128 | |
| Anti-Tuj1 | Millipore | MAB1637 | |
| B27 Serum Free Supplement | Gibco | 17504-044 | |
| Cell Counter | Life technologies | Countess II FL | |
| CO2 Incubator | Eppendorf | Galaxy 170 R | |
| D-glucose | SDFCL | 38450-K05 | |
| Ethanol | Merck Millipore | 100983 | |
| Fluorescence Microscope | Olympus | IX83 Model | |
| Formaldehyde | Sigma Aldrich | 47608 | |
| GlutaMax-I Supplement | Gibco | 35050-061 | |
| GtXMs IgG Fluor | Millipore | AP1814 | |
| GtXMs IgG (H+L) | Millipore | AP124C | |
| HEPES | SRL | 16826 | |
| Hoechst 33258 | Calbiochem | 382061 | |
| Horse Serum | HiMedia | RM10674 | |
| Hydrochloric Acid | Rankem | H0100 | |
| Laminar Hood | BioBase | BBS-V1800 | |
| MEM Eagle’s with Earle’s BSS | Sigma Aldrich | M-2279 | |
| Microscope | Dewinter | Victory Model | |
| Neurobasal Medium | Gibco | 21103-049 | |
| Plasticware (24 well plate, cell strainers, and low adherence plates) | BD Falcon | 353047, 352350 and 3471 | |
| 90 mm Petridishes | Himedia | PW001 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Poly-D-Lysine | Millipore | A.003.E | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Potassium Phosphate Monobasic | Merck | MI6M562401 | |
| Sodium Chloride | Qualigem | 15918 | |
| Sodium Phosphate Dibasic | Merck | MI6M562328 | |
| Stereomicrosope | Dewinter | Zoomstar Model | |
| Triton-X 100 | SRL | 2020130 | |
| Trypan Blue Solution | Gibco | 15250-061 | |
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 |
Referanslar
- Lorsch, J. R., Collins, F. S., Lippincott-Schwartz, J. Fixing problems with cell lines. Science. 346 (6216), 1452-1453 (2014).
- Masters, J. R. W. Cell line misidentification: the beginning of the end. Nature Reviews Cancer. 10 (6), 441-448 (2010).
- Banker, G. Culturing Nerve Cells, 2nd edition. , 339-370 (1998).
- Geschwind, D. H., Konopka, G. Neuroscience in the era of functional genomics and systems biology. Nature. 461 (7266), 908-915 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1, 2406-2415 (2006).
- Lu, Z. M., Piechowicz, M., Qiu, S. F. A Simplified Method for Ultra-Low Density, Long-Term Primary Hippocampal Neuron Culture. Journal of Visual Experiments. 109, e53797(2016).
- Kaneko, A., Sankai, Y. Long-Term Culture of Rat Hippocampal Neurons at Low Density in Serum-Free Medium: Combination of the Sandwich Culture Technique with the Three-Dimensional Nanofibrous Hydrogel PuraMatrix. PLoS ONE. 9 (7), e102703(2014).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209 (4458), 809-810 (1980).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. Journal of Neuroscience. 8 (4), 1454-1468 (1988).
- Piret, G., Perez, M. T., Prinz, C. N. Support of Neuronal Growth Over Glial Growth and Guidance of Optic Nerve Axons by Vertical Nanowire Arrays. ACS Applied Materials & Interfaces. 7 (34), 18944-18948 (2015).
- Campos, L. S. Neurospheres: Insights biology into neural stem cell biology. Journal of Neuroscience Research. 78 (6), 761-769 (2004).
- Ahmed, S. The Culture of Neural Stem Cells. Journal of Cellular Biochemistry. 106, 1-6 (2009).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Molecular Neurobiology. 34 (3), 153-161 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111, A3.B.1-A3.B.3 (2015).
- Pradhan, K., et al. Neuro-Regenerative Choline-Functionalized Injectable Graphene Oxide Hydrogel Repairs Focal Brain Injury. ACS Chemical Neuroscience. 10 (3), 1535-1543 (2019).
- Ray, B., Bailey, J. A., Sarkar, S., Lahiri, D. K. Molecular and immunocytochemical characterization of primary neuronal cultures from adult rat brain: Differential expression of neuronal and glial protein markers. Journal of Neuroscience Methods. 184 (2), 294-302 (2009).
- Robinson, A. P., Rodgers, J. M., Goings, G. E., Miller, S. D. Characterization of Oligodendroglial Populations in Mouse Demyelinating Disease Using Flow Cytometry: Clues for MS Pathogenesis. PLoS ONE. 9 (9), (2014).
- Osterberg, N., Roussa, E. Characterization of primary neurospheres generated from mouse ventral rostral hindbrain. Cell and Tissue Research. 336 (1), 11-20 (2009).
- Bernal, A., Arranz, L. Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cellular and Molecular Life Sciences. 75 (12), 2177-2195 (2018).
- Qu, Q. H., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5, 3449(2014).
- Bradke, F., Dotti, C. G. Differentiated neurons retain the capacity to generate axons from dendrites. Current Biology. 10 (22), 1467-1470 (2000).
- Theocharatos, S., et al. Regulation of Progenitor Cell Proliferation and Neuronal Differentiation in Enteric Nervous System Neurospheres. PLoS ONE. 8 (1), (2013).
- Binder, E., et al. Enteric Neurospheres Are Not Specific to Neural Crest Cultures: Implications for Neural Stem Cell Therapies. PLoS ONE. 10 (3), e0119467(2015).
- Cordey, M., Limacher, M., Kobel, S., Taylor, V., Lutolf, M. P. Enhancing the Reliability and Throughput of Neurosphere Culture on Hydrogel Microwell Arrays. Stem Cells. 26 (10), 2586-2594 (2008).
- Ladiwala, U., Basu, H., Mathur, D. Assembling Neurospheres: Dynamics of Neural Progenitor/Stem Cell Aggregation Probed Using an Optical Trap. PLoS ONE. 7 (6), (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır