Method Article
جيل من المجالات العصبية من الخلايا العصبية خلية فرس النهر الأولية المختلطة والقشرية معزولة عن E14-E16 سبراغ دولي الفئران الجنين
In This Article
Summary
يقدم هنا بروتوكول للجيل التلقائي من المجالات العصبية المخصب في الخلايا السلف العصبية من الخلايا العصبية مطلي عالية الكثافة. خلال نفس التجربة، عندما يتم طلاء الخلايا العصبية في كثافة أقل، والبروتوكول يؤدي أيضا في الثقافات العصبية الفئران الأولية لفترات طويلة.
Abstract
ثقافة الخلايا العصبية الأولية هي تقنية أساسية في مجال علم الأعصاب. للحصول على رؤى ميكانيكية أعمق في الدماغ، فمن الضروري أن يكون لديك نموذج قوي في المختبر التي يمكن استغلالها لمختلف دراسات علم الأحياء العصبية. على الرغم من أن الثقافات العصبية الأولية (أي، الثقافات فرس النهر على المدى الطويل) قدمت العلماء مع النماذج، فإنه لا يمثل حتى الآن تعقيد شبكة الدماغ تماما. في أعقاب هذه القيود، ظهر نموذج جديد باستخدام المجالات العصبية، والتي تحمل تشابها أوثق إلى أنسجة الدماغ. يصف هذا البروتوكول طلاء الكثافات العالية والمنخفضة من الخلايا العصبية القشرية وفرس النهر المختلطة المعزولة من جنين اليوم الجنيني 14-16 الفئران سبراغ داولي. وهذا يسمح لتوليد المجالات العصبية وثقافة الخلايا العصبية الأولية على المدى الطويل كمنصتين مستقلتين لإجراء مزيد من الدراسات. هذه العملية بسيطة للغاية وفعالة من حيث التكلفة, كما أنه يقلل من عدة خطوات والكواشف تعتبر سابقا ضرورية لثقافة الخلايا العصبية. هذا هو بروتوكول قوي مع الحد الأدنى من المتطلبات التي يمكن تنفيذها مع نتائج قابلة للتحقيق ومزيد من الاستخدام لتنوع الدراسات المتعلقة بعلم الأعصاب.
Introduction
الدماغ هو دوائر معقدة من الخلايا العصبية وغير العصبية. لسنوات، يحاول العلماء الحصول على نظرة ثاقبة في هذه الآلية المعقدة. وللقيام بذلك، لجأ علماء الأعصاب في البداية إلى مختلف خطوط الخلايا القائمة على الأعصاب المحولة لإجراء التحقيقات. ومع ذلك، فإن عدم قدرة هذه الخطوط الخلية clonal لتشكيل اتصالات متشابكة قوية والمحاور المناسبة أو dendrites قد تحولت الاهتمام العلمي إلى الثقافات العصبية الأولية1،2. الجانب الأكثر إثارة من ثقافة الخلايا العصبية الأولية هو أنه يخلق فرصة لمراقبة والتلاعب الخلايا العصبية الحية3. وعلاوة على ذلك، فإنه أقل تعقيدا بالمقارنة مع الأنسجة العصبية، مما يجعلها مرشحا مثاليا لدراسة وظيفة ونقل البروتينات العصبية المختلفة. في الآونة الأخيرة، ولدت العديد من التطورات في مجالات الفحص المجهري، وعلم الجينوم، والبروتيوميات فرصا جديدة لعلماء الأعصاب لاستغلال الثقافات العصبية4.
وقد سمحت الثقافات الأولية لعلماء الأعصاب باستكشاف الآليات الجزيئية وراء التطور العصبي، وتحليل مختلف مسارات الإشارات العصبية، وتطوير فهم أكثر تماسكا لنقاط الاشتباك العصبي. على الرغم من أن عددا من الأساليب قد ذكرت الثقافات من الخلايا العصبية الأولية (معظمها من أصل فرس النهر5و6و7)،بروتوكول موحد مع وسيلة محددة كيميائيا التي تمكن ثقافة طويلة الأجل من الخلايا العصبية هو لا تزال هناك حاجة. ومع ذلك، لوحظت الخلايا العصبية مطلية في كثافة منخفضة في معظم الأحيان، والتي لا البقاء على قيد الحياة على المدى الطويل، على الأرجح بسبب عدم وجود الدعم الغذائي8 التي يتم توفيرها من قبل الخلايا العصبية المجاورة والخلايا الغليفية. وقد اقترحت بعض الأساليب حتى المشاركة في زراعة الخلايا العصبية الأولية مع الخلايا الدبقية، حيث يتم استخدام الخلايا الدبقية كطبقة مغذية9. ومع ذلك، فإن الخلايا الغليفية تشكل الكثير من المشاكل بسبب فرط نموها، والتي تتجاوز في بعض الأحيان نمو الخلايا العصبية10. وبالتالي، وبالنظر إلى المشاكل المذكورة أعلاه، مطلوب بروتوكول أبسط وأكثر فعالية من حيث التكلفة للثقافة العصبية الأولية، والتي يمكن استخدامها من قبل كل من علماء الأحياء العصبية والكيميائيين العصبيين للتحقيقات.
ثقافة الخلايا العصبية الأولية هي أساسا شكل من أشكال الثقافة 2D ولا تمثل اللدونة، والسلامة المكانية، أو عدم تجانس الدماغ. وقد أدى هذا إلى الحاجة إلى نموذج 3D أكثر تصديقا يسمى neurospheres11,12. المجالات العصبية تقدم منصة جديدة لعلماء الأعصاب، مع تشابه أقرب إلى الحقيقي، في الدماغ في الجسم الحي13. المجالات العصبية هي مجموعات ثلاثية الجوانب غير ملتصقة من الخلايا الغنية بالخلايا الجذعية العصبية (NSCs)، والخلايا السلف العصبية (NPCs)، والخلايا العصبية، والخلايا النجمية. فهي مصدر ممتاز لعزل الخلايا الجذعية العصبية والخلايا السلف العصبية، والتي يمكن استخدامها لدراسة التمايز في مختلف السلالات العصبية وغير العصبية. ومرة أخرى، يشكل التغير داخل ثقافات الغلاف العصبي المنتجة باستخدام البروتوكولات المبلغ عنها سابقا عائقا أمام صياغة بروتوكول موحد لثقافة الغلاف العصبي14.
تقدم هذه المخطوطة بروتوكولًا يمكن فيه توليد منصات ثلاثية المدة وثلاثية المدة بالتناوب مع كثافات طلاء الخلايا من ثقافة القشرية وفرس النهر المختلطة. ويلاحظ أنه في غضون 7 أيام يتم الحصول على المجالات العصبية العائمة الحرة من الخلايا العصبية مطلي عالية الكثافة معزولة عن E14-E16 Sprague Dawley الفئران الجنين، والتي على مزيد من الثقافة، وتشكيل الجسور والترابط من خلال ملحقات شعاعي مثل glial. وبالمثل، في الخلايا العصبية مطلي منخفضة الكثافة، يتم الحصول على ثقافة الخلايا العصبية الأولية التي يمكن الحفاظ عليها لمدة تصل إلى 30 يوما عن طريق تغيير وسط الصيانة مرتين في الأسبوع.
Protocol
وقد وافقت اللجنة المؤسسية لأخلاقيات الحيوان التابعة للمعهد الهندي للبيولوجيا الكيميائية على جميع الإجراءات التجريبية المتعلقة بالحيوان (IICB/AEC/Meeting/Apr/2018/1).
1- الكاشف وإعداد وسائل الإعلام
- بولي-د-يسين (PDL) الحل: إعداد حلول PDL بتركيزات 0.1 ملغ / مل في الماء منزوع الأيونات وتخزينها في 4 درجة مئوية حتى الاستخدام.
- وسط التفكك: إلى 1 لتر من المياه المعقمة والمصفاة، تجمع بين المكونات التالية في التركيزات ذات الصلة: كلوريد الصوديوم (8 ملغ/مل)، كلوريد البوتاسيوم (0.4 ملغم/مل)، فوسفات البوتاسيوم أحادي القاعدة (0.06 ملغم/مل)، D-الجلوكوز (1 ملغ/مل)، ثنائي القاعدة فوسفات الصوديوم (0.479 ملغم/مل)، و1 م هيبس [4-(2-هيدروكسي إيثيل)-1-بيبرازينإيثانيسفولفونيك حمض؛ 10 مل]. دوامة جميع المكونات للمساعدة في خلط السليم وتخزينها في 4 درجة مئوية حتى استخدامها.
ملاحظة: استخدم وسيط التفكك في شكل بارد على الجليد أثناء التفكك ولكن في درجة حرارة الغرفة (RT) لأغراض الغسيل وغيرها. - وسط الطلاء: يتكون متوسط الطلاء من ما يلي: الحد الأدنى من المتوسط الأساسي (MEM) النسر مع حل الملح المتوازن إيرل (BSS؛ 88.4٪)، D-الجلوكوز (0.6٪)، مصل الحصان (10٪)، والبنسلين / العقدية (1٪). الجمع بين المكونات في النسب المعنية وتنفيذ الإجراء داخل غطاء محرك السيارة في ظل ظروف معقمة.
ملاحظة: دائماً استخدام وسيط الطلاء المعدة حديثاً لتجنب تدهور أي مكون. - صيانة المتوسطة: إعداد وسيلة الصيانة عن طريق الجمع بين ما يلي في النسب المعنية: المتوسطة العصبية (97٪)، 0.5 مليون متر تم الحصول عليها تجاريا عينة الجلوتامين، B27 الملحق خالية من المصل (2٪)، والبنسلين / العقديات (1٪). الجمع بين المكونات في النسب المعنية وتنفيذ الإجراء داخل غطاء محرك السيارة في ظل ظروف معقمة. تأكد من أن جميع المكونات يتم إعدادها حديثًا.
2- إعداد الأغطية
- خذ غطاء زجاجي مستدير قطره 12 مم وانقعه في 1 M حمض الهيدروكلوريك (حمض الهيدروكلوريك) لمدة 4 ساعة.
- نقل الأغطية في الماء المقطر باستخدام زوج من الملقط ودوامة بلطف للتخلص من حمض تماما.
- نقل الأغطية المغسولة لجولة إضافية من التنظيف في كوب يحتوي على الإيثانول 100٪.
- قبل استخدام الأغطية، تجف جيدا في غطاء محرك السيارة laminar عن طريق الاحتفاظ بها على ورقالأنسجة.
3. إعداد لوحات بولي د-يسين المغلفة لثقافة الخلايا العصبية
- خذ اثنين من 24 لوحات جيدا: واحد لطلاء عالية الكثافة وآخر لطلاء منخفض الكثافة. افتح الحزم المعقمة فقط داخل غطاء محرك السيارة لامينار.
- نقل 12 ملم من الأغطية الزجاجية المعقمة في لوحات الآبار 24.
- صب 300 ميكرولتر من محلول PDL (0.1 ملغ / مل في الماء منزوع الأيونات) في كل بئر بحيث يغطي تماما سطح الأغطية.
- التفاف لوحات مع رقائق الألومنيوم لمنع التجفيف والاحتفاظ بها في حاضنة CO2 بين عشية وضحاها.
- في اليوم التالي (قبل الطلاء)، يستنشق محلول PDL ويغسل بشكل صحيح مع 300 درجة مئوية من الماء المعقمة منزوع ة مرتين إلى ثلاث مرات.
- إضافة 200 درجة مئوية من الطلاء الطازجة المتوسطة والعودة لوحات إلى الحاضنة حتى الطلاء.
4. إزالة وقطع رأس الجنين
ملاحظة: تعقيم جميع الأدوات الجراحية معبأة في رقائق الألومنيوم في الأوتوكلاف في 121 درجة مئوية (15 رطل لكل بوصة مربعة) لمدة 30 دقيقة. وهذا يشمل زوج من مقص نهاية حادة، ملقط، ملقط غرامة، مقص ينفء، وملقط شريان واحد للإجراء بأكمله.
- لتوليد الخلايا العصبية وneurospheres، واستخدام الفئران Sprague Dawley في الوقت المناسب الحوامل وبمناسبة اليوم مع الكشف عن المكونات المهبلية كما E0.
ملاحظة: يجب تنفيذ الثقافة بين E14-E16. - في يوم الثقافة، ضع طبق بيتري الزجاجي المعقم على الثلج وملئه بمحلول الملح المتوازن البارد لهانك (HBSS).
- التخدير الفئران الحامل E14-E16 مع حقن داخل اقابية (i.p.) من 90 ملغ الكيتامين / كغ من وزن الجسم و 10 ملغ xylazine / كجم، ثم التضحية عن طريق إجراء خلع عنق الرحم.
ملاحظة: يمكن أيضا أن يتم قتل الفئران عن طريق جرعة زائدة من البنتوباربيتال أو جرعة زائدة من الكيتامين مع xylazine أو الديازيبام. - تعقيم بطن السد عن طريق رش 70٪ الإيثانول وجعل قطع على شكل V في منطقة البطن باستخدام ملقط معقمة وزوج من مقص نهاية حادة.
- تناول الأكياس الجنينية بعناية على طبق بيتري مع محلول HBSS البارد.
ملاحظة: لا تستخدم نفس الملقط والمقص التي كانت تستخدم فقط للبشرة، لأن هذا سوف يلوث الأعضاء الداخلية. استخدام مجموعة مختلفة من مقص / ملقط للأعضاء الداخلية. - أخرج الأجنة من الأكياس الجنينية في HBSS الطازجة والباردة.
- قطع الرأس بمقص معقم.
5. إزالة الدماغ وتشريح القشرة مع الحصين
- قبل البدء، املأ أطباق بيتري المعقمة عيار 90 مم بطبق HBSS البارد والعقيم.
- نقل رؤساء في الأطباق المعقمة باستخدام معقمة، ملقط خلع الملابس غير حادة.
- تحت المجهر المجسم، عقد الرأس من منطقة الوضعم مع الملقط المعقمة، مسننة وإزالة الدماغ عن طريق قطع الجلد والجمجمة مفتوحة.
- جمع جميع العقول الجنينية بنفس الطريقة في حل HBSS.
- إزالة جميع السحاين من نصفي الكرة الأرضية ومنتصف الدماغ عن طريق عقد جذع الدماغ.
- إزالة بعناية نصف الكرة الأرضية سليمة تشبه قبعات الفطر التي تحتوي على الحصين والقشرة.
- جمع نصف الكرة الأرضية التي تحتوي على القشرة والحصين سليمة في أنبوب مخروطي 15 مل تحتوي على 10 مل من وسط التفكك.
6. تفكك الأنسجة القشرية وفرس النهر في الخلايا العصبية واحدة
- السماح للأنسجة التي تم جمعها لتسوية واستنشاق وسط التفكك، وترك 5٪ -10٪ من المتوسطة في ذلك.
- إضافة 10 مل من انقطاع جديد المتوسطة إلى الأنسجة، وكرر الخطوة 6.1 مرتين.
- إضافة 4.5 مل من تفكك المتوسطة و 0.5 مل من 0.25٪ (1X) تريبسين EDTA (الإيثيلين ديامين تيتراخلات) الحل.
- الحفاظ على الأنسجة في الحاضنة في 37 درجة مئوية لمدة 20 دقيقة للهضم للمضي قدما.
- يستنشق المتوسط وإضافة 10 مل من التفكك والطلاء المتوسطة على التوالي إلى الأنسجة المهضومة.
- السماح للأنسجة المهضومة لتستقر وتستنشق وسط التفكك. إضافة 2.5 مل من الطلاء المتوسطة وتصب في قاعدة طبق معقم 90 ملم.
- تُدرّس الأنسجة المهضومة في القاعدة الزاوية للطبق باستخدام طرف ماصة بقوة 1000 ميكرولتر لتشغل الحد الأدنى من الحجم.
- تمرير تعليق الخلية التي تم الحصول عليها من خلال مصفاة الخلية 70 م، باستثناء أي قطع من الأنسجة.
- تحديد كثافة الخلايا القابلة للحياة باستخدام طريقة استبعاد صبغة الأزرق trypan وحساب عدد الخلايا في عداد الخلية الآلي.
- لطريقة استبعاد الصبغة الزرقاء trypan، خذ 10 ميكرولتر من تعليق الخلية و 10 ميكرولتر من 0.4٪ بقعة زرقاء trypan، ومزيج تماما، وإضافة 10 ميكرولتر من الخليط في واحدة من اثنين من الغرف المغلقة من الشرائح غرفة المتاح.
- أدخل الشريحة التي تحتوي على الخليط في عداد الخلية واحصل على القراءة.
ملاحظة: ويستند طريقة استبعاد صبغ ة زرقاء trypan على مبدأ أن الخلايا الحية (بسبب أغشيةها سليمة) سوف تستبعد صبغة زرقاء تريبان وبالتالي سوف تظهر السيتوبلازم واضحة، مقارنة مع خلية غير قابلة للحياة التي سوف يستغرق بسهولة الأزرق تريبان وتظهر الأزرق في اللون15.
- تخفيف عدد الخلايا التي تم الحصول عليها إلى لوحة 1.5 × 105 خلايا / مل لكثافة عالية و 20،000 خلية / مل لكثافة منخفضة في اثنين من أنابيب منفصلة تحتوي على 30 مل كل من وسط الطلاء.
- يستنشق وسيط الطلاء المضافة سابقا من كل بئر ولوحة 500 درجة مئوية من الخلايا المنتشرة في وسط الطلاء في كل بئر.
- بعد ذلك العودة لوحات إلى الحاضنة في 37 درجة مئوية و 5٪ CO2 لمدة 4 ساعة.
- فحص الخلايا للانضمام تحت المجهر 4 ح بعد الطلاء.
- إذا كان هناك التزام السليم من الخلايا في كل من لوحات، واستبدال المتوسطة في كل بئر مع 500 درجة مئوية من المتوسطة صيانة جديدة وحضانة في 37 درجة مئوية.
- ثقافة هذه الخلايا العصبية نمت في كثافة منخفضة لمدة 30 يوما عن طريق تغيير المتوسطة صيانة 2X في الأسبوع.
- ثقافة المجالات العصبية التي تم الحصول عليها من الخلايا العصبية مطلي عالية الكثافة في نفس وسيلة الصيانة عن طريق نقلها إلى لوحات المرفقات منخفضة جدا.
- تميز الخلايا العصبية والمجالات العصبية عن طريق تلطيخ المناعة لهم مع علامات هامة. للكيمياء المناعية، أولا إصلاح الخلايا / neurospheres باستخدام 4٪ الفورمالديهايد لمدة 30 دقيقة على اللوحة نفسها، ثم permeabilize الخلايا مع المنظفات غير الأيونية 0.1٪ لمدة 10 دقيقة.
- إضافة الأجسام المضادة الأولية لكلا الخلايا العصبية (المضادة لTuj1، GFAP، O4، تاو) وneurospheres (المضادة للنستين، GFAP، Tuj1) في الفوسفات المخزنة المالحة (PBS) في 1:300 تركيزات وحضانة بين عشية وضحاها في 4 °C16.
ملاحظة: Tuj1 (الفئة الثالثة β-tubulin) وتاو هي علامات إيجابية للخلايا العصبية الأولية، في حين GFAP (البروتين الحمضي الليفي الغليفي) وO4 (علامة oligodendrocyte) هي علامات سلبية للخلايا العصبية الأولية17،18. في حالة المجالات العصبية، Tuj1، GFAP، وNestin كلها بمثابة علامات إيجابية19،20. - في اليوم التالي، غسل الخلايا مع PBS مرة أو مرتين وإضافة الأجسام المضادة الثانوية المناسبة في PBS في تركيزات 1:600 في RT لمدة 2 ساعة.
ملاحظة: يتم تحديد الأجسام المضادة للماوس أو المضادة للأرنب الثانوية اعتماداً على الأنواع المضيفة للجسم المضاد الأساسي المضافة. وينبغي أن يوضع في الاعتبار أن الأجسام المضادة الثانوية يجب أن تكون مترافقة مع مشتقات الفلورة مناسبة لأغراض التنظير المجهري الفلوري. - اغسل الخلايا مرة أخرى مع PBS مرة أو مرتين.
- إجراء تلطيخ نووي للخلايا مع Hoechst 33258 (1 ملغ / مل حل الأسهم في الماء منزوع الأيونات). إعداد 0.1٪ حل Hoechst في PBS من حل الأسهم وإضافته إلى الخلايا.
- احتضان الخلايا مع 0.1٪ حل Hoechst لمدة 30 دقيقة، ثم يغسل مرة أخرى مع PBS.
- إضافة 20 μL PBS (أو تصاعد المتوسطة) على الشريحة وجبل ببطء غطاء تحتوي على الخلايا الملونة على مساحة الشريحة التي تحتوي على PBS. ختم هوامش غطاء مع ثنائي بوتيل فالثالات البوليسترين إكسيلين (DPX).
- إجراء تصوير للخلايا الثابتة تحت المجهر في التكبير 10X و 40x.
النتائج
في هذا البروتوكول، تم توضيح استراتيجية بسيطة يتم فيها الحصول على كثافات طلاء الخلايا المتغيرة من اثنين من منصات الفحص العصبي المختلفة. الشكل 1A،B يوضح التزام الخلايا بعد 4 ساعة من طلاء الخلايا العصبية في الخلايا المطلي عالية ومنخفضة الكثافة ، على التوالي. على مراقبة الالتزام السليم للخلايا العصبية كما هو مبين في الشكل 1، تم استبدال وسيط الطلاء من قبل وسيط الصيانة في كل من الآبار ، وبالتالي ، عاد إلى الحاضنة في 37 درجة مئوية. لوحظ التزام أكثر نسبيا الخلية في الخلايا العصبية مطلي عالية الكثافة. بعد 24 ساعة من الطلاء، أظهرت كل من الخلايا العصبية مطلي عالية ومنخفضة الكثافة ملحقات الخلايا العصبية تفصيلا والترابط متشابك، كما لوحظ في تباين التداخل التفاضلي (DIC) الصور في الشكل 2A،B.
في الشكل 3A، يتم تمثيل صورة على النقيض من المرحلة من الخلايا العصبية المطلي منخفضة الكثافة بعد 7 أيام في الثقافة. هنا، وضعت الخلايا العصبية شبكة متشابكة مفصلة تتكون من فروع التقشر. ويمكن الحفاظ على هذه الخلايا العصبية لمدة تصل إلى 30 يوما عن طريق تغيير وسيلة الصيانة كل 3 أيام مع تطوير شبكات الخلايا العصبية أكثر تعقيدا. في الشكل 3B،C، تم تنفيذ تلطيخ المناعية الكيميائية للكشف عن الطبيعة العصبية للخلايا العصبية ثقافة منخفضة الكثافة عن طريق تلطيخ مع علامات الخلايا العصبية Tuj1 (علامة من الخلايا العصبية المتمايزة)21 وتاو (علامة من المحاور)22 ، على التوالي. اللون الأحمر في الشكل 3B يشير إلى وجود Tuj1 تلطيخ، والأخضر في الشكل 3C يمثل تلطيخ في محاور الخلايا العصبية الأولية. ويظهر نقاء الثقافة العصبية من خلال عدم تلطيخ علامات غير الخلايا العصبية لGFAP من الخلايا النجمية (الشكل3D)وO4 من oligodendrocytes (الشكل3E). كانت النوى المعروضة باللون الأزرق ملطخة بـ Hoechst 33258.
تتميز الخلايا العصبية مطلية بالكثافة العالية بعد 7 أيام بتشكيل المجالات العصبية العفوية، كما لوحظ في الشكل 4A،B،C،D. بعد 8-10 أيام، لوحظت جسور متميزة تتكون من الدلي شعاعي مثل ملحقات بين المجالات العصبية، كما رأينا في الشكل 4E. وهبت المجالات العصبية غنية مع NPCs، والتي علامات coexpress نيستين وTuj123. تظهر الأعصاب تلطيخ إيجابي من نيستين وتوج، كما هو مبين في الشكل 524. كانت النوى المعروضة باللون الأزرق ملطخة بـ Hoechst 33258. ويمكن الحفاظ على هذه المجالات العصبية لعدة أسابيع عن طريق زراعة لهم في لوحات مرفق منخفضة جدا. في الشكل 6، تم تقييم طول عمر الخلايا العصبية المستزرعة لمدة 30 يوماً تقريباً، وتم قياس قدرة الخلايا على البقاء على مدى 5 أيام تقريبًا باستخدام MTT التقليدي [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] وجدت أن الخلايا العصبية أظهرت أكثر من 90٪ من البقاء على البقاء حتى بعد 30 يوما من الثقافة.
بعد ذلك، تم تقييم النسبة المئوية للخلايا النجمية في الثقافات المصنفة عالية ومنخفضة الكثافة. وبما أن هذه المنهجية تهدف في المقام الأول إلى زراعة الخلايا العصبية، كان من المهم تقييم ما إذا كانت هذه الطريقة تدعم النمو التفضيلي للخلايا العصبية على الخلايا غير العصبية، وخاصة الخلايا النجمية. ولوحظ وجود مجموعة من الخلايا النجمية في الثقافة ذات الكثافة العالية التي تشكل علم الأعصاب، والتي تتميز باللون الأخضر للتلطيخ GFAP في الشكل 7A؛ على الرغم من ذلك، لوحظ أقل بكثير بالمقارنة مع Tuj1 (الأحمر) ملطخة السكان الخلايا العصبية. وقد أعيد التأكيد على ذلك أيضاً من خلال البيانات الكمية الواردة في الشكل 7باء،حيث كان ما بين 17 في المائة من سكان الخلايا الذين أعربوا عن هاف، مقارنة بنسبة 83 في المائة من السكان في الخلايا التي تعبر عن Tuj1.
كما تم التحقيق في السكان الفلكية من خلال تلطيخ GFAP، مقارنة مع السكان الخلايا العصبية (Tuj1 تلطيخ) في الخلايا البذر منخفضة الكثافة، لمدة 7 أيام متواصلة. على الرغم من أن الفرق الكبير في إجمالي عدد الخلايا لم يلاحظ خلال 7 أيام، وذلك بسبب انخفاض البذر، لوحظ أيضا أن السكان astrocyte منخفضة جدا (تقريبا لا أو منخفضة جدا GFAP تلطيخ)، مع الغالبية التي يجري السكان الخلايا العصبية (جدا ارتفاع Tuj1 التعبير) كما لوحظ في الشكل 8A.
كما هو مبين في الشكل 8B، تم إجراء التحليل الكمي من خلال عد السكان من الخلايا النجمية والخلايا العصبية التي تم الحصول عليها من خلال الفحص المجهري مع مساعدة من برنامج cellSens ، والتي لوحظ تتكون فقط ~ 2٪ -3٪ من السكان astrocyte في البداية. بسبب عدم وجود وسائل الإعلام المناسبة والمواد الغذائية لدعم نموها، وهذا السكان من الخلايا النجمية أيضا ببطء هلك مع مرور الوقت، في حين أنه في وجود العوامل المثلى ووسائل الإعلام، والخلايا العصبية سرعان ما سيطرت على الثقافة بأكملها.
كما هو مبين في الشكل 9، لوحظ أنه بسبب وجود NPCs ، وأعرب العلماء العصبية أيضا كميات عالية من الخلايا النجمية ، التي تتميز بإشارة خضراء قوية من تلطيخ GFAP جنبا إلى جنب مع إشارة Tuj1 أقوى. وأخيرا، لمراقبة ما إذا كانت هذه المجالات العصبية توسعت مع مرور الوقت، بعد أسبوع واحد من الثقافة عالية الكثافة، وعند هذه النقطة بدأت المجالات العصبية الصغيرة في تشكيل، تم نقل عدد قليل في لوحات مرفق منخفضة جدا ورصد نموها كل 5 أيام لمدة تصل إلى خمسة عشر يوماً
كما تم إجراء فحص حي/ميت للخلايا باستخدام الكالسين AM (الأخضر) ويوديد يوم بروبيوديوم (أحمر) للتحقق من صحة الخلايا. ولوحظ أن المجالات العصبية الآخذة في الاتساع أظهرت كمية كبيرة من الفلورة الخضراء دون تلطيخ أحمر، مما يشير إلى عدم حدوث أي وفاة في المجالات العصبية لمدة تصل إلى 15 يوما على الأقل في الثقافة، على النحو الوارد في الشكل 10A. كما هو مبين في الشكل 10B، لوحظ توسع ضخم في المجالات العصبية في كل 5 أيام في الثقافة لمدة تصل إلى 15 يوما. لرسم الرسم البياني الخطي الذي يمثل الزيادة في نهاية المطاف في حجم المجالات العصبية (لكل نقطة زمنية)، تمت دراسة 50 كرة عصبية، واستخدمت متوسطاتها لاستخلاص أحجام الغلاف العصبي في كل نقطة زمنية.

الشكل 1 تمثيل الالتزام الخلية بعد 4 ساعة من الطلاء. (أ) التزام الخلية في الخلايا العصبية مطلي عالية الكثافة. (B) الالتزام الخلية في الخلايا العصبية مطلي منخفضة الكثافة. شريط مقياس في (A,B) هو 200 درجة مئوية.

الشكل 2 مورفولوجيا الخلية من الخلايا العصبية بعد 24 ساعة من الطلاء. (أ) مورفولوجيا الخلية من الخلايا العصبية مطلي عالية الكثافة. (ب) مورفولوجيا الخلية من الخلايا العصبية المطلي منخفضة الكثافة. وتمثل أشرطة المقياس في (ألف وباء) 20 درجة مئوية.
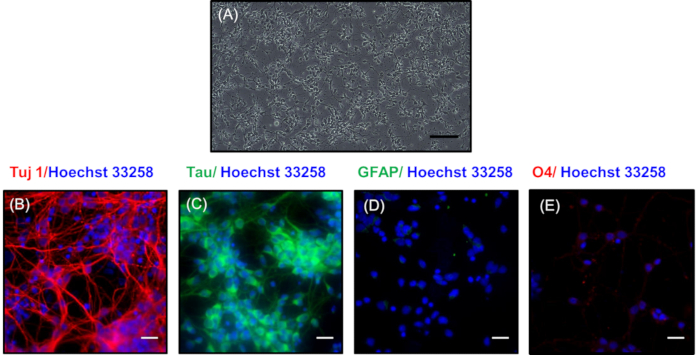
الشكل 3 : مورفولوجيا وتوصيف الخلايا العصبية المطلي منخفضة الكثافة بعد 7 أيام. (أ) صورة على النقيض من المرحلة من الخلايا العصبية تظهر تنبت واسعة النطاق. شريط مقياس يمثل 200 م. تراكب الصور التيتظهر التعبير عن البروتينات العصبية (B) Tuj1 (الأحمر) و (C) تاو (الأخضر). Immnunocytochemistry تظهر بوضوح عدم وجود تلطيخ فيالبروتينات غير العصبية (D) GFAP (الأخضر) و (E) O4 (الأحمر). كانت النوى ملطخة Hoechst 33258 (الأزرق). وتمثل أشرطة المقياس في (باء وجيم ودال وهاء) 20 درجة.

الشكل 4 : تشكيل المجالات العصبية في الخلايا العصبية مطلي عالية الكثافة بعد 7 أيام. (ألف-دال) ولدت تلقائيا المجالات العصبية بعد 7 أيام في الثقافة من الخلايا العصبية مطلي عالية الكثافة. (هـ)تشكيل امتدادات شعاعية تشبه الكالبين بين اثنين من المجالات العصبية المشكلة حديثا كما هو مبين من قبل السهام السوداء. وتمثل أشرطة المقياس في (ألف وباء وجيم ودال وهاء) 200 درجة مئوية.
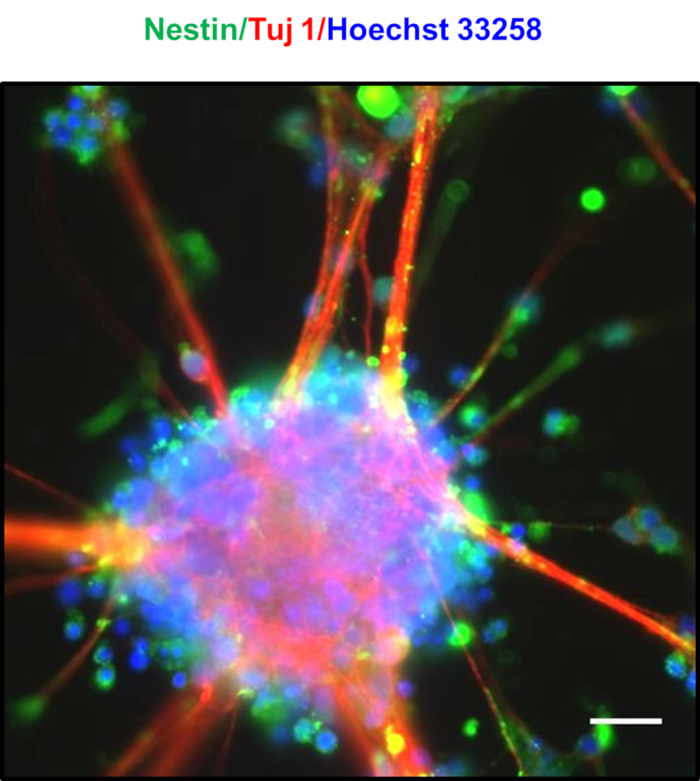
الشكل 5 : توصيف المجالات العصبية التي تم الحصول عليها. صورة تراكب من neurospheres تظهر التعبير عن البروتين العصبي Tuj1 (الأحمر) والعصبية علامة الخلايا الجذعية Nestin (الأخضر)، مما يشير إلى السكان الغنية بالمجلس الوطني لنواب الشعب الصيني. كانت ملطخة النوى مع Hoechst 33258 (الأزرق). شريط مقياس يمثل 20 درجة.

الشكل 6 : صلاحية الخلايا للخلايا العصبية الأولية. يمثل الرسم البياني الشريطي صلاحية الخلايا للخلايا العصبية الأولية، وتقييمها باستخدام اختبار MTT لمدة تصل إلى 30 يوما على فترات 5 أيام. يمثل شريط الخطأ SD للقيمة (*p < 0.05). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7 توصيف الثقافات ذات الكثافة العالية التي تشكل علم الأعصاب مع علامة الخلايا العصبية Tuj1 وعلامة الخلايا النجمية GFAP. (أ) تظهر الصورة الخلايا المصنفة عالية الكثافة (في وضع DIC)، والتي تولد neuropsheres التعبير عن كل من GFAP (للخلايا النجمية) وTuj1 (للخلايا العصبية). كانت ملطخة النوى مع Hoechst 33258. شريط مقياس يمثل 20درجة مئوية (B) الرسم البياني شريط يمثل النسبة المئوية للسكان من الخلايا التي تعبر عن Tuj1 والخلايا التي تعبر عن GFAP في neurosphere توليد خلايا عالية الكثافة. يمثل شريط الخطأ SD (*p < 0.05). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8 توصيف الخلايا المطلي منخفضة الكثافة لثقافة الخلايا العصبية الأولية مع علامة الخلايا العصبية Tuj1 وعلامة استروسيت GFAP باستمرار تصل إلى 7 أيام. (أ) تظهر الصورة الخلايا البذر منخفضة الكثافة في أربع قنوات مختلفة (أي DIC، القناة الزرقاء [تشير إلى تلطيخ نووي من قبل Hoechst 33258]، والقناة الخضراء [GFAP تلطيخ]، والقناة الحمراء [لتلطيخ Tuj1]) لمدة 7 أيام بشكل مستمر. شريط مقياس يمثل 20درجة مئوية (B) الرسم البياني شريط يمثل نسبة مئوية من السكان من الخلايا التي تعبر عن Tuj1 إلى أن من الخلايا التي تعبر عن GFAP في الخلايا البذور منخفضة الكثافة لثقافة الخلايا العصبية الأولية لمدة 7 أيام. يمثل شريط الخطأ SD (*p < 0.05). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9 مناعة منالمنة من [نيوروسفيرس] ينال مع [غفب] و [تج1]. صور من المجالات العصبية التي تم الحصول عليها هي (أ) في وضع DIC ، (ب) نواة تلطيخ باستخدام Hoechst 33258 ، (C ) علامة الخلايا النجمية GFAP (الأخضر) ، و (د) علامة الخلايا العصبية Tuj1 (الأحمر). شريط مقياس يمثل 20 درجة.

الشكل 10 النمو وحقن الخلايا الحية/الميتة من المجالات العصبية على مدى 15 يوما. (أ) تظهر الصورة نمو الغلاف العصبي على مدى 15 يوما على فترات 5 أيام في وضع DIC، فضلا عن تلطيخ مع الكالسين AM (الأخضر يشير إلى الخلايا الحية) وPI (يوديد البربيديوم مع اللون الأحمر يشير إلى الخلايا الميتة). شريط مقياس يمثل 20درجة مئوية (B) الرسم البياني يمثل الزيادة في حجم المجالات العصبية نمت في لوحات الالتزام منخفضة على مدى فترة 15 يوما على فترات 5 أيام. شريط الخطأ يمثل SD. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول كيف يتم الحصول على اثنين من المنصات العصبية المتغيرة عن طريق تغيير كثافات طلاء الخلايا من الخلايا العصبية الأولية. على الرغم من أن هذا هو أسلوب بسيط، يجب تنفيذ كل خطوة بدقة لتحقيق النتائج المرجوة. وقد أبلغت طرق سابقة أخرى إما على المدى الطويل الثقافات العصبية الأولية أو ثقافات neurosphere. وقد شملت معظم بروتوكولات ثقافة الخلايا العصبية الأولية زراعة الخلايا العصبية فرس النهر لمدة 3-5 أسابيع، ولكن معظمها قد فشلت، كما تموت الخلايا العصبية وتذبل بعيدا بسبب فقدان الاتصالات. ميزة أخرى للبروتوكول هو أن الخلايا العصبية يمكن أن تكون مثقفة دون الحاجة إلى أي طبقة التغذية glial، وبالتالي الحفاظ على نقاء الخلايا العصبية.
ومع ذلك، يجب اتباع عدة خطوات حاسمة بعناية للحصول على النتائج المرجوة. أولا، الحفاظ على الظروف المعقمة في جميع أنحاء ضروري للغاية. ينصح بتنفيذ معظم الخطوات في غطاء محرك السيارة اللامينار، فضلا عن ما قبل تنظيف جميع ألواح، والأدوات، والأدوات الجراحية مع الكحول 70٪ قبل البدء. خلاف ذلك ، هناك فرصة أكبر للفشل بسبب التلوث بالبكتيريا والفطريات. بعد ذلك، من المهم عزل الأجنة E14-16. وبالتالي، يجب أن يتم تنفيذ خطوة الكشف عن المكونات المهبلية بعناية. مع زيادة اليوم الجنيني، كلما زادت فرص التلوث بالخلايا غير العصبية. الإزالة الكاملة للالسحايا من نصفي الكرة الأرضية أمر بالغ الأهمية للحد من التدخل في الثقافة من قبل الخلايا غير العصبية. يجب أن يتم إعداد كل من الطلاء والصيانة المتوسطة الطازجة مع جميع المكونات، كما يلعب كل مكون دورا أساسيا. عامل آخر يجب أن يوضع في الاعتبار هو أن الخلايا العصبية الأولية التي تم الحصول عليها يجب الحفاظ عليها عن طريق تغيير المتوسطة صيانة 2X في الأسبوع بحيث إمدادات المواد الغذائية إلى الخلايا العصبية المنتشرة لا تزال ثابتة.
على الرغم من أنه لم يتم محاولة بعد, هذا البروتوكول مع تعديلات طفيفة قد تكون مفيدة أيضا في الخلايا العصبية الجنينية الماوس. إذا لم يتم الحصول على الخلايا العصبية المطلوبة أو neurospheres بعد هذه التقنية، وهناك عدد قليل من نصائح استكشاف الأخطاء وإصلاحها التي قد تكون مفيدة. للحفاظ على الأنسجة قابلة للحياة، يجب إجراء تشريح في HBSS الجليد الباردة. يمكن أيضاً إجراء تشريح في المخزن المؤقت كريبس الباردة الجليد بدلاً من المخزن المؤقت HBSS. إجراء تشريح بسرعة هو المفتاح للحفاظ على صلاحية الأنسجة. استخدام التربسين 10X سيؤدي إلى عسر الهضم المفرط للأنسجة. وبالتالي، ينبغي تخفيف 10X التربسين-EDTA الحل إلى 1X في العازلة تفكك قبل الهضم. إضافة متوسطة الجليد الباردة إلى الخلايا، مما يؤدي إلى تجميد الصدمة، وينبغي تجنب بأي ثمن، وينبغي استخدام المتوسطة بعد الوصول RT بدلا من ذلك. الأهم من ذلك، يجب أن تكون دائما المغلفة الأغطية مع PDL، وإلا فإن الخلايا العصبية لن نعلق على الأغطية. في حالة وجود أي صعوبة أثناء تنفيذ خطوة trituration (أي، الأنسجة لا يهضم بشكل صحيح)، يمكن إجراء الهضم عن طريق إضافة 0.5 مل من 1٪ DNase لمدة 10 دقيقة. إذا واجهت درجات عالية من التلوث من قبل الخلايا غير العصبية، ~ 5 μM السيتوسين أرابينوسيد (araC) ينبغي أن تضاف لمنع نمو الخلايا غير العصبية.
على الرغم من مزاياها المتعددة، هذه التقنية تعاني من بعض القيود. ومن المعروف أن هذه التقنية تولد تلقائيا المجالات العصبية (على الرغم من أن الآليات الجزيئية الزناد غير معروفة)؛ ومع ذلك، لا يزال هناك عدد قليل من الغموض فيما يتعلق بهذه التقنية، مثل الحجم الدقيق للغلاف العصبي شكلت وعدد دقيق من الأيام اللازمة لتشكيل عدد كاف من المجالات العصبية. في الغالب، الحجم هو المشكلة. على الرغم من أنه لوحظ أن المجالات العصبية تتسع من حيث الحجم مع مرور الوقت، فإن المجالات العصبية الأولية التي تم الحصول عليها ذات أحجام متغيرة. على الرغم من أنه مفيد، فإنه يجعل من الصعب إجراء دراسة متزامنة. ما يميز هذا البروتوكول جيل neurosphere من الآخرين هو قوتها وبساطتها. وهناك بروتوكولات أُبلغ عنها سابقاً لزراعة وانتشار الأعصاب التي تتطلب متطلبات متوسطة خاصة وظروفاً ثقافية، ولا يلزم أي منها في هذا البروتوكول. في هذه البروتوكولات التي تم الإبلاغ عنها سابقا، لا يكاد يكون هناك أي توحيد لأولئك الذين يتطلعون إلى توليد المجالات العصبية.
عموما، يصف هذا البروتوكول استراتيجية فريدة من نوعها لتوليد كل من المنصات العصبية 2D و 3D ببساطة عن طريق تغيير كثافات طلاء الخلايا من الخلايا العصبية الأولية المعزولة من أجنة الفئران Sprague Dawley E14-E16. هذه الطريقة فعالة من حيث التكلفة بالمقارنة مع أساليب أخرى، كما أنه يمكن تنفيذها مع إعداد بسيط ويتطلب أقل بكثير الكواشف والخطوات. يمكن أن توفر تطبيقات مختلفة ذات أهمية لعلماء الأعصاب. ويمكن استخدام هذا كمنصات فحص لمختلف الخيوط العلاجية العصبية، ومراقبة أدوار مختلف بروتينات البضائع العصبية، والتحقيقات في المسارات الخلوية في العديد من الأمراض العصبية التنكسية، والعديد من التطبيقات الأخرى. يمكن استخدام المجالات العصبية بشكل أكبر لفحص مختلف العوامل العصبية المختلفة ودراسة المراحل المبكرة من التطور العصبي في المختبر25و26.
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصالح مالية متنافسة.
Acknowledgements
نشكر مرفق الحيوانات CSIR-IICB. G. D. شكرا ICMR، J. K. و V. G. أشكر DST إلهام، وD. M. شكرا DBT، الهند على زمالاتهم. س. غ. تتكرم بـ "الصرب" (EMR/2015/002230) الهند لتقديمها الدعم المالي.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-GFAP | Abcam | AB7260 | |
| Anti- Nestin | Abcam | AB92391 | |
| Anti-O4 | Millipore | MAB345 | |
| Anti-Tau | Abcam | AB76128 | |
| Anti-Tuj1 | Millipore | MAB1637 | |
| B27 Serum Free Supplement | Gibco | 17504-044 | |
| Cell Counter | Life technologies | Countess II FL | |
| CO2 Incubator | Eppendorf | Galaxy 170 R | |
| D-glucose | SDFCL | 38450-K05 | |
| Ethanol | Merck Millipore | 100983 | |
| Fluorescence Microscope | Olympus | IX83 Model | |
| Formaldehyde | Sigma Aldrich | 47608 | |
| GlutaMax-I Supplement | Gibco | 35050-061 | |
| GtXMs IgG Fluor | Millipore | AP1814 | |
| GtXMs IgG (H+L) | Millipore | AP124C | |
| HEPES | SRL | 16826 | |
| Hoechst 33258 | Calbiochem | 382061 | |
| Horse Serum | HiMedia | RM10674 | |
| Hydrochloric Acid | Rankem | H0100 | |
| Laminar Hood | BioBase | BBS-V1800 | |
| MEM Eagle’s with Earle’s BSS | Sigma Aldrich | M-2279 | |
| Microscope | Dewinter | Victory Model | |
| Neurobasal Medium | Gibco | 21103-049 | |
| Plasticware (24 well plate, cell strainers, and low adherence plates) | BD Falcon | 353047, 352350 and 3471 | |
| 90 mm Petridishes | Himedia | PW001 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Poly-D-Lysine | Millipore | A.003.E | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Potassium Phosphate Monobasic | Merck | MI6M562401 | |
| Sodium Chloride | Qualigem | 15918 | |
| Sodium Phosphate Dibasic | Merck | MI6M562328 | |
| Stereomicrosope | Dewinter | Zoomstar Model | |
| Triton-X 100 | SRL | 2020130 | |
| Trypan Blue Solution | Gibco | 15250-061 | |
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 |
References
- Lorsch, J. R., Collins, F. S., Lippincott-Schwartz, J. Fixing problems with cell lines. Science. 346 (6216), 1452-1453 (2014).
- Masters, J. R. W. Cell line misidentification: the beginning of the end. Nature Reviews Cancer. 10 (6), 441-448 (2010).
- Banker, G. Culturing Nerve Cells, 2nd edition. , 339-370 (1998).
- Geschwind, D. H., Konopka, G. Neuroscience in the era of functional genomics and systems biology. Nature. 461 (7266), 908-915 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1, 2406-2415 (2006).
- Lu, Z. M., Piechowicz, M., Qiu, S. F. A Simplified Method for Ultra-Low Density, Long-Term Primary Hippocampal Neuron Culture. Journal of Visual Experiments. 109, e53797(2016).
- Kaneko, A., Sankai, Y. Long-Term Culture of Rat Hippocampal Neurons at Low Density in Serum-Free Medium: Combination of the Sandwich Culture Technique with the Three-Dimensional Nanofibrous Hydrogel PuraMatrix. PLoS ONE. 9 (7), e102703(2014).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209 (4458), 809-810 (1980).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. Journal of Neuroscience. 8 (4), 1454-1468 (1988).
- Piret, G., Perez, M. T., Prinz, C. N. Support of Neuronal Growth Over Glial Growth and Guidance of Optic Nerve Axons by Vertical Nanowire Arrays. ACS Applied Materials & Interfaces. 7 (34), 18944-18948 (2015).
- Campos, L. S. Neurospheres: Insights biology into neural stem cell biology. Journal of Neuroscience Research. 78 (6), 761-769 (2004).
- Ahmed, S. The Culture of Neural Stem Cells. Journal of Cellular Biochemistry. 106, 1-6 (2009).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Molecular Neurobiology. 34 (3), 153-161 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111, A3.B.1-A3.B.3 (2015).
- Pradhan, K., et al. Neuro-Regenerative Choline-Functionalized Injectable Graphene Oxide Hydrogel Repairs Focal Brain Injury. ACS Chemical Neuroscience. 10 (3), 1535-1543 (2019).
- Ray, B., Bailey, J. A., Sarkar, S., Lahiri, D. K. Molecular and immunocytochemical characterization of primary neuronal cultures from adult rat brain: Differential expression of neuronal and glial protein markers. Journal of Neuroscience Methods. 184 (2), 294-302 (2009).
- Robinson, A. P., Rodgers, J. M., Goings, G. E., Miller, S. D. Characterization of Oligodendroglial Populations in Mouse Demyelinating Disease Using Flow Cytometry: Clues for MS Pathogenesis. PLoS ONE. 9 (9), (2014).
- Osterberg, N., Roussa, E. Characterization of primary neurospheres generated from mouse ventral rostral hindbrain. Cell and Tissue Research. 336 (1), 11-20 (2009).
- Bernal, A., Arranz, L. Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cellular and Molecular Life Sciences. 75 (12), 2177-2195 (2018).
- Qu, Q. H., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5, 3449(2014).
- Bradke, F., Dotti, C. G. Differentiated neurons retain the capacity to generate axons from dendrites. Current Biology. 10 (22), 1467-1470 (2000).
- Theocharatos, S., et al. Regulation of Progenitor Cell Proliferation and Neuronal Differentiation in Enteric Nervous System Neurospheres. PLoS ONE. 8 (1), (2013).
- Binder, E., et al. Enteric Neurospheres Are Not Specific to Neural Crest Cultures: Implications for Neural Stem Cell Therapies. PLoS ONE. 10 (3), e0119467(2015).
- Cordey, M., Limacher, M., Kobel, S., Taylor, V., Lutolf, M. P. Enhancing the Reliability and Throughput of Neurosphere Culture on Hydrogel Microwell Arrays. Stem Cells. 26 (10), 2586-2594 (2008).
- Ladiwala, U., Basu, H., Mathur, D. Assembling Neurospheres: Dynamics of Neural Progenitor/Stem Cell Aggregation Probed Using an Optical Trap. PLoS ONE. 7 (6), (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved