Method Article
E14-E16スプラーグドーリーラット胚から分離された混合原発海馬および皮質ニューロンからの神経球の生成
要約
ここに提示されるのは、高密度めっきニューロンから神経前駆細胞に濃縮された神経球の自発的生成のためのプロトコルである。同じ実験の間に、ニューロンが低密度でめっきされるとき、プロトコルはまた、長期の一次ラットニューロン培養をもたらす。
要約
一次ニューロン培養は神経科学の分野で不可欠な技術です。脳に深い機械的洞察を得るためには、様々な神経生物学の研究に利用できる堅牢なインビトロモデルを持つことが不可欠です。一次ニューロン培養(すなわち、長期的な海馬培養)は、科学者にモデルを提供してきましたが、脳ネットワークの複雑さを完全に表しているわけではありません。これらの制限をきっかけに、脳組織に近い神経球を用いた新しいモデルが出現した。本プロトコルは、胚の胚から分離された皮質ニューロンと海馬ニューロンの高密度および低密度のめっきを記述する14-16スプラーグドーリーラットである。これにより、神経圏および長期の一次ニューロン培養の生成を2つの独立したプラットフォームとして、さらなる研究を行うことが可能となる。このプロセスは、ニューロン培養に不可欠と考えられていたいくつかのステップと試薬を最小限に抑えるため、非常にシンプルで費用対効果が高い。これは達成可能な結果で行うことができ、さらに神経科学に関連する研究の多様性のために使用することができる最小限の要件で堅牢なプロトコルです。
概要
脳は、神経細胞と非神経細胞の複雑な回路です。何年もの間、科学者たちはこの複雑な機械に関する洞察を得ようとしてきた。そのために、神経科学者は当初、調査のために様々な形質転換神経系細胞株に頼った。しかし、これらのクローン細胞株が強いシナプス結合および適切な軸線またはデンドライトを形成できないことは、科学的関心を一次ニューロン培養1、2にシフトさせた。一次ニューロン培養の最もエキサイティングな側面は、生きているニューロン3を観察し、操作する機会を作り出すことです。また、神経組織に比べて複雑性が低いため、様々な神経タンパク質の機能や輸送を研究するのに理想的な候補です。近年、顕微鏡、ゲノミクス、プロテオミクスの分野でいくつかの発展が起きており、神経科学者がニューロン培養を利用する新たな機会を生み出しています4。
一次培養により、神経科学者は神経発達の背後にある分子機構を探索し、様々な神経シグナル伝達経路を解析し、シナプスのより一貫した理解を開発することができました。多くの方法が一次ニューロン(主に海馬起源5、6、7から)からの培養を報告しているが、ニューロンの長期培養を可能にする化学的に定義された媒体を持つ統一プロトコルは、まだ必要です。しかし、低密度でめっきされたニューロンは、最も頻繁に観察され、これは長期的に生き残るものではなく、隣接するニューロンおよびグリア細胞によって提供される栄養支持体8の欠如に起因する可能性が高い。いくつかの方法は、グリア細胞とグリア細胞との一次ニューロンの共培養を示唆しています, ここでグリア細胞は、フィーダー層9として使用されています.しかし、グリア細胞は過剰増殖に起因する多くの問題を提起し、時には神経成長10を上書きする。したがって、上記の問題を考慮すると、より簡単で費用対効果の高い一次神経培養プロトコルが必要であり、これは神経生物学者と神経化学者の両方が調査に使用することができる。
一次ニューロン培養は本質的に2D培養の一形態であり、脳の可塑性、空間的完全性、または不均一性を表すものではありません。これは、神経球11、12と呼ばれるより信じられる3Dモデルの必要性を生み出しました。神経球は、生体内脳13において、実際に類似した新しいプラットフォームを神経科学者に提示する。神経球は、神経幹細胞(NSC)、神経前駆細胞(NPC)、ニューロン、および星状細胞が豊富な細胞の非付着性3Dクラスターです。それらは神経幹細胞および神経前駆細胞の単離のための優秀な源であり、様々な神経系および非神経系統への分化を研究するために使用することができる。繰り返しになりますが、以前に報告されたプロトコルを用いて産生される神経球培養内の変動性は、統一された神経球培養プロトコル14の定式化に対する障壁を提示する。
この原稿は、混合皮質および海馬培養から細胞めっき密度を交互にすることによって、2Dおよび3Dプラットフォームの両方を生成することができるプロトコルを提示する。自由浮遊神経球は、E14-E16スプラーグドーリーラット胚から単離された高密度めっきニューロンから7日以内に得られ、さらなる培養時に、放射状グリア状の拡張を介してブリッジと相互接続を形成する。同様に、低密度めっきニューロンでは、週2回維持培地を変更して最大30日間維持できる一次ニューロン培養が得られる。
プロトコル
動物に関するすべての実験手順は、CSIR-インド化学生物学研究所の機関動物倫理委員会(IICB/AEC/ミーティング/2018/1)によって承認されました。
1. 試薬およびメディアの準備
- ポリD-リジン(PDL)溶液:脱イオン水中で0.1mg/mLの濃度でPDL溶液を調製し、使用するまで4°Cに保存します。
- 解離培地:無菌、濾過脱イオン水の1Lに、塩化ナトリウム(8mg/mL)、塩化カリウム(0.4mg/mL)、リン酸カリウムモノベーシック(0.06mg/mL)、D-グルコース(1mg/mL)、各濃度で以下の成分を組み合わせます。リン酸ナトリウムジビ塩(0.479mg/mL)、および1M HEPES[4-(2-ヒドロキセチル)-1-ピペラジンエタンスルホン酸;10mM]。適切な混合を助け、使用するまで4°Cに貯えるためにすべての成分を渦。
注:解離時は氷冷状で、洗濯やその他の目的で室温(RT)で解離剤を使用してください。 - めっき媒体:めっき媒体は、アールのバランス塩溶液(BSS;88.4%)、D-グルコース(0.6%)、馬血清(10%)、ペニシリン/ストレプトマイシン(1%)を使用した最小必須培地(MEM)イーグルの最小必須培地(MEM)で構成されています。それぞれの比率でコンポーネントを組み合わせ、無菌条件下でフード内部の手順を実行します。
注:常に任意のコンポーネントの劣化を避けるために、新鮮なめっき媒体を使用してください。 - 維持培地:ニューロベースル培地(97%)、市販のグルタミン試料0.5mM、B27無血清サプリメント(2%)、ペニシリン/ストレプトマイシン(1%)を組み合わせて維持培地を調製する。それぞれの比率でコンポーネントを組み合わせ、無菌条件下でフード内部の手順を実行します。すべてのコンポーネントが準備されていることを確認します。
2. カバースリップの準備
- 直径12mmの丸いガラスカバーを取り、1M塩酸(HCl)に4時間浸します。
- 鉗子のペアを使用して蒸留水でカバーリップを転送し、完全に酸を取り除くために穏やかにそれを旋回します。
- 100%エタノールを含むビーカーで洗浄の追加ラウンドのために洗浄されたカバーリップを転送します。
- カバースリップを使用する前に、ティッシュペーパーの上にそれらを維持することにより、層フードでよくそれらを乾燥させます。
3. ニューロン培養用ポリD-リジンコーティングプレートの調製
- 2つの24のウェルプレートを取る:高密度めっきのための1つと低密度めっきのための別の。無菌パケットは、層フードの内側でのみ開きます。
- 24ウェルプレートに生殖不能ガラスカバーの12ミリメートルを転送します。
- 300 μL の PDL 溶液(脱イオン水中 0.1 mg/mL)を各井戸に注ぎ、カバースリップの表面を完全に覆います。
- プレートをアルミホイルで包み、乾燥を防ぎ、CO2インキュベーターに一晩保管します。
- 翌日(めっき前)、PDL溶液を吸引し、300μLの無菌脱イオン水を2~3回適切に洗浄します。
- 新たに調製しためっき媒体を200μL加え、めっきまでインキュベーターに戻します。
4. 胎児の除去と切断
注:121 °C(15 psi)でアルミホイルに詰め込まれたすべての手術器具を30分間殺菌します。これには、鈍い端のはさみ、鉗子、細かい鉗子、2つの細かいはさみ、およびプロシージャ全体のための1つの動脈鉗子のペアが含まれる。
- ニューロンと神経球を生成するために, 時間妊娠スプラーグドーリーラットを使用し、E0として膣プラグ検出で一日をマーク.
注: カルチャは E14-E16 の間で実行する必要があります。 - 培養の日に、無菌のガラスペトリプレートを氷の上に置き、冷たいハンクのバランス塩溶液(HBSS)でそれを埋めます。
- 体重90mgケタミン/kgの経皮内注射(i.p.)と10mgキシラジン/kgの注射でE14-E16妊娠中のラットを麻酔し、子宮頸部脱臼を行って犠牲にする。
注:ラットはまた、ペントバルビタールの過剰摂取またはキシラジンまたはジアゼパムとケタミンの過剰摂取によって安楽死させることができる。 - 70%のエタノールを噴霧してダムの腹部を殺菌し、無菌鉗子と鈍い端のはさみを使用して腹部のV字型のカットを作ります。
- 冷たいHBSS溶液でペトリプレート上の胚嚢を慎重に取ります。
注:これは内臓を汚染するので、皮膚に使用されたのと同じ鉗子やはさみを使用しないでください。内臓には異なるハサミ/鉗子を使用してください。 - 胚嚢から新鮮で冷たいHBSSで胚を取り出す。
- 生殖不能のはさみで頭を切り落とす。
5. 海馬による脳の除去と皮質の解剖
- 開始する前に、冷たい、無菌HBSSで90ミリメートルの生殖不能ペトリ皿を埋めます。
- 無菌の鈍い終わりのドレッシング鉗子を使用して無菌の皿の頭部を移す。
- 立体顕微鏡の下で、無菌の皮切り鉗子でスナ産領域から頭部を保持し、皮膚と頭蓋骨を開いて切断することによって脳を取り除く。
- HBSS溶液中で同じ方法ですべての胚脳を収集します。
- 脳幹を保持することにより、半球と中脳からすべての髄膜を削除します。
- 海馬と皮質を含むキノコキャップに似た無傷の半球を慎重に取り除きます。
- 10 mLの解離培地を含む15mLの円錐管に皮質と無傷の海馬を含む半球を集める。
6. 皮質組織と海馬組織を単一ニューロンに解離する
- 収集した組織が落ち着き、解離培地を吸引し、5%-10%の培地を残します。
- 組織に新鮮な解離培地の10 mLを追加し、ステップ6.1を2回繰り返します。
- 解離培地の4.5mLと0.25%(1x)トリプシンEDTA(エチレンジアミン四酢酸エチレン)溶液の0.5mLを加えます。
- 消化が進むまで20分間、インキュベーター内の組織を37°Cに保ちます。
- 培地を吸引し、消化組織に連続的に解離およびめっき媒体の10 mLを追加します。
- 消化された組織が落ち着き、解離媒体を吸引できるようにします。めっき媒体の2.5 mLを追加し、90ミリメートルの滅菌皿のベースに注ぎます。
- 1,000 μLピペット先端を使用して、皿の角ベースで消化された組織をトリチュレートし、最小限の体積を占めます。
- 組織の任意のチャンクを除く70 μm細胞ストレーナーを通して得られた細胞懸濁液を渡す。
- トリパン青色色素排除法を使用して生存可能な細胞の密度を決定し、自動セルカウンタ内のセル数をカウントします。
- トリパン青色色素排除法の場合は、セル懸濁液の10μLと0.4%トライパンブルーステインの10μLを取り、完全に混合し、使い捨て室スライドの2つの密閉室のいずれかに混合物の10 μLを追加します。
- 混合物を含むスライドをセルカウンタに挿入し、読み取りを取得します。
注:トリパン青色染料除外法は、生細胞(その無傷の膜による)がトリパン青色染料を除外し、したがって、簡単にトリパンブルーを取り上げ、青色に見える非実行可能な細胞と比較して、明確な細胞質を示す原理に基づいています。色15.
- プレートに得られた細胞数を希釈する 1.5 x 105セル/mL 高密度および 20,000 セル/mL 低密度の 20,000 セル/mL を、各めっき媒体を含む 2 つの別々のチューブで低密度にします。
- 各ウェルから以前に添加しためっき媒体を吸引し、各ウェルにめっき媒体に分散した細胞の500μLをプレート化する。
- その後、プレートを37°Cでインキュベーターに戻し、5%CO2を4時間返す。
- めっき後4時間の顕微鏡下で細胞の付着を調べる。
- 両方のプレートに細胞が適切に付着している場合は、各ウェルの培地を500μLの新鮮なメンテナンス培地で交換し、37°Cでインキュベートします。
- これらのニューロンを1週間に2倍の維持培地を変化させたりして30日間低密度で培養した。
- 超低アタッチメントプレートに転写して同じ維持培地中の高密度めっきニューロンから得られた神経球を培養する。
- 重要なマーカーでそれらを免疫染色することにより、ニューロンと神経球を特徴付け.免疫細胞化学の場合は、まずプレート自体に4%ホルムアルデヒドを使用して細胞/神経球を30分間固定し、次に0.1%の非イオン性洗剤で細胞を10分間透過させます。
- リン酸緩衝生理食塩分(PBS)にニューロン(抗Tuj1、GFAP、O4、タウ)と神経球(抗ネスチン、GFAP、Tuj1)の両方に一次抗体を加え、4°C16で一晩インキュベートする。
注:Tuj1(クラスIIIβ-チューブリン)およびタウは一次ニューロンに対する正のマーカーであり、GFAP(グリア線維性酸性タンパク質)およびO4(オリゴデンドロサイトマーカー)は原発ニューロン17、18に対する陰性マーカーである。神経球の場合、Tuj1、GFAP、およびネスチンはすべて正のマーカー19,20として機能します。 - 翌日、PBSで細胞を1~2回洗浄し、2時間RTで1:600濃度でPBSに適切な二次抗体を添加する。
注:抗マウスまたは抗ウサギ二次抗体は、添加された一次抗体の宿主種に応じて選択される。二次抗体は、蛍光顕微鏡の目的に適した蛍光誘導体に結合する必要があることを心に留めておく必要があります。 - PBSで再度細胞を1~2回洗います。
- Hoechst 33258(脱イオン水中の1mg/mLストック溶液)で細胞の核染色を行う。ストック溶液からPBSで0.1%のホエヒト溶液を準備し、細胞に追加します。
- 0.1%のホエヒト溶液で細胞を30分間インキュベートし、PBSで再び洗浄する。
- スライドに20 μL PBS(または取り付け媒体)を追加し、PBSを含むスライドの領域に染色されたセルを含むカバースリップをゆっくりと取り付けます。カバースリップの余白をジブチルフタレートポリスチレンキシレン(DPX)でシールします。
- 10倍と40倍の倍率で顕微鏡下で固定細胞のイメージングを行います。
結果
このプロトコルでは、2つの異なる神経スクリーニングプラットフォームから可変細胞めっき密度が得られるという簡単な戦略が解明されている。図1Aは、Bがそれぞれ高密度及び低密度メッキ細胞におけるニューロンをめっきした4時間後の細胞の付着を示す。図1に示すようにニューロンの適切な付着を観察すると、めっき培地を各ウェルのメンテナンス培地に置き換え、それによって37°Cでインキュベーターに戻した。高密度めっきニューロンでは比較的多くの細胞接着が認められた。めっきの24時間後、高密度メッキニューロンと低密度メッキニューロンの両方が精巧なニューロン拡張およびシナプス相互接続を示し、図2A、Bの差動干渉コントラスト(DIC)画像で観察された。
図3Aでは、培養7日後の低密度めっきニューロンの位相コントラスト画像が表される。ここで、ニューロンは樹状枝からなる精巧なシナプスネットワークを開発した。これらのニューロンは、より複雑なニューロンネットワークの発達に伴い、3日ごとに維持培地を変化させ、最大30日間維持することができる。図3Bでは、C、免疫細胞化学染色を行い、ニューロンマーカーTuj1(分化ニューロンのマーカー)21及びタウ(軸母のマーカー)22を染色することにより、低密度培養ニューロンのニューロン性質を明らかにした。、それぞれ。図3Bの赤色はTuj1染色の存在を示し、図3Cの緑色は一次ニューロンの軸線における染色を表す。神経培養の純度は、アストロサイトのGFAPに対する非ニューロンマーカーの染色の欠如(図3D)およびオリゴデンドロサイトのO4(図3E)の欠如によって示される。青色で示された核を、ホークスト33258で染色した。
7日後の高密度めっきニューロンは、図4A、B、C、Dで観察される自発的神経球の形成によって特徴付けられます。8-10日後、図4Eに見られるように、神経球間の放射状グリアのような拡張からなる別個の橋が観察された。神経球は、NPCに豊かに恵まれました, これは、マーカーネスチンとTuj123をコエクスプレス.神経類は、図524に示すように、ネスチンおよびTujの陽性染色を示す。青色で示された核を、ホークスト33258で染色した。これらの神経球は、超低アタッチメントプレートでそれらを培養することによって数週間維持することができる。図6では、約30日間培養したニューロンの寿命を評価し、従来のMTT[3-(4,5-ジメチルチアゾル-2-yl)-2,5-ジフェニルテチゾルゾリウム臭化物]アッセイを用いて約5日間隔で細胞生存率を測定した。ニューロンは培養の30日後でさえ90%以上の生存率を示したことがわかった。
次に、高密度および低密度種子培養におけるアストロサイトの割合を評価した。この方法論は主にニューロンの培養を目的としているため、この方法が非ニューロン細胞、特に星状細胞よりもニューロンの優生成長をサポートしているかどうかを評価することが重要でした。星状細胞の集団の存在は、図7AのGFAP染色の緑色で特徴付けされた神経球形成高密度種子培養物において観察された。しかし、Tuj1(赤色)染色された神経集団と比較して有意に少なく観察された。これはまた、図7Bの定量的データによって再確認され、その中で細胞の集団は約17%がGFAP発現であり、Tuj1発現細胞の集団の83%と比較した。
また、GFAP染色を用いて、低密度種子細胞における神経集団(Tuj1染色)と比較して、7日間連続して天球細胞集団を調べた。総細胞数の有意な差は7日間の間に観察されなかったが、低種子のために、星状細胞集団も非常に低い(ほとんどないまたは非常に低いGFAP染色)、大部分がニューロン集団(非常に)図8Aで観察される高Tuj1式)。
図8Bに示すように、細胞細胞集団の約2%〜3%のみが最初に観察されたcellSensソフトウェアの助けを借りて顕微鏡検査を通じて得られたアストロサイトおよびニューロンの集団を数えることによって定量分析を行った。その成長を支える適切な培養物と栄養素が不足しているため、このアストロサイトの集団も時間の経過とともにゆっくりと死んでしまい、最適な因子や培養物が存在する中で、ニューロンは急速に培養全体を引き継いだ。
図9に示すように、NPCの存在により、神経球も高量のアストロサイトを発現し、GFAP染色の強い緑色シグナルとより強いTuj1シグナルによって特徴付けられていた。最後に、これらの神経球が時間の経過とともに拡大するかどうかを観察するために、高密度培養の1週間後に、小さな神経球が形成され始めた時点で、少数が超低アタッチメントプレートに移され、その成長は最大5日ごとにモニタリングされた。15日
生細胞アッセイもカルセインAM(緑)とヨウ化プロピジウム(赤色)を用いて細胞の健康状態を確認した。膨張する神経球は、赤色染色なしで大量の緑色蛍光を示し、少なくとも15日間の培養中に神経球で死亡が起こらないことを示し、図10Aに示すように。図10Bに示すように、神経球の膨大な膨張は、最大15日間培養中の5日毎に観察された。神経球の体積の最終的な増加(各タイムポイント)を表す線グラフをプロットするために、50個の神経球を研究し、その平均を使用して各タイムポイントで神経球体積を導出した。

図 1:めっきの4時間後の細胞付着の表現。(A) 高密度めっきニューロンにおける細胞接着性(B) 低密度めっきニューロンにおける細胞接着(A,B) のスケール バーは 200 μm です。

図 2:めっきの24時間後のニューロンの細胞形態。(A) 高密度めっきニューロンの細胞形態(B) 低密度めっきニューロンの細胞形態(A, B) のスケールバーは 20 μm を表します。
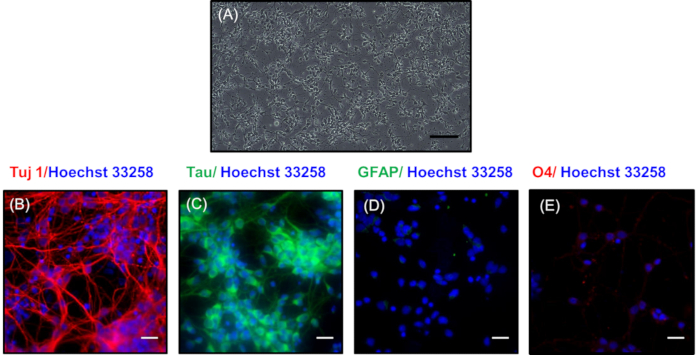
図 3:7日後の低密度めっきニューロンの形態と特徴付け(A) 広範囲の発芽を示すニューロンの相対照画像。スケールバーは200 μm. 神経タンパク質の発現を示すオーバーレイ画像(B) Tuj1(赤)および(C)タウ(緑)を表す。非神経タンパク質(D)GFAP(緑色)および(E)O4(赤色)における染色の欠如を明確に示すイムヌノサイト化学。ヌクレイは、ホークスト33258(青色)で染色した。(B、C、D、E)のスケールバーは20 μmを表し、この図のより大きなバージョンを表示するにはここをクリックしてください。

図 4:7日後の高密度めっきニューロンにおける神経球の形成(A-D)高密度めっきニューロンから培養7日後に自発的に神経球を生成した。 (E) 黒い矢印で示される2つの新たに形成された神経球間の放射状グリア様拡張の形成。(A、B、C、D、E)のスケールバーは200 μmを表します。
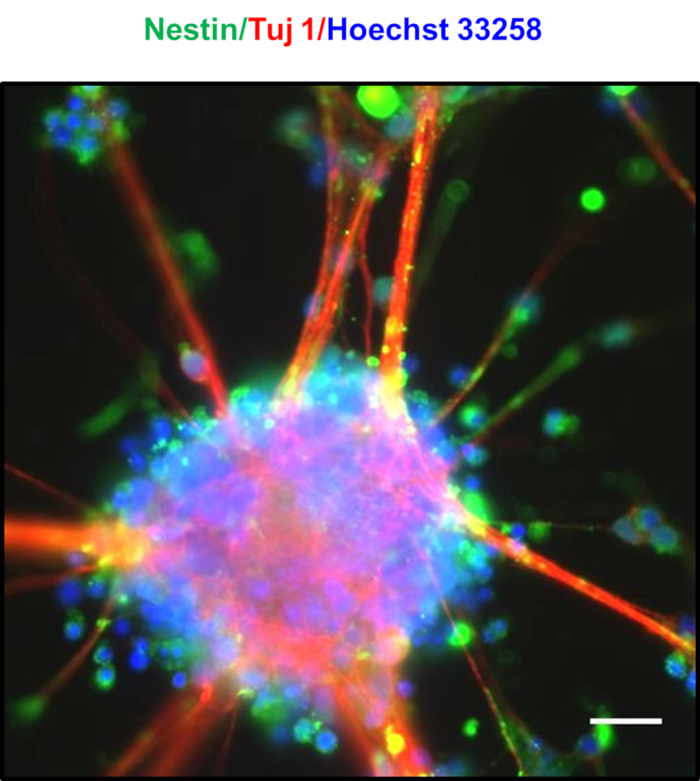
図 5: 得られた神経球の特徴付け。神経タンパク質Tuj1(赤色)および神経幹細胞マーカーネスチン(緑)に対する発現を示す神経球のオーバーレイ画像は、NPCが豊富な集団を示す。核は、ホークスト33258(青)で染色した。スケールバーは20 μmを表し、この図のより大きなバージョンを表示するにはここをクリックしてください。

図 6: 原発性ニューロンの細胞生存率。棒グラフは、一次ニューロンの細胞生存率を表し、5日間隔で最大30日間MTTアッセイを用いて評価した。エラー バーは、値の SD を表します (*p < 0.05)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 7: 神経マーカーTuj1とアストロサイトマーカーGFAPを用いて神経球形成高密度培養物の特性評価(A) 画像は、GFAP(星状細胞)とTuj1(ニューロン用)の両方を発現する神経剤を生成する高密度種子細胞(DICモード)を示しています。核は、ホークスト33258で染色した。スケールバーは20μmを表し(B)棒グラフは、高密度細胞を生成する神経圏におけるTuj1発現細胞およびGFAP発現細胞の集団の割合を表す。エラー バーは SD (*p < 0.05) を表します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 8:ニューロンマーカーTuj1およびアストロサイトマーカーGFAPを用いて一次ニューロン培養のための低密度めっき細胞の特徴付けは、最大7日間連続的に行う。(A) 画像は、4つの異なるチャネル(すなわち、DIC、青色チャネル[Hoechst 33258による核染色を示す]、緑色チャネル[GFAP染色]、および赤チャネル[Tuj1染色用])の4つの異なるチャネルにおける低密度シード細胞を連続して示す。スケールバーは20μmを表し(B)棒グラフは、一次ニューロン培養のための低密度種子細胞におけるGFAP発現細胞の集団とGFAP発現細胞の集団の割合を7日間表す。エラー バーは SD (*p < 0.05) を表します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 9: GFAPおよびTuj1で得られた神経球の免疫染色。得られた神経球の画像は、(A)DICモードにおいて、(B)ホークスト33258を用いた核染色、(C)アストロサイトマーカーGFAP(緑)、および(D)ニューロンマーカーTuj1(赤色)である。スケールバーは20 μmを表し、この図のより大きなバージョンを表示するにはここをクリックしてください。

図 10: 15日間の神経球の成長と生きた/死細胞アッセイ。(A) 画像は、DICモードで5日間間隔で15日間にわたる神経球の成長と、カルセインAM(緑は生細胞を示す)およびPI(赤色のヨウ化プロピジウム)による染色を示す。スケールバーは20μmを表し(B)グラフは、5日間隔で15日間にわたって低付着プレートで成長した神経球のサイズの増加を表す。エラーバーはSDを表し、この図のより大きなバージョンを表示するにはここをクリックしてください。
ディスカッション
このプロトコルは、一次ニューロンの細胞めっき密度を変化させ、2つの可変ニューロンプラットフォームが得られる方法を説明する。これは簡単な方法ですが、目的の結果を得るには、各ステップを細心の注意を払って実行する必要があります。他の以前の方法は、長期の一次ニューロン培養または神経球培養を報告しています。.ほとんどの一次ニューロン培養プロトコルは、3〜5週間海馬ニューロンの培養に関与しているが、ほとんどのニューロンが死亡し、接続の損失のために枯れるにつれて、ほとんどが失敗している。プロトコルのもう一つの利点は、ニューロンが任意のグリアフィーダー層を必要とせずに培養することができ、したがって、ニューロンの純度を維持することができることです。
ただし、目的の結果を得るには、いくつかの重要な手順を慎重に実行する必要があります。第一に、無菌状態を全面的に維持することが絶対に必要です。始める前に、ラミネートフードのほとんどのステップを実行するだけでなく、すべてのスラブ、器具、および外科用具を70%アルコールで事前に洗浄することをお勧めします。それ以外の場合は、細菌や真菌による汚染による故障の可能性が高くなります。次に、E14-16胚を単離することが重要である。したがって、膣プラグ検出ステップは慎重に実行する必要があります。胚の日が増えるにつれて、非神経細胞による汚染の可能性が高くなります。半球からの髄膜の完全な除去は、非神経細胞による培養における干渉を減らすために非常に重要である。すべてのコンポーネントが重要な役割を果たしているように、めっきとメンテナンス媒体の両方を、すべてのコンポーネントで新たに準備する必要があります。注意しなければならないもう一つの要因は、増殖するニューロンへの栄養供給が一定に保たるように、週に2倍の維持培地を変更することによって、得られた一次ニューロンを維持しなければならないということに留意する必要があります。
それはまだ試みられていないが、わずかな変更を伴うこのプロトコルは、マウス胚性ニューロンにも有用でありうる。この技術に従って所望のニューロンまたは神経球が得られない場合は、いくつかのトラブルシューティングのヒントが役立つ可能性があります。組織を存続させるためには、解剖を氷冷HBSSで行う必要があります。解剖は、HBSSバッファの代わりに氷冷クレブスバッファで行うこともできます。解剖を迅速に行うことはティッシュの生存率を維持するための鍵である。10倍トリプシンの使用は、組織の過剰消化につながります.したがって、10xトリプシン-EDTA溶液は、消化前に解離バッファーで1xに希釈する必要があります。凍結ショックを誘発する細胞への氷冷培地の添加は、すべてのコストで避けるべきであり、RTに達した後の培地は代わりに使用されるべきである。最も重要なことは、カバースリップは常にPDLでコーティングされるべきである、そうでなければニューロンはカバースリップに付着しない。トリチュレーション工程(すなわち、組織が適切に消化しない)を行っている間に任意の困難の場合には、消化は1%DNaseの0.5mLを10分間添加することによって行うことができる。非神経細胞による高度な汚染に遭遇した場合は、非神経細胞の増殖を防ぐために、約5μMシトシンアラビノシド(araC)を添加する必要があります。
その複数の利点にもかかわらず、この技術はいくつかの制限に苦しんでいます。この技術は、自発的に神経球を生成することは知られている(しかし、トリガ分子機構は知られていない)。しかし、形成された神経球の正確な大きさや十分な数の神経球を形成するのに必要な正確な日数など、この技術に関する曖昧さはほとんど残らない。ほとんどの場合、サイズが問題です。神経球は時間の経過とともに体積が膨張することが観察されているが、得られた最初の神経球は可変サイズである。便利ですが、同期スタディを実行することは困難です。この神経球生成プロトコルを他のプロトコルと区別するものは、その堅牢性とシンプルさです。特別な媒体要件および培養条件を必要とする神経フェアの培養および伝播のための以前に報告されたプロトコルがあり、いずれもこのプロトコルで必要とされない。これらの以前に報告されたプロトコルでは、神経球を生成しようとしている人のための均一性はほとんどありません。
全体として、このプロトコルは、E14-E16スプラーグドーリーラットの胚から単離された一次ニューロンの細胞めっき密度を単に変更することにより、2Dおよび3Dニューロンプラットフォームの両方の生成のためのユニークな戦略を説明する。この方法は、簡単なセットアップで行うことができ、はるかに少ない試薬とステップを必要とするように、他の方法と比較して費用対効果が高いです。それは神経科学者のための関心のさまざまな適用を提供できる。これは、様々な神経治療リードのスクリーニングプラットフォームとして使用することができ、様々な神経貨物タンパク質の役割を観察し、多くの神経変性疾患における細胞経路の調査、および他の多くのアプリケーション。神経球は、様々な神経分化剤のスクリーニングおよびインビトロ25,26における神経発達の初期段階の研究にさらに用いることができる。
開示事項
著者は、競合する金銭的利益を宣言しません。
謝辞
CSIR-IICB動物施設に感謝します。G. D. 感謝 ICMR, J. K. と V. G. DST インスパイアに感謝し、D. M. 彼らのフェローシップのために DBT に感謝します。S.G.は、インドのSERB(EMR/2015/002230)が財政支援を行った場合に認める。
資料
| Name | Company | Catalog Number | Comments |
| Anti-GFAP | Abcam | AB7260 | |
| Anti- Nestin | Abcam | AB92391 | |
| Anti-O4 | Millipore | MAB345 | |
| Anti-Tau | Abcam | AB76128 | |
| Anti-Tuj1 | Millipore | MAB1637 | |
| B27 Serum Free Supplement | Gibco | 17504-044 | |
| Cell Counter | Life technologies | Countess II FL | |
| CO2 Incubator | Eppendorf | Galaxy 170 R | |
| D-glucose | SDFCL | 38450-K05 | |
| Ethanol | Merck Millipore | 100983 | |
| Fluorescence Microscope | Olympus | IX83 Model | |
| Formaldehyde | Sigma Aldrich | 47608 | |
| GlutaMax-I Supplement | Gibco | 35050-061 | |
| GtXMs IgG Fluor | Millipore | AP1814 | |
| GtXMs IgG (H+L) | Millipore | AP124C | |
| HEPES | SRL | 16826 | |
| Hoechst 33258 | Calbiochem | 382061 | |
| Horse Serum | HiMedia | RM10674 | |
| Hydrochloric Acid | Rankem | H0100 | |
| Laminar Hood | BioBase | BBS-V1800 | |
| MEM Eagle’s with Earle’s BSS | Sigma Aldrich | M-2279 | |
| Microscope | Dewinter | Victory Model | |
| Neurobasal Medium | Gibco | 21103-049 | |
| Plasticware (24 well plate, cell strainers, and low adherence plates) | BD Falcon | 353047, 352350 and 3471 | |
| 90 mm Petridishes | Himedia | PW001 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Poly-D-Lysine | Millipore | A.003.E | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Potassium Phosphate Monobasic | Merck | MI6M562401 | |
| Sodium Chloride | Qualigem | 15918 | |
| Sodium Phosphate Dibasic | Merck | MI6M562328 | |
| Stereomicrosope | Dewinter | Zoomstar Model | |
| Triton-X 100 | SRL | 2020130 | |
| Trypan Blue Solution | Gibco | 15250-061 | |
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 |
参考文献
- Lorsch, J. R., Collins, F. S., Lippincott-Schwartz, J. Fixing problems with cell lines. Science. 346 (6216), 1452-1453 (2014).
- Masters, J. R. W. Cell line misidentification: the beginning of the end. Nature Reviews Cancer. 10 (6), 441-448 (2010).
- Banker, G. Culturing Nerve Cells, 2nd edition. , 339-370 (1998).
- Geschwind, D. H., Konopka, G. Neuroscience in the era of functional genomics and systems biology. Nature. 461 (7266), 908-915 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1, 2406-2415 (2006).
- Lu, Z. M., Piechowicz, M., Qiu, S. F. A Simplified Method for Ultra-Low Density, Long-Term Primary Hippocampal Neuron Culture. Journal of Visual Experiments. 109, e53797(2016).
- Kaneko, A., Sankai, Y. Long-Term Culture of Rat Hippocampal Neurons at Low Density in Serum-Free Medium: Combination of the Sandwich Culture Technique with the Three-Dimensional Nanofibrous Hydrogel PuraMatrix. PLoS ONE. 9 (7), e102703(2014).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209 (4458), 809-810 (1980).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. Journal of Neuroscience. 8 (4), 1454-1468 (1988).
- Piret, G., Perez, M. T., Prinz, C. N. Support of Neuronal Growth Over Glial Growth and Guidance of Optic Nerve Axons by Vertical Nanowire Arrays. ACS Applied Materials & Interfaces. 7 (34), 18944-18948 (2015).
- Campos, L. S. Neurospheres: Insights biology into neural stem cell biology. Journal of Neuroscience Research. 78 (6), 761-769 (2004).
- Ahmed, S. The Culture of Neural Stem Cells. Journal of Cellular Biochemistry. 106, 1-6 (2009).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Molecular Neurobiology. 34 (3), 153-161 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111, A3.B.1-A3.B.3 (2015).
- Pradhan, K., et al. Neuro-Regenerative Choline-Functionalized Injectable Graphene Oxide Hydrogel Repairs Focal Brain Injury. ACS Chemical Neuroscience. 10 (3), 1535-1543 (2019).
- Ray, B., Bailey, J. A., Sarkar, S., Lahiri, D. K. Molecular and immunocytochemical characterization of primary neuronal cultures from adult rat brain: Differential expression of neuronal and glial protein markers. Journal of Neuroscience Methods. 184 (2), 294-302 (2009).
- Robinson, A. P., Rodgers, J. M., Goings, G. E., Miller, S. D. Characterization of Oligodendroglial Populations in Mouse Demyelinating Disease Using Flow Cytometry: Clues for MS Pathogenesis. PLoS ONE. 9 (9), (2014).
- Osterberg, N., Roussa, E. Characterization of primary neurospheres generated from mouse ventral rostral hindbrain. Cell and Tissue Research. 336 (1), 11-20 (2009).
- Bernal, A., Arranz, L. Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cellular and Molecular Life Sciences. 75 (12), 2177-2195 (2018).
- Qu, Q. H., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5, 3449(2014).
- Bradke, F., Dotti, C. G. Differentiated neurons retain the capacity to generate axons from dendrites. Current Biology. 10 (22), 1467-1470 (2000).
- Theocharatos, S., et al. Regulation of Progenitor Cell Proliferation and Neuronal Differentiation in Enteric Nervous System Neurospheres. PLoS ONE. 8 (1), (2013).
- Binder, E., et al. Enteric Neurospheres Are Not Specific to Neural Crest Cultures: Implications for Neural Stem Cell Therapies. PLoS ONE. 10 (3), e0119467(2015).
- Cordey, M., Limacher, M., Kobel, S., Taylor, V., Lutolf, M. P. Enhancing the Reliability and Throughput of Neurosphere Culture on Hydrogel Microwell Arrays. Stem Cells. 26 (10), 2586-2594 (2008).
- Ladiwala, U., Basu, H., Mathur, D. Assembling Neurospheres: Dynamics of Neural Progenitor/Stem Cell Aggregation Probed Using an Optical Trap. PLoS ONE. 7 (6), (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved