Method Article
Generazione di neurosfere da neuroni ippocampali primari misti e corticali isolati da E14-E16 Sprague Dawley Rat Embryo
In questo articolo
Riepilogo
Presentato qui è un protocollo per la generazione spontanea di neurosfere arricchite in cellule progenitrici neurali da neuroni placcati ad alta densità. Durante lo stesso esperimento, quando i neuroni sono placcati ad una densità inferiore, il protocollo si traduce anche in colture di neuroni ratti primari prolungati.
Abstract
La cultura primaria dei neuroni è una tecnica essenziale nel campo delle neuroscienze. Per ottenere approfondimenti meccanicistici nel cervello, è essenziale avere un robusto modello in vitro che può essere sfruttato per vari studi di neurobiologia. Anche se le colture neuronali primarie (cioè le colture ippocampali a lungo termine) hanno fornito agli scienziati modelli, non rappresentano ancora completamente la complessità della rete cerebrale. Sulla scia di queste limitazioni, è emerso un nuovo modello usando le neurosfere, che assomiglia più in sé al tessuto cerebrale. Il presente protocollo descrive la placcatura di densità alte e basse di neuroni corticali e ippocampali misti isolati dall'embrione dei ratti Sprague Dawley del giorno embrionale 14-16. Questo permette per la generazione di neurosfere e la cultura dei neuroni primari a lungo termine come due piattaforme indipendenti per condurre ulteriori studi. Questo processo è estremamente semplice e conveniente, in quanto riduce al minimo diversi passaggi e reagenti precedentemente ritenuti essenziali per la coltura dei neuroni. Questo è un protocollo robusto con requisiti minimi che possono essere eseguiti con risultati raggiungibili e ulteriormente utilizzati per una varietà di studi relativi alle neuroscienze.
Introduzione
Il cervello è un intricato circuito delle cellule neuronali e non neuronali. Per anni, gli scienziati hanno cercato di ottenere informazioni su questo complesso meccanismo. Per farlo, i neuroscienziati inizialmente hanno fatto ricorso a varie linee cellulari basate sui nervi trasformate per le indagini. Tuttavia, l'incapacità di queste linee cellulari clonali di formare forti connessioni sinaptiche e assoni o dendriti adeguati ha spostato l'interesse scientifico alle colture neuronali primarie1,2. L'aspetto più eccitante della cultura neuronale primaria è che crea l'opportunità di osservare e manipolare i neuroni viventi3. Inoltre, è meno complesso rispetto al tessuto neurale, che lo rende un candidato ideale per studiare la funzione e il trasporto di varie proteine neuronali. Recentemente, diversi sviluppi nei campi della microscopia, genomica e proteomica hanno generato nuove opportunità per i neuroscienziati di sfruttare le colture neuronali4.
Le culture primarie hanno permesso ai neuroscienziati di esplorare i meccanismi molecolari alla base dello sviluppo neurale, analizzare vari percorsi di segnalazione neurale e sviluppare una comprensione più coerente della sinapsi. Anche se un certo numero di metodi hanno segnalato colture da neuroni primari (per lo più dall'origine ippocampale5,6,7), un protocollo unificato con un mezzo definito chimicamente che consente la coltura a lungo termine dei neuroni è ancora necessario. Tuttavia, neuroni placcati a bassa densità sono più spesso osservati, che non sopravvivono a lungo termine, probabilmente a causa della mancanza di supporto trofico8 che è fornito dai neuroni adiacenti e cellule gliali. Alcuni metodi hanno anche suggerito la cocoltura dei neuroni primari con cellule gliali, in cui le cellule gliali vengono utilizzate come strato di alimentazione9. Tuttavia, le cellule gliali pongono un sacco di problemi a causa della loro crescita eccessiva, che a volte sostituiscono la crescita neuronale10. Quindi, considerando i problemi di cui sopra, è necessario un protocollo di coltura neurale primaria più semplice e più conveniente, che può essere utilizzato sia dai neurobiologi che dai neurochimici per le indagini.
Una cultura neuronale primaria è essenzialmente una forma di cultura 2D e non rappresenta la plasticità, l'integrità spaziale o l'eterogeneità del cervello. Questo ha dato origine alla necessità di un modello 3D più credibile chiamato neurosfere11,12. Le neurosfere presentano una nuova piattaforma per i neuroscienziati, con una somiglianza più stretta con il vero cervello in vivo13. Le neurosfere sono cluster 3D non aderenti di cellule ricche di cellule staminali neurali (NSC), cellule progenitrici neurali (NPC), neuroni e astrociti. Sono un'ottima fonte per l'isolamento delle cellule staminali neurali e delle cellule progenitrici neurali, che possono essere utilizzate per studiare la differenziazione in varie linee neuronali e non neuronali. Ancora una volta, la variabilità all'interno delle culture della neurosfera prodotte utilizzando i protocolli precedentemente riportati presenta una barriera alla formulazione di un protocollo di coltura della neurosfera unificata14.
Questo manoscritto presenta un protocollo in cui è possibile generare piattaforme 2D e 3D alternando densità di placcatura cellulare da una coltura misa corticale e ippocampale. Si osserva che entro 7 giorni le neurosfere fluttuanti sono ottenute da neuroni placcati ad alta densità isolati dall'embrione di ratto E14-E16 Sprague Dawley, che su ulteriore cultura, formano ponti e interconnessioni attraverso estensioni radiali simili agli gliali. Allo stesso modo, nei neuroni placcati a bassa densità, una coltura neuronale primaria che può essere mantenuta fino a 30 giorni si ottiene cambiando il mezzo di manutenzione due volte alla settimana.
Protocollo
Tutte le procedure sperimentali che coinvolgono animali sono state approvate dal Comitato Etico Istituzionale degli Animali del CSIR-Indian Institute of Chemical Biology (IICB/AEC/Meeting/Apr/2018/1).
1. Preparazione del reagente e dei supporti
- Soluzione polid-lysina (PDL): preparare soluzioni PDL a concentrazioni di 0,1 mg/mL in acqua deionizzata e conservare in 4 gradi centigradi fino all'uso.
- Mezzo di dissociazione: A 1 L di acqua sterile, filtrata deionizzata, combinare i seguenti componenti nelle rispettive concentrazioni: cloruro di sodio (8 mg/mL), cloruro di potassio (0,4 mg/mL), fosfato di potassio monobasico (0,06 mg/mL), D-glucosio (1 mg/mL), fosfato dibase dibasic (0,479 mg/mL) e 1 M HEPES [4-(2-hydroxyethyl)-1-piperazineethanethanfonic acid; 10 mM]. Vortex tutti i componenti per aiutare la corretta miscelazione e conservare in 4 gradi centigradi fino all'uso.
NOTA: Utilizzare il mezzo di dissociazione in forma gelida durante la dissociazione ma a temperatura ambiente (RT) per il lavaggio e altri scopi. - Il mezzo di placcatura: mezzo di placcatura è costituito dai seguenti: mezzo essenziale minimo (MEM) Eagle's con Earle's Balanced Salt Solution (BSS; 88,4%), D-glucose (0,6%), siero di cavallo (10%), penicillina/streptomicina (1%). Combinare i componenti nei rispettivi rapporti ed eseguire la procedura all'interno di un cappuccio in condizioni sterili.
NOTA: Utilizzare sempre il mezzo di placcatura appena preparato per evitare la degradazione di qualsiasi componente. - Mezzo di manutenzione: preparare il mezzo di manutenzione combinando quanto segue nei rispettivi rapporti: mezzo neurobasale (97%), 0,5 mM di glutammina ottenuta commercialmente, integratore B27 senza siero (2%) e penicillina/streptomimina (1%). Combinare i componenti nei rispettivi rapporti ed eseguire la procedura all'interno di un cappuccio in condizioni sterili. Assicurarsi che tutti i componenti siano appena preparati.
2. Preparazione di copricoperture
- Prendi una vetrina di vetro rotonda di 12 mm di diametro e immergilo in acido cloridrico da 1 M (HCl) per 4 h.
- Trasferire i coperchi in acqua distillata utilizzando un paio di pinze e ruotarlo delicatamente per sbarazzarsi completamente dell'acido.
- Trasferire i copriletti lavati per un ulteriore giro di pulizia in un becher contenente 100% etanolo.
- Prima di utilizzare i copricopro, asciugarli bene nel cofano laminare tenendoli su carta velina.
3. Preparazione di piastre rivestite poli-D-lisina per la coltura dei neuroni
- Prendere due 24 piatti ben: uno per placcatura ad alta densità e un altro per placcatura a bassa densità. Aprire i pacchetti sterili solo all'interno del cofano laminare.
- Trasferire i 12 mm di vetro sterile coverslips nelle 24 piastre bene.
- Versare 300 l di soluzione PDL (0,1 mg/mL in acqua deionizzata) in ogni pozzo in modo che copra completamente la superficie dei coprilabbra.
- Avvolgere le piastre con un foglio di alluminio per evitare l'essiccazione e tenerlo nell'incubatrice di CO2 durante la notte.
- Il giorno successivo (prima della placcatura), aspirare la soluzione PDL e lavare correttamente con 300 l di acqua sterile ionizzata due o tre volte.
- Aggiungere 200 l di mezzo di placcatura appena preparato e riportare le piastre all'incubatrice fino alla placcatura.
4. Rimozione e decapitazione del feto
NOTA: Sterilizzare tutti gli strumenti chirurgici confezionati in un foglio di alluminio in un'autoclave a 121 gradi centigradi (15 psi) per 30 min. Questo include un paio di forbici smussate, pinze, pinze sottili, due forbici sottili e una pinze arteriosa per l'intera procedura.
- Per generare neuroni e neurosfere, utilizzare un ratto Sprague Dawley incinta a tempo e contrassegnare la giornata con il rilevamento della spina vaginale come E0.
NOTA: le impostazioni cultura devono essere eseguite tra E14-E16. - Il giorno della cultura, mettere una piastra di Petri di vetro sterile sul ghiaccio e riempirla con la soluzione fredda di sale equilibrato di Hank (HBSS).
- Anestesizzare un ratto in gravidanza E14-E16 con un'iniezione intraperitoneale (i.p.) di 90 mg ketamina/kg di peso corporeo e 10 mg di xilosina/kg, quindi sacrificio eseguendo la lussazione cervicale.
NOTA: I ratti possono anche essere eutanasia da un sovradosaggio di pentobarbital o sovradosaggio di ketamina con xillazina o diazepam. - Sterilizzare l'addome della diga spruzzando il 70% di etanolo e facendo un taglio a V nella zona addominale utilizzando pinze sterili e un paio di forbici smussate.
- Prendere le sacche embrionali con attenzione sulla piastra Petri con soluzione HBSS fredda.
NOTA: Non utilizzare le stesse pinze e forbici che sono state usate solo per la pelle, in quanto ciò contamina gli organi interni. Utilizzare un diverso set di forbici/pinze per gli organi interni. - Togliere gli embrioni dalle sacche embrionali in HBSS fresco e freddo.
- Decapitare la testa con forbici sterili.
5. Rimozione del cervello e dissezione della corteccia con ippocampo
- Prima di iniziare, riempire 90 mm sterile petri piatti con freddo, sterile HBSS.
- Trasferire le teste nei piatti sterili utilizzando pinze di condimento sterili e contundenti.
- Sotto lo stereoscopio, tieni la testa dalla regione del muso con pinze sterili e seghettate e rimuovi il cervello tagliando la pelle e il cranio aperti.
- Raccogliere tutti i cervelli embrionali nello stesso modo nella soluzione HBSS.
- Rimuovere tutte le meningi dagli emisferi e midbrain tenendo il tronco encefalico.
- Rimuovere con attenzione gli emisferi intatti simili a tappi di funghi che contengono l'ippocampo e la corteccia.
- Raccogliere gli emisferi contenenti corteccia e ippocampo intatto in un tubo conico da 15 mL contenente 10 mL di mezzo di dissociazione.
6. Dissociazione del tessuto corticale e ippocampale in singoli neuroni
- Permettere ai tessuti raccolti di stabilirsi e aspirare il mezzo di dissociazione, lasciando il 5%-10% del mezzo in esso.
- Aggiungere 10 mL di mezzo di dissociazione fresco al tessuto e ripetere il passaggio 6.1 due volte.
- Aggiungere 4,5 mL di mezzo di dissociazione e 0,5 mL di 0,25% (1x) trypsin EDTA (etilene diamine tetraacetate) soluzione.
- Conservare il tessuto nell'incubatrice a 37 gradi centigradi per 20 min affinché la digestione proceda.
- Aspirare il mezzo e aggiungere 10 mL di dissociazione e plating medio consecutivamente ai tessuti digeriti.
- Lasciare che i tessuti digeriti si stabiliscano e aspirano il mezzo di dissociazione. Aggiungere 2,5 mL di plating medium e versare nella base di un piatto sterile da 90 mm.
- Triturare i tessuti digeriti nella base angolare del piatto utilizzando una punta di pipetta da 1.000 lun per occupare il volume minimo.
- Passare la sospensione cellulare ottenuta attraverso il colino cellulare di 70 m, esclusi eventuali pezzi di tessuto.
- Determinare la densità delle cellule vitali utilizzando il metodo di esclusione del colorante blu trypan e contare il numero di celle in un contatore cellulare automatizzato.
- Per il metodo di esclusione dei coloranti blu trypan, prendere 10 L della sospensione cellulare e 10 l una di 0,4% di colore blu trypan, mescolare accuratamente e aggiungere 10 l l della miscela in una delle due camere racchiuse dei vetrini della camera usa e getta.
- Inserire la diapositiva contenente la miscela nel contatore cellulare e ottenere la lettura.
NOTA: Il metodo di esclusione del colorante blu trypan si basa sul principio che le cellule vive (a causa delle loro membrane intatte) escluderà il colorante blu trypan e mostrerà quindi un chiaro citoplasma, rispetto a una cellula non vitale che prenderà facilmente il blu trypan e apparirà blu in colore15.
- Diluire il numero di cellule ottenute per placcare 1,5 x 105 cellule/mL per un'alta densità e 20.000 cellule/mL per una bassa densità in due tubi separati contenenti 30 mL ciascuno del mezzo di placcatura.
- Aspirare il mezzo di placcatura precedentemente aggiunto da ogni pozzo e piastra 500 L di cellule disperse nel mezzo di placcatura in ogni pozzo.
- Dopo di che riportare le piastre all'incubatrice a 37 gradi centigradi e il 5% di CO2 per 4 h.
- Esaminare le cellule per l'aderenza al microscopio 4 h dopo la placcatura.
- Se c'è una corretta aderenza delle cellule in entrambe le piastre, sostituire il mezzo in ogni pozzo con 500 l di mezzo di manutenzione fresca e incubare a 37 .
- Cultura questi neuroni coltivati a bassa densità per 30 giorni modificando il mezzo di manutenzione 2x a settimana.
- Cultura le neurosfere ottenute dai neuroni placcati ad alta densità nello stesso mezzo di manutenzione trasferendoli alle piastre di fissaggio ultra-basse.
- Caratterizzare i neuroni e le neurosfere immunostaining con marcatori importanti. Per l'immunocitochimica, prima fissa le cellule/neurosfere usando il 4% di formaldeide per 30 min sulla piastra stessa, quindi permeabilizza le cellule con il detergente non ionico dello 0,1% per 10 min.
- Aggiungere anticorpi primari per entrambi i neuroni (anti-Tuj1, GFAP, O4, tau) e le neurosfere (anti-Nestin, GFAP, Tuj1) in salina con buffer fosfati (PBS) a 1:300 concentrazioni e incubare per la notte durante la notte a 4 gradicentigradi.
NOTA: Il Tuj1 (classe III z-tubulina) e il tau sono marcatori positivi per i neuroni primari, mentre GFAP (proteina acidica fibrillare gliale) e O4 (marcatore oligodendrocite) sono marcatori negativi per i neuroni primari17,18. Nel caso delle neurosfere, Tuj1, GFAP e Nestin servono tutti come marcatori positivi19,20. - Il giorno successivo, lavare le cellule con PBS una o due volte e aggiungere gli anticorpi secondari appropriati in PBS a 1:600 concentrazioni a RT per 2 h.
NOTA: Gli anticorpi secondari anti-mouse o anti-coniglio vengono selezionati a seconda delle specie ospiti dell'anticorpo primario aggiunto. Va tenuto presente che gli anticorpi secondari devono essere coniugati a derivati a fluorescenza adatti a scopi di microscopia a fluorescenza. - Lavare nuovamente le cellule con PBS una o due volte.
- Eseguire la colorazione nucleare delle cellule con Hoechst 33258 (1 soluzione di stock mg/mL in acqua deionizzata). Preparare la soluzione Hoechst 0,1% in PBS dalla soluzione di stock e aggiungerla alle celle.
- Incubare le cellule con soluzione Hoechst 0.1% per 30 min, quindi lavare di nuovo con PBS.
- Aggiungere 20 PBS (o supporto di montaggio) sul vetrino e montare lentamente lo scivolo contenente le celle macchiate sull'area del vetrino contenente PBS. Sigillare i margini della coverslip con xylene in polistirolo diabillico (DPX).
- Eseguire l'imaging delle cellule fisse al microscopio a ingrandimento 10x e 40x.
Risultati
In questo protocollo, è stata chiarita una semplice strategia in cui si ottengono densità di placcatura a cellule variabili da due diverse piattaforme di screening neurale. La figura 1A,B illustra l'aderenza delle cellule dopo 4 h di placcatura dei neuroni in cellule placcate ad alta e bassa densità, rispettivamente. Osservando la corretta aderenza dei neuroni, come mostrato nella Figura1, il mezzo di placcatura è stato sostituito dal mezzo di manutenzione in ciascuno dei pozzi e, di conseguenza, è tornato all'incubatrice a 37 gradi centigradi. Comparativamente più aderenza cellulare è stata osservata nei neuroni placcati ad alta densità. Dopo 24 h di placcatura, neuroni placcati sia ad alta che bassa densità hanno mostrato elaborate estensioni neuronali e interconnessioni sinaptiche, come osservato nelle immagini di contrasto di interferenza differenziale (DIC) nella Figura 2A,B.
Nella figura 3A, viene rappresentata un'immagine a contrasto di fase dei neuroni placcati a bassa densità dopo 7 giorni di coltura. Qui, i neuroni hanno sviluppato un elaborato rete sinaptico costituito da rami dendritici. Questi neuroni possono essere ulteriormente mantenuti fino a 30 giorni cambiando il mezzo di manutenzione ogni 3 giorni con lo sviluppo di reti neuronali più complesse. Nella figura 3B,C, la colorazione immunocitochimica è stata eseguita per rivelare la natura neuronale dei neuroni della coltura a bassa densità colorando con marcatori neuronali Tuj1 (un marcatore di neuroni differenziati)21 e Tau (un marcatore di assoni)22 , rispettivamente. Il colore rosso nella figura 3B indica la presenza di tuj1 colorazione, e verde in Figura 3C rappresenta la colorazione negli assoni dei neuroni primari. La purezza della coltura neuronale è dimostrata dall'assenza di colorazione di marcatori non neuronali per GFAP di astrociti (Figura 3D) e O4 di oligodendrociti (Figura 3E). I nuclei mostrati in blu erano macchiati con Hoechst 33258.
I neuroni placcati ad alta densità dopo 7 giorni sono contrassegnati dalla formazione di neurosfere spontanee, come osservato nella Figura 4A,B,C,D. Dopo 8-10 giorni, sono stati osservati ponti distinti costituiti da estensioni radiali simili a gliali tra le neurosfere, come si vede nella Figura 4E. Le neurosfere erano riccamente dotate di PNG, che coesprimomarcatori Nestin e Tuj123. I neurospehere mostrano una colorazione positiva di Nestin e Tuj, come mostrato nella Figura 524. I nuclei mostrati in blu erano macchiati con Hoechst 33258. Queste neurosfere possono essere mantenute per diverse settimane coltendole in piastre di attaccamento ultra-basse. Nella figura 6, è stata valutata la longevità dei neuroni coltivata per circa 30 giorni, e la fattibilità cellulare è stata misurata ad un intervallo di 5 giorni utilizzando il tradizionale assaggio MTT [3-(4,5-dimetilthiazol-2-yl)-2-diphenyltetrazolium] bromuro] ha scoperto che i neuroni hanno mostrato più del 90% di vitalità anche dopo 30 giorni di cultura.
Successivamente, è stata valutata la percentuale di astrociti nelle colture di semi ad alta e bassa densità. Poiché questa metodologia è finalizzata principalmente alla coltura dei neuroni, era importante valutare se questo metodo supporta la crescita preferenziale dei neuroni rispetto alle cellule non-neuronali, in particolare gli astrociti. La presenza di una popolazione di astrociti è stata osservata nella coltura di semi ad alta densità che forma la neurosfera, caratterizzata dal colore verde della colorazione GFAP nella figura 7A; tuttavia, significativamente meno è stato osservato rispetto alla popolazione neuronale tuj1 (rossa) macchiata. Ciò è stato ribadito anche dai dati quantitativi nella figura 7B, in cui il 17% delle popolazioni di cellule esprimeva GFAP, rispetto all'83% della popolazione delle cellule che esprimevano Tuj1.
La popolazione astrocitica è stata studiata anche attraverso la colorazione GFAP, rispetto alla popolazione neuronale (colorazione Tuj1) nelle cellule di semi a bassa densità, per 7 giorni continui. Anche se una differenza significativa nel numero totale di cellule non è stata osservata nel corso di 7 giorni, a causa della bassa semina, la popolazione di astrociti è stata osservata anche per essere molto bassa (quasi nessuna o molto bassa colorazione GFAP), con una maggioranza è la popolazione neuronale (molto espressione Tuj1 elevata) come si osserva nella figura 8A.
Come mostrato nella Figura 8B, l'analisi quantitativa è stata eseguita contando la popolazione di astrociti e neuroni ottenuti attraverso la microscopia con l'aiuto del software cellSens, in cui è stato inizialmente osservato solo il 2%-3% della popolazione di astrociti. A causa della mancanza di supporti e sostanze nutritive adeguate per sostenere la sua crescita, questa popolazione di astrociti è anche lentamente perito nel tempo, mentre in presenza di fattori e media ottimali, i neuroni hanno rapidamente assunto l'intera cultura.
Come mostrato nella Figura 9, è stato osservato che a causa della presenza di PNG, le neurosfere hanno anche espresso elevate quantità di astrociti, contrassegnati dal forte segnale verde della colorazione GFAP insieme a un segnale Tuj1 più forte. Infine, per osservare se queste neurosfere si sono espanse nel tempo, dopo 1 settimana di coltura ad alta densità, a quel punto le piccole neurosfere hanno iniziato a formarsi, alcune sono state trasferite in piastre di attaccamento ultra-basse e la loro crescita è stata monitorata ogni 5 giorni per un massimo di 15 giorni.
Un saggio di cellule vive / morte è stato eseguito anche utilizzando calcein AM (verde) e iodide propidio (rosso) per controllare la salute delle cellule. È stato osservato che le neurosfere in espansione hanno mostrato una grande quantità di fluorescenza verde senza colorazione rossa, indicando che non si verificano decessi nelle neurosfere per almeno fino a 15 giorni in coltura, come presentato nella Figura 10A. Come mostrato nella Figura 10B, espansione voluminosa delle neurosfere è stato osservato ogni 5 giorni in coltura per un massimo di 15 giorni. Per tracciare il grafico a linee che rappresenta l'eventuale aumento del volume delle neurosfere (per ogni timepoint), sono state studiate 50 neurosfere, e le loro medie sono state utilizzate per ricavare i volumi della neurosfera ad ogni momento.

Figura 1 : Rappresentazione dell'aderenza cellulare dopo 4 h di placcatura. (A) Aderenza cellulare nei neuroni placcati ad alta densità. (B) Aderenza cellulare nei neuroni placcati a bassa densità. Barra della scala in (A,B) è 200 m. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2 : morfologia cellulare dei neuroni dopo 24 h di placcatura. (A) Morfologia cellulare dei neuroni placcati ad alta densità. (B) Morfologia cellulare dei neuroni placcati a bassa densità. Le barre della scala in (A, B) rappresentano 20 m. Fare clic qui per visualizzare una versione più grande di questa figura.
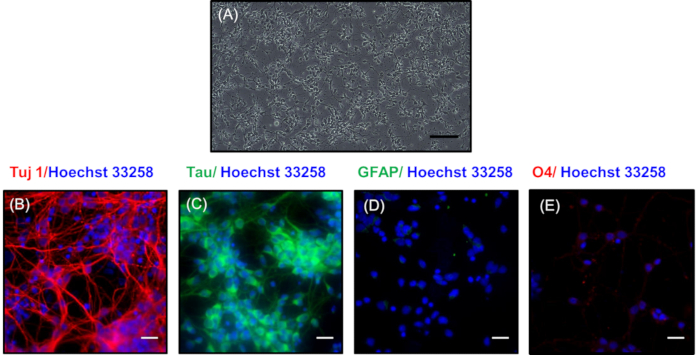
Figura 3 : Morfologia e caratterizzazione dei neuroni placcati a bassa densità dopo 7 giorni. (A) Immagine a contrasto di fase dei neuroni che mostrano un'estesa germogliazione. La barra della scala rappresenta le immagini sovrapposte di 200 m. che mostrano l'espressione per le proteine neuronali (B) Tuj1 (rosso) e (C)tau (verde). Immnunocytochemistry mostra chiaramente l'assenza di colorazione nelle proteine non neuronali (D) GFAP (verde) e (E) O4 (rosso). I nuclei erano macchiati con Hoechst 33258 (blu). Le barre di scala in (B, C, D, E) rappresentano 20 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4 : Formazione di neurosfere in neuroni placcati ad alta densità dopo 7 giorni. (A-D) Neurosfere generate spontaneamente dopo 7 giorni in coltura dai neuroni placcati ad alta densità. (E) Formazione di estensioni radiali simili al gliali tra due neurosfere appena formate, come indicato dalle frecce nere. Le barre di scala in (A, B, C, D, E) rappresentano 200 m. Fare clic qui per visualizzare una versione più grande di questa figura.
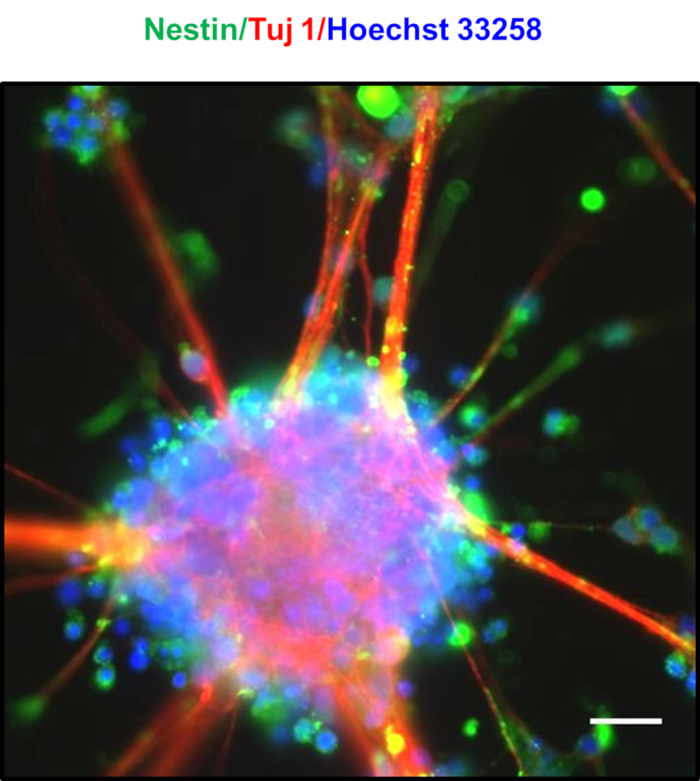
Figura 5 : Caratterizzazione delle neurosfere ottenute. Immagine sovrapposta delle neurosfere che mostra l'espressione per la proteina neuronale Tuj1 (rosso) e il marcatore di cellule staminali neurali Nestin (verde), che indica una popolazione ricca di PNG. Nuclei erano macchiati con Hoechst 33258 (blu). Barra della scala rappresenta 20 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6 : Vitalità cellulare dei neuroni primari. Il grafico a barre rappresenta la vitalità cellulare dei neuroni primari, valutata utilizzando un saggio MTT per un massimo di 30 giorni a intervalli di 5 giorni. La barra di errore rappresenta la SD del valore (p; 0,05). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7 : Caratterizzazione delle colture ad alta densità che formano la neurosfera con marcatore neuronale Tuj1 e marcatore astrocito GFAP. (A) L'immagine mostra le cellule di semi ad alta densità (in modalità DIC), che genera nepheres esprimendo sia GFAP (per gli astrociti) che Tuj1 (per i neuroni). I Nuclei erano macchiati con Hoechst 33258. La barra della scala rappresentala barra di 20 m. (B) rappresenta la percentuale della popolazione di cellule che esprimono Tuj1 e cellule che esprimono GFAP nella neurosfera generando cellule ad alta densità. La barra degli errori rappresenta l'SD (-p < 0,05). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8 : caratterizzazione delle cellule placcate a bassa densità per la coltura primaria del neurone con marcatore neuronale Tuj1 e marcatore di astrociti GFAP continuamente fino a 7 giorni. (A) L'immagine mostra le cellule di semi a bassa densità in quattro canali diversi (ad esempio, DIC, canale blu [indica la colorazione nucleare da Hoechst 33258], il canale verde [colorazione GFAP] e il canale rosso [per la colorazione Tuj1]) per 7 giorni in modo continuo. La barra della scala rappresentai 20 m. (B ) Il grafico a barre rappresenta il rapporto percentuale tra le popolazioni di cellule che esprimeno Tuj1 e quella delle cellule che esprimono GFAP nelle celle seminate a bassa densità per la coltura primaria dei neuroni per 7 giorni. La barra degli errori rappresenta l'SD (-p < 0,05). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9 : Immunostaining delle neurosfere ottenute con GFAP e Tuj1. Le immagini delle neurosfere ottenute sono (A) in modalità DIC, (B) colorazione nucleo utilizzando Hoechst 33258, (C) marcatore astrocito GFAP (verde), e (D) marcatore neuronale Tuj1 (rosso). Barra della scala rappresenta 20 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10 : Crescita e saggio di cellule vive/morte delle neurosfere nell'arco di 15 giorni. (A) Immagine mostra la crescita di una neurosfera in 15 giorni a intervalli di 5 giorni in modalità DIC, così come la sua colorazione con calceina AM (verde indica le cellule vive) e PI (iodio dipropidium con un colore rosso indica cellule morte). Il grafico della barra dellascala rappresenta l'aumento delle dimensioni delle neurosfere coltivate in piastre a bassa aderenza per un periodo di 15 giorni a intervalli di 5 giorni. La barra di errore rappresenta SD. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo descrive che come alterando la densità di placcatura cellulare dei neuroni primari, si ottengono due piattaforme neuronali variabili. Anche se questo è un metodo semplice, ogni passo deve essere eseguita meticolosamente per ottenere i risultati desiderati. Altri metodi precedenti hanno segnalato colture di neuroni primari a lungo termine o culture della neurosfera. La maggior parte dei protocolli di coltura neuronale primaria hanno coinvolto la coltura dei neuroni ippocampali per 3-5 settimane, ma la maggior parte hanno fallito, come i neuroni muoiono e appassire via a causa della perdita di connessioni. Un altro vantaggio del protocollo è che i neuroni possono essere coltivati senza la necessità di qualsiasi strato di alimentazione gliale, quindi mantenendo la purezza dei neuroni.
Tuttavia, diversi passaggi critici devono essere seguiti con attenzione per ottenere i risultati desiderati. In primo luogo, mantenere condizioni sterili in tutto è assolutamente necessario. Si consiglia di eseguire la maggior parte dei passaggi in un cappuccio laminare così come pre-pulire tutte le lastre, strumenti, e strumenti chirurgici con 70% alcol prima di iniziare; in caso contrario, c'è una maggiore probabilità di fallimento a causa della contaminazione da batteri e funghi. Successivamente, è importante isolare gli embrioni E14-16; quindi, il passaggio di rilevamento della spina vaginale deve essere eseguito con attenzione. Con l'aumentare del giorno embrionale, maggiori sono le probabilità di contaminazione da parte di cellule non neuronali. La rimozione completa delle meningi dagli emisferi è estremamente critica per ridurre l'interferenza nella coltura da parte delle cellule non neuronali. Sia il mezzo di placcatura che quello di manutenzione devono essere preparati al momento con tutti i componenti, poiché ogni componente svolge un ruolo essenziale. Un altro fattore che deve essere tenuto a mente è che i neuroni primari ottenuti devono essere mantenuti cambiando il mezzo di manutenzione 2x a settimana in modo che l'apporto di nutrienti ai neuroni in proliferazione rimanga costante.
Anche se non è ancora stato tentato, Questo protocollo con lievi modifiche può essere utile anche nei neuroni embrionali del topo. Se i neuroni o neurosfere desiderate non sono ottenuti seguendo questa tecnica, Ci sono alcuni suggerimenti per la risoluzione dei problemi che possono essere utili. Per mantenere i tessuti vitali, la dissezione deve essere eseguita in HBSS ghiacciati. La dissezione può essere eseguita anche nel buffer Krebs ghiacciato invece di HBSS buffer. L'esecuzione rapida della dissezione è fondamentale per mantenere la vitalità dei tessuti. L'uso di 10x trypsin porterà a sovradigestione del tessuto. Quindi, 10x soluzione trypsin-EDTA dovrebbe essere diluito a 1x in buffer di dissociazione prima della digestione. L'aggiunta di mezzo ghiacciato alle cellule, inducendo congelamento-shock, dovrebbe essere evitata a tutti i costi, e medio dopo aver raggiunto RT dovrebbe essere utilizzato invece. Ancora più importante, i copricopertine dovrebbero sempre essere rivestiti con PDL, altrimenti i neuroni non si attaccheranno ai copricopertine. In caso di difficoltà durante l'esecuzione della fase di triturazione (cioè, il tessuto non digerire correttamente), la digestione può essere eseguita aggiungendo 0,5 mL di 1% DNase per 10 min. Se si incontrano alti gradi di contaminazione da cellule non neuronali, è necessario aggiungere 5 usd di citosina arabicnoside (araC) per prevenire la crescita di cellule non neuronali.
Nonostante i suoi molteplici vantaggi, questa tecnica soffre di alcune limitazioni. È noto che questa tecnica genera spontaneamente neurosfere (anche se i meccanismi molecolari scatenanti non sono noti); tuttavia, rimangono poche ambiguità riguardanti questa tecnica, come la dimensione esatta delle neurosfere formate e il numero esatto di giorni necessari per formare un numero sufficiente di neurosfere. Per lo più, la dimensione è il problema. Anche se è stato osservato che le neurosfere si espandono nel volume nel tempo, le neurosfere iniziali ottenute sono di dimensioni variabili. Anche se utile, rende difficile eseguire uno studio sincronizzato. Ciò che distingue questo protocollo di generazione della neurosfera dagli altri è la sua robustezza e semplicità. Ci sono protocolli precedentemente riportati per la coltura e la propagazione di neuropheres che richiedono particolari requisiti medi e condizioni di coltura, nessuno dei quali è richiesto in questo protocollo. In questi protocolli precedentemente riportati, non c'è quasi alcuna uniformità per coloro che cercano di generare neurosfere.
Nel complesso, questo protocollo descrive una strategia unica per la generazione di piattaforme neuronali 2D e 3D semplicemente alterando le densità di placcatura cellulare dei neuroni primari isolati dagli embrioni dei ratti E14-E16 Sprague Dawley. Questo metodo è conveniente rispetto ad altri metodi, in quanto può essere eseguito con una semplice configurazione e richiede molto meno reagenti e passaggi. Può fornire varie applicazioni di interesse per i neuroscienziati. Questo può essere utilizzato come piattaforme di screening per vari lead neuro-terapeutici, osservando i ruoli di varie proteine del carico neuronale, indagini sui percorsi cellulari in molte malattie neurodegenerative e molte altre applicazioni. Le neurosfere possono essere ulteriormente utilizzate per lo screening di vari agenti di differenziazione neurale e studiare le prime fasi dello sviluppo neurale in vitro25,26.
Divulgazioni
Gli autori non dichiarano interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo l'impianto per animali CSIR-IICB. G. D. ringrazia ICMR, J. K. e V. G. ringraziano DST Inspire, e D. M. ringrazia NOT, India per le loro borse di studio. S. G. riconosce gentilmente seRB (EMR/2015/002230) India per fornire sostegno finanziario.
Materiali
| Name | Company | Catalog Number | Comments |
| Anti-GFAP | Abcam | AB7260 | |
| Anti- Nestin | Abcam | AB92391 | |
| Anti-O4 | Millipore | MAB345 | |
| Anti-Tau | Abcam | AB76128 | |
| Anti-Tuj1 | Millipore | MAB1637 | |
| B27 Serum Free Supplement | Gibco | 17504-044 | |
| Cell Counter | Life technologies | Countess II FL | |
| CO2 Incubator | Eppendorf | Galaxy 170 R | |
| D-glucose | SDFCL | 38450-K05 | |
| Ethanol | Merck Millipore | 100983 | |
| Fluorescence Microscope | Olympus | IX83 Model | |
| Formaldehyde | Sigma Aldrich | 47608 | |
| GlutaMax-I Supplement | Gibco | 35050-061 | |
| GtXMs IgG Fluor | Millipore | AP1814 | |
| GtXMs IgG (H+L) | Millipore | AP124C | |
| HEPES | SRL | 16826 | |
| Hoechst 33258 | Calbiochem | 382061 | |
| Horse Serum | HiMedia | RM10674 | |
| Hydrochloric Acid | Rankem | H0100 | |
| Laminar Hood | BioBase | BBS-V1800 | |
| MEM Eagle’s with Earle’s BSS | Sigma Aldrich | M-2279 | |
| Microscope | Dewinter | Victory Model | |
| Neurobasal Medium | Gibco | 21103-049 | |
| Plasticware (24 well plate, cell strainers, and low adherence plates) | BD Falcon | 353047, 352350 and 3471 | |
| 90 mm Petridishes | Himedia | PW001 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Poly-D-Lysine | Millipore | A.003.E | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Potassium Phosphate Monobasic | Merck | MI6M562401 | |
| Sodium Chloride | Qualigem | 15918 | |
| Sodium Phosphate Dibasic | Merck | MI6M562328 | |
| Stereomicrosope | Dewinter | Zoomstar Model | |
| Triton-X 100 | SRL | 2020130 | |
| Trypan Blue Solution | Gibco | 15250-061 | |
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 |
Riferimenti
- Lorsch, J. R., Collins, F. S., Lippincott-Schwartz, J. Fixing problems with cell lines. Science. 346 (6216), 1452-1453 (2014).
- Masters, J. R. W. Cell line misidentification: the beginning of the end. Nature Reviews Cancer. 10 (6), 441-448 (2010).
- Banker, G. Culturing Nerve Cells, 2nd edition. , 339-370 (1998).
- Geschwind, D. H., Konopka, G. Neuroscience in the era of functional genomics and systems biology. Nature. 461 (7266), 908-915 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1, 2406-2415 (2006).
- Lu, Z. M., Piechowicz, M., Qiu, S. F. A Simplified Method for Ultra-Low Density, Long-Term Primary Hippocampal Neuron Culture. Journal of Visual Experiments. 109, e53797(2016).
- Kaneko, A., Sankai, Y. Long-Term Culture of Rat Hippocampal Neurons at Low Density in Serum-Free Medium: Combination of the Sandwich Culture Technique with the Three-Dimensional Nanofibrous Hydrogel PuraMatrix. PLoS ONE. 9 (7), e102703(2014).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209 (4458), 809-810 (1980).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. Journal of Neuroscience. 8 (4), 1454-1468 (1988).
- Piret, G., Perez, M. T., Prinz, C. N. Support of Neuronal Growth Over Glial Growth and Guidance of Optic Nerve Axons by Vertical Nanowire Arrays. ACS Applied Materials & Interfaces. 7 (34), 18944-18948 (2015).
- Campos, L. S. Neurospheres: Insights biology into neural stem cell biology. Journal of Neuroscience Research. 78 (6), 761-769 (2004).
- Ahmed, S. The Culture of Neural Stem Cells. Journal of Cellular Biochemistry. 106, 1-6 (2009).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Molecular Neurobiology. 34 (3), 153-161 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111, A3.B.1-A3.B.3 (2015).
- Pradhan, K., et al. Neuro-Regenerative Choline-Functionalized Injectable Graphene Oxide Hydrogel Repairs Focal Brain Injury. ACS Chemical Neuroscience. 10 (3), 1535-1543 (2019).
- Ray, B., Bailey, J. A., Sarkar, S., Lahiri, D. K. Molecular and immunocytochemical characterization of primary neuronal cultures from adult rat brain: Differential expression of neuronal and glial protein markers. Journal of Neuroscience Methods. 184 (2), 294-302 (2009).
- Robinson, A. P., Rodgers, J. M., Goings, G. E., Miller, S. D. Characterization of Oligodendroglial Populations in Mouse Demyelinating Disease Using Flow Cytometry: Clues for MS Pathogenesis. PLoS ONE. 9 (9), (2014).
- Osterberg, N., Roussa, E. Characterization of primary neurospheres generated from mouse ventral rostral hindbrain. Cell and Tissue Research. 336 (1), 11-20 (2009).
- Bernal, A., Arranz, L. Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cellular and Molecular Life Sciences. 75 (12), 2177-2195 (2018).
- Qu, Q. H., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5, 3449(2014).
- Bradke, F., Dotti, C. G. Differentiated neurons retain the capacity to generate axons from dendrites. Current Biology. 10 (22), 1467-1470 (2000).
- Theocharatos, S., et al. Regulation of Progenitor Cell Proliferation and Neuronal Differentiation in Enteric Nervous System Neurospheres. PLoS ONE. 8 (1), (2013).
- Binder, E., et al. Enteric Neurospheres Are Not Specific to Neural Crest Cultures: Implications for Neural Stem Cell Therapies. PLoS ONE. 10 (3), e0119467(2015).
- Cordey, M., Limacher, M., Kobel, S., Taylor, V., Lutolf, M. P. Enhancing the Reliability and Throughput of Neurosphere Culture on Hydrogel Microwell Arrays. Stem Cells. 26 (10), 2586-2594 (2008).
- Ladiwala, U., Basu, H., Mathur, D. Assembling Neurospheres: Dynamics of Neural Progenitor/Stem Cell Aggregation Probed Using an Optical Trap. PLoS ONE. 7 (6), (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon