Method Article
הדור של נוירוספירות מ מעורב היפוקמאל ראשוני ונוירונים בקליפת המוח מבודדים מ E14-E16 ספראג העובר עכברוש
In This Article
Summary
מוצג כאן הוא פרוטוקול עבור הדור הספונטני של נוירוספירות מועשר בתאי מחולל קדמון בצפיפות גבוהה מצופה נוירונים. במהלך אותו ניסוי, כאשר הנוירונים מצופים בצפיפות נמוכה יותר, הפרוטוקול גם גורם לתרבויות ממושכות של עצב החולדות הראשי.
Abstract
תרבות תא העצב העיקרי היא טכניקה חיונית בתחום המוח. כדי לזכות בתובנות מכניסטיות עמוקות יותר במוח, חיוני להיות בעלי מודל מתורבת שניתן לנצל למחקרים שונים בנוירוביולוגיה. למרות התרבויות הראשיות של תא העצב (כלומר, לטווח ארוך בתרבויות ההיפוקמפוס) סיפקו מדענים עם דגמים, הוא עדיין לא מייצג את המורכבות של רשת המוח לחלוטין. בעקבות מגבלות אלה, מודל חדש התפתחה באמצעות נוירוספירות, אשר נושא דמיון קרוב יותר לרקמת המוח. הפרוטוקול הנוכחי מתאר את ציפוי של צפיפות גבוהה ונמוכה של קליפת המוח המעורב ואת הנוירונים היפוקמאל מבודדים מן העובר של היום העובריים 14-16 החולדות של הג דאוד. זה מאפשר את הדור של נוירוספירות ותרבות תא העצב העיקרי לטווח ארוך כמו שתי פלטפורמות עצמאיות לבצע מחקרים נוספים. תהליך זה הוא פשוט מאוד חסכוני, כפי שהוא ממזער מספר שלבים וריאגנטים שנחשבו בעבר חיוני לתרבות העצב. זהו פרוטוקול יציב עם דרישות מינימליות שניתן לבצע עם תוצאות השגה ושימוש נוסף עבור מגוון של מחקרים הקשורים למדעי המוח.
Introduction
המוח הוא מעגל מורכב של תאים עצביים ולא עצביים. במשך שנים, מדענים מנסים. להשיג תובנה במכונות המורכבות האלה כדי לעשות זאת, מדענים נוירו, בתחילה נקטו בקווים שונים של תאי עצב מבוססי העצבים לחקירות. עם זאת, חוסר היכולת של הקווים האלה תא שבטים ליצור קשרים סינפטית חזקים ואקסונים הנכון או דנדטים העבירו עניין מדעי לתרבויות תא העצב העיקרי1,2. ההיבט המרגש ביותר של תרבות תא העצב העיקרי הוא שזה יוצר הזדמנות להתבונן ולתפעל נוירונים חיים3. כמו-כן, היא מורכבת פחות לעומת רקמת העצבים, מה שהופך אותו למועמד אידיאלי לחקר התפקוד וההובלה של חלבונים עצביים שונים. לאחרונה, מספר התפתחויות בתחומים של מיקרוסקופ, גנומיקה, ו פרוטאומניקס יצרו הזדמנויות חדשות עבור נוירומדענים לנצל את תרבויות תא העצב4.
התרבויות הראשיות הרשו לנוירומדענים לחקור את המנגנונים המולקולריים שמאחורי ההתפתחות העצבית, לנתח מסלולים שונים של אותות עצביים, ולפתח הבנה ברורה יותר של synapsis. למרות שמספר שיטות דיווחו על תרבויות מפני הנוירונים הראשוניים (בעיקר ממקור ההיפוקמאל5,6,7), פרוטוקול אחיד עם מדיום מוגדר כימית המאפשר תרבות ארוכת טווח של נוירונים הוא עדיין צריכים עם זאת, נוירונים מצופה בצפיפות נמוכה מתבוננים בדרך כלל, אשר לא לשרוד לטווח ארוך, כנראה בשל חוסר תמיכה הזנה8 כי הוא סיפק את הנוירונים הסמוכים תאים גליה. שיטות מסוימות אפילו הציע co-culturing של הנוירונים העיקריים עם תאים גליה, שבו התאים גליה משמשים כשכבת ממזין9. עם זאת, תאים גליה להוות הרבה בעיות עקב צמיחת יתר שלהם, אשר לפעמים לעקוף את הצמיחה עצבי10. מכאן, בהתחשב בבעיות לעיל, חובה פשוטה וחסכונית יותר הפרוטוקול העיקרי התרבות העצבית נדרשת, אשר ניתן להשתמש הן נוירוביולוגים והן נוירוכימאים לחקירות.
תרבות תא העצב העיקרית היא למעשה צורה של תרבות דו-ממדית ואינה מייצגת את הפלסטיות, השלמות המרחבית, או הטרוגניות של המוח. זה נתן את הצורך במודל תלת-ממד אמין יותר בשם נוירוספירות11,12. נוירוספירות להציג פלטפורמה רומן מדענים נוירו, עם דמיון קרוב יותר למציאות, במוח vivo13. נוירוספירות הם לא מחסיד אשכולות תלת-ממד של תאים עשירים בתאי גזע עצביים (NSCs), בתאי מחולל קדמון (NPCs), נוירונים, ו astrocytes. הם מקור מצוין עבור בידוד של תאי גזע עצביים ותאים מחולל קדמון, אשר ניתן להשתמש בהם כדי ללמוד בידול לתוך שונים עצביים ושאינם עצביים. שוב, השונות בתוך תרבויות נוירוספירה המיוצר באמצעות הפרוטוקולים שדווחו קודם לכן מציג מחסום לניסוח של פרוטוקול נוירוספירה מאוחדת התרבות14.
כתב יד זה מציג פרוטוקול שבו ניתן ליצור הן 2D ו-3D פלטפורמות על ידי הציפוי תאים מתחלפים משולב של קליפת המוח מעורב היפוקמאל. הוא ציין כי בתוך 7 ימים חופשי-צפה נוירוספירות מתקבלים מפני נוירונים בצפיפות גבוהה מצופה מבודדים מ-E14-E16 ספראג העובר עכברוש דטרלי, אשר על תרבות נוספת, גשרים טופס והתקשרויות באמצעות הרחבות מדומה glial-. באופן דומה, בצפיפות נמוכה מצופה נוירונים, תרבות תא העצב העיקרי שניתן לשמור עד 30 ימים מושגת על ידי שינוי המדיום תחזוקה פעמיים בשבוע.
Protocol
כל ההליכים הניסיוניים הכרוכים בבעלי חיים אושרו על ידי ועדת האתיקה של בעלי החיים המוסדיים של CSIR-הודי מכון לביולוגיה כימית (IICB/AEC/פגישה/אפריל/2018/1).
1. הכנה מגיב ומדיה
- פתרון ליזין-D (PDL): להכין פתרונות PDL בריכוזים של 0.1 mg/mL במים מוכי ובחנות ב 4 ° צ' עד השימוש.
- מדיום דיסוציאציה: ל-1 L של מים סטריליים, מסוננים מסונן, לשלב את הרכיבים הבאים בריכוזים המתאימים: נתרן כלוריד (8 מ"ג/mL), אשלגן כלוריד (0.4 mg/mL), אשלגן פוספט חד-בסיסי (0.06 mg/mL), D-גלוקוז (1 מ"ג/mL), נתרן פוספט dibasic (0.479 מ"ג/mL), ו 1 M הפסי [4-(2-הידרוקסיל) -1-piperazinefonic חומצה; 10 מ"מ]. מערבולת כל המרכיבים כדי לסייע ערבוב נכון ולאחסן 4 ° צ' עד השימוש.
הערה: השתמש באמצעי הדיסוציאציה בצורת קרח קר במהלך הדיסוציאציה, אך בטמפרטורת החדר (RT) לכביסה ולמטרות אחרות. - ציפוי בינוני: ציפוי בינונית מורכב מהפעולות הבאות: בינוני חיוני מינימלי (הגברת) של נשר עם פתרון מלח מאוזן של ארל (BSS; 88.4%), D-גלוקוז (0.6%), סרום סוסים (10%), ופניצילין/סטרפטומיצין (1%). לשלב את הרכיבים ביחס המתאים ולבצע את ההליך בתוך ברדס תחת תנאים סטריליים.
הערה: השתמש תמיד במדיום ציפוי טרי כדי למנוע השפלה של כל רכיב. - תחזוקה בינונית: להכין את המדיום תחזוקה על ידי שילוב הבאים ביחס המתאים: neurobasal סיס מדיום (97%), 0.5 mM מסחרי מדגם גלוטמין, B27 סרום ללא תשלום (2%), ו פניצילין/סטרפטומיצין (1%). לשלב את הרכיבים ביחס המתאים ולבצע את ההליך בתוך ברדס תחת תנאים סטריליים. ודא כי כל הרכיבים מוכנים טרי.
2. הכנת שמיכות
- קח בקוטר 12 מ"מ שמיכות זכוכית עגול ולהשרות אותו בחומצה הידרוכלורית 1 M (HCl) עבור 4 h.
- להעביר את הכיסויים במים מזוקקים באמצעות זוג מלקחיים מערבולת בעדינות כדי להיפטר חומצה לחלוטין.
- העבר את הכיסויים שנשטפו עבור סיבוב נוסף של ניקוי בגביע המכיל 100% אתנול.
- לפני השימוש הכיסויים, לייבש אותם היטב במכסה המנוע על ידי שמירה עליהם על נייר טישו.
3. הכנת צלחות פולי-ליזין מצופות לתרבות תא העצב
- קח 2 24 צלחות טוב: אחד לציפוי בצפיפות גבוהה ואחר ציפוי צפיפות נמוכה. פתח את המנות הסטריליות רק בתוך המכסה המנוע.
- להעביר את 12 מ"מ של שמיכות זכוכית סטרילי ב 24 לוחות היטב.
- יוצקים 300 μL של פתרון PDL (0.1 mg/mL במים מוכי) בכל טוב, כך שהוא מכסה באופן מלא את פני השטח של שמיכות.
- עוטפים את הצלחות עם רדיד אלומיניום כדי למנוע ייבוש ולשמור אותו ב-CO2 חממה בלילה.
- למחרת (לפני ציפוי), מטפי את הפתרון PDL ולשטוף כראוי עם 300 μL של מים מעוקרים סטרילי פעמיים עד שלוש פעמים.
- הוסיפו 200 μL של מדיום ציפוי טרי והחזר את הצלחות לחממה עד לציפוי.
4. הסרת ועריפת ראשו של העובר
הערה: לעקר את כל כלי הניתוח הארוזים ברדיד אלומיניום ב-121 ° צ' (15 psi) במשך 30 דקות. זה כולל זוג מספריים בוטה-קצה, מלקחיים, מלקחיים עדינים, שני מספריים עדינים, ומלקחיים עורק אחד לכל ההליך כולו.
- ליצירת נוירונים וכדורים נוירו, השתמש בעכבר בזמן ההריון בזמן הריון ולסמן את היום עם זיהוי תקע הנרתיק כמו E0.
הערה: יש לבצע את התרבות בין E14-E16. - ביום התרבות, מניחים צלחת פטרי זכוכית סטרילית על הקרח ולמלא אותו עם פתרון מלח קר מאוזנת של האנק (HBSS).
- הE14-E16 עכברוש בהריון עם הזרקה של הצפק (כיתה) של 90 מ"ג קטמין/ק ג של משקל הגוף 10 מ"ג xylazine/ק"ג, ואז להקריב על ידי ביצוע פריקה צוואר הרחם.
הערה: ניתן לקבל חולדות גם על ידי מנת יתר של פנטוברביטל או מנת יתר של קטמין עם xylazine או דיאזפם. - לחטא את הבטן של הסכר על ידי ריסוס 70% אתנול ולעשות חיתוך בצורת V באזור הבטן באמצעות מלקחיים סטרילית וזוג מספריים קהה-קצה.
- קחו את השקי העובריים בזהירות על צלחת פטרי עם פתרון HBSS קר.
הערה: אין להשתמש באותם מלקחיים ומספריים ששימשו רק לצורך העור, שכן הדבר יזהם את האברים הפנימיים. השתמש בערכה שונה של מספריים/מלקחיים עבור האיברים הפנימיים. - קח את העוברים מתוך השקי העובריים בתוך הHBSS הטרי והקר.
- . ערוף את ראשו במספריים סטריליים
5. הסרת המוח והניתוח של הקליפה עם ההיפוקמפוס
- לפני שמתחילים, ממלאים 90 מ"מ מנות פטרי סטרילי, עם HBSS קר וסטרילי.
- להעביר את הראשים בכלים סטרילי באמצעות מלקחיים ההלבשה סטרילי, בוטה הסתיימה.
- תחת stereomicroscope, להחזיק את הראש מאזור החוטם עם מלקחיים סטרילי, משונן ולהסיר את המוח על ידי חיתוך העור והגולגולת פתוח.
- לאסוף את כל המוח העובר באותו אופן בפתרון HBSS.
- להסיר את כל מקרום המוח מהאונות ומידות על ידי החזקת גזע המוח.
- להסיר בזהירות את האונות ללא שינוי דמוי פטריות כמוסות המכילות את ההיפוקמפוס ואת קליפת המוח.
- לאסוף את האונות המכילה את קליפת ההיפוקמפוס בשלמותו בצינור 15 מ ל חרוט המכיל 10 מ ל של מדיום הדיסוציאציה.
6. דיסוציאציה של רקמה קורטיקלית והיפוקמאל לנוירונים בודדים
- הרשו לרקמות שנאספו להתיישב ולחלק את מדיום הדיסוציאציה, ומשאירים 5%-10% מהמדיום.
- הוסיפו 10 מ ל של מדיום דיסוציאציה טרייה לרקמה, וחזרו על שלב 6.1 פעמיים.
- הוסף 4.5 mL של הדיסוציאציה בינונית ו 0.5 mL של 0.25% (1x) טריפסין EDTA (אתילן הטטראצטט) פתרון.
- שמרו את הרקמה בחממה ב-37 ° c למשך 20 דקות כדי שתהיה העיכול להמשיך.
- מנושף את המדיום ומוסיף 10 מ ל לדיסוציאציה ולציפוי מדיום ברציפות לרקמות הממעוטות.
- הרשו לרקמות העיעוטות להתיישב ולהוריד את מדיום הדיסוציאציה. להוסיף 2.5 mL של ציפוי בינוני ולשפוך לתוך הבסיס של 90 מ"מ צלחת סטרילית.
- Triturate את הרקמות מתעכל בבסיס הפינה של המנה באמצעות טיפ 1,000 μL הצנרת לכבוש את נפח מינימלי.
- להעביר את ההשעיה התא המתקבל דרך מסננת תא 70 יקרומטר, למעט כל נתחי רקמות.
- קבע את צפיפות התאים הניתנים לשימוש בשיטת האי-הכללה של הצבע הכחול וספור את מספר התאים במונה תאים אוטומטיים.
- עבור טרימין כחול שיטת הדרה, לקחת 10 μL של ההשעיה התא ו 10 μL של 0.4% טרימין כחול כתם, לערבב ביסודיות, ולהוסיף 10 μL של התערובת באחד משני התאים הסגורים של השקופיות קאמרית חד פעמיות.
- הכנס את השקופית המכילה את התערובת לתוך מונה התא וקבל את הקריאה.
הערה: שיטת ההדרה של הצבע הכחול מתבססת על העיקרון שתאים חיים (בשל הקרומים האחרים שלהם) לא יכללו את הצבע הכחול, ומכאן יראו ציטופלסמה ברורים, בהשוואה לתא שאינו בר קיימא, שייקח בקלות להשתלט על הכחול ויופיע כחול ב . בצבע15
- לדלל את מספר התאים המתקבלים צלחת 1.5 x 105 תאים/ml עבור צפיפות גבוהה ו 20,000 תאים/mL עבור צפיפות נמוכה בשני צינורות נפרדים המכילים 30 מ ל כל אחד המדיום ציפוי.
- מנושף את בינונית ציפוי שנוספו בעבר מכל טוב צלחת 500 μL של תאים התפזרו במדיום ציפוי בכל טוב.
- לאחר מכן להחזיר את הצלחות לחממה ב 37 ° c ו 5% CO2 עבור 4 h.
- בדקו את התאים לדבקות מתחת למיקרוסקופ 4 שעות הציפוי.
- אם יש הדבקות הנכון של התאים בשתי הצלחות, להחליף את המדיום בכל טוב עם 500 μL של תחזוקה ומדיום בינוני טרי ב 37 ° c.
- תרבות אלה הנוירונים גדלו בצפיפות נמוכה עבור 30 ימים על ידי שינוי המדיום תחזוקה 2x בשבוע.
- תרבות הנוירוספירות המתקבלות מנוירונים מצופים בצפיפות גבוהה באותו מדיום תחזוקה על ידי העברתם ללוחות המצורפים האולטרה-נמוכים.
- אפיון הנוירונים והנוירוספירות על-ידי חיסוני מכתים אותם עם סמנים חשובים. עבור האימונוציטוכימיה, ראשית לתקן את התאים/נוירוספירות באמצעות 4% פורמלדהיד עבור 30 דקות על הצלחת עצמה, ולאחר מכן לחלחל את התאים עם 0.1% שאינם יוניים לניקוי עבור 10 דקות.
- הוסף נוגדנים עיקריים עבור הנוירונים הן (anti-Tuj1, GFAP, O4, טאו) ו נוירוספירות (אנטי Nestin, GFAP, Tuj1) ב פוספט-מלוחים באגירה (PBS) ב 1:300 ריכוזי ו-דגירה לילה ב 4 ° c16.
הערה: Tuj1 (השלישי III β-טובולין) ו-הטאו הם סמנים חיוביים עבור הנוירונים העיקריים, בעוד gfap (glial fibrillary חלבון חומצי) ו O4 (אוליגודנדרוציטים סמן) הם סמנים שליליים עבור נוירונים ראשוניים17,18. במקרה של נוירוספירות, Tuj1, gfap, ו nestin כולם לשמש סמנים חיוביים19,20. - למחרת, לשטוף את התאים עם PBS פעם או פעמיים ולהוסיף נוגדנים משניים המתאים PBS ב 1:600 ריכוזים ב RT עבור 2 h.
הערה: הנוגדנים המשניים נגד העכבר או נגד הארנב נבחרים בהתאם למינים המארחים של הנוגדן העיקרי הוסיף. יש לזכור כי על הנוגדנים המשניים להיות מצומנת לנגזרות של זריחה המתאימה למטרות המיקרוסקופיה פלואורסצנטית. - שטוף את התאים שוב פעם או פעמיים.
- בצע כתמים גרעיניים של התאים עם Hoechst 33258 (1 מ"ג/mL פתרון מניות במים מוהים). הכן 0.1% הפתרון ב-PBS מתוך פתרון המניה ולהוסיף אותו לתאים.
- מודיית את התאים עם 0.1% הפתרון עבור 30 דקות, ולאחר מכן לשטוף שוב עם PBS.
- הוסף 20 μL PBS (או הרכבה בינונית) בשקופית והבהר באיטיות את הכיסויים המכילים את התאים המוכתמים על אזור השקופית המכילה את ה-PBS. סגרו את שולי הכיסויים בפוליסטירן מוקצף שמנת (DPX).
- בצע הדמיה של התאים הקבועים תחת מיקרוסקופ בהגדלה של 10x ו-40x.
תוצאות
בפרוטוקול זה הובהר אסטרטגיה פשוטה שבה מתקבלים צפיפות תאים משתנה משתי פלטפורמות שונות של הקרנה עצבית. איור 1A,B ממחיש את הדבקות של תאים לאחר 4 h של ציפוי הנוירונים בתאים גבוהים ומצופים צפיפות נמוכה, בהתאמה. על התבוננות נכונה של הנוירונים כפי שמוצג באיור 1, מדיום הציפוי הוחלף באמצעי תחזוקה בכל אחת מהבארות, ובכך, חזר לחממה ב 37 ° c. הדבקות התא יחסית יותר נצפתה בצפיפות גבוהה מצופה נוירונים. לאחר 24 שעות של ציפוי, בצפיפות גבוהה בציפוי מצופה נמוכה הראה הרחבות נוירואליות מורכבים והתקשרויות סינפטית, כפי שנצפו בניגוד הפרעות הדיפרנציאלי (DIC) תמונות באיור 2A,B.
באיור 3A, תמונה בניגוד שלב של הנוירונים בצפיפות נמוכה לאחר 7 ימים בתרבות מיוצגת. כאן, הנוירונים פיתחו רשת סינפטית משוכללת המורכבת ענפים דנדריטים. נוירונים אלה יכולים להישמר עוד עד 30 ימים על ידי שינוי המדיום תחזוקה כל 3 ימים עם פיתוח של רשתות נוירואליות מסובכים יותר. באיור 3 ב,ג, כתמים אימונוציטוטוקכימיים בוצע כדי לחשוף את הטבע העצבי של הנוירונים בצפיפות נמוכה התרבות על ידי כתמים עם סמנים עצביים Tuj1 (סמן של נוירונים הבדיל)21 ו-טאו (סמן של axons)22 , בהתאמה. הצבע האדום באיור 3B מציין את הנוכחות של Tuj1 כתמים, ירוק באיור 3b מייצג כתמים באקסונים של נוירונים ראשוניים. טוהר התרבות העצבית מוצג על ידי היעדר כתמים של סמנים שאינם עצביים עבור gfap של אסטרוציטים (איור 3d) ו O4 של oligodendrocytes הפוך (איור 3d). הגרעינים המוצגים בכחול היו מוכתמים בצבע הואכסט 33258.
בצפיפות גבוהה מצופה נוירונים לאחר 7 ימים מסומנים על ידי היווצרות נוירוספירות ספונטנית, כפי שנצפתה באיור 4a,B,C,D. לאחר 8-10 ימים, גשרים שונים המורכב של הרחבות מוקדי גליה כמו שנצפו בין נוירוספירות, כפי שנראה באיור 4e. הנוירוספירות היו מצויד בעושר NPCs, אשר סמנים coexpress Nestin ו Tuj123. Neurospeheres להראות כתמים חיוביים של Nestin ו Tuj, כפי שמוצג באיור 524. הגרעין המוצג בכחול היה מוכתם עם הואכסט 33258. כדורים נוירוונים אלה יכולים להישמר במשך מספר שבועות על-ידי הצמדת הקבצים בלוחות המצורפים האולטרה-נמוכים. באיור 6, תוחלת החיים של הנוירונים בתרבית עבור כ 30 ימים העריכו, ואת הכדאיות התא נמדד במרווח של ~ 5 ימים באמצעות mtt קונבנציונאלי [3-(4, 5-diמתילthiazol-2-yl)-2, 5-diפניליום ברומיד] שיטת, שבה זה היה מצא כי הנוירונים הראו יותר מ 90% הכדאיות גם לאחר 30 ימי תרבות.
הבא, האחוז של אסטרוציטים בצפיפות גבוהה ונמוכה תרבויות הנזרע הוערך. מאז מתודולוגיה זו מיועדת בעיקר בנוירונים culturing, היה חשוב להעריך אם שיטה זו תומכת בצמיחה מועדפים של נוירונים על תאים שאינם עצביים, במיוחד astrocytes. הנוכחות של אוכלוסיה של אסטרוציטים נצפתה ב נוירוספירה-ויוצרים בצפיפות גבוהה הזריעה התרבות, מסומן על ידי הצבע הירוק של כתמים gfap באיור 7a; למרות, פחות משמעותית נצפתה בהשוואה Tuj1 (אדום) מוכתם האוכלוסיה הנוירולית. זה היה גם אישר את הנתונים הכמותיים באיור 7B, שבו ~ 17% אוכלוסיות של תאים היו GFAP-הביע, לעומת 83% האוכלוסייה ב Tuj1 ביטוי תאים.
האוכלוסייה astrocytic נחקר גם באמצעות כתמים GFAP, לעומת האוכלוסייה העצבית (Tuj1 כתמים) בצפיפות נמוכה תאים הזרע, עבור 7 ימים רצופים. למרות הבדל משמעותי במספר התאים הכולל לא נצפתה במהלך 7 ימים, עקב זריעה נמוכה, האוכלוסיה אסטרוציט נצפתה גם להיות נמוך מאוד (כמעט לא או נמוך מאוד gfap כתמים), עם רוב להיות האוכלוסייה העצבית (מאוד Tuj1 ביטוי גבוה) כפי שנצפה באיור 8A.
כפי שמוצג באיור 8b, ניתוח כמותי בוצע על ידי ספירת האוכלוסייה של אסטרוציטים ונוירונים שהתקבלו באמצעות מיקרוסקופ בעזרת התוכנה cellsens, שבו רק ~ 2%-3% של האוכלוסייה אסטרוציט נצפתה בתחילה. בשל היעדר מדיה מתאים וחומרים מזינים לתמוך בצמיחה שלה, האוכלוסייה הזאת של אסטרוציטים גם נספו לאט לאורך זמן, ואילו בנוכחות של גורמים מיטביים ומדיה, הנוירונים השתלטו במהירות על התרבות כולה.
כפי שמוצג באיור 9, זה נצפה כי בשל נוכחותם של npcs, נוירוספירות גם ביטא כמויות גבוהות של astrocytes, מסומן על ידי האות הירוק חזק של כתמים GFAP יחד עם אות Tuj1 חזק יותר. לבסוף, כדי לראות אם הנוירוספירות האלה התרחבו לאורך זמן, לאחר 1 שבוע של תרבות בעלת צפיפות גבוהה, בשלב זה הנוירוספירות קטנות החלו להיווצר, כמה הועברו לוחיות מצורף אולטרה נמוך הצמיחה שלהם היה במעקב כל 5 ימים עד . חמישה עשר ימים
הבדיקה תא חי/מת התבצע גם באמצעות calcein AM (ירוק) ו propidium יודיד (אדום) כדי לבדוק את בריאות התאים. זה נצפה כי הנוירוספירות המתרחב מראה כמות גדולה של זריחה ירוקה ללא כתמים אדומים, המציין לא מוות המתרחשים הנוירוספירות לפחות עד 15 ימים בתרבות, כפי שהוצג באיור 10A. כפי שמוצג באיור 10B, התרחבות העצבים של הנוירוספירות נצפתה בכל 5 ימים בתרבות במשך עד 15 יום. כדי להתוות את גרף הקו המייצג את העלייה הסופית בנפח של הנוירוספירות (עבור כל נקודת זמן), 50 למדו ממוצעים, והממוצעים שלהם שימשו להפקת אמצעי הנוירוספירה בכל רגע.

איור 1 : ייצוג הדבקות בתאים לאחר 4 שעות הציפוי. (A) תא הדבקות נוירונים מצופה צפיפות גבוהה. (ב) הדבקות בתא בצפיפות נמוכה מצופה נוירונים. סרגל קנה מידה ב (A, B) הוא 200 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2 : מורפולוגיה תא של נוירונים לאחר 24 שעות של ציפוי. (א) תא מורפולוגיה של נוירונים מצופים בצפיפות גבוהה. (ב) מורפולוגיה תאית של נוירונים בעלי צפיפות נמוכה. סרגל הקנה מידה ב (A, B) מייצג 20 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
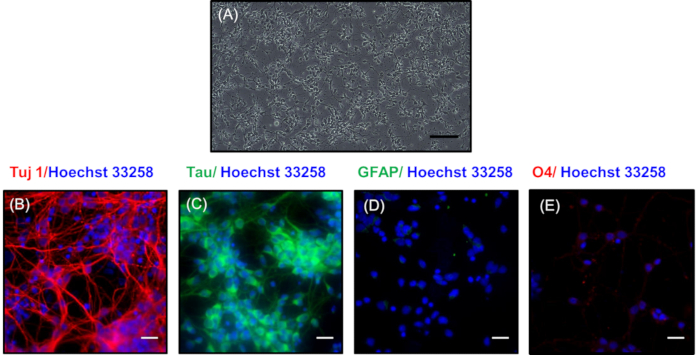
איור 3 : מורפולוגיה ואפיון של נוירונים מצופים בצפיפות נמוכה לאחר 7 ימים. (א) דמות הניגוד שלב של נוירונים מראה לבלוב נרחב. סרגל קנה מידה מייצג 200 μm. תמונות שכבת-על המציגות ביטוי לחלבונים עצביים (ב) Tuj1 (אדום) ו-(ג) טאו (ירוק). Immnunocytochemistry בבירור מראה היעדר הצביעת בחלבונים שאינם עצביים (D) gfap (ירוק) ו (E) O4 (אדום). גרעינים היו מוכתמים עם הואכסט 33258 (כחול). שינוי קנה מידה (ב, ג, ד, ה) מייצג 20 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4 : היווצרות של נוירוספירות בנוירונים מצופים בצפיפות גבוהה לאחר 7 ימים. (A-D) באופן ספונטני שנוצר נוירוספירות לאחר 7 ימים בתרבות מן הנוירונים בצפיפות גבוהה מצופה. (ה) היווצרות של הרחבות מוקדי glial, בין שני התחומים החדשים שנוצרו כמצוין על ידי חיצים שחורים. קנה מידה של פסים ב (A, B, C, D, E) מייצגים 200 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
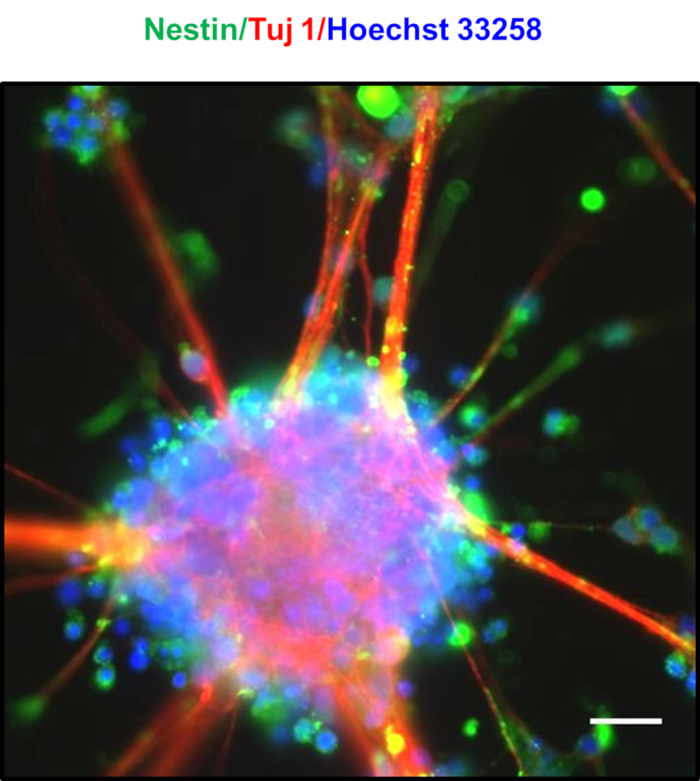
איור 5 : אפיון הנוירוספירות המתקבלות. תמונה של שכבת-על של הנוירודורים מראה ביטוי עבור חלבון עצבי Tuj1 (אדום) ומסמן תא גזע עצבי nestin (ירוק), המציין את האוכלוסייה של NPC עשיר. גרעינים היו מוכתמים עם הואכסט 33258 (כחול). סרגל בקנה מידה מייצג 20 μm. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6 : הכדאיות התאית של הנוירונים הראשוניים. גרף העמודות מייצג את הכדאיות התאית של הנוירונים הראשיים, המוערך באמצעות שיטת MTT למשך עד 30 יום במרווחי זמן של 5 ימים. סרגל השגיאות מייצג את ה-SD של הערך (* p < 0.05). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 7 : אפיון מעגל נוירוספירה ליצירת תרבויות בצפיפות גבוהה עם סמן Tuj1 ו אסטרוציט סמן gfap. (א) התמונה מציגה תאים בעלי צפיפות גבוהה הזרע (במצב DIC), אשר מייצרת neuropsheres ביטוי הן GFAP (האסטרוציטים) ו Tuj1 (עבור נוירונים). הגרעינים היו מוכתמים עם הואכסט 33258. סרגל בקנה מידה מייצג 20 μm. (ב) תרשים עמודות מייצג את אחוז האוכלוסיה של Tuj1 ביטוי תאים ו GFAP ביטוי תאים בנוירוספירה הפקת תאים בצפיפות גבוהה. סרגל שגיאות מייצג SD (* p < 0.05). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 8 : אפיון תאים בעלי צפיפות נמוכה עבור תרבות תא העצב הראשי עם סמן עצבי Tuj1 ו אסטרוציט סמן gfap ברציפות עד 7 ימים. (א) התמונה מציגה את תאי הזרע בצפיפות נמוכה בארבעה ערוצים שונים (כלומר, DIC, ערוץ כחול [מציין מכתים גרעיני על ידי Hoechst 33258], ערוץ ירוק [כתמים GFAP], ו ערוץ אדום [עבור Tuj1 כתמים]) במשך 7 ימים ברציפות. סרגל בקנה מידה מייצג 20 μm. (ב) הגרף בר מייצג את היחס אחוז של אוכלוסיות של Tuj1 ביטוי תאים זה של התאים GFAP ביטוי בצפיפות נמוכה הזרע תאים היסוד לתרבות תא העצב הראשי במשך 7 ימים. סרגל שגיאות מייצג SD (* p < 0.05). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 9 : כתמים חיסוני השיגה נוירוספירות עם GFAP ו Tuj1. תמונות של הנוירוספירות הושגו הם (א) ב-DIC mode, (ב) גרעין מכתים באמצעות hoechst 33258, (ג) אסטרוציט סמן gfap (ירוק), ו (ד) הסמן העצבי Tuj1 (אדום). סרגל בקנה מידה מייצג 20 μm. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 10 : צמיחה ושליטה בתאים חיים/מתים של הנוירוספירות מעל 15 ימים. (A) התמונה מראה את הצמיחה של נוירוספירה לאורך 15 ימים במרווחי זמן של 5 ימים במצב DIC, כמו גם הכשלה עם calcein AM (ירוק מציין תאים חיים) ו-PI (propidium יודיד עם צבע אדום מציין תאים מתים). סרגל בקנה מידה מייצג 20 μm. (ב) גרף מייצג את הגידול בגודל של נוירוספירות שגדלו בלוחות הדבקות נמוכות לאורך תקופה של 15 ימים במרווחי זמן של 5 יום. סרגל השגיאות מייצג את SD. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר כיצד על ידי שינוי צפיפויות הציפוי של תאים של נוירונים ראשוניים, שני פלטפורמות עצבי משתנה מתקבלים. למרות זאת היא שיטה פשוטה, כל צעד צריך להתבצע בקפדנות כדי להשיג את התוצאות הרצויות. שיטות קודמות אחרות דיווחו על תרביות נוירונים בטווח הארוך או בתרבויות נוירוספירה. רוב הפרוטוקולים הראשוניים של תרבות העצב יש לערב את culturing של נוירונים היפוקמאל עבור 3-5 שבועות, אבל רובם נכשלו, כמו הנוירונים למות ו לנבול בשל אובדן של חיבורים. יתרון נוסף של הפרוטוקול הוא כי הנוירונים יכולים להיות מתורבתים ללא צורך בכל שכבת ממזין גליה, ומכאן שמירה על טוהר הנוירונים.
עם זאת, יש לעקוב אחר מספר שלבים קריטיים כדי לקבל את התוצאות הרצויות. ראשית, שמירה על תנאים סטריליים לאורך הכרחי לחלוטין. מומלץ לבצע את רוב השלבים במכסה המנוע, כמו גם לנקות מראש את כל לוחות, מכשירים, כלי ניתוח עם 70% אלכוהול לפני התחלת; אחרת, יש סיכוי גבוה יותר של כישלון עקב זיהום על ידי חיידקים ופטריות. הבא, חשוב לבודד E14-16 עוברים; מכאן, השלב זיהוי התקע הנרתיק צריך להתבצע בקפידה. ככל שהיום מגדיל את היום, גבוה יותר הסיכויים לזיהום על ידי תאים שאינם עצביים. הסרה מלאה של מניגים מהמיאונות היא קריטית מאוד להפחתת ההפרעות בתרבות על-ידי תאים לא-עצביים. יש להכין את הציפוי ואת אמצעי התחזוקה הטריים עם כל הרכיבים, משום שלכל מרכיב תפקיד חיוני. גורם נוסף שיש לזכור הוא כי הנוירונים העיקריים המתקבלים חייב להישמר על ידי שינוי המדיום תחזוקה 2x בשבוע, כך אספקת התזונתי לנוירונים מתרבים נשאר קבוע.
למרות שזה עדיין לא נוסה, פרוטוקול זה עם שינויים קלים יכול להיות גם שימושי נוירונים עובריים העכבר. אם הנוירונים או הכדוריות הרצויות לא מתקבלים בעקבות טכניקה זו, יש כמה טיפים לפתרון בעיות שעשויים להועיל. כדי לשמור על הרקמות הקיימא, יש לבצע את הניתוח באמצעות HBSS קר קרח. ניתן לבצע את הניתוח גם במאגר Krebs קר במקום במאגר HBSS. ביצוע מהיר של הניתוח הוא המפתח. לשמירה על יכולת הרקמות שימוש ב-10x טריפסין יגרום לעיכול יתר של הרקמה. מכאן, הפתרון 10x טריפסין-EDTA צריך להיות מדולל ל-1x במאגר הדיסוציאציה לפני העיכול. הוספת מדיום קר הקרח לתאים, גרימת הקפאת הלם, יש להימנע בכל מחיר, ובינוני לאחר להגיע RT צריך לשמש במקום. החשוב ביותר, שמיכות צריך תמיד להיות מצופה PDL, אחרת הנוירונים לא לצרף את שמיכות. במקרה של קושי במהלך ביצוע שלב נשחקו (כלומר, רקמות לא לעכל כראוי), העיכול ניתן לבצע על ידי הוספת 0.5 mL של 1% dnase עבור 10 דקות. אם מדרגות גבוהות של זיהום על ידי תאים שאינם עצביים נתקלים, ~ 5 μM ציטוסינוס הערנוסייד (araC) יש להוסיף כדי למנוע את התפתחותם של תאים שאינם עצביים.
למרות יתרונותיה המרובים, טכניקה זו סובלת ממגבלות מעטות. ידוע כי טכניקה זו מייצרת באופן ספונטני כדורים עצביים (למרות, המנגנון מפעילה מנגנונים מולקולרים אינם ידועים); עם זאת, מעטים הקשורים לטכניקה זו נותרים, כגון הגודל המדויק של הנוירוספירות שנוצרו ומספר הימים המדויק הנדרש כדי ליצור מספר מספיק של נוירוספירות. . בעיקר, הגודל הוא הבעיה למרות שנצפתה כי הנוירוספירות מתרחבות בנפח הזמן, הנוירוספירות הראשוניות המתקבלות הן במידות משתנה. למרות שימושי, זה מקשה על ביצוע מחקר מסונכרן. מה שמבדיל בין הפרוטוקול של הדור הנוירולוגי הזה לבין אחרים הוא החוסן והפשטות שלו. ישנם פרוטוקולים שדווחו קודם לכן עבור culturing והפצת הנוירופרקלים המחייבים דרישות בינוניות מיוחדות ותנאי תרבות, אף אחד מהם אינו נדרש בפרוטוקול זה. בפרוטוקולים אלה שדווחו בעבר, אין כמעט אחידות עבור אלה המחפשים לייצר כדורים נוירוקלים.
באופן כללי, פרוטוקול זה מתאר אסטרטגיה ייחודית לדור של שני פלטפורמות נוירואליות תלת-ממדית על-ידי שינוי צפיפות הציפוי התאים של הנוירונים הראשוניים מבודדים מעוברים של חולדות E14-E16 ספראג. שיטה זו היא חסכונית בהשוואה לשיטות אחרות, כפי שניתן לבצע עם הגדרת פשוטה ודורש הרבה פחות ריאגנטים ושלבים. זה יכול לספק יישומים שונים של עניין עבור מדענים נוירו. זה יכול לשמש פלטפורמות הקרנה עבור שונים מוביל נוירולוגי, התבוננות התפקידים של חלבונים מטענים עצביים שונים, חקירות של מסלולים סלולריים במחלות ניווניות רבות, ויישומים רבים אחרים. הנוירוספירות ניתן להשתמש בנוסף להקרנה של סוכנים עצביים שונים המבדילים וללמוד את השלבים המוקדמים של התפתחות עצבית ב מבחנה25,26.
Disclosures
המחברים לא מצהירים על אינטרסים פיננסיים מתחרים.
Acknowledgements
אנו מודים CSIR-IICB מתקן בעלי חיים. ד. נ. תודה ICMR, J. K. ו-V. G תודה שעון השראה, ו D. M. תודה DBT, הודו עבור המלגות שלהם. ס. ג. באדיבות מודה סרבית (EMR/2015/002230) הודו למתן תמיכה כספית.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-GFAP | Abcam | AB7260 | |
| Anti- Nestin | Abcam | AB92391 | |
| Anti-O4 | Millipore | MAB345 | |
| Anti-Tau | Abcam | AB76128 | |
| Anti-Tuj1 | Millipore | MAB1637 | |
| B27 Serum Free Supplement | Gibco | 17504-044 | |
| Cell Counter | Life technologies | Countess II FL | |
| CO2 Incubator | Eppendorf | Galaxy 170 R | |
| D-glucose | SDFCL | 38450-K05 | |
| Ethanol | Merck Millipore | 100983 | |
| Fluorescence Microscope | Olympus | IX83 Model | |
| Formaldehyde | Sigma Aldrich | 47608 | |
| GlutaMax-I Supplement | Gibco | 35050-061 | |
| GtXMs IgG Fluor | Millipore | AP1814 | |
| GtXMs IgG (H+L) | Millipore | AP124C | |
| HEPES | SRL | 16826 | |
| Hoechst 33258 | Calbiochem | 382061 | |
| Horse Serum | HiMedia | RM10674 | |
| Hydrochloric Acid | Rankem | H0100 | |
| Laminar Hood | BioBase | BBS-V1800 | |
| MEM Eagle’s with Earle’s BSS | Sigma Aldrich | M-2279 | |
| Microscope | Dewinter | Victory Model | |
| Neurobasal Medium | Gibco | 21103-049 | |
| Plasticware (24 well plate, cell strainers, and low adherence plates) | BD Falcon | 353047, 352350 and 3471 | |
| 90 mm Petridishes | Himedia | PW001 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Poly-D-Lysine | Millipore | A.003.E | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Potassium Phosphate Monobasic | Merck | MI6M562401 | |
| Sodium Chloride | Qualigem | 15918 | |
| Sodium Phosphate Dibasic | Merck | MI6M562328 | |
| Stereomicrosope | Dewinter | Zoomstar Model | |
| Triton-X 100 | SRL | 2020130 | |
| Trypan Blue Solution | Gibco | 15250-061 | |
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 |
References
- Lorsch, J. R., Collins, F. S., Lippincott-Schwartz, J. Fixing problems with cell lines. Science. 346 (6216), 1452-1453 (2014).
- Masters, J. R. W. Cell line misidentification: the beginning of the end. Nature Reviews Cancer. 10 (6), 441-448 (2010).
- Banker, G. Culturing Nerve Cells, 2nd edition. , 339-370 (1998).
- Geschwind, D. H., Konopka, G. Neuroscience in the era of functional genomics and systems biology. Nature. 461 (7266), 908-915 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1, 2406-2415 (2006).
- Lu, Z. M., Piechowicz, M., Qiu, S. F. A Simplified Method for Ultra-Low Density, Long-Term Primary Hippocampal Neuron Culture. Journal of Visual Experiments. 109, e53797(2016).
- Kaneko, A., Sankai, Y. Long-Term Culture of Rat Hippocampal Neurons at Low Density in Serum-Free Medium: Combination of the Sandwich Culture Technique with the Three-Dimensional Nanofibrous Hydrogel PuraMatrix. PLoS ONE. 9 (7), e102703(2014).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209 (4458), 809-810 (1980).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. Journal of Neuroscience. 8 (4), 1454-1468 (1988).
- Piret, G., Perez, M. T., Prinz, C. N. Support of Neuronal Growth Over Glial Growth and Guidance of Optic Nerve Axons by Vertical Nanowire Arrays. ACS Applied Materials & Interfaces. 7 (34), 18944-18948 (2015).
- Campos, L. S. Neurospheres: Insights biology into neural stem cell biology. Journal of Neuroscience Research. 78 (6), 761-769 (2004).
- Ahmed, S. The Culture of Neural Stem Cells. Journal of Cellular Biochemistry. 106, 1-6 (2009).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Molecular Neurobiology. 34 (3), 153-161 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111, A3.B.1-A3.B.3 (2015).
- Pradhan, K., et al. Neuro-Regenerative Choline-Functionalized Injectable Graphene Oxide Hydrogel Repairs Focal Brain Injury. ACS Chemical Neuroscience. 10 (3), 1535-1543 (2019).
- Ray, B., Bailey, J. A., Sarkar, S., Lahiri, D. K. Molecular and immunocytochemical characterization of primary neuronal cultures from adult rat brain: Differential expression of neuronal and glial protein markers. Journal of Neuroscience Methods. 184 (2), 294-302 (2009).
- Robinson, A. P., Rodgers, J. M., Goings, G. E., Miller, S. D. Characterization of Oligodendroglial Populations in Mouse Demyelinating Disease Using Flow Cytometry: Clues for MS Pathogenesis. PLoS ONE. 9 (9), (2014).
- Osterberg, N., Roussa, E. Characterization of primary neurospheres generated from mouse ventral rostral hindbrain. Cell and Tissue Research. 336 (1), 11-20 (2009).
- Bernal, A., Arranz, L. Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cellular and Molecular Life Sciences. 75 (12), 2177-2195 (2018).
- Qu, Q. H., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5, 3449(2014).
- Bradke, F., Dotti, C. G. Differentiated neurons retain the capacity to generate axons from dendrites. Current Biology. 10 (22), 1467-1470 (2000).
- Theocharatos, S., et al. Regulation of Progenitor Cell Proliferation and Neuronal Differentiation in Enteric Nervous System Neurospheres. PLoS ONE. 8 (1), (2013).
- Binder, E., et al. Enteric Neurospheres Are Not Specific to Neural Crest Cultures: Implications for Neural Stem Cell Therapies. PLoS ONE. 10 (3), e0119467(2015).
- Cordey, M., Limacher, M., Kobel, S., Taylor, V., Lutolf, M. P. Enhancing the Reliability and Throughput of Neurosphere Culture on Hydrogel Microwell Arrays. Stem Cells. 26 (10), 2586-2594 (2008).
- Ladiwala, U., Basu, H., Mathur, D. Assembling Neurospheres: Dynamics of Neural Progenitor/Stem Cell Aggregation Probed Using an Optical Trap. PLoS ONE. 7 (6), (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved