Method Article
Generación de neuroesferas a partir de neuronas de hipocampo primario mixto y cortical esinas aisladas del e14-E16 Sprague Dawley Rat Embryo
En este artículo
Resumen
Aquí se presenta un protocolo para la generación espontánea de neuroesferas enriquecidas en células progenitoras neuronales a partir de neuronas chapadas de alta densidad. Durante el mismo experimento, cuando las neuronas se platean a una densidad más baja, el protocolo también resulta en cultivos prolongados de neuronas de rata primaria.
Resumen
El cultivo de neuronas primarias es una técnica esencial en el campo de la neurociencia. Para obtener una visión mecanicista más profunda en el cerebro, es esencial tener un modelo in vitro robusto que pueda ser explotado para varios estudios de neurobiología. Aunque los cultivos de neuronas primarias (es decir, cultivos hipocampales a largo plazo) han proporcionado a los científicos modelos, todavía no representa la complejidad de la red cerebral por completo. A raíz de estas limitaciones, un nuevo modelo ha surgido utilizando las neuroesferas, que tiene un parecido más cercano al tejido cerebral. El presente protocolo describe el revestimiento de altas y bajas densidades de neuronas corticales e hipocampales mixtas aisladas del embrión de ratas embrionarias del día 14-16 de Sprague Dawley. Esto permite la generación de neuroesferas y cultivo de neuronas primarias a largo plazo como dos plataformas independientes para llevar a cabo más estudios. Este proceso es extremadamente simple y rentable, ya que minimiza varios pasos y reactivos que anteriormente se consideraban esenciales para el cultivo de neuronas. Este es un protocolo robusto con requisitos mínimos que se pueden realizar con resultados alcanzables y más utilizado para una diversidad de estudios relacionados con la neurociencia.
Introducción
El cerebro es un circuito intrincado de células neuronales y no neuronales. Durante años, los científicos han estado tratando de obtener información sobre esta compleja maquinaria. Para ello, los neurocientíficos recurrieron inicialmente a varias líneas celulares transformadas basadas en los nervios para las investigaciones. Sin embargo, la incapacidad de estas líneas celulares clonales para formar fuertes conexiones sinápticasy axones o dendritas adecuadas han desplazado el interés científico a los cultivos de neuronas primarias 1,2. El aspecto más emocionante de la cultura de neuronas primarias es que crea una oportunidad para observar y manipular las neuronas vivas3. Además, es menos complejo en comparación con el tejido neural, lo que lo convierte en un candidato ideal para estudiar la función y el transporte de varias proteínas neuronales. Recientemente, varios desarrollos en los campos de la microscopía, la genómica y la proteómica han generado nuevas oportunidades para que los neurocientíficos exploten las culturas de las neuronas4.
Las culturas primarias han permitido a los neurocientíficos explorar los mecanismos moleculares detrás del desarrollo neuronal, analizar varias vías de señalización neuronal y desarrollar una comprensión más coherente de la sinapsis. Aunque una serie de métodos han reportado cultivos de neuronas primarias (principalmente del origen del hipocampo5,6,7), un protocolo unificado con un medio definido químicamente que permite el cultivo a largo plazo de las neuronas es todavía es necesario. Sin embargo, las neuronas plateadas a una baja densidad se observan con mayor frecuencia, que no sobreviven a largo plazo, probablemente debido a la falta de soporte trófico8 que es proporcionado por las neuronas adyacentes y células gliales. Algunos métodos incluso han sugerido la co-cultura de las neuronas primarias con célulasgliales, donde las células gliales se utilizan como una capa de alimentación 9. Sin embargo, las células gliales plantean muchos problemas debido a su crecimiento excesivo, que a veces anulan el crecimiento neuronal10. Por lo tanto, teniendo en cuenta los problemas anteriores, se requiere un protocolo de cultivo neural primario más simple y rentable, que puede ser utilizado por neurobiólogos y neuroquímicos para investigaciones.
Un cultivo de neurona primaria es esencialmente una forma de cultivo 2D y no representa la plasticidad, integridad espacial o heterogeneidad del cerebro. Esto ha dado lugar a la necesidad de un modelo 3D más creíble llamado neuroesferas11,12. Las neuroesferas presentan una plataforma novedosa para los neurocientíficos, con un parecido más cercano al cerebro real, in vivo13. Las neuroesferas son grupos 3D no adherentes de células que son ricas en células madre neurales (NSC), células progenitoras neuronales (NPC), neuronas y astrocitos. Son una excelente fuente para el aislamiento de células madre neurales y células progenitoras neuronales, que se pueden utilizar para estudiar la diferenciación en varios linajes neuronales y no neuronales. Una vez más, la variabilidad dentro de los cultivos de la neuroesfera producidos utilizando los protocolos reportados anteriormente presenta una barrera a la formulación de un protocolo unificado de cultivo de la neuroesfera14.
Este manuscrito presenta un protocolo en el que es posible generar plataformas 2D y 3D alternando densidades de chapado celular a partir de un cultivo cortical e hipocampal mixto. Se observa que en un plazo de 7 días, las neuroesferas flotantes se obtienen de neuronas chapadas de alta densidad aisladas del embrión de rata Sprague Dawley E14-E16, que tras un cultivo posterior, forman puentes e interconexiones a través de extensiones radiales de tipo glial. Del mismo modo, en las neuronas chapadas de baja densidad, se obtiene un cultivo de neuronas primarias que se pueden mantener hasta 30 días cambiando el medio de mantenimiento dos veces por semana.
Protocolo
Todos los procedimientos experimentales relacionados con el animal fueron aprobados por el Comité Institucional de etica animal del CSIR-Instituto Indio de Biología Química (IICB/AEC/Meeting/Apr/2018/1).
1. Preparación de reactivos y medios
- Solución de poli-d-lisina (PDL): preparar soluciones PDL a concentraciones de 0,1 mg/ml en agua desionizada y almacenar en 4oC hasta su uso.
- Medio de disociación: A 1 L de agua estéril desionizada filtrada, combinar los siguientes componentes en las concentraciones respectivas: cloruro de sodio (8 mg/ml), cloruro de potasio (0,4 mg/ml), fosfato potásico monobásico (0,06 mg/ml), D-glucosa (1 mg/ml), fosfato sódico dibásico (0,479 mg/ml), y 1 M HEPES [4-(2-hidroxietilo)-1-piperazineethanesulfonic acid; 10 mM]. Vortex todos los componentes para facilitar la mezcla adecuada y almacenar en 4 oC hasta su uso.
NOTA: Utilice el medio de disociación en forma helada durante la disociación pero a temperatura ambiente (RT) para el lavado y otros fines. - Medio de chapado: el medio de chapado consta de lo siguiente: medio esencial mínimo (MEM) Eagle's con solución de sal equilibrada de Earle (BSS; 88,4%), D-glucosa (0,6%), suero de caballo (10%) y penicilina/estreptomicina (1%). Combine los componentes en las relaciones respectivas y realice el procedimiento dentro de una campana en condiciones estériles.
NOTA: Utilice siempre un medio de chapado recién preparado para evitar la degradación de cualquier componente. - Medio de mantenimiento: preparar el medio de mantenimiento combinando lo siguiente en las proporciones respectivas: medio neurobasal (97%), 0,5 mM de muestra de glutamina obtenida comercialmente, suplemento libre de suero B27 (2%), y penicilina/estreptomicina (1%). Combine los componentes en las relaciones respectivas y realice el procedimiento dentro de una campana en condiciones estériles. Asegúrese de que todos los componentes estén recién preparados.
2. Preparación de los cubreobjetos
- Tome un cubreobjetos de vidrio redondo de 12 mm de diámetro y remoje en ácido clorhídrico de 1 M (HCl) durante 4 h.
- Transfiera los labios de las cubiertas en agua destilada usando un par de fórceps y gire suavemente para deshacerse del ácido por completo.
- Transfiera los cubreobjetos lavados para una ronda adicional de limpieza en un vaso de precipitados que contenga 100% etanol.
- Antes de usar los labios de las cubiertas, séquelos bien en la capucha laminar manteniéndolos en papel tisú.
3. Preparación de placas recubiertas de poli-D-lisina para el cultivo de neuronas
- Tome dos placas de 24 pozos: una para chapado de alta densidad y otra para chapado de baja densidad. Abra los paquetes estériles sólo dentro de la campana laminar.
- Transfiera los 12 mm de tapas de vidrio estérilen en las 24 placas de pozo.
- Vierta 300 l de solución PDL (0,1 mg/ml en agua desionizada) en cada pocil para que cubra completamente la superficie de los labios de las cubiertas.
- Envuelva las placas con papel de aluminio para evitar el secado y mantenerlas en la incubadora de CO2 durante la noche.
- Al día siguiente (antes del enchapado), aspirar la solución PDL y lavar correctamente con 300 ml de agua desionizada estéril de dos a tres veces.
- Añadir 200 s de medio de chapado recién preparado y devolver las placas a la incubadora hasta que estén enchapados.
4. Eliminación y decapitación del feto
NOTA: Esterilice todos los instrumentos quirúrgicos embalados en papel de aluminio en un autoclave a 121 oC (15 psi) durante 30 min. Esto incluye un par de tijeras de extremo romo, fórceps, fórceps finos, dos tijeras finas y una arteria fórceps para todo el procedimiento.
- Para generar neuronas y neuroesferas, utilice una rata Sprague Dawley embarazada y marque el día con la detección de tapones vaginales como E0.
NOTA: La referencia cultural debe realizarse entre E14-E16. - El día del cultivo, coloque una placa de vidrio estéril Petri en hielo y llénela con la solución de sal equilibrada de Hank (HBSS).
- Anestesiar una rata embarazada E14-E16 con una inyección intraperitoneal (i.p.) de 90 mg de ketamina/kg de peso corporal y 10 mg de xilazina/kg, luego sacrificar mediante la realización de la luxación cervical.
NOTA: Las ratas también pueden ser eutanasiadas por una sobredosis de pentobarbital o sobredosis de ketamina con xilazina o diazepam. - Esterilice el abdomen de la presa rociando 70% de etanol y haga un corte en forma de V en la zona abdominal usando fórceps estériles y un par de tijeras de extremo romo.
- Tome los sacos embrionarios cuidadosamente en la placa Petri con solución fría de HBSS.
NOTA: No utilice los mismos fórceps y tijeras que se acaban de utilizar para la piel, ya que esto contaminará los órganos internos. Utilice un conjunto diferente de tijeras/fórceps para los órganos internos. - Saque los embriones de los sacos embrionarios en HBSS fresco y frío.
- Decapita la cabeza con tijeras estériles.
5. Extirpación del cerebro y disección de la corteza con hipocampo
- Antes de empezar, llene los platos estériles de Petri de 90 mm con HBSS frío y estéril.
- Transfiera las cabezas en los platos estériles usando fórceps de apósito estériles y contundentes.
- Bajo el estereomicroscopio, sostenga la cabeza de la región del hocico con fórceps estériles y serrados y retire el cerebro cortando la piel y el cráneo abiertos.
- Recoger todos los cerebros embrionarios de la misma manera en la solución HBSS.
- Retire todas las meninges de los hemisferios y el cerebro medio sosteniendo el tronco encefálico.
- Retire cuidadosamente los hemisferios intactos que se asemejan a las tapas de setas que contienen el hipocampo y la corteza.
- Recoger los hemisferios que contienen corteza e hipocampo intacto en un tubo cónico de 15 ml que contiene 10 ml de medio de disociación.
6. Disociación del tejido cortical y del hipocampo en neuronas individuales
- Permitir que los tejidos recogidos se asienten y aspiren el medio de disociación, dejando un 5%-10% de medio en él.
- Añadir 10 ml de medio de disociación fresco al tejido, y repetir el paso 6.1 dos veces.
- Añadir 4,5 ml de medio de disociación y 0,5 ml de 0,25% (1x) solución de trippsina EDTA (tetraacetato de diamina de etileno).
- Mantener el tejido en la incubadora a 37oC durante 20 min para que la digestión proceda.
- Aspirar el medio y añadir 10 ml de disociación y enchapado de medio consecutivamente a los tejidos digeridos.
- Permita que los tejidos digeridos se asienten y aspiren el medio de disociación. Añadir 2,5 ml de medio de chapado y verter en la base de un plato estéril de 90 mm.
- Tritura los tejidos digeridos en la base de la esquina del plato usando una punta de pipeta de 1.000 ml para ocupar el volumen mínimo.
- Pasar la suspensión celular obtenida a través del colador celular de 70 m, excluyendo cualquier trozo de tejido.
- Determine la densidad de las células viables utilizando el método de exclusión de tinte azul trypan y cuente el número de células en un contador de células automatizado.
- Para el método de exclusión de tinte azul trypan, tomar 10 s de la suspensión celular y 10 l de tinción azul trypan 0,4%, mezclar bien y añadir 10 l de la mezcla en una de las dos cámaras cerradas de los portaobjetos de la cámara desechable.
- Inserte la diapositiva que contiene la mezcla en el contador de celdas y obtenga la lectura.
NOTA: El método de exclusión de tinte azul trypan se basa en el principio de que las células vivas (debido a sus membranas intactas) excluirán el tinte azul trypan y por lo tanto mostrarán un citoplasma claro, en comparación con una célula no viable que fácilmente tomará trypan azul y aparecerá azul en color15.
- Diluir el número de células obtenidas en la placa 1,5 x 105 celdas/ml para alta densidad y 20.000 celdas/ml para baja densidad en dos tubos separados que contienen 30 ml cada uno del medio de chapado.
- Aspirar el medio de chapado previamente añadido de cada pocal y la placa 500 l de células dispersas en medio de chapado en cada pocal.
- Después de eso, vuelva naícargo las placas a la incubadora a 37oC y 5% CO2 durante 4 h.
- Examine las células para la adherencia bajo el microscopio 4 h después del enchapado.
- Si hay una adherencia adecuada de las células en ambas placas, sustituya el medio en cada pocal por un medio de mantenimiento fresco de 500 ml e incubar a 37 oC.
- Cultivo de estas neuronas cultivadas a baja densidad durante 30 días mediante el cambio del medio de mantenimiento 2x por semana.
- Cultivo de las neuroesferas obtenidas de las neuronas chapadas de alta densidad en el mismo medio de mantenimiento transfiriéndolas a las placas de unión ultrabajas.
- Caracterizar las neuronas y las neuroesferas inmunostaindándolas con marcadores importantes. Para la inmunocitoquímica, primero fije las células/neuroesferas usando un 4% de formaldehído durante 30 minutos en la propia placa, luego permeabilizar las células con 0.1% detergente no iónico durante 10 min.
- Añadir anticuerpos primarios tanto para neuronas (anti-Tuj1, GFAP, O4, tau) como para neuroesferas (anti-Nestin, GFAP, Tuj1) en solución salina con fosfato (PBS) a concentraciones de 1:300 e incubar durante la noche a 4oC16.
NOTA: El Tuj1 (clase III) y el tau son marcadores positivos para las neuronas primarias, mientras que gfAP (proteína ácida fibrilar glial) y O4 (marcador de oligodendrocitos) son marcadores negativos para las neuronas primarias17,18. En el caso de las neuroesferas, Tuj1, GFAP y Nestin sirven como marcadores positivos19,20. - Al día siguiente, lave las células con PBS una o dos veces y agregue los anticuerpos secundarios apropiados en PBS a concentraciones de 1:600 a RT durante 2 horas.
NOTA: Los anticuerpos secundarios anti-ratón o anti-Conejo se seleccionan dependiendo de las especies anfitrionas del anticuerpo primario añadido. Debe tenerse en cuenta que los anticuerpos secundarios deben conjugarse con derivados de fluorescencia adecuados para fines de microscopía de fluorescencia. - Lave las células de nuevo con PBS una o dos veces.
- Realizar la tinción nuclear de las células con Hoechst 33258 (solución de stock de 1 mg/ml en agua desionizada). Prepare 0.1% solución Hoechst en PBS de la solución de stock y agréguela a las células.
- Incubar las células con 0.1% de solución Hoechst durante 30 min, luego lavar de nuevo con PBS.
- Agregue 20 oPbS de 20 ml (o medio de montaje) en la corredera y monte lentamente el cubreobjetos que contiene las celdas manchadas sobre el área de la diapositiva que contiene PBS. Sellar los márgenes de la cubierta con xibutlphthalate poliestireno xileno (DPX).
- Realizar imágenes de las células fijas bajo un microscopio con aumento de 10x y 40x.
Resultados
En este protocolo, se ha aclarado una estrategia simple en la que se obtienen densidades de chapado de células variables de dos plataformas de cribado neuronal diferentes. Figura 1A,B ilustra la adherencia de las células después de 4 h de chapado de las neuronas en células chapadas de alta y baja densidad, respectivamente. Al observar la correcta adherencia de las neuronas como se muestra en la Figura 1, el medio de chapado fue reemplazado por un medio de mantenimiento en cada uno de los pozos y, por lo tanto, devuelto a la incubadora a 37 oC. Comparativamente se observó más adherencia celular en las neuronas chapadas de alta densidad. Después de 24 h de chapado, las neuronas chapadas de alta y baja densidad mostraron elaboradas extensiones neuronales e interconexiones sinápticas, como se observa en las imágenes de contraste de interferencia diferencial (DIC) en la Figura 2A,B.
En la Figura 3A,se representa una imagen de contraste de fase de las neuronas chapadas de baja densidad después de 7 días en cultivo. Aquí, las neuronas han desarrollado una elaborada red sináptica que consiste en ramas dendríticas. Estas neuronas se pueden mantener durante un máximo de 30 días cambiando el medio de mantenimiento cada 3 días con el desarrollo de redes neuronales más intrincadas. En la Figura 3B,C, se realizó la tinción inmunocitoquímica para revelar la naturaleza neuronal de las neuronas de cultivo de baja densidad mediante la tinción con marcadores neuronales Tuj1 (un marcador de neuronas diferenciadas)21 y Tau (un marcador de axónicos)22 , respectivamente. El color rojo en la Figura 3B indica la presencia de tinción Tuj1, y verde en la Figura 3C representa la tinción en los axones de las neuronas primarias. La pureza del cultivo neuronal se demuestra por la ausencia de tinción de marcadores no neuronales para GFAP de astrocitos (Figura 3D) y O4 de oligodendrocitos (Figura3E). Los núcleos mostrados en azul estaban manchados con Hoechst 33258.
Las neuronas chapadas de alta densidad después de 7 días están marcadas por la formación de neuroesferas espontáneas, como se observa en la Figura 4A,B,C,D. Después de 8-10 días, se observaron puentes distintos que consisten en extensiones de glial radial es entre las neuroesferas, como se ve en la Figura 4E. Las neuroesferas estaban ricamente dotadas de PNJ, que coexpresan los marcadores Nestin y Tuj123. Los neuroesféreos muestran una tinción positiva de Nestin y Tuj, como se muestra en la Figura 524. Los núcleos mostrados en azul estaban manchados con Hoechst 33258. Estas neuroesferas se pueden mantener durante varias semanas culturinglas en placas de unión ultrabajas. En la Figura 6, se evaluó la longevidad de las neuronas cultivadas durante unos 30 días, y se midió la viabilidad celular en un intervalo de 5 días utilizando el ensayo convencional de MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-difeniturolium bromuro], en el que se encontraba encontró que las neuronas mostraron más del 90% de viabilidad incluso después de 30 días de cultivo.
A continuación, se evaluó el porcentaje de astrocitos en los cultivos de sembrados de alta y baja densidad. Dado que esta metodología está dirigida principalmente al cultivo de neuronas, era importante evaluar si este método apoya el crecimiento preferencial de las neuronas sobre las células no neuronales, especialmente los astrocitos. La presencia de una población de astrocitos se observó en el cultivo de cabezas de serie de alta densidad que forma la neuroesfera, marcado por el color verde de la tinción GFAP en la Figura 7A; sin embargo, se observó significativamente menos en comparación con la población neuronal teñida de Tuj1 (rojo). Esto también fue reafirmado por los datos cuantitativos de la Figura 7B,en los que las poblaciones de células del 17% eran de expresión gfAP, en comparación con el 83% de la población de las células que expresan Tuj1.
La población astrocítica también se investigó a través de la tinción GFAP, en comparación con la población neuronal (tinción Tuj1) en células sembradas de baja densidad, durante 7 días continuos. Aunque no se observó una diferencia significativa en el número total de células durante el transcurso de 7 días, debido a la baja sembración, la población de astrocitos también se observó que era muy baja (casi nula o muy baja tinción GFAP), siendo la mayoría la población neuronal (muy alta expresión Tuj1) como se observa en la Figura 8A.
Como se muestra en la Figura 8B,el análisis cuantitativo se realizó contando la población de astrocitos y neuronas obtenidas a través de la microscopía con la ayuda del software cellSens, en el que se observó inicialmente sólo el 2%-3% de la población de astrocitos. Debido a la falta de medios y nutrientes adecuados para apoyar su crecimiento, esta población de astrocitos también pereció lentamente con el tiempo, mientras que en presencia de factores y medios óptimos, las neuronas rápidamente se apoderaron de todo el cultivo.
Como se muestra en la Figura9, se observó que debido a la presencia de PNJ, las neuroesferas también expresaron altas cantidades de astrocitos, marcados por la fuerte señal verde de la tinción GFAP junto con una señal Tuj1 más fuerte. Finalmente, para observar si estas neuroesferas se expandieron con el tiempo, después de 1 semana de cultivo de alta densidad, momento en el que las pequeñas neuroesferas comenzaron a formarse, algunas fueron transferidas en placas de fijación ultrabajas y su crecimiento fue monitoreado cada 5 días hasta 15 días.
También se realizó un ensayo de células vivas/muertas utilizando calceína AM (verde) y yoduro propidium (rojo) para comprobar la salud de las células. Se observó que las neuroesferas en expansión mostraban una gran cantidad de fluorescencia verde sin manchas rojas, lo que indica que no se producía ninguna muerte en las neuroesferas durante al menos 15 días en cultivo, como se presenta en la Figura 10A. Como se muestra en la Figura 10B,se observó una expansión voluminosa de las neuroesferas cada 5 días en cultivo durante un máximo de 15 días. Para trazar el gráfico de líneas que representa el eventual aumento en el volumen de las neuroesferas (para cada punto de tiempo), se estudiaron 50 neuroesferas, y sus promedios se utilizaron para derivar los volúmenes de la neuroesfera en cada punto de tiempo.

Figura 1 : Representación de la adherencia celular después de 4 h de chapado. (A) Adherencia celular en neuronas chapadas de alta densidad. (B) Adherencia celular en neuronas chapadas de baja densidad. La barra de escala en (A,B) es de 200 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Morfología celular de las neuronas después de 24 h de chapado. (A) Morfología celular de las neuronas chapadas de alta densidad. (B) Morfología celular de neuronas chapadas de baja densidad. Las barras de escala en (A, B) representan 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
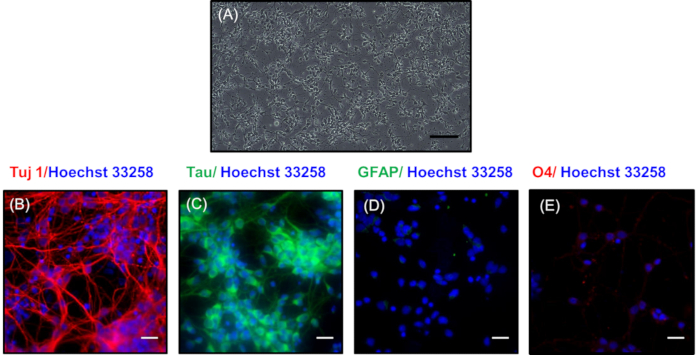
Figura 3 : Morfología y caracterización de neuronas chapadas de baja densidad después de 7 días. (A) Imagen de contraste de fase de las neuronas que muestran una amplia brotación. La barra de escala representa imágenes superpuestas de 200 m. que muestran expresión de proteínas neuronales (B) Tuj1 (rojo) y (C) tau (verde). La inmunización que muestra claramente la ausencia de tinción en proteínas no neuronales (D) GFAP (verde) y (E) O4 (rojo). Los núcleos se mancharon con Hoechst 33258 (azul). Las barras de escala en (B, C, D, E) representan 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Formación de neuroesferas en neuronas chapadas de alta densidad después de 7 días. (A-D) Neuroesferas generadas espontáneamente después de 7 días en el cultivo de las neuronas chapadas de alta densidad. (E) Formación de extensiones radiales de glial-como entre dos neuroesferas recién formadas como se indica por las flechas negras. Las barras de escala en (A, B, C, D, E) representan 200 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
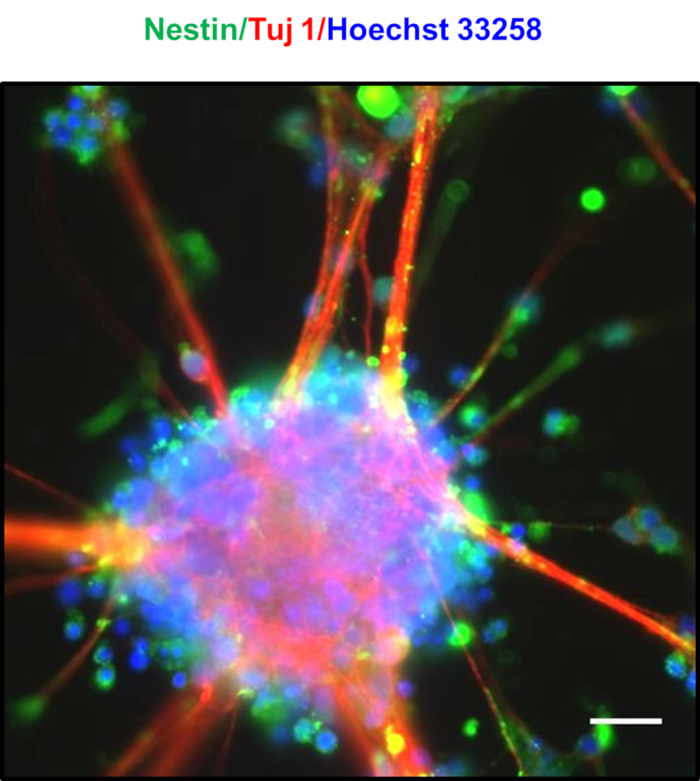
Figura 5 : Caracterización de las neuroesferas obtenidas. Imagen superpuesta de las neuroesferas que muestra expresión de la proteína neuronal Tuj1 (rojo) y marcador de células madre neuronales Nestin (verde), lo que indica una población rica en PNJ. Los núcleos se mancharon con Hoechst 33258(azul). La barra de escala representa 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 6 : Viabilidad celular de las neuronas primarias. El gráfico de barras representa la viabilidad celular de las neuronas primarias, evaluada mediante un ensayo MTT de hasta 30 días a intervalos de 5 días. La barra de errores representa SD del valor (*p < 0.05). Haga clic aquí para ver una versión más grande de esta figura.

Figura 7 : Caracterización de cultivos de alta densidad formadores de la neurosfera con marcador neuronal Tuj1 y marcador de astrocitoGF. (A) La imagen muestra células sembradas de alta densidad (en modo DIC), que genera neuropsilores que expresan GFAP (para astrocitos) y Tuj1 (para neuronas). Los núcleos se mancharon con Hoechst 33258. La barra de escala representa 20 m. (B) El gráfico de barras representa el porcentaje de la población de células que expresan Tuj1 y células que expresan GFAP en la neuroesfera generando células de alta densidad. La barra de errores representa SD (*p < 0.05). Haga clic aquí para ver una versión más grande de esta figura.

Figura 8 : Caracterización de células chapadas de baja densidad para el cultivo de neuronas primarias con marcador neuronal Tuj1 y marcador de astrocito GFAP continuamente hasta 7 días. (A) La imagen muestra las células sembradas de baja densidad en cuatro canales diferentes (es decir, DIC, canal azul [indica la tinción nuclear por Hoechst 33258], el canal verde [gfAP tinción] y el canal rojo [para la tinción Tuj1]) durante 7 días continuamente. La barra de escala representa 20 m. (B) El gráfico de barras representa la proporción porcentual de poblaciones de células que expresan Tuj1 con la de las células que expresan GFAP en las células sembradas de baja densidad para el cultivo de neuronas primarias durante 7 días. La barra de errores representa SD (*p < 0.05). Haga clic aquí para ver una versión más grande de esta figura.

Figura 9 : Inmunomanchación de las neuroesferas obtenidas con GFAP y Tuj1. Las imágenes de las neuroesferas obtenidas son (A) en modo DIC, (B) tinción del núcleo utilizando Hoechst 33258, (C) marcador de astrocito GFAP (verde), y (D) marcador neuronal Tuj1 (rojo). La barra de escala representa 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 10 : Crecimiento y ensayo de células vivas/muertas de las neuroesferas durante 15 días. (A) La imagen muestra el crecimiento de una neurosfera durante 15 días a intervalos de 5 días en modo DIC, así como su tinción con calcina AM (verde indica células vivas) y PI (yoduro propidio con un color rojo indica células muertas). La barra de escala representa 20 m. (B) Gráfico representa el aumento en el tamaño de las neuroesferas cultivadas en placas de baja adherencia durante un período de 15 días a intervalos de 5 días. La barra de errores representa SD. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe que cómo al alterar las densidades de revestimiento celular de las neuronas primarias, se obtienen dos plataformas neuronales variables. Aunque se trata de un método sencillo, cada paso debe realizarse meticulosamente para lograr los resultados deseados. Otros métodos anteriores han reportado cultivos de neuronas primarias a largo plazo o cultivos de neuroesfera. La mayoría de los protocolos de cultivo de neuronas primarias han implicado el cultivo de neuronas hipocampales durante 3-5 semanas, pero la mayoría han fallado, ya que las neuronas mueren y se marchitan debido a la pérdida de conexiones. Otra ventaja del protocolo es que las neuronas se pueden cultivar sin necesidad de ninguna capa de alimentación glial, por lo tanto mantener la pureza de las neuronas.
Sin embargo, se deben seguir cuidadosamente varios pasos críticos para obtener los resultados deseados. En primer lugar, mantener condiciones estériles en todo es absolutamente necesario. Se recomienda realizar la mayoría de los pasos en una capucha laminar, así como prelimpiar todas las losas, instrumentos y herramientas quirúrgicas con 70% de alcohol antes de comenzar; de lo contrario, hay una mayor probabilidad de fracaso debido a la contaminación por bacterias y hongos. A continuación, es importante aislar los embriones E14-16; por lo tanto, el paso de detección del tapón vaginal debe realizarse cuidadosamente. A medida que aumenta el día embrionario, mayores son las posibilidades de contaminación por células no neuronales. La eliminación completa de meninges de los hemisferios es extremadamente crítica para reducir la interferencia en el cultivo por células no neuronales. Tanto el soporte de chapado como el de mantenimiento deben estar recién preparados con todos los componentes, ya que cada componente desempeña un papel esencial. Otro factor que debe tenerse en cuenta es que las neuronas primarias obtenidas deben mantenerse cambiando el medio de mantenimiento 2 veces por semana para que el suministro de nutrientes a las neuronas que proliferan se mantenga constante.
Aunque todavía no se ha intentado, este protocolo con ligeras modificaciones también puede ser útil en las neuronas embrionarias de ratón. Si las neuronas o neuroesferas deseadas no se obtienen siguiendo esta técnica, hay algunos consejos de solución de problemas que pueden ser útiles. Para mantener los tejidos viables, la disección debe realizarse en HBSS helada. La disección también se puede realizar en el búfer Krebs helado en lugar del búfer HBSS. Realizar rápidamente la disección es clave para mantener la viabilidad del tejido. El uso de 10x trippsina conducirá a la sobredigestión del tejido. Por lo tanto, 10x solución de trippsina-EDTA debe diluirse a 1x en tampón de disociación antes de la digestión. La adición de medio helado a las células, induciendo congelación-choque, debe evitarse a toda costa, y medio después de alcanzar RT debe utilizarse en su lugar. Lo más importante, los labios de las cubiertas siempre deben estar recubiertos con PDL, de lo contrario las neuronas no se unirán a los labios de cubierta. En caso de cualquier dificultad durante la realización del paso de trituración (es decir, tejido que no digiere correctamente), la digestión se puede realizar añadiendo 0,5 ml de 1% de DNase durante 10 minutos. Si se encuentran altos grados de contaminación por células no neuronales, se debe añadir un arabinósido de citosina de 5 m (araC) para prevenir el crecimiento de células no neuronales.
A pesar de sus múltiples ventajas, esta técnica sufre de algunas limitaciones. Se sabe que esta técnica genera espontáneamente neuroesferas (aunque no se conocen los mecanismos moleculares desencadenantes); sin embargo, quedan pocas ambiguedades con respecto a esta técnica, como el tamaño exacto de las neuroesferas formadas y el número exacto de días necesarios para formar un número suficiente de neuroesferas. Sobre todo, el tamaño es el problema. A pesar de que se ha observado que las neuroesferas se expanden en volumen con el tiempo, las neuroesferas iniciales obtenidas son de tamañovariable. Aunque es útil, hace que sea difícil realizar un estudio sincronizado. Lo que distingue este protocolo de generación de la neuroesfera de los demás es su robustez y simplicidad. Hay protocolos notificados anteriormente para el cultivo y la propagación de neuroféreas que requieren requisitos medios especiales y condiciones de cultivo, ninguno de los cuales es necesario en este protocolo. En estos protocolos reportados anteriormente, apenas hay uniformidad para aquellos que buscan generar neuroesferas.
En general, este protocolo describe una estrategia única para la generación de plataformas neuronales 2D y 3D simplemente alterando las densidades de revestimiento celular de las neuronas primarias aisladas de embriones de ratas E14-E16 Sprague Dawley. Este método es rentable en comparación con otros métodos, ya que se puede realizar con una configuración simple y requiere mucho menos reactivos y pasos. Puede proporcionar varias aplicaciones de interés para los neurocientíficos. Esto se puede utilizar como plataformas de cribado para varios cables neuroterapéuticos, observando los roles de varias proteínas de carga neuronal, investigaciones de vías celulares en muchas enfermedades neurodegenerativas, y muchas otras aplicaciones. Las neuroesferas se pueden utilizar para el cribado de varios agentes diferenciadores neuronales y el estudio de las primeras etapas del desarrollo neuronal in vitro25,26.
Divulgaciones
Los autores no declaran intereses financieros en competencia.
Agradecimientos
Agradecemos a las instalaciones para animales del CSIR-IICB. G. D. agradece a ICMR, J. K. y V. G. agradecen a DST Inspire, y a D. M. gracias dbT, India por sus becas. S. G. reconoce amablemente a SERB (EMR/2015/002230) India por proporcionar apoyo financiero.
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-GFAP | Abcam | AB7260 | |
| Anti- Nestin | Abcam | AB92391 | |
| Anti-O4 | Millipore | MAB345 | |
| Anti-Tau | Abcam | AB76128 | |
| Anti-Tuj1 | Millipore | MAB1637 | |
| B27 Serum Free Supplement | Gibco | 17504-044 | |
| Cell Counter | Life technologies | Countess II FL | |
| CO2 Incubator | Eppendorf | Galaxy 170 R | |
| D-glucose | SDFCL | 38450-K05 | |
| Ethanol | Merck Millipore | 100983 | |
| Fluorescence Microscope | Olympus | IX83 Model | |
| Formaldehyde | Sigma Aldrich | 47608 | |
| GlutaMax-I Supplement | Gibco | 35050-061 | |
| GtXMs IgG Fluor | Millipore | AP1814 | |
| GtXMs IgG (H+L) | Millipore | AP124C | |
| HEPES | SRL | 16826 | |
| Hoechst 33258 | Calbiochem | 382061 | |
| Horse Serum | HiMedia | RM10674 | |
| Hydrochloric Acid | Rankem | H0100 | |
| Laminar Hood | BioBase | BBS-V1800 | |
| MEM Eagle’s with Earle’s BSS | Sigma Aldrich | M-2279 | |
| Microscope | Dewinter | Victory Model | |
| Neurobasal Medium | Gibco | 21103-049 | |
| Plasticware (24 well plate, cell strainers, and low adherence plates) | BD Falcon | 353047, 352350 and 3471 | |
| 90 mm Petridishes | Himedia | PW001 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Poly-D-Lysine | Millipore | A.003.E | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Potassium Phosphate Monobasic | Merck | MI6M562401 | |
| Sodium Chloride | Qualigem | 15918 | |
| Sodium Phosphate Dibasic | Merck | MI6M562328 | |
| Stereomicrosope | Dewinter | Zoomstar Model | |
| Triton-X 100 | SRL | 2020130 | |
| Trypan Blue Solution | Gibco | 15250-061 | |
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 |
Referencias
- Lorsch, J. R., Collins, F. S., Lippincott-Schwartz, J. Fixing problems with cell lines. Science. 346 (6216), 1452-1453 (2014).
- Masters, J. R. W. Cell line misidentification: the beginning of the end. Nature Reviews Cancer. 10 (6), 441-448 (2010).
- Banker, G. Culturing Nerve Cells, 2nd edition. , 339-370 (1998).
- Geschwind, D. H., Konopka, G. Neuroscience in the era of functional genomics and systems biology. Nature. 461 (7266), 908-915 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1, 2406-2415 (2006).
- Lu, Z. M., Piechowicz, M., Qiu, S. F. A Simplified Method for Ultra-Low Density, Long-Term Primary Hippocampal Neuron Culture. Journal of Visual Experiments. 109, e53797(2016).
- Kaneko, A., Sankai, Y. Long-Term Culture of Rat Hippocampal Neurons at Low Density in Serum-Free Medium: Combination of the Sandwich Culture Technique with the Three-Dimensional Nanofibrous Hydrogel PuraMatrix. PLoS ONE. 9 (7), e102703(2014).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209 (4458), 809-810 (1980).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. Journal of Neuroscience. 8 (4), 1454-1468 (1988).
- Piret, G., Perez, M. T., Prinz, C. N. Support of Neuronal Growth Over Glial Growth and Guidance of Optic Nerve Axons by Vertical Nanowire Arrays. ACS Applied Materials & Interfaces. 7 (34), 18944-18948 (2015).
- Campos, L. S. Neurospheres: Insights biology into neural stem cell biology. Journal of Neuroscience Research. 78 (6), 761-769 (2004).
- Ahmed, S. The Culture of Neural Stem Cells. Journal of Cellular Biochemistry. 106, 1-6 (2009).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Molecular Neurobiology. 34 (3), 153-161 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111, A3.B.1-A3.B.3 (2015).
- Pradhan, K., et al. Neuro-Regenerative Choline-Functionalized Injectable Graphene Oxide Hydrogel Repairs Focal Brain Injury. ACS Chemical Neuroscience. 10 (3), 1535-1543 (2019).
- Ray, B., Bailey, J. A., Sarkar, S., Lahiri, D. K. Molecular and immunocytochemical characterization of primary neuronal cultures from adult rat brain: Differential expression of neuronal and glial protein markers. Journal of Neuroscience Methods. 184 (2), 294-302 (2009).
- Robinson, A. P., Rodgers, J. M., Goings, G. E., Miller, S. D. Characterization of Oligodendroglial Populations in Mouse Demyelinating Disease Using Flow Cytometry: Clues for MS Pathogenesis. PLoS ONE. 9 (9), (2014).
- Osterberg, N., Roussa, E. Characterization of primary neurospheres generated from mouse ventral rostral hindbrain. Cell and Tissue Research. 336 (1), 11-20 (2009).
- Bernal, A., Arranz, L. Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cellular and Molecular Life Sciences. 75 (12), 2177-2195 (2018).
- Qu, Q. H., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5, 3449(2014).
- Bradke, F., Dotti, C. G. Differentiated neurons retain the capacity to generate axons from dendrites. Current Biology. 10 (22), 1467-1470 (2000).
- Theocharatos, S., et al. Regulation of Progenitor Cell Proliferation and Neuronal Differentiation in Enteric Nervous System Neurospheres. PLoS ONE. 8 (1), (2013).
- Binder, E., et al. Enteric Neurospheres Are Not Specific to Neural Crest Cultures: Implications for Neural Stem Cell Therapies. PLoS ONE. 10 (3), e0119467(2015).
- Cordey, M., Limacher, M., Kobel, S., Taylor, V., Lutolf, M. P. Enhancing the Reliability and Throughput of Neurosphere Culture on Hydrogel Microwell Arrays. Stem Cells. 26 (10), 2586-2594 (2008).
- Ladiwala, U., Basu, H., Mathur, D. Assembling Neurospheres: Dynamics of Neural Progenitor/Stem Cell Aggregation Probed Using an Optical Trap. PLoS ONE. 7 (6), (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados