Method Article
Bütün-Confocal mikroskobu yetişkin kulak cilt için mount: nöro-vasküler dallanma morfogenez ve bağışıklık hücre dağıtım modeli sistemi
Bu Makalede
Özet
Burada, dallanma morfogenez ve periferik sinirler ve kan damarları yanı sıra bağışıklık hücre dağıtım desenlendirme görselleştirmek sağlayan tüm yetişkin fare kulak deride bir yüksek çözünürlüklü bütün Dağı görüntüleme yöntemi açıklanmaktadır.
Özet
Burada, kapsamlı üç boyutlu nöro-vasküler dallanma morfogenez ve desenlendirme yanı sıra bağışıklık hücre dağıtım hücresel düzeyde eğitim için teknik görüntüleme bir bütün-mount yetişkin kulak deri bir iletişim kuralı mevcut. Periferik sinir ve damar anatomik yapıları yetişkin dokularda analizini bazı anlayışlar fonksiyonel nöro-vasküler kablolama ve patolojik durumlarda yara iyileşmesi gibi nöro-vasküler dejenerasyon anlayışı sunuyor. Son derece bilgilendirici modeli sistemi çalışmalarımız diseksiyon için kolay erişilebilir yetişkin kulak cilt üzerinde odaklanmıştır. Bizim basit ve tekrarlanabilir Protokolü (duyusal aksonlar, sempatik akson ve Schwann hücreleri) periferik sinirler, kan damarları (endotel hücreleri ve vasküler düz kas hücreleri gibi tüm cilt hücresel bileşenlerindeki doğru bir tasviri sağlar ) ve inflamatuar hücre. Bizce bu protokolü periferik sinirler ve kan damarları morfolojik anormallikleri yanı sıra farklı patolojik şartlar altında yetişkin kulak deride enflamasyon araştırmak için önünü açacak.
Giriş
Cilt üç katmandan oluşur: epidermis, dermis ve hypodermis. Bu kök hücre bakım, farklılaşma ve morfogenetik geliştirme gibi yeniden oluşturma işlemi, tumorigenesis ve inflamasyon yetişkin eğitim için bir model sistem olarak kullanılmıştır. Cilt zengin skarların ve periferik sinir sistemi ve damar sistemi gelişimi iyi koordine öyle ki innervated.
Biz daha önce olduğu gibi periferik sinirler ve kan damarları onların hücresel bileşenleri1,2,3, de dahil olmak üzere eğitim için birden çok etiket yapma ile bir bütün-mount embriyonik cilt görüntüleme tekniği göstermiştir 4: duyusal aksonlar, sempatik aksonlar, Schwann sinir hücrelerinde, endotel hücreleri, perisitlerden ve kan damarlarının damar düz kas hücrelerinde (VSMCs). Angiogenez sırasında birincil kapiller ağ yoğun vasküler remodeling uğrar ve hiyerarşik bir vasküler dallanma ağına geliştirir. Gelişmekte olan DermIS/hypodermis, arterler çevresel duyusal sinirler ve damarlar ile birlikte şube ardından arterler için bitişik form. Hiyerarşik damar ağı iyice VSMCs ile kapalı sonra sempatik sinirler boyunca genişletmek ve geniş çaplı kan damarları1,5,6innervate. Gelişmekte olan sinir ve damar sistemleri arasındaki yakın ilişki içinde önemini rağmen yetişkin çeşitli patolojik durumlarda nöro-vasküler ağlarda ne yönelik olarak önemli bir soru oldu. Üç boyutlu bir yüksek çözünürlüklü görüntü Patogenez, anatomik olarak tanınabilir dallanma morfogenez ve desenlendirme ile birlikte takdir etmek gereklidir.
Nöronal ve vasküler morfogenez yetişkin fare deride yaygın doku bölümü boyama tarafından analiz edilir. Diğer çalışmalar bütün Dağı görüntüleme deri periferik sinirler ve kan damarları, ek olarak saç folikülleri, yağ bezleri ve arrector pili kas7,8,9görselleştirmek için kullandık. Ancak, Yetişkin cilt kalınlığı deri tüm derinliği üzerinde analiz etmek zor yaptı.
Bu da çalışmanın, biz bu zorlukları aşmak için yetişkin kulak deri bir roman yüksek çözünürlüklü bütün Dağı görüntüleme geliştirdik. Kulak cilt üzerinde tüm derinliği diseksiyon ve sonraki bütün Dağı görüntüleme cilt için kolayca erişilebilir. Böylece, bu üç boyutlu mimari cilt kapsamlı miktar ölçümleri ile periferik sinir ve damar sistemlerinin karşılaştırmak için uygulanan bir basit ve son derece tekrarlanabilir yolu. Büyük çaplı kan damarları ile çevresel duyusal ve sempatik sinirler hizalamasını yetişkin cilt korunur gösterdi. Bu protokol dallanma morfogenez ve periferik sinirler ve kan damarları, aynı zamanda iltihabı gibi değişik koşullarda yetişkin fare modellerinde hücresel düzeyde bağışıklık hücre dağıtım desenlendirme görselleştirmek için hedeftir ve rejenerasyon.
Protokol
Bu bölümdeki tüm deneylerin Ulusal kalp, akciğer ve kan Enstitüsü (NHLBI) hayvan bakım ve kullanım Komitesi onayını altında yapıldı.
1. yetişkin Fare kulağı deri koleksiyonu
- Kapalı bir oda içinde karbondioksit (CO2) maruz yetişkin fareler ötenazi ve ötenazi tarafından servikal çıkığı onaylayın.
Not: Deneme ötenazi yöntemi için Ulusal Enstitüsü Sağlık (NIH) kılavuz takip eder. - Kulak tabanından incelemek ve bir 35 x 10 mm2 ' de 2 mL, Hank'in dengeli tuz çözüm (HBSS) içeren Petri kabına yerleştirin. Kısa bir süre kıllar makasla kesme.
- Soyma posterior cilt ve anterior deriden uzak dikkatli bir şekilde müdahalede bulunan kıkırdak.
Not: Kıkırdak ön cilde ekler. - Aktarım arka ve ön cilde ayrı ayrı bir 24 iyi plakası buz gibi taze % 4 (PFA) fosfat tamponlu tuz iyi (PBS) içinde paraformaldehyde içeren 1 mL. %4 arka ve ön deride dümdüz PFA.
- Arka ve ön Cilt 1 h için 4 ° C'de kıkırdak ile düzeltmek.
- Arka ve ön Cilt 3 kere 5 min için PBS bir karıştırıcı oda sıcaklığında hafif karıştırma ile 1 mL yıkayın.
- Arka ve ön cilt kıkırdak ile bir 35 x 10 mm2 Petri kabına altına aktarın. Katlandığında ve yağ ve bağ dokusu olduğu temel bölge, kes. Ön deri ince kavisli forseps kullanarak kıkırdak akasındaki.
- Dikkatli bir şekilde kıllar, yağ doku ve bağ dokusu iyi eğri cımbız kullanarak arka deri içinden çıkarın. PBS ile ıslak cilt tutmak.
2. bütün Dağı immunohistokimyasal Fare kulağı deri boyama
Not: Aşağıdaki bölümlerde tüm deneylerin NIH laboratuvar güvenlik kurallarına uygun olarak gerçekleştirilmiştir.
- Engelleme arabellek hazırlayın. Filtre % 10 ısı inaktive keçi serum (HIGS) PBS içinde % 0,2 triton ile X-100 (TX-100) engelleme arabellek seyreltilmiş veya % 10 eşek serum (DS) PBS içinde % 0,2 ile 0,45 µm filtre birimini kullanarak TX-100 engelleme arabellek seyreltilmiş.
- Arka aktarmak ve ön bir 24 cilde de içeren 1 mL % 10 HIGS engelleme arabellek veya iyi başına % 10 DS engelleme arabellek plakası. Cilt üzerinde bir karıştırıcı oda sıcaklığında hafif karıştırma ile 30 dk için kuluçkaya.
- Birincil antikor çözüm engelleme arabellekte (Malzemeler tablo) birincil antikorlar sulandrarak hazırlamak (ya da %10 HIGS veya % 10 DS).
Not: Bütün mout immunohistokimyasal analizi (Tuj1, tavşan poliklonal IgG veya fare monocloncal Igg2a, 2 µg/mL son konsantrasyonu, 1:500 seyreltme), pan-nöronal marker nöron özgü sınıf III β-tübülin antikorlar ile yetişkin kulak deri Pan-endotel hücre işaretçisi trombosit endotel hücre adezyon molekül 1 (PECAM-1, hamster monoklonal IgG, 3.3 µg/mL son konsantrasyonu, 1:300 seyreltme), miyelin kılıf marker miyelin temel protein (MBP, tavşan poliklonal IgG, 1: 200 seyreltme, son konsantrasyonu 5 µg/mL) ve inflamatuar myeloid hücre işaretçisi CD11b (fare monoklonal Igg2b, 1:50 20 µg/mL son konsantrasyonu, seyreltme) şekil 1 ve Şekil 2' gösterildi. Deriyi Cy3 Birleşik antikor vasküler düz kas hücre işaretçisi α düz kas aktin (αSMA) ile birlikte ikincil antikorlar (2,6) ile inkübe. Kendimiz test birincil antikorlar Malzemeler tabloiçinde listelenen. Birden çok birincil antikorlar farklı türlerden elde edilen aynı anda karışabilir. - Arka ve ön cilt 150 µL birincil antikorlar çözüm içeren yeni iyi transfer. Nazik bir karıştırıcı 4 ° c üzerinde gecede karıştırma ile cilt kuluçkaya.
- Ertesi gün, arka ve ön cilt 24 iyi plaka yeni kuyu transfer veya birincil antikorlar içeren engelleme arabellek Aspire edin. 1 mL de %2 HIGS seyreltilmiş DS PBS içinde % 0,2 TX-100 yıkama arabellek ile seyreltilmiş PBS % 2 veya % 0,2 TX-100 yıkama arabellek ile ekleyin. Her oda sıcaklığında bir mikser nazik karıştırma ile 15dk yıkama tamponunun 3 değişiklikler ile deri yıkayın.
- İkincil antikor çözüm (Tablo reçetesi) hazırlayın. İkincil antikorlar engelleme arabellekte seyreltik (ya da %10 HIGS veya % 10 DS) ve 0,22 µm polivinilidin difluoride (PVDF) membran şırınga filtre ikincil antikorlar içeren engelleme arabellek bağlı 1 mL şırınga için filtre.
Not: Alexa 488 veya 633 Birleşik keçi Anti-tavşan IgG (H + L) veya Tuj1, Alexa 647 Birleşik keçi Anti-hamster IgG (H + L) PECAM-1, Alexa 488 Birleşik keçi Anti-tavşan IgG (H + L) MBP için için için Igg2a fare ve sıçan IgG (H + L) CD11b için Alexa 594 Birleşik kullanılmıştır 8 µg/mL son konsantrasyonu, 1:250 seyreltme ile. Deriyi Cy3 Birleşik αSMA antikor (2-3 µg/mL son konsantrasyonu, 1:500 seyreltme) ikincil Bu antikorlar ile birlikte ile inkübe. - Belgili tanımlık eriyik vasıl 13.000 x g engelleme arabelleğinden ikincil antikorların toplanan parçacıklar kaldırmak 10 dakika santrifüj kapasitesi.
Not: aynı anda farklı floresan konjuge ikincil antikorlar farklı türlerden elde edilen karışık olabilir. - Arka ve ön cilt de 150 µL ikincil antikorlar çözüm içeren için transfer. 24 iyi plaka ışık önlemek ve cilt için 1s ile bir mikser, oda sıcaklığında hafif karıştırma kuluçkaya alüminyum folyo şal.
- Arka ve ön cilt 24 iyi plaka yeni kuyu transfer veya ikincil antikor çözüm damlalıklı tarafından tamamen Aspire edin. 1 mL % 2 HIGS çamaşır arabellek veya % 2 DS çamaşır arabellek ekleyin.
- Alüminyum folyo içinde 24 iyi plaka sarın ve her oda sıcaklığında bir mikser nazik karıştırma ile 15dk yıkama arabellek 3 değişiklikler ile yıkayın.
3. montaj kulak cilt slayt üzerinde
- Deri bir 35 x 10 mm2 Petri kabına dibinde yerleştirin. Dikkatli bir şekilde kıllar, yağ dokuları, bağ dokusu, toz ve elyaf geniş fotoğraf beyazlatma en aza indirmek için düşük aydınlatma ile stereomicroscope altında ince kavisli forseps kullanarak deri içinden çıkarın. PBS ile ıslak cilt tutmak.
- Cilt forseps kullanarak bir yapıştırıcı mikroskop slayt aktarın. Arka ve ön deri iç ile yer slayt üzerinde karşı karşıya. Deri forseps kullanarak düzleştirin.
- Photobleaching önlemek ve floresan sinyallerini korumak için sıvı Anti-fade montaj orta deride bağlayın. Hiçbir hava kabarcıklarının deri çevresinde veya üzerinde olduğundan emin olun.
- Coverslip deri örnekleri üzerinde dikkatle kapak ve bağlı cilt örnek slaytlar karanlık gecede montaj medya sağlam olsun izin vermek için oda sıcaklığında saklayın. Oje içeren coverslip mühür ve uzun süreli depolama için 4 ° C'de saklayın.
4. confocal mikroskobu
- Fluorophores için uygun lazerler ayarlayın. Confocal mikroskop üç lazer kaynakları (Argon 488 nm, DPSS 561 nm ve Helene 633 nm) ile bu deneyde kullanılır.
- Aynı anda önlemek ve herhangi bir çakışma azaltmak için üç kez lekeli örnekleri heyecanlandıran sıralı tarama aracını kullanın.
Not: Sıralı bir şekilde sıralı tarama modunu kullanarak görüntüleri alınacaktır. - 10 X amaç altında görüntü. Bütün kulak cilt yakalamak için döşeme tarama aracını kullanın. Z-yığın ayarla ve z-pozisyon kulak cilt tüm kalınlığı kapsadığından emin olun.
Sonuçlar
Yetişkin fare arka kulak cilt (şekil 1A) ve ön kulak cilt (şekil 1B) olduğunu αSMA (kırmızı), Tuj1 (yeşil), antikorlar ile immunostained ve PECAM-1 (mavi). Posterior cilt immunostained nöro-bağışıklık dağıtım CD11b (kırmızı) ve MBP (yeşil), Tuj1 (mavi) ile birlikte (şekil 2A) antikorları kullanarak çalışma yapıldı. CD11b dağılımı+ inflamatuar hücreler, makrofajlar da dahil olmak üzere bir tek hücresel çözünürlükte (şekil 2B) algılandı.

Şekil 1: hizalama ofperipheral sinirler ve kan damarları yetişkin kulak derideki. Bütün monteli arka ve ön kulak cilt αSMA (kırmızı), Tuj1 (yeşil), antikorlar ile üçlü ayirt confocal mikroskobu ve PECAM-1 (mavi) gösterilir. (A) VSMC kaplı büyük çaplı kan damarları hizalamak periferik sinirler posterior kulak deri ile. (B) daha küçük çaplı damarlar VSMCs ile kaplı hizalamak ön kulak cilt daha küçük çaplı periferik sinir demetleri ile. Ölçek çubuğu = 1 mm Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
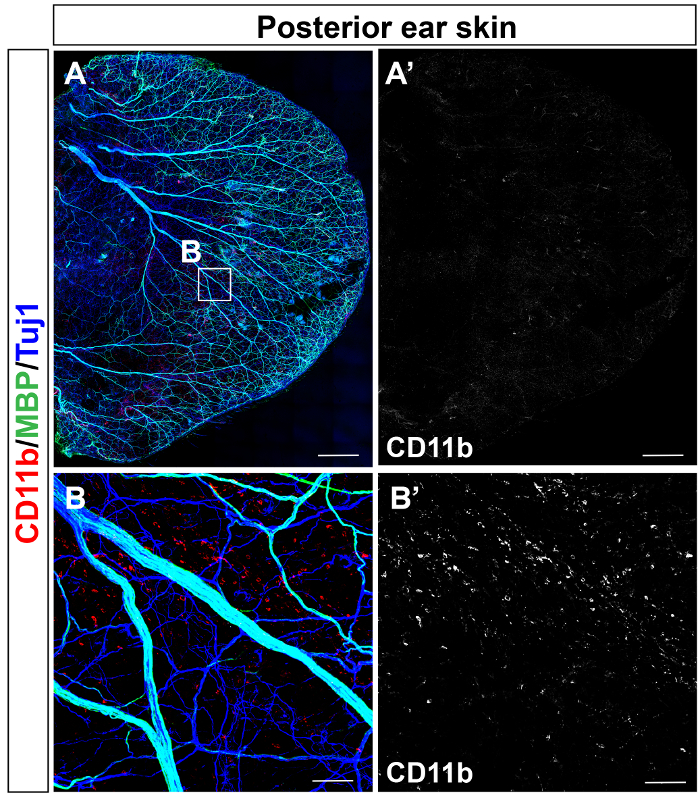
Resim 2: Myelination periferik sinirler ve CD11b+ myeloid hücre dağıtım yetişkin kulak derideki. Bütün Dağı üçlü ayirt confocal mikroskobu arka kulak cilt CD11b (kırmızı) ve MBP (yeşil), Tuj1 (mavi), birlikte antikorlar ile gösterilir. (A)orta büyük çapı periferik sinirler myelinated. (B) yakın çekim görüntü (A). CD11b+ inflamatuar hücrelerin arka kulak deride eşit olarak dağıtmak. Ölçek çubuğu 1 mm (A), 100 µm (B) =. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Bu iletişim kuralı nöro-vasküler yapılar ve bağışıklık hücre dağıtım analizi için yetişkin kulak derinin bütün-mount immunonohistochemical görüntüleme açıklar. İnanıyoruz Bu yöntem dallanma morfogenez ve periferik sinirler ve kan damarları desenlendirme, hem de bağışıklık hücreleri ve saç gibi cilt bileşenlerinin üç boyutlu dağıtım çalışmaya araştırmacılar için çok sayıda deneysel avantajları folikülleri. Görüntüleme sonuçlarını görüntüleme yazılımları kullanarak daha fazla nicel analiz için sayısal.
Uygun hazırlık kulak deri bu protokolü başarısı için önemlidir. İlk olarak, kulak cilt dikkatle yakında fare ötenazi sonra disseke. Kulak cilt arka kısmı kıkırdak uzak soyulmuş. O zaman, kıkırdak ön deri boyama önce soyulmuş. İkinci olarak, bağ dokusu, yağ doku ve saç yavaşça ve iyice montaj önce kaldırılması gerekir. Periferik sinirler cilt yüzeyinde varlığı nedeniyle dikkatli kaldırma sinirler zarar görmesini önlemek için gereklidir. Üçüncü olarak, kulak cilt kulak cilt bazı kalın dokulardan kaldırılması ile açılmalı. Son olarak, kulak deri hava kabarcığı düz monte edilmiş olmalıdır.
Bu iletişim kuralı bir sınırlama kulak kulak öğesini cilt kulak etiketi bir delik veya bir yara izi neden olur gibi analiz için uygun değildir. Bu nedenle, analiz etmek için birden fazla fareler diye fare kuyruk üzerinde etiketleme gibi kulak etiketi dışında farklı yöntemlerle tanımlanması gereklidir.
Her ne kadar bir önceki raporlar bir bölge ilgi ile yüksek çözünürlüklü10yansıması olduğunu gösterdi tüm kulak deri döşeme tarama aracı ile confocal mikroskobu tarafından taranabilir. İlginçtir, Bütün Dağı görüntüleme tüm kulak derinin farklı dallanma morfogenez ve periferik sinirler ve kan damarları arasında arka ve ön deri (şekil 1) desenlendirme ortaya koymaktadır: geniş çaplı posterior tenli sinir demetleri (20-50 µm) yenilenmiş geniş çaplı kan damarları αSMA+ VSMCs (20-60 µm) ile kaplı ile uyumlu ön sırasında cildi daha küçük çaplı sinir demetleri (< 20 µm) daha küçük çaplı ama yenilenmiş kan damarları ile uyumlu αSMA+ VSMCs ile kaplı (< 20 µm).
Atopik dermatit12, sedef13gibi insan dermatolojik hastalıklar mekanizmasının aydınlatmak, şifa14ve diyabetik nöropati15yara ile fare modelleri11 dikkate değer bir dizi vardır. Bu iletişim kuralı obezite diyet kaynaklı fareler kulak cilt için başvuran ve diyabetik nöropati16çalışmaya 2 diyabetik fare yazın. Bu iletişim kuralı Juvenil değişik patolojik koşullarda yetişkin fare cilde uygulanır.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
K. Gill Laboratuvar Yönetimi için teşekkür ediyoruz ve fare Bakımı ve R. Reed konusunda yardım almak için 50 hayvan tesis ve F. Baldrey yönetim yardım almak için teknik destek, J. Hawkins ve personel Ulusal kurumları, Sağlık (NIH) bina. Onların kulak cilt diseksiyon protokolü, N. Burns Editör Yardım ve üyeleri kök hücre Laboratuvarı ve teknik yardım ve düşünceli tartışma için Neuro-vasküler Biyoloji paylaştığınız için teşekkür ederiz S. Motegi ve M. Udey. T. Yamazaki bilim promosyon (JSP'ler) NIH-KAITOKU için Japonya Derneği tarafından desteklenmiştir. Bu eser Ulusal kalp, akciğer ve kan Enstitüsü (Y.M. için HL005702-11), Intramural araştırma programı tarafından desteklenen
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 x Phosphate Buffered Saline | KD Medical | RGE-3210 | PBS, without Ca2+/Mg2+ |
| Hank’s Balanced Salt Solution | Gibco | 14025-092 | HBSS, with Ca2+/Mg2+ |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | PFA, fixative, diluted in PBS |
| Triton X-100 | Sigma | X100 | Detergent |
| Normal goat serum | Gibco | 16210064 | Component of blocking/washing buffer |
| Normal donkey serum | Jackson Immuno research | 017-000-121 | Component of blocking/washing buffer |
| Curved fine tweezers | Dumont | RS-5047 | |
| Curved tweezers | Integra Miltex Vantage | V918-782, V918-784 | |
| Filter Unit 0.45 mm | Thermo Scientific | 157-0045 | For filtration |
| 1 mL syringe | Coviden | 8881501400 | For filtration |
| Syringe filter Unit 0.22 mm | Millex-GV | SLGVR04NL | For filtration |
| ProLong Gold | Thermo Scientific | P36934 | Anti-fade mounting medium |
| Nail Polish | Electron Microscopy Sciences | 72180 | For sealing |
| Dissecting microscope | Leica | MZ95 | |
| Confocal microscope | Leica | TCS SP5 | |
| Photoshop CC 2017 | Adobe | Graphics editor software | |
| Illustrator CC 2017 | Adobe | Graphics editor software | |
| Image J | NIH | Image processing software | |
| Anti-PECAM-1 (CD31) antibody | Millipore | MAB1398Z | Hamster IgG, vascular endothelial cell marker, 1:300 |
| Anti-PECAM-1 (CD31) antibody | BD Pharmingen | 553369 | Rat IgG2a kappa, vascular endothelial cell marker, 1:300 |
| Anti-αSMA antibody conjugated with cy-3 | Sigma | C6198 | Mouse IgG2a, vascular smooth muscle cell marker, 1:500 |
| Anti-EphB1 antibody | Santa Cruz | sc-9319 | Goat polyclonal, venous endothelial cell marker, 1:100 |
| Anti-neuron-specific Class III β-tubulin (Tuj1) | Abcam | AB18207 | Tuj1, Rabbit polyclonal IgG, pan-axonal marker, 1:500 |
| Anti-Tuj1 antibody | Covance | MMS-435P | Mouse IgG2a, pan-axonal marker, 1:500 |
| Anti-MBP antibody | Abcam | AB40390 | Rabbit polyclonal IgG, myelination marker, 1:200 |
| Anti-Tyrosine Hydroxylase antibody | Chemicon | AB152 | Rabbit polyclonal, sympathetic neuron marker, 1:500 |
| Anti-Peripherin antibody | Chemicon | AB1530 | Rabbit polyclonal, peripheral neuron marker, 1:1000 |
| Anti-CD11b antibody | Bio-Rad | MCA74G | Rat IgG2b, inflammatory cell marker (macrophages), 1:50 |
| Anti-CD45 antibody | Thermo Fisher Scientific | 14-0451-85 | Rat IgG2b kappa, pan-hematopoietic cell marker, 1:500 |
| Anti-CD3 antibody | Bio-Rad | MCA1477T | Rat IgG1, immune cell marker, 1:100 |
| Anti-CD45R (B220) antibody | Thermo Fisher Scientific | 14-0452 | Rat IgG2a kappa, inflammatory cell marker, 1:200 |
| Anti-GFP antibody | Thermo Fisher Scientific | A11122 | Rabbit polyclonal, 1:300 |
| Anti-GFP antibody | Abcam | Ab13970 | Chicken polyclonal, 1:500 |
| Anti-β-gal antibody | Cappel | 55976 | Rabbit polyclonal, 1:5000 |
| Anti-RFP antibody | Abcam | Ab62341 | Rabbit polyclonal, 1:300 |
| Goat anti-rabbit IgG (H+L) Alexa 488 | Thermo Fisher Scientific | A11034 | Rabbit polyclonal secondary antibody, 1:250 |
| Goat anti-hamster IgG (H+L) Alexa 647 | Jackson Immuno research | 127-605-160 | Hamster polyclonal secondary antibody, 1:250 |
| Goat anti-rat IgG (H+L) Alexa 594 | Jackson Immuno research | 112-585-167 | Rat polyclonal secondary antibody, 1:250 |
| Goat anti-mouse IgG2a Alexa 633 | Thermo Fisher Scientific | A21136 | Mouse IgG2a secondary antibody, 1:250 |
Referanslar
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., James, J., Nam, J., Uchida, Y. Whole-mount confocal microscopy for vascular branching morphogenesis. Methods Mol Biol. 843, 69-78 (2012).
- Li, W., Mukouyama, Y. S. Whole-mount immunohistochemical analysis for embryonic limb skin vasculature: a model system to study vascular branching morphogenesis in embryo. J Vis Exp. , (2011).
- Yamazaki, T., et al. Tissue Myeloid Progenitors Differentiate into Pericytes through TGF-beta Signaling in Developing Skin Vasculature. Cell Rep. 18, 2991-3004 (2017).
- Mukouyama, Y. S. Vessel-dependent recruitment of sympathetic axons: looking for innervation in all the right places. J Clin Invest. 124, 2855-2857 (2014).
- Li, W., et al. Peripheral nerve-derived CXCL12 and VEGF-A regulate the patterning of arterial vessel branching in developing limb skin. Dev Cell. 24, 359-371 (2013).
- Chang, H., Wang, Y., Wu, H., Nathans, J. Flat mount imaging of mouse skin and its application to the analysis of hair follicle patterning and sensory axon morphology. J Vis Exp. , e51749 (2014).
- Salz, L., Driskell, R. R. Horizontal Whole Mount: A Novel Processing and Imaging Protocol for Thick, Three-dimensional Tissue Cross-sections of Skin. J Vis Exp. , (2017).
- Liakath-Ali, K., et al. Novel skin phenotypes revealed by a genome-wide mouse reverse genetic screen. Nat Commun. 5, 3540 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16, 505-516 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opin Drug Dis. 8, 331-355 (2013).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. J Invest Dermatol. 129, 31-40 (2009).
- Wagner, E. F., Schonthaler, H. B., Guinea-Viniegra, J., Tschachler, E. Psoriasis: what we have learned from mouse models. Nat Rev Rheumatol. 6, 704-714 (2010).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Dis Model Mech. 7, 1205-1213 (2014).
- O'Brien, P. D., Sakowski, S. A., Feldman, E. L. Mouse models of diabetic neuropathy. ILAR J. 54, 259-272 (2014).
- Yamazaki, T., et al. Whole-Mount Adult Ear Skin Imaging Reveals Defective Neuro-Vascular Branching Morphogenesis in Obese and Type 2 Diabetic Mouse Models. Sci Rep. 8, (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır