Method Article
Целом гора Confocal микроскопии для уха взрослого кожи: модель системы для изучения нейро сосудистые ветвления морфогенеза и иммунных клеток распределения
В этой статье
Резюме
Здесь мы описываем высокого разрешения всего гора изображений метод в коже уха всей взрослой мыши, что позволяет нам визуализировать ветвления морфогенеза и кучность периферических нервов и кровеносных сосудов, а также распределение иммунных клеток.
Аннотация
Здесь мы представляем протокол кожи уха взрослого целом гора изображений техника для изучения всеобъемлющей трехмерной нейро сосудистые ветвления морфогенеза и структурирования, а также распределение иммунных клеток на клеточном уровне. Анализ периферических нервов и кровеносных сосудов анатомических структур во взрослых тканях предоставляет некоторые идеи в понимание функциональных нейро сосудистые проводки и нейро сосудистые дегенерации в патологических условиях заживление ран. Как весьма информативный модель системы мы сосредоточили наши исследования на кожу уха взрослого, который легко доступны для рассечения. Наш простой и воспроизводимые протокол обеспечивает точное описание клетчатых компонентов на всей коже, например периферических нервов (сенсорные аксонов, симпатичная(ый) аксонов и Шванновские клетки), кровеносные сосуды (эндотелиальные клетки и клетки сосудистой гладкой мышцы ) и воспалительных клеток. Мы считаем, что этот протокол будет проложить путь к расследованию морфологические аномалии в периферических нервов и кровеносных сосудов, а также воспаление в коже уха взрослого при различных патологических условиях.
Введение
Кожа состоит из трех слоев: эпидермиса, дермы и гиподермы. Он использовался как модель системы для изучения стволовых клеток обслуживания, дифференциация и морфогенез в развитие, а также регенерации, tumorigenesis и воспаления в взрослых. Кожа является Богато васкуляризированной и иннервируются таким образом, что хорошо скоординированного развития периферической нервной системы и сосудистой системы.
Ранее мы продемонстрировали изображений техника целом гора эмбриональных кожи с несколькими маркировки для изучения нетронутыми периферических нервов и кровеносных сосудов, включая их клеточных компонентов1,2,3, 4: сенсорные аксоны, симпатичная(ый) аксоны, Шванновские клетки в нервы, эндотелиальные клетки, pericytes и сосудистой гладких мышечных клеток (VSMCs) в кровеносных сосудах. Во время ангиогенеза первичной капиллярной сети проходит интенсивный сосудистого ремоделирования и превращается в иерархической сосудистой разветвленную сеть. В развивающихся дермы/гиподермы артерий филиал наряду с периферической сенсорные нервы и Вены, а затем образуют прилегающих к артерии. После того, как иерархическое сосудистой сети тщательно покрыта VSMCs, симпатические нервы протянулись вдоль и иннервируют большого диаметра сосудов1,5,6. Несмотря на значимость в тесную связь между развивающихся нервной и сосудистой систем главный вопрос был решать, что произойдет с нейро сосудистые сетей в различных патологических ситуаций в взрослых. Трехмерных изображений высокого разрешения необходимо оценить патогенеза, наряду с анатомически узнаваемые ветвления морфогенеза и кучность.
Нейронов и сосудистой морфогенеза в кожи взрослых мыши обычно анализируемой окрашивание ткани секции. Другие исследования использовали всего гора изображения кожи для визуализации периферических нервов и кровеносных сосудов, в дополнение к волосяных фолликулов, сальных желез и мышца пили мышцы7,8,9. Однако толщина кожи взрослых затрудняет анализ кожи на всю глубину.
В настоящем исследовании мы разработали роман с высоким разрешением изображений целом гора уха взрослого кожи для преодоления этих проблем. Ухо кожа легко доступны для диссекции и последующей целом гора изображения кожи над ее всю глубину. Таким образом это простой и очень воспроизводимый метод, который может применяться для сравнения трехмерную архитектуру периферической нервной и сосудистой систем в коже, с всеобъемлющей количественной измерения. Мы продемонстрировали, что выравнивание периферической сенсорной и симпатических нервов с большого диаметра сосудов сохраняется в взрослых кожи. Цель настоящего Протокола заключается в визуализации ветвления морфогенеза и кучность периферических нервов и кровеносных сосудов, а также распределение иммунных клеток на клеточном уровне в модели взрослых мыши в различных условиях, таких как воспаление и Регенерация.
протокол
Под номером официального утверждения от национального сердца, легких и крови института (NHLBI) животное уход и использование Комитета были все эксперименты в этом разделе.
1. Взрослый мыши ухо кожа коллекция
- Усыпить взрослых мышей воздействием двуокиси углерода (CO2) в закрытой камере, затем подтвердите euthanasia, шейки матки дислокации.
Примечание: Эксперимент придерживается руководящего положения национальных институтов здравоохранения (НИЗ) для метода эвтаназии. - Вскрыть уха из базы и поместите его в 35 x 10 мм2 Петри, содержащий 2 мл из Хэнка сбалансированный соли раствора (HBSS). Коротко обрежьте волосы ножницами.
- Пил задней кожи и передней кожу прочь тщательно от промежуточных хряща.
Примечание: Хряща придает передней кожи. - Передача задней и передней кожи отдельно до 24 хорошо пластины содержащий 1 мл ледяной свежие параформальдегида 4% (PFA) в фосфатный буфер (PBS) в колодец. Придавить задний и передний кожи в 4% PFA.
- Прикрепите задний и передний кожи с хряща при 4 ° C для 1 h.
- Помыть задний и передний кожи 3 раза по 5 минут в 1 мл PBS с нежным смешивания на смесителе при комнатной температуре.
- Передача задней и передней кожи с хряща в нижней части 35 x 10 мм2 Петри. Отрежьте базы региона, который складывается и жировой и соединительной ткани. Отделите хряща от передней кожи с помощью тонкой Изогнутый пинцет.
- Осторожно удалите волоски, жировой ткани и соединительной ткани с внутренней задней кожи с помощью тонкой Изогнутый пинцет. Сохранить кожу влажной с PBS.
2. всего гора иммуногистохимическое окрашивание кожи уха мыши
Примечание: В соответствии с низ Лаборатория безопасности были проведены все эксперименты в следующих разделах.
- Подготовьте блокирующий буфер. Фильтр 10% тепла инактивированная козьего сыворотки (HIGS) разводят в PBS с 0,2% Тритон блокирующий буфер X-100 (TX-100), или 10% осла сыворотки (DS) разводят в PBS с 0,2% блокировки буфера TX-100, с помощью фильтра 0.45 мкм.
- Передача задней и передней кожи до 24 хорошо пластины содержащие 1 мл 10% HIGS блокирующий буфер или 10% DS блокирующий буфер за хорошо. Инкубируйте кожу на 30 мин с нежным смешивания на смесителе при комнатной температуре.
- Приготовляют раствор основного антитела путем разбавления первичного антитела (Таблица материалов) в блокирующем буфере (либо 10% HIGS или 10% DS).
Примечание: Всего mout Иммуногистохимический анализ кожи уха взрослого с антителами к Пан нейронов маркер нейрон конкретного класса III β-тубулина (Tuj1, кролика polyclonal IgG или мыши monocloncal IgG2a, разведение 1: 500 в конечной концентрации 2 мкг/мл), Пан эндотелиальных клеток маркер тромбоцитов эндотелиальных клеток молекулы адгезии 1 (PECAM-1, хомяк моноклональных IgG, 1: 300 разрежения в конечной концентрации 3,3 мкг/мл), основной белок миелина маркер Миелиновые оболочки (ПМБ, кролика polyclonal IgG, разведение 1: 200 на конечная концентрация 5 мкг/мл) и воспалительных клеток миелоидного маркер CD11b (Крыса моноклональных IgG2b, 1:50 разрежения в конечной концентрации 20 мкг/мл) был показан на рисунке 1 и на рисунке 2. Кожа была инкубировали с Cy3-конъюгированных антител для сосудистой гладкой мышечной клетки маркер α гладких мышц актина (αSMA) вместе с вторичные антитела (2.6). Первичного антитела, проверены сами были перечислены в Таблице материалов. Одновременно можно смешивать несколько первичных антител, получаемые из различных видов. - Задний и передний кожи передавать новую скважину, содержащие 150 мкл раствора первичного антитела. Инкубируйте кожи с нежным смешивания на микшер на 4 ° C на ночь.
- На следующий день передавать новые скважины в пластину 24 хорошо задний и передний кожи или аспирационная блокирующий буфер, содержащий первичных антител. Добавьте 1 mL либо 2% HIGS разводят в PBS с 0,2% TX-100 Отмывающий буфер или 2% DS разводят в PBS с 0,2% TX-100 Отмывающий буфер. Вымойте кожу с 3 изменения Отмывающий буфер каждые 15 мин с нежным смешивания на смесителе при комнатной температуре.
- Подготовьте раствор вторичных антител (Таблица материалов). Разбавленных вторичных антител в блокирующем буфере (либо 10% HIGS или 10% DS) и фильтр, блокирующий буфер, содержащий вторичные антитела через 0,22 мкм винилидена фторид (PVDF) мембраны шприц фильтр подключен к 1 мл шприц.
Примечание: Alexa 488 или 633-конъюгированных коза анти кролик IgG (H + L) или мыши IgG2a для Tuj1, конъюгированных Alexa 647 коза анти хомяка IgG (H + L) для PECAM-1, Alexa 488-конъюгированных коза анти кролик IgG (H + L) для ПМБ, и были использованы конъюгированных Alexa 594 крыса IgG (H + L) для CD11b с 1: 250 разрежения в конечной концентрации 8 мкг/мл. Кожа была инкубировали с Cy3-конъюгированных αSMA антител (1: 500 разрежения в конечной концентрации 2-3 мкг/мл) в сочетании с эти вторичные антитела. - Центрифуга решение на 13 000 x g 10 мин для удаления агрегированных частиц вторичные антитела от блокировки буфера.
Примечание: Различные флуоресцентные конъюгированных вторичные антитела, получаемые из различных видов могут смешиваться одновременно. - Передать задний и передний кожу хорошо содержащие 150 мкл раствора вторичные антитела. Оберните 24 хорошо пластины в алюминиевой фольгой, чтобы избежать свет и инкубировать кожи за 1 час с нежным смешивания на смесителе при комнатной температуре.
- Передать новые скважины в пластину 24 хорошо задний и передний кожи или аспирационная раствор вторичных антител, накапайте полностью. Добавьте 1 мл 2% HIGS Отмывающий буфер или 2% DS Отмывающий буфер.
- Оберните 24 хорошо пластины в алюминиевой фольги и мыть с 3 изменения Отмывающий буфер каждые 15 мин с нежным смешивания на смесителе при комнатной температуре.
3. Монтаж кожи уха на слайде
- Место кожи на нижней части 35 x 10 мм2 Петри. Осторожно удалите волоски, жировой ткани, соединительной ткани, пыли и волокон с внутренней стороны с помощью тонкой щипцы изогнутые под стереомикроскопом с низкой освещенности для сведения к минимуму обширные фото отбеливание кожи. Сохранить кожу влажной с PBS.
- Передать кожи клей микроскопа, с помощью щипцов. Место задней и передней кожи с внутренней стороной вверх на слайде. Сгладить кожу, используя пинцет.
- Смонтируйте кожи в среде жидкого анти затухания монтажа избежать Фотообесцвечивание и сохранить флуоресцентные сигналов. Убедитесь, что нет пузырьков воздуха на или вокруг кожи.
- Крышка с coverslip на образцах кожи тщательно и хранить слайды образец монтируется кожи в темная ночь при комнатной температуре, чтобы позволить монтажа СМИ получить твердую. Печать coverslip на слайд с лаком и хранить его на 4 ° C для длительного хранения.
4. конфокальная микроскопия
- Настройте соответствующие лазеры для флуорофоров. Конфокальный микроскоп с тремя лазерных источников (аргон 488 нм, DPSS 561 Нм и HeNe 633 нм) используется в этом эксперименте.
- Используйте средство последовательное сканирование, которое одновременно возбуждает тройной витражи образцы, для недопущения и сокращения дублирования.
Примечание: Изображения будут приниматься в последовательном порядке, используя режим последовательного сканирования. - Изображение под объектив 10 X. Используйте средство проверки плитки захватить весь уха кожи. Установка Z-стек и убедитесь, что z позиция охватывает всю толщину кожи уха.
Результаты
Взрослый мыши задний уха (рис. 1A) переднего ухо кожи и (рис. 1B) были immunostained с антителами к αSMA (красный), Tuj1 (зеленый) и PECAM-1 (синий). Задняя кожа была immunostained для изучения распределения нейро иммунных антител к CD11b (красный) и MBP (зеленый), вместе с Tuj1 (синий) (рисунок 2A). Распределение CD11b+ воспалительных клеток, включая макрофаги был обнаружен в одной сотовой резолюции (рис. 2B).

Рисунок 1: выравнивание ofperipheral нервов и кровеносных сосудов в коже уха взрослого. Целом гора тройной иммунофлюоресценции confocal микроскопии кожи задней и передней уха с антителами к αSMA (красный), Tuj1 (зеленый), и показано, PECAM-1 (синий). (A) VSMC-покрыты большого диаметра сосудов согласовать с периферических нервов кожи задней уха. (B) меньше диаметр кровеносные сосуды, покрытые VSMCs выровнять с меньшего диаметра периферических нервных пучков в коже передней уха. Шкалы бар = 1 мм пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
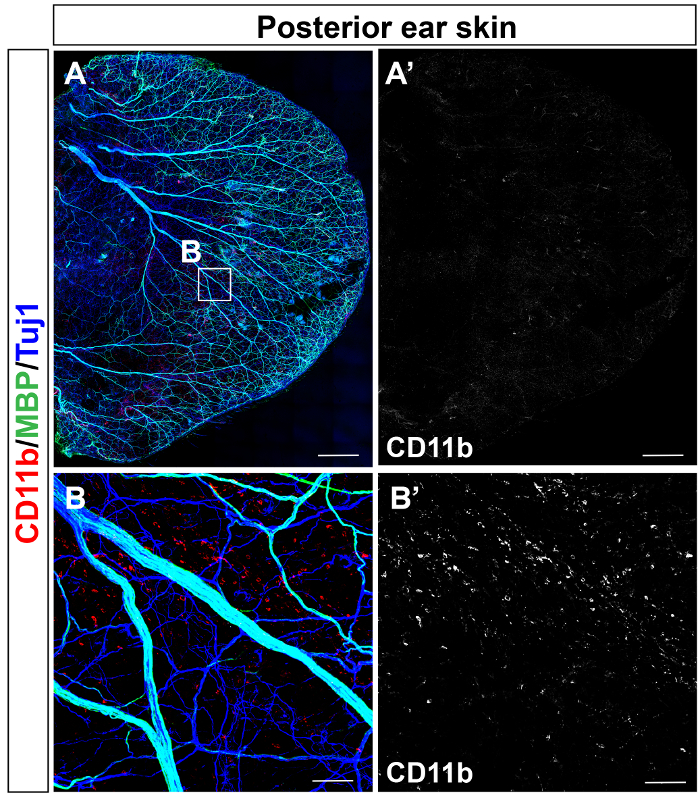
Рисунок 2: Миелинизации периферических нервов и CD11b+ распределение миелоидных клеток в коже уха взрослого. Целом гора тройной конфокальный иммунофлуоресценции задняя уха кожи с антителами к CD11b (красный) и MBP (зеленый), вместе с Tuj1 (синий), отображается. (A) среднего и большого диаметра периферических нервов среза. (B) крупным планом изображение в (A). CD11b+ воспалительных клеток равномерно распределить в коже задняя уха. Шкалы бар = 1 мм (A), 100 мкм (B). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Этот протокол описывает immunonohistochemical целом гора изображений уха взрослого кожи для анализа нервно сосудистых структур и распределение иммунных клеток. Мы считаем, что этот метод имеет многочисленные экспериментальные преимущества для исследователей для изучения ветвления морфогенеза и кучность периферических нервов и кровеносных сосудов, а также трехмерные распределения компонентов кожи, включая иммунные клетки и волос фолликулов. Результаты изображений могут быть количественно с помощью визуализации программного обеспечения для дальнейшего количественного анализа.
Надлежащая подготовка кожи уха имеет решающее значение для успешного осуществления этого протокола. Во-первых ухо кожи следует тщательно расчлененный вскоре после euthanizing мыши. Задняя часть уха кожи должны быть очищены от хряща. Затем хряща должны быть отрывании от передней кожи до окрашивания. Во-вторых соединительной ткани, жировой ткани и волосы должны быть удалены мягко и тщательно перед монтажом. Из-за существования периферических нервов на поверхности кожи тщательное удаление требуется, чтобы избежать повреждения нервов. В-третьих ухо кожа должна быть разворачивались с удалением некоторых толстые ткани от кожи уха. Наконец ухо кожа должна быть плоским монтируется без пузырьков воздуха.
Одно ограничение этого протокола является, что ухо ухо тегами кожи не подходит для анализа как ушная бирка вызывает отверстие или шрам. Таким образом идентификация мышей различными способами помимо ушная бирка например маркировки на хвост необходим в случае, если существует несколько мышей для анализа.
Весь уха кожи может проверяться конфокальная микроскопия с инструментом проверки плитки, хотя предыдущие доклады показали, что регион интерес может быть imaged с высоким разрешением10. Интересно, что целое гора изображения кожи всего уха показывает собственный ветвления морфогенеза и кучность периферических нервов и кровеносных сосудов между задней и передней кожи (рис. 1): задняя кожа имеет большого диаметра нервные пучки (20-50 мкм) в соответствие с перестроенный большого диаметра кровеносные сосуды, покрытые αSMA+ VSMCs (20 – 60 мкм), а передней кожи имеет меньший диаметр нервные пучки (< 20 мкм) в соответствие с меньшего диаметра, но реконструированный кровеносных сосудов покрытые αSMA+ VSMCs (< 20 мкм).
Есть замечательное количество мыши модели11 для выяснения механизма человеческого дерматологических заболеваний, как атопический дерматит12, псориаз13, ранение исцеления14и15диабетической невропатии. Мы применили этот протокол на кожу уха диета индуцированной ожирением мышей и типа 2 диабетических мышей для изучения диабетической невропатии16. Этот протокол может применяться от несовершеннолетних для взрослых мыши кожи при различных патологических состояниях.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим K. Gill Лаборатория управления и технической поддержки, J. Hawkins и сотрудников национальных институтов здравоохранения (НИЗ) 50 животных фонда для помощи с мыши уход и р. Рид и F. Baldrey для административной помощи. Спасибо также S. Motegi и м. Udey для обмена их уха кожи рассечение протокол, N. ожоги редакционной помощи, и члены лаборатории стволовых клеток и нейро-сосудистая биология для технической помощи и вдумчивого обсуждения. Т. Ямадзаки был поддержан японского общества для поощрения науки (JSP) низ-KAITOKU. Эта работа была поддержана интрамуральных исследовательской программы национального сердца, легких и крови института (HL005702-11-ю.м.)
Материалы
| Name | Company | Catalog Number | Comments |
| 10 x Phosphate Buffered Saline | KD Medical | RGE-3210 | PBS, without Ca2+/Mg2+ |
| Hank’s Balanced Salt Solution | Gibco | 14025-092 | HBSS, with Ca2+/Mg2+ |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | PFA, fixative, diluted in PBS |
| Triton X-100 | Sigma | X100 | Detergent |
| Normal goat serum | Gibco | 16210064 | Component of blocking/washing buffer |
| Normal donkey serum | Jackson Immuno research | 017-000-121 | Component of blocking/washing buffer |
| Curved fine tweezers | Dumont | RS-5047 | |
| Curved tweezers | Integra Miltex Vantage | V918-782, V918-784 | |
| Filter Unit 0.45 mm | Thermo Scientific | 157-0045 | For filtration |
| 1 mL syringe | Coviden | 8881501400 | For filtration |
| Syringe filter Unit 0.22 mm | Millex-GV | SLGVR04NL | For filtration |
| ProLong Gold | Thermo Scientific | P36934 | Anti-fade mounting medium |
| Nail Polish | Electron Microscopy Sciences | 72180 | For sealing |
| Dissecting microscope | Leica | MZ95 | |
| Confocal microscope | Leica | TCS SP5 | |
| Photoshop CC 2017 | Adobe | Graphics editor software | |
| Illustrator CC 2017 | Adobe | Graphics editor software | |
| Image J | NIH | Image processing software | |
| Anti-PECAM-1 (CD31) antibody | Millipore | MAB1398Z | Hamster IgG, vascular endothelial cell marker, 1:300 |
| Anti-PECAM-1 (CD31) antibody | BD Pharmingen | 553369 | Rat IgG2a kappa, vascular endothelial cell marker, 1:300 |
| Anti-aSMA antibody conjugated with cy-3 | Sigma | C6198 | Mouse IgG2a, vascular smooth muscle cell marker, 1:500 |
| Anti-EphB1 antibody | Santa Cruz | sc-9319 | Goat polyclonal, venous endothelial cell marker, 1:100 |
| Anti-neuron-specific Class III b-tubulin (Tuj1) | Abcam | AB18207 | Tuj1, Rabbit polyclonal IgG, pan-axonal marker, 1:500 |
| Anti-Tuj1 antibody | Covance | MMS-435P | Mouse IgG2a, pan-axonal marker, 1:500 |
| Anti-MBP antibody | Abcam | AB40390 | Rabbit polyclonal IgG, myelination marker, 1:200 |
| Anti-Tyrosine Hydroxylase antibody | Chemicon | AB152 | Rabbit polyclonal, sympathetic neuron marker, 1:500 |
| Anti-Peripherin antibody | Chemicon | AB1530 | Rabbit polyclonal, peripheral neuron marker, 1:1000 |
| Anti-CD11b antibody | Bio-Rad | MCA74G | Rat IgG2b, inflammatory cell marker (macrophages), 1:50 |
| Anti-CD45 antibody | Thermo Fisher Scientific | 14-0451-85 | Rat IgG2b kappa, pan-hematopoietic cell marker, 1:500 |
| Anti-CD3 antibody | Bio-Rad | MCA1477T | Rat IgG1, immune cell marker, 1:100 |
| Anti-CD45R (B220) antibody | Thermo Fisher Scientific | 14-0452 | Rat IgG2a kappa, inflammatory cell marker, 1:200 |
| Anti-GFP antibody | Thermo Fisher Scientific | A11122 | Rabbit polyclonal, 1:300 |
| Anti-GFP antibody | Abcam | Ab13970 | Chicken polyclonal, 1:500 |
| Anti-b-gal antibody | Cappel | 55976 | Rabbit polyclonal, 1:5000 |
| Anti-RFP antibody | Abcam | Ab62341 | Rabbit polyclonal, 1:300 |
| Goat anti-rabbit IgG (H+L) Alexa 488 | Thermo Fisher Scientific | A11034 | Rabbit polyclonal secondary antibody, 1:250 |
| Goat anti-hamster IgG (H+L) Alexa 647 | Jackson Immuno research | 127-605-160 | Hamster polyclonal secondary antibody, 1:250 |
| Goat anti-rat IgG (H+L) Alexa 594 | Jackson Immuno research | 112-585-167 | Rat polyclonal secondary antibody, 1:250 |
| Goat anti-mouse IgG2a Alexa 633 | Thermo Fisher Scientific | A21136 | Mouse IgG2a secondary antibody, 1:250 |
Ссылки
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., James, J., Nam, J., Uchida, Y. Whole-mount confocal microscopy for vascular branching morphogenesis. Methods Mol Biol. 843, 69-78 (2012).
- Li, W., Mukouyama, Y. S. Whole-mount immunohistochemical analysis for embryonic limb skin vasculature: a model system to study vascular branching morphogenesis in embryo. J Vis Exp. , (2011).
- Yamazaki, T., et al. Tissue Myeloid Progenitors Differentiate into Pericytes through TGF-beta Signaling in Developing Skin Vasculature. Cell Rep. 18, 2991-3004 (2017).
- Mukouyama, Y. S. Vessel-dependent recruitment of sympathetic axons: looking for innervation in all the right places. J Clin Invest. 124, 2855-2857 (2014).
- Li, W., et al. Peripheral nerve-derived CXCL12 and VEGF-A regulate the patterning of arterial vessel branching in developing limb skin. Dev Cell. 24, 359-371 (2013).
- Chang, H., Wang, Y., Wu, H., Nathans, J. Flat mount imaging of mouse skin and its application to the analysis of hair follicle patterning and sensory axon morphology. J Vis Exp. , e51749 (2014).
- Salz, L., Driskell, R. R. Horizontal Whole Mount: A Novel Processing and Imaging Protocol for Thick, Three-dimensional Tissue Cross-sections of Skin. J Vis Exp. , (2017).
- Liakath-Ali, K., et al. Novel skin phenotypes revealed by a genome-wide mouse reverse genetic screen. Nat Commun. 5, 3540 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16, 505-516 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opin Drug Dis. 8, 331-355 (2013).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. J Invest Dermatol. 129, 31-40 (2009).
- Wagner, E. F., Schonthaler, H. B., Guinea-Viniegra, J., Tschachler, E. Psoriasis: what we have learned from mouse models. Nat Rev Rheumatol. 6, 704-714 (2010).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Dis Model Mech. 7, 1205-1213 (2014).
- O'Brien, P. D., Sakowski, S. A., Feldman, E. L. Mouse models of diabetic neuropathy. ILAR J. 54, 259-272 (2014).
- Yamazaki, T., et al. Whole-Mount Adult Ear Skin Imaging Reveals Defective Neuro-Vascular Branching Morphogenesis in Obese and Type 2 Diabetic Mouse Models. Sci Rep. 8, (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены