Method Article
Toda a montagem em microscopia Confocal para pele da orelha do adulto: um sistema de modelo para estudar a morfogênese Neuro-vasculares de ramificação e distribuição de células imunes
Neste Artigo
Resumo
Aqui, descrevemos um método de imagem de toda a montagem de alta resolução da pele de orelha inteira rato adulto, que nos permite visualizar ramificação morfogênese e padronização de nervos periféricos e os vasos sanguíneos, bem como a distribuição de células imunes.
Resumo
Aqui, apresentamos um protocolo de uma pele de orelha do adulto de toda a montagem de imagem técnica para estudo abrangente tridimensional neuro-vascular ramificação morfogênese e padronização, bem como a distribuição de células imunes a um nível celular. A análise das estruturas anatômicas nervos e dos vasos sanguíneos periféricas em tecidos adultos fornece alguns insights sobre a compreensão da fiação neuro-vascular funcional e degeneração neuro-vascular em condições patológicas como a cicatrização de feridas. Como um sistema modelo altamente informativa, focamos nossos estudos na pele da orelha do adulto, que é facilmente acessível para dissecação. Nosso protocolo simples e reprodutível fornece uma descrição exata dos componentes celulares da pele inteira, tais como os nervos periféricos (axônios sensoriais, simpáticos axônios e células de Schwann), vasos sanguíneos (células endoteliais e células de músculo liso vascular ) e células inflamatórias. Acreditamos que este protocolo irá pavimentar o caminho para investigar as anormalidades morfológicas nos nervos periféricos e os vasos sanguíneos, bem como a inflamação da pele da orelha do adulto sob diferentes condições patológicas.
Introdução
Pele é composta por três camadas: epiderme, derme e hipoderme. Ela tem sido usada como um sistema modelo para estudar a manutenção de células-tronco, diferenciação e morfogênese em desenvolvimento, bem como a regeneração tumorigênese e inflamação em adultos. Pele é ricamente vascularizada e inervada tal que o desenvolvimento do sistema vascular e sistema nervoso periférico é bem coordenado.
Nós demonstramos anteriormente uma técnica de imagem de montagem em toda a pele embrionária com múltiplos rotulagem para estudar os nervos periféricos intactos e os vasos sanguíneos, incluindo seus componentes celulares1,2,3, 4: axônios sensoriais, simpáticos axônios, células em nervos Schwann, células endoteliais, pericitos e células de músculo liso vascular (VSMCs) nos vasos sanguíneos. Durante a angiogênese, uma rede capilar primária sofre remodelação vascular intensivo e se desenvolve em uma rede hierárquica de ramificação vascular. Na derme/hipoderme em desenvolvimento, as artérias ramificam ao lado de veias e nervos sensoriais periféricos dão forma então adjacentes às artérias. Depois que a rede vascular hierárquica é completamente coberta com VSMCs, nervos simpáticos se estendem ao longo e inervam os vasos sanguíneos de grande diâmetro1,5,6. Apesar da importância da associação estreita entre os sistemas nervosos e vasculares em desenvolvimento, uma grande questão tem sido a abordar o que acontece com as redes neuro-vascular em diversas situações patológicas em adultos. Uma imagem tridimensional de alta resolução é necessária apreciar a patogênese, juntamente com a morfogênese ramificação anatomicamente reconhecível e padronização.
Morfogênese neuronal e vascular em pele de rato adulto é comumente analisada pela coloração de secção de tecido. Outros estudos utilizaram imagens de toda a montagem da pele para visualizar os nervos periféricos e dos vasos sanguíneos, além dos folículos pilosos, glândulas sebáceas e arrector pili músculos7,8,9. No entanto, a espessura da pele adulta tornou difícil analisar a pele ao longo de toda a sua profundidade.
No presente estudo, nós desenvolvemos uma romance de alta resolução de imagem toda a montagem da pele da orelha do adulto para superar estes desafios. Pele da orelha é prontamente acessível para dissecção e subsequente de imagem de toda a montagem da pele ao longo de toda a sua profundidade. Assim, é um método simples e altamente reprodutível que pode ser aplicado para comparar a arquitetura tridimensional dos sistemas nervoso e vasculares periféricas na pele, com medidas de quantificação abrangente. Demonstrámos que o alinhamento dos nervos periféricos sensoriais e simpáticos com os vasos sanguíneos de grande diâmetro é preservado na pele adulta. O objetivo do presente protocolo é Visualizar ramificação morfogênese e a padronização dos nervos periféricos e os vasos sanguíneos, bem como a distribuição de células imunes a um nível celular em modelos do rato adulto em várias condições, tais como inflamação e regeneração.
Protocolo
Todos os experimentos nesta seção foram realizados sob aprovação do nacional do coração, pulmão e cuidado do Animal de sangue Institute (NHLBI) e Comité de uso.
1. coleção de pele de orelha de rato adulto
- Eutanásia em ratos adultos pela exposição de dióxido de carbono (CO2) em uma câmara fechada e em seguida, confirme a eutanásia por deslocamento cervical.
Nota: O experimento segue a diretriz do National Institutes of Health (NIH) para o método de eutanásia. - Dissecar a orelha da base e coloque-o em um 35 x 10 mm2 placa de Petri contendo 2 mL de Hank está equilibrado sal solução (HBSS). Brevemente, apare os pelos com uma tesoura.
- Descasca a pele posterior e anterior pele fora cuidadosamente da cartilagem intermediárias.
Nota: Cartilagem anexa à pele anterior. - Transferência posterior e anterior pele separadamente para um 24 bem placa contendo 1 mL de gelado fresco 4% paraformaldeído (PFA) em solução salina tampão fosfato (PBS) por poço. Achate a pele anterior e posterior nos 4% PFA.
- Corrigi a pele anterior e posterior com cartilagem a 4 ° C, durante 1 h.
- Lave a pele posterior e anterior por 5 min por 3 vezes em 1 mL de PBS com mistura suave em um misturador à temperatura ambiente.
- Transferi a pele anterior e posterior com cartilagem no fundo de um 35 x 10 mm2 placa de Petri. Corta a região de base, que é dobrada e tem adiposo e tecidos conjuntivos. Descole a cartilagem da pele anterior usando pinça curva bem.
- Cuidadosamente Retire os pelos, tecidos adiposo e tecidos conjuntivos do interior da pele posterior usando uma pinça curva bem. Manter a pele molhada com PBS.
2. coloração imuno-histoquímica toda a montagem de pele de orelha de rato
Nota: Todas as experiências nas seções a seguir foram realizadas em conformidade com as diretrizes de segurança do laboratório de NIH.
- Prepare o tampão de bloqueio. Soro de cabra de calor 10% inactivada de filtro (HIGS) diluído em PBS com 0,2% Tritão tampão de bloqueio X-100 (TX-100), ou 10% de soro de burro (DS) diluído em PBS com 0,2% de tampão de bloqueio TX-100, usando uma unidade de filtro de 0,45 µm.
- Transferência posterior e anterior pele para um 24 bem placa contendo 1 mL de tampão de bloqueio HIGS 10% ou 10% DS buffer bloqueio por bem. Incube a pele por 30 min com a mistura suave em um misturador à temperatura ambiente.
- Preparar a solução de anticorpo primário diluindo os anticorpos primários (Tabela de materiais) em tampão de bloqueio (ou 10% HIGS ou 10% DS).
Nota: Todo-mout immunohistochemical análise da pele da orelha do adulto com anticorpos para classe de neurônio específico marcador pan-neuronal III β-tubulina (Tuj1, coelho policlonais IgG ou mouse monocloncal IgG2a, diluição de 1: 500 na concentração final de 2 µ g/mL), molécula de adesão de célula endotelial para plaquetas de marcador Pan-endothelial da pilha 1 (PECAM-1, hamster monoclonal IgG, diluição de 1: 300 na concentração final de 3,3 µ g/mL), proteína básica da mielina marcador mielina (MBP, rabbit IgG policlonal, diluição de 1: 200 para o concentração final de 5 µ g/mL) e marcador de células mieloides inflamatória CD11b (Rat IgG2b monoclonal, 01:50 diluição na concentração final de 20 µ g/mL) foi mostrado na Figura 1 e Figura 2. A pele foi incubada com anticorpo conjugado Cy3 para actina de músculo liso α marcador do músculo liso vascular célula (αSMA) juntamente com anticorpos secundários (2.6). Os anticorpos primários testados por nós mesmos foram listados na Tabela de materiais. Vários anticorpos primários derivados de espécies diferentes podem ser misturados em simultâneo. - Transferi a pele posterior e anterior ao novo poço contendo 150 µ l da solução de anticorpos primários. Incube a pele com suave mistura em uma batedeira a 4 ° C durante a noite.
- No dia seguinte, transfira a pele anterior e posterior para novos poços em placa de 24 bem ou Aspire o tampão de bloqueio contendo anticorpos primários. Adicione 1 mL de qualquer 2% HIGS diluído em PBS com tampão de lavagem TX-100 0,2% ou 2% DS diluído em PBS com tampão de lavagem de TX-100 de 0,2%. Lave a pele com 3 alterações da reserva lavar cada 15 min com a mistura suave em um misturador à temperatura ambiente.
- Prepare a solução de anticorpo secundário (Tabela de materiais). Diluir a anticorpos secundários no buffer de bloqueio (ou 10% HIGS ou 10% DS) e o tampão de bloqueio contendo anticorpos secundários através de 0,22 µm polivinilideno difluoreto (PVDF) membrana seringa filtro ligado a uma seringa de 1 mL de filtro.
Nota: Alexa 488 ou 633-conjugados de cabra anticoelho IgG (H + L) ou mouse IgG2a pelo Tuj1, anticabra hamster Alexa 647-Conjugado IgG (H + L) para PECAM-1, Alexa 488-conjugados de cabra anticoelho IgG (H + L) para MBP, e utilizaram-se ratos Alexa 594-Conjugado IgG (H + L) para CD11b com a diluição de 1: 250 para a concentração final de 8 µ g/mL. A pele foi incubada com anticorpo de Cy3-conjugados αSMA (diluição 1: 500 na concentração final de 2-3 µ g/mL) em combinação com estes anticorpos secundários. - Centrifugue a solução a 13.000 x g por 10 min remover partículas de agregados dos anticorpos secundários do buffer do bloqueio.
Nota: Diferentes fluorescentes conjugados anticorpos secundários derivados de espécies diferentes podem ser misturados em simultâneo. - Transferi a pele anterior e posterior para bem contendo 150 µ l da solução de anticorpos secundários. Embrulhe a placa bem 24 em folha de alumínio para evitar a luz e incubar a pele para 1 h com uma mistura suave em um misturador à temperatura ambiente.
- Transferir a pele anterior e posterior para novos poços em placa de 24 bem ou Aspire a solução anticorpo secundário por pipeta completamente. Adicione 1 mL de tampão de lavagem HIGS 2% ou 2% tampão de lavagem de DS.
- Embrulhe a placa bem 24 em folha de alumínio e lave com 3 alterações da reserva lavar cada 15 min com a mistura suave em um misturador à temperatura ambiente.
3. a pele da orelha de montagem em Slide
- Coloque a pele na parte inferior de um 35 x 10 mm2 placa de Petri. Cuidadosamente Retire os pelos, tecidos adiposo, tecidos conectivos, poeiras e fibras do interior da pele usando pinças curvas bem sob estereomicroscópio com baixa iluminação para minimizar a extensa foto branqueamento. Manter a pele molhada com PBS.
- Transferi a pele para um adesivo de microscópio usando fórceps. Coloque a pele anterior e posterior com o interior voltado para cima no slide. Achate a pele usando fórceps.
- Monte a pele em meio líquido anti-desvaneça-se de montagem para evitar fotobranqueamento e preservar sinais fluorescentes. Certifique-se de que não há bolhas de ar são sobre ou em torno da pele.
- Cobrir com lamela em amostras de pele cuidadosamente e guarde os slides de amostra de pele montado na noite escura à temperatura ambiente para permitir que os meios de comunicação de montagem fiquem firmes. Selar a lamela para o slide com as unhas pintadas e armazená-lo em 4 ° C para armazenamento a longo prazo.
4. Confocal da microscopia
- Configure o apropriado lasers para fluorophores. Um microscópio confocal com três fontes de laser (argônio 488 nm, nm DPSS 561 e aqui vai 633 nm) é usado neste experimento.
- Use a ferramenta de varredura sequencial, que excita simultaneamente amostras triplo-manchada, para evitar e reduzir qualquer sobreposição.
Nota: Imagens serão tomadas de uma forma sequencial, usando o modo de varredura sequencial. - Imagem sob um objetivo X 10. Use a ferramenta de exame de telha para capturar a pele de todo o ouvido. Definir Z-pilha e certifique-se que o z-posição cobre toda espessura da pele da orelha.
Resultados
Pele de rato adulto orelha posterior (figura 1A) e pele de orelha anterior (figura 1B) foram immunostained com anticorpos αSMA (vermelho), Tuj1 (verde) e PECAM-1 (azul). Pele posterior foi immunostained para estudar a distribuição de neuro-imune usando anticorpos anti-CD11b (vermelho) e MBP (verde), juntamente com Tuj1 (azul) (Figura 2A). Distribuição de CD11b+ células inflamatórias, incluindo macrófagos foi detectado em uma única resolução celular (Figura 2B).

Figura 1: alinhamento ofperipheral nervos e vasos sanguíneos na pele da orelha do adulto. Toda a montagem em microscopia confocal triplo imunofluorescência de pele de orelha anterior e posterior com anticorpos αSMA (vermelho), Tuj1 (verde), e PECAM-1 (azul) é mostrado. Os vasos sanguíneos (A) 2R-coberto grande diâmetro alinhar com nervos periféricos na pele posterior da orelha. (B) menor diâmetro vasos sanguíneos cobertos com VSMCs alinhar com feixes de nervos periféricos de menor diâmetro da pele da orelha anterior. Barra de escala = 1 mm clique aqui para ver uma versão maior desta figura.
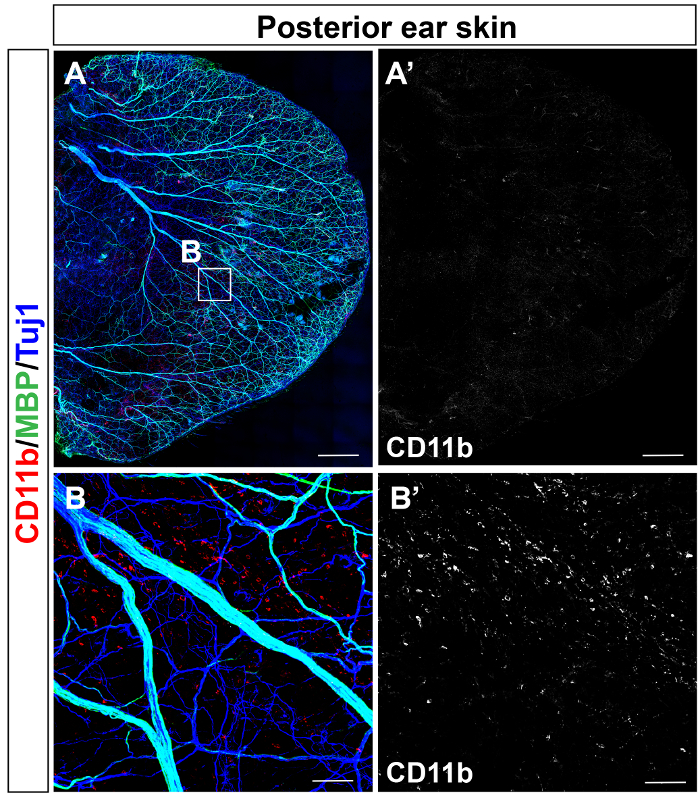
Figura 2: Mielinização dos nervos periféricos e CD11b+ distribuição de células mieloides em pele da orelha do adulto. Microscopia confocal toda montagem tripla imunofluorescência de pele de orelha posterior com anticorpos anti-CD11b (vermelho) e MBP (verde), juntamente com Tuj1 (azul), é mostrada. (A) os nervos periféricos de médio a grande diâmetro são mielinizados. (B) close-up de imagens do (A). CD11b+ células inflamatórias distribuem uniformemente na pele posterior da orelha. Barra de escala = 1 mm (A), 100 µm (B). Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve a imagem de toda a montagem immunonohistochemical de pele de orelha do adulto para a análise das estruturas neuro-vasculares e distribuição de células imunes. Acreditamos que este método tem várias vantagens experimentais aos pesquisadores estudar ramificação morfogênese e a padronização de nervos periféricos e os vasos sanguíneos, bem como a distribuição tridimensional dos componentes da pele, incluindo o cabelo e células do sistema imunológico folículos. Os resultados da imagem podem ser quantificados utilizando softwares de imagem para posterior análise de quantitativa.
Uma preparação adequada da pele da orelha é crítica para o sucesso do presente protocolo. Primeiro, a pele da orelha deve ser dissecada cuidadosamente logo após eutanásia o mouse. A parte posterior da orelha pele deve ser descascado longe da cartilagem. Em seguida, a cartilagem deve ser removida da pele anterior antes de coloração. Em segundo lugar, tecidos conjuntivos, tecidos adiposo e os pelos devem ser removidos delicadamente e completamente antes da montagem. Devido à existência de nervos periféricos na superfície da pele, é necessária a remoção de cuidado para não danificar os nervos. Em terceiro lugar, a pele do ouvido deve ser desdobrada com a remoção de alguns tecidos grossos da pele da orelha. Finalmente, a pele da orelha deve ser montado apartamento sem bolhas de ar.
Uma limitação do presente protocolo é que a pele da orelha orelha-com a tag não é apropriado para a análise como marca auricular provoca um buraco ou uma cicatriz. Portanto, a identificação de camundongos por diferentes métodos diferentes de marca auricular por exemplo marcando na cauda é necessária caso haja vários mouses para analisar.
A pele de orelha inteira pode ser verificada pela microscopia confocal com uma ferramenta de verificação de telha, embora um relatórios anteriores demonstraram que uma região de interesse pode ser fotografada com uma alta resolução10. Curiosamente, a imagem de toda a montagem da pele orelha inteira revela distinta morfogênese ramificação e padronização de nervos periféricos e os vasos sanguíneos entre a pele anterior e posterior (Figura 1): a pele posterior tem grande diâmetro nervo bundles (20 – 50 µm) alinhados com remodelado vasos de grande diâmetro cobertos com αSMA+ VSMCs (20 a 60 µm), enquanto o anterior pele tem feixes nervosos de menor diâmetro (< 20 µm) alinhado com os vasos sanguíneos de menor diâmetro- mas remodelados coberto com αSMA+ VSMCs (< 20 µm).
Há um número notável de rato modelos11 para elucidar o mecanismo de humanos doenças dermatológicas tais como dermatite atópica12, psoríase,13,14de cura e neuropatia diabética15feridas. Podemos ter aplicado este protocolo na pele da orelha de ratos de obesidade induzida por dieta e digite 2 ratos diabéticos para estudar a neuropatia diabética16. Este protocolo pode ser aplicado de juvenil a pele de rato adulto em várias condições patológicas.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a K. Gill para a gestão do laboratório e suporte técnico, J. Hawkins e os funcionários dos institutos nacionais de saúde (NIH) facilidade do edifício 50 animais de assistência com cuidados de rato e R. Reed e F. Bernardo para assistência administrativa. Obrigado também a Motegi S. e M. Udey por compartilhar o seu protocolo de dissecação de pele orelha, s. Burns para ajuda editorial e membros do laboratório de células-tronco e biologia Neuro-Vascular para ajuda técnica e discussão pensativo. T. Yamazaki foi apoiado pela sociedade de Japão para a promoção da ciência (JSPS) NIH-KAITOKU. Este trabalho foi financiado pelo programa de pesquisa Intramural de nacional do coração, pulmão e Instituto de sangue (HL005702-11 para Y.M.)
Materiais
| Name | Company | Catalog Number | Comments |
| 10 x Phosphate Buffered Saline | KD Medical | RGE-3210 | PBS, without Ca2+/Mg2+ |
| Hank’s Balanced Salt Solution | Gibco | 14025-092 | HBSS, with Ca2+/Mg2+ |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | PFA, fixative, diluted in PBS |
| Triton X-100 | Sigma | X100 | Detergent |
| Normal goat serum | Gibco | 16210064 | Component of blocking/washing buffer |
| Normal donkey serum | Jackson Immuno research | 017-000-121 | Component of blocking/washing buffer |
| Curved fine tweezers | Dumont | RS-5047 | |
| Curved tweezers | Integra Miltex Vantage | V918-782, V918-784 | |
| Filter Unit 0.45 mm | Thermo Scientific | 157-0045 | For filtration |
| 1 mL syringe | Coviden | 8881501400 | For filtration |
| Syringe filter Unit 0.22 mm | Millex-GV | SLGVR04NL | For filtration |
| ProLong Gold | Thermo Scientific | P36934 | Anti-fade mounting medium |
| Nail Polish | Electron Microscopy Sciences | 72180 | For sealing |
| Dissecting microscope | Leica | MZ95 | |
| Confocal microscope | Leica | TCS SP5 | |
| Photoshop CC 2017 | Adobe | Graphics editor software | |
| Illustrator CC 2017 | Adobe | Graphics editor software | |
| Image J | NIH | Image processing software | |
| Anti-PECAM-1 (CD31) antibody | Millipore | MAB1398Z | Hamster IgG, vascular endothelial cell marker, 1:300 |
| Anti-PECAM-1 (CD31) antibody | BD Pharmingen | 553369 | Rat IgG2a kappa, vascular endothelial cell marker, 1:300 |
| Anti-αSMA antibody conjugated with cy-3 | Sigma | C6198 | Mouse IgG2a, vascular smooth muscle cell marker, 1:500 |
| Anti-EphB1 antibody | Santa Cruz | sc-9319 | Goat polyclonal, venous endothelial cell marker, 1:100 |
| Anti-neuron-specific Class III β-tubulin (Tuj1) | Abcam | AB18207 | Tuj1, Rabbit polyclonal IgG, pan-axonal marker, 1:500 |
| Anti-Tuj1 antibody | Covance | MMS-435P | Mouse IgG2a, pan-axonal marker, 1:500 |
| Anti-MBP antibody | Abcam | AB40390 | Rabbit polyclonal IgG, myelination marker, 1:200 |
| Anti-Tyrosine Hydroxylase antibody | Chemicon | AB152 | Rabbit polyclonal, sympathetic neuron marker, 1:500 |
| Anti-Peripherin antibody | Chemicon | AB1530 | Rabbit polyclonal, peripheral neuron marker, 1:1000 |
| Anti-CD11b antibody | Bio-Rad | MCA74G | Rat IgG2b, inflammatory cell marker (macrophages), 1:50 |
| Anti-CD45 antibody | Thermo Fisher Scientific | 14-0451-85 | Rat IgG2b kappa, pan-hematopoietic cell marker, 1:500 |
| Anti-CD3 antibody | Bio-Rad | MCA1477T | Rat IgG1, immune cell marker, 1:100 |
| Anti-CD45R (B220) antibody | Thermo Fisher Scientific | 14-0452 | Rat IgG2a kappa, inflammatory cell marker, 1:200 |
| Anti-GFP antibody | Thermo Fisher Scientific | A11122 | Rabbit polyclonal, 1:300 |
| Anti-GFP antibody | Abcam | Ab13970 | Chicken polyclonal, 1:500 |
| Anti-β-gal antibody | Cappel | 55976 | Rabbit polyclonal, 1:5000 |
| Anti-RFP antibody | Abcam | Ab62341 | Rabbit polyclonal, 1:300 |
| Goat anti-rabbit IgG (H+L) Alexa 488 | Thermo Fisher Scientific | A11034 | Rabbit polyclonal secondary antibody, 1:250 |
| Goat anti-hamster IgG (H+L) Alexa 647 | Jackson Immuno research | 127-605-160 | Hamster polyclonal secondary antibody, 1:250 |
| Goat anti-rat IgG (H+L) Alexa 594 | Jackson Immuno research | 112-585-167 | Rat polyclonal secondary antibody, 1:250 |
| Goat anti-mouse IgG2a Alexa 633 | Thermo Fisher Scientific | A21136 | Mouse IgG2a secondary antibody, 1:250 |
Referências
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., James, J., Nam, J., Uchida, Y. Whole-mount confocal microscopy for vascular branching morphogenesis. Methods Mol Biol. 843, 69-78 (2012).
- Li, W., Mukouyama, Y. S. Whole-mount immunohistochemical analysis for embryonic limb skin vasculature: a model system to study vascular branching morphogenesis in embryo. J Vis Exp. , (2011).
- Yamazaki, T., et al. Tissue Myeloid Progenitors Differentiate into Pericytes through TGF-beta Signaling in Developing Skin Vasculature. Cell Rep. 18, 2991-3004 (2017).
- Mukouyama, Y. S. Vessel-dependent recruitment of sympathetic axons: looking for innervation in all the right places. J Clin Invest. 124, 2855-2857 (2014).
- Li, W., et al. Peripheral nerve-derived CXCL12 and VEGF-A regulate the patterning of arterial vessel branching in developing limb skin. Dev Cell. 24, 359-371 (2013).
- Chang, H., Wang, Y., Wu, H., Nathans, J. Flat mount imaging of mouse skin and its application to the analysis of hair follicle patterning and sensory axon morphology. J Vis Exp. , e51749 (2014).
- Salz, L., Driskell, R. R. Horizontal Whole Mount: A Novel Processing and Imaging Protocol for Thick, Three-dimensional Tissue Cross-sections of Skin. J Vis Exp. , (2017).
- Liakath-Ali, K., et al. Novel skin phenotypes revealed by a genome-wide mouse reverse genetic screen. Nat Commun. 5, 3540 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16, 505-516 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opin Drug Dis. 8, 331-355 (2013).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. J Invest Dermatol. 129, 31-40 (2009).
- Wagner, E. F., Schonthaler, H. B., Guinea-Viniegra, J., Tschachler, E. Psoriasis: what we have learned from mouse models. Nat Rev Rheumatol. 6, 704-714 (2010).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Dis Model Mech. 7, 1205-1213 (2014).
- O'Brien, P. D., Sakowski, S. A., Feldman, E. L. Mouse models of diabetic neuropathy. ILAR J. 54, 259-272 (2014).
- Yamazaki, T., et al. Whole-Mount Adult Ear Skin Imaging Reveals Defective Neuro-Vascular Branching Morphogenesis in Obese and Type 2 Diabetic Mouse Models. Sci Rep. 8, (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados